含有L-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物及其用途以及L-羟脯氨酸的制造方法与流程
本发明涉及含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物及其用途以及l-羟脯氨酸的制造方法。本发明还涉及用于制造l-羟脯氨酸的酵母的应用。本发明另外还涉及含有酵母的菌体或菌体培养物或者它们的提取物的饮食品、化妆料、化妆料原料及l-羟脯氨酸补充用组合物等。
背景技术:
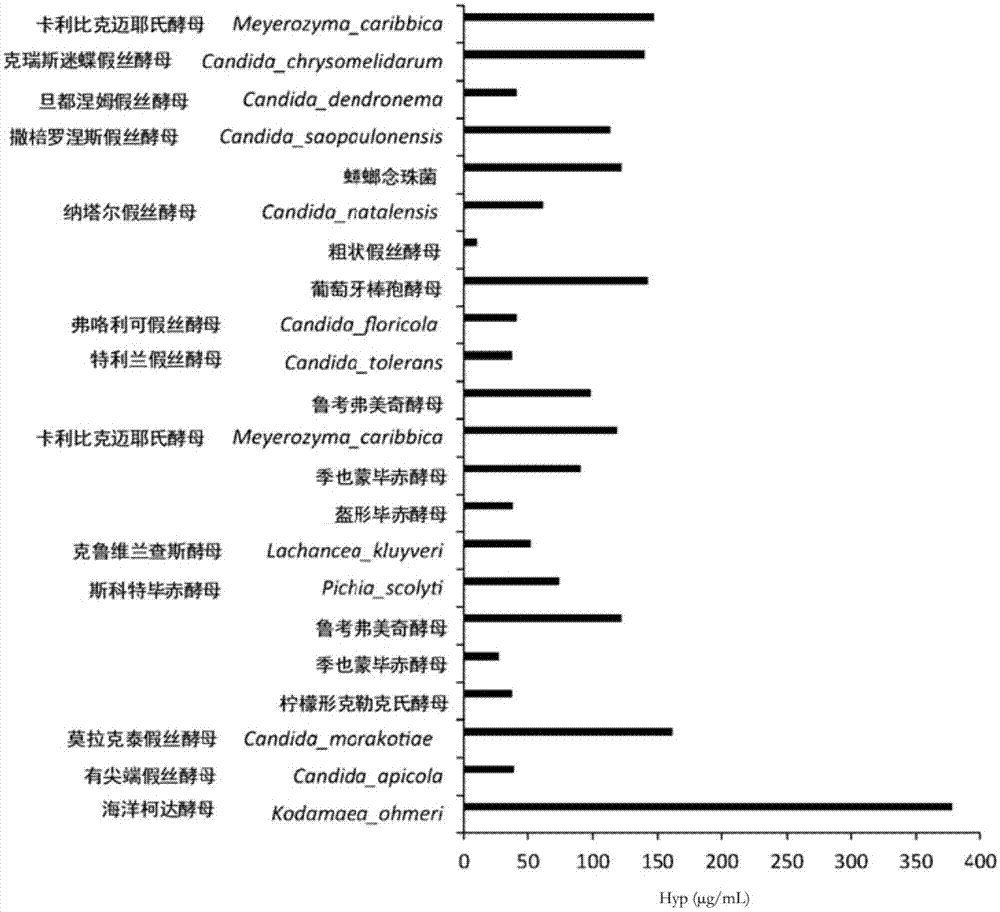
:l-羟脯氨酸(羟基-l-脯氨酸)为具有在l-脯氨酸的4位的碳原子上键合了羟基的结构的氨基酸。作为l-羟脯氨酸的功效,可列举成纤维细胞中的胶原蛋白产生促进、表皮细胞的增殖促进、与胶原蛋白同等以上的保湿效果、皮肤的抗老化、高于三肽的透皮吸收性、皱纹的改善效果、特应性皮炎的改善效果等。由于l-羟脯氨酸对人体安全,故而可使其在饮食品、化妆料、医药品等中含有来使用,其有益性非常高。l-羟脯氨酸可通过有机合成法来制造,也研究了利用微生物的制造方法。例如在专利文献1中记载了如下反式-4-羟基-l-脯氨酸的制造方法:将来自百脉根根瘤菌的编码l-脯氨酸-反式-4-羟化酶的多核苷酸导入宿主细胞所得到的转化体在培养基中培养,在培养物中使反式-4-羟基-l-脯氨酸生成、蓄积,从该培养物中采集反式-4-羟基-l-脯氨酸。现有技术文献专利文献专利文献1:日本专利第5506668号公报技术实现要素:不过,酵母为自古以来在饮食品领域等中就尝试了各种工业利用的微生物,含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物作为可期待l-羟脯氨酸的功效的化妆料、饮食品等的原料有用。然而,在菌体或者菌体培养物中蓄积l-羟脯氨酸的酵母还未报道。本发明主要解决的技术课题在于提供含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物及其用途以及l-羟脯氨酸的制造方法。本发明者为了解决上述课题进行了深入研究,结果发现将海洋柯达酵母(kodamaeaohmeri)等某种酵母进行好氧培养时,在其菌体或者菌体培养物中l-羟脯氨酸蓄积。另外,发现了所得到的含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物的相对于l-脯氨酸(pro)及l-羟脯氨酸(hyp)的合计重量含量的l-羟脯氨酸的重量含量的比例(100×hyp/(pro+hyp))可在特定范围内。本发明者基于上述见解进一步进行了研究,从而完成了本发明。本发明酵母的菌体或菌体培养物或者它们的提取物为选自海洋柯达酵母即kodamaeaohmeri、鲁考弗美奇酵母即metschnikowiareukaufii、卡利比克迈耶氏酵母即meyerozymacaribbica、季也蒙毕赤酵母即meyerozymaguilliermondii及葡萄牙棒孢酵母即clavisporalusitaniae中的至少1种的酵母的菌体或菌体培养物或者它们的提取物,其特征在于,上述酵母的菌体或菌体培养物或者它们的提取物含有l-羟脯氨酸,相对于l-脯氨酸即pro及l-羟脯氨酸即hyp的合计含量(μg/ml)的l-羟脯氨酸含量(μg/ml)的比例即100×hyp/(pro+hyp)为35~100。优选本发明的酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量为10μg/ml以上。优选本发明酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量(μg/ml)除以od660的值即μg/ml/od660为20以上。本发明酵母的菌体或菌体培养物或者它们的提取物的其他方式为选自海洋柯达酵母即kodamaeaohmeri、鲁考弗美奇酵母即metschnikowiareukaufii、卡利比克迈耶氏酵母即meyerozymacaribbica、季也蒙毕赤酵母即meyerozymaguilliermondii及葡萄牙棒孢酵母即clavisporalusitaniae中的至少1种的酵母的菌体或菌体培养物或者它们的提取物,其特征在于,l-羟脯氨酸的含量为10μg/ml以上本发明的l-羟脯氨酸的制造方法的特征在于,包括通过将选自海洋柯达酵母即kodamaeaohmeri、鲁考弗美奇酵母即metschnikowiareukaufii、卡利比克迈耶氏酵母即meyerozymacaribbica、季也蒙毕赤酵母即meyerozymaguilliermondii及葡萄牙棒孢酵母即clavisporalusitaniae中的至少1种的酵母在包含碳源及氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积的工序,上述氮源为包含含l-羟脯氨酸的肽的氮源。在本发明的制造方法中,优选上述含l-羟脯氨酸的肽为胶原蛋白肽。优选上述胶原蛋白肽的平均分子量为1000~10000。在本发明的制造方法中,优选将上述好氧培养进行10~100小时。本发明还包括将选自海洋柯达酵母即kodamaeaohmeri、鲁考弗美奇酵母即metschnikowiareukaufii、卡利比克迈耶氏酵母即meyerozymacaribbica、季也蒙毕赤酵母即meyerozymaguilliermondii及葡萄牙棒孢酵母即clavisporalusitaniae中的至少1种酵母用于制造l-羟脯氨酸的应用。本发明的应用优选包括通过将上述酵母在包含碳源及氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积,所述氮源为含有含l-羟脯氨酸的肽的氮源。在本发明的应用中,优选上述含l-羟脯氨酸的肽为胶原蛋白肽。另外,优选上述胶原蛋白肽的平均分子量为1000~10000。在本发明的应用中,优选将上述好氧培养进行10~100小时。本发明组合物的特征在于包含本发明酵母的菌体或菌体培养物或者它们的提取物。本发明饮食品的特征在于包含本发明酵母的菌体或菌体培养物或者它们的提取物。本发明的化妆料或者化妆料原料的特征在于包含本发明酵母的菌体或菌体培养物或者它们的提取物。本发明的化妆料或者化妆料原料优选可用于选自如下的用途:胶原蛋白产生促进、表皮细胞的增殖促进、皮肤的保湿、皮肤的抗老化、皮肤松弛的预防或者改善、皮肤弹性的改善、皱纹的预防或者改善及特应性皮炎的改善。在一个方式中,本发明的化妆料或者化妆料原料为化妆料原料,优选l-羟脯氨酸含量为5~300ppm。本发明的化妆料或者化妆料原料为化妆料,还优选l-羟脯氨酸含量为0.01~20ppm。在本说明书中,ppm意味着重量ppm。本发明的l-羟脯氨酸补充用组合物的特征在于含有l-羟脯氨酸且包含选自海洋柯达酵母即kodamaeaohmeri、鲁考弗美奇酵母即metschnikowiareukaufii、卡利比克迈耶氏酵母即meyerozymacaribbica、季也蒙毕赤酵母即meyerozymaguilliermondii及葡萄牙棒孢酵母即clavisporalusitaniae中的至少1种的酵母的菌体或菌体培养物或者它们的提取物。在本发明的l-羟脯氨酸补充用组合物中,优选上述酵母的菌体或菌体培养物或者它们的提取物的相对于l-脯氨酸即pro及l-羟脯氨酸即hyp的合计含量即μg/ml的l-羟脯氨酸的含量即μg/ml的比例即100×hyp/(pro+hyp)为35~100。另外,优选上述酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量为10μg/ml以上。根据本发明在于提供含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物及其用途以及l-羟脯氨酸的制造方法等。本发明酵母的菌体或菌体培养物或者它们的提取物可适合地用作饮食品、化妆料等的原料等。附图说明图1为表示通过hplc进行的培养物样品的l-羟脯氨酸含量的测定结果的图。图2为将包含氨基酸混合标准液h型及l-羟脯氨酸的0.1n盐酸溶液(各氨基酸浓度20μmol/l)进行分析的hplc图((a):ch1在激发波长350nm、荧光波长450nm下进行检测,(b):ch2在激发波长266nm、荧光波长305nm下进行检测)。具体实施方式以下,对本发明的实施方式进行具体说明。然而,本发明并不限定于以下的实施方式,在不改变本发明要旨的范围内还可适当改变来应用。在本说明书中,酵母的属种用theyeasts,ataxonomicstudyfifthedition(elsevier出版,2011年)记载的属种名来记载。本发明第一方式的酵母的菌体或菌体培养物或者它们的提取物为选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母的菌体或菌体培养物或者它们的提取物,上述酵母的菌体或菌体培养物或者它们的提取物含有l-羟脯氨酸,相对于l-脯氨酸(pro)及l-羟脯氨酸(hyp)的合计含量(μg/ml)的l-羟脯氨酸的含量(μg/ml)的比例(100×hyp/(pro+hyp))为35~100。本发明第二方式的酵母的菌体或菌体培养物或者它们的提取物为选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母的菌体或菌体培养物或者它们的提取物,l-羟脯氨酸的含量为10μg/ml以上。以下,也可将本发明的第一方式及第二方式的酵母的菌体或菌体培养物或者它们的提取物统称为本发明酵母的菌体或菌体培养物或者它们的提取物。本发明酵母的菌体或菌体培养物或者它们的提取物为选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母的菌体或菌体培养物或者它们的提取物。本发明中的酵母只要为上述任一项属种的酵母即可。酵母可仅使用1种,也可使用2种以上。上述酵母可从各种保藏机构获得。作为保藏机构,例如可列举日本国立技术与评估研究院(日本千叶县木更津市上总镰足2-5-8)等。另外也可从自然界中分离。其中,作为本发明中的酵母,从l-羟脯氨酸含量多的观点出发优选海洋柯达酵母(kodamaeaohmeri)。本发明酵母的菌体或菌体培养物或者它们的提取物优选为海洋柯达酵母(kodamaeaohmeri)的菌体或菌体培养物或者它们的提取物。本发明酵母的菌体或菌体培养物或者它们的提取物含有l-羟脯氨酸(hyp)。本发明中的l-羟脯氨酸为4-羟基-l-脯氨酸。在本说明书中,酵母的菌体或菌体培养物或者它们的提取物所包含的l-羟脯氨酸是指游离的l-羟脯氨酸。酵母的菌体或菌体培养物或者它们的提取物中的l-羟脯氨酸含量或者蓄积量是指游离的l-羟脯氨酸量。其菌体或者菌体培养物中蓄积游离的l-羟脯氨酸的酵母没有报道。本发明第一方式的酵母的菌体或菌体培养物或者它们的提取物相对于l-脯氨酸(pro)及l-羟脯氨酸(hyp)的合计含量(μg/ml)的l-羟脯氨酸的含量(μg/ml)的比例(100×hyp/(pro+hyp))为35~100。这样的酵母的菌体或菌体培养物或者它们的提取物可适合地应用于可期待l-羟脯氨酸的功效的饮食品、化妆料的原料等。以下,也将“相对于l-脯氨酸(pro)及l-羟脯氨酸(hyp)的合计含量(μg/ml)的l-羟脯氨酸的含量(μg/ml)的比例”(100×hyp/(pro+hyp))称作“(hyp/(pro+hyp))比例”。在本说明书中,上述(hyp/(pro+hyp))比例中的l-脯氨酸含量是指酵母的菌体或菌体培养物或者它们的提取物所包含的游离l-脯氨酸的含量。在优选的方式中,本发明第二方式的酵母的菌体或菌体培养物或者它们的提取物的(hyp/(pro+hyp))比例为35~100。上述(hyp/(pro+hyp))比例优选40~100,更优选50~100,更优选60~100,进一步优选70~100,进一步更优选80~100,特别优选90~100。上述(hyp/(pro+hyp))比例中,这样的酵母的菌体或菌体培养物或者它们的提取物的hyp的含量比例高,特别适合作为期待有l-羟脯氨酸的功效的饮食品、化妆料的原料等。本发明第二方式的酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量为10μg/ml以上。优选本发明第一方式的酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸含量为10μg/ml以上。l-羟脯氨酸的含量处于上述范围的酵母的菌体或菌体培养物或者它们的提取物可适合地作为期待有l-羟脯氨酸的功效的饮食品、化妆料的原料等。本发明酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量更优选15μg/ml以上,更优选17μg/ml以上,更优选20μg/ml以上,进一步优选30μg/ml以上,进一步优选40μg/ml以上,进一步优选50μg/ml以上,进一步优选100μg/ml以上,进一步优选150μg/ml以上,特别优选200μg/ml以上,特别优选250μg/ml以上,特别优选300μg/ml以上。酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸含量的上限没有特别限定,优选l-羟脯氨酸的含量多,通常为6000μg/ml以下,也可为3000μg/ml以下或者2000μg/ml以下。根据本发明可提供来自酵母的菌体或者菌体培养物的l-羟脯氨酸的含量处于上述范围的酵母的菌体或菌体培养物或者它们的提取物。酵母的菌体或菌体培养物或者它们的提取物中的l-脯氨酸的含量(μg/ml)及l-羟脯氨酸的含量(μg/ml)可通过高效液相色谱(hplc)测定。酵母的菌体或菌体培养物或者它们的提取物包含菌体时,使用通过由加热等进行的自溶、酶分解处理等将菌体粉碎并将菌体内容物溶出的物质,测定l-脯氨酸及l-羟脯氨酸的含量。例如,通过巯基丙酸、邻苯二甲醛(opa)将伯氨基衍生化后,通过氯甲酸-9-芴甲酯(fmoc)将仲氨基酸衍生化,通过由hplc分析的方法(在激发波长266nm、荧光波长305nm处进行检测)可对l-脯氨酸及l-羟脯氨酸进行定量。l-脯氨酸及l-羟脯氨酸含量的测定方法及hplc的测定条件等只要采用实施例记载的方法及条件等即可。本发明酵母的菌体或菌体培养物或者它们的提取物可通过将上述酵母在液体培养基中进行好氧培养并根据需要进行菌体粉碎等来得到。优选酵母的菌体培养物包含酵母的菌体及/或者培养上清,还可包含酵母的菌体内容物。酵母的菌体可为活菌也可为死菌。作为包含酵母的菌体及/或者培养上清的菌体培养物,可列举将上述酵母进行好氧培养所得到的包含酵母的菌体(培养菌体)及培养上清的菌体培养液、从该菌体培养液收集了酵母的菌体的物质(菌体)或者从该菌体培养液除去了菌体的培养上清。可将菌体培养液的培养上清简称为培养上清。菌体培养物优选为包含酵母的菌体及培养上清的菌体培养液或者培养上清。另外,菌体或者菌体培养物的提取物通常包含菌体内容物,优选包含菌体内容物及培养上清。作为菌体或者菌体培养物的提取物,可列举对菌体或者包含菌体的菌体培养物(优选菌体培养液)进行自溶处理、酶分解处理等的菌体粉碎处理,使酵母菌体内容物溶出到培养液中等的物质(菌体粉碎物)、从进行了菌体粉碎处理的菌体或者菌体培养物(菌体粉碎物)除去了菌体残渣的物质,优选从进行了菌体粉碎处理的菌体培养液(菌体粉碎物)或者从该菌体粉碎物除去了菌体残渣所得到的包含菌体内容物及培养上清的提取物。如上所述,本发明酵母的菌体或菌体培养物或者它们的提取物通常可对将上述酵母在液体培养基中进行好氧培养所得到的包含酵母的菌体及培养上清的菌体培养液根据需要进行集菌、菌体粉碎等的处理来制备。本发明酵母的菌体或菌体培养物或者它们的提取物所包含的l-羟脯氨酸优选来自通过上述好氧培养所得到的酵母的菌体或者菌体培养物。本发明酵母的菌体或菌体培养物或者它们的提取物中所包含的l-羟脯氨酸优选在上述好氧培养前实质上不存在。本发明酵母的菌体或菌体培养物或者它们的提取物例如可适合地用作化妆料、包含酒类的饮食品等的原料。优选本发明酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量(μg/ml)除以od660的值(μg/ml/od660)为20以上。以下,也将l-羟脯氨酸的含量(μg/ml)除以od660的值(μg/ml/od660)称作hyp/od660值。由于hyp/od660值越高,单位细胞的l-羟脯氨酸的含量越多,故而优选。酵母的菌体或菌体培养物或者它们的提取物的hyp/od660值的上限没有特别限定,越多越优选,通常为300以下。更优选hyp/od660值为25以上,进一步优选30以上,进一步更优选40以上,特别优选50以上,特别优选60以上,最优选80以上。od为opticaldensity的简称,是指光学密度。od表示细胞的浓度等。一般而言,测定相对于600nm或者660nm波长的可见光的吸光度od600或者od660(bioexperimentillustrated▲7▼可使用酵母的双杂交,日本秀润公司,2003年出版)。在hyp/od660值的计算中所使用的od660为在菌体或菌体培养物或者它们的提取物的制备中使用的包含菌体及培养上清的菌体培养液(包含菌体及培养上清的菌体培养物)在660nm处的吸光度。更具体而言,将上述酵母在液体培养基中进行好氧培养所得到的酵母的菌体培养液直接作为菌体培养物时,od660为该菌体培养液(菌体培养物)的吸光度od660。酵母的菌体或菌体培养物或者它们的提取物为将酵母的菌体粉碎使菌体内容物溶出的菌体或者菌体培养物的提取物时,od660为在其制备中使用的菌体培养液(包含菌体粉碎前的酵母的菌体及培养上清的菌体培养液)的吸光度od660。od660例如可通过分光光度计测定。优选本发明酵母的菌体或菌体培养物或者它们的提取物的乙醇含量为1v/v%以下。乙醇含量为1v/v%以下时,可特别适合地作为各种饮食品、化妆料等的原料使用。乙醇超过1v/v%时,有时会对酵母的增殖等产生不良影响。本发明酵母的菌体或菌体培养物或者它们的提取物的乙醇含量更优选为0.8v/v%以下,进一步优选0.5v/v%以下。乙醇含量可通过公知的方法测定。本发明酵母的菌体或菌体培养物或者它们的提取物的形态没有特别限定,例如可列举膏状、混悬状、浸膏状、液状等。如后所述,本发明酵母的菌体或菌体培养物或者它们的提取物可适合地作为化妆料、饮食品等的原料使用。还可将本发明酵母的菌体或菌体培养物或者它们的提取物通过干燥等进行粉末化来使用。本发明酵母的菌体或菌体培养物或者它们的提取物可通过将选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母在包含碳源及氮源的液体培养基中进行好氧培养并根据需要进行菌体粉碎等来得到。更具体而言,氮源包括含l-羟脯氨酸的肽。通过将上述酵母在包含碳源及含有含l-羟脯氨酸的肽的氮源的液体培养基中进行好氧培养,l-羟脯氨酸在该酵母的菌体或者菌体培养物中蓄积,可得到含有l-羟脯氨酸的酵母的菌体或者菌体培养物。包括通过将上述酵母在含有碳源及含有含l-羟脯氨酸的肽的氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在该酵母的菌体或者菌体培养物中蓄积的工序的方法优选作为上述本发明的酵母的菌体或菌体培养物或者它们的提取物的制造方法或者l-羟脯氨酸的制造方法。本发明的l-羟脯氨酸的制造方法包括通过将选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母在包含碳源及氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积的工序(以下也称为hyp蓄积工序)。上述氮源为含有含l-羟脯氨酸的肽的氮源。本发明的制造方法根据期望还可具有hyp蓄积工序以外的工序。例如,还可具有后述的前培养工序、集菌工序、菌体粉碎工序等中的1或者2个以上的工序。在本发明的l-羟脯氨酸的制造方法中,可得到上述的本发明酵母的菌体或菌体培养物或者它们的提取物。通过进行上述hyp蓄积工序,可得到含有l-羟脯氨酸的酵母的菌体或者菌体培养物。通常,所得到的酵母的菌体或者菌体培养物的上述(hyp/(pro+hyp))比例为35~100。另外,通常通过hyp蓄积工序所得到的酵母的菌体或者菌体培养物的l-羟脯氨酸的含量为10μg/ml以上。这样的酵母的菌体或者菌体培养物可作为上述的本发明酵母的菌体或者菌体培养物使用。另外,对于所得到的菌体或者菌体培养物还可根据期望进一步进行菌体粉碎处理等的处理来制备含有l-羟脯氨酸的酵母的菌体或者菌体培养物的提取物。包含hyp蓄积工序的l-羟脯氨酸的制造方法也优选作为上述本发明的酵母的菌体或菌体培养物或者它们的提取物的制造方法。得到本发明酵母的菌体或菌体培养物或者它们的提取物时,hyp蓄积工序及其优选的方式与l-羟脯氨酸的制造方法中的hyp蓄积工序及其优选的方式相同。在hyp蓄积工序中,酵母向液体培养基的添加方法可通过在含有碳源及氮源的液体培养基中直接接种少量的菌体来使其增殖,为了短期内使菌体浓度上升,优选接种前培养的菌液。前培养中使用的培养基没有特别限定,可为与在hyp蓄积工序(通常为主培养)中使用的液体培养基为相同的培养基,还可使用可在酵母中使用的公知的培养基。前培养的时间通常为10~72小时,优选12~48小时。前培养温度优选15~40℃。作为接种前培养的菌液的量,通常为在hyp蓄积工序中使用的培养基量的1/100000~1/2,优选1/1000~1/10,更优选1/200~1/10,进一步优选1/200~1/20。只要接种量在上述范围,则在hyp蓄积工序中酵母的增殖快,从而可高效地蓄积l-羟脯氨酸。在hyp蓄积工序中所使用的液体培养基的氮源为含有含l-羟脯氨酸的肽的氮源。使用这样的氮源将上述酵母进行好氧培养时,在菌体或者菌体培养物中l-羟脯氨酸蓄积。这样的氮源可仅使用1种,也可使用2种以上。含l-羟脯氨酸的肽可为1种,也可为2种以上。含l-羟脯氨酸的肽只要为在构成氨基酸中包含l-羟脯氨酸的肽即可,优选构成氨基酸的10重量%以上为l-羟脯氨酸的肽。在一个方式中,含有含l-羟脯氨酸的肽的氮源也优选为含l-羟脯氨酸的肽。含有含l-羟脯氨酸的肽的氮源例如可通过将含l-羟脯氨酸的蛋白质水解来得到。含l-羟脯氨酸的蛋白质只要是在构成氨基酸中包含l-羟脯氨酸的蛋白质即可,优选构成氨基酸的10重量%以上为l-羟脯氨酸的蛋白质。作为上述含l-羟脯氨酸的蛋白质,优选胶原蛋白性蛋白质等。作为胶原蛋白性蛋白质,例如可列举从内脏、皮、鱼鳞、骨等包含胶原蛋白的组织制备的蛋白质;胶原蛋白、明胶。胶原蛋白性蛋白质的原料来源没有特别限定。例如可适合地使用来自牛、来自猪、来自鱼等来自动物的胶原蛋白性蛋白质。胶原蛋白性蛋白质可使用市售品。含l-羟脯氨酸的蛋白质的水解可通过酶等用公知的方法进行。作为含有含l-羟脯氨酸的肽的氮源,例如可适合地使用来自动物的肽。优选来自牛、猪或者鱼的肽,更优选来自牛或者鱼的肽。在本发明的一个方式中,作为肽还优选兽肉肽、心肌肽、明胶肽。作为在本发明中可使用的含有含l-羟脯氨酸的肽的氮源的市售品的一个例子,例如可列举产品名pepton(#211677)(bacto公司)等。在一个方式中,上述含l-羟脯氨酸的肽优选为胶原蛋白肽。胶原蛋白肽意味着水解胶原蛋白,可为将天然胶原蛋白进行热处理使其变性的明胶或者将天然胶原蛋白水解的胶原蛋白肽或者将它们进行了化学、酶修饰的物质等任一物质。水解可通过酶、酸、碱等进行,优选通过酶进行。优选使用将天然胶原蛋白进行热处理使其变性的明胶或者将天然胶原蛋白进行水解的胶原蛋白肽。胶原蛋白肽的原料来源没有特别限定。例如可适合地使用来自牛、来自猪、来自鱼等来自动物的胶原蛋白肽。优选来自鱼的胶原蛋白肽。胶原蛋白肽可使用市售品。作为可在本发明中使用的胶原蛋白肽的市售品的一个例子,例如可列举新田明胶株式会社制的“collagenpeptideixoshdl-50sp”(产品名)(平均分子量5000)、“collagenpeptidetypes”(产品名)(平均分子量1200)、“supercollagenpeptidescp-2000”(产品名)(平均分子量2000)、日本野洲化学工业株式会社制的“collagenpeptidep-5000”(产品名)(平均分子量5000)、“collagenpeptidef-5000”(产品名)(平均分子量5000)、日本天祥株式会社制的“marinecollagenoligocf”(产品名)(平均分子量900~1100)、“marinecollagenoligomf”(产品名)(平均分子量900~1500)等。其中,优选“collagenpeptidetypes”(平均分子量1200)、“collagenpeptideixoshdl-50sp”(平均分子量5000)等。其中,例如“collagenpeptideixoshdl-50sp”、“collagenpeptidetypes”、“collagenpeptidef-5000”、“marinecollagencf”、“marinecollagenoligomf”来自鱼,“collagenpeptidep-5000”、“supercollagenpeptidescp-2000”来自猪。在本发明优选的实施方式中,含有含l-羟脯氨酸的肽的氮源优选胶原蛋白肽(更优选来自鱼的胶原蛋白肽)及/或者肽(优选来自动物的肽,更优选来自牛、猪或者鱼的肽,进一步优选来自牛或者鱼的肽),特别优选胶原蛋白肽。使用这样的含有含l-羟脯氨酸的肽的氮源时,酵母的菌体或者菌体培养物中的l-羟脯氨酸的蓄积量增多。肽为兽肉肽、心肌肽、明胶肽。本发明的l-羟脯氨酸的制造方法优选的实施方式的一个例子包括通过将上述酵母在包含碳源以及胶原蛋白肽及/或者肽的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积的工序。在一个方式中,优选含有含l-羟脯氨酸的肽的氮源的平均分子量为10000以下,例如优选平均分子量为100~10000。优选含l-羟脯氨酸的肽的平均分子量为10000以下,例如优选平均分子量为100~10000。另外,也优选含l-羟脯氨酸的肽的分子量为10000以下。优选胶原蛋白肽的平均分子量为1000~10000。将平均分子量处于上述范围的胶原蛋白肽用作氮源时,菌体或者菌体培养物中的l-羟脯氨酸的蓄积量增多。含l-羟脯氨酸的肽的平均分子量可通过凝胶过滤等算出。胶原蛋白肽的平均分子量通常为通过照相用明胶试验法(pagi法)第10版“20-2平均分子量”记载的方法所算出的值。肽的平均分子量是指重均分子量。胶原蛋白肽的平均分子量更优选1000~6000,进一步优选1000~5500,特别优选1000~5000。将这样的胶原蛋白肽用作氮源时,菌体或者菌体培养物中的l-羟脯氨酸的蓄积量变得更多。另外,在一个方式中,作为胶原蛋白肽的平均分子量,更优选1000~3000,进一步优选1000~1500。在本发明的其他的优选方式中,胶原蛋白肽的平均分子量更优选2000~5500,进一步优选3000~5000。上述液体培养基中的含有含l-羟脯氨酸的肽的氮源的浓度通常优选0.1~10重量%,更优选0.25~5重量%,进一步优选1~5重量%。上述氮源的浓度处于上述范围时,l-羟脯氨酸在菌体或者菌体培养物中蓄积。因此,例如可得到l-羟脯氨酸含量为10μg/ml以上的酵母的菌体或菌体培养物或者它们的提取物。另外,可得到(hyp/(pro+hyp))比例为35~100的菌体或菌体培养物或者它们的提取物。液体培养基中的上述氮源的浓度进一步更优选1.5~4.5重量%,特别优选2~4重量%。上述氮源的浓度只要在培养开始时为上述浓度即可。在一个方式中,上述液体培养基中的胶原蛋白肽或者肽的浓度优选在上述范围。上述碳源没有特别限定,例如可列举葡萄糖、果糖、蔗糖、棉子糖、甘露糖、麦芽糖、半乳糖、甘露醇、海藻糖、松三糖、纤维二糖、淀粉、糖蜜、山梨糖醇、l-山梨糖、甘油、乙醇、山梨醇等的糖质或者糖醇;乙酸、柠檬酸或者葡萄糖酸等的有机酸等。碳源可单独使用1种,另外也可2种以上混合使用。其中,碳源优选为葡萄糖、果糖、蔗糖等的糖,特别优选葡萄糖。液体培养基中的碳源浓度优选为0.1~20重量%,优选0.5~15重量%,更优选1~10重量%,更优选1~5重量%,进一步优选2~5重量%。液体培养基中的碳源的浓度为1重量%以上时,由于菌体的增殖速度快,故而优选。且,碳源的浓度只要在培养开始时为上述浓度即可。在本发明的制造方法中,优选碳源(c)与含有含l-羟脯氨酸的肽的氮源(n)的重量比(c/n)为0.25~20。c/n的重量比处于上述范围时,由于菌体或者菌体培养物中的l-羟脯氨酸的蓄积量增多故而优选。上述c/n的重量比更优选0.25~5,更优选0.3~3,进一步优选0.4~1.5。c/n的重量比处于上述范围时,菌体或者菌体培养物中的l-羟脯氨酸的蓄积量变得更多。在一个方式中,例如在含有含l-羟脯氨酸的肽的氮源(n)中使用胶原蛋白肽(优选平均分子量为1000~5000)或者肽时,更优选上述c/n的重量比为0.25~5,进一步优选0.3~3,进一步更优选0.4~1.5,特别优选0.5~1.3。在其他优选的方式中,也优选c/n的重量比为0.5~20。上述c/n的重量比只要在培养开始时为上述范围即可。液体培养基还可包含上述的碳源及含有含l-羟脯氨酸的肽的氮源以外的成分,例如优选包含酵母提取物(yeastextract)。酵母提取物通常不含有含l-羟脯氨酸的肽,不包括在含有含l-羟脯氨酸的肽的氮源中。酵母提取物只要可用于酵母的培养即可,没有特别限定,可使用市售品。例如,可适合地使用产品名bactoyeastextract(#212750)(bacto公司)等。使用酵母提取物时,酵母提取物的浓度相对于液体培养基优选为0.1~3重量%,更优选0.5~3重量%。酵母提取物的浓度只要在培养开始时为上述浓度即可。在一个方式中,优选液体培养基的ph为3~9,优选4~9,更优选超过4、9以下,进一步优选4.5~8.8,特别优选5~8.7。液体培养基的ph可适当调节。对于ph调节可使用公知的酸或者碱剂,例如可列举盐酸、硫酸、磷酸、硝酸、谷氨酸、乙酸、丁酸、乳酸、甲酸、琥珀酸、马来酸、苹果酸、草酸、柠檬酸、氢氧化钠、氢氧化钾、氢氧化钙、氨水、谷氨酸钠等。培养温度优选15~45℃,更优选20~40℃,进一步优选25~35℃。培养温度处于该温度范围时,酵母的增殖快,菌体或者菌体培养物中的l-羟脯氨酸的蓄积量增多。进行好氧培养的方法没有特别限定,例如将接种菌的液体培养基进行振荡培养或者搅拌培养即可。振荡或者搅拌的速度没有特别限定,优选30~600rpm,在一个方式中,更优选30~500rpm,进一步优选50~500rpm,特别优选50~300rpm,特别优选50~100rpm。另外在其他的优选方式中,振荡或者搅拌的速度也优选50~600rpm,更优选100~600rpm。在这样的速度下进行振荡培养或者搅拌培养时,由于l-羟脯氨酸的蓄积量增多故而优选。更优选以上述速度进行振荡培养。另外,根据期望还可通过灭菌的空气或者氧进行鼓泡。另外,培养形式可为分批培养、流加培养、连续培养中的任一种,优选分批培养。在本发明的制造方法中还可进行静置培养。培养时间没有特别限定,只要适当设定即可,例如优选进行10~100小时的好氧培养。培养时间在上述范围时,在上述酵母的菌体或者菌体培养物中l-羟脯氨酸蓄积。另外,通常可得到(hyp/(pro+hyp))比例为35~100的酵母的菌体或菌体培养物或者它们的提取物、l-羟脯氨酸含量为10μg/ml以上的酵母的菌体或菌体培养物或者它们的提取物。另外,可得到乙醇含量少(例如为1v/v%以下)的酵母的菌体或菌体培养物或者它们的提取物。培养时间小于10小时时,有时l-羟脯氨酸的蓄积量少、所得到的酵母的菌体或菌体培养物或者它们的提取物的(hyp/(pro+hyp))比例小于35。培养时间超过100小时时,有时所得到的酵母的菌体或菌体培养物或者它们的提取物的乙醇浓度超过1v/v%。另外,有时易于发生污染或在酵母死亡后发生自溶引起的着色等。培养时间更优选10~80小时,更优选12~72小时,进一步优选20~60小时,进一步更优选24~55小时,特别优选24~50小时。另外,在本发明的制造方法中优选进行好氧培养,直至菌体或者菌体培养物中的l-羟脯氨酸含量成为10μg/ml以上。在本发明的制造方法中,好氧培养通常作为主培养进行,还可为前培养,在前培养及主培养中还可进行好氧培养。通过进行上述的好氧培养,在上述酵母的菌体或者菌体培养物中l-羟脯氨酸蓄积。菌体培养物可为包含酵母的菌体及培养上清的菌体培养液,也可为酵母的菌体或者还可为菌体培养液的培养上清。通过进行hyp蓄积工序,可得到含有l-羟脯氨酸且(hyp/(pro+hyp))比例为35~100的酵母的菌体或者菌体培养物。另外,可得到l-羟脯氨酸的含量为10μg/ml以上的酵母的菌体或者菌体培养物。通过对酵母的菌体或者菌体培养物例如进行菌体粉碎处理,可得到酵母的菌体或者菌体培养物的提取物。在本发明中,制备含有l-羟脯氨酸的酵母的菌体或菌体培养物或者其提取物时,例如可将在hyp蓄积工序中所得到的包含酵母的菌体及培养上清的菌体培养液直接制成含有l-羟脯氨酸的酵母的菌体培养物。另外,可从菌体培养液收集酵母的菌体并将所得到的菌体作为酵母的菌体或者菌体培养物,还可将从菌体培养液除去了菌体的培养上清作为菌体培养物。进而,还在上述菌体或者菌体培养液中根据需要进行粉碎菌体的处理,并使菌体内容物溶出到培养液中等来制备菌体或者菌体培养物的提取物。在菌体或者菌体培养物的提取物的制备中,还可进行将菌体粉碎后除去菌体残渣的工序。另外,还可在菌体或菌体培养物或者它们的提取物中根据需要进行杀菌、加热等的处理。本发明的制造方法还可包括这样的集菌工序、菌体粉碎工序、菌体残渣除去工序、杀菌工序等中的1或者2个以上的工序。从菌体培养液收集菌体的方法没有特别限定,可采用通常可进行的方法,例如可列举离心分离等。上述粉碎菌体的方法没有特别限定,可采用通常可进行的方法,例如可列举自溶法、酶分解法、碱提取法等。其中,优选自溶法。在自溶法中,例如将菌体或者菌体培养物于40~60℃加热60~180分钟即可。在自溶法中,例如还可于95~100℃加热5~15分钟。除去菌体残渣的方法没有特别限定。例如,只要通过过滤、离心分离等公知的方法除去菌体残渣即可。进行杀菌时,优选将酵母的菌体或菌体培养物或者它们的提取物于75~90℃(更优选80℃)加热45~90分钟(更优选60分钟)。进行菌体残渣除去及杀菌时,任一种先进行均可。在本发明中所得到的酵母的菌体或菌体培养物或者它们的提取物及其优选的方式与上述的本发明酵母的菌体或菌体培养物或者它们的提取物及其优选的方式相同。根据本发明的制造方法,例如可制造(hyp/(pro+hyp))比例为35~100且l-羟脯氨酸含量为10μg/ml的酵母的菌体或菌体培养物或者它们的提取物。还可在通过上述方法所得到的酵母的菌体或菌体培养物或者它们的提取物中进一步添加来自天然物或者合成的l-羟脯氨酸,在优选的方式中,酵母的菌体或菌体培养物或者它们的提取物中所包含的l-羟脯氨酸由来自通过上述的hyp蓄积工序所得到的酵母的菌体或者菌体培养物的l-羟脯氨酸构成。含有本发明中所得到的l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物可作为后述的饮食品、化妆料等的原料等来使用。另外,在本发明的l-羟脯氨酸的制造方法中,还可进行从所得到的酵母的菌体或菌体培养物或者它们的提取物中纯化l-羟脯氨酸的工序。l-羟脯氨酸的纯化例如只要通过柱层析等公知的方法进行即可。本发明还包括使用选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母来制造l-羟脯氨酸的应用。上述酵母可适合地用于制造含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物。优选含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物的(hyp/(pro+hyp))比例为35~100。还优选含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量为10μg/ml以上。另外,优选含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物的上述hyp/od660值为20以上。含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物的优选方式与上述的本发明酵母的菌体或菌体培养物或者它们的提取物的优选方式相同。本发明的应用优选包括通过将上述酵母在包含碳源及氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积。上述氮源优选为含有含l-羟脯氨酸的肽的氮源。在本发明的应用中,优选上述含l-羟脯氨酸的肽为胶原蛋白肽。另外,优选上述胶原蛋白肽的平均分子量为1000~10000。在本发明的应用中,优选上述液体培养基中的含有含l-羟脯氨酸的肽的氮源的浓度为1~5重量%。另外,优选碳源(c)与含有含l-羟脯氨酸的肽的氮源(n)的重量比(c/n)为0.25~20。在一个方式中,还优选上述c/n比为0.5~20。在本发明的应用中,优选将上述好氧培养进行10~100小时,更优选进行10~80小时。在本发明应用中的液体培养基、碳源及含有含l-羟脯氨酸的肽的氮源以及它们的优选方式与上述l-羟脯氨酸的制造方法中的相同。另外,好氧培养的条件及其优选的方式也与上述的l-羟脯氨酸的制造方法中的相同。本发明的应用还包括上述的集菌工序、菌体粉碎工序、菌体除去工序、杀菌工序等的1或者2个以上的工序。上述本发明酵母的菌体或菌体培养物或者它们的提取物可配合于化妆料、饮食品、医药品等各种组合物。包含本发明酵母的菌体或菌体培养物或者它们的提取物的组合物也包含在本发明中。本发明的组合物只要包含上述本发明的第一方式及第二方式的酵母的菌体或菌体培养物或者它们的提取物中的任一项即可,也可包含两者。包含本发明酵母的菌体或菌体培养物或者它们的提取物的组合物包含来自该酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸。作为本发明的组合物,例如可列举化妆料(化妆料组合物)、饮食品(饮食品组合物)、医药品(医药品组合物)、医药部外品(医药部外品组合物)等。组合物也可为它们的原料。在一个方式中,组合物优选化妆料或者饮食品、它们的原料。本发明组合物中的上述酵母的菌体或菌体培养物或者它们的提取物的含量没有特别限定,可根据该组合物的种类、用途来适当设定。例如,相对于组合物优选上述酵母的菌体或菌体培养物或者它们的提取物的固体成分换算的含量为0.00001~50重量%,更优选0.00005~20重量%,进一步优选0.0001~10重量%。本发明组合物为化妆料或者医药品时,其剂型没有特别限定,可制成溶液状、膏状、凝胶状、固体状、粉末状等任意的剂型。化妆料没有特别限定,例如可制成洁面膏、洗面奶、化妆水、乳液、乳霜、美容液、生发剂、油剂、凝胶、洗发水、护发素、焗油膏、指甲油、粉底、口红、香粉、面膜、香水、粉、花露水、沐浴皂、肥皂、浴液、防晒霜等。将上述包含本发明酵母的菌体或菌体培养物或者它们的提取物作为化妆料或者化妆料原料为本发明的优选方式之一。化妆料及化妆料原料还可包括上述酵母的菌体或菌体培养物或者它们的提取物以外的成分。在化妆料及化妆料原料中可配合在化妆料中通常可配合的各种成分。例如,可适当配合油分、香料、表面活性剂、保湿剂、抗氧化剂、紫外线吸收剂、防腐剂、颜料、色素等。它们的配合比率只要可适当选自即可。本发明的化妆料原料可适合地用于制造本发明的化妆料。化妆料的用法及用量可根据化妆料的种类等来适当确定。由于本发明的化妆料或者化妆料原料含有l-羟脯氨酸,故而例如可适合地用于选自如下的用途:胶原蛋白产生促进、表皮细胞的增殖促进、皮肤的保湿、皮肤的抗老化、皮肤松弛的预防或者改善、皮肤弹性的改善、皱纹的预防或者改善及特应性皮炎的改善,可更适合地用于选自皮肤弹性的改善及皱纹的预防或者改善的用途。化妆料中的上述酵母的菌体或菌体培养物或者它们的提取物的含量相对于化妆料以固体成分换算计,优选0.00001~10重量%,优选0.0001~10重量%,更优选0.0001~5重量%,更优选0.001~5重量%,进一步优选0.01~3重量%,特别优选0.05~2重量%。另外,在其他的优选方式中,化妆料中的上述酵母的菌体或菌体培养物或者它们的提取物的含量相对于化妆料以固体成分换算计,更优选0.00005~1重量%,进一步优选0.0001~0.5重量%。化妆料原料中的上述酵母的菌体或菌体培养物或者它们的提取物的含量相对于化妆料原料例如以固体成分换算计,优选0.001~20重量%,更优选0.01~10重量%,进一步优选0.05~5重量%,特别优选0.1~2重量%。化妆料原料中的l-羟脯氨酸含量例如优选5~300ppm,更优选10~200ppm,进一步优选50~100ppm。在一个方式中,化妆料中的l-羟脯氨酸含量例如可制成0.01~20ppm,优选0.03~15ppm,更优选0.05~10ppm。优选配合上述酵母的菌体或菌体培养物或者它们的提取物,使l-羟脯氨酸含量成为上述的范围。本发明组合物为饮食品(饮食品组合物)时,饮食品没有特别限定。饮食品的形态可为液状、半液体状或者固体状、膏状中的任一种,例如还可为一般的饮食品、健康食品、功能性食品等中的任一种。一般的饮食品没有特别限定,还包括酒类。健康食品是指健康的或者对健康有益的食品,包含营养辅助食品、天然食品等。营养辅助食品是指特定的营养成分得到强化的食品。功能性食品是指用于补充承担机体调节功能的营养成分的食品,包含特定保健用食品、营养功能食品。作为营养辅助食品,可列举美容饮料、膳食补充剂等。本发明的饮食品还可为胶囊等的医药制剂的形态、饮料剂等。在饮食品中可配合认为可配合在饮食品中的各种成分。作为这样的成分,例如可列举粘结剂、增粘剂、着色剂、稳定剂、乳化剂、分散剂、崩解剂、混悬剂、表面活性剂、防腐剂、甜味剂、酸味剂等。上述包含本发明酵母的菌体或菌体培养物或者它们的提取物的饮食品为本发明中的优选方式之一。饮食品中的上述酵母的菌体或菌体培养物或者它们的提取物的含量例如相对于饮食品以固体成分换算计优选0.0001~10重量%,更优选0.001~5重量%,进一步优选0.01~1重量%。另外,饮食品中的l-羟脯氨酸含量优选0.0001~0.01重量%,优选配合上述酵母的菌体或菌体培养物或者它们的提取物,使l-羟脯氨酸含量成为上述范围。上述化妆料、化妆料原料、饮食品等组合物中的l-羟脯氨酸含量为游离的l-羟脯氨酸含量。l-羟脯氨酸优选来自上述酵母的菌体或菌体培养物或者它们的提取物。含有本发明酵母的菌体或菌体培养物或者它们的提取物的化妆料、饮食品、它们的原料等的组合物可根据其种类选择它们中通常使用的原料、添加剂等来配合,并在其中配合本发明酵母的菌体或菌体培养物或者它们的提取物,通过公知的方法来制造。本发明还包含选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母的菌体或菌体培养物或者它们的提取物的化妆料或者化妆料原料。上述酵母的菌体或菌体培养物或者它们的提取物优选上述本发明酵母的菌体或菌体培养物或者它们的提取物。本发明还包括如下含l-羟脯氨酸的化妆料原料的制造方法:包括将选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母在包含碳源及氮源的液体培养基中进行好氧培养,从而在上述酵母的菌体或者菌体培养物中使l-羟脯氨酸蓄积的工序(hyp蓄积工序)。上述氮源为含有含l-羟脯氨酸的肽的氮源。本发明的含l-羟脯氨酸的化妆料原料的制造方法的优选方式与上述的l-羟脯氨酸的制造方法的优选方式相同。上述含l-羟脯氨酸的化妆料原料的制造方法作为本发明的化妆料原料的制造方法优选。通过进行hyp蓄积工序,可得到含有l-羟脯氨酸的酵母的菌体或者菌体培养物。另外,通过对酵母的菌体或者菌体培养物进行上述的菌体粉碎处理,可得到含有l-羟脯氨酸的酵母的菌体或者菌体培养物的提取物。这样所得到的酵母的菌体或菌体培养物或者它们的提取物及其优选的方式与上述本发明的酵母的菌体或菌体培养物或者它们的提取物及其优选的方式相同。所得到的含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物可根据期望配合化妆料中通常使用的添加剂等,可作为含l-羟脯氨酸的化妆料原料使用。另外,可根据期望在由含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物纯化的l-羟脯氨酸中配合化妆料中通常使用的添加剂等来制造含l-羟脯氨酸的化妆料原料。根据本发明所得到的含l-羟脯氨酸的化妆料原料可适合地用于选自如下用途的化妆料:胶原蛋白产生促进、表皮细胞的增殖促进、皮肤的保湿、皮肤的抗老化、皮肤松弛的预防或者改善、皮肤弹性的改善、皱纹的预防或者改善及特应性皮炎的改善。本发明还包括含有l-羟脯氨酸且包含选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母菌体或菌体培养物或者它们的提取物的l-羟脯氨酸补充用组合物。上述酵母的菌体或菌体培养物或者它们的提取物含有l-羟脯氨酸,优选相对于l-脯氨酸(pro)及l-羟脯氨酸(hyp)的合计含量(μg/ml)的l-羟脯氨酸的含量(μg/ml)的比例(100×hyp/(pro+hyp))为35~100。优选上述酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸的含量为10μg/ml以上。包含这样的酵母的菌体或菌体培养物或者它们的提取物的l-羟脯氨酸补充用组合物可特别适合地用作用于辅助、补充或者强化化妆品、饮食品等的l-羟脯氨酸的添加剂。酵母的菌体或菌体培养物或者它们的提取物的优选方式与上述本发明酵母的菌体或菌体培养物或者它们的提取物及其优选方式相同。l-羟脯氨酸补充用组合物作为l-羟脯氨酸补充用的添加剂组合物,可适合地用于饮食品、化妆料等。l-羟脯氨酸补充用组合物也可称作l-羟脯氨酸补充用组合物或者l-羟脯氨酸强化用组合物。本发明的l-羟脯氨酸补充用组合物只要包含含有l-羟脯氨酸的上述酵母的菌体或菌体培养物或者它们的提取物即可,该菌体或菌体培养物或者它们的提取物的含量还可为100重量%,根据期望还可含有其他成分。例如作为食品添加剂使用l-羟脯氨酸补充用组合物时,还可包含在食品中使用的公知的添加剂中的1种或者2种以上。本发明的l-羟脯氨酸补充用组合物例如还可适合地用作化妆料添加剂。使用l-羟脯氨酸补充用组合物作为化妆料添加剂时,该组合物中只要包含上述酵母的菌体或菌体培养物或者它们的提取物即可,该菌体或菌体培养物或者它们的提取物的含量还可为100重量%,根据期望还可包含在化妆料中可使用的公知的添加剂中的1种或者2种以上。本发明的l-羟脯氨酸补充用组合物的制造方法优选包括通过将选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母在包含碳源及氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积的工序。包含这样的工序的l-羟脯氨酸补充用组合物的制造方法也包括在本发明中。上述氮源为含有含l-羟脯氨酸的肽的氮源。本发明的l-羟脯氨酸补充用组合物的制造方法及其优选方式与上述的l-羟脯氨酸的制造方法及其优选方式相同。本发明的l-羟脯氨酸补充用组合物的制造方法根据期望还可包括在酵母的菌体或菌体培养物或者它们的提取物中添加公知的食品添加剂、化妆料添加剂等的工序。本发明的其他方式的l-羟脯氨酸的制造方法包括通过在将选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母在包含碳源及氮源的液体培养基中进行好氧培养,从而使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积的工序。在本发明的其他方式的制造方法中,优选上述氮源含有含l-羟脯氨酸的蛋白质或者含l-羟脯氨酸的肽。在本发明的其他方式的制造方法中,上述含l-羟脯氨酸的蛋白质为胶原蛋白性蛋白质,优选上述含l-羟脯氨酸的肽为胶原蛋白肽。在本发明的其他方式的制造方法中,优选上述胶原蛋白性蛋白质及胶原蛋白肽的平均分子量为1000~100000。在本发明的其他方式的制造方法中,优选上述液体培养基中的氮源浓度为1~5重量%,碳源(c)与氮源(n)的重量比(c/n)为0.5~20。另外,优选上述好氧培养进行10~100小时,更优选进行10~80小时。本发明的其他方式的应用为将选自海洋柯达酵母(kodamaeaohmeri)、鲁考弗美奇酵母(metschnikowiareukaufii)、卡利比克迈耶氏酵母(meyerozymacaribbica)、季也蒙毕赤酵母(meyerozymaguilliermondii)及葡萄牙棒孢酵母(clavisporalusitaniae)中的至少1种的酵母用于制造l-羟脯氨酸的应用,包括通过将上述酵母在包含碳源及氮源的液体培养基中进行好氧培养,使l-羟脯氨酸在上述酵母的菌体或者菌体培养物中蓄积,优选上述氮源含有含l-羟脯氨酸的蛋白质或者含l-羟脯氨酸的肽。在本发明的其他方式的应用中,上述含l-羟脯氨酸的蛋白质为胶原蛋白性蛋白质,优选上述含l-羟脯氨酸的肽为胶原蛋白肽。在本发明的其他方式的应用中,优选上述胶原蛋白性蛋白质及胶原蛋白肽的平均分子量为1000~100000。在本发明的其他方式的应用中,优选上述液体培养基中的氮源的浓度为1~5重量%,碳源(c)与氮源(n)的重量比(c/n)为0.5~20。另外,优选上述好氧培养进行10~100小时,更优选进行10~80小时。作为上述含l-羟脯氨酸的蛋白质,可列举上述的胶原蛋白性蛋白质。胶原蛋白性蛋白质等的含l-羟脯氨酸的蛋白质的平均分子量优选超过10000、100000以下。蛋白质的平均分子量是指重均分子量。胶原蛋白性蛋白质等的含l-羟脯氨酸的蛋白质的平均分子量可通过凝胶过滤等算出。实施例以下,示出更为具体地说明本发明的试验例等。且,本发明并不仅限于这些试验例等。试验例中,在用于标准曲线的制作的l-羟脯氨酸(hyp)标准溶液的制备时,使用nacalaitesque株式会社制的l-4-羟脯氨酸。对于l-脯氨酸(pro)标准溶液的制备,使用nacalaitesque株式会社制的l-脯氨酸。通过试验例测定的l-羟脯氨酸及l-脯氨酸中的任一个均为游离的l-羟脯氨酸及l-脯氨酸。<试验例1>筛选蓄积l-羟脯氨酸(以下称为hyp)的菌为了筛选在菌体培养液中蓄积hyp的属种,通过以下的筛选条件进行1~3次筛选试验。1次筛选试验:筛选条件:乙醇生产量、增殖速度2次筛选试验:筛选条件:hyp蓄积量(比色法)3次筛选试验:筛选条件:hyp蓄积量(hplc)重现性:hyp蓄积量(hplc)将表1~3所示的不同属种的菌株供于试验。表1属种etoh(%)毕赤酵母(pichia)库德里阿兹威(kudriavzevii)0.03假丝酵母(candida)泽普琳娜(zemplinina)0.22伊萨酵母(issatchenkia)暹罗(siamensis)0.02米勒罗济马酵母(millerozyma)粉状(farinosa)0.10柯达酵母(kodamaea)海洋(ohmeri)0.03假丝酵母(candida)有尖端(apicola)0.20接合酵母(zygosaccharomyces)鲁氏(rouxii)0.24假丝酵母(candida)炼乳(lactis-condensi)0.62假丝酵母(candida)皱褶(rugosa)0.03丝孢毕赤酵母(hyphopichia)伯顿(burtonii)0.04假丝酵母(candida)间型(intermedia)0.02毕赤酵母(pichia)sp0.02三角酵母(trigonopsis)变异(variabilis)0.01接合酵母(zygosaccharomyces)假鲁氏(pseudorouxii)0.11接合酵母(zygosaccharomyces)暹罗(siamensis)0.08固囊酵母(citeromyces)暹罗(siamensis)0.15毕赤酵母(pichia)发酵(fermentans)0.01威克汉姆酵母(wickerhamomyces)皮杰普氏(pijperi)0.01威克汉姆酵母(wickerhamomyces)赛道威(sydowiorum)0.00假丝酵母(candida)莫拉克泰(morakotiae)0.02假丝酵母(candida)埃切(etchellsii)0.04假丝酵母(candida)副皱褶(pararugosa)0.02双足囊酵母(dipodascus)曼氏(magnusii)0.00有孢汉逊酵母(hanseniaspora)葡萄酒(vineae)0.00假丝酵母(candida)软(colliculosa)0.06接合酵母(zygosaccharomyces)sp0.24酵母(saccharomyces)酿酒(cerevisiae)0.05有孢汉逊酵母(hanseniaspora)耐渗透压(osmophila)0.00克勒克氏酵母(kloeckera)柠檬形(apiculata)0.00假丝酵母(candida)光滑(glabrata)0.18毕赤酵母(pichia)巴氏(barkeri)0.00美奇酵母(metschnikowia)韩国(koreensis)0.78假丝酵母(candida)虫群(homilentoma)0.82假丝酵母(candida)蔻氏(corydali)0.77接合有孢酵母(zygotorulaspora)弗洛伦蒂纳(florentina)0.93迈耶氏酵母(meyerozyma)季也蒙(guilliermondii)0.56沙雷菌(serratia)粘质(marcescens)0.17星形假丝酵母(starmerella)球拟(bombicola)0.02兰查斯酵母(lachancea)梅耶里(meyersii)0.11酵母(saccharomyces)米卡泰(mikatae)0.21假丝酵母(candida)菌膜(pelliculosa)0.00假丝酵母(candida)铁红(pulcherrima)0.13美奇酵母(metschnikowia)鲁考弗(reukaufii)0.17表2属种etoh(%)酿酒酵母(kazachstania)非洲(africana)0.56酿酒酵母(kazachstania)单孢(unispora)0.41酿酒酵母(kazachstania)需氧(aerobia)0.51裂殖酵母(schizosaccharomyces)刺参(japonicus)0.74毕赤酵母(pichia)克鲁维(kluyveri)0.00假丝酵母(candida)泽普琳娜(zemplinina)0.36有孢汉逊酵母(hanseniaspora)仙人掌(opuntiae)0.02星形假丝酵母(starmerella)sp0.50酿酒酵母(kazachstania)夜蛾(exigua)0.68酵母(saccharomyces)少孢(exiguus)0.55假丝酵母(candida)霍氏(holmii)0.43拉恩氏菌(rahnella)水生(aquatilis)0.04假丝酵母(candida)铁杉(railenensis)0.33假丝酵母(candida)欧诺比(ernobii)0.35德巴利酵母(debaryomyces)石芒草(nepalensis)0.07假丝酵母(candida)清酒(sake)0.04酵母(saccharomyces)库德里阿兹威(kudriavzevii)0.52假丝酵母(candida)索尔波斯范斯(sorbosivorans)0.06皮济马酵母(peterozyma)托莱纳(toletana)0.04中泽酵母(nakazawaea)何氏(holstii)0.23假丝酵母(candida)苏西费拉(succiphila)0.39假丝酵母(candida)莱塞比(lessepsii)0.32葡萄球菌(staphylococcus)溶血(haemolyticus)0.18毕赤酵母(pichia)斯科特(scolyti)0.18兰查斯酵母(lachancea)克鲁维(kluyveri)0.05假丝酵母(candida)棓米蔻拉(pomicola)0.04接合酵母(zygosaccharomyces)拜尔(bailii)0.23毕赤酵母(pichia)盔形(manshurica)0.16接合酵母(zygosaccharomyces)二孢(bisporus)0.30迈耶氏酵母(meyerozyma)季也蒙(guilliermondii)0.17迈耶氏酵母(meyerozyma)卡利比克(caribbica)0.10假丝酵母(candida)邦比(bombi)0.25美奇酵母(metschnikowia)鲁考弗(reukaufii)0.33毕赤酵母(pichia)森林(silvicola)0.38酿酒酵母(kazachstania)撒丁岛(ichnusae)0.74假丝酵母(candida)萨尔曼特斯(salmanticensis)0.33假丝酵母(candida)塞比(xestbii)0.13有孢汉逊酵母(hanseniaspora)葡萄(uvarum)0.00有孢汉逊酵母(hanseniaspora)泰国(thailandica)0.00表3属种etoh(%)酵母(saccharomycodes)路德类(ludwigii)0.24假丝酵母(candida)尼瓦内斯(nivariensis)0.02假丝酵母(candida)特利兰(tolerans)0.18有孢汉逊酵母(hanseniaspora)海兰迪卡(hailandica)0.00假丝酵母(candida)盾形(peltata)0.11假丝酵母(candida)弗咯利可(floricola)0.24伊萨酵母(issatchenkia)陆生(terricola)0.04棒孢酵母(clavispora)葡萄牙(lusitaniae)0.05假丝酵母(candida)卡棓皮拉(carpophila)0.19三角酵母(trigonopsis)卡泰莱利(cantarellii)0.16假丝酵母(candida)粗状(valida)0.01假丝酵母(candida)加利福尼亚(californica)0.03假丝酵母(candida)平常(inconspicua)0.02酒香酵母(brettanomyces)布鲁克莱斯(bruxellensis)0.28克鲁维酵母(kluyveromyces)耐热(thermotolerans)0.85毕赤酵母(pichia)中清(nakasei)0.30星形假丝酵母(starmerella)杆状(bacillaris)0.50接合有孢酵母(zygotorulaspora)sp0.39毕赤酵母(pichia)西文(occidentalis)0.05假丝酵母(candida)纳塔尔(natalensis)0.11假丝酵母(candida)蟑螂(blattae)0.17假丝酵母(candida)撒棓罗涅斯(saopaulonensis)0.17克勒克氏酵母(kloeckera)海泰涅斯(hatyaiensis)0.24假丝酵母(candida)旦都涅姆(dendronema)0.36美奇酵母(metschnikowia)美极(pulcherrima)0.34特拉皮西普酵母(tetrapisispora)西表(iriomotensis)0.33有孢圆酵母(torulaspora)球(pretoriensis)0.16假丝酵母(candida)郎比可(lambica)0.02特拉皮西普酵母(tetrapisispora)南塞斯(nanseiensis)0.55假丝酵母(candida)桔(quercitrusa)0.10假丝酵母(candida)克瑞斯迷蝶(chrysomelidarum)0.06迈耶氏酵母(meyerozyma)卡利比克(caribbica)0.06美奇酵母(metschnikowia)核果(fructicola)0.71假丝酵母(candida)橄榄(oleophila)0.11在1~3次筛选试验中,按照以下的条件进行前培养及主培养。在前培养及主培养中使用的ypd液体培养基的y:p:d为1:2:2(重量比)(y:酵母提取物(bacto公司制的产品名yeastextract(#212750))1.0重量%,p:肽(bacto公司制的产品名pepton(#211677)、将牛的细胞用来自猪的胰腺的酶分解的物质)2.0重量%,d:葡萄糖2.0重量%)。(前培养)在ypd液体培养基3ml中接种1接种环的各菌株,于30℃静置培养1天从而得到前培养液。(主培养)在ypd液体培养基5ml中接种前培养液100μl,于30℃振荡培养(60rpm)1天,从而得到酵母的菌体培养液(菌体培养物)。在2次筛选试验及3次筛选试验中用于hyp含量测定的培养物样品通过对主培养中得到的酵母的菌体培养液进行以下的自溶工序及杀菌工序等来制备。(自溶工序)将酵母的菌体培养液于50℃孵育2小时,通过自溶使菌体内容物在培养液中溶出。(杀菌工序)将上述自溶的培养液于80℃孵育1小时。由所得到的提取物通过离心分离(3000rpm、5min、1℃)来除去菌体残渣。据此来制备用于测定hyp蓄积量的培养物样品。1.1次筛选试验(1)乙醇生产量关于表1~3所示的酵母116株,测定进行主培养(30℃、1天、振荡培养)所得到的菌体培养液的上清的乙醇浓度。对于乙醇的测定使用biosensorbf5(日本王子计测机器公司)。用于试验的酵母培养液上清的乙醇浓度如表1~3所示。在试验中使用的全部酵母(116株)中,菌体培养液上清的乙醇浓度为1v/v%以下。(2)增殖速度接着,测定上述酵母的增殖曲线。在测定中,使用tvs062ca(advantec公司)来测定菌体培养液的吸光度(660nm)。其中,将增殖速度快的100株(以下记载为16株以外的菌株)用于2次筛选试验及3次筛选试验。(未用于2次筛选试验及3次筛选试验的菌株)鲁氏接合酵母、假鲁氏接合酵母(zygosaccharomycespseudorouxii)、暹罗接合酵母、埃切假丝酵母、球拟假丝酵母、星形假丝酵母sp(starmerellasp)、霍氏假丝酵母、水生拉恩氏菌、铁杉假丝酵母、欧诺比假丝酵母、石芒草德巴利酵母(debaryomycesnepalensis)、清酒假丝酵母、托莱纳皮济马酵母(peterozymatoletana)、卡泰莱利三角酵母(trigonopsiscantarellii)、布鲁克莱斯酒香酵母(brettanomycesbruxellensis)、橄榄假丝酵母2.2次筛选试验使用在1次筛选试验中筛选的100株,通过以下记载的比色法来对比hyp蓄积量。在2ml微量离心管中添加0.5m硼酸缓冲液0.2ml及培养物样品(或者hyp标准液)0.4ml并充分搅拌,于室温静置5分钟后在冰浴中(0℃)静置5分钟。接着,添加0.2m氯胺t溶液0.2ml,并一边不时地搅拌一边在冰浴中(0℃)放置120分钟(氧化反应)。在氧化反应后的溶液中添加3.6m硫代硫酸钠水溶液0.4ml并密封,在沸水浴中加热30分钟(脱羧反应)。将去氧化反应后的溶液用自来水冷却至室温后,添加乙酸乙酯0.6ml,用振荡器剧烈振荡20分钟。脱羧及乙酸乙酯提取时盖上用于防止开封的盖子。将所得到的溶液离心分离(1500rpm、5分钟)后,在1.5ml微量离心管中将乙酸乙酯层(上层:无色)0.4ml进行分级分离,并在其中添加erich试剂(黄)0.16ml,于室温静置30分钟作为样品(呈色反应:包含hyp时变红)。空白为在乙酸乙酯0.4ml中添加erich试剂0.16ml并于室温静置30分钟来制备。在玻璃制平皿(96孔、透明、平底)中分注200μl样品,用酶标仪(tecan公司制;infinitem200pro)将650nm的基线调节为0后,测定560nm的吸光度(为了防止挥发及由酸引起的机器的腐蚀,在板上贴膜)。用hyp标准液(hyp浓度2.5~0.25μg/ml)来制作标准曲线,求得培养物样品的hyp浓度。在供于试验的菌株中,通过比色法筛选培养物样品的hyp含量高的22株。3.3次筛选试验使用与2次筛选试验相同的菌株的培养物样品,通过与比色法相比精度更高的hplc法来测定hyp蓄积量。在hplc中,使用通过自动进样进行伯氨基酸(伯氨基)、仲氨基酸(仲氨基)的荧光标记化,通过反相hplc进行分析的系统。在伯氨基的荧光标记中使用邻苯二甲醛(opa),在仲氨基的荧光标记中使用氯甲酸-9-芴甲酯(fmoc)。将培养物样品用0.1nhcl进行稀释并制成样品。将该样品用0.45μm的过滤器过滤至样品瓶并设置成自动进样。在空瓶中装入mpa(巯基丙酸)试剂30μl、opa试剂15μl、上述样品5μl并静置1分钟后,添加5μl的fmoc试剂并将反应2分钟的溶液1μl注入hplc。opa与伯氨基酸反应,剩余的具有仲氨基的hyp及pro与fmoc反应。通过将各个荧光波长用2通道进行检测,可同时检测全部的氨基酸。以下示出hplc分析中使用的装置及条件。(装置)株式会社岛津制作所制的高效液相色谱nexerax2系统(产品名)系统控制器:cbm-20a,送液单元:lc-30ad(2台),脱气单元:dgu-20a5r,混合器:mr180μlii,自动进样器:sil-30ac,柱温箱:cto-20ac,荧光检测器:rf-20axs,工作站:labsolutionslc/gc(测定条件)色谱柱:inertsilods-4s-2μm(glsciences株式会社)保护柱:uhplcfitting(产品名,glsciences株式会社)(max.pressure:130mpa)流动相a液:15mmol/lkh2po4及5mmol/lk2hpo4(ph6.5)b液:15/45/40(v/v/v)=水/乙腈/甲醇r0(冲洗液):水/甲醇=20/80(v/v)r3(冲洗液):水/乙腈=80/20(v/v)初始b液浓度:10%(v/v)流量:0.8ml/min柱温箱温度:35℃进样量:1μl检测:ch1:激发波长350nm、荧光波长450nmch2:激发波长266nm、荧光波长305nm样品池温度:25℃,增益:×4,灵敏度:midium梯度程序(b液浓度(%)为v/v%)0~1.5分钟:b.conc10%1.5~6分钟:b.conc10%→30%的梯度6~11分钟:b.conc30%→40%的梯度11~15分钟:b.conc100%20~21.5分钟:b.conc100%→10%25分钟:控制器停止标准曲线:制备各氨基酸的6.25μmol/l、25μmol/l、50μmol/l、100μmol/l的0.1nhcl溶液。通过上述方法使上述的各溶液与mpa、opa及fmoc的各试剂反应,通过hplc进行分析来制成标准曲线。关于包含氨基酸混合标准液h型溶液及l-羟脯氨酸的0.1n盐酸溶液,也与上述同样使其与各试剂反应,在上述的装置及测定条件下通过hplc进行分析。图2为将包含氨基酸混合标准液h型及l-羟脯氨酸的0.1n盐酸溶液(各氨基酸浓度20μmol/l)进行分析的hplc图((a):ch1在激发波长350nm、荧光波长450nm下检测、(b):ch2在激发波长266nm、荧光波长305nm下检测)。使用的氨基酸混合标准液h型为日本和光纯药工业株式会社。关于在2次筛选试验中可确认hyp蓄积量多的22株菌体培养物,通过hplc进行的测定也可确认到hyp含量多。将由上述22株的菌体培养物制备的培养物样品通过hplc进行hyp含量测定的结果示于图1。且,在培养开始前的各液体培养基中未检测到游离的hyp。图1为表示通过hplc进行培养物样品的hyp含量测定结果的图。其中,对于通过hplc测定的hyp含量为90μg/ml以上的以下11种菌株,确认了重现性。卡利比克迈耶氏酵母(meyerozymacaribbica)(2种)、克瑞斯迷蝶假丝酵母(candidachrysomelidarum)、撒棓罗涅斯假丝酵母(candidasaopaulonensis)、蟑螂念珠菌、葡萄牙棒孢酵母、鲁考弗美奇酵母(2种)、季也蒙毕赤酵母、莫拉克泰假丝酵母(candidamorakotiae)、海洋柯达酵母(kodamaeaohmeri)4.重现性的确认对于上述11株确认了重现性。用与3次筛选试验同样的方法进行各菌株的前培养及主培养,使用通过主培养所得到的菌体培养液进行酵母的自溶来制备培养物样品。关于培养物样品,通过与3次筛选试验的hplc法相同的方法来测定hyp含量。其结果,关于全部的11株可得到与3次筛选试验同样的结果,从而可确认重现性。<试验例2>由试验例1的结果,从hyp蓄积量、用于食品、化妆料等时的安全性等的观点出发,对有望制备含有hyp的酵母的菌体或菌体培养物或者它们的提取物的属种卡利比克迈耶氏酵母(meyerozymacaribbica)(2种)、葡萄牙棒孢酵母、鲁考弗美奇酵母、季也蒙毕赤酵母及海洋柯达酵母(kodamaeaohmeri)的6种进一步进行实验。关于上述6种菌,改变ypd培养基的组成(y:p:d的比率及p的种类)及培养时间来进行主培养,测定菌体培养物中的hyp含量及pro含量。(前培养)使用y:p:d为1:2:2(重量比)(y:酵母提取物1.0重量%,p:肽2.0重量%,d:葡萄糖2.0重量%)的ypd液体培养基。酵母提取物及肽与在试验例1中使用的相同。前培养在与试验例1的1次筛选试验相同的条件下进行。(主培养)将上述所得到的前培养液100μl接种于下述的ypd液体培养基5ml,并于30℃进行振荡培养(60rpm)。培养时间为1天或者2天从而得到菌体培养液(菌体培养物)。在主培养中,作为ypd液体培养基的p使用肽或者胶原蛋白肽(cp)。对于胶原蛋白肽,使用collagenpeptideixoshdl-50sp(产品名,日本新田明胶株式会社制,平均分子量5000)(以下记载为胶原蛋白肽(cp1))或者collagenpeptidetypes(产品名,日本新田明胶株式会社制,平均分子量1200)(以下记载为胶原蛋白肽(cp2))。在ypd培养基中,也将使用胶原蛋白肽来代替肽的培养基称作ypd改变培养基。另外,在主培养中的ypd液体培养基的y:p:d的比率为(1)y:p:d=1:2:2(重量比)(y:酵母提取物1.0重量%,p:肽或者胶原蛋白肽2.0重量%,d:葡萄糖2.0重量%)或者(2)y:p:d=1:4:5(重量比)(y:酵母提取物1.0重量%,p:肽或者胶原蛋白肽4.0重量%,d:葡萄糖5.0重量%)。在表4示出在主培养中使用的培养条件1~12。表4用于测定hyp含量的培养物样品为将在主培养中所得到的酵母的菌体培养液用与试验例1相同的方法自溶并杀菌从而除去菌体残渣来制备。将所得到的培养物样品用0.1n盐酸溶液稀释来制备hplc的样品。由培养时间1天的菌体培养液制备的样品将培养物样品进行10倍稀释,由培养时间2天的菌体培养液制备的样品进行40倍稀释。使上述样品用与试验例1相同的方法与mpa、opa及fmoc的各试剂反应,并通过hplc分析。在hplc中使用的装置及测定条件与3次筛选试验相同。关于hyp及pro,标准曲线分别制备5μmol/l、10μmol/l、20μmol/l、50μmol/l、100μmol/l、250μmol/l的0.1nhcl溶液,并使上述溶液用与试验例1相同的方法与mpa、opa及fmoc的各试剂反应,并通过hplc分析来制作。培养物样品的hyp定量结果如表5所示。表中,cp1为上述的胶原蛋白肽(cp1)(产品名collagenpeptideixoshdl-50sp),cp2为胶原蛋白肽(cp2)(产品名collagenpeptidetypes)。培养物样品的pro定量结果如表6所示。表中的培养条件为主培养的条件。且,在培养开始前的各液体培养基中几乎不包含游离的hyp。表5表6由表5及表6所示的结果计算相对于各培养物样品中的pro及hyp的合计含量(μg/ml)的hyp含量(μg/ml)的比例(100×hyp/(pro+hyp))。其结果如表7所示。表7供于试验的6种酵母均通过好氧培养而在培养物中蓄积l-羟脯氨酸。所得到的菌体培养物中的任一种的(hyp/(pro+hyp))比例均为35以上。<试验例3>使用表8所示的卡利比克迈耶氏酵母(meyerozymacaribbica)、葡萄牙棒孢酵母、鲁考弗美奇酵母、季也蒙毕赤酵母及海洋柯达酵母(kodamaeaohmeri)。表8所示的由nbrc编号鉴定的酵母通过日本国立技术与评估研究院(日本千叶县木更津市上总镰足2-5-8)获得。表8(前培养)使用表8所示的酵母,除此以外在与试验例2相同的条件下进行。(主培养)将上述所得到的前培养液100μl接种于下述的ypd液体培养基5ml,并于30℃进行振荡培养(60rpm)。培养时间为1天或者2天从而得到菌体培养液。主培养的条件为试验例2的培养条件11或者12。具体而言,作为ypd液体培养基的p,使用collagenpeptidetypes(产品名,日本新田明胶株式会社制,平均分子量1200)(试验例2的胶原蛋白肽(cp2))。ypd液体培养基的y:p:d的比率为y:p:d=1:4:5(重量比)(y:酵母提取物1.0重量%,p:collagenpeptidetypes4.0重量%,d:葡萄糖5.0重量%)。由菌体培养液用与试验例2相同的方法制备培养物样品。将所得到的培养物样品用0.1n盐酸溶液稀释来制备hplc的样品。由培养时间1天的菌体培养液制备的样品为将培养物样品进行20倍稀释,由培养时间2天的菌体培养液制备的样品为将培养物样品进行50倍稀释。使上述样品用与试验例2相同的方法与mpa、opa及fmoc的各试剂反应。在与试验例2相同的条件下通过hplc进行分析来测定培养物样品中的氨基酸含量。结果如表9所示。在表9中,除hyp含量及pro含量以外还表示总氨基酸量(totalaa)。供于试验的酵母均通过好氧培养而使l-羟脯氨酸在培养物中蓄积。另外,菌体培养液(培养时间1天)在660nm的吸光度(od660)如表9所示。吸光度通过tvs062ca(advantec公司)测定。由表9所示的结果计算相对于各培养物样品中的pro及hyp的合计含量(μg/ml)的hyp含量(μg/ml)的比例(100×hyp/(pro+hyp))。其结果如表10所示。另外,将1天培养物的hyp含量(μg/ml)除以菌体培养液的吸光度od660的值(μg/ml/od660)(hyp/od660值)示于表10。表9表10<试验例4>使用在试验例2及3中使用的酵母,通过与试验例2及3相同的方法培养从而得到菌体培养液。通过将其于50℃孵育2小时,通过自溶使菌体内容物溶出到培养液中后,于80℃孵育1小时。其后,于1℃进行离心分离(3000rpm,5min),从而得到除去了菌体残渣的含l-羟脯氨酸的菌体培养物的提取物(含hyp的菌体培养物的提取物)。含hyp的菌体培养物的提取物还可适当稀释来使用。以下,示出配合了试验例4所得到的各含hyp的菌体培养物的提取物的皮肤外用剂组合物的制造例的一个例子。<制造例1>肥皂原料的配合量如表11所示。将肥皂坯料进行混合搅拌,其后加入各含hyp的菌体培养物的提取物并均匀混合后进行成型。表11原料使用量(重量份)肥皂坯料99.9含hyp的菌体培养物的提取物0.1总量100<制造例2>洗发水原料配合量如表12所示。在纯化水中加入溶解于1,3-丁二醇的防腐剂。均匀搅拌后,加入月桂醇硫酸钠、椰子油脂肪酸单乙醇酰胺,其后加入色素、香料及剩余的1,3-丁二醇,加入各含hyp的菌体培养物的提取物后均匀地混合搅拌。表12原料使用量(重量份)月桂醇硫酸钠16椰子油脂肪酸单乙醇酰胺41,3-丁二醇1.9含hyp的菌体培养物的提取物0.1防腐剂、色素、香料适量纯化水78总量100<制造例3>护发素原料的配合量如表13所示。(1)在纯化水中加入硬脂基二甲基苄基氯化铵及食盐并加热至80℃使其溶解。(2)将鲸蜡硬脂醇、氢化聚异丁烯及甘油单硬脂酸酯加热至80℃使其溶解。(3)一边将(1)用均质器进行搅拌一边添加(2),并在添加后进行5分钟预搅拌。(4)预搅拌结束后,一边搅拌一边冷却至50℃,添加各含hyp的菌体培养物的提取物并进一步搅拌冷却至35℃来制备。表13原料使用量(重量份)硬脂基二甲基苄基氯化铵1.4鲸蜡硬脂醇4氢化聚异丁烯2甘油单硬脂酸酯1.5食盐0.1含hyp的菌体培养物的提取物0.1纯化水90.9总量100<制造例4>生发水原料的配合量如表14所示。在纯化水中加入溶解于水杨酸、甘油、乙醇的维生素e、l-薄荷醇,进一步加入溶解于纯化水的一部分的甘草酸二钾,其后加入各含hyp的菌体培养物的提取物并均匀地混合来制备。表14原料使用量(重量份)乙醇70维生素e0.4l-薄荷醇0.4甘草酸二钾0.1含hyp的菌体培养物的提取物0.1水杨酸0.5甘油0.5纯化水28总量100<制造例5>喷雾剂原料的配合量如表15所示。在纯化水中加入柠檬酸及柠檬酸钠使其溶解。其后加入溶解于乙醇的防腐剂及聚山梨酯80。其后加入各含hyp的菌体培养物的提取物并均匀地搅拌来制备。表15原料使用量(重量份)柠檬酸0.01柠檬酸钠0.09防腐剂适量聚山梨酯800.05乙醇10含hyp的菌体培养物的提取物1纯化水88.85总量100<制造例6>化妆水原料的配合量如表16所示。在纯化水中加入柠檬酸及柠檬酸钠使其溶解。接着,依次加入甘油、1,3-丁二醇及乙二胺四乙酸三钠,进一步加入溶解于乙醇的聚氧乙烯(18)油醇醚、维生素e及羟苯甲酯并搅拌至均匀。其后加入各含hyp的菌体培养物的提取物并均匀地搅拌来制备。表16原料使用量(重量份)甘油41,3-丁二醇4乙醇7聚氧乙烯(18)油醇醚0.5柠檬酸0.05柠檬酸钠0.1乙二胺四乙酸三钠0.02维生素e0.5含hyp的菌体培养物的提取物1羟苯甲酯0.1纯化水82.7总量100<制造例7>乳液原料的配合量如表17所示。(1)将硬脂酸、鲸蜡醇、辛基十二烷基肉豆蔻酸酯及液体石蜡加热至80℃使其溶解。(2)在纯化水中加入三乙醇胺、透明质酸钠、甘油、1,3-丁二醇、聚氧乙烯(10)单油酸酯及乙二胺羟基三乙酸钠并加热至80℃。(3)一边将(1)用均质器进行搅拌一边添加(2),并在加入后进行5分钟预搅拌。(4)预搅拌结束后冷却至50℃,添加各含hyp的菌体培养物的提取物,并进一步冷却至35℃来制备。表17原料使用量(重量份)硬脂酸1.5鲸蜡醇0.5辛基十二烷基肉豆蔻酸酯5聚氧乙烯(10)单油酸酯1液体石蜡5三乙醇胺0.5含hyp的菌体培养物的提取物1透明质酸钠0.01甘油71,3-丁二醇3乙二胺羟基三乙酸钠0.01纯化水75.48总量100<制造例8>乳霜原料的配合量如表18所示。(1)将硬脂酸、单硬脂酸甘油酯、山梨坦倍半硬脂酸酯、聚氧乙烯山梨糖醇酐单硬脂酸酯、鲸蜡硬脂醇、角鲨烷、六(羟基硬脂酸/硬脂酸/松香酸)二季戊四醇、橄榄油、辛基十二烷基肉豆蔻酸酯及甲基聚硅氧烷加热至80℃使其溶解。(2)在纯化水中加入甘油、1,3-丁二醇、氢氧化钠及羟苯甲酯并加热至80℃使其溶解。(3)一边将(1)用均质器进行搅拌一边添加(2),并在加入后进行5分钟预搅拌。(4)预搅拌结束后冷却至50℃,添加各含hyp的菌体培养物的提取物,并进一步冷却至35℃来制备。表18产业上的可利用性本发明的含有l-羟脯氨酸的酵母的菌体或菌体培养物或者它们的提取物作为化妆料、饮食品等的原料有用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1