可定制设施的制作方法
本申请要求2016年8月2日提交的美国临时专利申请序列号62/370,041的优先权,其通过引用完整并入本文用于所有目的。
发明领域
本公开涉及可定制的设施,其使得用户能够在设施内制造多个产品。特别地,本公开涉及用于在清洁室环境中制造产品的可定制设施。
发明背景
用于制造产品,例如单克隆抗体和微生物产品的传统结构不允许有效利用结构的空间。传统结构的布局通常限制它们易于配置或扩展为制造新的产品线。因此,需要制造设施(facility),其允许用户有效地使用产品线之间的公共资源并且容易地修改设施以适应新的制造过程或具有减少的设施停机时间(downtime)的新生产线。
技术实现要素:
本公开提供了用于制造至少一种产品的可定制设施,其利用至少一种生产过程(例如,使用发酵单元和纯化单元的生产过程)。根据本公开的一个方面,可定制设施包含壳体(shell)、定位在壳体内的至少一个中央单元(centralunit)、以及至少一个模块单元(modularunit),每个模块单元定位在壳体内。壳体、中央单元和模块单元配置和排列成使修改不同范围的制造容量(capacity)的速度和便利性最大化。
根据本公开的另一方面,用于制造至少一种药物产品的可定制设施包含至少一个中央单元。至少一个模块单元与至少一个中央单元通信,使得至少一个中央单元向至少一个模块单元提供效用(utility)。
在一些实施方案中,可定制设施包含壳体,其中至少一个中央单元至少部分地定位在壳体内,并且至少一个模块单元至少部分地定位在壳体内。
在一些实施方案中,至少一个模块单元包含以下中的至少一种:发酵单元、病毒前单元(pre-viralunit)、病毒后单元(post-viralunit)、效用空间(utilityspace)、仓库、培养基缓冲剂设施(mediabufferfacility)、办公室(office)、人员单位(personnelunit)、生产单位(productionunit)、填充-成品单元(fill-finishunit)、剂量配制单元和包装单元。
在一些实施方案中,至少一个模块单元中的至少一个与至少一个中央单元直接相邻。
在一些实施方案中,至少一个模块单元包含多个模块单元,所述多个模块单元排列成在最小化壳体的占地面积(footprint)的情况下使壳体内的模块单元数目最大化。
在一些实施方案中,多个模块单元中的每个模块单元与至少一个中央单元中的至少一个和多个模块单元中的另一个直接相邻。
在一些实施方案中,至少一个中央单元和多个模块单元形成轮辐式结构(hubandspokeformation)。
在一些实施方案中,至少一个中央单元和多个模块单元排列成h形布局(layout)。
在一些实施方案中,可定制设施包含在壳体内的地面(groundsurface)上支持的生物反应器。
在一些实施方案中,可定制设施包含在至少一个模块单元之一内支持的生物反应器。
在一些实施方案中,可定制设施的外壁是以下之一:由所述壳体形成,所述壳体完全密封所述至少一个中央单元和所述至少一个模块单元;和由所述壳体和所述至少一个中央单元的外壁和所述至少一个模块单元的外壁中的至少一个形成。
在一些实施方案中,壳体包含至少一个侧壁,所述至少一个侧壁围绕所述至少一个中央单元和所述至少一个模块单元,以及固定到所述至少一个侧壁的上边缘的顶盖(roof),所述顶盖在所述至少一个中央单元和所述至少一个模块单元上延伸。
在一些实施方案中,至少一个模块单元中的至少一个是清洁室(cleanroom)。
在一些实施方案中,至少一个模块单元配置用于细胞疗法操作。
根据本公开的另一方面,组装用于制造至少一种药物产品的设施的方法包括:提供至少一个中央单位;和提供至少一个模块单元,所述至少一个模块单元与所述至少一个中央单元通信,使得所述至少一个中央单元向所述至少一个模块单元提供效用。
在一些实施方案中,该方法包含提供壳体;将所述至少一个中央单元至少部分地定位在所述壳体内;并且将所述至少一个模块单元至少部分地定位在所述壳体内。
在一些实施方案中,至少一个模块单元包含以下中的至少一种:发酵单元、病毒前单元、病毒后单元、效用空间、仓库、培养基缓冲剂设施、办公室、人员单位、生产单位、填充-成品单元、剂量配制单元和包装单元。
在一些实施方案中,所述至少一个模块单元包含多个模块单元,所述多个模块单元排列成在最小化壳体的占地面积的情况下使壳体内的模块单元数目最大化。
在一些实施方案中,多个模块单元中的每个模块单元直接邻近至少一个中央单元中的至少一个和至少一个模块单元中的另一个。
在一些实施方案中,至少一个中央单元和多个模块单元形成轮辐式结构。
在一些实施方案中,至少一个中央单元和多个模块单元排列成h形布局。
在一些实施方案中,方法包含以下之一:在所述壳体内的地面上支持生物反应器以及在所述至少一个模块单元之一内支持所述生物反应器。
在一些实施方案中,可定制设施的外壁是以下之一:由所述壳体形成,所述壳体完全密封所述至少一个中央单元和所述至少一个模块单元;和由所述壳体和所述至少一个中央单元的外壁和所述至少一个模块单元的外壁中的至少一个形成。
在一些实施方案中,壳体包含至少一个侧壁,所述至少一个侧壁围绕所述至少一个中央单元和所述至少一个模块单元,以及固定到所述至少一个侧壁的上边缘的顶盖,所述顶盖在所述至少一个中央单元和所述至少一个模块单元上延伸。
在一些实施方案中,至少一种药物产品是生物仿制药产品。
根据本公开的另一方面,用于制作至少一种药物产品的园区(campus)包含可定制设施,其配置为制造至少一种药物产品;培养基/缓冲剂车间(plant),其配置为对可定制设施供给至少一种处理材料;以及效用建筑物,其由效用线连接到培养基/缓冲剂车间和可定制设施中的至少一者,以经由效用线提供至少一种第一效用。
在一些实施方案中,仓库定位在可定制设施附近。
在一些实施方案中,至少一种第一效用包含蒸汽供给和/或空气供给。
在一些实施方案中,可定制设施包含至少一个中央单元,以及至少一个模块单元,所述至少一个模块单元与至少一个中央单元通信,使得至少一个中央单元向至少一个模块单元提供至少一种第二效用。
在一些实施方案中,可定制设施还包含壳体。至少一个中央单元至少部分地定位在壳体内,并且至少一个模块单元至少部分地定位在壳体内。
在一些实施方案中,至少一个模块单元包含以下中的至少一种:发酵单元、病毒前单元、病毒后单元、效用空间、仓库、培养基缓冲剂设施、办公室、人员单元、生产单元、填充-成品单元、剂量配制单元,以及包装单元。
在一些实施方案中,至少一种第一效用中的第一效用与至少一种第二效用中的第二效用相同。
在一些实施方案中,至少一种第一效用中的第一效用与至少一种第二效用中的第二效用不同。
在一些实施方案中,至少一个模块单元包含多个模块单元,多个模块单元排列为在使壳体的占地面积最小化的情况下使壳体内的模块单元数目最大化。
在一些实施方案中,培养基/缓冲剂车间定位在可定制设施附近,并且效用建筑物定位在可定制设施附近。
在一些实施方案中,可定制设施的外壁由壳体形成,壳体完全密封至少一个中央单元和至少一个模块单元,或
在一些实施方案中,可定制设施的外壁由壳体与至少一个中央单元的外壁和至少一个模块单元的外壁中的至少一者形成。
在一些实施方案中,壳体包含至少一个侧壁以及顶盖,所述至少一个侧壁环绕至少一个中央单元和至少一个模块单元,所述顶盖固定到至少一个侧壁的上边缘,所述顶盖在至少一个中央单元和至少一个模块单元之上延伸。
在一些实施方案中,可定制设施的第一层包含效用区域。
在一些实施方案中,至少一种药物产品是多种药物产品,并且可定制设施包含多个制造翼(manufacturingwing),每个制造翼配置为制造多种药物产品中的相应的药物产品。
在一些实施方案中,园区包含多个可定制设施。
在一些实施方案中,园区包含至少一个走廊,所述至少一个走廊将培养基/缓冲剂车间连接到可定制设施,至少一个走廊配置为允许用户将至少一种处理材料从培养基/缓冲剂车间运输到可定制设施。
根据本公开的另一方面,组装用于制造至少一种药物产品的园区的方法包含提供至少一个可定制设施,其配置为制造至少一种药物产品;提供培养基/缓冲剂车间,使得培养基/缓冲剂车间配置为对可定制设施供给处理材料;以及将效用建筑物可操作地耦接到培养基(medium)/缓冲剂车间和可定制设施中的至少一者,以经由效用线向培养基/缓冲剂车间提供至少一种第一效用。
在一些实施方案中,方法包含在可定制设施附近提供仓库。
在一些实施方案中,至少一种第一效用包含蒸汽供给和/或空气供给。
在一些实施方案中,方法包含提供至少一个中央单元,以及提供至少一个模块单元,所述至少一个模块单元与至少一个中央单元通信,使得至少一个中央单元向至少一个模块单元提供至少一种第二效用。
在一些实施方案中,方法包含提供壳体,将至少一个中央单元至少部分地定位在壳体内,以及将至少一个模块单元至少部分地定位在壳体内。
在一些实施方案中,至少一个模块单元包含以下中的至少一个:发酵单元、病毒前单元、病毒后单元、效用空间、仓库、培养基缓冲剂设施、办公室、人员单元、生产单元、填充-成品单元、剂量配制单元,以及包装单元。
在一些实施方案中,至少一种第一效用中的第一效用与至少一种第二效用中的第二效用相同。
在一些实施方案中,至少一种第一效用中的第一效用与至少一种第二效用中的第二效用不同。
在一些实施方案中,方法包含提供至少一个模块单元,包含提供多个模块单元,多个模块单元排列为在使壳体的占地面积最小化的情况下使壳体内的模块单元的数目最大化。
在一些实施方案中,方法包含将培养基/缓冲剂车间定位在可定制设施附近,并且将效用建筑物定位在可定制设施附近。
在一些实施方案中,可定制设施的外壁由壳体形成,壳体完全密封中央单元和至少一个模块单元中的至少一者。
在一些实施方案中,可定制设施的外壁由壳体与至少一个中央单元的外壁和至少一个模块单元的外壁中的至少一者形成。
在一些实施方案中,壳体包含至少一个侧壁以及顶盖,所述至少一个侧壁环绕至少一个中央单元和至少一个模块单元,所述顶盖固定到至少一个侧壁的上边缘,所述顶盖在至少一个中央单元和至少一个模块单元之上延伸。
根据本公开的另一方面,管理药物设施的方法包含提供用于制作至少一种药物产品的园区,所述园区包含配置为制造至少一种药物产品的至少一个可定制设施、培养基/缓冲剂车间,以及效用建筑物,所述效用建筑物由效用线连接到培养基/缓冲剂车间和至少一个可定制设施中的至少一者,以经由效用线提供至少一种第一效用;以及向期望制造药物产品的客户提供园区的至少一部分。
在一些实施方案中,园区的至少一部分包含至少一个可定制设施中的制造翼。
在一些实施方案中,提供园区的至少一部分的步骤包含提供购买园区的至少一部分的选项。
在一些实施方案中,提供园区的至少一部分的步骤包含提供租赁园区的至少一部分的选项。
根据本公开的另一方面,调整药物设施的容量的方法包含提供用于制作至少一种药物产品的园区,所述园区包含配置为制造至少一种药物产品的至少一个可定制设施、培养基/缓冲剂车间,以及效用建筑物,所述效用建筑物由效用线连接到培养基/缓冲剂车间,以经由效用线提供至少一种第一效用;向期望制造第一药物产品的第一客户提供园区的第一部分;以及构建园区的用于制造第二药物产品的第二部分,园区的第二部分是技术不可知论的(technologyagnostic)。
在一些实施方案中,第二药物产品是以下中的一种:与第一药物产品不同,以及与第一药物产品相同。
在一些实施方案中,园区的第一部分是可定制设施内的制造模块。
在一些实施方案中,方法包含向第二客户提供园区的第二部分;以及构建园区的用于制造第三药物产品的第三部分,所述第三部分是技术不可知论的。
在一些实施方案中,第一部分是仅经由第一专用访问路线可访问的,所述第一专用访问路线是由第一客户可访问的,但由第二客户不可访问;并且第二部分是仅经由第二专用访问路线可访问的,所述第二专用访问路线是由第二客户可访问的,但由第一客户不可访问。
在一些实施方案中,方法包含以对于新客户开始制造药物的就绪状态持续地维护园区的技术不可知论部分。
附图说明
附图不意图按比例绘制。为了清楚起见,并非每个部件都可以在每个附图中标记。在附图中:
图1是根据本公开的可定制设施的实施方案的俯视图;
图2a是图1的实施方案的透视图;
图2b是图1的实施方案的透视图,显示可定制设施内组件的位置;
图2c是图1的实施方案的透视图,显示可定制设施内另一个组件的位置;
图2d是图1的实施方案的透视图,显示可定制设施内另一个组件的位置;
图2e是图1的实施方案的透视图,显示可定制设施内另一个组件的位置;
图3a是根据本发明的模块单元的实施方案的分解图。
图3b是根据本发明的模块单元的另一实施方案的分解图。
图3c是根据本发明的模块单元的另一实施方案的分解图。
图3d是根据本公开的模块单元的另一实施方案的分解图。
图3e是根据本发明的模块单元的另一实施方案的分解图。
图4是根据本公开的可定制设施的实施方案的前透视剖视图。
图5是以h形布局排列的一组模块单元和中央单元的透视图;
图6是以h形布局排列的一组模块单元和中央单元的俯视图;
图7是其透视图;
图8是在壳体内以另一种排列来排列的模块单元和中央单元的俯视图;
图9是排列在壳体内的模块单元和中央单元的另一排列的俯视图;
图10是模块单元和中央单元的另一种排列的俯视图;
图11是以脊(spine)排列的一组模块单元和中央单元的示意图;
图12是根据本公开的园区的实施方案的透视图;
图13是图12中所示的园区的一部分的放大透视图;
图14是图12的园区的实施方案的另一透视图;和
图15是根据本公开的可定制设施的另一实施方案的透视剖视图。
具体实施方式
本文公开的用于可定制设施的结构可用于在给定时间时制造至少一种产品。本文公开的结构特别适合于制造利用共同资源的各种产品。
本公开提供了允许一个或多个可缩放产品线至少部分地密封在可定制设施的壳体内的系统和方法。由于结构可改编,因此它不需要用户长时间段将结构定型为单一产品线。可以重新配置结构以满足产品线的尺寸要求。
本公开的可定制设施使用户能够减少构建时间线,减少资本支出,增加全球设计标准化,并遵守全球各种标准。
可定制的结构允许从概念到构建的更短周转时间,允许减少构建现场拥堵,并且在实施新产品线时需要更少的固定资产。
通常,可定制设施包含壳体、位于壳体内的至少一个中央单元、以及至少一个模块单元,每个模块单元位于壳体内。
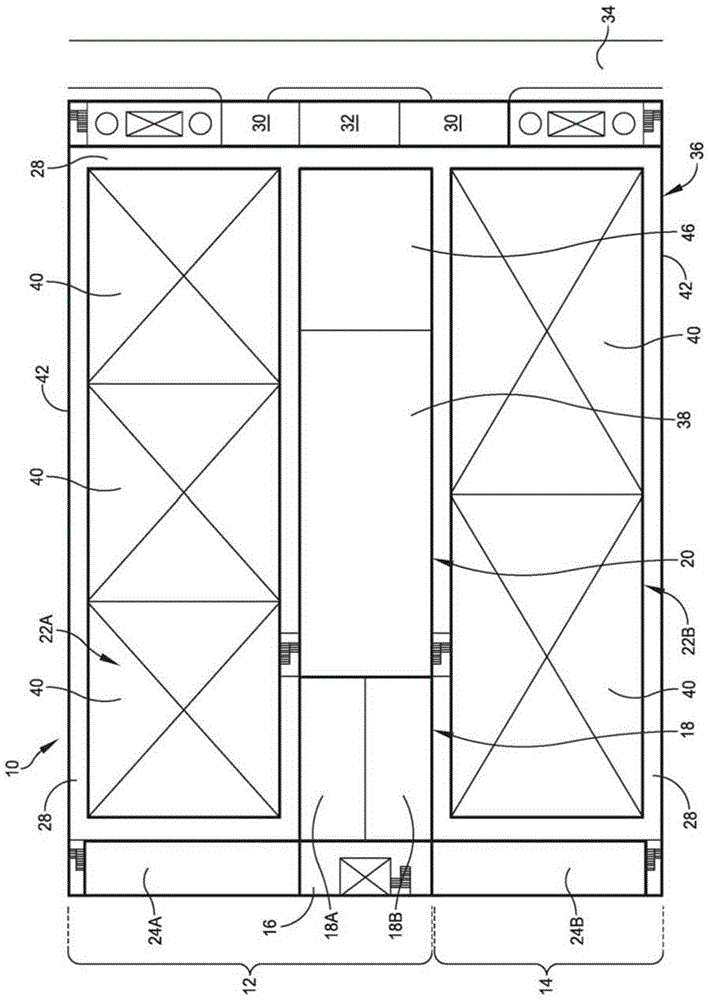
图1是通常用10指示的可定制设施的示例性实施方案的俯视图。图1的可定制设施可以在一系列阶段,例如第一阶段12、第二阶段14和后续阶段中构建。
安装在图1的可定制设施10的构建的第一阶段12中的特征包含空气受控的入口通道(aircontrolledentryway)16、换衣区域(changingarea)18、效用区域20、第一制造翼(manufacturingwing)22a、第一办公空间24a和至少一个走廊(corridor)28,其允许可定制设施10的占有者在可定制设施10内从一个区域移动到另一个。
在可定制设施10外部,存在有院(yard)30,其包含用于处理设备和材料的处理区域32。显示院区域30与道路(roadway)34相邻。通常,可定制设施10可以在任何方向上扩展。另外,可定制设施10构建成使得其可以在周围特征,例如院区域30和道路34的物理约束内的一系列构造阶段和/或子阶段中扩展。
图1显示了可以在构造的第二阶段14期间添加的附加特征,例如第二制造翼22b和第二办公空间24b。
可定制设施10的布局可以被配置用于在清洁室背景中制造。可定制设施10利用混合棒(hybridstick)或框架构建建筑物(framebuildbuilding)和具有效用单元(或效用中枢(utilityhub))的模块化建筑物。
现在参考图2a-2e,显示了可定制设施的各种组件的相对位置。
图2a显示了可定制设施10的外壳体36的外壁的透视图。外壳体(或壳体)36至少部分地密封中央单元(其可以是中央效用单元)38并且至少部分地密封多个模块单元40,如下面进一步讨论的。在一些实施方案中,外壳体36完全密封效用单元(其可以是中央效用单元)38并且完全密封多个模块单元40。
外壳体36可以根据传统的棒式建筑物或另一种方法(诸如但不限于预制模块)构造。例如,外壳体36可以使用传统的建筑方法由钢结构制成。外壳体36可以在地面上固定的立足点上支持。外壳体36是防风雨的。
外壳体36形成上部结构。在一些实施方案中,外壳体36可以是“巴特勒(butler)”式建筑物,其在建筑构建领域中是已知的。
外壳体36包含侧壁42,所述侧壁42尺寸为并且配置成环绕包含在可定制设施10中的一个或多个中央单元38和一个或多个模块单元40,并在下面更详细地描述。
顶盖44固定到侧壁42的上边缘,顶盖44在中央单元38和模块单元40上延伸。因此,侧壁42和顶盖44密封位于壳体36内的中央单元38和模块单元40。中央单元38和模块单元40可以在壳体36的底面上或上面固定有壳体的另一个支持表面上支持。可定制设施10提供部分模块(可称为模块棒建造)方法,其包含基本上部结构,然后用模块类型元件填充该上部结构。
在一个实施方案中,图2a的可定制设施10具有30米的外部高度。在一个实施方案中,每个制造翼具有100米的长度和30米的宽度。
图2b以虚线显示了可定制设施10的外部,效用区域为实线。效用区域20可以包含中央单元(其可以称为中央效用隔间(centralutilitybay,cub)或效用建筑物或中央效用模块)38,其朝向可定制设施10的中间定位。
图1的壳体36也密封未来的效用区域46,其被图1中的未来效用模块完全占据。未来的效用区域46与效用模块38相邻,并在图1中显示。未来的效用区域46可以用作与效用模块38相邻的仓库区域。此可定制设施10内的未来效用区域46也可以配合(suite)高隔间应用(highbayapplication),例如具有自动搜索和检索系统(asars)的40英尺高的仓库。
在一些实施方案中,效用模块38和未来的效用区域46是单个效用模块,其被分成效用部分和未来的效用部分。
中央效用模块38不需要位于可定制设施10的中心。在一些实施方案中,中央效用模块38可以沿着可定制设施10的外边缘定位。
图2c以虚线显示了可定制设施10的外部,其中制造翼22a,22b为实线。
制造翼22a,22b配置成含有用于产品线的模块单元40,诸如发酵模块或纯化模块。可定制设施10易于扩展和可放缩,并且制造翼22a,22b内的不同模块单元40可以用于在同一可定制设施10中生产完全不同的产品。
例如,在配置为第一发酵模块的模块单元40中,用户可以制造一种类型的产品,例如源自哺乳动物细胞系的单克隆抗体产品。在第二模块单元40中,用户可以制造完全不同的产品,诸如微生物产品。本公开的可定制设施10能够从单一可扩展的上部结构同时支持多个产品线和支持多个客户。本公开的可定制设施10能够扩展以添加额外的产品线。
可以在可定制设施10的制造翼22a,22b的模块单元40内支持反应器。可定制设施10可以支持任何期望的且合适的容器容积。例如,在诸如图1中所示的一些方面中,可定制设施10可以配置成含有多达20,000升的生产容器,以及超过20,000升(例如,23,000-24,000升)的储存容器(例如收获)。例如,可定制设施10的尺寸和构造可以支持具有约20,000升、15,000升、10,000升、5,000升、2,000升和/或1,000升的体积的容器。也可以支持具有其他体积的容器。
任何典型的制造和清洁室设备可以包含在可定制设施10中,并且可定制设施10可以完全适合于cgmp(目前良好生产实践)过程。
可以适应可定制设施10的一些设备的实例包含但不限于:生物反应器、盘式堆叠式离心机(discstackcentrifuge)、切向流过滤(tff)橇(skid)、深度过滤橇、在线稀释橇、层析柱与相关的控制设备、培养基罐、收获罐、纯化容器、深层过滤器支架(depthfilterholder)、水软化和脱氯系统、清洁蒸汽发生器、注射用水(wfi)储罐、wfi断流罐(wfibreaktank)、wfi蒸馏器(wfistill)、冷却塔、配电盘、应急发电机、冷却器、液体循环加热泵(hydronicpump)、高压釜、空气处理单元、工艺废物中和(如玻璃纤维增强塑料(frp))、生物废物收集和灭活系统、就地清洁系统(clean-in-placesystem)、玻璃清洗器和/或其他设备。
本公开的可定制设施10中的生物反应器可以是基于地面的反应器。或者,可以从结构自身悬挂生物反应器。例如,可以从一个或多个模块单元40悬挂生物反应器。
可定制设施10可以包含一个或多个中央单元38和一个或多个模块单元40。在一些实施方案中,每个模块单元40选自下组:发酵或细胞培养单元、病毒前单元、病毒后单元、效用院、仓库,培养基缓冲剂设施、办公室、人员单元、生产单元、填充-成品单元、剂量配制单元和包装单元。生产单元可用于制造产品。填充-成品单元可用于填充诸如小瓶的容器。剂量配制单元分配设定剂量的产品。包装单元包装产品以进行分销或销售。
可以根据需要进一步划分为每个模块单元分配的空间以适合特定的处理要求。每个制造翼22a,22b可以配置成允许超过一个模块单元40定位在相应的制造翼22a,22b内。
在图1和图2c中,第一制造翼22a包含三个模块单元40。第二制造翼22b包含两个模块单元40。中央效用区域20具有50米的长度和20米的宽度,并且具有三个内部水平。中央效用块(block)是可扩展的。
在一些实施方案中,模块单元40中的至少一个是清洁室。在一些实施方案中,模块单元40中的至少一个包含相应模块单元40内的清洁室部分。
建筑物外壳36设计成适应不同的生产模块。在一些实施方案中,外壳可以容纳四个用于哺乳动物细胞系的20,000升容器。在一些实施方案中,壳体可以容纳四个用于一次性技术操作的2,000升容器。
在一些实施方案中,制造翼可以包含含有四个20,000升容器和下游处理设备并且配置用于制造源自哺乳动物细胞系的单克隆抗体产品的模块单元、含有用于制造源自哺乳动物细胞系的单克隆抗体产品的一次性设备且具有四个20,000升容器的模块单元、配置用于制造微生物产品的模块单元和/或包含用于制造微生物产品的一次性设备的模块单元。
在一个实施方案中,模块单元被配置用于哺乳动物制造,并且包含四个20,000升容器和下游处理设备。在另一个实施方案中,模块单元包含四个用于商业和临床生产的20,000升容器。在另一个实施方案中,模块单元包含一个用于临床生产的1,000升容器。在另一个实施方案中,模块单元配置用于制造微生物产品,并包含一个15,000升容器。在另一个实施方案中,模块单元包含三个5,000升容器。在另一个实施方案中,模块单元包含一个或多个过程开发实验室。在另一个实施方案中,模块单元包含填充和成品临床开发小瓶填充设备、一组或多组冻干设备、用于制造预填充注射器的设备和/或用于制造用于商业应用的高效力产品的设备。在一些实施方案中,模块单元包含细胞疗法设备。在一些实施方案中,模块单元包含病毒疗法设备。
图2d以虚线显示了可定制设施10的外部,其中第一办公空间24a和第二办公空间24b以实线显示。第一办公空间24a包含办公室、用于个人存储的柜和支持区域。第二办公空间24b包含办公室、用于个人存储的柜和支持区域。第一办公空间24a的前壁48a形成可定制设施10的前外表面的一部分,如图2所示。第一办公空间24b的前壁48b形成可定制设施10的前外表面的一部分。因此,每个办公空间24a,24b仅部分地被可定制设施10的壳体36密封。
类似地,在一些实施方案中,中央单元的外壁和/或至少一个模块单元之一的外壁形成可定制设施的外壁的至少一部分。在一些实施方案中,中央效用模块的上表面和/或模块单元的上表面形成可定制设施的上表面的一部分。
图2e以虚线显示了可定制设施10的外部,其中换衣区域18为实线。换衣区域18允许用户进入可定制设施10并从便装变为工作服。图2e中的换衣区域18进一步细分为男性换衣区域18a和女性换衣区域18b。在一些实施方案中,换衣区域18细分为两个或更多个换衣区域。在一些实施方案中,换衣区域18未被细分。
在其他实施方案中,第一制造翼22a和第二制造翼22b、第一办公空间24a、第二办公空间24b、换衣区域18和效用区域20的相对位置可以在可定制设施10中不同地定位和/或相对于可定制设施10不同地定向。
脚手架(scaffolding)和走廊28允许可定制设施10的用户访问效用区域20的效用单元38和模块单元(发酵等模块)40。
在将构建的第二阶段14添加到可定制设施10之后,用户随时间可能希望进一步扩展可定制设施10。例如,全球经济中的消费者可以对用户制造的产品产生增加的需求或全球经济中的消费者可以对用户可以生产的产品产生增加的需求。为了响应对产品的需求的此类增加,用户可以在后续的构造阶段中扩展可定制设施10,所述后续阶段将附加特征添加到图1的可定制设施。在一些实施方案中,此类附加特征(诸如附加模块单元、附加制造翼或可定制设施的另一部件)水平地定位在第一制造翼22a或第二制造翼22b附近。在一些实施方案中,此类附加特征垂直地定位在第一制造翼22a和/或第二制造翼22b附近。
现在参考图3a-3e,用户可以在不同的子阶段中扩展制造翼,诸如图1的第一制造翼22a或第二制造翼22b。用户可以从图3a-3e中所示的配置之一转换成图3a-3e所示的另一种配置。或者,用户可以将制造翼布局转换为另一种配置。
图3a显示了模块单元40a的实施方案的部分分解图,该模块单元40a被配置为填充成品模块。图3a的填充成品模块包含具有单一层60a,占地面积为1500平方米。填充成品模块包含用于hvac车间房间和一些局部化效用的中层(mezzanine)。自由场地(freefield)50a与填充成品模块相邻以虚线显示,并且具有1500平方米的占地面积。自由场地50a可用于各种目的,诸如产品存储。填充成品模块40a和自由场地50a一起在第二制造翼22b的3,000平方米的占地面积上延伸。
图3b显示了配置为“2k模块”的模块单元40b的实施方案的部分分解图。图3b的2k模块具有单一层60b,占地面积为1500平方米。2k模块可以密封2,000升的容器。2k模块包含用于hvac车间房间和一些局部化效用的中层。自由场地50b与2k模块相邻以虚线显示,并且具有1500平方米的占地面积。自由场地50b可用于各种目的,诸如产品存储。2k模块40b和自由场地50b一起在第二制造翼22b的3,000平方米的占地面积上延伸。
图3c显示了配置为“5k模块”的模块单元40c的实施方案的部分分解图。图3c的5k模块具有单一层60c,占地面积为3,000平方米。5k模块可以密封5,000升的容器。5k模块包含用于hvac车间房间和一些局部化效用的中层。5k模块在制造翼的3,000平方米的占地面积上延伸。
图3d显示了配置为“15k模块”的模块单元40d的实施方案的部分分解图。图3d的15k模块具有第一层60d和第二层62。图3d的15k模块具有3,000平方米的占地面积。15k模块可以密封15,000升的容器。15k模块包含局部hvac单元、就地清洁(cip)单元和温度控制单元(tcu)。在一些实施方案中,温度控制单元包含水套,所述水套在罐上具有热交换器以控制产品线中使用的罐的温度。cip单元通常是模块撬,并且具有多个罐以容纳清洁溶液(例如苛性碱溶液和漂白剂)、泵和传感器以将清洁溶液送至待清洁的适当罐。
15k模块的第一层60d在制造翼的3,000平方米的占地面积上延伸。15k模块的第二层62在15k模块的第一层上方垂直延伸,并在制造翼的3,000平方米的占地面积上延伸。15k模块的第一层60d和15k模块的第二层62一起具有6,000平方米的组合面积。
图3e显示了配置为“20k模块”的模块单元40e的实施方案的部分分解图。图3e的20k模块具有3,000平方米的占地面积。20k模块可以密封20,000升的容器。20k模块包含局部hvac单元、cip单元和tcu。20k模块包含第一层、第二层和第三层。20k模块的第一层60e在制造翼的3,000平方米的占地面积上延伸。20k模块的第二层64在20k模块的第一层60e上方垂直延伸,并且在制造翼的3,000平方米的占地面积上延伸。20k模块的第三层66在20k模块的第一层60e和20k模块的第二层64上方垂直延伸,并且在制造翼的3,000平方米的占地面积上延伸。20k模块的第一层60e、20k模块的第二层64和20k模块的第三层66一起具有9,000平方米的组合面积。
图4是根据本公开的总体上以110指示的可定制设施的示例性实施方案的前透视剖视图。可定制设施110布局可以配置用于在清洁室背景中制造。可定制设施110利用混合棒或框架建筑建筑物和具有位于中心的效用中枢(或中央单元)114的模块建筑物。
外壳体(或壳体)112密封中央单元114和与中央单元114相邻的多个模块单元116。外壳体112可以根据传统的棒式建筑物或另一种方法(诸如但不限于预制模块)构建。例如,外壳体112可以使用传统的建筑方法从钢结构制成。外壳体112可以在地面上固定的立足点上支持。外壳112是防风雨的。
外壳体112形成上部结构。在一些实施方案中,外壳体112可以是“巴特勒”式建筑物,其在建筑构建领域中是已知的。
外壳体112包含侧壁118,所述侧壁42尺寸为并且配置成环绕包含在可定制设施110中的一个或多个中央单元114和一个或多个模块单元116,并在下面更详细地描述。顶盖120固定到侧壁118的上边缘,顶盖120在中央单元114和模块单元116上延伸。因此,侧壁118和顶盖120密封位于壳体112内的中央单元114和模块单元116。中央单元114和模块单元116可以在壳体112的底面122上或上面固定有壳体112的另一个支持表面上支持。可定制设施110提供部分模块(可称为模块棒建造)方法,其包含基本上部结构,然后用模块类型元件填充该上部结构。
在壳体112内,图4的可定制设施110包含至少一个中央单元114,其各自可以称为中央效用隔间(cub)。中央单元114提供图4中的中央效用。如图所示,cub114位于具有模块单元116的结构的中间,所述结构可以称为制造吊舱(manufacturingpod),其源自cub114(或多个cub)。在图4中,模块单元116是发酵模块。可定制设施110易于扩展和可放缩,并且吊舱/模块方法(即,轮辐式方法)允许不同模块在相同可定制设施110中生产完全不同的产品。
例如,在第一发酵模块中,诸如图4左侧的发酵模块,用户可以制造一种类型的产品,例如源自哺乳动物细胞系的单克隆抗体产品。在第二模块中,例如图4右侧的发酵模块,用户可以制造完全不同的产品,例如微生物产品。本公开的可定制设施110能够从单一可扩展的上部结构同时支持多个产品线和支持多个客户。
图4显示了在可定制设施110内支持的反应器124。可定制设施110可以支持任何期望的且合适的容器体积。例如,在诸如图4中所示的一些方面中,设施110可以配置成含有多达20,000升的生产容器和超过20,000升(例如,23,000-24,000升)的储存容器(例如收获)。例如,可定制设施110可以尺寸为并且配置成支持容器124,所述容器124具有约20,000升、15,000升、10,000升、5,000升、2,000升和/或1,000升的体积。还可以支持具有其他体积的容器124。
脚手架126和走廊128允许设施110的用户访问中央单元(中央效用)114和模块单元(发酵等模块)116。如图4所示,脚手架126定位在壳体112内。
在一些实施方案中,一个或多个中央单元(cub)114和一个或多个模块单元116排列成轮辐式排列。
任何典型的制造和清洁室设备可以包含在可定制设施110中,并且可定制设施110可以完全适合于cgmp过程。
可以装配在设施110中的一些设备的实例包含但不限于:生物反应器、盘式堆叠式离心机、切向流过滤(tff)橇、深度过滤橇、在线稀释橇、层析柱与相关的控制设备、培养基罐、收获罐、纯化容器、深层过滤器支架、水软化和脱氯系统、清洁蒸汽发生器、注射用水(wfi)储罐、wfi断流罐、wfi蒸馏器、冷却塔、配电盘、应急发电机、冷却器、液体循环加热泵、高压釜、空气处理单元、工艺废物中和(如玻璃纤维增强塑料(frp))、生物废物收集和灭活系统、就地清洁系统、玻璃清洗器和/或其他设备。
如图4所示,本公开的可定制设施110中的生物反应器可以是基于地面的反应器。或者,可以从结构自身悬挂生物反应器124。例如,可以从一个或多个模块单元116悬挂生物反应器124。
图4的壳体112向设施110的右后方围绕仓库区域130。此设施110内的仓库区域130也可以配合高隔间应用,例如具有自动搜索和检索系统(asars)的40英尺高的仓库。
可定制设施110可以包含一个或多个中央单元114和一个或多个模块单元116。在一些实施方案中,每个模块单元116选自下组:发酵或细胞培养单元、病毒前单元、病毒后单元、效用院、仓库,培养基缓冲剂设施、办公室、人员单元、生产单元、填充-成品单元、剂量配制单元和包装单元。可以根据需要进一步划分为每个模块单元分配的空间以适合特定的处理要求。
在一些实施方案中,模块单元116中的至少一个是清洁室。
图5显示了以h形布局132排列的一组中央单元114和模块单元116的透视图。可以调整每个模块单元116的位置以最佳地适合处理要求。
图6和7显示了可定制设施的实施方案,其中当从上方观察时,中央单元114和配置为纯化单元116a和发酵单元116b的一组八个模块单元排列成h形布局133。在这些视图中未显示壳体112。图6的平面图显示了中央单元(标记为中央效用建筑物)114,其具有第一排模块单元和第二排模块单元,所述第一排模块单元配置为纯化单元116a和发酵单元116b,排列在与中央单元114的第一侧136相邻的线性阵列134中,所述第二排模块单元配置为纯化单元116a和发酵单元116b,排列在与中央单元114的第二侧140相邻的线性阵列138中。模块单元的阵列134包含四个模块单元,在阵列134的第一末端的第一纯化单元116a、在阵列134的中间的两个发酵单元116b、和在阵列134的第二末端的第二纯化单元116a。类似地,模块单元的阵列138包含四个模块单元,在阵列138的第一末端的第一纯化单元116a、在阵列138的中间的两个发酵单元116b、和在阵列138的第二末端的第二纯化单元116a。
模块单元的第一阵列134的两个发酵单元116b各自包含侧壁,该侧壁与中央单元114的第一侧壁136直接面对接合。类似地,模块单元的第二阵列138的两个发酵单元116b各自包含侧壁,该侧壁与中央单元114的第二侧壁140直接面对接合。纯化单元116a与它们各自相邻的发酵单元116b处于直接面对关系。由于中央单元114和发酵单元116b的直接面对接合,可以装配在给定大小的壳体112内的中央单元114和模块单元的数量增加。同样地,密封给定的一组中央单元114和模块单元所需要的壳体112的占地面积减小。可选地,在一些方面,发酵单元116b(或其他模块单元)的侧壁不需要直接面对接合,而可以是间隔的以提供任何期望的占地面积。
模块单元116和中央单元114可以排列成便于同时制造多个产品。模块单元116和中央单元114排列成有效地在相应产品的生产线之间共享资源。例如,在一些实施方案中,中央单元114含有以下中的至少一个:发电机、管道线(plumbingline)、电力线(powerline)和可由模块单元116共享的其他资源。另外,模块单元116和中央单元114可以排列成便于将来扩展制造容量。例如,最初可以利用单个模块单元116,在后来的时间能够添加额外的模块单元116,同时具有对现有操作的最小影响。
在一些实施方案中,每个模块单元116包含其自身相应的加热、通风和空调(hvac)系统,如操作和隔离所需要。
在一些实施方案中,轮辐式排列可以类似于字母h,诸如在图6的平面图中。在其他实施方案中,轮辐式排列不类似于字母h。其他形状是可能的,包含但不限于:正方形、矩形、五边形和其他几何形状,只要它具有中央单元(中央效用隔间)与至少一个从那里延伸的模块单元。别的形状也是可能的,例如,如图10所示。在一些实施方案中,例如,可以使用线性“脊”形状或者可以使用“e”形状,使得轴辐式排列类似于字母e。
在一些实施方案中,中央单元114不在中央单元114和模块单元116的排列的中心。模块单元116和中央单元114的排列优选地配置成减少给定的一组生产线所需要的模块单元116的数量。
模块单元116可以彼此分割开来以减少产品或套件的交叉污染。
图8显示了本公开的可定制设施1000的另一优选实施方案的平面图。两个中央单元114朝向图8所示结构的平面图的底部中心定位,并且位于共用走廊128之间,所述共用走廊128沿着中央单元114的壁延伸。中央单元114的左侧是六个模块单元的成组。此成组包含两个病毒前单元116c、两个病毒后单元116d和两个发酵单元116b。如图8所示的中央单元114的右侧是六个模块单元的成组,包含两个病毒前单元116c、两个病毒后单元116d和两个发酵单元116b。此配置设计为根据需要扩展附加能力(例如,参见图10作为显示扩展选项的实施方案的实例)。沿着如图8所示的设施1000的顶部,存在其他模块单元,包含效用院单元116e、两个仓库单元116f、两个培养基/缓冲剂设施单元116g和办公室单元116h、以及两个人员访问单元116j。该图中未显示在每个纯化单元正上方添加独立的缓冲保持模块单元的能力。共用走廊128沿着单元的壁延伸,使得用户可以自共同的走廊128访问图8的每个模块单元和中央单元114。
根据评级标准,不同的单元可以有不同的分类水平。例如,根据美国食品药品管理局制定的分级标准或eudralex,欧盟医药产品管理规则(therulesgoverningmedicinalproductsintheeuropeanunion)第4卷欧盟良好制造实践指南人用和兽用医药产品(euguidelinestogoodmanufacturingpracticemedicinalproductsforhumanandveterinaryuse)(由附录1欧盟无菌医药产品制造(annex1manufactureofsterilemedicinalproductsintheeuropeanunion)增补)制定的分级标准,不同的单元可以具有不同的分类水平。例如,根据欧盟标准,图8中的病毒前单元116c、病毒后单元116d和培养基/缓冲剂设施单元116g分类为“c级”,而发酵单元116b分类为“d级”,并且剩余单元未分类。单元的其他分类是可能的,并可根据用户需要进行选择。
图9显示了本公开的可定制设施1200的另一个实施方案。图9包含中央单元(中央效用建筑物)114,其在中央单元114的任一侧上具有用于清洁材料和人员的走廊128。走廊128从图9所示的设施1200的上端的仓库116f延伸,并延伸超出设施底部的中央单元114。在相应的走廊128的外侧是更衣室(lockerroom)单元116k、病毒前单元116c、病毒后单元116d和发酵单元116b。
在一个实施方案,诸如图9中所示的实施方案中,发酵单元116b各自具有63英尺乘以65英尺的尺寸,并且高35英尺。在一个实施方案中,在诸如图9中所示的实施方案中,病毒前单元116c可以具有62英尺乘以50英尺的尺寸,并且高17英尺。在一个实施方案。诸如图9所示的实施方案中,病毒后单元116d各自具有62英尺乘以65英尺的尺寸,并且高35英尺。在其他实施方案中,单元可以具有其他尺寸。
图10显示了本公开的可定制设施1300的另一个实施方案,其中未显示壳体112。图10包含五行区域。在图10的平面图中的第一排(顶排)142包含纯化区117a。第二排144包含发酵区117b。第三排150包含中央效用区114。第四排146包含发酵区117b。第五排148包含纯化区域117a。
在一些方面,用于制造至少一种药物产品的可定制设施可以包含至少一个中央单元和至少一个模块单元,但是可定制设施不包含壳体。每个模块单元与至少一个中央单元通信,使得至少一个中央单元向每个模块单元提供效用。
实线的区域指示可以以初始配置提供的一组区域。在此初始配置160中,存在有第一排142中的三个纯化区域(pure1、pure3、pure5)117a、第二排144中的三个发酵区域(ferm1、ferm3、ferm5)117b、第三排150中的中央效用区域(中央效用1)115、第四排146中的三个发酵区(ferm2、ferm4,ferm6)117b、以及第五排148中的三个纯化区(pure2、pure4、pure6)117a。
可以通过向右扩展区域阵列来添加一组区域162。例如,可以将两个另外的纯化区域(pure7,pure9)117a添加到第一排142,可以将另外两个发酵区域(ferm7,ferm9)117b添加到第二排144;可以将另外的中央效用区域114添加到第三排150,可以将两个另外的发酵区域(ferm8,ferm10)117b添加到第四排146,并且可以将两个另外的纯化区域(pure8,pure10)117a添加到第五排148。右边的箭头,例如标记为ferm9和fermn+1的发酵区117b之间的箭头a指示区域排列的潜在扩展方向。可以根据需要将另外的区域添加到相应行,并且图10显示了第一排142末端的纯化单元(puren+1)117、第二排144末端的发酵区(fermn+1)117b、第四行146末端的沿箭头b方向的发酵区(fermn)117b、以及在第五行148的末端的纯化区(puren)117a。n数值可以是用户根据需要选择的整数值,并且仅受到壳体112的内部尺寸的限制,模块单元116和中央单元114位于所述壳体112内。
可以通过沿箭头c将中央效用区域114添加到第三排150来扩展第三排。
图10的区域是各自可以是中央单元或模块单元(例如,发酵单元,纯化单元等)的区域,或可以支持供单元用的设备的区域。在图10显示了区域(例如区域ferm1)的情况下,此区域可以细分为区域内的发酵单元ferm1和一个或多个走廊。在至少一些区域中,单元可以占据整个区域。
本文公开的模块单元116可以进一步细分为子单元。例如,单元可以具有病毒前子单元和病毒后子单元。病毒后子单元是无病毒的。
就图4-9而言,尽管图显示了分为描述为单元的区域的视图,但是视图的区域可以指定各区域(诸如纯化区,发酵区等),其各自包含单元和连接单元的一个或多个走廊。
图11显示了设施1400的另一个示例性实施方案,其中中央单元114呈线性“脊”的形状,其中多个模块116从脊发出。在该实施方案中,模块116可以随后在多个构建阶段中添加,使得设施随时间扩展。
根据本公开的一个方面,组装用于制造至少一种药物产品的设施的方法可以包含提供壳体,将至少一个中央单元至少部分地定位在壳体内,以及至少部分地在壳体内定位至少一个模块单元。
根据本公开的方面,提供了用于制作至少一种药物产品的园区。在图12和图13中显示园区1500的一个实施方案。园区1500包含五个可定制设施,各自在1510处指示。每个可定制设施1510配置为制造至少一种药物产品。五个可定制设施1510依赖于由园区提供的现有的基础设施(infrastructure)和支持网络。例如,可以从定位在可定制设施1510附近的培养基/缓冲剂车间(培养基/缓冲剂设施)1520向可定制设施1510提供培养基。在图12中,培养基/缓冲剂车间1520与可定制设施1510中的四个相邻。
在一些方面中,培养基/缓冲剂车间1520可操作地耦接至少一个可定制设施1510和/或配置为对至少一个可定制设施1510提供或供给处理材料,诸如但不限于培养基或缓冲。在一些方面中,培养基/缓冲剂车间1520可以配置为在诸如袋的可运输容器中提供处理材料,并且经由卡车、轨道或园区上的其他地面运输系统将处理材料运输到可定制设施1510。在一些方面中,园区可以包含供给线1530,且相应的供给线1530将培养基/缓冲剂车间1520连接到每个相应的可定制设施1510,以对每个可定制设施1510供给培养基来制造(多种)药物产品。
在一些实施方案中,供给线1530是连接走廊,其将培养基/缓冲剂车间1520连接到每个可定制设施1510。在一些实施方案中,连接走廊是6米高的覆盖的走道。员工或自动化交通工具可以通过连接走廊运输诸如缓冲或培养基的处理材料,以将处理材料递送到每个可定制设施1510。
在一些方面中,效用建筑物1540由效用线1550连接到培养基/缓冲剂车间1520,以经由效用线1550向培养基/缓冲剂车间1520提供至少一种第一效用。例如,效用建筑物1540可以向图12中的培养基/缓冲剂车间1520提供空气供给和蒸汽供给。效用建筑物1540可以配置为递送或以其他方式向培养基/缓冲剂车间1520和/或可定制设施1510提供效用。效用建筑物1540定位在可定制设施1510中的一个附近。在一些方面中,效用建筑物1540是可选的。
在一些实施方案中,效用建筑物1540还包含连接到每个可定制设施1510的一个或多个效用线,使得效用建筑物1540向培养基/缓冲剂车间1520并向每个可定制设施1510供给效用。在一些实施方案中,效用建筑物1540可以用来向培养基/缓冲剂车间1520、可定制设施1510、仓库1560,以及园区上的任意其他建筑物中的任意者提供效用。
培养基/缓冲剂车间区域与每个可定制设施1510的(多个)制造翼中的(多个)下游处理区域区分。尽管培养基/缓冲剂车间和可定制设施1510在相同的园区1500上,但是只要浓缩溶液可以在每个可定制设施1510内从培养基/缓冲剂车间1520递送到(多个)下游处理区域而不会不利地影响溶液的稳定性或活性,就不要求其相邻性。进行溶液的调度(scheduling)、配制,以及递送,以在意图使用它们时或恰在之前制备溶液。此排列减少了生物反应器现场的储存空间,并且允许多个制造者分担与培养基/缓冲剂车间1520相关联的花费。
在一些实施方案中,可定制设施1510中的相应的一个的第一层包含效用区域。
仓库1560定位在图12中的可定制设施1510之一附近。用户可以在仓库1560中储存材料,并且然后将材料从仓库1560运输到园区1500上的另一建筑物,诸如园区上的可定制设施1510之一。在一些方面中,仓库是可选的。
每个可定制设施1510可以配置为制造与园区1500上的其他可定制设施1510不同的药物产品。此外,如本文中所描述的,每个可定制设施1510可以配置为利用可定制设施内的模块、翼或套间(suite)生产多个药品产品。
图13显示了园区1500的一部分的放大图,更详细地显示了图12的可定制设施1510之一。图13的可定制设施1510包含不同的模块。特别地,图13的可定制设施1510包含办公室模块1570、长袍模块(gownmodule)1580、效用模块1590,以及两个制造翼1600a、1600b。
制造翼1600a可以配置为使得其具有三个制造模块1610,每个制造模块1610可以由不同的制造者使用来制造不同的药物产品。每个制造模块1610在可定制设施1510内具有其自身的专用访问,具有从长袍模块1580到相应的制造模块1610的独立路线。制造翼1600b可以配置为以与制造翼1600a相似的方式具有多个制造模块。
在园区1500的一些实施方案中,可定制设施1510中的至少一个的第一制造翼1600a是预建造的,并且可用于制造至少一种药物产品。当第一制造翼1600a正被完全利用于制造操作时,用户可以建造出与第一制造翼1600a是技术不可知论的第二制造翼1600b,这意味着第二制造翼1600b总体上配置为广泛的制造操作,以生产广泛的制造的产品,其可以与由第一制造翼1600a生产的药物产品不同。因为制造翼1600a、1600b是技术不可知论的,所以园区1500对用户提供灵活制造选项。在一些实施方案中,在用户要求附加的制造空间前,第二制造翼1600b可以配置为建造在相应的可定制设施1510内。依此方式,在园区1500上的五个可定制设施1510中建造起附加的制造翼。例如,当五个制造翼正被用于制造药物产品时,用户建造出第六制造翼。通过建造出超过需求制造空间的附加的制造翼,用户确保可定制设施不具有制造翼的100%利用率,直到全部十个制造翼(图12的五个可定制设施1510中每一个有两个制造翼)用于制造药物产品。
效用模块1590还可以被识别为中央单元,并且向可定制设施1510的模块单元提供至少一种第二效用,所述模块单元是图12的实施方案中的办公室模块1570、长袍模块1580、效用模块1590,以及两个制造翼1600a、1600b。
在园区1500的一些实施方案中,效用建筑物1540连接到可定制设施1510中的每一者,并且第一效用与第二效用相同。在此类实施方案中,效用模块1590补充由效用建筑物1540提供给相应的可定制设施1510的模块单元的效用。在一些实施方案中,第一效用与第二效用不同。
在园区1500的一些实施方案中,每个可定制设施1510可以是可定制设施,如以上关于图1-11所描述的。例如,在一些实施方案中,可定制设施1510包含至少一个中央单元,以及至少一个模块单元,所述至少一个模块单元与至少一个中央单元通信,使得至少一个中央单元向至少一个模块单元提供至少一种第二效用。
在一些实施方案中,一个或多个模块单元包含发酵单元、病毒前单元、病毒后单元、效用空间、仓库、培养基/缓冲剂车间、办公室、人员单元、生产单元、填充-成品单元、剂量配制单元,和/或包装单元。
尽管图12和图13中未显示壳体,但每个可定制设施1510包含壳体,相似于关于图1-2e或图4所描述的可定制设施的实施方案或本公开的可定制设施的另一实施方案中的壳体。
在一些实施方案中,一个或多个中央单元至少部分地定位在壳体内,并且一个或多个模块单元至少部分地定位在壳体内。
在一些实施方案中,可定制设施包含多个模块单元,其排列为在使壳体的占地面积最小化的情况下使壳体内的模块单元数目最大化。
在园区1500的一些实施方案中,可定制设施1510中的至少一者的外壁由该可定制设施1510的壳体形成,并且相应的壳体完全密封该可定制设施1510的一个或多个中央单元和至少一个模块单元。在园区1500的一些实施方案中,可定制设施1510中的至少一者的外壁由该可定制设施1510的壳体与该可定制设施1510的一个或多个中央单元的外壁和该可定制设施1510的一个或多个模块单元的外壁中的至少一者形成。在一些实施方案中,壳体包含至少一个侧壁,至少一个侧壁环绕一个或多个中央单元和一个或多个模块单元。顶盖固定到至少一个侧壁的上边缘,顶盖在一个或多个中央单元和一个或多个模块单元之上延伸。
在园区上的可定制设施中建造出制造翼是快速且成本有效的。园区提供较快的生产线开发时间线。因为至少一个制造翼是预建造且可使用的,所以制造者可以在一些实施方案中,将上市前时间减少12个月,并且在一些实施方案中减少16个月。在一些实施方案中,园区允许用户将上市前时间从四年半缩短到两年。在一些实施方案中,园区允许用户缩短上市前时间,例如从三年到两年。药物制造者可以根据需要容易地放大或缩减它们的制造线。
园区为制造者降低财务和运营风险。园区允许制造者更容易地应对随时间的对药物的需求的不确定性。本公开的园区允许制造者随着他们的需求演化而迅速响应。
通过提供可以由可定制设施1510中的每一者共同地使用的建筑物(诸如效用建筑物1540、仓库1560,以及培养基/缓冲剂车间1520),园区在一个地点提供效用并支持技术。园区包含具有顶尖技术(state-of-the-art)的专用设施。例如,每个制造者可以受益于顶尖培养基/缓冲剂车间、效用建筑物,以及园区上的其他设施。
在一些实施方案中,园区1500上可以包含多于或少于五个可定制设施1510。在一些方面中,园区可以随时间迭代地构建,使得构建第一可定制设施,并且然后,一旦在第一设施中达到容量,则将第二可定制设施上线,等等。
根据本公开的方面,提供了组装用于制造至少一种药物产品的园区的方法。提供了配置为制造至少一种药物产品的可定制设施。可定制设施如以上关于图1-13所描述的可定制设施的实施方案所配置。提供培养基/缓冲剂车间,并且可用于生产培养基/缓冲剂,生产培养基/缓冲剂可以递送到园区上的制造模块。在一些方面中,培养基/缓冲剂车间可操作地耦接到至少一个可定制设施和/或配置为对至少一个可定制设施提供或供给处理材料,诸如但不限于培养基或缓冲剂。在一些方面中,培养基/缓冲剂车间可以配置为以诸如袋的可运输容器提供处理材料,并且经由卡车、轨道,或园区上的其他地面运输系统将处理材料运输到可定制设施。在一些方面中,园区可以包含供给线,且相应的供给线将培养基/缓冲剂车间连接到每个相应的可定制设施,以对每个可定制设施供给用于制造(多种)药物产品的培养基。
效用线的第一端连接到效用建筑物,并且效用线的第二端连接到培养基/缓冲剂车间,以经由效用线将至少一种第一效用提供到培养基/缓冲剂车间。例如,第一效用可以为蒸汽供给和/或空气供给。仓库定位在可定制设施附近,并且可用于将材料提供到可定制设施。培养基/缓冲剂车间定位在可定制设施附近,并且效用建筑物定位在可定制设施附近。
当可定制设施之一中的第一制造翼1600a正被完全用于制造操作时,方法包含在相应的可定制设施中建造出第二制造翼1600b。
图14显示了根据图12的示意图所构建的五个可定制设施1510,培养基/缓冲剂车间1520,效用建筑物1540的透视图。
图15显示了可定制设施1710,其具有第一制造翼1800a和第二制造翼1800b。第一制造翼1800a包含第一制造模块1810a和第二制造模块1810b。第二制造翼1800b包含第三制造模块1810c。每个制造模块1810a、1810b、1810c是其相应的制造翼1800a、1800b内的模块单元。每个制造模块1810a、1810b、1810c可以由不同的制造者所运行、所有,或租赁。在制造模块1810a、1810b、1810c之一被租赁的实施方案中,模块可以被从相应的制造模块1810a、1810b、1810c的所有者租赁。在一些实施方案中,制造模块的所有者可以是园区的所有者或可定制设施1710的所有者。
每个制造者可以使用不同的长袍区域。在某实施方案中,第一制造者具有其对第一制造模块1810a的自身专用访问和对第一长袍区域1820a的专用访问。仅与第一制造者相关联的工作人员可以进入第一长袍区域1820a。仅与第一制造者相关联的工作人员可以进入第一制造模块1810a,其是经由从第一长袍区域1820a到第一制造模块1810a的第一专用访问路线1880a可访问的。
对此实施方案,第二制造者具有其对第二制造模块1810b的自身的专用访问和对第二长袍区域1820b的专用访问。仅与第二制造者相关联的工作人员可以进入第二长袍区域1820b。仅与第二制造者相关联的工作人员可以进入第二制造模块1810b,其是经由从第二长袍区域1820b到第二制造模块1810b的第二专用访问路线1880b可访问的。
继续此实施方案,第三制造者具有其对第三制造模块1810c的自身的专用访问和对第三长袍区域1820c的专用访问。仅与第三制造者相关联的工作人员可以进入第三长袍区域1820c。仅与第三制造者相关联的工作人员可以进入第三制造模块1810c,其是从第三长袍区域1820c到第三制造模块1810c的经由第三专用访问路线1880c可访问的。
可定制设施1710包含效用模块1890,其向可定制设施1710中的其他模块(诸如第一制造模块1810a、第二制造模块1810b,以及第三制造模块1810c)提供效用。
图15的可定制设施可以包含在本公开的园区上,诸如图12的园区1500。
因为可定制设施1710包含各自具有相应的专用访问路线1880a、1880b、1880c的制造模块1810a、1810b、1810c,所以制造模块1810a、1810b、1810c被彼此隔离。这避免了相应的制造者的员工的交叉污染。三个制造模块1810a、1810b、1810c的隔离还防止了由相应的制造者所制造的产品的交叉污染。例如,这防止了来自可定制设施1710内的制造模块之一的病原体传播到可定制设施1710内的制造模块中的另一个。
效用模块1890向三个制造模块1810a、1810b、1810c提供共用的效用。相似地,当可定制设施1710整合到园区(诸如图12或图14中所示的园区)中时,效用建筑物1540能够连接到三个制造模块1810a、1810b、1810c,以将效用递送到三个制造模块1810a、1810b、1810c。
以此方式,可定制设施1710提供共用的效用,同时为制造模块内的制造者提供安全的、隔离的制造环境。
根据本公开的方面,提供了管理药物设施的方法。方法包含提供用于制作一个或多种药物产品的园区。在一些实施方案中,园区可以是本文中所描述的园区,诸如图12的园区1500。例如,在一些实施方案中,园区包含配置为制造一个或多种药物产品的至少一个可定制设施。在一些实施方案中,园区还包含培养基/缓冲剂车间。在一些实施方案中,园区还包含培养基/缓冲剂车间中的装袋单元,在此处将培养基/缓冲剂装袋,使得其可以由地面运输移动到可定制设施。在一些方面中,培养基/缓冲剂车间可操作地耦接到至少一个可定制设施和/或配置为对至少一个可定制设施提供或供给处理材料,诸如但不限于培养基或缓冲剂。在一些方面中,培养基/缓冲剂车间可以配置为以诸如袋的可运输容器提供处理材料,并且经由卡车、轨道,或园区上的其他地面运输系统将处理材料运输到可定制设施。在一些方面中,园区可以包含供给线,且相应的供给线将培养基/缓冲剂车间连接到每个相应的可定制设施,以对每个可定制设施供给用于制造(多种)药物产品的培养基。
在一些实施方案中,园区还包含效用建筑物,所述效用建筑物由效用线连接到培养基/缓冲剂车间,以经由效用线向培养基/缓冲剂车间提供至少一种第一效用。管理药物设施的方法还包含向期望制造药物产品的客户提供园区的至少一部分(例如,通过销售、租赁或另一合同)。
在一些实施方案中,园区中向客户提供的一部分包含园区上的可定制设施之一中的制造翼。
在一些实施方案中,园区中向客户提供的一部分包含园区上的可定制设施之一的制造翼之一内的制造模块。
管理药物设施的此方法可以由园区的所有者执行。在一些实施方案中,园区的所有者为客户提供购买园区的一部分的第一选项和从所有者租赁园区的一部分的第二选项。在一些实施方案中,园区的所有者仅为客户提供购买园区的一部分的选项。例如,园区的所有者可以为客户提供购买园区上的可定制设施的一部分的选项。特别地,园区的所有者可以为客户提供购买可定制设施内的制造模块的选项。在一些实施方案中,园区的所有者仅为客户提供租赁园区的一部分的选项。例如,园区的所有者可以为客户提供租赁可定制设施的一部分的选项。特别地,园区的所有者可以为客户提供租赁可定制设施内的制造模块的选项。
在一些实施方案中,园区的所有者可以为客户提供另一选项,诸如客户租借园区的一部分第一时段,并且然后客户可以在第一时段结束时选择是否购买园区的该部分的选项。附加的所有权和租借选项也在本公开的范围内。在一些实施方案中,园区的所有者提出将其自身的员工指派去代表客户在园区的提供部分内制造药物产品。
根据本公开的方面,提供了调整药物设施的容量的方法。调整容量的方法包含提供用于制作至少一种药物产品的园区。在一些实施方案中,园区可以是本文中所描述的园区,诸如图12的园区1500。例如,在一些实施方案中,园区包含配置为制造一个或多种药物产品的至少一个可定制设施。在一些实施方案中,园区还包含培养基/缓冲剂车间。在一些实施方案中,园区还包含培养基/缓冲剂车间中的装袋单元,在该处将培养基/缓冲剂装袋,使得其可以由地面运输被移动到可定制设施。在一些方面中,培养基/缓冲剂车间可操作地耦接到至少一个可定制设施和/或配置为至少一个可定制设施提供或供给处理材料,诸如但不限于培养基或缓冲剂。在一些方面中,培养基/缓冲剂车间可以配置为以诸如袋的可运输容器提供处理材料,并且经由卡车、轨道,或园区上的其他地面运输系统将处理材料运输到可定制设施。在一些方面中,园区可以包含供给线,且相应的供给线将培养基/缓冲剂车间连接到每个相应的可定制设施,以为每个可定制设施供给用于制造(多种)药物产品的培养基。
在一些实施方案中,园区还包含效用建筑物,效用建筑物由效用线连接到培养基/缓冲剂车间,以经由效用线向培养基/缓冲剂车间提供至少一种第一效用。管理药物设施的方法还包含向期望制造药物产品的客户提供园区的至少一部分。
方法还包含向期望制造第一药物产品的第一客户提供园区的至少第一部分。方法还包含构建园区的至少第二部分,用于制造第二药物产品。第二部分是技术不可知论的。例如,园区的所有者可以向期望制造第一药物产品的第一客户提供第一制造模块。园区的所有者构建第二制造模块(或以其他方式确保第二制造模块由第二客户可使用)。该第二制造模块是技术不可知论的。
在一些实施方案中,第二制造模块可以随后由制造者用来制造第二产品,其可以与第一产品不同或与第一产品相同。
在一些实施方案中,园区的所有者然后向第二客户提供园区的至少第二部分。园区的所有者构建第三制造模块(或以其他方式确保第三制造模块由第三客户可使用)。该第三制造模块是技术不可知论的。
通过建造出园区的超出制造空间所需的附加部分,用户确保可定制设施不具有制造翼的100%利用率,直到园区上的全部的制造翼用于制造药物产品。
在一些实施方案中,园区的所有者为第一客户提供园区的第一部分,其仅经由第一专用访问路线可访问,第一专用访问路线是由第一客户可访问的,但第二客户不能访问。园区的所有者为第二客户提供园区的第二部分,其仅经由第二专用访问路线可访问,第二专用访问路线是由第二客户可访问的,但第一客户不能访问。第一部分和第二部分不需限于制造模块。
在一些实施方案中,园区的所有者以对于新客户开始制造药物就绪的状态持续地维护园区的技术不可知论部分。这允许园区的所有者迅速地响应对药物的需求上的改变。对于新客户开始制造药物处于就绪状态的园区的技术不可知论部分可以由新的客户或现有的客户迅速地租用、租赁、销售,或以其他方式使用,以满足对于药物的市场需求。
管理药物设施和调整药物设施的容量的方法可以由园区的所有者或另一方执行,诸如园区的操作者或代表园区的所有者行为的一方。
发酵单元的实例
发酵单元116b容纳适于细胞培养和/或发酵的设备。例如,用于细胞培养和发酵的设备包含但不限于生物反应器(例如,适合于培养细胞或发酵)、罐(例如,适合于容纳细胞,培养基或由细胞产生的产物)、倾析装置、离心机、泵和其它可用于产品回收的设备。将包含再折叠罐(refoldtank)和微过滤单元用于微生物发酵过程。
在一个实施方案中,发酵单元116b含有一个或多个适合于培养细胞的生物反应器单元。生物反应器单元可以进行以下一种或多种或全部:营养物和/或碳源的进料、合适气体(例如氧气)的注射、发酵或细胞培养基的流动、气相和液相的分离、生长温度的维持、ph水平的维持、搅拌(例如,搅动)和/或清洁/灭菌。发酵单元可以含有1、2、3、4、5、10、15、20、25、30、35、40、45、50、60、70、80、90、或100个或更多个生物反应器。在各种实施方案中,生物反应器适合于分批、半补料-分批、补料-分批、灌注和/或连续发酵过程。在一个实施方案中,生物反应器是搅拌釜反应器。在一个实施方案中,生物反应器是气升式反应器。在一个实施方案中,生物反应器可以具有约100毫升至约50,000升的体积。非限制性实例包含100毫升、250毫升、500毫升、750毫升、1升、2升、3升、4升、5升、6升、7升、8升、9升、10升、15升、20升、25升、30升、40升、50升、60升、70升、80升、90升、100升、150升、200升、250升、300升、350升、400升、450升、500升、550升、600升、650升、700升、750升、800升、850升、900升、950升、1000升、1500升、2000升、2500升、3000升、3500升、4000升、4500升、5000升、6000升、7000升、8000升、9000升、10,000升、15,000升、20,000升、或50,000升的体积。
在一个实施方案中,生物反应器适合于培养悬浮细胞或贴壁依赖性(贴壁)细胞。在一个实施方案中,发酵套件适合于细胞疗法和/或病毒疗法操作。在一个实施方案中,生物反应器适合于培养原核细胞或真核细胞。细胞的实例包含但不限于细菌细胞(例如大肠杆菌(e.coli),巴斯德毕赤酵母(p.pastoris))、酵母细胞(例如酿酒酵母(s.cerevisae),里氏木霉(t.reesei))、植物细胞、昆虫细胞(例如,sf9)、中国仓鼠卵巢细胞(cho,以及任何遗传修饰或衍生的cho细胞系)、小鼠细胞(例如,小鼠胚胎成纤维细胞,源自小鼠癌症模型的细胞)、人细胞(例如,来自任何组织或器官的细胞、来自癌症或其他患病细胞系的细胞、干细胞),杂交瘤细胞或其他遗传修饰或杂合细胞。在一个实施方案中,细胞表达或产生产物,如重组治疗或诊断产物。由细胞产生的产物的实例包含但不限于抗体分子(例如,单克隆抗体,双特异性抗体)、融合蛋白(例如,fc融合蛋白,嵌合细胞因子)、其他重组蛋白(例如,糖基化蛋白、酶、激素)、或脂质包囊的颗粒(例如,外来体,病毒样颗粒)。在实施方案中,发酵单元还包含用于从细胞中分开、纯化和分离此类产物的设备。在一个实施方案中,设施和/或生物反应器可以用于生产生物仿制药产品。
在实施方案中,发酵单元符合良好制造过程和生物安全标准。在一个实施方案中,发酵单元符合生物安全水平1(bsl1)、生物安全水平2(bsl2)、生物安全水平3(bsl3)、或生物安全水平4(bsl4)。
发酵单元可以包含子区室,其中每个子区室可以用于进行支持细胞培养、发酵和生产过程的不同功能或方面。举例来说,发酵单元包含容纳一个或多个生物反应器的子区室、容纳产品回收设备的子区室、用于接种的子区室、以及用于清洁和净化设备以及处理此类设备的操作员的子区室。
下游处理单元的实例
上面讨论的纯化单元116a是下游处理单元的实例。
作为一个实例,标准下游处理(dsp)单元包含病毒前分离和病毒后分离子单元。尽管贯穿典型的哺乳动物细胞衍生的蛋白质纯化确实发生病毒减少,但认为关键的病毒减少步骤是与应当认为基本上无病毒的病毒后分离子单元空间分离的适当点。病毒后分离子单元容纳适合于以下任何一种的设备和效用:超滤(切向过滤)、正常过滤、层析、配制、滴定、混合、浓缩、缓冲液交换、原料药物质容器填充和冷冻。
已经出于示例的目的呈现了本公开的各种实施方案和/或实例的描述,但是并不旨在穷举或限于所公开的实施方案。在不脱离所描述的实施方案的范围和精神的情况下,许多修改和变化对于本领域普通技术人员来说是显而易见的。选择本文使用的术语以最好地解释实施方案的原理、实际应用或对市场中发现的技术的技术改进,或者使本领域普通技术人员能够理解本文公开的实施方案。
本公开的各种实施方案的描述可以用于生产药物和生物制药产品。本文描述的装置、设施和方法适合于培养任何期望的细胞系,包含原核和/或真核细胞系。此外,在实施方案中,装置、设施和方法适合于培养悬浮细胞或贴壁依赖性(贴壁)细胞,并且适合于配置用于生产药物和生物制药产品,如多肽产品、核酸产品(例如dna或rna)、或细胞和/或病毒,如用于细胞和/或病毒治疗的细胞和/或病毒的生产操作。
在实施方案中,细胞表达或产生产物,如重组治疗或诊断产物。如下文更详细描述的,由细胞产生的产物的实例包含但不限于抗体分子(例如,单克隆抗体,双特异性抗体)、抗体模拟物(与抗原特异性结合但与抗体在结构上不相关的多肽分子,例如darpins、亲和体(affibodies)、adnectin或ignars)、融合蛋白(例如,fc融合蛋白,嵌合细胞因子)、其他重组蛋白(例如,糖基化蛋白、酶、激素)、病毒治疗剂(例如,抗癌溶瘤性病毒、用于基因疗法的病毒载体和病毒免疫疗法)、细胞疗法(例如多能干细胞、间充质干细胞和成体干细胞)、疫苗或脂质包囊的颗粒(例如,外来体,病毒样颗粒)、rna(如例如sirna)或dna(如例如质粒dna)、抗生素或氨基酸。在实施方案中,装置、设施和方法可以用于生产生物仿制药。
如提及,在实施方案中,装置、设施和方法允许产生真核细胞,例如哺乳动物细胞或低等真核细胞,例如酵母细胞或丝状真菌细胞,或原核细胞,例如革兰氏阳性细胞或革兰氏阴性细胞和/或真核细胞或原核细胞产物,例如蛋白质、肽、抗生素、氨基酸、核酸(例如dna或rna),其由真核细胞以大规模方式合成。除非本文另有说明,否则装置、设施和方法可以包含任何期望的体积或生产容量,包含但不限于实验室规模、中试规模(pilot-scale)和完全生产规模能力。
此外,除非本文另有说明,否则装置、设施和方法可以包含任何合适的反应器,包含但不限于搅拌罐、空气升液器(airlift)、纤维、微纤维、中空纤维、陶瓷基质、流化床、固定床和/或喷动床生物反应器。如本文所用,“反应器”可以包含发酵罐或发酵单元,或任何其他反应容器,并且术语“反应器”可与“发酵罐”互换使用。例如,在一些方面,示例性生物反应器单元可以进行以下中的一个或多个或者全部:营养物和/或碳源的进料、合适气体(例如氧气)的注射、发酵或细胞培养基的入口和出口流动、气相和液相的分离、温度的维持、氧气和co2水平的维持、ph水平的维持、搅拌(例如搅动)和/或清洁/消毒。示例性反应器单元如发酵单元可以在单元内包含多个反应器,例如单元可以在每个单元中具有1、2、3、4、5、10、15、20、25、30、35、40、45、50、60、70、80、90或100或更多个生物反应器和/或设施可以含有设施内具有单个或多个反应器的多个单元。在各个实施方案中,生物反应器可以适合于分批、半补料-分批、补料-分批、灌注和/或连续发酵过程。可以使用任何合适的反应器直径。在实施方案中,生物反应器可以具有约100ml至约50,000l的体积。非限制性实例包含100毫升、250毫升、500毫升、750毫升、1升、2升、3升、4升、5升、6升、7升、8升、9升、10升、15升、20升、25升、30升、40升、50升、60升、70升、80升、90升、100升、150升、200升、250升、300升、350升、400升、450升、500升、550升、600升、650升、700升、750升、800升、850升、900升、950升、1000升、1500升、2000升、2500升、3000升、3500升、4000升、4500升、5000升、6000升、7000升、8000升、9000升、10,000升、15,000升、20,000升、和/或50,000升的体积。另外,合适的反应器可以是多次使用、单次使用、一次性或非一次性,并且可以由任何合适的材料形成,所述材料包含金属合金,例如不锈钢(例如316l或任何其它合适的不锈钢)和inconel、塑料和/或玻璃。
在实施方案中并且除非本文另有说明,否则本文所述的装置、设施和方法还可以包含未另外提及的任何合适的单元操作和/或设备,如用于分离、纯化和分离此类产品的操作和/或设备。可以使用任何合适的设施和环境,如传统的棒式建筑设施、模块、移动和临时设施、或任何其他合适的结构、设施和/或布局。例如,在一些实施方案中,可以使用模块清洁室。另外并且除非另有说明,否则本文描述的装置、系统和方法可以在单个位置或设施中容纳和/或进行,或者备选地在分开的位置和/或设施或多个位置和/或设施处容纳和/或进行。
作为非限制性实例而非限制性地,美国公开号2013/0280797;2012/0077429;2009/0305626;和美国专利no.8,298,054;7,629,167;和5,656,491(其通过引用在此完整并入)描述了可能适合的示例性设施、设备和/或系统。
在实施方案中,细胞是真核细胞,例如哺乳动物细胞。哺乳动物细胞可以是例如人或啮齿类或牛细胞系或细胞株。此类细胞、细胞系或细胞株的实例是例如小鼠骨髓瘤(nso)细胞系、中国仓鼠卵巢(cho)细胞系、ht1080、h9、hepg2、mcf7、mdbkjurkat、nih3t3、pc12、bhk(幼仓鼠肾细胞)、vero、sp2/0、yb2/0、y0、c127、l细胞、cos(例如cos1和cos7)、qc1-3、hek-293、vero、per.c6、hela、ebl、eb2、eb3、溶瘤或杂交瘤细胞系。优选地,哺乳动物细胞是cho细胞系。在一个实施方案中,细胞是cho细胞。在一个实施方案中,细胞是cho-k1细胞、cho-k1sv细胞、dg44cho细胞、duxb11cho细胞、chos、chogs敲除细胞、chofut8gs敲除细胞、chozn、或cho衍生的细胞。chogs敲除细胞(例如gsko细胞)是例如cho-k1svgs敲除细胞。chofut8敲除细胞是例如
在一个实施方案中,真核细胞是干细胞。干细胞可以是例如多能干细胞,包含胚胎干细胞(esc)、成体干细胞、诱导多能干细胞(ipsc)、组织特异性干细胞(例如,造血干细胞)和间充质干细胞(msc)。
在一个实施方案中,细胞是本文描述的任何细胞的分化形式。在一个实施方案中,细胞是源自培养中的任何原代细胞的细胞。
在实施方案中,细胞是肝细胞,如人肝细胞、动物肝细胞或非实质细胞。例如,细胞可以是可铺板的代谢合格的人肝细胞(plateablemetabolismqualifiedhumanhepatocyte)、可铺板的诱导合格的人肝细胞(plateableinductionqualifiedhumanhepatocyte)、可铺板的qualysttransportercertifiedtm人肝细胞、悬浮合格的人肝细胞(包含10个供体和20个供体合并的肝细胞)、人肝库弗细胞、人肝星状细胞、狗肝细胞(包含单一和合并的beagle肝细胞)、小鼠肝细胞(包含cd-1和c57bi/6肝细胞)、大鼠肝细胞(包含sprague-dawley、wistarhan和wistar肝细胞)、猴肝细胞(包含食蟹猴(cynomolgus)或恒河猴(rhesus)肝细胞)、猫肝细胞(包含domesticshorthair肝细胞)和兔肝细胞(包含newzealandwhite肝细胞)。示例性肝细胞可购自triangleresearchlabs,llc,6davisdriveresearchtrianglepark,northcarolina,usa27709。
在一个实施方案中,真核细胞是低等真核细胞,诸如例如酵母细胞(例如毕赤酵母(pichia)属(例如巴斯德毕赤酵母(pichiapastoris)、甲醇毕赤酵母(pichiamethanolica)、克鲁维毕赤酵母(pichiakluyveri)和安格斯毕赤酵母(pichiaangusta))、komagataella属(例如komagataellapastoris、komagataellapseudopastoris或komagataellaphaffii)、酵母属(例如酿酒酵母(saccharomycescerevisae)、酿酒酵母(cerevisiae)、克鲁维酵母(saccharomyceskluyveri)、葡萄汁酵母(saccharomycesuvarum))、克鲁维酵母属(kluyveromyces)(例如乳酸克鲁维酵母(kluyveromyceslactis)、马克斯克鲁维酵母(kluyveromycesmarxianus))、假丝酵母属(candida)(例如实用假丝酵母(candidautilis)、candidacacaoi、博伊丁假丝酵母(candidaboidinii))、地丝菌属(geotrichum)(例如发酵地丝菌(geotrichumfermentans))、多形汉逊酵母(hansenulapolymorpha)、解脂耶氏酵母(yarrowialipolytica)或裂殖酵母(schizosaccharomycespombe)。优选巴斯德毕赤酵母。巴斯德毕赤酵母菌株的实例是x33、gs115、km71、km71h;和cbs7435。
在一个实施方案中,真核细胞是真菌细胞(例如曲霉属(aspergillus)(例如黑曲霉(a.niger)、烟曲霉(a.fumigates)、米曲霉(a.orzyae)、构巢曲霉(a.nidula))、支顶孢属(acremonium)(例如嗜热支顶孢(a.thermophilum))、黑毛菌属(chaetomium)(例如嗜热黑毛菌(c.thermophilum))、金小孢子属(chrysosporium)(如嗜热金小孢子(c.thermophile))、冬虫夏草(cordyceps)(如北冬虫夏草(c.militaris))、棒囊壳属(corynascus)、栉霉属(ctenomyces)、镰刀菌属(fusarium)(如尖孢镰刀菌(f.oxysporum))、小丛壳属(glomerella)(如禾生小丛壳(g.graminicola))、肉座菌属(hypocrea)(如红褐肉座菌(h.jecorina))、稻瘟病菌(magnaporthe)(如稻瘟病菌(m.orzyae))、毁丝霉属(myceliophthora)(如嗜热毁丝霉(m.thermophile))、丛赤壳属(nectria)(如赤球丛赤壳(n.heamatococca))、链孢霉属(neurospora)(如粗糙链孢霉(n.crassa))、青霉属(penicillium)、侧孢霉属(sporotrichum)(如嗜热侧孢霉(s.thermophile))、梭孢壳属(thielavia)(如陆地梭孢壳(t.terrestris),t.heterothallica)、木霉属(trichoderma)(如里氏木霉)或轮枝孢属(verticillium)(如大丽轮枝孢(v.dahlia))。
在一个实施方案中,真核细胞是昆虫细胞(例如,sf9、mimictmsf9、sf21、highfivetm(bt1-tn-5b1-4)或bt1-ea88细胞)、藻类细胞(例如,双眉藻属(amphora)、硅藻纲(bacillariophyceae)、杜氏藻属(dunaliella)、小球藻属(chlorella)、衣藻属(chlamydomonas)、蓝藻门(cyanophyta)(蓝细菌)、微拟球藻属(nannochloropsis),螺旋藻属(spirulina)或棕鞭藻属(ochromonas)的细胞)、或植物细胞(如来自单子叶植物细胞(如玉米、稻、小麦或狗尾草(setaria)),或来自双子叶植物(例如,木薯、马铃薯、大豆、番茄、烟草、苜蓿、小立碗藓(physcomitrellapatens)或拟南芥(arabidopsis)的细胞)。
在一个实施方案中,细胞是细菌或原核细胞。
在实施方案中,原核细胞是革兰氏阳性细胞,例如芽孢杆菌(bacillus)、链霉菌(streptomyces)、链球菌(streptococcus)、葡萄球菌(staphylococcus)或乳杆菌(lactobacillus)。可以使用的芽孢杆菌是例如枯草芽孢杆菌(b.subtilis)、解淀粉芽胞杆菌(b.amyloliquefaciens)、地衣芽孢杆菌(b.licheniformis)、纳豆芽孢杆菌(b.natto)或巨大芽孢杆菌(b.megaterium)。在实施方案中,细胞是枯草芽孢杆菌,如枯草芽孢杆菌3na和枯草芽孢杆菌168。芽孢杆菌可从例如芽孢杆菌遗传保藏中心(bacillusgeneticstockcenter),biologicalsciences556,484west12thavenue,columbusoh43210-1214获得。
在一个实施方案中,原核细胞是革兰氏阴性细胞,例如沙门氏菌属种或大肠杆菌,例如tg1、tg2、w3110、dh1、dhb4、dh5a、hms174、hms174(de3)、nm533、c600、hb101、jm109、mc4100、xl1-blue和origami,以及源自大肠杆菌b-菌株的,诸如例如bl-21或bl21(de3),所有这些都是商品化的。
合适的宿主细胞可购自例如培养物保藏中心,例如dsmz(德国微生物菌种保藏中心(deutschesammlungvonmikroorganismenandzellkulturengmbh),braunschweig,germany)或美国典型培养物保藏中心(atcc)。
在实施方案中,培养的细胞用于产生用于治疗用途的蛋白质,例如抗体,例如单克隆抗体和/或重组蛋白质。在实施方案中,培养的细胞产生肽、氨基酸、脂肪酸或其他有用的生物化学中间体或代谢物。例如,在实施方案中,可以制备具有分子量约4000道尔顿至大于约140,000道尔顿的分子。在实施方案中,这些分子可以具有一系列复杂性并且可以包含翻译后修饰,包含糖基化。
在实施方案中,蛋白质是例如botox、myobloc、neurobloc、dysport(或其他肉毒杆菌神经毒素血清型)、阿葡糖苷酶α、达托霉素(daptomycin)、yh-16、绒毛膜促性腺激素α、非格司亭(filgrastim)、西曲瑞克(cetrorelix)、白细胞介素-2、阿地白介素(aldesleukin)、替西白介素(teceleulin)、地尼白介素2(denileukindiftitox)、干扰素α-n3(注射)、干扰素α-nl、dl-8234、干扰素、suntory(γ-1a)、干扰素γ、胸腺素α1、他索那敏(tasonermin)、digifab、viperatab、echitab、crofab、奈西立肽(nesiritide)、阿巴他塞(abatacept),阿来法塞(alefacept)、rebif、依托特明α(eptoterminalfa)、特立帕肽(teriparatide)(骨质疏松)、降钙素注射液(骨病)、降钙素(鼻,骨质疏松)、依那西普,血红蛋白glutamer250(牛)、替加色罗α(drotrecoginalpha)、胶原酶、卡培立肽(carperitide)、重组人表皮生长因子(局部凝胶,伤口愈合),dwp401,促红血球生成素α(darbepoetinalpha)、依泊汀(epoetin)omega、依泊汀β、依泊汀α、地西卢定(desirudin)、来匹卢定(lepirudin)、比伐卢定(bivalirudin)、诺那凝血素α(nonacogalpha)、mononine、依他凝血素α(eptacogalpha)(激活)、重组因子viii+vwf、recombinate、重组因子viii、因子viii(重组)、alphnmate、辛凝血素α(octocogalpha)、因子viii、帕利夫明(palifermin)、indikinase、替奈普酶(tenecteplase)、阿替普酶(alteplase)、帕米普酶(pamiteplase)、瑞替普酶(reteplase)、那替普酶(nateplase)、孟替普酶(monteplase)、促滤泡素α(follitropinalpha)、rfsh、hpfsh、米卡芬净(micafungin)、培非司亭(pegfilgrastim)、来格司亭(lenograstim)、那托司亭(nartograstim)、舍莫瑞林(sermorelin)、胰高血糖素、依泽那太(exenatide)、普兰林肽(pramlintide),iniglucerase、半乳糖加硫酶(galsulfase)、leucotropin、莫拉司亭(molgramostirn)、醋酸曲普瑞林(triptorelinacetate)、组氨瑞林(histrelin)(皮下植入物,hydron)、地洛瑞林(deslorelin)、组氨瑞林(histrelin)、那法瑞林(nafarelin)、亮丙瑞林(leuprolide)持续释放储库(atrigel)、亮丙瑞林植入物(duros)、戈舍瑞林(goserelin)、eutropin、kp-102程序、生长激素、美卡舍明(mecasermin)(生长不足(growthfailure))、enlfavirtide、org-33408、甘精胰岛素、谷赖胰岛素、胰岛素(吸入)、赖脯胰岛素(insulinlispro)、地特胰岛素(insulindeternir)、胰岛素(口腔,rapidmist)、美卡舍明林菲培(mecaserminrinfabate)、阿那白滞素(anakinra)、西莫白介素(celmoleukin)、99mtc-apcitide注射液、myelopid、重组干扰素β-1b(betaseron)、醋酸格拉默(glatirameracetate)、gepon、沙格司亭(sargramostim)、奥普瑞白介素(oprelvekin)、人白细胞衍生的α干扰素、bilive、胰岛素(重组)、重组人胰岛素、门冬胰岛素、mecasenin、罗扰素(roferon)-a、干扰素-α2、alfaferone、干扰素alfacon-1、干扰素α、avonex重组人黄体生成素、脱氧核糖核酸酶α(dornasealpha)、曲弗明(trafermin)、齐考诺肽(ziconotide)、他替瑞林(taltirelin)、地波特明α(diboterminalfa)、阿托西班(atosiban)、贝卡普勒明(becaplermin)、依替巴肽(eptifibatide)、zemaira、ctc-111、shanvac-b、hpv疫苗(四价)、奥曲肽(octreotide)、兰瑞肽(lanreotide)、ancestirn、agalsidaseβ、agalsidaseα、拉罗尼酶(laronidase)、醋肽铜(prezatidecopperacetate)(局部凝胶)、拉布立酶(rasburicase)、兰尼单抗(ranibizumab)、干扰素γ-1b(actimmune)、peg-intron、tricomin、重组房尘螨变态反应脱敏注射液、重组人甲状旁腺激素(pth)1-84(sc,骨质疏松)、依泊汀δ、转基因抗凝血酶iii、granditropin、透明质酸酶(vitrase)、重组胰岛素、干扰素-α(口服锭剂)、gem-21s、伐普肽(vapreotide)、艾杜硫酸酯酶(idursulfase)、奥马曲拉(omnapatrilat)、重组血清白蛋白、培戈赛妥珠单抗(certolizumabpegol)、谷卡匹酶(glucarpidase)、人重组c1酯酶抑制剂(血管性水肿)、拉诺替普酶(lanoteplase)、重组人生长激素、恩夫韦肽(enfuvirtide)(无针注射,biojector2000)、vgv-1、干扰素(α)、芦西纳坦(lucinactant)、阿肽地尔(aviptadil)(吸入,肺部疾病)、艾替班特(icatibant)、艾卡拉肽(ecallantide)、奥米加南(omiganan)、aurograb、醋酸培西加南(pexigananacetate)、adi-peg-20、ldi-200、地加瑞克(degarelix)、cintredelinbesudotox、favld、mdx-1379、isatx-247、利拉鲁肽(liraglutide)、特立帕肽(teriparatide)(骨质疏松)、替法可近(tifacogin)、aa4500、t4n5脂质体洗剂、卡妥索单抗(catumaxomab)、dwp413、art-123、chrysalin、去氨普酶(desmoteplase)、安地普酶(amediplase)、绒促卵泡素α(corifollitropinalpha)、th-9507、替度鲁肽(teduglutide)、diamyd、dwp-412、生长激素(持续释放注射)、重组g-csf、胰岛素(吸入,air)、胰岛素(吸入,technosphere)、胰岛素(吸入,aerx)、rgn-303、diapep277、干扰素β(丙型肝炎病毒感染(hcv))、干扰素α-n3(口服)、贝拉西普(belatacept)、透皮胰岛素贴剂、amg-531、mbp-8298、xerecept、奥培巴坎(opebacan)、aidsvax、gv-1001、lymphoscan、豹蛙酶(ranpirnase)、lipoxysan、卢舒普肽(lusupultide)、mp52(β-磷酸三钙载体,骨再生)、黑色素瘤疫苗、sipuleucel-t、ctp-37、insegia、vitespen、人凝血酶(冷冻,手术出血)、凝血酶、transmid、蛇毒纤溶酶(alfimeprase)、puricase、特利加压素(terlipressin)(静脉内,肝肾综合征)、eur-1008m、重组fgf-i(可注射,血管疾病)、bdm-e、rotigaptide、etc-216、p-113、mbi-594an、耐久霉素(duramycin)(吸入,囊性纤维化)、scv-07、opi-45、内皮抑素(endostatin)、血管他丁(angiostatin)、abt-510、bowmanbirk抑制剂浓缩物、xmp-629、99mtc-hynic-膜联蛋白v、kahalalidef、ctce-9908、替维瑞克(teverelix)(延长释放)、ozarelix、罗米地辛(romidepsin)、bay-504798,白细胞介素4、prx-321、pepscan、iboctadekin、rh乳铁蛋白(rhlactoferrin)、tru-015、il-21、atn-161、西仑吉肽(cilengitide)、albuferon、biphasix、irx-2、ω干扰素、pck-3145、cap-232、帕西瑞肽(pasireotide)、hun901-dmi、卵巢癌免疫治疗疫苗、sb-249553、oncovax-cl、oncovax-p、blp-25、cervax-16、多表位肽黑色素瘤疫苗(mart-1、gp100、酪氨酸酶)、奈米非肽(nemifitide)、raat(吸入)、raat(皮肤病学)、cgrp(吸入,哮喘)、培那西普(pegsunercept)、胸腺素β4、plitidepsin、gtp-200、雷莫拉宁(ramoplanin)、graspa、obi-1、ac-100、鲑鱼降钙素(口服,eligen)、降钙素(口服,骨质疏松)、艾沙瑞林(examorelin)、卡普瑞林(capromorelin)、cardeva,velafermin、131i-tm-601、kk-220、t-10、乌拉立肽(ularitide)、depelestat、培尼沙肽(hematide)、chrysalin(局部)、rnapc2、重组因子v111(peg化脂质体)、bfgf、peg化重组葡激酶变体、v-10153、sonolysisprolyse、neurovax、czen-002、胰岛细胞新生疗法、rglp-1、bim-51077、ly-548806、艾塞那肽(exenatide)(受控释放,medisorb)、ave-0010、ga-gcb、阿伏瑞林(avorelin)、acm-9604、醋酸利那洛肽(linaclotideacetate)、ceti-1、hemospan、val(注射用)、速效胰岛素(注射用,viadel)、鼻内胰岛素、胰岛素(吸入)、胰岛素(口服,eligen)、、重组甲硫氨酰人瘦蛋白、pitrakinra皮下注射,湿疹)、pitrakinra(吸入干粉,哮喘)、multikine、rg-1068、mm-093、nbi-6024、at-001、pi-0824、org-39141、cpn10(自身免疫疾病/炎症)、talactoferrin(局部)、rev-131(眼科)、rev-131(呼吸系统疾病)、口服重组人胰岛素(糖尿病)、rpi-78m、奥普瑞白介素(oprelvekin)(口服)、cyt-99007ctla4-ig、dty-001、valategrast、干扰素α-n3(局部)、irx-3、rdp-58、tauferon、胆盐刺激脂肪酶、梅里斯普酶(merispase)、碱性磷酸酶(alalinephosphatase)、ep-2104r、美拉诺坦(melanotan)-ii、布雷默浪丹(bremelanotide)、atl-104、重组人微纤溶酶(microplasmin)、ax-200、semax、acv-1、xen-2174、cjc-1008、强啡肽(dynorphin)a、si-6603、labghrh、aer-002、bgc-728、疟疾疫苗(病毒体,pevipro)、altu-135、细小病毒(parvovirus)b19疫苗、流感疫苗(重组神经氨酸酶)、疟疾/hbv疫苗、炭疽疫苗、vacc-5q、vacc-4x、hiv疫苗(口服)、hpv疫苗、tat类毒素、yspsl、chs-13340、pth(1-34)脂质体乳膏(novasome)、ostabolin-c、pth类似物(局部,银屑病),mbri-93.02、mtb72f疫苗(结核病)、mva-ag85a疫苗(结核病)、fara04、ba-210、重组瘟疫fiv疫苗、ag-702、oxsodrol、rbetv1、der-p1/der-p2/der-p7变应原靶向疫苗(尘螨变态反应)、pr1肽抗原(白血病)、突变体ras疫苗、hpv-16e7脂肽疫苗、迷路疫苗(labyrinthinvaccine)(腺癌)、cml疫苗、wt1-肽疫苗(癌症)、idd-5、cdx-110、pentrys、norelin、cytofab、p-9808、vt-111、icrocaptide、telbermin(皮肤病,糖尿病足溃疡)、芦平曲韦(rupintrivir)、reticulose、rgrf、ha、α-半乳糖苷酶a、ace-011、altu-140、cgx-1160、血管紧张素治疗性疫苗,d-4f、etc-642、app-018、rhmbl、scv-07(口服,结核病)、drf-7295、abt-828、erbb2特异性免疫毒素(抗癌)、dt3ssil-3、tst-10088、pro-1762、combotox、胆囊收缩素-b/胃泌素受体结合肽、111in-hegf、ae-37、trasnizumab-dm1、拮抗剂g、il-12(重组)、pm-02734、imp-321、rhigf-bp3、blx-883、cuv-1647(局部)、基于l-19的放射免疫治疗剂(癌症)、re-188-p-2045、amg-386、dc/1540/klh疫苗(癌症)、vx-001、ave-9633、ac-9301、ny-eso-1疫苗(肽)、na17.a2肽、黑素瘤疫苗(脉冲抗原治疗剂)、前列腺癌疫苗、cbp-501、重组人乳铁蛋白(干眼)、fx-06、ap-214、wap-8294a(可注射)、acp-hip、sun-11031、肽yy[3-36](肥胖,鼻内)、fgll、阿塞西普(atacicept)、br3-fc、bn-003、ba-058、人甲状旁腺激素1-34(鼻,骨质疏松)、f-18-ccr1、at-1100(乳糜泻/糖尿病)、jpd-003、pth(7-34)脂质体乳膏(novasome)、耐久霉素(眼科,干眼)、cab-2、ctce-0214、糖peg化(glycopegylated)促红细胞生成素、epo-fc、cnto-528、amg-114、jr-013、因子xiii、氨基康定(aminocandin)、pn-951、716155、sun-e7001、th-0318、bay-73-7977、替维瑞克(teverelix)(立即释放)、ep-51216、hgh(受控释放,biosphere)、ogp-i、西夫韦肽(sifuvirtide)、tv4710、alg-889、org-41259、rhcc10、f-991、胸腺喷丁(thymopentin)(肺病)、r(m)crp、肝选择性胰岛素、subalin、l19-il-2融合蛋白、弹力素(elafin)、nmk-150、altu-139、en-122004、rhtpo、血小板生成素受体激动剂(血小板减少病症)、al-108、al-208、神经生长因子作用拮抗剂(疼痛)、slv-317、cgx-1007、inno-105、口服特立帕肽(teriparatide)(eligen)、gem-os1、ac-162352、prx-302、lfn-p24融合疫苗(therapore)、ep-1043、肺炎链球菌(spneumoniae)儿科疫苗、疟疾疫苗、脑膜炎奈瑟球菌(neisseriameningitidis)b组疫苗、新生儿b组链球菌疫苗、炭疽疫苗、hcv疫苗(gpe1+gpe2+mf-59)、中耳炎疗法、hcv疫苗(核心抗原+iscomatrix)、hpth(1-34)(透皮,viaderm)、768974、syn-101、pgn-0052、aviscumnine、bim-23190、结核病疫苗、多表位酪氨酸酶肽、癌症疫苗、卡斯替母(enkastim)、apc-8024、gi-5005、acc-001、tts-cd3、血管靶向tnf(实体瘤)、去氨加压素(口腔受控释放)、奥那西普(onercept)和tp-9201。
在一些实施方案中,多肽是阿达木单抗(adalimumab)(humira)、英夫利昔单抗(infliximab)(remicadetm)、利妥昔单抗(rituximab)(rituxantm/mabtheratm)、依那西普(etanercept)(enbreltm)、贝伐单抗(avastintm)、曲妥珠单抗(herceptintm)、pegrilgrastim(neulastatm),或任何其他合适的多肽,包含生物仿制药和生物增强药(biobetter)。
其他合适的多肽是下面和us2016/0097074的表1中列出的那些:
表1
表1
表1
表1
表1
在实施方案中,多肽是激素、凝血/凝固因子、细胞因子/生长因子、抗体分子、融合蛋白、蛋白质疫苗或肽,如表2所示。
表2:示例性的产品
在实施方案中,蛋白质是多特异性蛋白质,例如表3中所示的双特异性抗体。
表3:双特异性形式
除非另外定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些方法和材料类似或等同的任何方法和材料可用于本公开的实践和/或测试,但本文描述了优选的材料和方法。在描述和要求保护本公开时,以下术语在提供定义的地方根据其如何定义而使用。
还应理解,本文使用的术语仅用于描述特定实施方案的目的,而不意图是限制性的。
本文中使用冠词“一种”和“一个”来指冠词的一个/种或超过一个/种(即,至少一个/种)语法对象。举例来说,“模块单元”可以表示一个/种模块单元或超过一个/种模块单元。
在没有进一步描述的情况下,认为本领域普通技术人员可以使用前面的描述和说明性实例来产生和利用本公开的可定制设施。
虽然已经参考具体方面公开了本发明,但是显而易见的是,在不脱离本发明的真实精神和范围的情况下,本领域技术人员可以设计出本发明的其他方面和变化。所附权利要求书旨在解释为包含所有这些方面和等同变化。
- 还没有人留言评论。精彩留言会获得点赞!