以高收率分离RNA的方法与流程
本发明涉及一种从样品中分离核酸例如rna的方法,并且特别地提供了通过使用无苯酚rna分离法,从各种样品、包括富蛋白质的样品中以高收率有效地分离小rna和大rna的手段。
对来自各种组织、体液和其他生物样品中的200个核苷酸或更少级别的小核酸的研究是一个极为受关注的领域并且未来有望继续保持。小核酸特别包括但不限于小rna,例如,尤其是微小rna(mirna)和小干扰rna分子,它们两个都可以对基因表达具有强大影响。此外,参与mrna和rrna加工的其他核小rna和核仁小rna(例如snrna和snorna)也受到关注。此外,诸如长度为500个核苷酸或更少的rna之类的核酸也经常作为降解产物包含在其他样品中,并且必须从中有效捕获。随着对各个小rna的兴趣日益增加,标准分离程序已经得到了修正,以促进小核酸的分离和改善小核酸的收率。这样的改进是必要的,因为用于分离总rna的标准方案通常对于分离小rna不理想,原因在于使用标准方法往往无法有效结合小rna。因此,使用标准程序分离的总rna通常不包含足量的小rna用于后续分析。这些低收率可归因于小rna在核酸分离过程期间未结合或丢失。因此,开发了可以有效分离总rna、包括期望的小rna或从样品中选择性分离小rna(没有较大rna)的方法。
设计用来分离小rna、例如特别是小单链rna如mirna的常用方法在结合期间需要≥45%或优选≥50%的相当高的醇浓度,以确保小rna与核酸结合固相的有效结合。结合效率随着醇浓度的增加而增加。但是,这些为了确保rna与固相有效结合所需的高醇浓度造成了干扰分离程序的问题。特别是当处理富蛋白质的样品例如血浆、血清或组织样品时,rna结合步骤期间所需的高醇浓度会导致蛋白质沉淀到固相上。这些沉淀物是干扰分离程序的污染物,因为它们例如非特异性地与固相结合并由此阻塞固相和/或作为污染物被带入洗脱物中。
因此,从富蛋白质的样品中分离小rna的既定方法包括在建立允许结合小rna的结合条件之前的蛋白质去除步骤。蛋白质去除技术包括例如苯酚/氯仿提取或蛋白质沉淀步骤。其他方法采用耗时的酶促蛋白质消化步骤,例如用蛋白酶k消化。或者,大幅稀释样品或降低结合期间的醇浓度,这具有降低分离效率的缺点。与这些已知方法相关的问题随后将进一步详细描述。
基于苯酚/氯仿的有机提取方法经常根据chomczynski法进行(chomczynski和sacchi,1987:通过酸性硫氰酸胍-苯酚-氯仿提取的一步rna分离法(single-stepmethodofrnaisolationbyacidguanidiniumthiocyanate-phenol-chloroformextraction).anal.biochem.(162):156-159)。根据所述方法,在苯酚/氯仿提取期间将rna浓缩在水相中,然后从中分离,例如,通过向水相添加醇并使rna与核酸结合固相结合。在所述rna结合步骤中,同样需要特殊条件例如高醇浓度以有效结合并由此在分离的总rna中捕获小rna。基于相应的苯酚/氯仿方法的商业试剂盒是mirvanamirna分离试剂盒(ambion)。在苯酚/氯仿提取后,该方案遵循分级策略,其中较大的rna(超过200个核苷酸)在第一结合步骤中在中等酒精浓度(通常为25%)下与核酸结合固相结合。流过物包含小rna。通过第二结合步骤从所述流过物中捕获所述小rna,其中醇浓度提高到大于50%(通常为55%)并使所述小rna与第二固相结合,所述小rna可以从所述第二固相洗脱。此外,mirvanamirna分离试剂盒提供了一种方案,其中从苯酚/氯仿提取后获得的水相中分离包含小rna的总rna。在此,结合条件是通过将醇浓度增加到允许一步有效结合小rna的所需量(通常为55%)来建立的。类似的方法也在wo2005/012523和wo2005/054466中描述。但是,在这些方案中,也通常预先进行有机苯酚/氯仿提取步骤。另一种基于苯酚/氯仿的商业产品是mirneasymini试剂盒(qiagen)。它从各种不同生物样品提供高质量和高收率的总rna,包括小rna。
一般而言,基于苯酚的分离程序对样品组成或蛋白质含量相对不敏感。然而,通常将样品与3至10体积的含苯酚溶液合并。这导致需要处理的样品体积相对较高。因此,初始样品体积经常相当小,处于100μl至200μl范围内,很少高达500μl。这是一个缺点,特别是如果靶小rna在初始样品中以低浓度存在时。另一个缺点是苯酚可能被带入洗脱物中。此外,通过有机相提取步骤实现蛋白质的去除,其中每个样品都需要手动处理。除了这些技术上的困难和局限性外,尤其是苯酚的强毒性被认为是缺点。因此,迫切需要无苯酚的rna分离方法,其允许从各种样品中以高收率和高质量分离包括小rna的总rna。
用于分离包括小rna的rna的无苯酚方法在现有技术中也是已知的。为了使包括小rna的总rna与核酸结合固相结合,经常使用高浓度的离液盐和醇。通常,所使用的核酸结合固相包含二氧化硅或由二氧化硅组成。然而,在基于在醇和离液物质存在下使rna与二氧化硅表面结合的方法中回收小rna物种如mirna,需要很高的醇浓度。通常,在结合混合物中使用大约至少50%的醇,通常的范围包括在结合混合物中50-80%(v/v)的醇。但是,当使用在结合期间使用高醇浓度的相应无苯酚方案时,在处理富蛋白质的样品时总rna收率以及获得的小rna收率经常降低,这可能是当向被破坏的样品添加高浓度的醇时引起蛋白质沉淀的结果。因此,一些方法限制了初始样品体积或降低了rna结合期间使用的醇浓度(请参见上文)。这两种措施均使得因蛋白质沉淀干扰分离的风险降低。然而,由于结合效率较低和/或输入样品体积减少具有可分离的小核酸总浓度降低的缺点,因此小核酸分离效率降低。因此,一般而言,这些方案的性能令人遗憾地无法与基于苯酚/氯仿的分离方法相比。这些问题尤其是在基于柱的方法中出现。
其他无苯酚方法包括在实际rna分离步骤之前进行的蛋白质沉淀步骤。蛋白质沉淀由金属阳离子引发,这是一种选择性沉淀蛋白质的既定方法(参见,例如lovrien,r.e.和matulis,2001“蛋白质的选择性沉淀(selectiveprecipitationofproteins)”.currentprotocolsinproteinsscience.7:4.5.1-4.5.36)。相应的方法在ep2163622中描述。这里,公开了从不同样品类型中分离长度≤200nt的小rna。使用金属阳离子沉淀蛋白质,此外,在蛋白质沉淀步骤之前或期间去除较大的核酸。然后,通过向获得的上清液添加高浓度的有机溶剂,例如非极性质子有机溶剂,例如thf,从上清液中分离所述小rna。这种方法选择性分离小rna,其中大量的较大rna(例如mrna)和基因组dna丢失,因此不可用于后续的分析。这是一个主要缺点,因为一些客户对小rna和较大的rna例如mrna感兴趣,因此,如果还对较大的rna感兴趣,则需要进行额外的分离程序。此外,如果在对小rna进行分析后想要分析较大的rna,则会需要处理新样品或现有样品的新的一部分。
wo2016/009059通过将选自非质子极性溶剂和质子溶剂的有机溶剂掺入沉淀混合物中,克服了这些缺点。这允许提供包含小rna以及大rna的贫蛋白质的上清液。而且,还可以从上清液中分离出dna。
本发明的目的是提供一种核酸分离方法,特别是rna分离方法,其克服了现有技术方法的上述缺点中的至少一个。特别地,本发明的目的是提供一种允许分离小rna以及大rna的方法,所述方法避免了使用苯酚或蛋白水解酶,并且对于不同样品类型、包括富蛋白质的样品提供了良好的rna收率。
技术实现要素:
发明人发现,在从贫蛋白质的上清液中分离核酸之前包含金属阳离子诱导的蛋白质沉淀步骤的核酸分离方法,可以通过在沉淀混合物中使用低浓度(小于200mm)的金属阳离子沉淀剂与使用ph为4.0或更低的沉淀缓冲液相结合而得到显著改善。令人惊讶的是,发现在沉淀混合物中使用低浓度的金属阳离子沉淀剂与低ph的沉淀缓冲液相结合可以避免在蛋白质沉淀步骤期间使用有机溶剂,而有机溶剂在wo2016/009059中被描述为对于提供包含小rna(小于200nt)以及大rna(至少1000nt)的贫蛋白质上清液是必备的。如本发明的实施例所证明,即使避免使用相应的有机溶剂,本发明的方法同样提供了在除去沉淀物之后提供贫蛋白质的上清液,其包含小rna(小于200nt)以及大rna(至少1000nt),当然如果样品中含有的话,还有中等大小的rna。因此,所有这些rna物种都可以从贫蛋白质的上清液中分离,例如以总rna的形式或者作为一个或多个单独的富集所需大小的、相应大小范围的rna的级分。因此,所述方法特别适合于分离各种类型的rna。此外,用本方法也可以从获得的上清液中分离dna。因此,本发明提供了一种允许从生物样品中同时分离dna和各种类型的rna的方法,而与wo2016/009059中描述的方法相反,本方法不需要使用有机溶剂作为蛋白质沉淀缓冲液的一部分,以避免长rna和dna的共沉淀。本发明因此提供了相比wo2016/009059的改进,所述改进在于可以避免在蛋白质沉淀期间使用有机溶剂。意外的是,这可以通过降低沉淀混合物中金属阳离子沉淀剂的浓度与在沉淀缓冲液中使用特定的ph(4.0或更低)相结合来实现。这特别是,如wo2016/009059和ep2163622中所述的已知方法,教示了在沉淀混合物中较高的金属阳离子沉淀剂浓度对于改善结果是优选的。然而,如本发明所教示在沉淀混合物中使用较低浓度的金属阳离子沉淀剂与沉淀缓冲液中的特定ph条件相结合,允许避免在蛋白质沉淀期间使用有机溶剂。另外,如本文所教示在沉淀混合物中使用较低的金属阳离子沉淀剂浓度,降低了在核酸分离期间金属阳离子沉淀剂被带入洗脱物中的风险。这是有利的,因为金属阳离子沉淀剂例如锌可抑制下游反应,例如基于pcr的方法。因此,本发明提供了一种改进的核酸分离方法,所述方法还为用户提供了关于待分离核酸的灵活性。
根据第一方面,提供了一种从样品中分离核酸的无苯酚方法,所述方法包括以下步骤:
a)向样品添加沉淀缓冲液以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含金属阳离子沉淀剂和缓冲剂,ph值为4.0或更低,并且不包含选自非质子极性溶剂和质子溶剂中的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度小于200mm的金属阳离子沉淀剂,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从所述上清液中分离核酸。
所述方法特别适合于从样品、特别是被破坏的生物样品中分离作为靶核酸的rna。实施例表明,本发明提供了一种收率良好的高效rna分离方法,其使用不包含基于苯酚的提取步骤的方法。即便没有使用苯酚或水不溶性有机溶剂例如氯仿来提取蛋白质,本方法也提供了可比的结果。另外,可以避免在沉淀步骤期间使用选自非质子极性溶剂和质子溶剂的有机溶剂(这样的有机溶剂例如在wo2016/009059中使用)。因此,在沉淀步骤期间可以避免使用有机溶剂。该方法在金属阳离子诱导的沉淀步骤之后提供了贫蛋白质的上清液,其包含小rna、大rna以及根据实施方式的基因组dna。然后可以从所述上清液中分离所含的核酸类型中的一种或多种。因此,该方法允许例如以良好的收率分离小rna以及大rna,从而有利地提供了一种为用户提供更大灵活性的方法。另外,如本文所教示在沉淀混合物中使用低浓度的金属阳离子沉淀剂,降低了下游分析方法、特别是基于酶的方法例如基于聚合酶的方法被夹带的金属阳离子沉淀剂抑制的风险。本发明对本领域做出了重大贡献,并且还显著改进了现有的无苯酚、基于沉淀的rna分离方法。此外,本发明的核酸分离方法可以容易地实施到现有方案中,所述方案旨在从各种样品、包括富蛋白质的样品例如血液、血浆或血清中分离小和/或大rna,或者旨在平行分离这些rna以及dna。
根据第二方面,提供了一种用于沉淀蛋白质的沉淀缓冲液,其包含至少一种金属阳离子沉淀剂和至少一种缓冲剂,其中所述沉淀缓冲液的ph值为4或更低并且其中所述沉淀缓冲液不包含选自非质子极性溶剂和质子溶剂的有机溶剂。
所述沉淀缓冲液可以用于例如从样品、例如被破坏的生物样品中沉淀蛋白质,从而在分离沉淀物之后提供贫蛋白质的上清液,其包含长度小于200nt的小rna和长度为至少1000nt的大rna以及,如果样品中含有的话,中等大小的rna。然后可以从上清液中分离所含的rna,例如以总rna的形式或作为一种或多种单独的富集某种大小、相应的大小范围(例如小于200nt或大于200nt))的rna的级分。所述沉淀缓冲液可以包含在用于分离核酸例如特别是rna的试剂盒中。
根据以下描述和所附的权利要求书,本申请的其他目的、特征、优点和方面对本领域技术人员将变得显而易见。然而,应该理解,以下描述、所附权利要求书和具体实施例,虽然指示了本申请的优选实施方式,但是仅以说明性方式给出。通过阅读以下内容,在所公开的发明的精神和范围内的各种变化和修改对于本领域技术人员而言将变得显而易见。
发明的详细描述
本发明提供了一种用于处理含rna样品的改进的基于蛋白质沉淀的方法,所述方法在沉淀后提供了贫蛋白质的上清液,所述上清液包含小rna以及大rna还有dna。随后可以从所述上清液中分离所含的核酸类型中的一种或多种。因此,提供了一种可用于分离不同核酸的方法。
a.从样品中分离核酸的方法
根据第一方面,提供了一种从样品中分离核酸的无苯酚方法,所述方法包括以下步骤:
a)向样品、优选被破坏的生物样品添加沉淀缓冲液以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含金属阳离子沉淀剂和缓冲剂,ph值为4.0或更低,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度小于200mm的金属阳离子沉淀剂,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从所述上清液中分离核酸。
随后,我们将详细解释每个步骤及其优选的实施方式。
步骤a)–蛋白质沉淀
在步骤a)中,制备含有样品的沉淀混合物并沉淀蛋白质。所述样品优选是生物样品,并且可以是例如破坏的样品,如果必需破坏样品以释放核酸的话。如随后所述,样品破坏也可以在蛋白质沉淀步骤期间发生。样品破坏,例如通过使用包含离液剂的裂解试剂进行的样品破坏,如随后所解释的,对于首先使蛋白质例如核酸酶变性、使蛋白质-核酸复合物解离、使包含核酸的外泌体和其他细胞外囊泡裂解和/或协助准备用于随后在步骤c)中结合核酸的合适条件,是有利的。因此,优选在步骤a)之前进行相应的样品破坏步骤。在处理富含蛋白质的生物样品例如血浆、血清或全血时,尤为如此。为了启动沉淀,将沉淀缓冲液添加到样品中以制备酸性沉淀混合物。所述沉淀缓冲液包含金属阳离子沉淀剂(优选氯化锌)和缓冲剂,并且ph值为4.0或更低。与现有技术相反,所述沉淀缓冲液不包含选自非质子极性溶剂和质子溶剂的有机溶剂。不需要有机溶剂。由此,提供了酸性沉淀混合物,其以小于200mm的浓度包含所述沉淀缓冲液中所含的金属阳离子沉淀剂。这些沉淀条件允许获得贫蛋白质的上清液,其不仅包含长度小于200nt的小rna,而且还包含长度至少为1000nt的大rna。当然,如果样品中包含的话,上清液也可以包含中等大小的rna物种。贫蛋白质的上清液不仅包含小rna物种而且包含较大的rna物种是有利的,因为所述方法的适用性广,并且用户可以分离不同类型的rna。此外,如实施例所证明,还可以从上清液中分离dna。
金属阳离子沉淀剂在沉淀蛋白质中的用途是现有技术中已知的,并且还描述了合适的金属阳离子沉淀剂(参见,例如,lovrien,r.e.和matulis,2001“蛋白质的选择性沉淀(selectiveprecipitationofproteins)”.currentprotocolsinproteinsscience.7:4.5.1-4.5.36,或ep2163622和wo2016/09059)。能够充当蛋白质沉淀剂的任何金属阳离子都可以结合本发明使用,实例包括但不限于cu、cd、hg、pb、zn、fe和al的阳离子。也可以使用金属阳离子沉淀剂的组合。优选地,所述金属阳离子沉淀剂选自zn2+、cu2+和al3+,更优选它是zn2+。如从现有技术中所知(例如参见wo2016/009059)并且也通过实施例证明,这些金属阳离子沉淀剂具有优点,因为zn2+、cu2+和al3+非常迅速地启动蛋白质沉淀并且在低浓度下也有效。特别优选使用zn2+。
所述金属阳离子沉淀剂经由沉淀缓冲液添加,所述沉淀缓冲液优选包含金属阳离子沉淀剂的溶解盐。例如,可以使用卤化物盐,例如氯化物盐。在本方法中特别优选使用氯化锌。因此,本申请中关于金属阳离子沉淀剂描述的所有公开内容一般都明确适用并且特别是指优选实施方式氯化锌,即使没有明确说明。所述沉淀缓冲液优选是水溶液。
在步骤a)中提供的酸性沉淀混合物包含浓度为200mm或更低的由沉淀缓冲液引入的金属阳离子沉淀剂。如从现有技术中已知的(参见例如wo2016/009059),在沉淀混合物中浓度为大约50mm的氯化锌已经足以沉淀蛋白质。然而,现有技术优选使用至少200mm以及更高的较高浓度。如本实施例所证明,使用较低浓度的金属阳离子沉淀剂例如氯化锌是有利的,因为与沉淀缓冲液的低ph相结合,它允许在沉淀期间省略选自非质子极性溶剂和质子溶剂的有机溶剂,同时仍然提供包含小rna以及大rna的贫蛋白质上清液。因此,本方法不包括向样品添加选自非质子极性溶剂和质子溶剂的有机溶剂以制备沉淀混合物的步骤。所述沉淀混合物不包含选自非质子极性溶剂和质子溶剂的有机溶剂。相应的有机溶剂曾在wo2016/009059中描述,关于本方法在沉淀期间所避免的有机溶剂的细节将所述文献通过引用并入本文。wo2016/009059中描述的非质子极性溶剂的例子包括亚砜例如二甲基亚砜(dmso)、酮例如丙酮、腈例如乙腈、环醚例如四氢呋喃(thf)和1,4二
步骤a)中提供的酸性沉淀混合物可包含浓度为185mm或更低、180mm或更低、175mm或更低、170mm或更低、165mm或更低、160mm或更低、155mm或更低、150mm或更低、145mm或更低或者140mm或更低的金属阳离子沉淀剂,优选氯化锌。在沉淀混合物中使用相应的低浓度是有利的,因为它降低了金属阳离子沉淀剂被意外带入下游反应中的风险。特别优选浓度为150mm或更低、145mm或更低或者140mm或更低。如所讨论的,优选使用氯化锌。步骤a)中提供的酸性沉淀混合物可包含浓度为至少50mm、至少60mm、至少65mm、至少70mm、至少75mm、至少80mm、至少85mm、至少90mm、至少95mm或至少100mm的金属阳离子沉淀剂。优选浓度为至少80mm或至少90mm。如所讨论的,优选使用氯化锌。
根据一个实施方式,步骤a)中提供的酸性沉淀混合物包含选自以下浓度的金属阳离子沉淀剂:50mm至175mm,60mm至170mm,65mm至165mm,70mm至160mm,75mm至155mm,80mm至150mm,85mm至145mm,以及90mm至140mm。特别优选的浓度选自75mm至160mm、80mm至150mm和90mm至140mm。如所讨论的,优选使用氯化锌。这些浓度范围在本方法中特别适合于实现蛋白质沉淀,同时提供包含大量小rna和大rna的上清液。如果zn2+用作金属阳离子沉淀剂,则这些浓度范围特别有用。如所讨论的,所述沉淀缓冲液优选包含氯化锌,因此沉淀混合物中的这些浓度范围特别适用于氯化锌。
根据一个实施方式,如果添加两种或更多种金属阳离子沉淀剂来提供沉淀混合物的话,所提到的浓度是指所述沉淀混合物中金属阳离子沉淀剂的总浓度。根据一个实施方式,沉淀缓冲液中包含单一金属阳离子沉淀剂,优选zn2+,例如氯化锌,并因此用于制备沉淀混合物。在实施例中也使用了这种实施方式。
为了提供酸性沉淀混合物而添加的沉淀缓冲液的ph值可以选自2.5至4、2.75至3.9、2.8至3.9、3.0至3.9、3.1至3.9、3.2至3.9、3.3至3.9、3.4至3.9以及3.5至3.9。也可以使用选自3.3至3.8、3.4至3.8和3.5至3.8的ph值。如实施例所证明,使用相应的酸性沉淀缓冲液是有利的。所述沉淀缓冲液优选适合于在沉淀混合物中建立和/或维持相应的ph值。
根据一个实施方式,所述沉淀缓冲液的ph值在2.75至4.0的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在50mm至175mm范围内的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在3.0至4.0的范围内,例如3.3至3.9、3.4至3.9或3.5至3.9,并且步骤a)中提供的酸性沉淀混合物包含浓度在50mm至175mm范围内的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在2.75至4.0的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在60mm至170mm范围内,例如70mm至160mm、80mm至150mm或90mm至140mm的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在3.5至3.9的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在50mm至175mm范围内,例如60mm至170mm、70mm至160mm、80mm至150mm或90mm至140mm的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在2.75至4.0的范围内,例如3.0至4.0、3.3至3.9、3.4至3.9或3.5至3.9,并且步骤a)中提供的酸性沉淀混合物包含浓度在90mm至140mm范围内的金属阳离子沉淀剂。
在一些实施方式中,所述沉淀缓冲液的ph值在3.0至4.0的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在60mm至170mm范围内的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在3.3至3.9的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在70mm至160mm范围内的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在3.4至3.9的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在80mm至150mm范围内的金属阳离子沉淀剂。在一些实施方式中,所述沉淀缓冲液的ph值在3.5至3.9的范围内,并且步骤a)中提供的酸性沉淀混合物包含浓度在90mm至140mm范围内的金属阳离子沉淀剂。
所述沉淀缓冲液包含缓冲剂以维持沉淀缓冲液的酸性ph,这对于本方法是重要的。不同的缓冲剂都是合适的并且可以被使用(也参见wo2016/009059)。也可以使用缓冲剂的组合。根据一个实施方式,缓冲剂是羧酸或由羧酸衍生而来。羧酸包括一元-、二元-或三元-羧酸。优选地,缓冲剂是乙酸或柠檬酸,相应地是乙酸盐或柠檬酸盐。乙酸盐和柠檬酸盐可以不同盐的形式添加。例如,可以使用碱金属盐,例如钠盐或钾盐。根据一个实施方式,乙酸钠用作缓冲剂。根据一个实施方式,所述沉淀缓冲液包含选自以下浓度的缓冲剂:300mm至3m,600mm至2.75m,900mm至2.5m,1.2m至2.4m,1.4m至2.3m,和1.5m至2.25m。特别优选的是羧酸盐,例如乙酸盐或柠檬酸盐,例如可以在之前提到的浓度范围内使用的碱金属盐。特别优选的浓度位于1.6m至2.5m、1.8m至2.3m或1.9mm至2.2m的范围内。根据一个实施方式,如果包含两种或更多种缓冲剂,或者如果缓冲剂以两种或更多种不同的形式,例如乙酸钠和乙酸,添加到缓冲液中,则所提到的浓度是指所述沉淀缓冲液中缓冲剂的总浓度。
使用在沉淀混合物中具有并维持各自酸性ph值的沉淀缓冲液可提供有利的结果,特别是在处理富含蛋白质的样品例如血浆或血清时。所述沉淀混合物的ph值为酸性。它可能受到生物样品的影响,并且可以≤6、≤5.75、≤5.5、≤5.25或≤5。这也取决于所用的沉淀缓冲液的体积。合适的范围包括3至6.5、3.5至6.0、4.0至5.5或4.5至5.25。
根据一个实施方式,所述沉淀混合物包含浓度位于选自以下范围内的缓冲剂:25mm至500mm,50mm至400mm,75mm至300mm,100mm至250mm,和125mm至200mm。这些浓度范围特别适用于羧酸,相应地羧酸的盐,例如乙酸钠。位于100mm至200mm或125mm至175mm范围内的浓度实现了特别好的结果。
沉淀缓冲液的使用是方便的,因为在添加到样品的一种缓冲液中含有实现蛋白质沉淀并因此贫化蛋白质同时将小rna以及大rna维持在上清液中所需的作用剂。所述样品在一个实施方式中是被破坏的样品。所述沉淀缓冲液的组成要使得当将预定体积的沉淀缓冲液添加到一定体积的样品、其可能是被破坏的样品中时,会提供包含如上所述浓度的金属阳离子沉淀剂的沉淀混合物。在某些实施方式中,将样品,其可以是被破坏的样品,与所述沉淀缓冲液以1:1至1:30(沉淀缓冲液:样品)范围内的比率混合。特别地,所述比率可以位于1:3至1:25的范围内,例如1:6至1:20、1:8至1:17、1:10至1:15、或1:12至1:14(沉淀缓冲液:样品)。在一些实施方式中,将样品与所述沉淀缓冲液以1:11至1:15、尤其是1:12至1:14(沉淀缓冲液:样品)范围内的比率混合。在特定实施方式中,以约1:13(沉淀缓冲液:样品)的比率,将所述沉淀缓冲液添加到样品,所述样品可以是被破坏的样品。在一些实施方式中,可以在添加所述沉淀缓冲液之前将用于破坏样品的破坏缓冲液添加到样品中。在这些实施方式中,沉淀缓冲液与样品的比率可以使用被破坏样品的体积、即初始样品和破坏缓冲液的体积作为样品体积来计算。有利地,与大体积的样品、优选是被破坏的样品相比,本发明允许使用低体积的沉淀缓冲液。这允许增加样品的处理体积。如果处理贫细胞或无细胞的生物样品,例如血浆、血清或尿液,以便从这样的生物样品中分离细胞游离或循环核酸,那么这尤其有利。细胞游离核酸例如rna和dna通常以低量存在于这样的样品中,因此处理大样品体积是有利的。
为了建立沉淀混合物的条件而添加到样品、根据一种实施方式是被破坏的样品中的沉淀缓冲液,优选包含溶解盐形式的金属阳离子沉淀剂。例如,可以使用卤化物盐,例如氯化物盐。所述金属阳离子沉淀剂,优选以溶解盐的形式存在,可以按照选自以下的浓度包含在沉淀缓冲液中:250mm至3m,500mm至2.8m,0.75m至2.7m,1m至2.6m,1.2m至2.5m,1.3m至2.25m和1.6m至2m。上文描述了合适的金属阳离子沉淀剂,优选使用选自zn2+、cu2+和al3+的金属阳离子沉淀剂。最优选的是zn2+,它可以例如以氯化锌的形式使用。如实施例所证明,使用包含相应浓度的金属阳离子沉淀剂的沉淀缓冲液提供了良好的结果。即使本发明在沉淀混合物中使用低金属阳离子沉淀剂浓度,但在添加至样品的沉淀缓冲液中使用高浓度的金属阳离子沉淀剂仍然是可能的并且也是有利的。这允许使用较少量的沉淀缓冲液来制备沉淀混合物。使用较少量的沉淀缓冲液是有利的,因为由此减少了要处理的沉淀混合物的总体积。而且这还允许在维持沉淀混合物的处理体积的同时增加样品的体积。当打算从无细胞或贫细胞的生物样品(例如血浆或血清)中分离mrna时,这是特别有利的,因为这样的样品通常只含有少量的mrna。因此,处理的样品体积为至少500μl、至少750μl、至少800μl、至少900μl或至少1000μl是有利的,特别是当打算从贫蛋白质的上清液中捕获mrna时。
当通过添加沉淀缓冲液来提供沉淀混合物时,样品中含有的蛋白质会沉淀。可以通过例如搅拌来帮助沉淀。搅拌包括但不限于涡旋、振荡、倒转和上下吹吸。此外,可以将样品冷却,例如,如同也在实施例中所述,储存在冰上。
如上所述,通过将上述沉淀缓冲液添加到含核酸的样品中来制备沉淀混合物。合适的含rna的生物样品的非限制性例子也在下文描述。本方法特别适合于从富含蛋白质的样品、例如血浆或血清中分离rna。必要时,预先破坏所述样品。因此,根据一个实施方式,所述方法包括破坏样品的步骤。由此,核酸例如特别是rna被释放并且对于随后的核酸分离步骤而言变得更容易接近。
可以使用不同的方法以破坏样品。术语“破坏”在本文中以广义使用,并且特别地包括样品的裂解。在相应的裂解步骤中,生物分子、例如特别是rna从细胞中释放或者可以从其他样品成分例如蛋白质中脱离,从而使rna易于分离。样品破坏,例如通过使用包含离液剂的裂解试剂进行的样品破坏,对于最初使蛋白质例如核酸酶变性、使蛋白质-核酸复合物解离、使包含核酸的外泌体和其他细胞外囊泡裂解和/或协助准备用于随后在步骤c)中结合核酸的合适条件,是有利的。在本文中,提到相应的破坏步骤通常也称为裂解步骤,不管是否从细胞中释放出生物分子例如特别是核酸、或者是否进行裂解以例如从样品中包含的蛋白质或其他物质释放出诸如核酸之类的生物分子。因此,样品可以包含细胞或可以不包含细胞或只包含少量细胞,例如血浆的情况。
为了裂解样品可以使用不同的方法,并且合适的裂解方法在现有技术中是公知的。优选地,使样品与一种或多种裂解剂接触以进行破坏,相应地是裂解。这些可以包含在破坏试剂例如裂解缓冲液中。裂解期间应保护rna免受核酸酶降解。所选的裂解条件也可以取决于要处理的样品类型而变化。通常,裂解程序可以包括但不限于对样品的机械、化学、物理和/或酶促作用。例子包括但不限于在珠磨机中或在玻璃珠存在下研磨样品、均质化样品、施加超声、加热、添加一种或多种洗涤剂和/或添加蛋白质降解化合物,例如蛋白降解酶或盐。此外,可以添加还原剂例如β-巯基乙醇或dtt进行裂解,以帮助例如核酸酶的变性。根据一个实施方式,使用至少一种离液剂、例如优选至少一种离液盐进行裂解并由此破坏样品。合适的离液剂、特别是合适的离液盐是技术人员已知的,并且也在本文中描述。如本文所述,使用离液盐进行裂解的优点在于:它允许引入离液盐,离液盐可以额外支持建立步骤c)中合适的核酸结合条件。
如从现有技术所知(参见wo2016/009059),样品破坏可以在添加金属阳离子沉淀剂之前发生,但是也可以在制备沉淀混合物的同时的相应阶段发生。取决于待处理的样品,也可以在制备沉淀混合物后添加裂解/结合组合物。不过这不太优选,因为当处理复杂样品例如血液或血清时,它可能会降低rna收率。
因此,根据一个实施方式,当在步骤a)中添加沉淀缓冲液时的相应阶段的同时,进行样品破坏。根据这种实施方式,提供了一种从样品中分离核酸的无苯酚方法,所述方法包括以下步骤:
a)向所述样品中添加沉淀缓冲液和至少一种破坏剂以破坏样品并制备酸性沉淀混合物,
其中所述沉淀缓冲液包含金属阳离子沉淀剂和缓冲剂,ph值为4.0或更低,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度小于200mm的金属阳离子沉淀剂并包含破坏试剂,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从所述上清液中分离核酸。
可以使用的合适的破坏试剂例如裂解缓冲液是技术人员公知的并且也在本文中描述。这样的破坏试剂可以例如与沉淀缓冲液分开添加,或者可以预先与沉淀缓冲液混合以便之后在步骤a)中将所述沉淀缓冲液和破坏试剂的混合物添加到样品中。根据一个实施方式,所述破坏试剂包含离液盐。合适的例子是已知的并且也在本文中描述。
根据一个优选实施方式,所述样品在步骤a)中添加金属阳离子沉淀剂和有机溶剂之前被破坏。依据这种实施方式,提供了一种从样品中分离核酸的无苯酚方法,所述方法包括以下步骤:
x)破坏样品;
a)向所述被破坏的样品添加沉淀缓冲液以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含金属阳离子沉淀剂和缓冲剂,ph值为4.0或更低,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度小于200mm的金属阳离子沉淀剂,
并沉淀蛋白质;
b)从上清液中分离沉淀物,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从所述上清液中分离核酸。
根据一个实施方式,为了在步骤x)中破坏样品,提供了一种破坏组合物,其包含待破坏的样品以及在此之外的离液剂,优选离液盐,所述离液剂的浓度选自0.5m至饱和、0.75m至4m、0.8m至3.5m、1m至3m、1m至2.5m和1m至2m。离液盐包括但不限于胍盐,例如盐酸胍、硫氰酸胍(或异硫氰酸胍(gitc)),或者包含硫氰酸盐、碘化物、高氯酸盐、三氯乙酸盐或三氟乙酸盐等的离液盐。这样的离液盐可以例如作为钠盐或钾盐提供。优选地,所述离液盐是gtc(gitc)或同等强度的离液盐。相应的强离液盐是有利的,因为它们也可以有效地保护组合物中包含的rna免于酶促降解。脲也可用于支持样品的破坏。根据一个实施方式,在步骤x)中并因此在步骤a)中向包含被破坏的样品的所述破坏组合物添加所述沉淀缓冲液之前提供所述破坏组合物。
此外,在裂解期间,还可以添加一种或多种其他添加剂,所述添加剂例如选自洗涤剂、例如非离子型洗涤剂。螯合剂,核酸酶抑制剂、特别是rna酶抑制剂或dna酶抑制剂(如果想要并行分离rna和dna)等。可用于支持样品裂解并保护释放的核酸、特别是释放的rna的相应添加剂在现有技术中是公知的,因此无需在本文中详细描述。
在步骤a)中制备沉淀混合物之前,也可以任选地对在步骤x)中从样品获得的被破坏样品进行进一步处理。例如,可以将裂解液均质化;均质化也可以在破坏/裂解过程本身期间发生。此外,可以清理裂解液以去除细胞碎片。裂解液清理方法可以涉及将细胞碎片和其他污染物过滤和/或结合到适当的表面,例如带有离子基团、特别是阴离子基团如羧基基团的表面。
本发明的方法可以与蛋白水解消化物相结合。即使进行蛋白水解消化,本发明的基于沉淀的方法仍可以通过贫化残余蛋白质来改善结果。本文所用的术语“蛋白质”还包涵肽。然而,本发明的优点是它不需要耗时的蛋白水解酶促消化步骤。因此,根据一个实施方式,样品的破坏不涉及使用蛋白水解酶。蛋白水解酶是指催化例如蛋白质、多肽、寡肽和肽中的肽键的切割的酶。示例性的蛋白水解酶包括但不限于蛋白(内肽)酶(proteinases)和蛋白酶(proteases),特别是枯草杆菌蛋白酶、枯草杆菌酶、碱性丝氨酸蛋白酶等。枯草杆菌酶是一个丝氨酸蛋白酶家族,即在活性侧带有丝氨酸残基的酶。枯草杆菌蛋白酶是具有广泛底物特异性的细菌丝氨酸蛋白酶。枯草杆菌蛋白酶比较耐受离液剂例如脲和盐酸胍以及阴离子洗涤剂例如十二烷基硫酸钠(sds)的变性作用。示例性的枯草杆菌蛋白酶包括但不限于蛋白酶k、蛋白酶r、蛋白酶t、枯草杆菌蛋白酶、枯草杆菌蛋白酶a、qiagen蛋白酶等。
步骤b)–去除沉淀物
在步骤b)中,将形成的沉淀物与剩余样品、本文中称为“上清液”进行分离。可以通过各种手段例如沉降、离心或过滤来辅助分离。术语“上清液”本文中特别用来描述从中除去形成的沉淀物的沉淀混合物。术语“上清液”因此不限于通过某种沉淀分离方式获得的特定的贫沉淀物的沉淀混合物。因此,术语“上清液”例如包涵其中沉淀物被收集在容器的底部并且其中剩余的样品作为上清液被移出的实施方式,以及其中使沉淀混合物通过过滤器以除去形成的沉淀物并以流过物的形式回收剩余的样品的实施方式。
如实施例所证明,由于本发明方法中所用的条件,所获得的上清液包含长度小于200nt的小rna以及除此之外的长度为至少1000nt的大rna。当然,如果原始样品中包含中等大小的rna的话,则其也包含在上清液中。根据一个实施方式,获得的上清液包含原始样品中含有的长度为至少1000nt的rna分子的至少60%、至少65%、至少70%、至少75%或至少80%。还发现大rna回收率一样高。因此,与现有技术的基于沉淀的方法相反,本方法允许以良好的收率回收和分离大rna分子,同时允许避免使用选自非质子极性溶剂和质子溶剂的有机溶剂。另外,如在实施例中所证明的,高分子量核酸例如基因组dna可以包含在所述上清液中并从中分离。
步骤c)–从上清液中分离核酸
在步骤c)中,从获得的上清液中分离核酸。核酸可以是rna、dna或两者。为了从获得的上清液中分离所述一种或多种靶核酸(例如rna和/或dna),可以使用现有技术中已知的方法。合适的分离方法的实例包括但不限于:基于二氧化硅的纯化方法,基于磁性粒子的纯化方法,基于色谱的纯化程序,阴离子交换色谱法(使用阴离子交换表面,例如柱或磁性粒子),沉淀,及其组合。优选地,靶核酸例如rna和/或dna中的一种或多种通过使用适当的结合条件使所述核酸与固相结合而从上清液中分离。所述固相可以例如提供二氧化硅结合表面或可以带有可与目的核酸结合的阴离子交换官能团。关于后一实施方式,例如可以使用基于电荷开关(charge-switch)原理的分离方法。
优选地,从上清液中分离至少rna。为了从获得的上清液中分离rna,可以使用现有技术中已知的方法。本发明方法的优点在于上清液包含小rna以及大rna。因此,取决于感兴趣的靶rna,用户可以从上清液中分离小rna、大rna或两者。小rna和大rna可以被分离在分开的级分中或者可以以总rna或总核酸的形式从上清液中分离。当然,如果样品中包含中等大小的rna的话,则其也包含在上清液中,并且可以例如可以与大rna和/或小rna一起被分离。dna可以被共分离。
优选地,所述核酸,特别是rna,通过在有机溶剂例如醇的存在下使其与核酸结合固相结合而从上清液中分离。在结合混合物中存在离液盐的情况下,可以增强与所述固相的结合。非限制性实施方式随后描述。
所述醇可以是具有1至5个碳原子的支链或无支链的脂族醇,并且可以选自甲醇、乙醇、丙醇、异丙醇和丁醇及其混合物。也可以使用醇的混合物。技术人员熟悉使用相应的醇来建立rna和/或dna结合条件。优选地,使用异丙醇和/或乙醇作为建立结合条件的醇。这些醇通常用于从被破坏的样品中分离小rna和大rna。dna也可以在这些条件下被分离。特别优选使用异丙醇。已发现使用异丙醇尤其降低了金属阳离子沉淀剂被带入洗脱物中的风险。如上文所讨论,这应该被避免,因为金属阳离子沉淀剂例如氯化锌会抑制几种下游方法,例如基于pcr的方法。
根据一个实施方式,从上清液中分离核酸,其中所述核酸包含小rna以及大rna和中等大小的rna,或由其组成。在这种实施方式中,步骤c)优选包括:
aa)向上清液添加至少一种醇以提供包含浓度为≥35%、优选≥40%、更优选≥45%的醇的结合混合物;
bb)使所述结合混合物中所含的核酸与含硅的核酸结合固相结合,其中在步骤bb)之后,至少大rna和小rna与所述固相结合;
cc)任选洗涤所述结合的核酸;和
dd)任选从所述固相洗脱核酸。
一个确立已久的原理是,在高浓度醇的存在下,大rna以及小rna,当然还有中等大小的rna,可以与核酸结合固相结合。因此,在这种实施方式中,本方法允许分离包含小rna、大rna和中等大小的rna的总rna。相应的方法也在本发明的
背景技术:
中描述。如本文所述,分离的核酸中也可以包含dna。然而,从上清液中分离dna贫化的总rna也在本发明的范围内。
在结合步骤期间,在所述结合混合物中使用至少35%、优选至少40%、更优选至少45%或至少50%的醇浓度具有建立rna结合条件的效果,从而允许小rna与核酸结合固相结合。在此发现,与现有技术中常用的相比,可以结合本方法使用35%的较低醇浓度来实现小rna与所述固相的结合。当然,更长的rna分子也可以在这些条件下结合并因此被捕获。
由于预先进行了蛋白质沉淀步骤,因为降低了在结合步骤期间蛋白质沉淀和例如堵塞核酸结合固相或以其它方式干扰核酸结合的风险,所以可以在所述结合混合物中使用高醇浓度。这对于收率是有利的。所述结合混合物中的醇浓度可以≥40%(v/v)、≥45%(v/v)或≥50%(v/v)。在实施方式中,醇浓度为70%(v/v)或更低、65%(v/v)或更低、或者60%(v/v)或更低。所述结合混合物中醇浓度的合适范围包括但不限于≥35%(v/v)至≤80%(v/v)、≥35%(v/v)至≤70%(v/v)、≥40%(v/v)至≤65%(v/v)、≥45%(v/v)至≤60%(v/v)和≥45%(v/v)至≤55%(v/v)。约50%(v/v)的醇浓度是特别优选的。相应的醇浓度可以用于步骤aa)中。如同所讨论的,优选乙醇和异丙醇,最优选异丙醇。较高的醇浓度有益于结合小rna。然而,非常高的醇浓度增加了痕量金属阳离子沉淀剂和/或其他污染物被带入洗脱物中的风险。因此,特别优选醇浓度为≥45%(v/v)至≤55%(v/v),特别是约50%(v/v)。
根据一个实施方式,通过将离液盐掺入所述结合混合物中,增强了核酸、例如特别是rna与核酸结合固相的结合。合适的离液盐浓度是技术人员已知的并在本文中描述。
根据一个实施方式,步骤aa)的结合混合物包含浓度位于0.1m直至饱和极限范围内的离液盐。所述浓度可以选自0.2m至5m、0.25m至4.5m、0.3m至4.25m、0.35至4m和0.4m至3.75m。较高的离液盐浓度可有利于增加结合的核酸、例如特别是rna的收率。离液盐包括但不限于胍盐,例如盐酸胍、硫氰酸胍(或异硫氰酸胍(gitc)),或者包含硫氰酸盐、碘化物、高氯酸盐、三氯乙酸盐或三氟乙酸盐等的离液盐。也可以使用离液盐的混合物。这样的离液盐可以例如作为钠盐或钾盐提供。优选地,所述离液盐是gtc或gitc或同等强度的离液盐。所述结合混合物中存在的离液盐可以已在裂解期间被引入,因为使用离液剂、特别是离液盐进行裂解对于破坏样品而言是优选的。细节在上文描述。这种程序也用于实施例中。离液盐也可以在步骤c)中被添加,以将离液盐引入结合混合物中或增加核酸结合步骤期间离液盐的浓度。因此,通过在分离步骤c)中添加追加量的离液盐来增加用于结合的离液盐的浓度也在本发明的范围内。此外,可以添加其他添加剂以改善核酸结合,例如洗涤剂。
在步骤bb)中,使从步骤aa)产生的结合混合物中所含的小rna和大rna以及中等大小的rna与核酸结合固相结合。适合于核酸结合的固相是技术人员已知的;示例性的合适的核酸结合固相也在下面描述。根据一个实施方式,从步骤aa)产生的结合混合物在步骤bb)中与固相接触。如果使用包含在柱中的核酸结合相,则这种实施方式是特别合适的。如果使用基于柱的程序,则在步骤bb)中可以使用核酸结合固相,以使包括小rna的核酸与所述固相结合。在使用粒子的情况下,它们也可以在步骤aa)中已经存在或可以在步骤bb)中被引入。
结合的核酸可任选在步骤cc)中洗涤。为此,可以使用常用的洗涤溶液。根据一个实施方式,用于洗涤的溶液包含至少一种离液剂和/或至少一种醇。例如,第一洗涤溶液包含离液剂并且第二洗涤溶液包含醇。可用于所述洗涤溶液中的离液剂包括但不限于离液盐,例如盐酸胍、硫氰酸胍、异硫氰酸胍和碘化钠。上文还描述了其他离液盐。作为醇,可以在所述洗涤溶液中相应地使用优选1至5个碳原子的短链支链或无支链醇用于洗涤。例子是甲醇、乙醇、丙醇、异丙醇和丁醇。优选地,使用异丙醇和/或乙醇。然而,也可以使用没有离液剂的洗涤溶液。所述洗涤步骤还允许影响分离的核酸的类型。例如,如果打算分离dna贫化的总rna的话。
可以替代或也可以附加于上述洗涤溶液使用的合适的洗涤溶液的例子包括醇和缓冲液。上文描述了合适的醇。优选地,异丙醇或乙醇、最优选乙醇被用于该洗涤步骤。优选地,乙醇的使用浓度为至少60%(v/v)、至少70%(v/v)、优选至少80%(v/v)。根据一个实施方式,所述用于洗涤的溶液包含至少一种离液剂、至少一种醇、至少一种洗涤剂和/或至少一种缓冲剂。可以使用合适的缓冲剂,例如tris或柠檬酸盐;合适的缓冲剂也是技术人员已知的。
在上述任选的一个或多个洗涤步骤之前或之后,可以进行dna酶消化。这样的dna酶消化可以例如在核酸与核酸结合固相结合的同时进行。如果打算分离dna贫化的总rna,则相应步骤是有利的。由此,如果只有rna是目的核酸的话,则可以减少分离的rna中的基因组dna污染物的量。进行相应dna酶消化的合适的实施方式在本文中描述并且在现有技术中也是已知的。相应的dna酶消化步骤是任选的。用于在rna与核酸结合固相结合的同时进行dna酶消化的条件可导致rna并特别是小rna从核酸结合固相中部分释放。因此,优选确保可能释放的小rna与核酸结合固相重新结合,以确保小rna的高回收率。取决于所使用的核酸结合固相的类型,例如不管使用基于柱还是基于粒子的方法,不同的程序是可行的。如果粒子例如磁性粒子用作核酸结合固相,则在进行所述任选的dna酶消化后,可以添加离液剂和醇,从而建立使小rna与所述粒子重新结合的结合条件。为此,可以使用包含例如离液盐和/或醇的溶液。相应的溶液也可以充当洗涤溶液。也可以另行添加补加的醇,以增加醇浓度用于重新结合。合适的醇、醇浓度、离液盐和离液盐浓度在上文结合步骤c)描述。相同的条件可用于重新结合。如果使用基于柱的核酸结合固相,则优选在rna与固相结合的同时进行任选的dna酶消化(经常也称为柱上dna酶消化)之后,进行以下步骤:
-作为流过物收集在dna酶消化期间可能从所述核酸结合固相释放的小rna;
-使与回收溶液混合的包含小rna的所述流过物与所述核酸结合固相接触,以使所含的小rna与所述核酸结合固相重新结合。
为了确保在柱上dna酶消化期间可能被部分释放的rna与所述核酸结合固相重新结合并作为流过物收集释放的小rna,优选在dna酶消化完成后使回收溶液通过所述柱子。在回收溶液建立的条件下可以重新结合的rna与所述核酸结合固相紧密地重新结合,并且“逃逸”的小rna可以作为流过物收集起来并进而可以被重新施加并因此可以与所述核酸固相重新结合。即使进行柱上dna酶消化,这也防止了小rna丢失。wo2012/028737中描述了柱上dna酶消化后相应的重新结合步骤的细节,该文献通过引用并入本文。在可能逃逸的小rna与所述核酸结合固相重新结合后,可以再次进行一个或多个洗涤步骤。合适的条件在上文描述。
在希望进行洗脱步骤以从固相洗脱结合的核酸的情况下,则可以用经典的洗脱溶液例如水、洗脱缓冲液特别是低盐洗脱缓冲液实现洗脱。所述洗脱缓冲液可以包含生物缓冲液,例如tris、mops、hepes、mes、bis-tris丙烷等。相应的洗脱步骤可以在步骤dd)中进行。优选地,使用不干扰预期的下游应用的洗脱溶液。洗脱后,可以将洗脱物热变性。然而,通过其他或辅助洗脱手段,例如加热,从固相释放并由此洗脱核酸也在本发明的范围内。
随后,描述了合适的实施方式,其允许从包含rna和dna的样品中分离包括小rna在内的总rna。在此,描述了允许分离包括小rna在内的总rna的实施方式,或者允许作为与较大的rna分开的级分和/或与dna并行地分离小rna的实施方式。因此,可以从根据本发明的方法提供的蛋白质贫化的上清液中分离rna以及dna。但是,如果需要,可以在纯化期间选择性地贫化dna,从而提供基本不含dna、特别是不含基因组dna的分离的rna。在此,存在去除dna的不同选项。随后将描述非限制性实施方式。
根据一个实施方式,步骤b)中获得的上清液包含rna以及dna,并且在步骤c)中通过使这两种类型的核酸与核酸结合固相结合来分离rna和dna。rna和dna可以作为总核酸的形式被洗脱。根据一个实施方式,如果rna和dna二者都与所述核酸结合固相结合的话,这是可行的,可以随后进行差别洗脱过程,从而允许分别分离dna与总rna,所述总rna包括大rna和小rna。例如,在洗脱结合的rna之前,可以选择性洗脱dna,反之亦然。相应的差别洗脱条件例如描述在wo95/21849或ep1693453中。
根据一个实施方式,通过在适当条件下选择性地使dna与核酸固相结合,然后将与核酸结合固相结合的dna与仍然包含小rna和大rna的剩余上清液分离,从而去除dna。这可以例如通过在主要是dna而不是rna与合适的核酸结合固相结合的条件下使上清液与所述固相接触来实现。允许dna结合的合适的核酸结合固相是现有技术中公知的,并且在其中也是需要的。一般而言,本文描述的用于rna结合步骤的核酸结合固相,特别是含硅固相,也可以用于dna结合。选择性结合并由此去除dna的合适方法例如描述在ep0880537和wo95/21849中,所述文献通过引用并入本文。例如,如果使用离液剂例如离液盐来裂解样品,则可以在不存在对dna具有选择性的短链醇例如乙醇或异丙醇的情况下建立结合条件。如果需要,可以进一步使用结合的dna,例如进一步处理,并且可以将其例如任选地从核酸结合固相上洗涤和洗脱,从而提供基本不含rna的dna级分。然后相应的dna级分可用于分析。因此,本发明还提供了一种方法,其中可以从同一样品中分离rna和dna,因为与现有技术方法相反,可以提供一种贫蛋白质的上清液,其除了小rna和大rna外还包含dna,例如基因组dna。但是,若是对dna不感兴趣,如果打算(只)分离rna,例如小rna和大rna,以分开的级分或以总rna的形式,视什么是优选的,则结合的dna也可以被简单地丢弃。在这种情况下,这样的dna结合和去除步骤也是有利的,因为它减少了纯化的rna中dna污染物的量。
当dna与核酸结合固相、例如含二氧化硅的固相结合时,将结合的dna与剩余样品分离,提供了dna贫化的含有rna的上清液,从中可以分离小rna以及大rna和中等大小的rna。
为了进一步减少分离的rna中dna的量,通过如上所述使dna与核酸固相结合而从贫蛋白质的上清液中除去dna之后,可以进行使用合适的酶降解dna的中间步骤。进行dna酶消化允许去除残留的痕量dna。在rna与所述核酸结合固相结合之后,可以进行dna酶处理,例如作为柱上dna酶消化。细节在上文描述。此外,也可以对获得的含有rna的洗脱物进行dna酶消化。
此外,以分开的级分的形式分离大rna和小rna也在本发明的范围内。这可以,例如,通过使用对这样的较大rna物种具有选择性的条件,在第一步骤中使长度>200nt的rna与第一核酸结合固相结合来实现。由此,这样的较大rna的主要部分与所述固相结合,而剩余的上清液则包含小rna。在第二结合步骤中,然后从去除了大rna的剩余上清液中分离长度为200nt或更低的小rna。相应的选择性结合条件是现有技术中公知的,因此不需要详细描述。它们也描述在背景技术中。通常,为了在第一结合步骤中选择性结合大rna,在结合混合物中使用的醇浓度低于40%,例如浓度位于10%至37%、15%至35%或20%至30%的范围内,优选在离液盐存在下。分离与固相结合的大rna后,上清液剩余部分仍包含小rna。然后可以在第二结合步骤中分离小rna,例如通过增加醇浓度至≥40%、优选≥45%、更优选≥50%并使小rna与核酸结合固相结合。结合的rna可以被洗涤和洗脱。此外,总rna可以与相同的固相结合,并且小rna可以在例如差别洗脱方案之后作为与较大rna分开的富集级分获得。然而,优选分离总rna,其包含长度小于200nt的小rna以及较大的rna物种,因为由于回收了全部大小(小、中和大)的rna,这样的程序对于用户而言非常方便并且对于分离的rna的下游应用而言非常灵活。
也可以使用其他rna分离方法以便从使用本发明的特殊沉淀条件提供的贫蛋白质的上清液中分离rna。rna分离方法例如也描述在ep2163622和wo2009/070558中,并且可以使用所描述的结合条件以便从上清液中分离rna。通常,在适合使小rna与核酸结合固相结合的条件下,较大的rna也会结合。
此外,可以从上清液中分离dna。合适的方法是技术人员已知的,并且根据本公开也是显而易见的。根据一个实施方式,从上清液中分离出总核酸。在此,分离的核酸包含小rna、大rna、中等大小的rna以及dna。合适的结合条件是技术人员已知的,并且根据本公开也是显而易见的。
分离的核酸然后可以使用合适的测定和/或分析方法进行分析和/或进一步处理。例如,rna诸如小、大和/或中等尺寸的rna,如果从上清液中分离出来的话,可以进行鉴别、修饰、与至少一种酶接触、扩增、逆转录、测序、与探针接触、检测(它们的存在与否)和/或可以进行定量。相应的方法是现有技术中公知的并普遍应用于医疗、诊断和/或预后领域以便分析rna。因此,可以对回收的核酸进行分析以例如识别疾病状态的存在、不存在或严重程度,所述疾病状态包括但不限于多种肿瘤性疾病,尤其是恶变前肿瘤和恶性肿瘤,例如不同形式的肿瘤或癌症。例如,可以对分离的核酸进行分析,以便在许多应用领域中检测诊断标志物和/或预后标志物(例如胎儿或肿瘤来源的细胞外核酸),所述领域包括但不限于非侵入性产前基因检测相应的筛查、疾病筛查、病原体筛查、肿瘤学、癌症筛查、早期癌症筛查、癌症治疗监测、基因检测(基因分型)、感染性疾病检测、损伤诊断、创伤诊断、移植医学或许多其他疾病,因此,具有诊断和/或预后相关性。因此,如上所讨论,本方法可以包括进一步的核酸分析和/或处理步骤。
因此,根据一个实施方式,对分离的核酸,例如特别是分离的rna,进行分析以鉴定、检测、筛查、监测或排除疾病和/或至少一种胎儿特征。分析方法将取决于感兴趣的核酸物种。分离的核酸的分析/进一步处理可以使用任何核酸分析/处理方法进行,所述方法包括但不限于扩增技术、聚合酶链反应(pcr)、等温扩增、逆转录聚合酶链反应(rt-pcr)、定量实时聚合酶链反应(q-pcr)、数字pcr、凝胶电泳、毛细管电泳、质谱、荧光检测、紫外光谱、杂交测定、rna或dna测序、下一代测序、限制性酶切分析、逆转录、nasba、等位基因特异性聚合酶链反应、聚合酶循环组装(pca)、不对称聚合酶链反应、指数线性聚合酶链反应(late-pcr)、螺旋酶依赖性扩增(hda)、热启动聚合酶链反应、序列间特异性聚合酶链反应(issr)、反向聚合酶链反应、连接介导的聚合酶链反应、甲基化特异性聚合酶链反应(msp)、多重聚合酶链反应、嵌套聚合酶链反应、固相聚合酶链反应、或其任意组合。
特别地,本发明的方法可出于通常期望分离rna的任何目的而用于分离rna。非限制性例子包括但不限于分离rna用于随后的cdna合成、cdna文库构建、基于扩增的方法例如逆转录pcr、消减式杂交、体外翻译、sage技术、表达分析、表达阵列和表达芯片分析、微阵列分析、rna酶和s1核酸酶保护、rna杂交、点和狭线印迹、微量注射,此外,用于测序应用。相应的技术是技术人员公知的,因此不需要在此进一步描述。本发明的方法有效、灵活并且不需要使用酚类化合物。根据一个实施方式,mrna被逆转录为cdna,并随后使用聚合酶链反应进行检测。
具体实施方式
下面将描述本发明方法的非限制性具体实施方式。
根据一个实施方式,所述方法包括以下步骤
x)任选地破坏样品;
a)向所述样品、其任选是被破坏的样品添加沉淀缓冲液,以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含金属阳离子沉淀剂和缓冲剂,ph值选自3.0至4.0、3.1至3.9、3.2至3.9、3.3至3.9、3.4至3.9、3.5至3.9和3.5至3.8,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度选自50mm至175mm、60mm至170mm、65mm至165mm、70mm至160mm、75mm至155mm、80mm至150mm、85mm至145mm以及90mm至140mm的所述金属阳离子沉淀剂,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从上清液中分离至少小rna和大rna,其中步骤c)任选包括:
aa)向上清液添加至少一种醇,优选异丙醇,以提供包含浓度为≥35%(v/v)、≥40%(v/v)、≥45%(v/v)或约50%(v/v)的醇、优选异丙醇的结合混合物;
bb)使所述结合混合物中所含的至少小rna和大rna与含硅的核酸结合固相结合,其中在步骤bb)之后,至少大rna和小rna与所述固相结合;
cc)任选地洗涤结合的rna;
dd)从所述固相上洗脱rna。
根据一个实施方式,所述方法包括以下步骤
x)任选地破坏样品;
a)向所述样品、其任选是被破坏的样品添加沉淀缓冲液,以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含金属阳离子沉淀剂和缓冲剂,ph值选自3.3至3.9、3.4至3.9、3.5至3.9和3.5至3.8,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度选自75mm至175mm、80mm至160mm、85mm至150mm和90mm至140mm的所述金属阳离子沉淀剂,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从上清液中分离至少小rna和大rna,其中步骤c)包括:
aa)向上清液添加至少一种醇,优选异丙醇,以提供包含浓度为≥35%(v/v)、≥40%(v/v)、≥45%(v/v)或约50%(v/v)的醇、优选异丙醇的结合混合物;
bb)使所述结合混合物中所含的至少小rna和大rna与含硅的核酸结合固相结合,其中在步骤bb)之后,至少大rna和小rna与所述固相结合;
cc)任选地洗涤结合的rna;
dd)从所述固相上洗脱rna。
根据一个实施方式,所述方法包括以下步骤
x)任选地破坏样品;
a)向所述样品、其任选是被破坏的样品添加沉淀缓冲液,以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含溶解盐形式的选自zn2+、cu2+和al3+的金属阳离子沉淀剂,优选氯化锌,和缓冲剂,ph值选自3.3至3.9、3.4至3.9、3.5至3.9和3.5至3.8,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度选自75mm至175mm、80mm至160mm、85mm至150mm和90mm至140mm的所述金属阳离子沉淀剂,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从上清液中分离至少小rna和大rna,其中步骤c)包括:
aa)向上清液添加至少一种醇,优选异丙醇,以提供包含浓度为≥35%(v/v)、≥40%(v/v)、≥45%(v/v)或约50%(v/v)的醇、优选异丙醇的结合混合物;
bb)使所述结合混合物中所含的至少小rna和大rna与含硅的核酸结合固相结合,其中在步骤bb)之后,至少大rna和小rna与所述固相结合;
cc)任选地洗涤结合的rna;
dd)从所述固相上洗脱rna。
根据一个实施方式,所述方法包括以下步骤
x)任选地破坏样品;
a)向所述样品、其任选是被破坏的样品添加沉淀缓冲液,以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含溶解盐形式的zn2+作为金属阳离子沉淀剂,优选氯化锌,和缓冲剂,ph值选自3.3至3.9、3.4至3.9、3.5至3.9和3.5至3.8,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度选自80mm至175mm、85mm至160mm、90mm至150mm、95mm至145mm和100mm至140mm的zn2+,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从上清液中分离至少小rna和大rna,其中步骤c)包括:
aa)向上清液添加至少一种醇,优选异丙醇,以提供包含浓度为≥35%(v/v)、≥40%(v/v)、≥45%(v/v)或约50%(v/v)的醇、优选异丙醇的结合混合物;
bb)使所述结合混合物中所含的至少小rna和大rna与含硅的核酸结合固相结合,其中在步骤bb)之后,至少大rna和小rna与所述固相结合;
cc)任选地洗涤结合的rna;
dd)从所述固相上洗脱rna。
关于上述实施方式,要注意的是,在步骤a)之前,可以进行破坏样品的步骤x)。上文描述的细节和优选条件也适用于此。然而,如本文所述和从现有技术中知晓(参见wo2016/009059),也可以在制备沉淀混合物的同时发生样品破坏(如有必要)。因此,根据一个实施方式,当在步骤a)中添加沉淀缓冲液的相应阶段的同时,进行样品破坏。优选地,在步骤a)中添加沉淀缓冲液,其包含溶解盐形式的金属阳离子沉淀剂,更优选氯化锌。步骤c)aa)中用于建立结合条件的醇的优选浓度范围以及结合条件的其他特征,例如优选的离液剂使用,描述于上文并且也适用于此。
根据一个实施方式,所述方法包括以下步骤
x)使用离液剂破坏生物样品;
a)向所述被破坏的样品添加沉淀缓冲液以制备酸性沉淀混合物,
其中所述沉淀缓冲液包含氯化锌形式的zn2+作为金属阳离子沉淀剂,和缓冲剂,ph值选自3.3至3.9、3.4至3.9、3.5至3.9和3.5至3.8,并且不包含选自非质子极性溶剂和质子溶剂的有机溶剂,并且
其中所述酸性沉淀混合物包含浓度选自80mm至175mm、85mm至160mm、90mm至150mm、95mm至145mm和100mm至140mm的zn2+,
并沉淀蛋白质;
b)将沉淀物与上清液分离,其中所述上清液包含长度小于200nt的小rna和长度为至少1000nt的大rna;以及
c)从上清液中分离至少小rna和大rna,其中步骤c)包括:
aa)向上清液添加异丙醇以提供包含浓度为≥35%(v/v)、≥40%(v/v)、≥45%(v/v)或约50%(v/v)的异丙醇的结合混合物;
bb)使所述结合混合物中所含的至少小rna和大rna与含硅的核酸结合固相结合,其中在步骤bb)之后,至少大rna和小rna与所述固相结合;
cc)任选地洗涤结合的rna;
dd)从所述固相上洗脱rna。
优选地,所述结合混合物中的异丙醇浓度选自≥35%(v/v)至≤70%(v/v)、≥40%(v/v)至≤65%(v/v)、≥45%(v/v)至≤60%(v/v)和≥45%(v/v)至≤55%(v/v)。特别优选约50%的异丙醇浓度。
术语“样品”在本文中以广义使用,并且旨在包括各种含核酸的来源。样品可以是并且优选是生物样品,但是该术语还包括其他样品,例如包含rna的人工样品。示例性样品包括但不限于:组织,包括但不限于肝、脾、肾、肺、肠、脑、心脏、肌肉、脂肪、胰腺、细胞培养物、一般体液;全血;血清;血浆;红细胞;白细胞;血沉棕黄层,肿瘤细胞,胎儿细胞,宿主和移植物细胞;拭子,包括但不限于颊拭子、咽拭子、阴道拭子、尿道拭子、宫颈拭子、咽拭子、直肠拭子、病灶拭子、脓肿拭子、鼻咽拭子等;尿液;痰;唾液;精液;淋巴液;液(liqour);羊水;脑脊液;腹膜积液;胸膜积液;囊肿液;滑液;玻璃体液;眼房水;囊液;洗眼液;眼抽吸物;肺灌洗液;肺抽吸物;骨髓抽吸物,悬浮细胞,以及从可能存在于样品之上或之中的任何细胞和微生物及病毒获得的裂解物、提取物或材料,等等。从临床或法医环境获得的含有或怀疑含有rna的材料也在术语样品的目标含义之内。此外,技术人员将领会,从任何上述示例性样品获得的裂解物、提取物或材料或其部分也在术语样品的范围内。优选地,样品是源自于人类、动物、植物、细菌或真菌的生物样品。优选地,样品选自细胞、组织、体液例如血液、血液产物例如血沉棕黄层、血浆和血清、尿液、液、痰、粪便、csf和精子、上皮拭子、活检组织、骨髓样品和各种各样的组织样品。如上所述,优选在制备沉淀混合物之前破坏样品。在一个实施方式中,样品是液体样品。本发明的方法特别适合于从富含蛋白质的样品如血浆或血清中分离rna。如实施例所示,即使在纯化期间不使用苯酚,并且在制备沉淀混合物期间没有使用选自非质子极性溶剂和质子溶剂的有机溶剂,本发明的方法仍然可以从各个样品中有效分离小rna以及大rna。
本发明的方法也适合于处理血液样品,特别是使用例如抗凝剂稳定的血液样品和从这样的血液样品衍生的样品例如血浆或血清。用于稳定血液样品的典型抗凝剂包括但不限于edta和柠檬酸盐。所述方法还适合于从相应的稳定化样品衍生的样品例如从血浆或血清样品中分离rna。此外,可以从血清样品、包括含激活剂的血清样品中分离rna。
如本文所用的术语“核酸”,特别是指包含核糖核苷和/或脱氧核糖核苷的聚合物,所述核糖核苷和/或脱氧核糖核苷通常通过亚基之间的磷酸二酯键、但在有些情况下通过硫代磷酸酯、甲基膦酸酯等共价键合。dna包括但不限于所有类型的dna,例如gdna;环状dna、质粒dna和循环dna。rna包括但不限于hnrna;mrna;细胞外rna,非编码rna(ncrna),包括但不限于rrna、trna、lncrna(长非编码rna)、lincrna(长基因间非编码rna)、mirna(微小rna)、sirna(小干扰rna)、snorna(核仁小rna)、snrna(核小rna)和strna(时序小rna),pirna(piwi相互作用rna),tirna(转录起始rna),pasr(启动子相关rna),cut(隐蔽不稳定转录本)。小rna或术语小rna物种特别是指链长为200nt或更低、175nt或更低、150nt或更低、125nt或更低、100nt或更低、或者75nt或更低的rna,并包括但不限于mirna、sirna、其他短干扰核酸、snorna等。如本文所用的大rna和类似的表达是指长度为至少1000nt、例如至少1250nt、至少1500nt或甚至更大的rna物种。大rna特别包括mrna。在rna是双链分子的情况下,则表示为“nt”的链长是指“bp”。可以用本方法分离的rna当然也可以是中等大小的rna,并且例如当从样品中分离总rna时被分离。
本方法特别适合于从各种生物样品、例如特别是血浆和血清中分离细胞外核酸,例如总循环细胞游离rna和dna。如本文中所用的术语“细胞外核酸”特别是指不包含在细胞中的核酸。相应的细胞外核酸也经常被称为细胞游离核酸。术语“细胞外核酸”是指例如细胞外rna以及细胞外dna。在生物样品例如体液的无细胞级分(相应部分)中存在的典型的细胞外核酸的例子包括但不限于哺乳动物细胞外核酸例如细胞外肿瘤相关或肿瘤源性的dna和/或rna、其他细胞外疾病相关dna和/或rna、表观遗传修饰dna、胎儿dna和/或rna、小干扰rna例如mirna和sirna,以及非哺乳动物细胞外核酸例如由原核生物(例如细菌)、病毒、真核生物寄生虫或真菌释放到细胞外核酸群体中的病毒核酸、病原体核酸。细胞外核酸可包含在外泌体或其他细胞外囊泡的内部。细胞外核酸可以从生物样品的贫细胞或无细胞级分中分离,所述生物样品例如源自于体液,例如血液、血浆、血清、唾液、尿液、液、脑脊液、痰、泪液、汗液、羊水或淋巴液。使用已知的方法,例如离心,可以从这样的生物样品中去除细胞。然后可以从获得的无细胞或贫细胞部分中分离细胞外核酸。从血浆或血清中分离核酸是特别优选的。根据一个实施方式,本方法包括对分离的细胞外核酸进行分析的步骤。
作为可用于结合核酸例如rna的核酸结合固相,可以使用能够结合目的核酸的任何材料。这包括各种能够结合核酸的材料。可以结合本发明使用的示例性固相包括但不限于包含硅的化合物,包括但不限于二氧化硅材料例如二氧化硅粒子、二氧化硅纤维、玻璃纤维、二氧化硅、硅藻土、玻璃、烷基二氧化硅、硅酸铝和硼硅酸盐;硝化纤维素;重氮化纸;羟磷灰石(也称为羟基磷灰石);尼龙;金属氧化物;矿物质,氧化锆;氧化铝;聚合载体,有机聚合物,二乙基氨乙基和三乙基氨基乙基衍生的载体,疏水色谱树脂等。术语固相无意暗示对其形式或设计的任何限制。因此,术语固相包括多孔或非多孔、可渗透或不可渗透的适当材料,包括但不限于膜、过滤器、片、粒子、磁性粒子、珠子、凝胶、粉末、纤维等。根据一个实施方式,使用被阴离子交换配体官能化的固相,以便从贫蛋白质的上清液中结合目的核酸。例如,可以使用被阴离子交换配体官能化的柱或粒子例如磁性粒子。根据另一个实施方式,固相例如二氧化硅固相的表面没有被修饰,并且例如没有被官能团修饰。
特别优选使用含硅材料例如二氧化硅和聚硅酸材料、硼硅酸盐、硅酸盐和无机玻璃作为固相。在此,所述固相优选提供二氧化硅表面用于与可以通过沉淀和/或吸附结合的rna相互作用。如本文所用的术语“二氧化硅表面”包括包含二氧化硅和/或其他硅氧化物、硅藻土、玻璃、沸石、膨润土、烷基硅胶、硅酸铝和硼硅酸盐或由它们组成的表面。所述二氧化硅表面优选是未改性的。因此,所述表面没有被核酸结合配体或其他核酸结合基团修饰。例如,所述固相在其结合表面上不带有任何包含离子交换基团的配体,特别是,所述固相的表面没有被功能性配体修饰。特别是,它未被包含阴离子或阳离子交换基团例如胺基基团或羧基基团的配体修饰。根据一个实施方式,所述二氧化硅表面除了它的硅烷醇基团或硅的其他氧化形式如氧化物外,不包含任何官能团。可以结合本发明使用的示例性固相包括但不限于包含二氧化硅表面的固相,包括但不限于:二氧化硅粒子,二氧化硅纤维,玻璃材料例如玻璃粉、玻璃纤维、玻璃粒子或可控孔度玻璃,颗粒形式的二氧化硅、玻璃或硅石例如粉末、珠子或玻璃料(frit)。根据本发明,优选使用基于柱的固相或使用粒子,特别是磁性粒子。
基于二氧化硅的核酸分离方法在现有技术中被广泛使用,并且在优选与至少一种离液盐结合使用高醇浓度用于结合而分离rna、包括小rna时作用特别好。
根据一个实施方式,使用的二氧化硅粒子可以作为珠子的形式。优选地,所述粒子的大小为约0.02至30μm,更优选为0.05至15μm,最优选为0.1至10μm。为了易于处理核酸结合固相,优选使用磁性二氧化硅粒子。磁性粒子响应磁场。磁性二氧化硅粒子可以是例如亚铁磁性、铁磁性、顺磁性或超顺磁性的。合适的磁性二氧化硅粒子例如描述在wo01/71732、wo2004/003231和wo2003/004150中。其他磁性的二氧化硅粒子也是现有技术中已知的并且例如描述在wo98/31840、wo98/31461、ep1260595、wo96/41811和ep0343934中,并且还包括例如磁性二氧化硅玻璃粒子。磁性粒子的使用很方便,因为借助于磁场,例如通过使用永磁体,可以容易地处理包含结合的rna的磁性粒子。这种实施方式与已建立的能够处理磁性粒子的机器人系统相容。在此,现有技术中存在不同的机器人系统,其可以结合本发明用于处理与核酸结合的磁性粒子。根据一个实施方式,磁性粒子被收集在反应容器的底部或侧面,并从反应容器中去除剩余的液体样品,留下所收集的与核酸结合的磁性粒子。所述剩余样品的除去可通过倾析或吸出发生。这样的系统在现有技术中是公知的,因此不需要在此详述描述。在另一种已知用于处理磁性粒子的系统中,将通常被罩子或封套覆盖的磁体投入反应容器中来收集磁性粒子。因为相应的系统是现有技术中公知的并且也是可商购的(例如
根据一个优选实施方式,进行基于柱的核酸分离程序,其中固相包含在柱中。如本文所用的术语“柱”特别描述了具有至少两个开口的容器。由此,溶液和/或样品可以通过所述柱。术语“柱”特别不暗示关于容器形状的任何限制,所述容器形状可以是例如圆形的或有角的,并优选是圆柱形的。然而,也可以使用其他形状,特别是当使用多个柱时。所述柱包含用于rna结合的固相。包含在柱中的所述固相应允许溶液、相应的结合混合物当施加于柱上时通过。这意味着如果例如向所述柱施加离心力时,溶液和/或结合混合物能够在离心力的方向上通过所述柱。如上所讨论,当使用相应的基于柱的分离程序时,通常将结合混合物通过所述柱,例如在离心或真空的辅助下,并且核酸分子在所述通过期间与所包含的固相结合。结合哪种核酸物种(例如小rna和/或大rna)取决于所使用的结合条件。所述柱可以以单一型式或以多种型式使用。具有与多孔板相似的型式并包含固相例如二氧化硅膜或玻璃纤维的这样的多重柱在现有技术中是公知的,并且也是可商购的。优选地,所述柱是离心柱。优选地,将核酸结合膜或核酸结合纤维用作固相。例子包括但不限于二氧化硅膜、玻璃纤维膜或提供用于核酸结合的含硅表面的过滤器。优选地,所述核酸结合固相是多孔的。如实施例所示,使用包含在柱中的固相具有几个优点。使用柱例如离心柱来纯化rna是广泛确立的,因此,柱的使用对用户非常方便。基于柱的方法也是快速的,此外,还存在允许自动处理样品的自动化系统(参见,例如qiacube,qiagen)。从而避免了繁琐的人工处理程序。此外,使用基于离心柱的方法来分离核酸具有以下优点:不存在携带来自洗涤溶液(例如,醇)或珠粒的潜在抑制组分的风险。优选在柱中使用包含二氧化硅或由二氧化硅组成的膜或纤维作为固相。上文也描述了合适的和优选的基于二氧化硅的材料,其提供了适合于核酸并特别是rna结合的二氧化硅表面。包含在柱中的另一种常见的固相是二氧化硅粒子填充物、或二氧化硅材料(例如硅胶)层。例如,可以将二氧化硅粒子在惰性过滤器或膜上布置成层,从而形成核酸结合固相。为了缓解结合混合物通过包含在柱中的固相,可以使用合适的手段,例如离心或使用压差产生装置,其例如压迫样品通过柱,相应地通过固相,或通过施加真空将其吸过固相。相应的手段在现有技术中是公知的,因此在此不需要进一步描述。
如本领域技术人员公知的,上述核酸结合固相通常也适合于结合dna。
b.沉淀缓冲液
根据第二方面,提供了一种用于沉淀蛋白质的沉淀缓冲液,其包含至少一种金属阳离子沉淀剂和至少一种缓冲剂,其中所述沉淀缓冲液的ph值为4或更低并且其中所述沉淀缓冲液不包含选自非质子极性溶剂和质子溶剂的有机溶剂。
相应的沉淀缓冲液可以有利地被使用,以从各种生物样品、特别是被破坏的生物样品中沉淀蛋白质。因此,为了沉淀蛋白质,可以特别将其用于根据本发明第一方面的方法。因此,本发明还涉及根据第二方面的沉淀缓冲液在根据第一方面的方法中的应用。
所述沉淀缓冲液的细节已经在上文结合根据第一方面的方法进行了描述,并且它涉及的相应公开内容也适用于此。下面再次简要描述非限制性实施方式。
所述金属阳离子沉淀剂可以以溶解盐的形式包含在沉淀缓冲液中,其浓度选自250mm至3m、500mm至2.8m、0.75m至2.7m、1m至2.6m、1.2m至2.5m、1.3m至2.25m和1.6m至2m。例如,可以使用卤化物盐,例如氯化物盐。在包含两种或更多种金属阳离子沉淀剂的情况下,根据一个实施方式,这些浓度是指所包含的金属阳离子沉淀剂的总浓度。如实施例所证明,使用包含相应浓度的金属阳离子沉淀剂的沉淀缓冲液提供了良好的结果。合适的金属阳离子沉淀剂已在上文描述,相应的公开内容也适用于此。优选地,所述金属阳离子沉淀剂选自zn2+、cu2+和al3+。zn2+是特别优选的。它可以作为氯化锌包含在沉淀缓冲液中。
所述沉淀缓冲液不包含选自非质子极性溶剂和质子溶剂的有机溶剂。wo2016/009059中使用了这样的溶剂。在其中描述的有机溶剂不包含在本发明的沉淀缓冲液中。本发明允许在沉淀混合物中避免所有有机溶剂。
所述沉淀缓冲液的ph值可以选自2.5至4、2.75至4.0、2.8至4.0、3.0至3.9、3.1至3.9、3.2至3.9、3.3至3.9、3.4至3.9和3.5至3.9。也可以使用选自3.3至3.8、3.4至3.8和3.5至3.8的ph值并且这是优选的。如实施例所证明,使用相应的酸性沉淀缓冲液是有利的,特别是在处理富含蛋白质的样品例如血浆或血清时。所述沉淀缓冲液优选适合于在沉淀混合物中建立和/或维持相应的ph值。
为了维持酸性ph值,所述沉淀缓冲液包含至少一种缓冲剂。可以使用不同的缓冲剂。也可以使用缓冲剂的组合。根据一个实施方式,缓冲剂是羧酸或衍生自羧酸。羧酸包括一元-、二元-或三元-羧酸。优选地,缓冲剂是乙酸或柠檬酸,相应的是乙酸盐或柠檬酸盐。如实施例所证明,乙酸盐和柠檬酸盐可以以不同盐的形式添加。根据一个实施方式,所述沉淀缓冲液包含浓度选自300mm至3m,600mm至2.75m、900mm至2.5m、1.2m至2.4m、1.4m至2.3m和1.5m至2.25m的缓冲剂。特别优选的是羧酸盐,例如乙酸盐或柠檬酸盐,例如可以在前述浓度范围内使用的碱金属盐。特别优选的是浓度位于1.6mm至2.5m、1.8m至2.3m或1.9m至2.2m的范围内。在使用两种或更多种缓冲剂的情况下,或者如果缓冲剂以两种或更多种不同的形式、例如乙酸钠和乙酸添加到缓冲液中,则根据一个实施方式,相应的浓度是指所述沉淀缓冲液中缓冲剂的总浓度。
根据一个实施方式,所述沉淀缓冲液
aa)包含浓度选自250mm至3m、500mm至2.8m、0.75m至2.7m、1m至2.6m、1.2m至2.5m、1.3m至2.25m和1.6m至2m的溶解盐形式的zn2+、cu2+或al3+,优选zn2+,作为金属阳离子沉淀剂;并且
bb)具有位于选自3.3至3.9、3.4至3.9、3.5至3.9和3.5至3.8的范围内的ph值。
如上所述,zn2+是优选的并且可以例如作为氯化锌包含在其中。
根据第三方面的沉淀缓冲液也可以包含在试剂盒中。因此,本发明还提供了一种试剂盒。所述试剂盒用于从样品中分离核酸,优选至少rna。根据一个实施方式,所述试剂盒包含分离核酸所必需的所有试剂,所述核酸优选至少是rna。根据一个实施方式,这样的试剂盒包含根据第三方面的沉淀缓冲液和以下组分中的一种或多种:
-至少一种破坏试剂,优选包含离液剂;
-至少一种核酸结合固相;
-至少一种结合溶液;
-至少一种洗涤溶液;和/或
-至少一种洗脱液。
根据一个实施方式,所述试剂盒包含沉淀缓冲液、包含离液盐的破坏试剂以及核酸结合固相。相应的破坏剂和核酸结合固相的合适的实施方式在上文结合根据第一方面的方法进行了描述,并且它涉及的上述公开内容也适用于此。所述试剂盒还可包含结合溶液。所述结合溶液可以包含适合于促进核酸例如优选rna与核酸结合固相结合的醇或由所述醇组成。合适的醇在上文描述,优选是乙醇和异丙醇。例如,如果含硅材料用作核酸结合固相,则这种实施方式是合适的。所述结合溶液可包含离液剂,例如优选离液盐。这在破坏缓冲液不包含离液盐的情况下是特别有利的。
本发明不受在本文中公开的所述示例性方法和材料限制,并且与本文中所述的相似或等效的任何方法和材料均可用于实践或检验本发明的实施方式。数值范围包括限定该范围的数字在内。本文提供的标题不限制本发明的各个方面或实施方式,本发明可通过将说明书作为一个整体进行参考来理解。
用于本说明书和权利要求书中时,不带数量指示的指称物包括复数的方面,除非上下文明确地另有规定。因此,例如,提及“金属阳离子沉淀剂”包括单一类型的金属阳离子沉淀剂,以及两种或更多种金属阳离子沉淀剂。同样地,提及“醇”、“有机溶剂”、“离液盐”、“缓冲剂”等包括单一实体以及两种或更多种这样的实体的组合。提及“本公开内容”和“本发明”等包括在本文中教示的单个或多个方面;以此类推。在本文中教示的方面由术语“本发明”涵盖。
如本文中所用的术语“溶液”特别是是指液体组合物,优选水性组合物。它可以是只有单相的均质混合物,但溶液包含固体成分例如沉淀物也在本发明的范围内。
如本文所用的术语“混合物”,特别是当结合“沉淀混合物”使用时,是指可以包含固体成分、例如特别是沉淀物的组合物,除非上下文另有说明。如本领域的读者将领会的,当向样品添加沉淀缓冲液以制备沉淀混合物时,蛋白质迅速沉淀。因此,沉淀混合物通常不是均质性质的混合物,而是包含已经沉淀的组分。
根据一个实施方式,本文中在方法的情况下描述为包括某些步骤或者在组合物、溶液和/或缓冲液的情况下描述为包含某些成分的主题是指由相应的步骤或成分组成的主题。优选选择和组合在本文中描述的优选实施方式,并且由优选实施方式的相应组合产生的特定主题也属于本公开。
附图说明
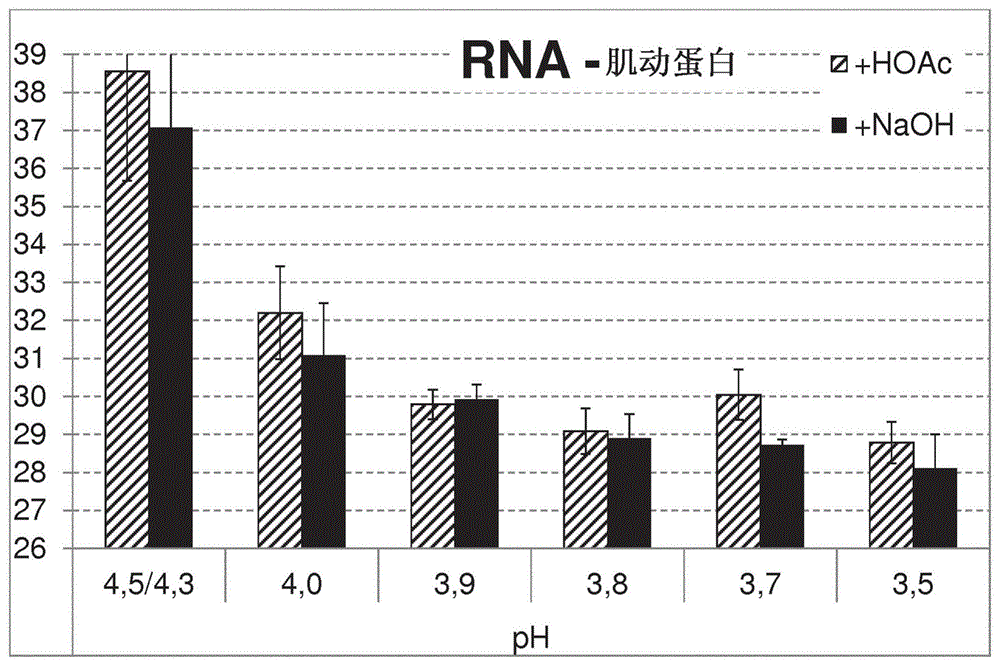
图1显示了使用含有zncl2而没有有机溶剂的沉淀缓冲液在不同ph值下分离的肌动蛋白mrna的量。ph使用naoh(+naoh)向上调节,或使用乙酸(+hoac)向下调节。分离的mrna的量由ct值表示,其中较高的ct值指示较低的rna量。
图2显示了使用含有zncl2而没有有机溶剂的沉淀缓冲液在不同ph值下分离的let-7amirna的量。ph使用naoh(+naoh)向上调节,或使用乙酸(+hoac)向下调节。分离的mirna的量由ct值表示,其中较高的ct值指示较低的rna量。
图3显示了使用含有zncl2而没有有机溶剂的沉淀缓冲液在不同ph值下分离的mir-16mirna的量。ph使用naoh(+naoh)向上调节,或使用乙酸(+hoac)向下调节。分离的mirna的量由ct值表示,其中较高的ct值指示较低的rna量。
图4显示了使用不同的zncl2浓度,在有或没有有机溶剂进行蛋白质沉淀的情况下分离的mir-16mirna的量。在有或没有dmso的情况下使用435mm、257mm或138mm的zncl2。分离的mirna的量由ct值表示,其中较高的ct值指示较低的rna量。
实施例
i.实施例1
1.材料
沉淀缓冲液a:(0%dmso;zncl2(1.909m);naoac;酸性ph)
沉淀缓冲液b:(45%(v/v)dmso;zncl2(1.909m);naoac;ph4.0-4.5)。该缓冲液对应于wo2016/009059的沉淀缓冲液xp。
硅胶柱(
收集管(1.5ml和2ml)
洗涤缓冲液rwt(qiagen;含有gtc,在使用前向缓冲液浓缩物rwt添加2体积乙醇(96%-100%))
洗涤缓冲液rpe(qiagen;在使用前向缓冲液浓缩物rpe添加4体积乙醇(96%-100%))
包含硫氰酸胍的裂解缓冲液。
无rna酶的水
2.方法
每种条件重复三次测试。
样品制备
将1ml混合血浆与300μl裂解缓冲液和24μl非离子型洗涤剂接触以破坏样品。通过在室温下涡旋和温育3分钟来支持样品破坏。
蛋白质沉淀
向所述被破坏的样品添加大约100μl沉淀缓冲液a或b,并涡旋20秒。这提供了包含大约140mmzncl2的沉淀混合物。然后将所述样品在冰上温育3分钟。任选地,所述样品也可以在4℃下保存几个小时。通过在>12.000xg/4℃下离心10分钟除去所得的沉淀物。
将含有核酸的贫蛋白质的上清液转移到新的收集管中。
rna结合
将醇(乙醇或异丙醇)添加到使用沉淀缓冲液a或b制备的各上清液中,以在结合混合物中提供以下浓度:
-35%乙醇
-50%异丙醇
-55%异丙醇
通过上下吹吸来混合所述结合混合物。然后将所述结合混合物施加到硅胶离心柱上并在室温下温育。然后,将所述柱以8.000xg离心15秒。
洗涤步骤
为了进一步纯化结合的rna,进行几个洗涤步骤:700μlrwt,以8000xg离心15秒,弃去流过物;500μlrpe,以8000xg离心15秒,弃去流过物;最后,将500μlrpe(或80%乙醇)添加到柱中并以8000xg离心2分钟;弃去流过物。
然后将带有洗涤过的rna的柱转移到新的2ml收集管中。然后将打开盖子的柱以最大rpm离心5分钟,以去除残留的痕量洗涤液。
洗脱
将所述柱转移至新的1.5ml反应容器中。将30μl无rna酶的水加到柱的中间。将所述柱在室温下封闭温育1分钟。然后将其以最大rpm离心1分钟。
3.分析
大rna(肌动蛋白)的分析
cdna合成后,进行β-肌动蛋白qpcr。下表显示了所述测定的平均ct结果:
表1
小rna的分析
将5ul每种洗脱物随后用于cdna合成并使用miscriptmirnapcr阵列进行分析。下表显示了let-7a和mir-16测定的平均ct结果:
表2:
总结
可以看出,当使用本发明的条件时,不需要沉淀混合物中的有机溶剂例如dmso来防止长rna(例如mrna)与蛋白质一起共沉淀。本方法获得了更好的结果(即ct值较低)。使用不同的醇类型和浓度进行rna结合,在不存在有机溶剂的沉淀混合物中使用低浓度氯化锌(小于200mm–在此约为140mm)的条件下,观察到了最佳的mrna回收。使用50-55%异丙醇进行核酸结合,mrna回收特别好。所使用的条件还允许回收小rna(mirna)和dna。
使用本发明的方法可以有效地分离小rna和大rna以及相应地,mirna以及mrna。此外,所述方法允许在上述条件下以相似或更好的结果分离dna(基于18sdna的测试)。
ii.实施例2
为了测试沉淀缓冲液的ph对rna分离的影响,使用了不同ph的沉淀缓冲液。将如实施例1中所述的方法用于分离mrna或小rna。将沉淀缓冲液a的ph调节至3.5、3.7、3.8、3.9、4.0和4.3/4.5作为对照。每种ph调节实行两次,一次用naoh向上调节ph,一次用乙酸向下调节ph。由此,确保了观察到的效果仅基于ph值。分析了肌动蛋白的mrna或小rnalet-7a或mir-16的分离。所有步骤均如实施例1中所述进行。
图1至3显示了rna分离依赖于沉淀缓冲液的ph值的平均ct结果。如同所示,使用ph为4.0或更低的沉淀缓冲液获得了更好的结果(ct值较低)。使用4.3或4.5的ph,观察到高得多的ct值,表明分离的rna的量少得多。对于大rna以及小rna均获得这些结果。
使用本发明的方法,特别是使用ph为4.0或更低的沉淀缓冲液,可以有效地分离小rna和大rna并且相应地,mirna以及mrna。
iii.实施例3
1.材料
沉淀缓冲液a:(0%dmso;zncl2(1.909m);naoac;酸性ph)
沉淀缓冲液b:(45%(v/v)dmso;zncl2(1.909m);naoac;ph4.0-4.5)。该缓冲液对应于wo2016/009059的沉淀缓冲液xp。
硅胶柱(
收集管(1.5ml和2ml)
洗涤缓冲液rwt(qiagen;含有gtc,在使用前向缓冲液浓缩物rwt添加2体积乙醇(96%-100%))
洗涤缓冲液rpe(qiagen;在使用前向缓冲液浓缩物rpe添加4体积乙醇(96%-100%))
包含硫氰酸胍的裂解缓冲液。
无rna酶的水
2.方法
每种条件重复三次测试。
样品制备
将200μl混合血浆与120μl裂解缓冲液接触以破坏样品。通过在室温下涡旋和温育3分钟来支持样品破坏。
蛋白质沉淀
向所述被破坏的样品添加95μl、50μl或25μl的沉淀缓冲液a或b,并涡旋3秒。这提供了分别包含435mm,257nm或138mmzncl2的沉淀混合物。然后将所述样品在冰上温育3分钟。通过在>12.000xg/4℃下离心10分钟除去所得的沉淀物。将含有核酸的贫蛋白质的上清液转移到新的收集管中。
rna结合
将1体积的异丙醇添加到使用沉淀缓冲液a或b制备的各上清液中。通过上下吹吸来混合所述结合混合物,然后将其施加到硅胶离心柱上并在室温下温育。然后,将所述柱以8.000xg离心15秒。
洗涤步骤
为了进一步纯化结合的rna,进行几个洗涤步骤:700μlrwt,以8200xg离心15秒,弃去流过物;500μlrpe,以8200xg离心15秒,弃去流过物;最后,将500μl80%乙醇添加到柱中并以8200xg离心2分钟;弃去流过物。然后将带有洗涤过的rna的柱转移到新的2ml收集管中。然后将打开盖子的柱以最大rpm离心5分钟,以去除残留的痕量洗涤液。
洗脱
将所述柱转移至新的1.5ml反应容器中。将20μl无rna酶的水加到柱的中间。将所述柱在室温下封闭温育1分钟。然后将其以最大rpm离心1分钟。
3.分析
小rna的分析
将4ul每种洗脱物随后用于cdna合成并使用miscriptmirnapcr阵列进行分析。图4显示了mir-16分析依赖于zncl2的量和dmso的存在的平均ct结果。
总结
可以看出,当使用本发明的条件、即没有有机溶剂例如dmso的沉淀缓冲液时,沉淀混合物中较低的zncl2浓度提供了明显更高的分离的mirna量(由较低的ct值指示)。在使用的条件是在沉淀混合物中不存在有机溶剂的情况下使用低浓度氯化锌(小于200mm–在此约为140mm)下,观察到最佳的mirna回收。用其他mirna和mrna也获得了相似的结果。
因此,使用本发明的方法可以有效地分离小rna和大rna并且相应地,可以有效地分离mirna和mrna。
- 还没有人留言评论。精彩留言会获得点赞!