一种包含B细胞及肿瘤双识别性T细胞的免疫细胞药物的制作方法
本发明属于生物医药技术领域,具体而言本发明提供一种免疫细胞治疗药物,这种细胞药物解决了肿瘤识别性t细胞的数量瓶颈难题。
背景技术:
t细胞是肿瘤免疫治疗的主力军,肿瘤免疫治疗的疗效在很大程度上取决于能识别肿瘤的t细胞的数量的多少。目前已经有多种技术手段来收集肿瘤识别性t细胞,包括从肿瘤组织中分离肿瘤浸润t淋巴细胞(til),或者通过高通量测序获得肿瘤新抗原(neoantigen)从而在筛选出来neoantigen反应性t细胞,等等。
一般情况下,晚期肿瘤患者体内的天然存在的能特异识别肿瘤的、且可采集到的t细胞——无论是来自til或是neoantigen反应性t细胞,其总数量与肿瘤细胞总量相比,都是很少的,有可能相差4个数量级(万倍)以上。
另一方面,无论是neoantigen反应性t细胞,还是til,在体外都不可能无限扩增,而且反复刺激扩增容易使t细胞状态过早进入耗竭状态,从而严重影响其治疗效果,这一点对于til尤甚。
因此无论是til或新抗原疗法,都面临肿瘤识别性t细胞数量局限问题,这对于这类肿瘤免疫疗法是非常严重的瓶颈问题和困扰。
另一方面,来自对治b细胞血液肿瘤的大量cd19car-t的临床研究数据表明,靶向cd19、cd20、cd22等b细胞普遍表达的抗原的car-t细胞,可以在体内大量扩增。由此可见,借助患者体内广泛的海量的b细胞的类似疫苗的环境,靶向b细胞的car的t细胞的可在体内大量扩增。
技术实现要素:
上述car-t的临床研究的目的是为治疗b细胞血液肿瘤,本发明的实质是将b细胞对car-t的大幅扩增的效应,作为肿瘤识别性t细胞的辅助扩增体系,应用于实体瘤的治疗中。
本发明通过将靶向b细胞的car表达在肿瘤识别性t细胞上,制备“b细胞&肿瘤——双识别性t细胞”,解决了这一瓶颈问题。
首先双识别性t细胞的前提是这类t细胞是有肿瘤特异识别性的,这是本发明的基础条件,即先要收集患者的肿瘤识别性t细胞,再做靶向b细胞的car的基因改造。
基因改造可以通过慢病毒等体系来实现。转入car的肿瘤识别性t细胞即为“b细胞&肿瘤——双识别性t细胞”。
这类t细胞之所以被称为双识别性,是因为这类t细胞既可通过识别肿瘤新抗原而启动对肿瘤的杀伤,又可以通过识别b细胞而启动对正常b细胞的杀伤。在杀伤b细胞的同时,这类肿瘤识别性t细胞即在体内大量扩增,从而得以更有效的杀伤肿瘤细胞。
本发明应用于临床唯一的风险是这类双识别性t细胞药物有可能杀伤正常b细胞,导致患者体液免疫功能缺陷,但这一风险是有限的:首先当体内不再需要双识别性t细胞的时候,可以通过利用car结构中的表达调控或自杀开关元件的设计,清除双识别性t细胞,从而终止其对b细胞的杀伤;患者可以通过外源性补充免疫球蛋白而弥补这一缺陷,而且大多患者可在2~12个月内恢复b细胞的再生;另一方面,与威胁生命的肿瘤疾病相比,两害相权取其轻,b细胞被清除的风险可以被暂时忽略,正如car-t技术在b细胞血液肿瘤治疗中被广泛应用的情形。
附图表说明:
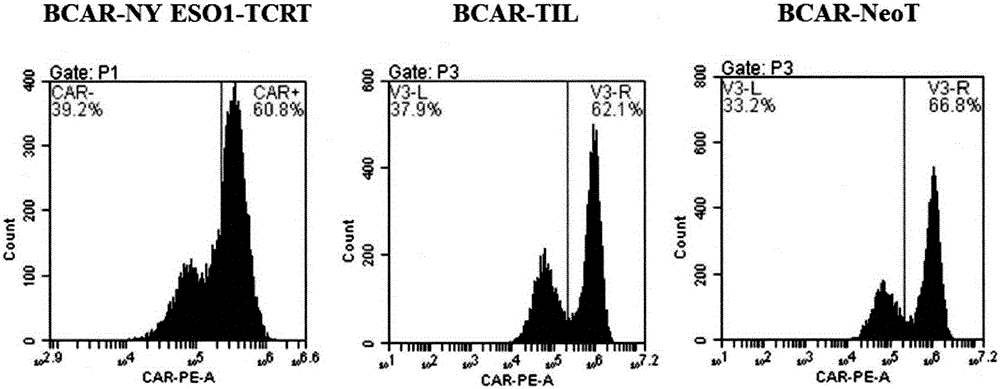
图1.bcar在tcr-t,til及neot中的表达。
图2.bcar在靶向nyes01基因的tcr-t的体外功能试验及扩增。
图3.bcar在til的体外功能试验及扩增。
图4.bcar在neot的体外功能试验及扩增。
图5.bcar-nyes01-tcrt细胞在动物实验中的肿瘤负荷变化。
图6.bcar-til细胞在动物实验中的肿瘤负荷变化。
图7.bcar-neot细胞在动物实验中的肿瘤负荷变化。
具体实施方式
为了更全面地理解和应用本发明,下文将参考实施例和附图详细描述本发明,所述实施例仅是意图举例说明本发明,而不是意图限制本发明的范围。本发明的范围由后附的权利要求具体限定。
实施例一、肿瘤识别性t细胞——靶向肿瘤靶点ny-eso-1的tcr-t细胞的制备
本实施例用靶向肿瘤靶点ny-eso-1的tcr-t细胞模拟单靶点的新抗原反应性t细胞。
静脉采集健康人30ml外周血,,采用ficoll淋巴细胞分离液分离pbmc,贴壁2小时,取悬浮细胞-主要是t细胞。加入识别ny-eso-1的tcr慢病毒载体(hla-a:0201),按照moi(慢病毒数目/细胞数)=5加入慢病毒,培养72h,流式分选出tcr表达阳性的tcr-t细胞,流式检测tcr阳性率在95%以上。
实施例二、肿瘤识别性t细胞——肿瘤浸润t淋巴细胞(til)的制备
取患者肿瘤组织10克或以上,用酶消化法分离出肿瘤组织的细胞,并用cd3磁珠分离纯化出cd3阳性的t细胞,其余细胞贴壁培养获得患者自体的肿瘤细胞。
实施例三、肿瘤识别性t细胞——neoantigen反应性t细胞(neot)的制备
首先,抽取患者外周血或手术切除的肿瘤组织进行全外显子或rna转录组测序;选取突变位点,并结合患者hla分型进行亲和肽预测,选取约20个突变作为neoantigen。基因合成该neoantigen,并体外转录成rna;再次,单采或是直接抽取患者外周血,分离出pbmc并贴壁2小时,取贴壁单核细胞,加入相关细胞因子促进dc细胞分化成熟,并电转rna进入细胞;取悬浮细胞,主要为t细胞,与电转的dc细胞共培养,分离cd137+阳性的t细胞得到新抗原反应性t细胞(以下或简称neot),并扩增该细胞。
实施例四、靶向b细胞的car(以下或简称bcar)的慢病毒载体的制备
选取cd19作为bcar的靶标,构建cd19car,代表bcar。
cd19car慢病毒载体,采用更安全的第四代慢病毒载体系统。将主载体cd19car,及包装载体pmdl-gag,rev,包膜载体pmd2.g,采用磷酸钙或是脂质体pei共转染293t细胞,48小时收集上清,并进行超速离心浓缩慢病毒。
cd19car慢病毒载体的滴度检测,采用3倍倍比稀释,取50ul感染293t细胞,感染48小时至72小时,收集293t细胞进行car染色,流式分析car+细胞的比例,并按照公式进行滴度计算:
滴度(tu/ml)=起始293t细胞数×car+细胞百分比×稀释倍数×20(取第一个pd1+细胞百分比<20%进行计算),计算慢病毒滴度>3×107可进行下一步使用。
实施例五、bcar在前述肿瘤识别性t细胞的转染
根据制备的cd19car慢病毒滴度,按照moi=5,将慢病毒加入前述三种新抗原识别性t细胞(即ny-eso-1-tcr-t,til,neot)中,分别得到bcar-ny-eso-1-tcr-t,bcar-til,bcar-neot,流式检测的结果显示,bcar在三种肿瘤抗原识别性t细胞都有约60%的表达(图1),分别培养并扩增三种t细胞。
实施例六、表达bcar的ny-eso1tcr-t细胞的体外功能试验
为了验证bcar在靶向ny-eso-1的tcr-t中的作用,我们首先构建了hla分型为a:0201的j82-nyeso1-luc的肿瘤细胞系。为了验证bcar-nyeso1-tcrt的双识别性功能,我们首先在24孔板接种1×105数量的j82-nyeso1肿瘤细胞,过夜贴壁后,分成4组进行实验,对照组a组加入2×105数量的t细胞共培养;b组加入2×105数量的bcar-t(car的阳性率为60%)共培养;c组加入2×105数量的ny-eso1tcr-t共培养;d组加入2×105数量的bcar-ny-eso1tcr-t共培养;同时,这四组细胞都加入5×104的b细胞,分别检测:
1、t细胞的扩增情况。共培养48h,96h,分别对t细胞进行计数,如图2a所示,经过4天的共培养,a组t细胞扩增3倍左右;b组bcar-t扩增约12倍;c组nyeso1-tcrt扩增约10倍;而d组bcar-nyeso1-tcrt扩增最多,达到27倍。体外实验的结果表明,在b细胞的刺激环境下,tcr-t在转染cd19car后,数量可以得到大幅扩增。
2、肿瘤细胞的生长情况。共培养48h和96h后,去掉上清液,pbs漂洗3次,裂解贴壁的肿瘤细胞,采用试剂盒测定荧光素酶的活性来指示肿瘤细胞的存活率。图2b共培养48h的体外实验结果提示,在b细胞的刺激环境下,tcr-t在转染bcar后,杀伤肿瘤的能力明显提高。
实施例七、表达bcar的的til的体外功能试验
为了验证cd19car在til中的作用,我们首先将从患者新鲜肿瘤组织分离的肿瘤细胞接种到24孔板,过夜贴壁后,分别加入til和bcar-til共培养,同时所有的分孔中都加入相同数量的b细胞并进行检测:
1、t细胞的数量对比。与肿瘤细胞共培养96h,如图3a所示,til扩增了约10倍,而bcar-til扩增约25倍。体外实验的结果表明,在b细胞的刺激环境下,til在转染cd19car后,数量可以得到大幅扩增。
2、肿瘤细胞的生长情况。共培养96h后,去掉上清液,pbs漂洗3次,裂解贴壁的肿瘤细胞,采用试剂盒测定荧光素酶的活性来指示肿瘤细胞的存活率。图3b的体外实验结果表明,在b细胞的刺激环境下,til在转染bcar后,杀伤肿瘤的能力明显提高。
实施例八、表达bcar的的新抗原反应性t细胞的体外功能实验
为了验证cd19car在neot中的作用,我们首先将从患者新鲜肿瘤组织分离的肿瘤细胞接种到24孔板,过夜贴壁后,分别加入neot和bcar-neot共培养,同时所有的分孔中都加入相同数量的b细胞并进行检测:
1、t细胞的数量对比。与肿瘤细胞共培养96h,如图4a所示,_neot扩增了约9倍,而bcar-neot扩增约23倍。体外实验的结果表明,在b细胞的刺激环境下,neot在转染cd19car后,数量可以得到大幅扩增。
2、肿瘤细胞的生长情况。共培养96h后,去掉上清液,pbs漂洗3次,裂解贴壁的肿瘤细胞,采用试剂盒测定荧光素酶的活性来指示肿瘤细胞的存活率。图4b的体外实验结果表明,在b细胞的刺激环境下,neot在转染bcar后,杀伤肿瘤的能力明显提高。
实施例九、表达bcar的ny-eso-1tcr-t细胞的动物实验
动物模型构建:将1×106数量的肿瘤细胞j82-ny-eso-1皮下接种到nsg小鼠体内,空白对照组皮下注射pbs(a0),注射肿瘤细胞的小鼠,大约两周后开始成瘤,第23天测量肿瘤大小,并选取30只老鼠入组。
给药:空白对照组(a0)尾静脉注射pbs,接种肿瘤细胞的小鼠分成6组,分别为:pbs组(a1);t细胞组(a2);bcar-t细胞组(a3);ny-eso-1tcr-t细胞组(a4);bcar&ny-eso-1tcrt双识别性t细胞组(a5);ny-eso-1tcr-t细胞高剂量组(a6)。给药方式:a1-5组均为1×104个t细胞尾静脉静脉输注,a6组为1×107个t细胞尾静脉输注,所有组均输注1×107个b细胞。
给药后,每2-3天进行肿瘤大小的测量及小鼠状态观察,肿瘤体积=1/2*长径*短径*短径,持续观察28天。
一、肿瘤负荷变化:
荷瘤小鼠在给药后的一周,肿瘤体积持续增长,第7天,检测到a4、a5和a6组肿瘤开始缩小,但a4组肿瘤缩小幅度不明显,并在第11天开始反弹并继续生长,a6组有明显缩小,但在第16天开始反弹;而a5组持续缩小至几近消失,第23天肿瘤才开始反弹。其他三组肿瘤均保持自然生长(图5)。
二、输注的t细胞在体内的总量变化:
在给药的四个组,给药之后第10天,从2、3、4、5组抽取外周血,使用流式方法检测cd3进行估计t细胞的总量,其结果分别为2.11×105,1.91×107,1.52×106,5×107,提示带bcar的a3、a5组所获得的t细胞总量远远超过a4组,表明bcar-t细胞以及b细胞&肿瘤——双识别性t细胞可以在体内大幅扩增。
实施例十、表达bcar的til细胞的动物实验
动物模型构建:将分离自新鲜肿瘤组织的1×106数量的肿瘤细胞皮下接种到nsg小鼠体内,空白对照组皮下注射pbs(a0),注射肿瘤细胞的小鼠,大约两周后开始成瘤,第25天测量肿瘤大小,并选取30只老鼠入组。
给药:空白对照组(a0)尾静脉注射pbs,接种肿瘤细胞的小鼠分成5组,分别为:不给药-pbs组(a1);t细胞组(a2);bcar-t细胞组(a3);til细胞组(a4);bcar-til细胞组(a5)。给药方式:a1~5组均为1×104个t细胞尾静脉输注,所有组均输注1×107个b细胞。给药后,每2-3天进行肿瘤大小的测量及小鼠状态观察,肿瘤体积=1/2*长径*短径*短径,持续观察28天。
一、肿瘤负荷变化:
荷瘤小鼠在给药后的一周,肿瘤体积持续增长,第6天,检测到a4、a5组肿瘤开始缩小,但a4组肿瘤缩小幅度不明显,并在第14天开始反弹并继续生长,a5组持续缩小至几近消失,第21天肿瘤才开始反弹。其他三组肿瘤均保持自然生长(图6)。
二、输注的t细胞在体内的总量变化:
在给药的四个组,给药之后第10天,从2、3、4、5组抽取外周血,使用流式方法检测cd3进行估计t细胞的总量。其结果分别为1.87×105,1.57×107,9.52×106,3×107,提示带bcar的a3、a5组所获得的t细胞总量远远超过a4组,表明bcar-t细胞以及b细胞&肿瘤——双识别性t细胞可以在体内大幅扩增。
实施例十、表达bcar的新抗原反应性t细胞的动物实验
动物模型构建:将分离自新鲜肿瘤组织的1×106肿瘤细胞皮下接种到nsg小鼠体内,空白对照组皮下注射pbs(a0),注射肿瘤细胞的小鼠,大约两周后开始成瘤,第23天测量肿瘤大小,并选取30只老鼠入组。
给药:空白对照组(a0)尾静脉注射pbs,接种肿瘤细胞的小鼠分成6组,分别为:不给药-pbs组(a1);t细胞组(a2);bcar-t细胞组(a3);普通neot细胞组(a4);bcar-neot双识别性t细胞组(a5);普通neot细胞高剂量组(a6)。给药方式:a1~5组均为1×104个t细胞尾静脉静脉输注,a6组为1×107个t细胞尾静脉输注,所有组均输注1×107个b细胞。
给药后,每2-3天进行肿瘤大小的测量及小鼠状态观察,肿瘤体积=1/2*长径*短径*短径,持续观察28天。
一、肿瘤负荷变化:
荷瘤小鼠在给药后的一周,肿瘤体积持续增长,第9天,检测到a4、a5和a6组肿瘤开始缩小,但a4组第11天反弹,a6组在第18天开始反弹;而a5组持续缩小至几近消失,第23天肿瘤才开始反弹。其他三组肿瘤均保持自然生长(图7)。
二、输注的t细胞在体内的总量变化:
在给药的四个组,给药之后第10天,从2、3、4、5组抽取外周血,使用流式方法检测cd3进行估计t细胞的总量。其结果分别为1.65×105,1.23×107,1,02×107,3.15×107,提示带bcar的a3、a5组所获得的t细胞总量远远超过a4组,表明bcar-t细胞以及b细胞&肿瘤——双识别性t细胞可以在体内大幅扩增。
上述b细胞&肿瘤——双识别性t细胞的动物实验表明:
1.b细胞&肿瘤——双识别性t细胞可以借助b细胞刺激实现大幅扩增。
a6组双识别性t细胞可以在体内大幅扩增,达到和car-t细胞相同数量级的数量。
2.同样是小剂量回输,b细胞&肿瘤——双识别性t细胞可以取得更好的疗效。
a5组双识别性t细胞在体内大幅扩增后,可以起到明显增强肿瘤特异杀伤的效果,效果远超小剂量回输的肿瘤识别性t细胞组,堪比大剂量肿瘤识别性t细胞组甚至可能更强。
数据表明,b细胞&肿瘤——双识别性t细胞可在小鼠体内扩增迅速并实现明显肿瘤抑制效果,无论是扩增效果还是疗效上,都远超给予同样小剂量给予肿瘤识别性t细胞组。
- 还没有人留言评论。精彩留言会获得点赞!