用于检测眼内液中白色念珠菌的LAMP引物组合及应用的制作方法
本发明涉及一种用于检测眼内液中白色念珠菌的lamp引物组合及应用。
背景技术:
真菌性眼内炎是一种对视力威胁极大的感染性眼部疾病,致盲率高,发病潜伏期长,通常数周甚至数月。早期临床症状不明显,诊断困难,因此,在临床上,尤其发病初期常被误诊而贻误治疗。临床抗真菌药物疗效不足且不良反应较大,真菌对眼部组织破坏性强等原因导致真菌性眼内炎的预后差。近年来,随着术后及慢性炎症大量滥用皮质类固醇激素、抗菌素及免疫制剂,致使人体菌群失调,免疫功能下降,真菌性眼内炎发病率逐年上升。真菌性眼内炎分为内源性眼内炎和外源性眼内炎两种。内源性真菌性眼内炎是由真菌通过血行播散到达眼部引起眼内感染所致,患者通常有长期使用激素、抗生素或免疫抑制剂,或糖尿病、恶性肿瘤、免疫缺陷等病史。最常见的致病真菌为白色念珠菌和曲霉菌。外源性真菌性眼内炎继发于穿通性眼外伤、内眼手术后或真菌性角膜炎,继发于内眼手术后的真菌性眼内炎多由曲霉菌引起。
白色念珠菌(moniliaalbican或canidiaalbicans)又称白假丝酵母菌,当机体免疫功能或一般防御力下降或正常菌群相互制约作用失调,则本菌大量繁殖并改变生长形式(芽生菌丝相)侵入细胞引起疾病。念珠菌眼内炎症通过血行播散或手术时直接接种感染,表现为视物模糊、漂浮盲点和眼痛。
目前临床针对真菌的检测方法主要是分离培养、涂片镜检和血清学诊断。这些检测方法繁琐,检测时间长,阳性率低,且容易发生漏检和错检,无法满足临床快速检测的要求。近几年发展起来的分子检测技术,特别是pcr技术,在微生物快速鉴定和检测方面的应用,为真菌的快速检测开辟了新的途径。但是,pcr存在检测时间长、易污染、假阳性率高的缺点,使其应用受到限制。环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)是近年来发展出的一种敏感、特异、简便、快捷的核酸扩增技术,其原理是在一种具有链置换活性的dna聚合酶的作用下,识别6-8个区域的4-6条引物,在等温条件下快速、特异地扩增目的基因,可推广应用于快速、准确的检测真菌。
技术实现要素:
本发明的目的是提供一种用于检测眼内液中白色念珠菌的lamp引物组合及应用。
本发明提供了引物组合,由引物f3、引物b3、引物fip、引物bip、引物lf和引物lb组成;
所述引物f3为如下(a1)或(a2):
(a1)序列表的序列1所示的单链dna分子;
(a2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的dna分子;
所述引物b3为如下(a3)或(a4):
(a3)序列表的序列2所示的单链dna分子;
(a4)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的dna分子;
所述引物fip为如下(a5)或(a6):
(a5)序列表的序列3所示的单链dna分子;
(a6)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的dna分子;
所述引物bip为如下(a7)或(a8):
(a7)序列表的序列4所示的单链dna分子;
(a8)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的dna分子;
所述引物lf为如下(a9)或(a10):
(a9)序列表的序列5所示的单链dna分子;
(a10)将序列5经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列5具有相同功能的dna分子;
所述引物lb为如下(a11)或(a12):
(a11)序列表的序列6所示的单链dna分子;
(a12)将序列6经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列6具有相同功能的dna分子。
所述引物组合的用途为如下(b1)或(b2)或(b3)或(b4):
(b1)鉴定或辅助鉴定待测真菌是否为白色念珠菌;
(b2)制备用于鉴定或辅助鉴定待测真菌是否为白色念珠菌的试剂盒;
(b3)检测待测样本是否感染了白色念珠菌;
(b4)制备用于检测待测样本是否感染了白色念珠菌的试剂盒。
本发明还保护所述引物组合的应用,如下(b1)或(b2)或(b3)或(b4):
(b1)鉴定或辅助鉴定待测真菌是否为白色念珠菌;
(b2)制备用于鉴定或辅助鉴定待测真菌是否为白色念珠菌的试剂盒;
(b3)检测待测样本是否感染了白色念珠菌;
(b4)制备用于检测待测样本是否感染了白色念珠菌的试剂盒。
本发明还保护含有所述引物对的试剂盒;所述试剂盒的用途为如下(c1)或(c2):
(c1)鉴定或辅助鉴定待测真菌是否为白色念珠菌;
(c2)检测待测样本是否感染了白色念珠菌。
本发明还保护所述试剂盒的制备方法,包括将各条引物单独包装的步骤。
本发明还保护鉴定待测真菌是否为白色念珠菌方法,包括如下步骤:以待测真菌的基因组dna为模板,采用所述引物组合进行lamp扩增反应,如果采用所述引物组合可以实现以所述基因组dna为模板的阳性扩增、待测真菌为白色念珠菌,如果采用所述引物组合不能实现以所述基因组dna为模板的阳性扩增、待测真菌为非白色念珠菌。
本发明还保护鉴定待测真菌是否为白色念珠菌方法,包括如下步骤:检测待测真菌的基因组dna中是否存在所述引物组合的靶序列,如果所述基因组dna中存在所述引物组合的靶序列、待测真菌为白色念珠菌,如果所述基因组dna中不存在所述引物组合的靶序列、待测真菌为非白色念珠菌。
本发明还保护检测待测样本是否感染了白色念珠菌的方法,包括如下步骤:以待测样本的总dna为模板,采用所述引物组合进行lamp扩增反应,如果采用所述引物组合可以实现以所述总dna为模板的阳性扩增、待测样本感染了白色念珠菌,如果采用所述引物组合不能实现以所述总dna为模板的阳性扩增、待测样本没有感染白色念珠菌。
本发明还保护检测待测样本是否感染了白色念珠菌的方法,包括如下步骤:检测待测样本的总dna中是否存在所述引物组合的靶序列,如果所述总dna中存在所述引物组合的靶序列、待测样本感染了白色念珠菌,如果所述总dna中不存在所述引物组合的靶序列、待测样本没有感染白色念珠菌。
以上任一所述方法中,具体可通过如下方法判断“阳性扩增”:用荧光pcr仪检测荧光信号,如果出现阳性扩增曲线则为阳性扩增。所述阳性扩增曲线具体可为s型扩增曲线。
以上任一所述采用引物组合进行lamp扩增的反应体系中,引物组合中各条引物的浓度为:0.5μmf3、0.5μmb3、2μmfip、2μmbip、1μmlf、1μmlb。
以上任一所述采用引物组合进行lamp扩增的反应体系具体可为:1μl10×thermopolbuffer,1.6μl5m甜菜碱,0.1μl50mg/mlbsa,0.4μl100mmmgso4,0.3μl20×evagreen,0.15μl100mmdntps,0.4μl8u/mlbstdna聚合酶大片段,1μl引物混合物(f3、b3、fip、bip、lf和lb的混合物),模板dna(50pg-50ng,具体可为2ng),用ddh2o补足至10μl。
以上任一所述lamp扩增的反应程序具体可为:65℃恒温50min。
以上任一所述待测样本具体可为眼部临床样本培养物、眼液体或抽吸物。
以上任一所述待测真菌具体可为白色念珠菌、烟曲霉菌、黄曲霉菌或光滑念珠菌。
本发明提供了一种用于检测眼内液中白色念珠菌的lamp引物组合及应用。本发明所述的lamp引物组合包括外引物f3和b3,内引物fip和bip以及环引物lf和lb,可特异性识别靶序列上的六个独立区域进行扩增,具有高特异性。应用本发明的lamp引物及方法,可快速、准确的检测出白色念珠菌。
附图说明
图1为实施例3的lamp扩增曲线图。
图2为实施例5的lamp扩增曲线图。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
白色念珠菌:atcc90028。
烟曲霉菌:atcc10894。
黄曲霉菌:atcc16870。
光滑念珠菌:atcc2001。
实施例1、引物设计及制备
进行大量序列分析、比对获得了用于鉴定白色念珠菌的若干引物。将各个引物进行预实验,比较灵敏度、特异性等性能,最终得到用于鉴定白色念珠菌的lamp引物组。
用于鉴定白色念珠菌的引物组,包括2条外引物(f3、b3),2条内引物(fip、bip)和2条环引物(lf、lb),各条引物序列如下所示(5’→3’):
f3(序列表的序列1):cgatacgtaatatgaattgcagat;
b3(序列表的序列2):ccattgtcaaagcgatcc;
fip(序列表的序列3):aggcatgccctccggaatactcgtgaatcatcgaatctttgaac;
bip(序列表的序列4):gagcgtcgtttctccctcaaaccgccttaccactaccgtctt;
lf(序列表的序列5):agagggcgcaatgtgc;
lb(序列表的序列6):tgttgagcaatacgacttgggtttg。
实施例2、检测方法建立
1、提取待测真菌的基因组dna或提取待测生物样本的总dna。
2、取步骤1得到的dna,作为模板,采用实施例1中制备的lamp引物组进行lamp扩增。
lamp扩增的反应体系:1μl10×thermopolbuffer,1.6μl5m甜菜碱,0.1μl50mg/mlbsa,0.4μl100mmmgso4,0.3μl20×evagreen,0.15μl100mmdntps,0.4μl8u/mlbstdna聚合酶大片段,1μl引物混合物(f3、b3、fip、bip、lf和lb的混合物),2ng模板dna,用ddh2o补足至10μl。反应体系中各引物的浓度如下:0.5μmf3、0.5μmb3、2μmfip、2μmbip、1μmlf、1μmlb。
lamp扩增的反应程序:65℃恒温50min。反应过程中,采用荧光pcr仪检测荧光信号。
如果采用所述lamp引物组可以得到阳性扩增曲线,表明待测真菌为白色念珠菌或待测样本含有白色念珠菌,如果不可以得到阳性扩增曲线,表明待测真菌不为白色念珠菌或待测样本不含有白色念珠菌。
实施例3、特异性
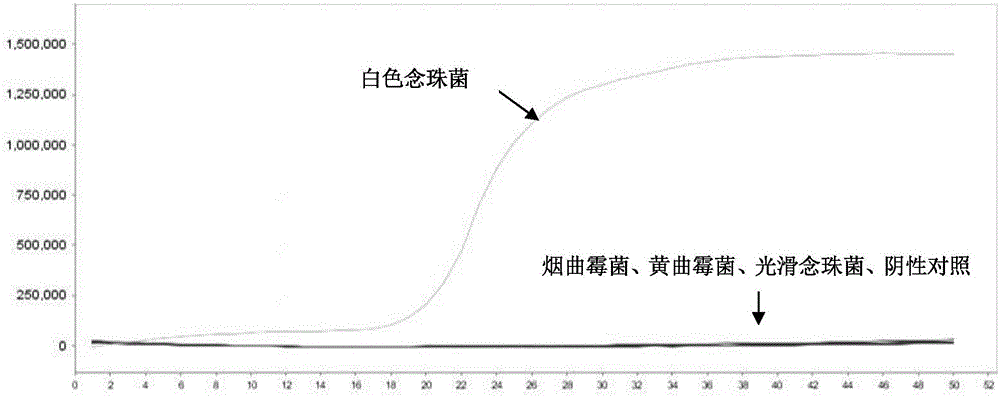
待测菌:白色念珠菌、烟曲霉菌、黄曲霉菌和光滑念珠菌。
提取待测菌的基因组dna,采用实施例2的检测方法进行检测。设置采用水作为模板dna的阴性对照。
结果见图1。图1中,横坐标为循环数,纵坐标为荧光信号强度。结果表明,白色念珠菌基因组dna得到s型扩增曲线,扩增结果为阳性,烟曲霉菌基因组dna、黄曲霉菌基因组dna和光滑念珠菌基因组dna均没有得到s型扩增曲线,扩增结果为阴性。
结果表明,实施例1制备的lamp引物组具有很高的特异性。
实施例4、灵敏度
待测样本:白色念珠菌基因组dna。
1、用无菌水10倍梯度稀释待测样本,得到各稀释液。
2、分别取步骤1得到的各稀释液作为模板,采用实施例2的检测方法进行检测。
由于采用的稀释度不同,形成如下不同的反应体系:
反应体系1中,基因组dna的初始含量为:10000个拷贝;
反应体系2中,基因组dna的初始含量为:1000个拷贝;
反应体系3中,基因组dna的初始含量为:500个拷贝;
反应体系4中,基因组dna的初始含量为:100个拷贝。
结果表明,白色念珠菌基因组dna含量为500-10000个拷贝时得到s型扩增曲线,白色念珠菌基因组dna浓度为100个拷贝时没有得到s型扩增曲线。
结果表明实施例1制备的lamp引物组具有较高的灵敏度。
实施例5、临床样本检测
待测样本为:经过临床鉴定为白色念珠菌阳性的眼部抽吸物样本(样本1)和经过临床鉴定不存在白色念珠菌的健康者的眼部抽吸物样本(样本2)。
提取待测样本的总dna,采用实施例2的检测方法进行检测。设置采用水作为模板dna的阴性对照,设置采用白色念珠菌的基因组dna作为模板的阳性对照。
结果见图2。图2中,横坐标为循环数,纵坐标为荧光信号强度。结果表明,只有样本1和阳性对照得到s型扩增曲线,样本2和阴性对照没有得到s型扩增曲线,与临床鉴定结果相符。
结果表明,使用实施例1制备的lamp引物组进行白色念珠菌鉴定,对于人正常基因组来说不存在非特异性扩增,结果准确可靠。
<110>北京智德臻和医学检验所有限公司
<120>用于检测眼内液中白色念珠菌的lamp引物组合及应用
<160>6
<210>1
<211>24
<212>dna
<213>人工序列
<220>
<223>
<400>1
cgatacgtaatatgaattgcagat24
<210>2
<211>18
<212>dna
<213>人工序列
<220>
<223>
<400>2
ccattgtcaaagcgatcc18
<210>3
<211>44
<212>dna
<213>人工序列
<220>
<223>
<400>3
aggcatgccctccggaatactcgtgaatcatcgaatctttgaac44
<210>4
<211>42
<212>dna
<213>人工序列
<220>
<223>
<400>4
gagcgtcgtttctccctcaaaccgccttaccactaccgtctt42
<210>5
<211>16
<212>dna
<213>人工序列
<220>
<223>
<400>5
agagggcgcaatgtgc16
<210>6
<211>25
<212>dna
<213>人工序列
<220>
<223>
<400>6
tgttgagcaatacgacttgggtttg25
- 还没有人留言评论。精彩留言会获得点赞!