一种高效富集水牛细胞蛋白质的方法与流程
本发明涉及蛋白质提取技术领域,特别涉及一种高效富集水牛细胞蛋白质的方法。
背景技术:
中国水牛均为沼泽型,原为南部地区的役畜,后来随着农业机械化,水牛乳肉价值逐渐取代了其役用价值,但是中国水牛繁殖效率低,又使其乳肉价值得不到很好的开发,而生殖细胞成熟质量是影响水牛繁殖率的主要原因之一,这种复杂性主要表现在转录、翻译和翻译后修饰及调控网络上。蛋白质是生命功能的执行者,采用高通量的蛋白质组学技术可大规模发现蛋白质的表达和翻译后修饰,有助于从整体上揭示生殖细胞发育的蛋白质调控网络,筛选和鉴定关键基因或生物标志物,所以有必要对水牛的卵母细胞及早期胚胎的蛋白质组进行研究,以期为提高水牛繁殖能力奠定基础。
2014年,Daniela R.Deutsch等人利用1600个卵母细胞或者早期胚胎共鉴定到1072种蛋白质;2015年,陈富美等人利用1000个GV期和MII期的水牛卵母细胞鉴定到574种蛋白质;2016年,陈凌声等人从522个GV期和545个MII期水牛卵母细胞中分别鉴定到647和570种蛋白质,水牛卵母细胞及早期胚胎材料极为珍贵,传统的蛋白质组学方法对细胞样品上样量要求需要上千个细胞,而常规的蛋白质分离纯化方法不能高效富集水牛卵母细胞及早期胚胎的微量蛋白质,给水牛的繁殖研究带来了一定的困难,所以迫切需要找出一种可高效富集水牛卵母细胞及早期胚胎微量蛋白质的方法,能有效的提高蛋白质提取效率,满足分析所需上样量的需求,从而实现水牛微量生物样品甚至单个细胞蛋白的蛋白质组学研究。
技术实现要素:
鉴于上述内容,有必要提供一种可高效富集水牛卵母细胞及早期胚胎微量蛋白质的方法,能有效的提高蛋白质提取效率,满足分析所需上样量的需求,从而实现水牛微量生物样品甚至单个细胞蛋白的蛋白质组学研究。
为达到上述目的,本发明所采用的技术方案是:
一种高效富集水牛细胞蛋白质的方法,所述方法为:先将磁珠进行预处理得到均质磁珠溶液,然后富集水牛细胞并将其放在冰上进行第一次裂解;向第一次裂解后的水牛细胞加入均质磁珠溶液和三氟代乙醇的混合物并进行第二次裂解;然后对第二次裂解液进行蛋白质纯化、肽段回收得到富集后的水牛细胞蛋白质;
进一步的,所述水牛细胞为水牛卵母细胞或水牛早期胚胎细胞;所述水牛早期胚胎细胞包括孤雌激活胚胎细胞和体外受精胚胎细胞:
所述水牛卵母细胞的富集方法包括以下步骤:
(1)预处理卵巢:剪去水牛卵巢多余组织,用39℃的双抗生理盐水清洗2-3遍,清洗完后将卵巢置于39℃左右的双抗生理盐水中,并在39℃的恒温水浴条件下保温完成水牛卵巢预处理;
(2)用含有1-2mL洗卵液的10mL注射器抽取步骤(1)预处理后卵巢表面的卵泡,将抽取的卵泡液连同洗卵液一起放入60mm的捡卵皿中,在体式显微镜下挑选卵丘卵母细胞复合体,剔除裸卵和蜘蛛网状卵;
(3)将步骤(2)挑选的卵丘卵母细胞复合体依次用洗卵液和成熟液各清洗2-3遍,然后置于成熟液中并放在39℃含有体积百分数为5%二氧化碳的培养箱中培养22-24h后,用 200μL的移液器吹打成熟后的卵母细胞至周围无颗粒细胞,然后向卵母细胞中加入链酶蛋白酶去除透明带,用DPBS缓冲液清洗2-3遍后装于PCR管中并置于-80℃保存,完成水牛卵母细胞的富集;
所述孤雌激活胚胎细胞的制备方法为:将裸露的MII期卵母细胞在5mol/L的离子霉素中处理5min,然后用2mmol/L的6-DMHP溶液处理4-6h,将处理好的卵母细胞在培养液中清洗2-3遍,移入培养液中进行培养,收集分裂至2-细胞期的早期胚胎,然后向2-细胞用中加入链酶蛋白酶去除透明带,用DPBS缓冲液清洗2-3遍后装于PCR管中并置于-80℃保存,得到孤雌激活胚胎细胞;所述培养的培养时间为24h;
所述体外受精胚胎细胞的制备方法为:将裸露的MII期卵母细胞在受精液中洗2-3遍,移入受精液中进行受精,所述培养的滴液每滴含有15-20个MII期卵母细胞,每滴加入处理后的精液15μl,在培养箱中受精6-8h,吹掉死精子,将受精后的卵母细胞移入单层颗粒细胞中共同培养12h后,收集分裂至2-细胞的早期胚胎,然后向2-细胞用中加入链酶蛋白酶去除透明带,用DPBS缓冲液清洗2-3遍后装于PCR管中并置于-80℃保存,得到体外受精胚胎细胞。
进一步的,所述洗卵液含有如下成分:质量百分数为0.99%的TCM199溶液、NaHCO3溶液5mmol/L、Hepes缓冲液20mmol/L、肝素钠0.004μg/ml、新生牛血清3%、青霉素 600mg/L、链霉素100mg/L,余量为水,PH为7.2-7.4;
所述成熟液含有如下成分:质量百分数为0.99%的TCM199溶液、NaHCO3溶液 5mmol/L、Hepes缓冲液20mmol/L、质量百分数为10%的胎牛血清、乳酸钠0.026%、卵泡刺激素0.5μg/ml、促黄体生成素5μg/ml,余量为水,PH为7.2-7.4;
所述受精液含有如下成分:质量百分数为1.2916%的Tyrode’s液(台氏液)、肝素钠溶液20μg/ml、2.0mmol/L咖啡因、牛血清白蛋白6.0mg/ml,余量为水,pH 7.5-7.8;
所述培养液含有如下成分:体积百分数为54%的所述受精液、体积百分数为36%的所述成熟液、体积百分数为10%的胎牛血清,pH 7.2-7.4。
进一步的,所述磁珠进行预处理的方法包括如下步骤:
①将保存在4℃下的亲水性磁珠A和疏水性磁珠B取出分别放置在室温下摇匀;
②分别取20μl步骤①的亲水性磁珠A、疏水性磁珠B和160μl超纯水混合,并置于 PCR管内混匀;
③将步骤②含有磁珠的PCR管置于磁力架上静置,待磁珠吸附至管底后去掉上清;
④将步骤③的PCR管从磁力架上取下,加入超纯水200μl混匀,重新放置磁力架上静置,待磁珠吸附至管底后去掉上清,此步骤重复3次;
⑤向步骤④的PCR管中加入超纯水100μl混匀,4℃长期保存。
进一步的,所述第一次裂解的方法为:取富集的水牛细胞1-25个,向水牛细胞中加入20 μl的裂解液并放置在温度为-2℃~0℃的冰上裂解10min。
进一步的,所述第二次裂解的方法包括如下步骤:
A、将第一次裂解后的溶液:预处理磁珠:三氟代乙醇按照体积比为5:1:5进行混合;
B、将步骤A的混合物放入冰浴中进行超声处理,所述超声处理的处理方式为间隔超声处理,按照“超声5s-间隔30s-超声5s”的处理方式进行循环,超声处理的总时长为15min;超声处理后进行2s的离心处理得到第二次裂解液;
C、向步骤B离心处理后的第二次裂解液中加入质量百分数为0.1%的甲酸0.75μl,混匀;
D、将步骤C的混合液放入PCR仪中反应,反应条件为:95℃6min,0℃50s,45℃30 min;
E、向步骤D反应液中加入400mmol的吲哚-3-乙酸5μl,在室温下孵育30min;
F、步骤E孵育结束后,向反应液中加入200mmol的二硫苏糖醇5μl,终止反应。
进一步的,所述蛋白质纯化的方法包括如下步骤:
步骤1:取第二次裂解后得到的混合液54.75μl与质量百分数为1%的甲酸溶液10μl均匀混合;
步骤2:向步骤1的混合液中加入乙腈溶液,使乙腈最终的质量浓度达到50%;
步骤3:将步骤2的混合液在室温下静置8min,然后再放置在磁力架上静置2min,待磁珠吸附至管底,去掉上清;
步骤4:在磁力架上,用200μl体积百分数为70%的乙醇,清洗磁珠两次,最后用200 μl的乙腈清洗磁珠一次,开盖室温干燥至磁珠龟裂;
步骤5:向步骤4干燥后的磁珠加入酶解溶液进行酶解,保证磁珠包含在酶解溶液中,无需混匀,在37℃条件下静置14h-24h。
进一步的,所述肽段回收的方法包括如下步骤:
步骤A:重悬酶解后的磁珠,加入乙腈溶液在PCR管中混匀,使其终浓度达到95%;在室温下静置8min;
步骤B:将步骤A静置后的PCR管磁珠混合液置于磁力架上,待磁珠吸附至管底,去掉上清;用200μl乙腈清洗磁珠一次,开盖室温干燥至磁珠龟裂;
步骤C:向步骤B的PCR管内加入质量百分数为2%的二甲基亚砜溶液10μl对磁珠进行复溶,保证磁珠包含在二甲基亚砜溶液中并进行超声处理;所述超声处理的处理方式为间隔超声处理,按照“超声5s-间隔30s-超声5s”的处理方式进行循环,超声处理的总时长为 1min;超声处理后进行2s的离心处理;
步骤D:将步骤C离心处理后的PCR管置于磁力架上,室温静置2min,待磁珠吸附至管底,回收上清液至新的PCR管,得到回收液I;
步骤E:将含有步骤D回收液I的PCR管再置于磁力架上,进行第二次回收,确保上清内不含有磁珠,得到回收液II,将回收液II放入1μl质量百分浓度为1%甲酸溶液中在-20℃条件下保存,完成肽段回收过程。
本发明具有如下有益效果:
1、本发明采用了非接触式超声破碎样品结合磁珠进行蛋白质富集的方法,大大减少了样品使用量并提高了蛋白质的提取效率,磁珠是一种以铁的氧化物或硫化物为核心的表面包裹一层高分子以及稳定性好的物质,利用这些物质表面的功能集团进行抗体的共价或者非共价偶联抗原,最后在磁场外力的作用下达到分离蛋白质的作用,本申请的选用亲水性磁珠和疏水性磁珠相混合对蛋白质进行吸附,本申请的羧基磁珠具有单分散性、超顺磁性、高羧基含量、快速磁响应性和亚微米尺度粒径等特点,在特殊化学试剂的作用下能够将蛋白质、多肽、寡聚核苷酸等生物配体共价偶联到微球表面,是一种富集微量蛋白质的高效方法;在水牛卵母细胞和胚胎早期蛋白质的处理纯化过程中,仅采用磁珠吸附还是不能有效富集相关蛋白质,这是因为,磁珠还不能特异性的选择水牛卵母细胞,如果要做到有效富集蛋白质则需要对水牛卵母细胞进行有效预处理,而且水牛的早期胚胎细胞也是需要经过预处理得到的,并不能直接从自然界中获取,为此,如果要有效解决微量样品无法满足蛋白质组学研究所需样本量的瓶颈问题需要合理的对水牛卵母细胞和水牛早期胚胎细胞进行有效预处理;因此,发明人采用了非接触式超声破碎法对水牛卵母细胞和水牛早期胚胎细胞进行预处理,能使水牛卵母细胞和水牛早期胚胎细胞释放到混合液中,被磁珠吸附后杂质少,从而达到高效富集。
【附图说明】
图1是卵母细胞的不同单细胞数所对应的蛋白质种数结果图;
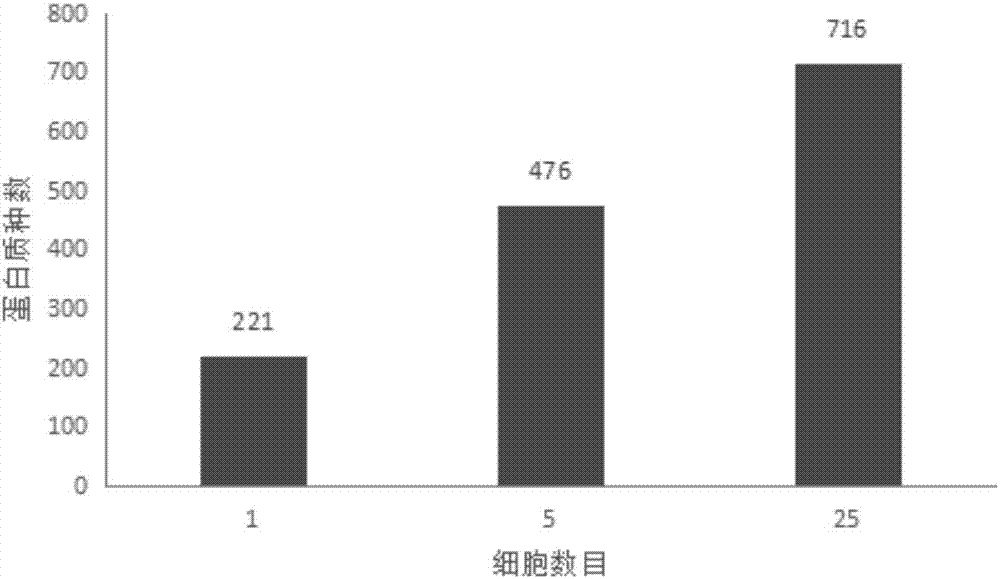
图2是2-细胞期早期胚胎细胞的不同单细胞数所对应的蛋白质种数结果图。
【具体实施方式】
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
实施例:
本实施例纯化水牛细胞蛋白质的方法为:先将磁珠进行预处理得到均质磁珠溶液,然后富集水牛细胞并将其放在冰上进行第一次裂解;向第一次裂解后的水牛细胞加入均质磁珠溶液和三氟代乙醇的混合物并进行第二次裂解;然后对第二次裂解液进行蛋白质纯化、肽段回收得到富集后的水牛细胞蛋白质;
上述水牛细胞为水牛卵母细胞或水牛早期胚胎细胞;其中,水牛早期胚胎细胞包括孤雌激活胚胎细胞和体外受精胚胎细胞:
本实施例所使用水牛卵巢由南宁肉联食品加工厂提供;
1、细胞收集:
将水牛卵巢送至实验室后,先用剪刀去掉多余组织,并用39℃左右的双抗生理盐水清洗2-3遍,清洗完后将卵巢置于39℃左右的双抗生理盐水中,并放置在39℃的恒温水浴锅中保温备用。然后用含有1-2mL洗卵液的10mL注射器抽取卵巢表面的卵泡,将抽取的卵泡液连同洗卵液一起放入60mm的捡卵皿中,在体式显微镜下挑选卵丘卵母细胞复合体(COCs),且剔除裸卵和蜘蛛网状卵。
将COCs依次用洗卵液和成熟液各清洗2-3遍后置于成熟液中并放在39℃含有5%二氧化碳的培养箱中培养22-24 h后,用200uL的移液器吹打成熟后的卵母细胞至周围无颗粒细胞,分别进行以下处理:
①孤雌激活:将裸露的MII期卵母细胞在5mol/L的离子霉素中处理5min,然后2mmol/L 的6-DMHP处理4-6h,将处理好的卵母细胞在培养液中清洗2-3遍转入到用培养液做的滴中培养,在培养箱中培养24h后收集分裂至2-细胞期的早期胚胎。
②体外受精:将裸露的MII期卵母细胞在受精液中洗2-3遍,移入含有40ul受精液的滴中,每滴15-20个细胞,每滴加入处理后的精液15ul,在培养箱中长时间受精6-8h,吹掉死精子,将受精后的卵母细胞移入单层颗粒细胞中共同培养12h后,收集分裂至2-细胞的早期胚胎。
将收集的卵母细胞或者2-细胞用链酶蛋白酶去除透明带,DPBS缓冲液清洗2-3遍后装于PCR管中,-80℃保存备用。
上述洗卵液含有如下成分:质量百分数为0.99%的TCM199溶液、NaHCO3溶液5mmol/L、 Hepes缓冲液20mmol/L、肝素钠0.004μg/ml、新生牛血清3%、青霉素600mg/L、链霉素100 mg/L,余量为水,PH为7.2-7.4;
上述成熟液含有如下成分:质量百分数为0.99%的TCM199溶液、NaHCO3溶液 5mmol/L、Hepes缓冲液20mmol/L、质量百分数为10%的胎牛血清、乳酸钠0.026%、卵泡刺激素0.5μg/ml、促黄体生成素5μg/ml,余量为水,PH为7.2-7.4;
上述受精液含有如下成分:质量百分数为1.2916%的Tyrode’s液(台氏液)、肝素钠溶液20μg/ml、2.0mmol/L咖啡因、牛血清白蛋白6.0mg/ml,余量为水,pH 7.5-7.8;
上述培养液含有如下成分:体积百分数为54%的所述受精液、体积百分数为36%的所述成熟液、体积百分数为10%的胎牛血清,pH 7.2-7.4。
2、磁珠预处理方法:
①将保存在4℃下的亲水性磁珠A和疏水性磁珠B取出分别放置在室温下摇匀;
②分别取步骤①的亲水性磁珠A(20μl)、疏水性磁珠B(20μl)和160μl超纯水混合,并置于PCR管内混匀;
③将步骤②含有磁珠的PCR管置于磁力架上静置,待磁珠吸附至管底后去掉上清;
④将步骤③的PCR管从磁力架上取下,加入超纯水200μl混匀,重新放置磁力架上静置,待磁珠吸附至管底后去掉上清,此步骤重复3次;
⑤向步骤④的PCR管中加入超纯水100μl混匀,4℃长期保存。
3、细胞裂解以及蛋白质样品的制备
①将收集的卵母细胞或孤雌激活和体外受精的2-细胞期早期胚胎(1个、5个和25个) 的PCR管从-80℃冰箱拿出后瞬离,并各加入20ul裂解液,以确保含有细胞的裂解液在管底,冰上裂解10min;
②将第一次裂解后的溶液:预处理磁珠:三氟代乙醇按照体积比为5:1:5进行混合;
③将步骤②的混合物放入冰浴中进行超声处理,所述超声处理的处理方式为间隔超声处理,按照“超声5s-间隔30s-超声5s”的处理方式进行循环,超声处理的总时长为15min;超声处理后进行2s的离心处理得到第二次裂解液;
④向步骤③离心处理后的第二次裂解液中加入质量百分数为0.1%的甲酸0.75μl,混匀;
⑤将步骤④的混合液放入PCR仪中反应,反应条件为:95℃6min,0℃50s,45℃30 min;
⑥向步骤⑤反应液中加入400mmol的吲哚-3-乙酸5μl,在室温下孵育30min;
⑦步骤⑥孵育结束后,向反应液中加入200mmol的二硫苏糖醇5μl,终止反应。
4、蛋白质纯化:
步骤1:取第二次裂解后得到的混合液54.75μl与质量百分数为1%的甲酸溶液10μl均匀混合;
步骤2:向步骤1的混合液中加入乙腈溶液,使乙腈最终的质量浓度达到50%;
步骤3:将步骤2的混合液在室温下静置8min,然后再放置在磁力架上静置2min,待磁珠吸附至管底,去掉上清;
步骤4:在磁力架上,用200μl体积百分数为70%的乙醇,清洗磁珠两次,最后用200 μl的乙腈清洗磁珠一次,开盖室温干燥至磁珠龟裂;
步骤5:向步骤4干燥后的磁珠加入酶解溶液进行酶解,保证磁珠包含在酶解溶液中,无需混匀,在37℃条件下静置14h-24h。
5、肽段回收:
步骤A:重悬蛋白质纯化酶解后的磁珠,加入乙腈溶液在PCR管中混匀,使其终浓度达到95%;在室温下静置8min;
步骤B:将步骤A静置后的PCR管磁珠混合液置于磁力架上,待磁珠吸附至管底,去掉上清;用200μl乙腈清洗磁珠一次,开盖室温干燥至磁珠龟裂;
步骤C:向步骤B的PCR管内加入质量百分数为2%的二甲基亚砜溶液10μl对磁珠进行复溶,保证磁珠包含在二甲基亚砜溶液中并进行超声处理;所述超声处理的处理方式为间隔超声处理,按照“超声5s-间隔30s-超声5s”的处理方式进行循环,超声处理的总时长为1min;超声处理后进行2s的离心处理;
步骤D:将步骤C离心处理后的PCR管置于磁力架上,室温静置2min,待磁珠吸附至管底,回收上清液至新的PCR管,得到回收液I;
步骤E:将含有步骤D回收液I的PCR管再置于磁力架上,进行第二次回收,确保上清内不含有磁珠,得到回收液II,将回收液II放入1μl质量百分浓度为1%甲酸溶液中在-20℃条件下保存,完成肽段回收过程。
验证分析:(采用液质联用分析法对回收的肽段进行分析)
将样品在30℃或45℃真空旋干,使用10ul流动相A(99.9%water and 0.1%formic acid) 复溶;水浴超声5min,用移液枪缓慢加入上样瓶内(避免气泡产生)。
1、液质联用分析条件:
液质联用的洗脱过程中使用的流动相:流动相A(99.9%water and 0.1%formic acid);流动相B(99.9%acetonitrile and 0.1%formic acid)。
在100min内从流动相A-100%,B%-0%变化到流动相A-75%,B-25%;在接下来的24min 内流动相A-75%,B-25%变化到流动相A-60%,B-40%;总时间为145min;对于TMT标记的样品,梯度变化改为在100min内从流动相A-100%,B%-0%变化到流动相A-73%,B-27%;在qExactive MS(Thermo Scientific)获取数据采用data-dependent method。在HCD片段化后选择前12个峰进行二级质谱分析(tandem-MS/MS(MS2)analysis)。扫描覆盖的质量范围为350-1500,分辨率为70,000(at m/z 200),最大填充时间为32毫秒,自动增益控制 (AGC),目标值为1e6。二级质谱(MS2)获取的分辨率为17,500(at m/z 200),最大填充时间为200毫秒,自动增益控制(AGC),目标值为5e4。在所有实验中,每个2.0m/z的分离窗口(isolation window),固定第一个质量为110.0m/z。HCD破碎和碰撞能量归一化诱导(NCE),对于未标记和重复样本(unlabeled and dimethyl samples),采用25;对于TMT肽段采用33。填充率设置为40%,以实现阈值强度为1e5。动态排除(Dynamic exclusion)设置为排除先前选择的前体,根据梯度长度不同,共计30或60秒。电荷排斥(Charge state exclusion)设置为忽略未排除(ignore unassigned,1,5–8,and>8charges)。同位素排除(Isotope exclusion)启用,肽匹配(peptide match)禁用。
2、数据库搜索设置:
从Uniprot数据库下载相应物种的数据库,导入数据库检索软件Proteome Discoverer software v1.3,并进行搜库参数设置:酶切方式选择胰蛋白酶(Trypsin full);Precursor Mass Tolerance设置为20ppm;Fragment Mass Tolerance设置为0.02Da;动态修饰(Dynamic Modification)为Oxidation(+15.995Da M);固定修饰为Carbamidomethyl(+57.021Da C); Target FDR(Strict)设置为0.01,Target FDR(Relaxed)设置为0.05,验证方法采用q-Value。
3、实验结果:
如图1所示,检测到卵母细胞的蛋白质种类如下:单个、5个、25个、50个、100个和 200个卵母细胞的蛋白质种数分别是191种、450种、745种、867种、942种和970种。
如图2所示,检测到2-细胞期早期胚胎的蛋白质种类如下:单个2-细胞期早期胚胎、5 个2-细胞期早期胚胎、25个2-细胞期早期胚胎鉴定所得的蛋白质种类数量分别为221种、476 种、716种。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!