一种炔烃化合物及其合成方法与应用与流程
本发明涉及有机合成领域,尤其涉及一种炔烃化合物及其合成方法与应用。
背景技术
炔烃也是非常良好的有机合成中间体,更是构建复杂分子的重要骨架,并参与各种反应。例如:通过diels-alder环加成反应合成各种复杂环状化合物(kang,t.,wang,z,lin,l.;liao,y.;zhou,y.;lin,x.;feng,x.;adv.synth.catal.2015,357,2045.);加聚反应增长分子碳链;参与加成反应快速增加分子的复杂度,为复杂分子(天然产物)的快速高效合成提供新方法(teles,j.,stefan,b.,mathieu,c.angew.chem.int.ed.1998,3,1415);在亲核金属化反应中与金属配位形成氢金属化,再进一步偶联,麻生明、negishi等发展了从ω-三甲基硅基-(ω-1)-炔-1-醇的反式及顺式氢铝反应(mas,liuf,negishie.tetrahedronlett.1997,38,3829.);炔烃参与click反应通过小单元的拼接,来快速可靠地完成形形色色分子的化学合成,开辟以碳-杂原子键合成为基础的组合化学新方法,并借助这些反应(点击反应)来简单高效地获得分子多样性(kolb,h.c.;finn,m.g.;sharpless,k.b.angew,chem.int.ed.2001,40,2004.)。lee等人用叠氮化合物与gdp-fucose炔底物连接在一起,得到了能够直接用于生物检测且对多个糖基转移酶有效的抑制剂(lee,l.;mitchell,m.;huang,s.-j.;fokin,v.;sharpless,k.b.;wong,c.j.am.chem.soc.2003,125,9588.)。
由于炔烃在各个方面展示出的重要性,其简洁高效的合成方法一直备受人们关注。然而自然界中存在的具有活性的复杂类炔烃分子少见且不易分离,这也就使得化学家们迫切去寻找人工合成炔烃化合物的方法。例如:最单直接的合成方法就是两种末端炔烃通过脱氢交叉偶联,它能够得到对称或不对称的共轭二炔或多炔化合(如:石墨、金刚石、富勒烯)。共轭二炔易于进一步衍生物,或合成取代杂环或芳环,早在1882年,baeyer就曾以共扼二炔来制备染料靛蓝等衍生物(baeyer,a.,ber.dtsch.chem.ges.1882,15,50.),这种方法面临着选择性问题挑战。而sonogashira偶联反应就是末端炔烃与卤代芳烃在钯和铜共催化下生成炔基取代的芳环偶联反应(chinchilla,r.,najera,c.chem.rev.2007,107,874.)。该反应是一类典型的过渡金属催化的偶联反应,它具有良好的反应选择性、底物的容忍性等优点。但仍面临烷基膦配体对氧气的敏感需要隔除空气,此外,配体的价格昂贵,运输和使用都不便的一系列挑战。近年来,csp3-csp偶联反应涉及到sp3杂化,由于烷基碳原子活性较低,或容易发生副反应,相关报道通常较少,而对于一些苄基或羰基α位的碳原子而言,它们具备部分双键的性质,活性更强,也更容易发生反应。例如:fu等人于2004年报道过一例铜催化的α-重氮羰基化合物与末端炔烃之间的交叉偶联反应,该反应在碘化亚铜的催化下,该反应能够在温和的条件下进行(suarez,a.;fu,g.c.angew.chem.int.ed.2004,43,3580.)。但重氮化合物一般稳定性不高,并且具备一定的危险性。
因此,提供一种简单、高效、经济、安全且具有良好的普适性的炔烃化合物的合成方法,是目前亟待解决的技术问题。
技术实现要素:
本发明提供了一种炔烃化合物及其合成方法与应用,解决了现有技术中炔烃化合物的合成反应成本高,反应稳定性不高,且反应复杂的技术问题。其具体技术方案如下:
本发明提供了一种炔烃化合物的合成方法,包括以下步骤:
在惰性溶剂的存在下,催化剂和氧化剂的作用下,将式(ii)化合物与式(iii)化合物进行反应,得到式(ⅰ)化合物;
r1-x式(ii);
其中,r1、r2各自或独立地选自饱和或不饱和的烃基、苯基、取代苯基、含n、o、s杂环取代烃基、稠环芳基、含卤素、酯基、羰基、氨基、硝基、氰基、砜基、酰基等官能团的饱和或不饱和的直链烃基或环烃基,x为nhnh2或so2nhnh2。
优选的,式(ii)化合物为甲苯磺酰肼化合物、2-噻吩肼化合物、苯磺酰肼化合物、对氰基苯磺酰肼化合物或苯肼化合物。
优选地,所述催化剂为金属催化剂;
所述金属催化剂选自醋酸铜、三氟甲磺酸铜、卤化亚铜、卤化铜、三卤化铁或硝酸铁。
本发明实施例中,金属催化剂为三氯化铁或醋酸铜。铜或铁催化剂比较廉价,可以节约反应的成本。
优选地,所述式(ii)化合物与所述式(iii)化合物的摩尔比为3:1~1:3。
更优选地,式(ii)化合物与式(iii)化合物的摩尔比为1:1和2:1,最优选为1:1。
优选地,所述催化剂的用量是所述式(ii)化合物用量的1mol%~50mol%。
更优选地,所述催化剂的用量是式(ii)化合物用量的5mol%~10mol%,进一步优选为5mol%和10mol%,最优选为10mol%。
优选地,所述惰性气体选自甲苯、四氢呋喃、1,4-二氧六环、n,n’-二甲基甲酰胺、n,n’-二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、乙腈、1,2-二氯乙烷、乙醇或水;
所述氧化剂选自空气或氧气。
更优选地,惰性气体为1,4-二氧六环。
优选地,还包括添加剂;
所述添加剂为醋酸钠、碳酸锂、碳酸钾、碳酸铯或醋酸钾中的一种或多种。
更优选地,添加剂为醋酸钠和碳酸锂。
优选地,惰性溶剂的用量为1~2ml。
更优选地,惰性溶剂的用量为1ml。
优选地,所述反应温度为80℃~120℃;
所述反应时间为12h~24h。
更优选地,反应温度为110℃,反应时间为12h。
本发明实施例中,反应结束后,还包括以下步骤:反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,得到产物。其中,所选展开剂或洗脱剂为石油醚,且石油醚与乙酸乙酯的体积比100:1。
本发明还提供了一种上述合成方法制得的炔烃化合物。
本发明还提供了上述合成方法得到的炔烃化合物或上述的炔烃化合物在药物和/或材料中的应用。
本发明提供了一种炔烃化合物的合成方法,以肼或磺酰肼与末端炔为原料,在惰性溶剂的存在下,催化剂和氧化剂的作用下进行反应,该合成方法原料简单易得,操作安全简单,底物适用范围广,该合成方法对于芳基肼或磺酰肼均适用,且对于脂肪族或芳香族末端炔烃底物都可以兼容,该合成方法化学选择性好该合成方法经历的是自由基历程,即通过单电子金属催化剂铜或铁的催化作用下,以及氧气的协助氧化下,芳基肼或磺酰肼氧化为芳基自由基,同时离去氮气和水,芳基自由基自身偶联可以有效地抑制,表现出良好的化学选择性;同时要指出的是,末端炔烃在铜催化,以及氧化性条件下极容易发生glaser偶联,即氧化炔烃自身偶联反应,而在该合成方法中,芳基肼或磺酰肼与末端炔的各自自身偶联较好地被抑制,而选择性地发生氧化交叉偶联,该合成方法也易于后续的进一步转化,具有非常良好的原子经济性,副产物为氮气、水,符合可持续的绿色化学。通过上述合成方法得到的炔烃化合物为全新的炔烃化合物,该炔烃化合物可广泛应用于医药和材料领域。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
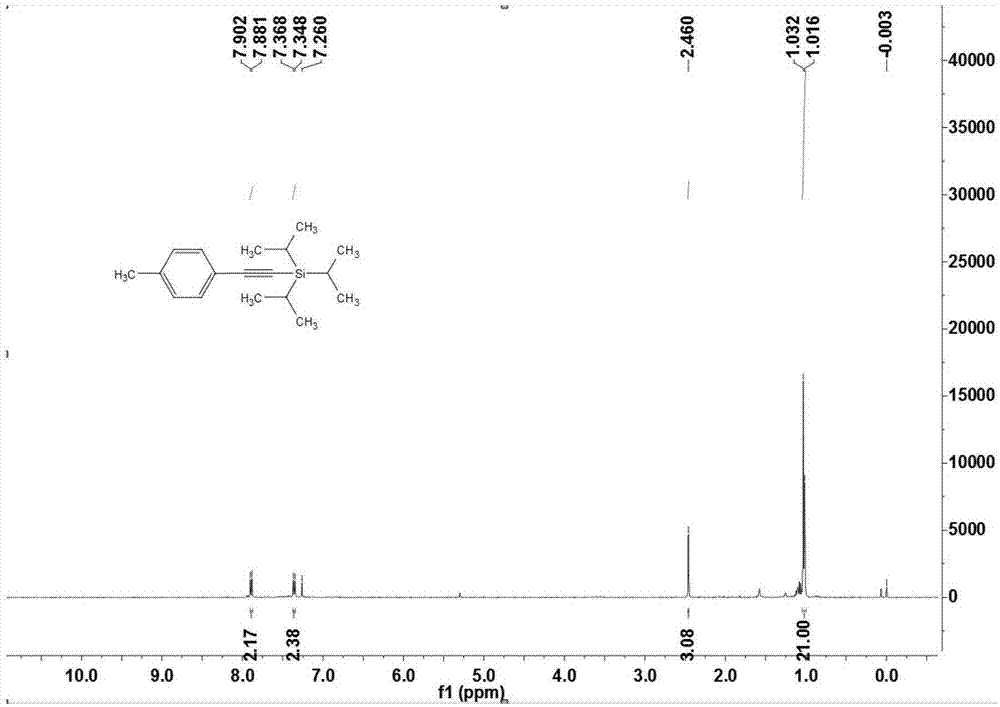
图1为本发明实施例一提供的1-对甲基苯基-2-((三异丙基硅基)乙炔(3aa)核磁共振1h谱图;
图2为为本发明实施例一提供的1-对甲基苯基-2-((三异丙基硅基)乙炔(3aa)核磁共振13c谱图;
图3为本发明实施例二提供的4-甲基-3’-氨基-二苯乙炔(3ab)核磁共振1h谱图;
图4为本发明实施例二提供的4-甲基-‘-氨基-二苯乙炔(3ab)核磁共振13c谱图;
图5为本发明实施例三提供的4-溴-4’-甲氧基-二苯乙炔(3bc)核磁共振1h谱图;
图6为本发明实施例三提供的4-溴-4’-甲氧基-二苯乙炔(3bc)核磁共振13c谱图;
图7为本发明实施例四提供的2-苯乙炔基噻吩(3cd)核磁共振1h谱图;
图8为本发明实施例四提供的2-苯乙炔基噻吩(3cd)核磁共振13c谱图;
图9为本发明实施例五提供的2-(丙基-1-炔基)苯(3de)核磁共振1h谱图;
图10为本发明实施例五提供的2-(丙基-1-炔基)苯(3de)核磁共振13c谱图;
图11为本发明实施例六提供的4-(丁基-1-炔基)苯甲腈(3ef)核磁共振1h谱图;
图12为本发明实施例六提供的4-(丁基-1-炔基)苯甲腈(3ef)核磁共振13c谱图;
图13为本发明实施例七提供的1,2,3,4,5-五氟-6-(苯乙炔基)苯(3dg)核磁共振1h谱图;
图14为本发明实施例七提供的1,2,3,4,5-五氟-6-(苯乙炔基)苯(3dg)核磁共振13c谱图;
图15为本发明实施例八提供的2-甲基-6-苯基戊-3,5-二炔-2-醇(3fh)核磁共振1h谱图;
图16为本发明实施例八提供的2-甲基-6-苯基戊-3,5-二炔-2-醇(3fh)核磁共振13c谱图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的其他实施例,都属于本发明保护的范围。
本发明提供的炔烃化合物及其合成方法与应用中所用的原料及试剂均可由市场购得。
以下就本发明所提供的一种炔烃化合物及其合成方法与应用做进一步说明。
实施例一1-对甲基苯基-2-((三异丙基硅基)乙炔(3aa)
在一个大气压氧气氛围下,向15mlschlenk反应管中依次加入对甲磺酰肼化合物1a(37.2mg,0.20mmol),末端炔2a(10μl,0.20mmol),三氯化铁(1.7mg,0.01mmol)或醋酸铜(2.0mg,0.01mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应12小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比100:1,得到产物1-对甲基苯基-2-((三异丙基硅基)乙炔3aa:黄色液体,收率82%(46.2mg)。
1-对甲基苯基-2-((三异丙基硅基)乙炔(3aa)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.89(d,j=8.4hz,2h),7.36(d,j=8.0hz,2h),2.46(s,3h),1.05-1.02(m,21h)。
1-对甲基苯基-2-((三异丙基硅基)乙炔(3aa)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ145.2,139.2,129.9,127.3,100.8,100.1,21.8,18.3,10.9。
本发明实施例可以很好地兼容硅基取代的炔烃,而硅基可以很方便地在温和条件下脱除,从而得到末端炔烃。
实施例二4-甲基-3’-氨基-二苯乙炔(3ab)
在一个大气压氧气氛围下,向15mlschlenk反应管中依次加入对甲苯磺酰肼化合物1a(74.4mg,0.40mmol),末端炔2b(10μl,0.20mmol),三氯化铁(3.3mg,0.02mmol)或醋酸铜(4.0mg,0.02mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应12小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比30:1,得到产物4-甲基-3’-氨基-二苯乙炔(3ab):黄色液体,收率85%(35.2mg)。
4-甲基-3’-氨基-二苯乙炔(3ab)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.42(d,j=7.9hz,2h),7.16(d,j=7.9hz,2h),7.13-7.11(m,1h),6.95(d,j=7.0hz,1h),6.86(s,1h),6.66(d,j=8.0hz,1h),3.33(br,2h),2.37(s,3h)。
4-甲基-3’-氨基-二苯乙炔(3ab)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ146.2,138.3,131.5,129.2,129.1,124.1,122.1,120.3,117.8,115.2,89.0,88.9,21.45。
本发明实施例可以很好地兼容氨基取代的炔烃,这在以往的报道中是较少的,主要是由于一级胺与金属催化剂较强的配位作用;与此同时,该产物还可以很方便地转化其它官能团取代的炔烃,如通过氨基的转化为重氮之类,从而利用sandmeyer类型反应得到氟、氯、溴等卤素取代的内炔。
实施例三4-溴-4’-甲氧基-二苯乙炔(3bc)
在一个大气压氧气氛围下,向15mlschlenk反应管中依次加入对甲磺酰肼化合物1b(50.2mg,0.20mmol),末端炔2c(20μl,0.40mmol),三氯化铁(3.3mg,0.02mmol)或醋酸铜(4.0mg,0.02mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应15小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比100:1,得到产物4-溴-4’-甲氧基-二苯乙炔(3bc):白色固体,收率80%(48.6mg);mp:153-154℃。
4-溴-4’-甲氧基-二苯乙炔(3bc)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.57-7.41(m,4h),7.36(d,j=8.4hz,2h),6.88(d,j=8.5hz,2h),3.83(s,3h)。
4-溴-4’-甲氧基-二苯乙炔(3bc)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ159.8,133.1,132.8,131.5,122.6,122.0,115.0,114.1,90.6,87.0,55.3。
本发明实施例可以高效得到溴取代的内炔,而溴作为多功能性的官能团可以通过偶联反应(如钯或铜催化的heck、suzuki、negishi反应,以及ullmann反应)得到各种官能团化的内炔。
实施例四2-苯乙炔基噻吩(3cd)
在一个大气压氧气或者空气氛围下,向15mlschlenk反应管中依次加入2-噻吩磺酰肼化合物1c(22.8mg,0.20mmol),末端炔2(10μl,0.20mmol),三氯化铁(3.3mg,0.02mmol)或醋酸铜(4.0mg,0.02mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应12小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比100:1,得到产物2-苯乙炔基噻吩(3cd):白色固体,收率90%(38.5mg);mp:53-54℃。
2-苯乙炔基噻吩(3cd)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.57(d,j=3.9hz,1h),7.55(d,j=5.2hz,1h),7.41-7.35(m,3h),7.36-7.29(m,2h),7.04(dd,j=5.2,3.9hz,1h)。
2-苯乙炔基噻吩(3cd)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ131.8,131.4,128.4,128.3,127.2,127.0,123.3,122.9,93.0,82.6。
本发明实施例可以很好地兼容在材料领域中广泛使用的杂环噻吩,从而为该转化在其它领域中的应用提供便利。
实施例五2-(丙基-1-炔基)苯(3de)
在一个大气压氧气或者空气氛围下,向15mlschlenk反应管中依次加入苯磺酰肼化合物1d(37.2mg,0.20mmol),末端炔2e(20μl,0.40mmol),三氯化铁(1.7mg,0.001mmol)或醋酸铜(2.0mg,0.001mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应12小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比100:1,得到产物2-(丙基-1-炔基)萘(3de):黄色液体,收率75%(19.3mg)。
2-(丙基-1-炔基)苯(3de)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.40-7.38(m,2h),7.28-7.25(m,3h),2.38(t,j=6.8hz,3h),1.62(dt,j=7.2hz,14.4hz,2h),1.04(t,j=7.2hz,3h)。
2-(丙基-1-炔基)苯(3de)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ131.6,128.2,127.5,124.1.90.3,80.7,22.2,21.4,13.5.
本发明实施例可以很好地兼容脂肪族取代的炔烃,这在以往的报道中是较少的,且常常需要特殊配体稳定的钯或者镍催化剂才可以很好地促进该类反应,而该申请的转化条件则相对简单。
实施例六4-(丁基-1-炔基)苯甲腈(3ef)
在一个大气压氧气或者空气氛围下,向15mlschlenk反应管中依次加入对氰基苯磺酰肼化合物1e(37.2mg,0.20mmol),末端炔2f(12μl,0.24mmol),三氯化铁(3.3mg,0.02mmol)或醋酸铜(4.0mg,0.02mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应12小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比100:1,得到产物4-(丁基-1-炔基)苯甲腈(3ef):黄色液体,收率78%(28.5mg)。
4-(丁基-1-炔基)苯甲腈(3ef)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.53(d,j=8.0hz,2h),7.42(d,j=8.4hz,2h),2.41(t,j=7.2hz,2h),1.61-1.54(m,2h),1.50-1.41(m,2h),0.93(t,j=7.2hz,3h)。
4-(丁基-1-炔基)苯甲腈(3ef)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ132.1,131.9,129.2,110.8,95.6,79.4,30.5,22.0,19.2,13.6。
本发明实施例可以很好地兼容脂肪族取代的炔烃,且氰基作为强配位性、又易转化的官能团也可以很好地兼容。
实施例七1,2,3,4,5-五氟-6-(苯乙炔基)苯(3dg)
在一个大气压氧气或者空气氛围下,向15mlschlenk反应管中依次加入苯磺酰肼化合物1d(37.2mg,0.20mmol),末端炔2g(10μl,0.20mmol),氯化铁(3.3mg,0.02mmol)或醋酸铜(4.0mg,0.02mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃下反应12小时。反应结束后冷却至室温,经硅藻土抽滤,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比100:1,得到产物1,2,3,4,5-五氟-6-(苯乙炔基)苯(3dg):黄色液体,收率72%(38.6mg)。
1,2,3,4,5-五氟-6-(苯乙炔基)苯(3dg)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.54-7.52(m,2h),7.40-7.31(m,2h)。
1,2,3,4,5-五氟-6-(苯乙炔基)苯(3dg)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ132.5,129.2,128.4,121.8,81.6,73.9。
本发明实施例可以很好地兼容在材料中有广泛应用的五氟苯基的炔烃,从而为该转化在材料分子的快速构建以及后期衍生化提供新方法。
实施例八2-甲基-6-苯基戊-3,5-二炔-2-醇(3fh)
在一个大气压氧气或者空气氛围下,向15mlschlenk反应管中依次加入苯肼化合物1f(21.6mg,0.20mmol),末端炔2h(15μl,0.30mmol),三氯化铁(3.3mg,0.02mmol)或醋酸铜(4.0mg,0.02mmol),碳酸锂(15mg,0.20mmol),醋酸钠(17.0mg,0.20mmol),1,4-二氧六环(1,4-dioxane,1ml),在温度为110℃中反应12小时。反应结束后冷却至室温,经硅藻土抽滤后,浓缩得到粗产物。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比10:1,得到产物2-甲基-6-苯基戊-3,5-二炔-2-醇(3fh):黄色液体,收率76%(28.0mg)。
2-甲基-6-苯基戊-3,5-二炔-2-醇(3fh)核磁共振氢谱测定结果为:1hnmr(400mhz,cdcl3)δ7.48-7.45(m,2h),7.36-7.27(m,3h),1.57(s,6h)。
2-甲基-6-苯基戊-3,5-二炔-2-醇(3fh)核磁共振碳谱测定结果为:13cnmr(100mhz,cdcl3)δ132.5,129.2,128.4,121.6,87.0,78.7,67.0,65.6,31.1。
本发明实施例可以很好地得到多炔,如共轭二炔,从而为相应的具有生活活性的炔烃衍生物的合成提供便利。
以上所述,以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!