微肝组织培养模型、其构建方法及其应用与流程
本发明属于生物技术领域,涉及组织化培养模型及其构建方法,特别涉及一种肝毒性药物安全性评测用三维微肝组织培养模型及其构建方法与其在药物、中草药、化妆品等相关物质的肝毒性评测中的应用。
背景技术
肝脏在药物(或外源性毒物)的代谢和处置中起着十分重要的作用,大多数药物和毒物在肝内经生物转化作用而排出体外。药物诱导的肝损伤(drug-inducedliverinjury,dili)是导致肝功能障碍的最常见原因,也常导致药物研发失败,以及药物上市后被撤回或使用限制。此外,化妆品中重金属超标,新装修的房子甲醛超标,使用有毒的干洗剂四氯乙烯干洗衣物等都可能导致中毒性肝脏损伤。
肝细胞是具有高度极性化的细胞,其极性是维持肝脏独特生理功能的基础,而传统二维培养的细胞呈平面生长,细胞因在培养条件下缺少细胞与细胞、细胞与细胞外基质之间的接触而丧失极性,因而丧失肝细胞功能。此外,药物代谢酶和药物转运体等与药物代谢相关的酶表达量及活性随培养时间延长而急剧降低,这些极大限制了二维培养的肝系细胞在药物安全性评价中的应用;而用于体内安全性评价的动物模型的价格昂贵,实验周期长,还涉及动物福利问题。并且对于化妆品的毒性检测,使用动物模型更是阻碍重重,在2013年,欧盟就禁止销售经过动物测试的化妆品。更为重要的是,由于药物代谢酶具有种属特异性,动物实验结果常无法准确预测临床人体反应。因此,开发建立一种高效、精确、可重复且廉价的体外培养体系用于药物、化妆品等安全性尤其是肝毒性实验和研究,具有重要的理论和应用意义。
随着组织工程学科的发展,科学家们提出并逐渐完善了组织化培养技术(或称三维培养),这种培养方法获得的细胞在基因表达、基质分泌及细胞功能活动等方面与单层培养均有明显差异,与体内细胞生长情况更为相似,而且三维细胞培养既能保留体内细胞微环境的结构基础,又能体现为细胞生长提供物质基础,能够将组织化细胞培养体系与组织器官及整体研究联系起来。
建立良好的微组织化培养模型,包含三个重要因素,种子细胞、支架材料与微环境。具有良好的生物相容性支架材料是有效模拟细胞外基质、提供细胞体外构建三维组织模型的关键因素。人们不断探索使用不同的生物材料做支架,如纳米纤维支架、三维聚苯乙烯薄膜、多孔支架、胶原水凝胶支架、matrigel等。
“developmentofcomplex-shapedlivermulticellularspheroidsasahuman-basedmodelfornanoparticletoxicityassessmentinvitro”(monikadubiak-szepietowska,2016)采用三种不同的水凝胶制备肝脏多细胞球体:即无生长因子和酚红的基质胶(corning,荷兰)、猪皮肤来源的(sigma)a型明胶和i型胶原蛋白(sigma)的a型明胶。用dmem制备1mg/ml的基质胶储备液,在接种细胞前以1:1的比例用细胞培养基稀释。将dmem中10%明胶溶液(v/v)在37℃下孵育30分钟后用0.22μm孔径的注射器过滤器过滤,然后用1%(v/v)转谷氨酰胺酶(100u/g,ajinomoto)进行交联。通过混合dmem和i型胶原溶液(10mg/ml,在0.1%乙酸中)获得胶原凝胶,并用1mnaoh(sigma)将ph调节至7.4。将hepg2细胞与上述水凝胶混合,并在37℃下在细胞培养箱中培养。此模型中使用的水凝胶支架材料成分均较为单一,难以模拟肝细胞在体内复杂的生长环境。
技术实现要素:
本发明的第一个目的是提供一种用于化合物肝毒性评测的微肝组织模型。
本发明所提供的用于化合物肝毒性评测的微肝组织模型,是将肝细胞、肝样细胞和肝相关细胞中的一种或多种细胞,与去细胞的肝脏生物基质支架所制备的粉末(lbs粉末)在常规条件下混合培养得到的肝细胞球状聚集体,即微肝组织模型。
所述肝细胞可为普通肝细胞系(如heparg、hepg2、lo2、huh7细胞等)或原代分离的肝细胞,优选为heparg细胞、hepg2细胞;所述肝样细胞可为干细胞来源的肝样细胞或自体来源的ipsc诱导的肝样细胞,优选为自体来源的ipsc诱导的肝样细胞;所述多种肝相关细胞还包括血管内皮细胞(如huvec细胞)、免疫细胞(如kuffer细胞等)、肝星状细胞等。
所述肝脏生物基质支架为从肝脏中脱去细胞但保留肝脏细胞外基质(ecm)等成分的生物材料,即去细胞的肝脏(lbs),其保留了原始肝脏器官的总体外观和尺寸,颜色白色几乎透明,含有大部分肝特异性ecm成分、基质结合细胞因子和生长因子。
所述肝脏生物基质支架使用形式为lbs粉末,其为剪碎的lbs冻干脱水后用pbs配成溶液,液氮环境下研磨得到的微纳米级细粉。
本发明具体实施例中,提供了用lbs粉末和heparg细胞混合培养得到的微肝组织模型,lbs粉末和hepg2细胞、huvec细胞混合培养得到的微肝组织模型,以及用lbs粉末和肝样细胞混合培养得到的微肝组织模型。
本发明的第二个目的是提供用于化合物肝毒性评测的微肝组织模型的构建方法。
本发明所提供的构建方法,可包括以下步骤:
1)对细胞进行常规消化处理,制成单细胞悬液;所述细胞为肝细胞、肝样细胞和肝相关细胞中的一种或多种;
2)用细胞常规培养基将去细胞的肝脏生物基质支架(lbs)稀释为lbs溶液,向细胞板中每孔加入lbs溶液;
3)将细胞悬液接种至细胞板中与lbs溶液混合,将细胞板常规培养,取培养7-28天得到的细胞球状聚集体作为微肝组织培养模型。
在上述去细胞的微肝组织模型的构建方法中,所述步骤1)中的细胞为肝细胞、肝样细胞和肝相关细胞中的一种或多种细胞。所述肝细胞可为普通二维(2d)培养的肝细胞(如heparg、hepg2、lo2、huh7细胞等)或原代分离的肝细胞,优选为heparg细胞、hepg2细胞;所述肝样细胞可为干细胞来源的肝样细胞或病人自体来源的ipsc诱导的肝样细胞,优选为病人自体来源的ipsc诱导的肝样细胞;所述多种肝相关细胞还可以包括血管内皮细胞(如huvec细胞)、免疫细胞(如kuffer细胞等)、肝星状细胞等。
所述步骤2)中去细胞的肝脏生物基质支架(lbs)的获得方法,包括以下步骤:将取自sd大鼠血液流尽后的肝脏,灌注37℃预热的1%sdc溶液(即1%脱氧胆酸钠溶液,浓度单位g/100ml,其中含磷脂酶a230-100ng/ml,优选72.2ng/ml),灌至肝脏几乎透明后用4℃放置的双蒸水灌注大鼠肝脏,洗尽肝脏中残留的sdc(脱氧胆酸钠),得到去细胞的肝脏生物支架(lbs)。
进一步,将lbs冻干保存制成lbs粉末作为肝脏生物基质支架。其制备方法为:将前述去细胞的肝脏lbs剪碎,放入冻干机中冻干脱水,加入pbs配成lbs浓度为5%-30%(w/v)的溶液,在液氮环境下用使打粉机,经多个(一般为5-7个)循环后得到细粉状的lbs粉末。
更具体的,以上微肝组织模型的构建方法包括以下步骤:
1)对细胞进行常规处理,制成单细胞悬液后进行细胞计数,用培养基将细胞悬液稀释至浓度为500-100000个细胞/ml;
2)用细胞常规培养基将去细胞的肝脏生物基质支架(lbs粉末)稀释至蛋白浓度为0.5-200μg/ml,向细胞板中每孔加入25-100μl含lbs的培养基,最终每孔内lbs的含量为0.05-2.5μg;
3)将25-100μl单种或多种细胞悬液接种至细胞培养板中,细胞接种密度为50-2000个细胞/孔,将细胞悬液与lbs溶液混合均匀后,将细胞板置于37℃、5%co2条件下进行常规培养,隔天半量换液,并进行形貌表征和肝细胞相关功能检测,培养7-28天,得到用于化合物肝毒性评测的微肝组织模型。
这里,步骤2)中的细胞板可为琼脂糖包被细胞培养板、超低吸附细胞培养板或3d悬滴培养板等,细胞板可为6、24、48、96或384孔板等。
所述步骤2)中最终每孔内lbs的含量可为0.05、0.1、0.5、1、1.5、2或2.5μg。
所述步骤3)中肝细胞或肝样细胞的接种密度可为50、100、400、800、1600或2000个细胞/孔。
微肝组织培养模型在肝毒性药物(含中草药)的安全性评测以及肝毒性相关物质检测中的应用也属于本发明,肝毒性相关物质包括化妆品、含甲醛样品、洗涤剂等。
本发明提供了一种用于化合物肝毒性评测的微肝组织模型及其构建方法。本发明的微肝组织模型是将肝细胞或肝样细胞或多种肝相关细胞与去细胞的肝脏生物基质支架粉末(lbs粉末)在常规条件下混合培养得到的细胞球状聚集体。经过培养,细胞成球并逐渐增大,细胞与细胞之间及细胞与细胞外基质之间建立紧密的连接,形成类似于体内的三维生长方式,聚集成球率高。lbs模拟肝脏特异性ecm组成,能够重现复杂的生物和生物化学相关微环境,为细胞生长提供更接近于体内细胞的微环境,从而增强肝细胞或肝样细胞对于药物、化合物的代谢能力,提高对于毒性产物的敏感度。本发明提供具有肝功能强的微肝组织模型,其可用于大量未知肝毒性药物、中草药、化合物、化学品、化妆品、洗涤剂等的安全性评测中,提高筛选的准确性,还可用于对已知肝毒性药物的毒性机制研究中,甚至可直接用于组织工程肝脏及人源化肝脏小鼠的移植,为移植提供有功能的肝细胞作为种子细胞来源,应用前景广阔。
附图说明
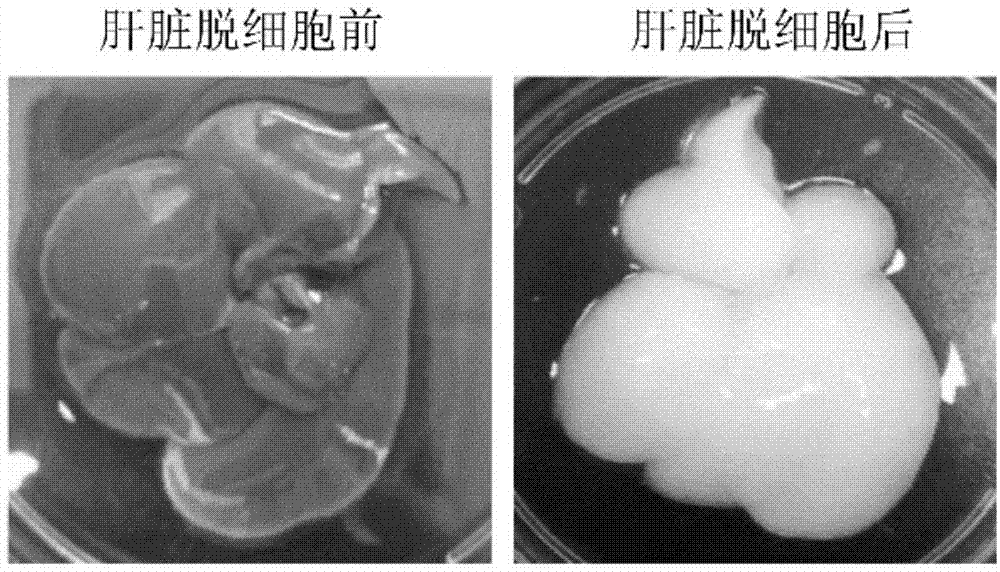
图1为sd大鼠肝脏去细胞前、后的形貌照片;
图2为显微镜下的heparg细胞与lbs混合培养形成的细胞球(3dl)照片;
图3为heparg细胞与lbs混合培养形成的细胞球(3dl)及heparg2d培养细胞分泌的白蛋白量检测结果柱图;
图4为heparg细胞与lbs混合培养7天、21天及heparg细胞2d培养上清中尿素分泌量的检测结果柱图;
图5为rt-pcr检测heparg细胞与lbs混合培养7天、21天形成的细胞球(3dl)药物代谢酶和药物转运体基因(肝功能相关基因)的表达水平柱图;
图6为肝毒性药物对乙酰氨基酚(apap)对heparg细胞与lbs混合培养形成的细胞球(3dl)及heparg2d培养细胞的细胞毒性检测结果曲线。
具体实施方式
本发明旨在提供一种操作简单、可行,可用于化合物肝毒性评测的微肝组织模型。在模型构建中,需要重点解决两方面技术,一是有适合的支架材料,二是有适合的种子细胞,通过适当高效的方法,构建出能够重现复杂的生物和生物化学相关微环境,为肝细胞或肝样细胞提供更接近于体内细胞的微环境,提高肝细胞或肝样细胞的功能,使其成为适用于高通量药物、中草药、化合物、化学品、化妆品等物质的肝毒性安全性评测筛选的三维微肝组织模型。
常规可选用的支架生物材料,如纳米纤维支架、三维聚苯乙烯薄膜、多孔支架、胶原水凝胶支架、matrigel等难以构建复杂的生物和生物化学相关微环境。发明人分析得知:细胞外基质(ecm)是由细胞分泌到细胞外间质中的大分子物质,构成复杂的网架结构,支持并连接组织结构、调节组织的发生和细胞的生理活动。细胞外基质的主要成分包括纤维蛋白、整合素蛋白、多糖类、金属基质蛋白酶等,因此细胞外基质能作为一种特殊的天然生物支架材料,适于在体外培养中为细胞提供良好的微环境,提高细胞的功能,使体外培养的细胞状态更接近体内。
发明人努力寻找适于作为肝细胞模型的骨架材料的细胞外基质,最终发现,专利公开号us008802081b2提供了一种成熟的去细胞化方法,是从新鲜肝脏中脱去细胞保留肝脏细胞外基质(extracellularmatrix,ecm)成分。发明人尝试以该文献方法获得的生物材料作为本发明微肝组织模型构建中的肝脏生物基质支架(liverbiomatrixscaffold,lbs),并将其在液氮条件下研磨成为微纳级别的粉末颗粒(本申请命名为lbs粉末)。实验确证获得的lbs是天然生物材料,含有大部分肝特异性ecm成分、基质结合细胞因子和生长因子。当将正常的成年大鼠或人肝细胞接种在lbs上时,成体实质细胞(是指具有肝功能的细胞,正常的成年大鼠或人的肝细胞)能够快速附着于lbs,并能在lbs上保持其活力和功能超过8周。因此,本发明中,选择lbs粉末作为微肝组织模型的支架材料。
下面结合具体实施例对本发明做进一步详细说明。
下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《分子克隆实验指南》(《molecularcloning:alaboratorymanual》sambrook,j.,russell,davidw.,molecularcloning:alaboratorymanual,3rdedition,2001,ny,coldspringharbor)。
所述百分比浓度如无特别说明均为质量/质量(w/w,单位g/100g)百分比浓度、质量/体积(w/v,单位g/100ml)百分比浓度或体积/体积(v/v,单位ml/100ml)百分比浓度。
实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但是本发明的保护范围不限于下述的实施例。
实施例1、获得肝脏生物基质支架粉末(lbs粉末)
肝脏生物基质支架(lbs)的获得方法参照us008802081b2。具体实验中可包括以下操作:
1).先将雄性sd大鼠(180-220g)腹腔注射氯胺酮-甲苯噻嗪进行麻醉,随后剪开腹腔,分离出肝脏门静脉,用22号导管(383407,bd,usa)插入门静脉以提供灌注入口。
2).灌注pbs(磷酸盐缓冲液)15分钟,将血液从肝脏中移除。
3).用含有36u/l的磷脂酶a的21%去氧胆酸钠(fisher,pittsburgh,pa,usa)溶液去除血浆和核膜,灌注约30分钟至1小时或直到肝组织变得接近透明。
4).用3.4mnacl缓冲液灌注30分钟,用pbs冲洗肝脏15分钟以除去之前的缓冲液,然后用100mldnase(1mg/100ml;fisher)和rnase(5mg/100ml;sigmaaldrich)灌注以除去任何残余的核酸,得到肝脏生物基质支架粗品(lbs粗品)。
5).用pbs冲洗lbs粗品1小时,以除去任何残留的盐和核酸酶,保留肝中叶,所有血管结构完整,重约3克左右;最后使用钴-60γ辐照器(军事医学院辐射中心,北京)使用1.5mradγ辐射剂量对进行灭菌,得到肝脏生物基质支架(lbs)。
sd大鼠肝脏去细胞前、后的形貌如图1所示,左图为肝脏去细胞前的形貌,右图为肝脏去细胞后的形貌,可以看出去细胞处理后的肝脏保留了原始肝脏的总体外观和尺寸,颜色从白色变为几乎透明,初步表明肝脏已成功去细胞化,其能作为肝脏生物基质支架(lbs)材料。
以上为参照us008802081b2方法实施的实验操作。商业使用时,可对符合相关规定来源的肝脏做去细胞处理来获得肝脏生物基质支架(lbs)材料。
本发明进一步将上述去细胞处理后的肝脏制成肝脏生物基质支架粉末(lbs粉末)。lbs粉末的制备可进一步包括以下步骤:
6).将前述去细胞处理后的肝脏生物材料即肝脏生物基质支架(lbs)剪碎,放入冻干机中冻干脱水,加入pbs配成lbs浓度为5%-30%(w/v)的溶液,分装入冷冻打粉机的加样管中,在打粉机中加入适量(一般为3/4体积至最高刻度线之间)的液氮,启动打粉机程序,经多个(一般为5-7个)循环后取出细粉即为lbs粉末,作为肝脏生物基质支架粉末,该lbs粉末中包含lbs和pbs。
将打成细粉的lbs粉末(常温下呈粘稠状液体)进行分装,γ射线照射灭菌,照射完毕后放置-80℃冰箱保存,常温下使用。
为了对lbs粉末中所含蛋白质进行蛋白定量(肝脏去细胞支架中的总蛋白浓度),便于确定后续与细胞混合培养时使用的lbs中蛋白的浓度,用superbradford蛋白测定试剂盒(cwbio,china)提取lbs粉末中的总蛋白,对lbs粉末中的总蛋白进行定量。
结果:检测本例获得的去细胞肝脏生物基质支架lbs粉末中蛋白浓度为43.79μg/μl(包含lbs和pbs的lbs粉末常温下呈粘稠状液体),表明lbs粉末中含有充足的蛋白量(发明人经实验验证,蛋白质浓度达到0.5μg/μl时lbs粉末即满足要求),足以保证后续实验和使用,说明lbs粉末保留了肝脏细胞外基质ecm,作为细胞模型的生物基质支架可以为细胞提供附着点。
另外,利用蛋白质组学的方法对lbs粉末进行测定,确证其中还保留有基质结合细胞因子和生长因子(包括转录辅助调节因子hcfc1,膜联蛋白家族等),表明lbs粉末还可以为细胞提供更接近于体内的微环境。
实施例2、用heparg细胞构建微肝组织模型
本实施例用lbs粉末和heparg细胞构建微肝组织模型。heparg细胞是从慢性肝炎病毒感染的肝癌患者体内非瘤组织分离而得到的细胞株,具有肝祖细胞的特征,能表现人肝细胞的大多数功能,包括药物代谢所涉及的主要cyp酶系,可用于与肝功能相关疾病和药物代谢的研究。
微肝组织模型构建过程如下:
1)取对数生长期的二维培养(平面培养)的heparg细胞(来源于atcc),用0.25%(0.05-1%均可)(v/v)胰酶消化处理1min(0.5-2min均可),用含10%(8-15%均可)(v/v)胎牛血清(购自gibco)的william'se培养基(购自gibco)终止消化,将细胞吹打至脱落,收集至离心管中,离心后弃上清用william'se培养基重悬为单细胞悬液,进行细胞计数,用william'se培养基将heparg细胞稀释至浓度为4000个细胞/ml(500-100000个细胞/ml均可);
2)用上述william'se培养基将用实施例1方法制成的lbs粉末稀释至蛋白浓度为5μg/ml(0.5-200μg/ml均可)的lbs溶液,向琼脂糖包被的96孔细胞板(购自corning)中每孔加入100μl(25-100μl均可)的lbs溶液,最终每孔内lbs的含量为0.5μg(0.05-2.5μg均可,如0.05、0.1、0.5、1、1.5、2或2.5μg);
3)将100μl(25-100μl均可)heparg细胞悬液接种至细胞板中,细胞接种密度为400个细胞/孔(50-2000个细胞/孔均可,如50、100、400、800、1600或2000个细胞/孔),将heparg细胞悬液与lbs溶液混合均匀后,将细胞板置于37℃、5%co2条件下进行常规培养,隔天半换液,并进行形貌表征和肝细胞相关功能检测。观察可见2天后heparg细胞可在lbs上粘附并聚集成球,收获培养3-28天的细胞球状聚集体。
显微镜下的heparg细胞与lbs混合培养形成的细胞球(3dl)如图2所示,分别为培养3天、7天、14天、21天和28天的细胞球状聚集体,可以看出细胞培养3天已聚集成紧实的球体状,并随培养时间增加细胞球状聚集体的直径逐渐增加,表明heparg细胞与lbs混合培养可以成功聚集成球状,聚集成球率高,并能保持健康的生长状态。本实施例,将收获培养7-28天的细胞球状聚集体作为肝毒性药物安全性评测三维肝细胞模型即微肝组织模型。
本实施例使用heparg细胞构建微肝组织模型,其优势为heparg细胞可经诱导分化为肝样细胞和胆管样细胞,与由多种细胞组成的肝脏环境更接近,可用于药物及其代谢产物肝毒性的研究。
实施例3、用hepg2和huvec细胞构建微肝组织模型
本实施例用hepg2和huvec细胞基于lbs粉末构建微肝组织模型。
hepg2细胞为人肝癌细胞系,来源于人的肝癌组织,是研究药物代谢酶最常用的一种细胞株,因为其具备人肝细胞基本功能如白蛋白和尿素的表达及具有人肝细胞的i、ii相药物代谢酶,并且可以体外无限扩增,易于操作和获取,可用于对肝功能及初步药物筛选及与肝细胞代谢相关的肝脏疾病的研究;huvec细胞为人脐静脉内皮细胞,具有干细胞的潜能,体外培养可成血管样管腔结构,可用于组织工程中血管的重建研究、血管再生与内皮细胞及其它类型细胞相互作用等方面的研究。
微肝组织模型构建过程如下:
1)取密度约80%的二维(2d)培养的hepg2细胞(来源于atcc)和huvec细胞(来源于atcc),用0.25%(0.05-1%均可)(v/v)胰酶消化处理2min(1-3min均可),用含10%(5-15%均可)(v/v)胎牛血清(购自gibco)的dmem培养基(购自gibco)终止消化,将细胞吹打至脱落,收集至离心管中,离心后弃上清用dmem培养基重悬为单细胞悬液,进行细胞计数,用dmem培养基分别将hepg2与huvec细胞稀释至浓度为1000个细胞/ml(500-100000个细胞/ml均可);
2)用上述含血清的dmem培养基将去细胞的肝脏生物基质支架(lbs粉末)稀释至蛋白浓度为20μg/ml(0.5-200μg/ml均可),向低吸附96孔细胞板(购自corning)中每孔加入50μl(25-100μl均可)含lbs的培养基,最终每孔内lbs的含量为1μg(0.05-2.5μg均可,如0.05、0.1、0.5、1、1.5、2或2.5μg);
3)将50μl(25-100μl均可)hepg2细胞悬液和50μl(25-100μl均可)huvec细胞接种至细胞板中,细胞接种密度为100个细胞/孔(50-2000个细胞/孔均可,如50、100、400、800、1600或2000个细胞/孔,hepg2与huvec细胞比例为0.1-10),将hepg2细胞悬液与lbs溶液混合均匀后,将细胞板置于37℃、5%co2条件下进行常规培养,隔天半换液,并进行形貌表征和肝细胞相关功能检测,3天后hepg2细胞可在lbs上粘附并聚集成球状。将培养7-28天收获得到的细胞球状聚集体作为药物等肝毒性安全性评测微肝组织模型。
本实施例使用hepg2和huvec细胞构建微肝组织模型,其中hepg2细胞为肝实质细胞,huvec为内皮细胞,两者混合培养后通过内皮细胞的支持作用可以提高肝细胞功能,用于获得功能更强的微肝组织模型。
实施例4、用肝样细胞构建肝毒性药物安全性评测微肝组织模型
本实施例用lbs粉末和肝样细胞构建肝毒性药物安全性评测微肝组织模型。
微肝组织模型构建过程如下:
1)取由胚胎干细胞(es)(来源于atcc)诱导至肝细胞阶段的肝样细胞(闫舫.hescs来源的肝系细胞构建hcv易感的细胞模型和人源化小鼠模型研究[d].中国人民解放军军事医学科学院,2014.),用accutase细胞消化液消化处理4min(3-5min均可)(购自stemcell),用hm培养基(购自gibco)终止消化,将细胞吹打至脱落,收集至离心管中,离心后弃上清用hm培养基重悬为单细胞悬液,进行细胞计数,用hm培养基将肝样细胞稀释至浓度为20000个细胞/ml(500-100000个细胞/ml均可);
2)用上述hm培养基将去细胞的肝脏生物基质支架(lbs粉末)稀释至蛋白浓度为20μg/ml(0.5-200μg/ml均可),向3d悬滴细胞板(购自insphero)中每孔加入30μl(25-100μl均可)含lbs的培养基,最终每孔内lbs的含量为0.6μg(0.05-2.5μg均可,如0.05、0.1、0.5、1、1.5、2或2.5μg);
3)将30μl(25-100μl均可)肝样细胞悬液接种至gravityplusplates(3d悬滴细胞板上层平板)中,细胞接种密度为600个细胞/孔(50-2000个细胞/孔均可,如50、100、400、800、1600或2000个细胞/孔),将肝样细胞悬液与lbs溶液混合均匀后,将细胞板置于37℃、5%co2条件下进行常规培养,隔天半换液,并进行形貌表征和肝细胞相关功能检测,3天后肝样细胞可在lbs上粘附并聚集成球状。将细胞球转移至gravitytrapplates(3d悬滴细胞板下层平板)中继续培养至7-28天,收获得到的细胞球状聚集体均可作为药物等肝毒性安全性评测微肝组织模型。
本实施例使用肝样细胞构建微肝组织模型,其优势为由胚胎干细胞诱导的肝样细胞肝功能更贴近于原代肝细胞,lbs混合培养为其提供了与体内接近的微环境,可用于化合物肝毒性的安全性研究。
检测1、heparg细胞与lbs混合培养形成的细胞球(3dl)培养上清中白蛋白含量的elisa检测
培养结束后,收集实施例2的培养上清液,用humanalbuminelisa试剂盒(购自bethyl)检测heparg细胞与lbs粉末混合培养形成的细胞球(3dl,即微肝组织模型)分泌的白蛋白量。
检测结果如图3所示,heparg细胞与lbs混合培养形成的细胞球(3dl)分泌的白蛋白量较heparg细胞二维培养细胞有明显升高,提高了约20倍,说明heparg细胞经与lbs混合三维培养后形成的微肝组织模型分泌白蛋白能力显著增强,初步表明经三维混合培养的heparg细胞在肝功能方面增强。
检测2、heparg细胞与lbs混合培养形成的细胞球(3dl)培养上清中尿素合成量的检测
分别将实施例2heparg细胞与lbs混合培养第7天、第21天时的细胞培养基(william'se培养基)换成含有10mmnh4cl的无血清dmem培养基(购自gibco),继续常规培养24小时后取培养上清,用quantichromureaassaykit(尿素检测试剂盒,购自bioassaysystems)检测培养上清中的尿素含量。
检测结果如图4所示,heparg细胞与lbs混合培养7天、21天后形成的细胞球(3dl,即微肝组织模型)经无血清dmem继续培养的培养上清中,尿素分泌量均远远高于heparg的二维培养上清,说明将heparg细胞与lbs混合培养heparg细胞的尿素分泌水平明显增强,进一步表明经三维混合培养的heparg细胞在肝细胞功能方面明显增强。
检测3、rt-pcr检测heparg细胞与lbs混合培养形成的细胞球(3dl)药物代谢酶和药物转运体基因(肝功能相关基因)的表达水平
rt-pcr检测heparg细胞与lbs混合培养7天、21天形成的细胞球(3dl,即微肝组织模型)药物代谢酶和药物转运体基因(肝功能相关基因)的表达水平,方法为:分别收集heparg细胞与lbs混合培养7天、21天的细胞球,用rneasyminikit试剂盒(购自qiagen)提取细胞球总rna,用goldscript反转录试剂盒(购自toyobo)合成cdna,以gapdh为内参基因,rt-pcr检测ⅰ相药物代谢酶:细胞色素p450酶3a4(cyp3a4);细胞色素p450酶2d6(cyp2d6);细胞色素p450酶2e1(cyp2e1);ⅱ相药物代谢酶:n-乙酰转移酶2(nat2);尿苷二磷酸葡萄糖醛酸转移酶1a1(ugt1a1);尿苷二磷酸葡萄糖醛酸转移酶2b7(ugt2b7)和药物转运体基因多耐药相关蛋白2(mrp2);多药耐药相关蛋白3(mrp3)的mrna水平,引物序列如表1所示。
表1引物序列
检测结果如图5所示,heparg细胞与lbs混合培养7天、21天形成的细胞球(3dl,即微肝组织模型)药物代谢ⅰ相酶、ⅱ相酶、药物转运体基因的表达水平较heparg二维培养细胞明显提高,其中培养21天形成的细胞球的肝功能相关基因的表达量升高更为显著,表明heparg三维细胞模型(即微肝组织模型)较heparg二维细胞模型的肝细胞功能明显改善。
本例还说明,利用微肝组织模型能用于药物等肝毒性安全性评测,如图5所示,其中药物代谢酶活性显著提高,药物在该模型上的代谢水平较二维细胞更接近体内的代谢水平。此模型不仅能检测药物对肝细胞的毒性作用,也可以检测出药物经肝脏的代谢产物对肝细胞的毒性,表明该模型可用于药物的肝毒性评价。
用检测1-检测3相同的方法对实施例3所述hepg2和huvec细胞与lbs粉末混合培养形成的细胞球(即微肝组织模型)白蛋白分泌量、尿素分泌量和肝功能相关基因表达量进行检测,结果分泌水平和基因表达水平较二维培养均明显提高,表明经三维混合培养的hepg2细胞在肝细胞功能方面明显增强。
检测例4、检测对乙酰氨基酚(apap)对heparg细胞与lbs混合培养形成的细胞球(3dl)的细胞毒性
对heparg细胞与lbs混合培养形成的细胞球(3dl)模型(即用实例2方法构建得到微肝组织模型)进行半换液加药处理,加入有明确肝毒性药物对乙酰氨基酚(apap,购自mce),药物作用最高浓度为100mm,5倍梯度稀释设置5个浓度梯度(分别为100mm、20mm、4mm、0.8mm、0.16mm),作用24小时后,以heparg2d培养细胞为对照,用alarmblue试剂(购自invitrogen)进行细胞活力检测。
检测结果如图6所示,在细胞培养基中加入对乙酰氨基酚后,在本发明微肝组织模型上培养的细胞球(3dl)随浓度增高细胞活力逐渐降低,表明对乙酰氨基酚药物在11mm浓度下存在药物安全问题。
对照表明,heparg细胞与lbs混合培养形成的细胞球(3dl)较heparg二维培养细胞对apap更为敏感,如在20mm浓度下,二维模型细胞存活率为60%,而三维模型(微肝组织模型)显示的细胞存活率仅有38%,这表明微肝组织模型可更为真实地反映肝毒性药物在体内的作用情况。
- 还没有人留言评论。精彩留言会获得点赞!