一种小分子血红素肽及其制备方法与流程
本发明涉及补铁活性物质制备技术领域,具体涉及一种小分子血红素肽及其制备方法。
背景技术
畜禽动物血液作为屠宰场加工的副产物之一,其高值化利用一直是研究的热点。血红蛋白作为动物血液中含量最丰富的蛋白质,加强其综合运用对提高猪血附加值具有非常重要的意义。血红素是典型的卟啉类化合物,是由四个吡咯连接构成的卟啉环中心镶嵌一个铁离子形成的化合物,其相对分子质量约为616.5。对动物血液中血红素的开发利用是动物血液深加工利用的重要方向。
血红素铁在食品工业上被广泛的用作补铁剂,主要有三种形式:血红素肽、氯化血红素以及血红蛋白,用于治疗和缓解缺铁性贫血。除了在食品工业上的运用,血红素铁在药物领域也是制备抗肿瘤药物-血卟啉的前体物质。
目前来说,血红素肽的制备在食品工业上又叫做血液的脱色处理,制备血红素肽的方法分为三大类,第一类是化学法,如酸性丙酮法和冰醋酸法。第二类是物理法,如沉淀法和吸附法。第三类是生物法,如酶法。酸性丙酮法等化学法虽然提取率好,产物纯度高,但是残留的有机试剂会成为食品中风险成分。cmc-na等吸附法适用于医药工业中制备成片剂,但血红素肽后期的分离纯化较难实现。相较于其他脱色方法,酶法是目前为止制备血红素肽最环保的工艺方法,产物具有更好溶解性和最小有害残留物风险。
蛋白酶如胃蛋白酶、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶都有研究用来制备血红素肽,酶解类型又可以分为:单一酶解、复合酶解、分步酶解。同时酶解也可以与物理前处理方式相结合,如超声酶解、微波酶解、高压酶解等,这些酶解产物中都是含有适量的血红素肽。目前通过酶解制备血红素肽多存在酶解时间长、产物得率低,酶解工艺复杂等问题,因此如何简化酶解工艺,提高血红素得率,缩短酶解时间也一直是需要解决的问题。
技术实现要素:
本发明的目的在于提供一种小分子血红素肽及其制备方法。本发明提供的小分子血红素肽中血红素的提取率高、纯度高,且所述血红素肽补铁活性高。
本发明提供了一种小分子血红素肽,由包括以下步骤的方法制备得到:
将血红蛋白与复合蛋白酶混合进行酶解反应;所述酶解反应的条件为在ph值为7~9的条件下,40~60℃酶解1~5h;所述复合酶包括碱性蛋白酶和中性蛋白酶。
优选的是,所述血红素肽的分子量为3.4~14.4kda。
优选的是,所述蛋白复合酶相对于血红蛋白的用量为6000~10000u/g。
优选的是,所述蛋白复合酶中碱性蛋白酶和中性蛋白酶的酶添加量比为(7~3):(3~7)。
优选的是,酶解反应完成后,采用酸沉淀法对得到的酶解反应液进行纯化。
本发明还提供了上述技术方案所述血红素肽的制备方法,包括以下步骤:
将血红蛋白与蛋白复合酶混合进行酶解反应,所述酶解反应条件为在ph值为7~9的条件下,40~60℃酶解1~5h;所述蛋白复合酶包括碱性蛋白酶和中性蛋白酶。
优选的是,所述蛋白复合酶相对于血红蛋白的用量为6000~10000u/g。
优选的是,所述蛋白复合酶中碱性蛋白酶和中性蛋白酶的酶添加量比为(7~3):(3~7)。
优选的是,酶解反应完成后,采用酸沉淀法对得到的酶解反应液进行纯化。
优选的是,所述酸沉淀法中采用的ph值为3~5。
本发明提供了一种小分子血红素肽。本发明提供的小分子血红素肽分子量仅为3.4~14.4kda,不仅吸收好,且本发明的小分子血红素肽中血红素的提取率高、纯度高,且血红素肽补铁活性高。试验结果表明,小分子血红素肽中血红素的提取率高达87.8057%,纯度为23.2693%,且本发明血红素肽补贴活性高于血红蛋白、氯化血红素、硫酸亚铁等铁化合物。
附图说明
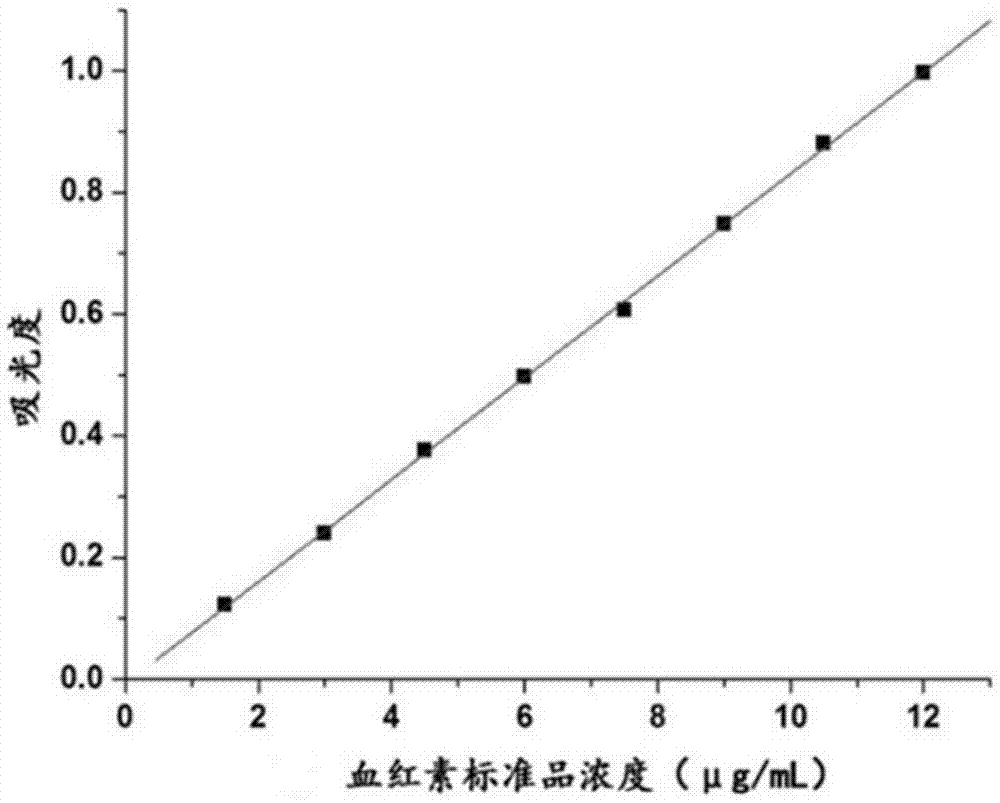
图1为本发明提供的血红素标准曲线图;
图2为本发明实施例1提供的不同酶解条件下血红素提取率和纯度结果图;
图3为本发明实施例3提供的不同来源铁的铁吸收率比较结果图。
具体实施方式
本发明提供了一种小分子血红素肽,所述血红素肽的制备方法包括以下步骤:
将血红蛋白与蛋白复合酶混合进行酶解反应,所述酶解反应条件为在ph值为7~9的条件下,40~60℃酶解1~5h;所述蛋白复合酶包括碱性蛋白酶和中性蛋白酶。
在本发明中,所述蛋白复合酶相对于血红蛋白的用量为6000~10000u/g,更优选为7500~9500u/g,最优选为9000u/g。在本发明中,所述蛋白复合酶中碱性蛋白酶和中性蛋白酶的酶添加量比为(7~3):(3~7),更优选为6:4。本发明对所述碱性蛋白酶和中性蛋白酶的来源没有特殊的限定,采用本领域技术人员熟知的常规碱性蛋白酶和中性蛋白酶的市售产品即可。在本发明中,所述碱性蛋白酶能够酶解珠蛋白链中的碱性氨基酸,使珠蛋白多肽链更好地伸展,暴露出血红素中心,提高血红素肽的活性。在本发明中,所述中性蛋白酶的作用为酶解珠蛋白肽链。本发明碱性蛋白酶和中性蛋白酶的组合的作用是酶解血红蛋白中的珠蛋白多肽链,尽可能充分的暴露出血红素基团。
在本发明中,所述酶解的ph值优选为7.5~8.5,更优选为8。在本发明中,所述酶解的时间优选为2~4h,更优选为2h;所述酶解的温度优选为45~55℃,更优选为55℃。
本发明对所述血红蛋白的来源没有特殊的限定,采用常规血红蛋白的常规市售产品或采用常规市售血液自行制备即可。在本发明中,自行制备血红蛋白时,所述血液优选包括猪血、鸡血、羊血等,更优选包括抗凝猪血。本发明所述血红蛋白的制备方法优选包括以下步骤:取血液,优选抗凝猪血,1700×g离心10min后血液分层,收集下层红细胞,用ph7.4的pbs缓冲液洗涤三次;破碎红细胞;破碎液在10000×g下离心30min,弃下层细胞碎片收集上清液冷冻干燥后即得血红蛋白粉末,置于-20℃低温保存。本发明对红细胞破碎的方法没有特殊的限定,采用常规间歇式超声粉碎仪进行破碎即可,破碎过程中优选采用碎冰降温。
本发明所述血红蛋白优选溶于缓冲液进行酶解反应,本发明对所述缓冲液的种类没有特殊的限定,优选采用本领域技术人员熟知的ph缓冲液即可,如tris-hcl缓冲液或磷酸盐缓冲液。在本发明中,所述血红蛋白在缓冲液中的浓度优选为1g/50ml~5g/50ml,更优选为3g/50ml。
酶解反应完成后,本发明采用酸沉淀法对得到的酶解反应液进行纯化。在本发明中,所述酸沉淀法中采用的ph值为3~5,更优选为4.5。具体地,本发明在所述纯化过程中,调节完ph值后,优选恒温振荡30min;在4000r/min下搅拌10min,然后10000rpm/min下离心30min,弃上清液收集沉淀,将沉淀洗涤三次后收集冻干,保存在-20℃冰箱。
在本发明中,所述血红素肽的分子量为3.4~14.4kda。本发明所述小分子血红素肽吸收性好,且本发明所述血红素肽铁吸收率高,血红素肽活性好。本发明得到的小分子血红素肽中的血红素提取率高,且纯度高。
在本发明中,血红素提取率和纯度的测定方法优选包括以下步骤:本发明采用标准曲线-紫外可见分光光度法测定血红素含量:准确称量烘干至恒重的血红素标准品15mg,用0.1mol/l的naoh溶液溶解配置成150μg/ml的标准母液,分别取1、2、3、4、5、6、7、8ml的标准母液定容至100ml的容量瓶中,配置成浓度分别为1.5、3、4.5、6、7.5、9、10.5、12μg/ml的标准溶液。以0.1mol/l的naoh溶液作为空白调零,在测定波长下依次测定不同浓度标准溶液的吸光度,绘制标准曲线,如图1所示。然后在标准曲线范围内,依次测定样品吸光度。血红素提取率及纯度如下面公式所示进行计算:
本发明对所述小分子血红素肽分子量的测定方法没有特殊的限定,采用本领域技术人员熟知的超低分子量电泳分析方法即可。
本发明还提供了上述技术方案所述血红素肽的制备方法,包括以下步骤:
将血红蛋白与蛋白复合酶混合进行酶解反应,所述酶解反应条件为在ph值为7~9的条件下,40~60℃酶解1~5h;所述蛋白复合酶包括碱性蛋白酶和中性蛋白酶。本发明对酶解条件的限定如上文所述。
下面结合具体实施例对本发明所述的一种小分子血红素肽及其制备方法做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
实施例1
通过组合酶酶解血红蛋白制备血红素肽的单因素实验,采用l9(34)正交实验表来进行实验设计,选择酶解ph,酶解温度,酶解时间作为实验因素,血红素提取率以及纯度作为实验考察指标,实验设计以及结果如表1所示。根据正交实验结果进行极差分析和方差分析,分析结果如表2,3,4,5。
对血红素纯度影响较大的因素排序为a>c>b,即酶解ph>酶解时间>酶解温度,其中酶解ph与酶解时间对血红素纯度的影响极显著,酶解温度的影响不显著,其最优水平为酶解ph8,酶解时间4h,酶解温度50℃。
对血红素提取率影响较大的因素排序为a>b>c,即酶解ph>酶解温度>酶解时间,其中酶解ph和酶解温度分别对血红素提取率的影响极显著以及显著,酶解时间对血红素提取率影响不显著,其最优水平为酶解ph8,酶解温度55℃,酶解2h。
如图2所示,第5组(酶解ph8,酶解时间4h,酶解温度50℃)是优化后的血红素纯度最高组,第6组(酶解ph8,酶解温度55℃,酶解2h)为优化后的血红素提取率最高组。综合考虑,酶解ph8对二者影响都显著,酶解温度对纯度影响不显著而对提取率影响显著,故酶解温度选择选择55℃。酶解时间对纯度影响大而对提取率影响不显著,故应该选择酶解时间4h,但是由酶解时间单因素的显著性分析可知,酶解2h与酶解4h对纯度的影响都是显著的,但是二者之间是没有显著差异性,则基于节约时间及成本考虑,选择酶解时间为2h。
因此将第6组(酶解ph8,酶解温度55℃,酶解2h)作为最佳工艺组,这时血红素提取率为87.8057%,纯度为23.2693%。
表1正交实验设计及结果
表2血红素纯度的极差分析结果
表3血红素提取率的极差分析结果
表4血红素纯度的方差分析结果
表5血红素提取率的方差分析结果
实施例2
将本发明酶解方法得到的血红素肽进行超低分子量电泳分析
溶液配制
阳极缓冲液:称取tris碱121.1g,双蒸水400ml,用hcl调ph至8.9,用双蒸水定容至500ml,稀释10倍后使用。
阴极缓冲液:称取tris碱12.11g,tricine17.92g,用双蒸水溶解后,十二烷基磺酸钠(sds)1g,用双蒸水定容至1000ml,此溶液不用调节ph值。
固定液:30%乙醇,0.5%戊二醛,加双蒸水至100ml。
染色液:50%甲醇,10%乙酸,0.2%考马斯亮蓝g-250,用双蒸水定容至500ml。
脱色液:250ml乙醇,80ml冰醋酸,加双蒸水至1000ml,混匀。
电泳方法
分离胶浓度16.5%,夹层胶浓度10%,浓缩胶浓度4%,三种胶的制胶体积比为4:1.5:1,蛋白上样量5~10μl。电泳时,30v跑1~2h后,待指示前沿跑到分离胶上沿时,将电压调至100v。整个电泳过程大概需要6~8小时。电泳完成后,将凝胶依次在固定液和染色液中固定和染色30min,最后过夜脱色至背景色退去。
取0.1g酶解产物冻干粉末溶解在40ml的蒸馏水中,滴加0.1mol/lnaoh调整ph值为8。进行电泳,血红蛋白经过双酶酶解后水解程度较高,得到的肽段多集中在3~14.4kda范围内。
实施例3
1)血红蛋白制备:
取新鲜抗凝猪血,1700×g离心10min后血液分层,收集下层红细胞,用ph7.4pbs缓冲液洗涤三次。采用间歇式超声粉碎仪破碎红细胞,破碎过程中采用碎冰降温。破碎液在10000×g下离心30min,弃下层细胞碎片收集上清液冷冻干燥后即得血红蛋白粉末,置于-20℃低温保存。
2)血红素肽的制备
配制ph8.5的tris-hcl缓冲液,称取2.0g血红蛋白冻干粉末溶于50ml上述缓冲液中配制成底物浓度为2g/50ml的血红蛋白溶液,加酶量为8000u/g,在55℃及ph8.5酶解2h,以不添加酶组作为空白对照组,沸水浴5min灭酶终止反应。用盐酸调节酶解液ph为4.5,恒温振荡30min后,利用高速分离搅拌机在4000r/min下搅拌10min,然后10000rpm/min下离心30min,弃上清液收集沉淀,将沉淀洗涤三次后收集冻干,将冻干样品1保存在-20℃冰箱。
3)血红素肽与其它铁化合物的铁生物利用率比较
不同来源铁经过模拟胃肠道消化后再进行caco-2细胞实验,产生的铁蛋白往往是作为铁吸收的标志物。将经过模拟胃肠道消化后的硫酸亚铁、氯化血红素、血红蛋白、血红素肽和胶原蛋白+氯化血红素这几个组的冻干样品分别用培养基配置成浓度为相同铁离子浓度的待试液,备用。给药前先将transwell板中小室里面的培养基倒掉并用hbss清洗三次,换上mem培养基后培养24h后给药,ap端加入0.5ml的各待试液,bl端加入1.5ml的dmem完全培养基,培养24小时后,利用胰酶将各小室里面的caco-2细胞消化下来后收集,用于测定总蛋白含量和铁蛋白含量。利用bca试剂盒和铁蛋白试剂盒测定总蛋白以及铁蛋白含量。实验结果如图3所示,血红素肽的铁吸收量最大为50.245ngferritin/mgprotein。其次是氯化血红素,并且二者具有显著性差异。硫酸亚铁、血红蛋白以及胶原蛋白+氯化血红素这三组之间是没有显著性差异。血红素肽的铁吸收是显著高于不含有肽链的高纯度氯化血红素以及完整血红蛋白和硫酸亚铁。添加的外源性胶原蛋白虽然可以提高氯化血红素的铁溶解度但是对铁吸收却是没有帮助的。
实施例4
1)血红蛋白制备:
取新鲜抗凝猪血,1700×g离心10min后血液分层,收集下层红细胞,用ph7.4pbs缓冲液洗涤三次。采用间歇式超声粉碎仪破碎红细胞,破碎过程中采用碎冰降温。破碎液在10000×g下离心30min,弃下层细胞碎片收集上清液冷冻干燥后即得血红蛋白粉末,置于-20℃低温保存。
2)血红素肽的制备
称取2.0g血红蛋白冻干粉末溶于50mlph7.5磷酸缓冲液中配制成底物浓度为2g/50ml血红蛋白溶液,双酶添加量为8000u/g,碱性蛋白酶和中性蛋白酶的酶添加比例分别为6:4,在酶解温度50℃下反应3h,沸水浴5min灭酶终止反应。用盐酸调节酶解液ph为4.5,恒温振荡30min后,利用高速分离搅拌机在4000r/min下搅拌10min,然后10000rpm/min下离心30min,弃上清液收集沉淀,将沉淀洗涤三次后收集冻干,将冻干样品2保存在-20℃冰箱。
3)血红素肽与其它铁化合物的铁生物利用率比较
将经过模拟胃肠道消化后的硫酸亚铁、氯化血红素、血红蛋白、血红素肽和胶原蛋白+氯化血红素这几个组的冻干样品分别用培养基配置成浓度为相同铁离子浓度的待试液,备用。给药前先将transwell板中小室里面的培养基倒掉并用hbss清洗三次,换上mem培养基后培养24h后给药,ap端加入0.5ml的各待试液,bl端加入1.5ml的dmem完全培养基,培养24小时后,利用胰酶将各小室里面的caco-2细胞消化下来后收集,用于测定总蛋白含量和铁蛋白含量。利用bca试剂盒和铁蛋白试剂盒测定总蛋白以及铁蛋白含量。血红素肽的铁吸收量>氯化血红素>硫酸亚铁≈血红蛋白≈胶原蛋白+氯化血红素。血红素肽的铁吸收是显著高于不含有肽链的高纯度氯化血红素以及完整血红蛋白和硫酸亚铁。添加的外源性胶原蛋白虽然可以提高氯化血红素的铁溶解度但是对铁吸收却是没有帮助的。
实施例5
1)血红蛋白制备:
取新鲜抗凝猪血,1700×g离心10min后血液分层,收集下层红细胞,用ph7.4pbs缓冲液洗涤三次。采用间歇式超声粉碎仪破碎红细胞,破碎过程中采用碎冰降温。破碎液在10000×g下离心30min,弃下层细胞碎片收集上清液冷冻干燥后即得血红蛋白粉末,置于-20℃低温保存。
2)血红素肽的制备
向底物浓度为2g/50ml血红蛋白溶液中加入组合蛋白酶量为8000u/g,碱、中性蛋白酶添加比例为6:4,在酶解ph8,酶解温度55℃下反应3h,沸水浴5min灭酶终止反应。用盐酸调节酶解液ph为4.5,恒温振荡30min后,利用高速分离搅拌机在4000r/min下搅拌10min,然后10000rpm/min下离心30min,弃上清液收集沉淀,将沉淀洗涤三次后收集冻干,将冻干样品3保存在-20℃冰箱。
3)血红素肽与其它铁化合物的铁生物利用率比较
将经过模拟胃肠道消化后的硫酸亚铁、氯化血红素、血红蛋白、血红素肽和胶原蛋白+氯化血红素这几个组的冻干样品分别用培养基配置成浓度为相同铁离子浓度的待试液,备用。给药前先将transwell板中小室里面的培养基倒掉并用hbss清洗三次,换上mem培养基后培养24h后给药,ap端加入0.5ml的各待试液,bl端加入1.5ml的dmem完全培养基,培养24小时后,利用胰酶将各小室里面的caco-2细胞消化下来后收集,用于测定总蛋白含量和铁蛋白含量。利用bca试剂盒和铁蛋白试剂盒测定总蛋白以及铁蛋白含量。血红素肽的铁吸收量>氯化血红素>硫酸亚铁≈血红蛋白≈胶原蛋白+氯化血红素。血红素肽的铁吸收是显著高于不含有肽链的高纯度氯化血红素以及完整血红蛋白和硫酸亚铁。添加的外源性胶原蛋白虽然可以提高氯化血红素的铁溶解度但是对铁吸收却是没有帮助的。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!