单链环状核酸及其制备方法和应用与流程
本发明涉及分子生物学技术领域,尤其是涉及一种单链环状核酸及其制备方法和应用。
背景技术:
核酸不仅仅是遗传信息的载体,也是一种构建纳米结构的材料,特别是近些年来,核酸机器的设计成为了研究热点,不同的核酸机器可呈现“网笼”、“链锁”等形状,其有可能用于药物载体、物质运输、液体计算等方面。单链环状核酸是一种由单链dna、rna或其他修饰核酸链首尾相接形成的环状将结构,由于其独特的动力学和拓扑学性质使其在构建纳米材料时起到了重要作用。此外,环状核酸除了可以用于构建纳米材料外,也可用于滚环扩增、食品溯源及核酸拓扑结构的研究等。所以,单链线性核酸能否环化成功或者线性核酸环化后能够得到单一的环状核酸产物成为当前研究的焦点。
当前,大多数单链环状核酸的合成,是在连接酶、成环辅助链(与单链dna或rna的3’和5’末端互补的短链)的作用下,首尾相连成为闭合的环(如图1途径①)。然而,单链环状核酸制备过程中面临的主要问题是难以抑制高底物浓度下分子间连接产生的副产物。比如说在反应体系中,多条模板单链在成环辅助链作用下相互连接(如图1途径②),形成多聚物,即在连接底物的浓度较高的情况下,体系内分子间距离拉近,使分子间的碰撞几率增大,而线性核酸两端分子内的碰撞几率不变,分子间与分子内的碰撞几率差别变小,最终导致分子间连接效率的增高,多聚物产量急剧增加。最近,对于高浓度连接会产生大量副产物的问题,已有实验证明在低buffer浓度的条件下能够有效减少连环过程中的副产物,其低buffer就是降低了反应效率,使分子间的连接效率大幅下降,使分子内的连接处于优势,但是其存在操作繁琐,耗时较长等缺点。
因此,开发一种能够有效使线性核酸连接为环状核酸,且连接效率高、副产物少,操作简单、耗时短的环状核酸的制备方法尤为重要。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种单链环状核酸的制备方法,以缓解现有技术中存在的单链环状核酸连接效率低、副产物较多或操作繁琐,耗时较长的技术问题。
本发明的第二个目的在于由上述方法制备得到的单链环状核酸。
本发明的第三个目的在于提供上述单链环状核酸在构建纳米材料、滚环扩增、食品溯源或核酸拓扑结构研究中的一种或多种中的应用。
本发明提供了一种单链环状核酸的制备方法,所述制备方法包括:
经连接酶连接,使与成环辅助链杂交后的线性核酸两端闭合,得到所述环状核酸;
其中,所述线性核酸具有发夹结构,所述发夹结构位于所述线性核酸与所述成环辅助链的连接处;
所述成环辅助链与所述线性核酸的3’端和5’端互补。
进一步地,将所述线性核酸进行二级结构模拟,选择稳定的发夹结构作为所述线性核酸与所述成环辅助链的连接处。
进一步地,所述线性核酸的长度为40-200nt,优选为44-200nt,更优选为54-200nt。
进一步地,所述发夹结构的tm值高于连接反应温度10-60℃,优选为高于连接反应温度20-40℃。
进一步地,将所述线性核酸、成环辅助链、连接酶和连接缓冲液混合为同一连接体系,进行连接反应;
优选地,所述连接反应的时间为1-5小时;
优选地,所述连接反应的缓冲液为标准缓冲液的0.1-1倍。
进一步地,所述连接酶为可连接双链dna、双链rna或dna-rna杂交链中的切刻部分的连接酶;
优选地,所述连接酶为t4dna连接酶、t4rna连接酶、t3dna接酶、t7dna连接酶或e.colidna连接酶中的任意一种。
进一步地,所述线性核酸的浓度为1-100μm,优选为5-50μm。
进一步地,所述线性核酸与所述成环辅助链的摩尔比为1:1-5,优选为1:1-3。
本发明还提供了应用上述的制备方法制备得到的环状核酸。
另外,本发明还提供了上述的环状核酸在构建纳米材料、滚环扩增、食品溯源或核酸拓扑结构研究中的一种或多种中的应用。
本发明提供的环状核酸的制备方法,包括经连接酶连接,使与成环辅助链杂交后的具有发夹结构的线性核酸两端闭合,得到环状核酸。将线性核酸与成环辅助链的连接处设计为发夹结构,能够保证在连接体系中,先会有少部分发夹结构打开与成环辅助链连接进行成环,使连接体系中可以连接的分子始终保持在浓度较低的水平,这样使分子内相互连接的优势处于较为明显的地位,大大降低了副产物的生成。运用这种“末端发夹”连接方法,使线性核酸在连接酶连接下,在常规体系中的单环成环率可达近100%。并且,大多数的核酸单链在连接体系中均会形成发夹结构,所以本发明提供的制备方法的通用性极高。此外,该方法操作简单,耗时较短,无需专门的实验人员即可进行操作,在节约人力及时间成本的基础上,还具有普适性广的优点。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明提供的有发夹末端的线性核酸连接成环示意图;
图2a为本发明实施例1提供的l643-4,24-4的mfold模拟图;
图2b为本发明实施例1提供的l6416-4,37-4的mfold模拟图;
图2c为本发明实施例1提供的发夹位置对连接的成环目的产物量的影响结果比较结果图;
图3a为本发明实施例2提供的l743-4,24-4,65-2的线性核酸的mfold模拟图;
图3b为本发明实施例2提供的l643-4,24-4,55-2的线性核酸的mfold模拟图;
图3c为本发明实施例2提供的l543-4,24-4,45-2的线性核酸的mfold模拟图;
图3d为本发明实施例2提供的l4414-6,24-4,55-2的线性核酸的mfold模拟图;
图3e为本发明实施例2提供的l3414-6,35-2的线性核酸的mfold模拟图;
图3f为本发明实施例2提供的不同长度的具有末端发夹结构的单链的连接比较的结果图;
图4a为本发明实施例3提供的l642-4,23-4,51-2的线性核酸的mfold模拟图;
图4b为本发明实施例3提供的l643-4,24-4的线性核酸的mfold模拟图;
图4c为本发明实施例3提供的l644-4,25-4的线性核酸的mfold模拟图;
图4d为本发明实施例3提供的l645-4,26-4的线性核酸的mfold模拟图;
图4e为本发明实施例3提供的l646-4,27-4的线性核酸的mfold模拟图;
图4f为本发明实施例3提供的不同连接位置比较结果图;
图5a为本发明实施例4提供的l640-4,24-4的线性核酸的mfold模拟图;
图5b为本发明实施例4提供的l640-6,24-4的线性核酸的mfold模拟图;
图5c为本发明实施例4提供的l640-7,24-4的线性核酸的mfold模拟图;
图5d为本发明实施例4提供的l640-7,20-4的线性核酸的mfold模拟图;
图5e为本发明实施例4提供的不同稳定性的发夹在链的末端的连接成环比较结果图;
图6a为本发明实施例5提供的l643-4,24-4的连接转化率及环状核酸产率的统计图;
图6b为本发明实施例5提供的l6416-4,37-4的连接转化率及环状核酸产率的统计图;
图7a为本发明实施例6提供的l643-4,24-4的高浓度成环电泳图;
图7b为本发明实施例6提供的l6416-4,37-4的高浓度成环电泳图;
图8a为本发明实施例7提供的ldna的线性核酸的mfold模拟图;
图8b为本发明实施例7提供的带有末端发卡的线性核酸ldna成环电泳图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种单链环状核酸的制备方法,包括:
经连接酶连接,使与成环辅助链杂交后的线性核酸两端闭合,得到环状核酸;
其中,线性核酸具有发夹结构,该发夹结构位于线性核酸与成环辅助链的杂交处;
成环辅助链与线性核酸的3’端和5’端互补。
在本发明中,单链环状核酸为线性核酸同一条链首尾相接,闭合成环得到。
在本发明中,线性核酸为单链线性核酸,核酸可以为dna、rna或其他修饰核酸;相应的,制备得到的环状核酸为单链环状核酸,核酸可以为dna、rna或其他修饰核酸。
在本发明中,核酸分子自身回折,部分碱基彼此靠近,折叠区域内碱基互补配对,回折部分就形成了发夹结构。当线性核酸的发夹结构位于线性核酸与成环辅助链的杂交处时,在连接反应过程中,在连接体系中的线性核酸需要先将自身的发夹结构打开,才能与成环辅助链配对成环,达到了使连接体系中可以连接的分子始终保持在浓度较低的水平的目的,从而使分子内连接的优势处于较为明显的地位,大大降低了副产物的生成。
同时,本发明提供的环状核酸的制备方法,大多数的核酸单链在连接体系中均会形成发夹结构,且连接位置的选择不影响最终得到的环状核酸的序列,所以本发明提供的制备方法的通用性极高。此外,该方法操作简单,耗时较短,无需专门的实验人员即可进行操作,在节约人力及时间成本的基础上,还具有普适性广的优点。
在一个优选的实施方式中,将线性核酸进行二级结构模拟,选择稳定的发夹结构作为线性核酸与成环辅助链的杂交处。
可以利用计算机软件进行二级结构模拟,例如可以为,但不限于应用mfold、idt等软件进行二级结构模拟。
选择带有一定稳定性的发夹处作为连接处,能够保证发夹结构不轻易打开,达到了使连接体系中可以连接的分子始终保持在浓度较低的水平的目的,从而使分子内连接的优势处于较为明显的地位,大大降低了副产物的生成。
在一个优选的实施方式中,线性核酸的长度为40-200nt,例如可以为,但不限于40nt、50nt、60nt、80nt、100nt、120nt、150nt、180nt或200nt。优选为44-200nt,更优选为54-200nt。
当线性核酸的长度为40-200nt时,能够保证较高的成环率。
对本发明中线性核酸的长度进行进一步的调整和优化,能够使成环率更高。
在一个优选的实施方式中,发夹结构的tm值高于连接反应温度10-60℃,例如可以为,但不限于10℃、20℃、30℃、40℃、50℃、或60℃,优选为高于连接反应温度20-40℃。
当发夹结构的tm值高于连接反应温度20-40℃时,能够保证较高的成环率。
在一个优选的实施方式中,通过提高分子内与分子间连接的差距,降低有效连接浓度。
根据吉普斯自由能与平衡常数之间的关系:
δg=-rtlnk(1)
可知随着末端发夹结构的-δg的升高,可达到高产率(>85%)的底物浓度成指数型增长,根据实验结果初步确定了末端发夹结构的-δg在1-4范围内时,其连接的副产物量会大大抑制,其得到的单链环状核酸量会大幅提升。
在一个优选的实施方式中,将线性核酸、成环辅助链、连接酶和连接缓冲液混合为同一连接体系,进行连接反应;
优选地,连接反应的温度为20-40℃,例如可以为,但不限于20℃、22℃、25℃、28℃、30℃、32℃、35℃、或37℃或40℃,优选为25-37℃;
优选地,连接反应的时间为1-5小时,例如可以为,但不限于1小时、2小时、3小时、4小时或5小时,优选为2-4小时。
优选地,所述连接酶反应的缓冲液为标准缓冲液的0.1-1倍,例如可以为,但不限于0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍或1倍。
对本发明中连接反应的条件进行进一步的调整和优化,能够使成环率更高。
在一个优选的实施方式中,连接酶为可连接双链dna、双链rna或dna-rna杂交链中的切刻部分的连接酶;
优选地,所述连接酶为t4dna连接酶、t4rna连接酶、t3dna连接酶、t7dna连接酶或e.colidna连接酶中的任意一种。
在一个优选的实施方式中,线性核酸的浓度为1-100μm,例如可以为,但不限于1μm、10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm或100μm,优选为5-50μm。
当线性核酸的浓度为1-100μm时,能够保证较高的成环率。
对本发明中线性核酸的浓度进行进一步的调整和优化,能够使成环率更高。
在一个优选的实施方式中,线性核酸与成环辅助链的摩尔比为1:1-5,例如可以为,但不限于1:1、1:2、1:3、1:4或1:5,优选为1:1-3。
当线性核酸与成环辅助链的摩尔比为1:1-5时,能够保证较高的成环率。
对本发明中线性核酸与成环辅助链的摩尔比进行进一步的调整和优化,能够使成环率更高。
本发明还提供了应用上述的制备方法制备得到的单链环状核酸。
另外,本发明还提供了上述的单链环状核酸在构建纳米材料、滚环扩增、食品溯源或核酸拓扑结构研究中的一种或多种中的应用。
为了有助于更清楚的理解本发明的内容,现结合具体的实施例详细介绍如下。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
如无特别说明,本发明实施例中使用的药品及试剂均来源为正规而易购渠道:
线性核酸和成环辅助链均购自苏州金唯智生物科技有限公司,为人工合成;t4dna连接酶、t4rna连接酶购自美国赛默飞世尔公司(thermoscientific);t3dna连接酶、e.colidna连接酶购自newenglandbiolabs;其他化合用品购自美国西格玛奥德里奇(sigma-aldrich)。
实施例1
1、原料
线性核酸1(5’→3’,l643-4,24-4):
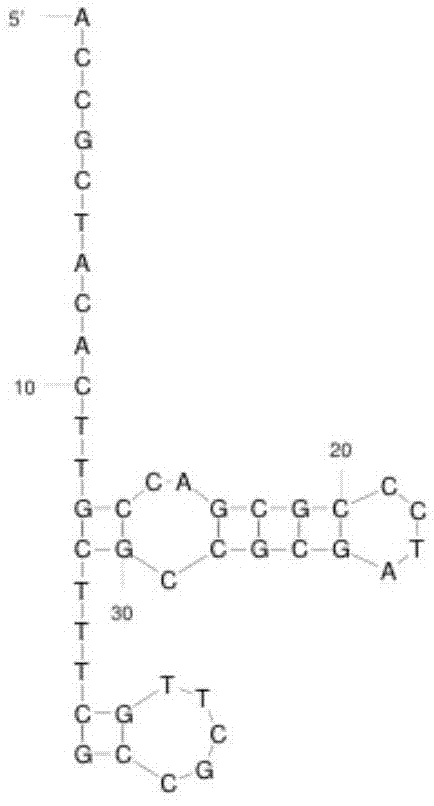
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgccgg(5’-磷酸化,长度为64nt,seqidno:1);
线性核酸2(5’→3’,l6416-4,37-4):
ccattttcgccggaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctcc(5’-磷酸化,长度为64nt,seqidno:2);
成环辅助链1(5’→3’):
agcggtccggcg(长度为12nt,seqidno:3);
成环辅助链2(5’→3’):
aaatggggagaa(长度为12nt,seqidno:4)。
来源:人工合成(苏州金唯智生物技术有限公司)。
两条线性核酸连接成为环状核酸后其序列是相同的,只是在连接成环时选择的连接位置有所不同。线性核酸1是将连接处选择在了发夹旁边,线性核酸2则将连接处选择在了远离发夹的地方。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为5μm,线性核酸与成环辅助链的摩尔比为1:2,10ut4dna连接酶(购自thermoscientific),1×t4dna连接酶缓冲液(ligasebuffer),总体积20μl;25℃条件下连接1小时。两条线性核酸在连接后形成的环状核酸的序列是相同的,只是在连接时选择的连接位置不同。
2)酶切确认
取一部分连接后的体系,并加入外切酶exonucleasei,将体系中的单链去除。酶切体系:连接体系5μl,1×exonucleasei外切酶缓冲液,5uexonucleasei,37℃条件下酶切1小时,总体积10μl。
3)电泳检测
如图2a、图2b和图2c所示。其中,图2a为l643-4,24-4的mfold模拟图,图2b为l6416-4,37-4的mfold模拟图,模拟条件为,[mg2+]=10mm,25℃。图2c中反应体系及条件:[线性核酸]=5μm,[成环辅助链]=10μm,10ut4dna连接酶,1×t4dna连接酶缓冲液,25℃,1小时。泳道1为l643-4,24-4,未加入成环辅助链和连接酶;泳道2为l643-4,24-4加入成环辅助链和t4dna连接酶后的条带;泳道3为l643-4,24-4连接成环后加入外切酶将单链去除后的条带;泳道4为l6416-4,37-4,未加入成环辅助链和连接酶;泳道5为l6416-4,37-4加入成环辅助链和t4dna连接酶后的条带;泳道6为l6416-4,37-4连接成环后加入外切酶将单链去除后的条带。
图2c为发夹在链的末端及在链的中部的连接成环及酶切后结果比较(10%尿素变性丙烯酰胺凝胶电泳)。结果显示,当发夹结构在链的末端时,其生成的环状核酸的产率可以达到93%,且酶切后可达100%。但是当连接位置在没有发夹的地方时,其生成的环状核酸的产率只有45%,酶切后为64%。由结果可以看出,当选择带有末端发夹结构的地方进行连接时,其成环率可显著提升,使成环产率从45%到93%。
实施例2
1、原料
线性核酸1(5’→3’,l743-4,24-4,65-2):
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttcctttctcgccacgttcgccgg(5’-磷酸化,长度为74nt,seqidno:5);
线性核酸2(5’→3’,l643-4,24-4,55-2):
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttctcgccacgttcgccgg(5’-磷酸化,长度为64nt,seqidno:6);
线性核酸3(5’→3’,l543-4,24-4,45-2):
accgctacacttgccagcgccctagcgcccgctcctttcgctttcgttcgccgg(5’-磷酸化,长度为54nt,seqidno:7);
线性核酸4(5’→3’,l4414-6,24-4,55-2):
accgctacacttgccagcgccctagcgccgctttcgttcgccgg(5’-磷酸化,长度为44nt,seqidno:8);
线性核酸5(5’→3’,l3414-6,35-2):
accgctacacttgccagcgcgccacgttcgccgg(5’-磷酸化,长度为34nt,seqidno:9);
成环辅助链(5’→3’):
agcggtccggcg(长度为12nt,seqidno:10)。
来源:人工合成(苏州金唯智生物技术有限公司)。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为5μm,线性核酸与成环辅助链的摩尔比为1:2,10ue.colidna连接酶,1×e.colidna连接酶缓冲液,总体积40μl;16℃条件下连接2小时。选择带有末端发夹的不同长度的单链进行连接。
2)酶切确认
取一部分连接后的体系,并加入外切酶exonucleasei,将体系中的单链去除。酶切体系:连接体系5μl,1×exonucleasei外切酶缓冲液,5uexonucleasei,37℃条件下酶切1小时,总体积10μl。
3)电泳检测
如图3a、图3b、图3c、图3d、图3e和图3f所示。其中,图3a为l743-4,24-4,65-2的线性核酸的mfold模拟图,图3b为l643-4,24-4,55-2的线性核酸的mfold模拟图,图3c为l543-4,24-4,45-2的线性核酸的mfold模拟图,图3d为l4414-6,24-4,55-2的线性核酸的mfold模拟图,图3e为l3414-6,35-2的线性核酸的mfold模拟图,模拟条件为,[mg2+]=10mm,25℃。图3f反应体系及条件:[线性核酸]=5μm,[成环辅助链]=10μm,10ue.colidna连接酶,1×e.colidna连接酶缓冲液,16℃,2小时。泳道1、4、7、10、13为线性核酸,未加入成环辅助链和连接酶;泳道2、5、8、11、14为线性核酸加入成环辅助链和e.colidna连接酶后的条带;泳道3、6、9、12、15为线性核酸连接成环后加入外切酶将单链去除后的条带。
图3f为不同长度线性核酸使用“末端发夹”方法成环的结果比较(10%尿素变性丙烯酰胺凝胶电泳)。结果显示,线性核酸的长度在54nt以上时,带有末端发夹的单链的成环率可达94%以上,当线性核酸的长度降到44nt左右时,成环率会降到60%左右。且当线性核酸的长度降到34nt时,成环率仅有14%。
实施例3
1、原料
线性核酸1(5’→3’,l642-4,23-4,51-2):
ccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgccgga(5’-磷酸化,长度为64nt,seqidno:11);
线性核酸2(5’→3’,l643-4,24-4):
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgccgg(5’-磷酸化,长度为64nt,seqidno:12);
线性核酸3(5’→3’,l644-4,25-4):
gaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgccg(5’-磷酸化,长度为64nt,seqidno:13);
线性核酸4(5’→3’,l645-4,26-4):
ggaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgcc(5’-磷酸化,长度为64nt,seqidno:14);
线性核酸5(5’→3’,l646-4,27-4):
cggaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgc(5’-磷酸化,长度为64nt,seqidno:15);
成环辅助链1(5’→3’):
tagcggtccggc(长度为12nt,seqidno:16);
成环辅助链2(5’→3’):
agcggtccggcg(长度为12nt,seqidno:17);
成环辅助链3(5’→3’):
gcggtccggcga(长度为12nt,seqidno:18);
成环辅助链4(5’→3’):
cggtccggcgaa(长度为12nt,seqidno:19);
成环辅助链5(5’→3’):
ggtccggcgaaa(长度为12nt,seqidno:20)。
来源:人工合成(苏州金唯智生物技术有限公司)。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为5μm,线性核酸与成环辅助链的摩尔比为1:2,5ut4dna连接酶,1×t4dna连接酶缓冲液,总体积10μl;25℃条件下连接4小时。两条线性核酸在连接后的序列是相同的,只是在连接时选择的连接位置不同。
2)酶切确认
取一部分连接后的体系,并加入外切酶exonucleasei,将体系中的单链去除。酶切体系:连接体系5μl,1×exonucleasei外切酶缓冲液,5uexonucleasei,37℃条件下酶切1小时,总体积10μl。
4)电泳检测
如图4a、图4b、图4c、图4d、图4e和图4f所示。其中,图4a为l642-4,23-4,51-2的线性核酸的mfold模拟图,图4b为l643-4,24-4的线性核酸的mfold模拟图,图4c为l644-4,25-4的线性核酸的mfold模图,图4d为l645-4,26-4的线性核酸的mfold模拟图,图4e为l646-4,27-4的线性核酸的mfold模拟图,模拟条件为,[mg2+]=10mm,25℃。图4f反应体系及条件:[线性核酸]=5μm,[成环辅助链]=10μm,10ut4dna连接酶,1×t4dna连接酶缓冲液,25℃,12小时。泳道1、3、5、7、9为线性核酸,未加入成环辅助链和连接酶;泳道2、4、6、8、10为线性核酸加入成环辅助链和t4dna连接酶后的条带。
图4f为发夹位于链末端的不同位置的线性核酸的成环结果比较(10%尿素变性丙烯酰胺凝胶电泳)。结果显示,随着发夹离连接处碱基的增加,环状核酸的产率会降低,当发夹离连接处距离为1-3nt的碱基长度时,环状核酸的产率为90%左右,当发夹里连接处距离为4、5nt时,其环状核酸的产率下降到70%左右。
实施例4
1、原料
线性核酸1(5’→3’,l640-4,24-4):
cgctacacttgccagcgcccactagcgcccgctcctttcgctttcttctccccattttcgccgg(5’-磷酸化,长度为64nt,seqidno:21);
线性核酸2(5’→3’,l640-6,24-4):
ggcgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgccgg(5’-磷酸化,长度为64nt,seqidno:22);
线性核酸3(5’→3’,l640-7,24-4):
ggcgcgccacttgcgcgcgccctagcgcccgctcctttcgctttcttctccccattttcgccgg(5’-磷酸化,长度为64nt,seqidno:23);
线性核酸4(5’→3’,l640-7,20-4):
ggcgcgcgaagcgcgccctagcgcccgctcctttcgctttcttctccccattttcgccgg(5’-磷酸化,长度为64nt,seqidno:24);
成环辅助链1(5’→3’):
gtagcgccggcg(长度为12nt,seqidno:25);
成环辅助链2(5’→3’):
agcgccccggcg(长度为12nt,seqidno:26);
成环辅助链3(5’→3’):
cgcgccccggcg(长度为12nt,seqidno:27)。
来源:人工合成(苏州金唯智生物技术有限公司)。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为5μm,线性核酸与成环辅助链的摩尔比为1:2,1000ut3dna连接酶(购自newenglandbiolabs),1×t3dna连接酶缓冲液,总体积20μl;25℃条件下连接12小时。选择带有末端发夹的不同长度的单链进行连接。
2)电泳检测
如图5a、图5b、图5c、图5d和图4e所示。其中,图5a为l640-4,24-4的线性核酸的mfold模拟,其末端发夹的tm值为57℃,图5b为l640-6,24-4的线性核酸的mfold模拟图,其末端发夹的tm值为73℃,图5c为l640-7,24-4的线性核酸的mfold模拟图,其末端发夹的tm值为85℃,图5d为l640-7,20-4的线性核酸的mfold模拟图,其末端发夹的tm值为90℃,模拟条件为,[mg2+]=10mm,25℃。图5e反应体系及条件:[线性核酸]=5μm,[成环辅助链]0=10μm,1000ut3dna连接酶,1×t3dna连接酶缓冲液,25℃,12小时。泳道1、3、5、7为线性核酸,未加入成环辅助链和连接酶;泳道2、4、6、8为线性核酸加入成环辅助链和t3dna连接酶后的条带。
图5e为末端带有不同稳定性的发夹的线性核酸的成环结果比较(12%尿素变性丙烯酰胺凝胶电泳)。结果显示,当末端发夹结构的tm大约在50-70℃左右时,连接后的环状核酸量会在90%左右,当tm高于80℃时,其成环率会下降至64%左右。
实施例5
1、原料
用实施案例1中的两条线性核酸进行连接速率及成环率的测定。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为5μm,线性核酸与成环辅助链的摩尔比为1:2,10ut4dna连接酶,1×t4dna连接酶缓冲液,总体积30μl;25℃条件下,连接时间分别为2min,5min,10min,20min,40min,1h,2h,3h。
2)电泳检测
图6a和图6b为发夹在末端的线性核酸与发夹在中部的线性核酸不同时间内的成环结果比较(12%尿素变性丙烯酰胺凝胶电泳)。转化率=(环状核酸+多聚副产物)/总的线性核酸量,转化率表示线性核酸的连接速率;成环率=环状核酸/总的底物量,成环率表示线性核酸的成环效果。结果显示,发夹在中部(末端无发夹)的线性核酸的连接速率为发夹在末端的线性核酸的连接速率的10倍以上。末端无发夹时,分子间的碰撞几率增大,连接速率过快,所以副产物量急剧上升。末端有发夹的线性核酸连接成环后环状核酸的产率可达90%以上,发夹在中部的线性核酸的环状核酸产率仅为45%。
实施例6
1、原料
用实施案例1中的两条线性核酸进行高浓度连接比较。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为10μm、20μm、40μm、60μm、100μm,线性核酸与成环辅助链的摩尔比为1:2,10-50ut4dna连接酶,1×t4dna连接酶缓冲液和0.1×t4dna连接酶缓冲液,总体积10μl;25℃条件下,连接时间为12小时。
3)电泳检测
如图7a和图7b所示,图7a为l643-4,24-4的高浓度成环电泳图,图7b为l6416-4,37-4的高浓度成环电泳图。泳道2-6、9连接用1×t4连接酶缓冲液为;泳道7、10连接用0.1×t4连接酶缓冲液。
从结果图中可以看出,带有末端发夹的线性核酸(线性核酸1)在100μm终浓度时环状核酸的产率可达80%以上,而此时的发夹在中部的线性核酸(线性核酸2)的成环率只有27%。
实施例7
1、原料
线性核酸(5’→3’,lrna):
cugcuguuguucccuuauaauuuccuccuccauaguuuccuucugaguuguguu(5’-磷酸化,长度为54nt,seqidno:28);
成环辅助链(5’→3’):
aacagcagaacacaac(长度为16nt,seqidno:29);
来源:人工合成(苏州金唯智生物技术有限公司)。
2、试验
1)连接成环
将线性核酸和相应的成环辅助链、连接酶和连接缓冲液混合在一个体系中,该体系中线性核酸的浓度为1μm,线性核酸与成环辅助链的摩尔比为1:2,5ut4rna连接酶,1×t4rna连接酶缓冲液,总体积20μl;37℃条件下连接12小时。
2)电泳检测
如图8a和图8b所示。其中,图8a为lrna的mfold模拟图,模拟条件为,[mg2+]=10mm,37℃。图8b中反应体系及条件:[线性核酸]=1μm,[成环辅助链]=2μm,5ut4rna连接酶,1×t4rna连接酶缓冲液,37℃,12小时。泳道1为lrna,未加入成环辅助链和连接酶;泳道2为lrna加入成环辅助链和t4rna连接酶后的条带;
图8b为发夹结构位于末端的rna链的成环结果(12%尿素变性丙烯酰胺凝胶电泳)。结果显示,当发夹结构位于rna链的末端时,连接后其成环率可达90%以上(泳道2),说明末端发夹结构对于rna链的连接成环也有显著促进作用。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>中国海洋大学
<120>单链环状核酸及其制备方法和应用
<160>29
<170>patentinversion3.5
<210>1
<211>64
<212>dna
<213>人工序列
<400>1
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcg60
ccgg64
<210>2
<211>64
<212>dna
<213>人工序列
<400>2
ccattttcgccggaccgctacacttgccagcgccctagcgcccgctcctttcgctttctt60
ctcc64
<210>3
<211>12
<212>dna
<213>人工序列
<400>3
agcggtccggcg12
<210>4
<211>12
<212>dna
<213>人工序列
<400>4
aaatggggagaa12
<210>5
<211>74
<212>dna
<213>人工序列
<400>5
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttcctttctc60
gccacgttcgccgg74
<210>6
<211>64
<212>dna
<213>人工序列
<400>6
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttctcgccacgttcg60
ccgg64
<210>7
<211>54
<212>dna
<213>人工序列
<400>7
accgctacacttgccagcgccctagcgcccgctcctttcgctttcgttcgccgg54
<210>8
<211>44
<212>dna
<213>人工序列
<400>8
accgctacacttgccagcgccctagcgccgctttcgttcgccgg44
<210>9
<211>34
<212>dna
<213>人工序列
<400>9
accgctacacttgccagcgcgccacgttcgccgg34
<210>10
<211>12
<212>dna
<213>人工序列
<400>10
agcggtccggcg12
<210>11
<211>64
<212>dna
<213>人工序列
<400>11
ccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcgc60
cgga64
<210>12
<211>64
<212>dna
<213>人工序列
<400>12
accgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcg60
ccgg64
<210>13
<211>64
<212>dna
<213>人工序列
<400>13
gaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttc60
gccg64
<210>14
<211>64
<212>dna
<213>人工序列
<400>14
ggaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccatttt60
cgcc64
<210>15
<211>64
<212>dna
<213>人工序列
<400>15
cggaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattt60
tcgc64
<210>16
<211>12
<212>dna
<213>人工序列
<400>16
tagcggtccggc12
<210>17
<211>12
<212>dna
<213>人工序列
<400>17
agcggtccggcg12
<210>18
<211>12
<212>dna
<213>人工序列
<400>18
gcggtccggcga12
<210>19
<211>12
<212>dna
<213>人工序列
<400>19
cggtccggcgaa12
<210>20
<211>12
<212>dna
<213>人工序列
<400>20
ggtccggcgaaa12
<210>21
<211>64
<212>dna
<213>人工序列
<400>21
cgctacacttgccagcgcccactagcgcccgctcctttcgctttcttctccccattttcg60
ccgg64
<210>22
<211>64
<212>dna
<213>人工序列
<400>22
ggcgctacacttgccagcgccctagcgcccgctcctttcgctttcttctccccattttcg60
ccgg64
<210>23
<211>64
<212>dna
<213>人工序列
<400>23
ggcgcgccacttgcgcgcgccctagcgcccgctcctttcgctttcttctccccattttcg60
ccgg64
<210>24
<211>60
<212>dna
<213>人工序列
<400>24
ggcgcgcgaagcgcgccctagcgcccgctcctttcgctttcttctccccattttcgccgg60
<210>25
<211>12
<212>dna
<213>人工序列
<400>25
gtagcgccggcg12
<210>26
<211>12
<212>dna
<213>人工序列
<400>26
agcgccccggcg12
<210>27
<211>12
<212>dna
<213>人工序列
<400>27
cgcgccccggcg12
<210>28
<211>54
<212>rna
<213>人工序列
<400>28
cugcuguuguucccuuauaauuuccuccuccauaguuuccuucugaguuguguu54
<210>29
<211>16
<212>dna
<213>人工序列
<400>29
aacagcagaacacaac16
- 还没有人留言评论。精彩留言会获得点赞!