水稻OsERF101基因在提高干旱天气下水稻结实率上的应用的制作方法
本发明属于分子生物学、基因工程
技术领域:
,具体涉及一种水稻oserf101基因在提高干旱天气下水稻结实率上的应用,本发明在水稻中表达的转录因子oserf101基因的表达特征鉴定、转录活性确定、转基因载体构建、转化以及转基因植株的耐旱性和育性观察,实验结果表明该基因在作物抗旱性改造及稳产上具有应用价值。
背景技术:
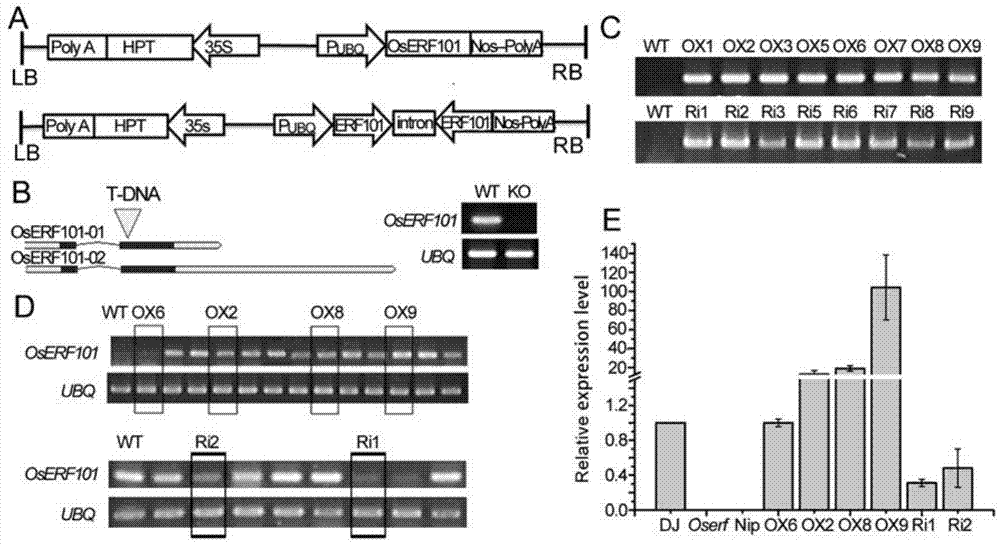
水稻在我国广为种植,是中国人口的主粮作物,水稻种植过程中需要大量的灌溉用水,但我国是联合国认定的13个贫水国之一,缺水严重限制了水稻的生长和产量的稳定;另外,长江中下游地区是我国水稻的主栽区,在夏季经常会面临高温和干旱交织的天气,由于水稻的扬花期也在夏季,干热天气往往导致严重的谷物减产。由于这些原因,培植耐旱性增强的水稻,减少灌溉用水,对我国的水资源安全、粮食安全以及保证农民的经济收入具有非常重要的现实意义。在作物育种领域,分子育种比常规育种时间短、见效快,可以有目的地对作物的性状进行优化。进行作物耐旱性改造的手段之一就是挖掘与植物耐旱性相关的基因,利用基因工程技术进行分子育种,使得在面临干旱时,抗旱相关基因可以在水稻中高度表达,从而改善水稻的抗旱性,培育出抗旱又稳产优质的农作物新品种。本申请中涉及的erf101基因属于ap2/erebp(apetala2/ethyleneresponsiveelementbindingprotein)转录因子超家族的一员,这个家族依据其含有ap2/erf功能域的数量和进化关系,又可以分为4个亚家族,包括ap2,rav(relatedtoabi3/vp1),dreb(dehydration-responsiveelement-bindingprotein)和erf(ethylene-responsivefactor)亚家族(sakumaetal.2002;sharonietal.2011),其中,dreb和erf亚家族包括单个ap2/erf域,可以直接结合到dna顺式因子上(nakanoetal.2006)。来自这两个亚家族的成员分别与生物和非生物胁迫响应有关。erf亚家族主要通过结合启动子区域的gccbox(chakravarthyetal.2003;ohme-takagiandshinshi1995;wangetal.2004),调节生物胁迫响应有关基因的表达;而dreb亚家族则通过与c-重复(c-repeat)或者dre元件结合调节非生物途径基因的表达(chenetal.2008;gilmouretal.1998;stockingeretal.1997)。但在过去的几年时间,也有实验室发现,erf亚家族的成员也参与了一些非生物胁迫过程的调控。例如烟草中的tsi1(tobaccostress-inducedgene1)和tsrf1(tomatostress-responsivefactor1)转录因子,可以同时结合到gcc盒和dre顺序上调节植物的盐和干旱耐受性(parketal.2001;quanetal.2010;zhangetal.2004);水稻erf亚家族的一个重要成员sub1a(submergence1a),是水稻耐淹性决定的一个主调控因子(fukaoetal.2011);另两个erf亚家族成员oserf922andosderf1,也分别调节了水稻营养生长期的耐盐和耐旱性(liuetal.2012a;wanetal.2011).水稻ap2/erebp家族中共有163个成员,有77个属于erf亚家族(sharonietal.2011),在实验室的前期工作中,我们发现oserf101受干旱胁迫的诱导(jinetal.2013),但它是否具有转录激活的活性以及在在干旱胁迫响应中发挥何种作用是未知的。为了阐明该基因的功能,我们利用分子及生化手段研究了该基因的表达特征和蛋白质产物活性,并利用过表达、干扰及突变体株系观察了该基因表达变化引起的作物表型变化。我们发现oserf101编码一个转录因子,在正常情况下主要表达水稻的花器官中,但在叶片和花中都受干旱胁迫的诱导,通过转基因的实验证明了它可以改善植物耐旱性,增强干旱天气下花粉粒的育性,提高干旱天气下水稻的结实率。因此,该基因在稳定干旱天气下作物的产量上具有重要应用价值。技术实现要素:本发明的目的在于提供一种水稻oserf101基因在提高干旱天气下水稻结实率上的应用。具体地,提供水稻oserf101基因在提高作物抗旱性,从而稳定干旱天气下作物的结实率以及产量上的功能。相应地,利用水稻oserf101基因的功能构建转基因植物,得到抗旱性增强的植物,例如抗旱性更好的农作物。本发明提出的水稻oserf101基因在提高干旱天气下水稻结实率上的应用,水稻中过表达oserf101可以增强水稻的抗旱性,提高干旱胁迫下水稻的结实率,从而稳定干旱天气下水稻的产量。本发明提出的水稻oserf101基因在提高干旱天气下水稻结实率上的应用,具体步骤如下:(1)将编码oserf101蛋白的开放阅读框核苷酸顺序可操作的连接入植物转基因载体;(2)将步骤(1)得到的植物转基因载体转入到农杆菌中,将含有表达载体的农杆菌侵染水稻愈伤,经过共培养、除菌、抗生素筛选和分化,获得oserf101基因的过表达的转基因植株。本发明中,步骤(1)中将编码水稻转录因子oserf101的核苷酸序列转化到水稻中,应用于改变水稻抗旱性。本发明中,步骤(2)中所述农杆菌为eha105。本发明中,将含有表达载体的农杆菌侵染水稻愈伤,在28℃下培养、除菌、抗生素筛选和分化,共计4个月的时间。本发明中,水稻转录因子oserf101的核苷酸顺序,其基因座位:loc_os04g32620,基因全长2360bp,黑体下划线部分为外显子,其余为内含子和utr区域,核苷酸序列见seqidno.1所示;cdna编码区序列长807bp,序列见seqidno.2所示;该基因编码268个氨基酸,氨基酸序列见seqidno.3所示。本发明中,从水稻mrna中通过反转录pcr克隆oserf01的引物序列,该扩增水稻oserf01基因的引物为seqidno.4和seqidno.5。seqidno.4具体为oserf101-f:5’-ggatccatggtcaccgcgctagccca-3’;seqidno.5具体为oserf101-r:5’-ggtacctcacgacgacgaatccttctt-3’。本发明中,所述水稻oserf01基因的载体,如pcambia1301u载体。本发明中,所述水稻erf01基因载体的宿主。优选地,所述宿主为植物;更优选地,所述宿主为水稻。本发明提供用于检测转基因水稻中表达量的方法,主要利用荧光定量pcr的方法;具体步骤为:取转基因水稻的叶片,用trizol法抽提水稻rna,并用dnasei消化dna,然后反转录形成cdna,以其为模板进行荧光定量pcr进行分析。荧光定量pcr引物核苷酸序列为seqidno.6和seqidno.7。seqidno.6具体为oserf101qpcr-f:5’-cagcaggcttcttccttctacc-3’,seqidno.7具体为oserf101qpcr-r:5’-cttcttcgggtcccttatctcc-3’。根据本申请所报道的oserf101基因的功能,利用转基因手段将oserf101转入植物中得到的抗旱性增强的转基因植物,例如抗旱性增强的水稻、玉米、小麦或大豆等作物株系。本发明至少具有下列优点及有益效果:(1)本发明提供的水稻oserf101基因及其编码蛋白在改良植物抗旱性方面具有明显作用,能够降低在干旱土地上种植的农作物的死亡率,具有很大的应用价值。(2)利用转基因技术得到的含有本发明oserf101基因的转化植物在缺水条件下花粉粒育性优于野生型,表明了oserf101基因能够通过改善作物的生殖生长状态和提高结实率来稳定干旱天气下的粮食作物产量。附图说明图1.转基因载体构建及转基因植物鉴定。a.过表达及rna干扰载体简要示意图,上图为过表达载体,下图为rnai载体;b.t-dna插入突变体中t-dna在oserf101基因中插入位点示意图,右侧为利用半定量pcr检测oserf101基因在野生型和突变体中表达水平的结果,表明oserf101突变体是一个功能缺失型突变体;c.利用pcr手段扩增hpt基因(潮霉素抗性基因)鉴定转基因阳性株系;d.利用半定量rt-pcr鉴定oserf101在过表达和rna干扰株系中的表达水平。图中标出了用来进行干旱实验的株系;e.利用定量pcr方法鉴定oserf101在过表达和rna干扰株系中的表达水平。鉴定oserf101突变体和rnai株系时利用花作为抽提rna的材料,因为oserf101高度表达于花中;鉴定过表达株系则用叶子作为材料,因为oserf101在叶子中表达水平低。图2.oserf101具有转录活性。转空bd载体的酵母作为对照,转bd-oserf101载体的酵母出现蓝色,说明oserf101具有激活报告基因表达的作用。图3.渗透和干旱胁迫下oserf101过表达株系的表型。a-d.苗期渗透胁迫下oserf101过表达株系的表型。4叶期植物(生长约3周)置于20%peg6000处理3天,然后拍照。a,c,胁迫前植物;b,d,胁迫后植物。vc为转基因载体对照。ox2,8,9为过表达株系,表现出明显的渗透胁迫耐受表型。比例尺,2cm。e-h.孕穗期干旱胁迫下oserf101过表达株系的表型。e,g,干旱胁迫前;f,h,干旱胁迫后。比例尺:10cm。i.孕穗期干旱胁迫后植株的生存率分析;j.干旱前后叶片相对含水量分析;k.干旱前后叶片中叶绿素含量分析;l.干旱前后叶片中脯氨酸含量分析;m.干旱前后叶片pod酶活分析;n.干旱前后叶片sod酶活分析。图中显示为平均值±标准差(n≥40)。实验重复3次;野生型与转基因株系之间的差异进行t-检验,*p≤0.05,**p≤0.01。图4.oserf101表达缺失降低了水稻耐旱性。a.正常和干旱胁迫下oserf101干扰株系和缺失突变体的表型。ri1,ri2为干扰株系;ko为oserf101突变体。比例尺:10cm。b.干旱胁迫下各株系的存活率比较;c.正常及干旱胁迫下各株系叶片相对水含量比较;d.正常及干旱胁迫下各株系叶片叶绿素含量比较;e.正常及干旱胁迫下各株系叶片脯氨酸含量分析;f.正常及干旱胁迫下各株系叶片pod活性分析;g.正常及干旱胁迫下各株系叶片sod活性分析。图中值为平均值±sd(n≥40),实验为3次重复。野生型与突变体之间的差异进行t检验,*p≤0.05,**p≤0.01。图5.oserf101过表达增强了干旱胁迫下水稻花粉粒育性,并提高了结实率。a.利用历山大红进行花粉粒染色的结果。可育花粉粒染成深紫色而不育花粉粒为蓝色;b.正常和干旱胁迫下不同植物花粉粒育性比较,过表达提高了干旱胁迫下花粉粒育性;c.正常和干旱胁迫条件下不同植物的结实率比较,过表达提高了干旱胁迫下结实率;d.正常和干旱胁迫下不同植物的千粒重比较,各株系千粒重无显著性差异。图中值为平均值±sd(n≥20),实验为3次重复。野生型与突变体之间的差异进行t检验,*p≤0.05,**p≤0.01。图6.oserf101基因在水稻中的表达谱分析。a.正常生长条件下poserf101:gus转基因株系中gus报告基因的组织特异性表达情况。蓝色为gus活性信号。其中幼叶为4叶期叶片;老叶为分蘖期叶片;b.正常生长条件下的花药利用oserf101探针进行原位杂交的结果。oserf101表达于绒毡层和小孢子中。褐色指示阳性信号。正义链杂交作为反义链杂交的对照。t,绒毡层;msp,小孢子;c.oserf101在不同胁迫条件下的表达谱分析。peg6000,20%;aba,50μm;nacl,200mm。两周大小的苗用peg6000,aba或nacl处理,取叶片进行qrt-pcr。图中显示的值为平均值±标准差,t-检验*p<0.05;**p<0.01。比例尺:根、愈伤、幼叶、老叶、干旱的幼叶和老叶为1cm;穗原基,0.5cm;幼花和雌蕊,0.5mm;雄蕊和发育中种子,1mm;b中比例尺:50μm。图7.oserf101调控了逆境胁迫耐受相关基因的表达。a.oserf101过表达株系和突变体中胁迫响应性基因的表达水平发生变化。干旱胁迫一周后收集第5-8期的花进行qrt-pcr,以野生型植物花作为对照。d-ox8,d-ox9为干旱胁迫下的过表达株系;d-wt为干旱胁迫下的野生型;ko为突变体;b.两周大的苗以20%peg6000处理不同时间后aba响应基因在叶片中的表达水平变化,oserf101的过表达改变了这些基因的表达水平。图中显示的值为平均值±标准差。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。以下实施例中未注明具体条件的实验方法,均按照常规条件,例如sambrook等分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,l989)中所述的条件,或按照制造厂商建议的条件。实施例1水稻oserf101基因cdna的克隆、转基因载体构建和突变株系的获取(1)rna的提取:取干旱处理的水稻花,在研钵中用液氮冷冻后研磨成粉状,加入1mltrizol试剂(takara)中,充分振荡后,室温放置5分钟,于4℃,12000rpm离心10min后,上清移至新的ep管中,加上200µl氯仿混成乳状,室温静置5分钟,12000rpm离心10min后,上清液移至新的ep管中,加入两倍体积异丙醇沉淀rna,溶解后37℃用dnasei(fermentas)消化降解残留dna1小时。然后在分光光度计上测定rna含量。(2)反转录:按照takara公司的primescripttmreversetranscriptase说明书进行操作:离心管中加入水稻总rna5µl(5µg),oligo(dt)17primer(50µmol/l)1µl,dntp(10mmol/l)1µl,并用双蒸水加至10µl;瞬时离心使液体集中于管底,65℃保温5min,迅速在冰上冷却2min以上。在上述混合物中加入5×primescripttmbuffer4µl,rnase抑制剂(40u/µl)0.5µl,primescripttmreversetranscriptase(200u/µl)0.5µl,双蒸水加至20µl,离心使液体集中于管底,42℃保温1h,70℃灭活15min,冰上冷却,得到水稻cdna。(3)cdna的克隆根据genbank中水稻数据库信息中提供的序列信息,设计引物(seqidno.4),采用rt-pcr方法进行cdna全长克隆。通过rt-pcr得到一个包含有完整开放读框的编码区,长度为810bp左右;回收,连接到pmd19-t载体上,并进行测序。测序结果在ncbi网站上进行blast分析,结果显示其与水稻注释基因loc_os04g32620匹配,注释为ap2/erf超家族成员oserf101。(4)过表达转基因载体构建将带有oserf101完整读码框的cdna片段从测序正确的中间载体pmd19-t上切下来后进一步克隆到以玉米ubiquitin基因为启动子的过表达载体(如pcambia1301u)上(图1a),测序,在保证阅读框架正确的前提下再将该过表达载体转入农杆菌中,通过菌落pcr筛选含有oserf101cdna的阳性农杆菌菌落,然后利用农杆菌介绍的水稻转基因方法(ozawa2009)将过表达载体转入水稻日本晴中。(5)oserf101rna干扰载体的构建为了进一步证明oserf101的功能,我们又利用rna干扰手段构建了该基因的knockdown(敲低)株系。将oserf101基因编码区中顺序特异性较强的长度为371bp的片段以正反两个方向插入到pgem-rnai载体中,形成一个发夹回文结构(图1b),然后将这一段发夹结构利用两端的限制性内切酶位点切下来插入pcambia1301u载体中,测序确定克隆正确后,转入eha105农杆菌中,通过农杆菌介导的转基因技术,将干扰基因转入水稻日本晴中,筛选到潮霉素阳性苗后,种植于大田,获得下一代的种子。(6)启动子的克隆及gus报告载体构建以ctab法提取水稻基因组dna,通过pcr技术扩增oserf101基因atg上游3kb大小片段的启动子,上游引物引入hindiii酶切位点及保护碱基,下游引物引入bamhi酶切位点及保护碱基。酶切后的扩增产物在t4连接酶作用下连入终载体pcambia1301中,使得oserf101的启动子与gus报告基因融合。获得连接正确的质粒后转入农杆菌eha105中,然后利用农杆菌将报告基因转入水稻日本晴中。(7)oserf101突变株系的获得和鉴定为了进一步确认oserf101的功能,我们从risd-db(http://cbi.khu.ac.kr/risd_db.html)数据库订到该基因的t-dna插入突变体(图1b),经dna和rna水平鉴定发现t-dna插入在第二个外显子中,它是一个基因表达缺失型突变体(图1b);实施例2转基因植株的鉴定剪取转基因水稻叶片,用ctab法提取dna,通过检测潮霉素基因是否存在的方法鉴定转基因情况(图1c)。用trizol法抽取叶片或花中rna,反转录成cdna,反转录采用takara公司的primescript™rtreagentkitwithgdnaeraser。由于oserf101在花中表达水平较高,而在幼叶中表达水平低,因此检测rnai及突变体中oserf101表达水平时,采用花作为材料来进行定量和半定量pcr,以显示oserf101表达水平的差异;而检测过表达株系则采用叶片为材料,原因相同。利用半定量pcr手段进行转基因株系的初筛(图1d),利用定量pcr进一步确认其表达水平的差异(图1e)。荧光定量试剂采用takara公司的primescript™rtmastermix。荧光定量pcr仪为abisteponeplustm,引物序列见seqidno.5。对转基因株系中oserf101的表达水平进行半定量和定量pcr鉴定之后,选择ox2、ox6、ox8和ox9不同表达量的转基因株系继续表型观察,其中ox6中oserf101的表达水平与野生型接近,可以作为转基因对照或者空载体对照(vc);rnai转基因株系中则选择r1和r2两个表达量比较低的株系与突变体一起进行表型观察(图1d、1e)。实施例3酵母单杂交确定oserf101的转录激活活性将oserf101基因的开放阅读框克隆于酵母载体pdest-gbkt7中,然后转化到ah109宿主菌中(gietzandwoods2002)。将酵母涂布在sd/-trp单缺培养基上,筛选阳性转化子,然后将阳性菌落过夜培养并稀释后,点种于补充了x-α-gal的sd/-trp单缺培养基上,观察mel1的酶活性,如果菌落变蓝,则表明oserf101具有转录激活活性,激活了gal4报告基因的表达。结果表明(图2),oserf101确实具有激活报告基因表达的转录活性,表明它是一个转录因子。实施例4oserf101过表达转基因水稻植株的抗旱性鉴定实验室进行芯片分析及基因表达分析的结果均表明,oserf101在干旱条件下表达水平明显提高,表明它参与水稻抗旱胁迫响应过程,因此对oserf101基因的过表达转基因水稻(日本晴)在苗期和成株期进行水分胁迫实验,以分析水稻基因osmyb的抗旱和抗渗透胁迫的表型。(1)营养器官(叶)抗旱性鉴定在水稻液体培养基中生长水稻苗,待生长至四叶期时(约3周后),将peg6000加入培养基中至终浓度为20%,3天后观察各株系的萎蔫情况。结果表明,oserf101的过量表达株系ox2、ox8、ox9号株系对peg具有一定抗性,过表达株系的存活情况明显优于wt(图3a-d);将转基因水稻和对照株置于含水稻种植土的方形盘中生长,待水稻长到孕穗期时倾去盆中多余的水并停止浇水,让水分自然蒸发,待土壤含水率降低到20%左右时,维持此含水量约10天,然后复水一周,观察水稻表型,转基因水稻叶片的生存情况明显好于野生型(图3e-h)。测量水稻复水后的生存率后发现,过表达株系的生存率明显较高(可增加20%以上)(图3i),叶片含水量和叶绿素含量的测量也印证了过表达株系的生理状况好于野生型(图3j、k),说明oserf101过表达后增强了植株的耐旱性能;oserf101基因对干旱耐受起正调控作用。我们进一步检测了植株体内能帮助提高耐旱性能的酶活性及代谢物的水平,例如过氧化物酶(pod)活性、超氧化物歧化酶(sod)活性和脯氨酸含量的变化。结果表明,图4a中显示过量表达植株中的pod酶活性和脯氨酸含量都有明显升高(图3l、m),但sod活性无明显变化(图3n)。同样对苗期rnai株系r1、r2和突变体进行短期渗透胁迫,发现与野生型没有明显的不同(图略);但将植物种植于盆中进行缓慢干旱处理时,oserf101突变体(突变体对应的野生型背景为dj),则发现rna干扰株系和ko株系都比野生型对干旱更敏感(图4a,b),叶片含水率、叶绿素含量、脯氨酸含量和pod、sod酶活性较野生型均有不同程度的降低(图4c-g)。(2)花器官抗旱性鉴定水稻种植在含水稻土的方形盆中,当生长至生殖期启动时,倒去多余水分,自然干旱,待水分挥发至土壤含水率为20%左右时,每天适当补充少量水份,保持此低含水率一周,然后复水,取将要抽穗时的稻穗,利用亚历山大红染色法观察水稻花粉粒的活性,方法如下:取花药未完全开裂的花采集成熟花粉粒,将花药于载玻片上,加1滴蒸馏水,用镊子将花药捣碎,使花粉粒释放。晾干,大约10min;加1~2滴染色溶液,盖上盖玻片,5min;在显微镜下观察,观察2~3张片子,每片取3-5个视野,统计花粉的染色率,其中深紫红色的花粉为可育花粉,蓝色的为不育花粉(图5a),花粉育性等于可育花粉数/(可育+不育花粉总数)。结果显示,过表达osref101基因的转基因水稻在干旱条件下花粉粒育性明显高于对照组(图5b),育性提高了10%-20%,而rnai株系则相反。干旱后复水待水稻生长至成熟后测量结实率和千粒重,发现过表达株系中结实率也高于对照株(图5c),结实率提高9%-15%,与花粉粒育性提高的趋势一致,但千粒重则不受该基因表达水平的影响(图5d)。说明oserf101表达提高后对干旱胁迫下产量的影响主要是通过提高结实率而不是千粒重。附抗旱性生理指标方法:i.脯氨酸含量的测定脯氨酸含量的测定采用茚三酮法。(1)标准曲线制作:取7支具塞刻度15ml离心管按下表加入各试剂。混匀后加玻璃球塞,在沸水中加热30min。脯氨酸标准液为10μg/ml。取出冷却后向各管加人4ml甲苯充分振荡,静置,吸取甲苯层,以0号管为对照在波长520nm下比色。以消光值为纵坐标,以脯氨酸含量为横坐标,绘制标准曲线,求线性回归方程。试管号0123456水ml21.61.20.80.40.20脯氨酸标准液ml00.40.81.21.61.82冰乙酸ml2222222茚三酮ml2222222(2)样品测定;取不同处理的水稻叶片约0.2g剪碎混匀,分别置于离心管中,加入5ml3%磺基水杨酸溶液,沸水浴中浸提30min。取出试管,待冷却至室温后,吸取上清液2ml,加2ml冰乙酸和2ml茚三酮显色液,于沸水浴中加热30min。下步操作按标准曲线制作方法进行甲苯萃取和比色。样品中脯氨酸含量的计算:脯氨酸含量(μg/g)=(c*v/a)/w*106式中c:提取液中脯氨酸含量(μg),通过标准曲线求得;v:提取液总体积(ml);a:测定时所吸取的体积(ml);w:样品重(g)。活性测定sod活性测定氮蓝四唑(nbt)法。(1)酶液提取:取不同处理的水稻叶片约0.5g,液氮研磨后,加入10ml提取液;取5ml于4℃下8000rpm离心15min。上清液即为sod粗提液。(2)显色反应:取质地相同的试管4支,2支为测定,2支为对照,按下表加入试剂。混匀后,1支对照管遮光,与其它管同时置于4000lx日光灯下28℃反应30min。试剂磷酸缓冲液metnbtedta核黄素酶液水用量ml1.50.30.30.30.30.10.5(3)sod活性测定与计算:反应结束后,用黑布罩试管,终止反应。以遮光的对照管作为空白,分别在560nm波长下测定各管的吸光度,计算sod活性。sod活性=(a0-as)×vt/(0.5×a0×fw×v1)其中sod总活性(u/g);a0:照光对照管的光吸收值;as:样品管的光吸收值;vt:样品总体积,ml;v1:测定时样品用量;fw:样品鲜重,g。活性测定pod活性测定采用愈创木酚法。(1)酶液的制备:取0.1g不同处理的水稻叶片,液氮研磨后转入到离心管中,定容到5ml,并于3000g离心10min。(2)过氧化物酶活性测定:酶活性测定的反应体系为2.9ml0.05m磷酸缓冲液,1.0ml2%h2o2,1.0ml0.5m愈创木酚和0.1ml酶液。用煮沸5min的酶液为对照,反应体系加入酶液后,立即于37℃水浴中保温15min,后迅速转入冰浴中,并加入2ml20%三氯乙酸终止反应,转入离心管中6000g离心5min。470nm波长下测定吸光度。(3)结果计算:以每分钟内a470变化0.01为1个过氧化物酶活性单位u。过氧化物酶活性[u/(g×min)]=△a470×vt/(w×vs×0.01×t)式中:△a470为反应时间内吸光度的变化;w为样品鲜重,g;t为反应时间,min;vt为提取酶液总体积,ml;vs为测定时取用酶液体积,ml。实施例5oserf101基因的表达特征分析及组织特异性表达观察分析表明oserf101在干旱胁迫和花药发育过程中起着重要的作用,为了进一步理解oserf101基因的功能,我们将oserf101基因启动子与报道基因gus融合构建报告载体转基因,以及利用原位杂交和qrt-pcr的手段来研究oserf101基因的时空表达模式。获得oserf101启动子驱动的gus报告基因转基因株系后(见实施例1),利用gus染色检测oserf101启动子在不同组织中的活性(图6a)。结果表明,在营养器官中,只有在干旱的老叶中能检测到gus信号,正常生长条件下的植株根、茎、幼叶、老叶中没有明显的gus染色信号,说明oserf101在正常情况下在这些组织中的表达水平较低,在干旱胁迫后的幼叶的受伤部位可以检测到gus信号;在生殖器官中,除晚期的内外稃外,早期(1-5期)的整朵花均能检测到较强的gus活性,11期以后仅在花药和雌蕊中检测到gus蓝色信号,在发育的种子中只有在伤口处能检测到信号。为了更深入了解oserf101的表达模式,我们用rna原位杂交方法来检测oserf101在水稻花药(雄蕊)的表达(图6b)。结果表明,在小穗发育的第4期,可在四个药室检测到弱的oserf101的信号;在stage5、6、7和8,在花药的绒毡层、小孢子中都能检测到较强oserf101的信号;在stage11在花药的绒毡层检测到oserf101的表达,在绒毡层残留部位也能检测到弱的oserf101信号,rna原位杂交结果基本与gus染色结果一致。为了进一步分析oserf101基因受胁迫诱导的表达情况,我们分别采集了受peg6000、aba和nacl处理不同时间点的水稻苗的总rna,通过qrt-pcr方法分析oserf101基因在不同处理下的表达模式(图6c)。结果表明,oserf101受peg、aba的诱导表达,在peg处理后1h明显上升,但处理24h后又下降了;而aba处理3小时才上升,至24h时达到最高值;oserf101不受nacl的诱导表达。综合以上结果可以看出,oserf101主要在生殖器官的内外稃、花药和雌蕊中表达。oserf101受peg和aba的诱导,但不受nacl的胁迫诱导。附实施例中所用到的方法:i.gus报告基因表达的组织化学染色取植物样品放入90%丙酮预处理10min;用适量的不含x-gluc的染色液洗涤一次;然后放入gus染色液中,抽真空10分钟3次;然后放入37℃恒温箱中避光温育,每隔半小时观察显色效果,可过夜;一定时间后,吸出gus染色液,加100%乙醇脱水,然后用光学显微镜拍照。后换成70%乙醇放在4℃可以长时间保存。原位杂交植物石蜡切片的过程:植物材料用无rnase的faa固定液固定,经梯度乙醇(50%、60%、70%、85%和95%各1h)脱水后,在用100%乙醇脱水4h(中间多换几次);以25%二甲苯,75%乙醇;50%二甲苯,50%乙醇;75%二甲苯,25%乙醇;100%二甲苯进一步脱水各1h,然后100%二甲苯+1/4体积的蜡片过夜;后逐步用石蜡替代二甲苯,然后每天换蜡两次,连续三天,此时,组织样品已经包埋在石蜡中;然后用石蜡切片机切片,切片的厚度为6-8μm。探针准备:原位探针构建的载体酶切线性化后,利用digrnalabelingkit(roche)进行体外转录,分别转录正义探针和反义探针。转录体系:模板dna2μg转录缓冲液2μl核苷酸(utpanddig-utpmix)2μlrnasin(rnase抑制剂)1μlrna聚合酶2μldepc处理过的无菌水补齐总体积为20μl37℃保温2小时。转录完后取1μl跑胶检测rna的质量,然后加80μldepc水、1μl100mg/mltrna和5unitsdnase,37℃保温10min消化dna。杂交前准备:实验所用器皿经180℃烘烤3~4小时;杂交操作完成前所使用的溶液均需用depc水配制;载玻片用专门的已经多聚赖氨酸处理的玻片。原位杂交的过程:(1)石蜡切片经常规二甲苯脱蜡至水,然后2×ssc预处理15-20min;(2)暴露mrna核酸片段:酶解rna上的蛋白质,暴露需杂交的目的rna。预热蛋白酶缓冲液,迅速加入蛋白酶k至终浓度1mg/ml,37℃保温30min;(3)组织再固定:固定液为1%多聚甲醛(以ph7.2-7.6的0.1mpbs配制),室温固定10分钟。depc-水洗3分钟×3次;(4)乙酸酐处理:将2ml乙酸酐加入400ml0.1m新配的三乙醇胺中,搅拌混匀后处理玻片10min,其主要作用是使带电荷的氨基乙酰化,防止非特异性吸附探针;(5)洗涤和脱水,依次1×pbs、30%、60%、80%、90%、95%、100%乙醇脱水后,抽真空干燥;(6)预杂交--湿盒的准备:干的杂交盒底部加用0.3mnacl-50%甲酰胺饱和的吸水纸以保持湿度。按每张切片加100μl预杂交液后至45℃恒温箱孵育1-2小时;(7)杂交:按每张玻片加100μl杂交液;(8)洗涤:去掉盖玻片,37℃左右的2×ssc洗5分钟×2次,0.5×ssc洗15分钟×1次,37℃0.2×ssc洗15分钟×1次;(9)rnase处理及洗涤:将37℃预热含rnase的溶液处理玻片30min后,用rnasebuffer洗涤3次,每次15min;然后用2×scc室温洗涤30min×2次;(10)显色:1×pbt室温洗涤5min;0.5%封闭液封闭30-60min;1×pbt洗涤1min;每张玻片加100μl抗dig-ap抗体室温孵育30-120min(在含有1×pbt的湿盒里);1×pbt洗涤20min×2min;1×tnm50洗涤5min;每张玻片加100μl2%nbt/bcip的显色液室温显色(最长可显色7天)。实施例6应用荧光定量pcr方法检测转oserf101基因水稻中抗逆基因表达的变化提取oserf101基因的过表达株系及突变体的rna,反转录成cdna,然后利用takara公司的荧光定量试剂进行rna表达的定量分析(具体操作参照相关公司的说明书),然后根据-δδct方法分析基因的表达情况,在各种情况下均以相应的野生型作为对照。具体分析的基因为已报道的与抗旱相关的基因,分别为pod、dreb、sdr、rd22、p5cs1、oat、p5cdh、aba-ox3,lea等。结果显示(图7a)oserf101基因的过表达能够明显的增加pod、p5cs1、aba-ox3、lea、dreb等基因的表达,表明此基因可能是通过转录调控抗旱相关基因的表达来达到抗旱的目的,特别是脯氨酸合成相关的基因和aba信号途径相关基因。进一步采用qrt-pcr检测aba信号途径的下游标志性基因表达水平在两个过表达株系中的时间变化曲线,与野生型进行比较,结果表明oserf101的过表达确实导致了aba信号途径lea、pod2、rd22基因的表达水平升高(图7b),表明oserf101的过表达导致了aba信号途径中抗逆相关基因的转录水平上调,从而导致作物的抗逆性增强。综上所述,oserf101基因编码一个转录因子,受干旱胁迫的诱导,正常情况下主要表达于花器官中。过表达oserf101基因可以增强干旱胁迫下花粉粒的育性,从而提高结实率,达到稳定粮食生产的目的。该基因在作物的抗旱基因工程育种上具有重要的应用价值。序列表<110>复旦大学<120>水稻oserf101基因在提高干旱天气下水稻结实率上的应用<130>111111<160>7<170>siposequencelisting1.0<210>1<211>2359<212>dna<213>人工序列(artificialsequence)<400>1ggcaactggttagacttttttttccctttgcccataataaagccatctctcataaagcca60tcgacctcatctcctcctcctcctctctctgtctctctctggctgttcttatcagtttac120gttgtcctcatcgtcgccggcgccgccctccaaagcttcatagatagctcgatcgatcga180tcccgtcgtcgtcgatcgtcgtcgacgcagcagcctcgccggcggccggagactggggag240atcgatcgagagggagggaggttgagtaaggtggatccacgggtcaggcatggcaagagg300cccctaccggccggcgaggaggaggaagaagaccagccaccgcctccgacaccaccagca360aagcaggagcagcaggacgaggaggagctcgccgcggtcgtcatcagcggcggcggagca420ggagcagctccggcgccggagacgtacgcgcagtactactacgcggcgcgcgccgaccac480gacgcctccgccatggtcaccgcgctagcccacgtcatccgcgccgcccccgacctgcac540ctcccccaccacccatcctcctccgcctccgccgccgcccacccgcagcaggcttcttcc600ttctacccgaccgccgccgccgccgcctcctcgccgtccgaccagctcgccgccgccgcc660gctgccgaagagcaaggtaccagctgatccattcaccgcacaagtaaattcctctctctc720accgcgccgcgtgccacgccccgattgcgaaagcatggcacgcgcgagcgcgccataatt780tggaagcttcgcatccgccaacgccaacgcccacgccgccgtcttcctcgtcctacgtta840atccccatggctctagctagctaattaccgggttaagtagcttcgaagcttgcaatgcat900gcttaattagcggtaattgatccataattaattaattagttgaaccaaacgagggttaat960aagttaattaactcccaaatcgttgcctatttcgtgccggaagatacgctaaattaatag1020cgccatgtgagtattttatgcacacaccgtattacgttatccctgacgatcgaaggggga1080gtccgaattagtcacggattaattagcaagttgcagtattattattattattatgggatt1140aattagtgggaattaattagcttagtgtgttttggtgggtgcaggaggaggcggcactac1200agaggtgttcgacagcggccatgggggaagtgggcggcggagataagggacccgaagaag1260gcggcgagggtgtggctggggacgttcgacacggcggaggacgccgccatcgcctacgac1320gaggcggcgctccggttcaaggggaccaaggccaagctcaacttccccgagcgcgtccag1380ggccgcaccgacctcggcttcctcgtcacccgtggcatcccccccgccgccacccacggt1440ggcggctactacccctcgtcgtcgccggcggcgggggcatgccccccgccgcggcagcag1500cagacggtcgtgccgtacccggacctcatgcggtacgcgcagctgctgcagggcggcgtc1560ggcggcagttacatgccgttcggcggcgccgcgacgatgtcgtcgtcgacggtgtcgtcc1620tcgtcggcgccgcagatactcgacttctcgacgcagcagctcatccgggccggcccgccg1680tcaccaatgccatcgtcgggctccggctcggcgaccgcggcggcgtcgtccacgacgtcg1740gcgtcgtcgcccggtgcatggccgtacggcggctcggagcgcaagaagaaggattcgtcg1800tcgtgacgtcactggatggatcgatcgatgcatgaatatgccatgcatttgagaggaaga1860ggtcaagtttttttttaagcaatggaaatggattacatcttcggcctcggcacgtggaca1920gaaagagatcaagtgatatggatcgagaagaatgtttagctgatctgctctttactctgc1980acgatcgaggagatgaaaatgcatgcaatatgcatggaggggtaagtgttaagtggttaa2040ttggtgatttttgcgggttaattaattacatggacattaatttttcttttgatcaccttt2100tgtttattttttctctgaaaactatcttcttttgttcatttttattttcttggaggtact2160taattaattagctaggttaattagctggtgatttttagtttgttgtttccctccttttgt2220tcaagtgtgaactaattgtgcaaaattagtccaagtaaagcaaagagagaggattcttat2280ttaattattggttaaacattacccttttttaagatgaaacatgatgtctttttttaaaaa2340aaaaatctgaatgattacc2359<210>2<211>807<212>dna<213>人工序列(artificialsequence)<400>2atggtcaccgcgctagcccacgtcatccgcgccgcccccgacctgcacctcccccaccac60ccatcctcctccgcctccgccgccgcccacccgcagcaggcttcttccttctacccgacc120gccgccgccgccgcctcctcgccgtccgaccagctcgccgccgccgccgctgccgaagag180caagggaggaggcggcactacagaggtgttcgacagcggccatgggggaagtgggcggcg240gagataagggacccgaagaaggcggcgagggtgtggctggggacgttcgacacggcggag300gacgccgccatcgcctacgacgaggcggcgctccggttcaaggggaccaaggccaagctc360aacttccccgagcgcgtccagggccgcaccgacctcggcttcctcgtcacccgtggcatc420ccccccgccgccacccacggtggcggctactacccctcgtcgtcgccggcggcgggggca480tgccccccgccgcggcagcagcagacggtcgtgccgtacccggacctcatgcggtacgcg540cagctgctgcagggcggcgtcggcggcagttacatgccgttcggcggcgccgcgacgatg600tcgtcgtcgacggtgtcgtcctcgtcggcgccgcagatactcgacttctcgacgcagcag660ctcatccgggccggcccgccgtcaccaatgccatcgtcgggctccggctcggcgaccgcg720gcggcgtcgtccacgacgtcggcgtcgtcgcccggtgcatggccgtacggcggctcggag780cgcaagaagaaggattcgtcgtcgtga807<210>3<211>268<212>prt<213>人工序列(artificialsequence)<400>3metvalthralaleualahisvalileargalaalaproaspleuhis151015leuprohishisproserserseralaseralaalaalahisprogln202530glnalaserserphetyrprothralaalaalaalaalaserserpro354045seraspglnleualaalaalaalaalaalaglugluglnglyargarg505560arghistyrargglyvalargglnargprotrpglylystrpalaala65707580gluileargaspprolyslysalaalaargvaltrpleuglythrphe859095aspthralagluaspalaalailealatyraspglualaalaleuarg100105110phelysglythrlysalalysleuasnpheprogluargvalglngly115120125argthraspleuglypheleuvalthrargglyileproproalaala130135140thrhisglyglyglytyrtyrproserserserproalaalaglyala145150155160cysproproproargglnglnglnthrvalvalprotyrproaspleu165170175metargtyralaglnleuleuglnglyglyvalglyglysertyrmet180185190propheglyglyalaalathrmetserserserthrvalserserser195200205seralaproglnileleuasppheserthrglnglnleuileargala210215220glyproproserprometproserserglyserglyseralathrala225230235240alaalaserserthrthrseralaserserproglyalatrpprotyr245250255glyglysergluarglyslyslysaspserserser260265<210>4<211>26<212>dna<213>人工序列(artificialsequence)<400>4ggatccatggtcaccgcgctagccca26<210>5<211>27<212>dna<213>人工序列(artificialsequence)<400>5ggtacctcacgacgacgaatccttctt27<210>6<211>22<212>dna<213>人工序列(artificialsequence)<400>6cagcaggcttcttccttctacc22<210>7<211>22<212>dna<213>人工序列(artificialsequence)<400>7cttcttcgggtcccttatctcc22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1