一种长链非编码RNA-SNHG1及其组合物在诊断或治疗胆管癌中的应用的制作方法
本发明涉及基因工程技术领域,特别涉及一种长链非编码rna-snhg1及其组合物在诊断或治疗胆管癌中的应用。同时,本发明还涉及其引物,在制备诊断胆管癌试剂中的应用。通过研究该长链非编码rna细胞水平的表达,揭示了其与胆管癌发病机理的关系。
背景技术:
肿瘤是严重威胁人类健康的一大主要元凶,对肿瘤恶性进展的分子机制研究一直是学界关注的焦点与难点。已有研究报道,肿瘤细胞在生长过程中具有促进增殖和侵袭转移,持续血管生成,免疫耐受及免疫逃逸等细胞表型特征。研究表明,肿瘤细胞的生长是一个复杂的多基因调控和多步骤、多阶段发展的过程,包括p53、p21等抑癌基因的失活和blc1、myc等原癌基因的激活。迄今为止,恶性肿瘤的发生机制仍未完全清楚,需要进一步探索。
研究显示:除这些已被广泛研究的编码基因外,长非编码rna(longnoncodingrnas,lncrnas)的异常表达也参与肿瘤恶性进展。lncrnas是一类转录本长度超过200nt的rna分子,有别于其他小分子非编码rna,其可以顺式(incis)或反式(intrans)作用的方式调节rna代谢、蛋白质功能活性、组蛋白修饰及染色质重塑,在表观遗传学、转录以及转录后水平广泛参与细胞生物学过程。越来越多的研究证实,lncrnas不仅在维持机体的正常生理功能及发育过程中发挥重要的调控作用,其异常表达与疾病的发生发展尤其是肿瘤的恶性进展有着密切的联系。
胆管癌(cholangiocarcinoma,cca)是起源于胆管上皮细胞的高度侵袭性的恶性肿瘤,其全球发生率,尤其是在亚洲国家中呈逐年上升趋势,5年生存率不足5%。胆管癌早期发病隐匿,常无明显的临床表现,明确诊断时已至中晚期。尽管目前已有手术、放疗、化疗等临床治疗手段,但是胆管癌患者的预后仍很差。已有研究表明,lncrnas的异常表达介导胆管癌恶性进展。上调的h19和hulc可通过cerna机制促进胆管癌细胞的迁移和侵袭。
lncrnacps1intronictranscript1(cps1-it1)可促进胆管癌细胞的增殖及抑制凋亡,且影响病人的肝功能及预后。进一步文献检索结果显示:lncrnas可以通过发挥原癌基因的作用,参与胆管癌细胞增殖、凋亡和侵袭转移等生物学过程,提示更多胆管癌恶性进展相关lncrnas的功能和机制具有进一步研究的必要性。
技术实现要素:
本发明所要解决的技术问题是提供一种长链非编码rna-snhg1及其组合物在诊断或治疗胆管癌中的应用。同时,本发明还涉及其引物,在制备诊断胆管癌试剂中的应用。通过研究该长链非编码rna细胞水平的表达,揭示了其与胆管癌发病机理的关系。
本发明所要解决的技术问题是通过以下技术方案来实现的:
一种长链非编码rna-snhg1在制备用于诊断或治疗胆管癌药物或试剂盒中的应用,所述长链非编码rna-snhg1的序列如seqidno:1所示。
一种用于治疗胆管癌的药物组合物,所述药物组合物含有rna-snhg1和药学上可接受的载体和辅料,所述rna-snhg1的序列为seqidno:1所示。
优选地,上述技术方案中,所述药物组合物包括snhg1的抑制剂,所述抑制剂的序列如seqidno:4和seqidno:5所示。
优选地,上述技术方案中,所述药物组合物以口服或注射的方式给药。
一种药物组合物在制备用于治疗胆管癌药物中的应用。
一种用于检测rna-snhg1的引物,所述引物包括序列seqidno:2和seqidno:3。
一种用于检测rna-snhg1的引物在制备用于治疗胆管癌药物中的应用。
一种用于检测rna-snhg1的试剂盒,所述试剂盒包含上述所述的检测rna-snhg1的引物,所述试剂盒中引物的浓度为0.01~0.1mol/l。
一种用于检测rna-snhg1的试剂盒在制备用于治疗胆管癌药物中的应用。
本发明上述技术方案,具有如下有益效果:
本发明从临床组织标本、细胞、模式动物三个层面研究snhg1调控胆管癌细胞恶性进程的作用机制,运用qpcr、rip分子生物学技术手段对snhg1与靶基因之间的关系作进一步验证。本发明具有显著的科学意义:snhg1在胆管癌中异常高表达并参与表观遗传介导的增殖侵袭机制;生物信息学分析、转录组高通量测序、rip、质谱等方法的运用保证了结果的准确性和系统性;本研究的成功实施将丰富lncrnas调控胆管癌发生发展的分子机制,揭示了snhg1可作为胆管癌诊断、预后的标志物,为临床早期胆管癌临床诊治提供实验和理论依据。
附图说明
图1为snhg1在癌变组织-癌旁组织的差异表达情况图:a为聚类图,b为散点图,c为柱状图。
图2为snhg1对hucct1细胞和rbe细胞增殖的影响图:a为snhg1在胆管癌上皮细胞(hucct1细胞及rbe细胞)中的干扰效率,b为克隆形成实验结果,c为cck8实验结果,d为transwell实验结果。
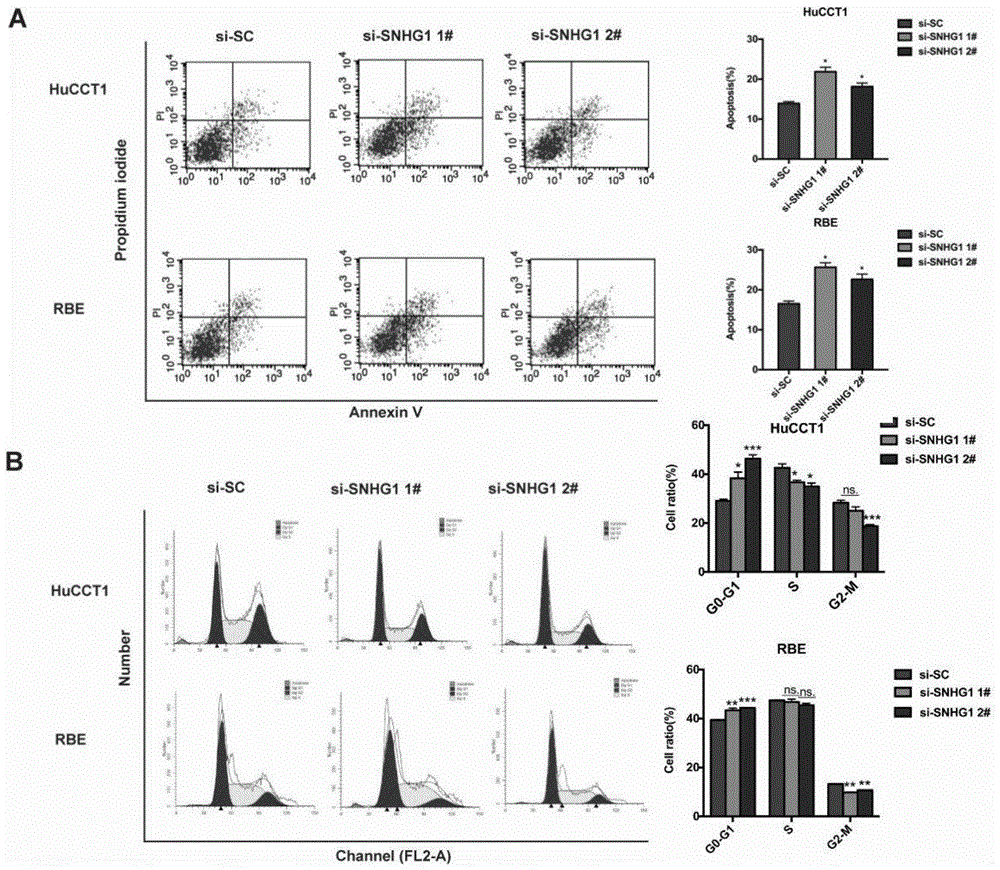
图3为snhg1对hucct1细胞和rbe细胞的细胞周期影响图:a为流式细胞仪检测细胞凋亡结果,b为流式细胞仪检测细胞周期结果。
图4为snhg1对肿瘤细胞形成大小的影响图:(a)裸鼠皮下成瘤实验,待瘤体形成16天后处死小鼠,拍照记录;(b)裸鼠皮下成瘤实验,待瘤体形成16天后处死小鼠,取出瘤体,拍照记录;(c)观察并记录小鼠瘤体大小。(d)瘤体检测,敲低sh-snhg1组小鼠瘤体的平均重量显著低于对照组瘤体的重量。
图5高通量测序snhg1调节下游靶基因表达图:a为聚类分析图,b为go分析图,c为qpcr实验验证在胆管癌细胞株hucct1中干扰snhg1后下游靶基因显著上调,d为qpcr实验验证在胆管癌细胞株rbe中干扰snhg1后下游靶基因显著上调。
图6为snhg1绑定ezh2表观抑制下游靶基因:a为核质分离实验确定snhg1在胆管癌细胞株中亚细胞定位,b为网站预测snhg1与ezh2蛋白结合能力,c为rip技术以鉴定snhg1与ezh2蛋白结合,d为ezh2在胆管癌中的干扰效率,e为敲低ezh2后也可引起cdkn1a基因上调,f为分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,cdkn1a基因均与ezh2存在显著相关性,g为分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,cdkn1a基因与snhg1存在显著负相关性,h为分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,相较于正常组织,cdkn1a基因发生下调,i为westernblot实验验证在胆管癌细胞株hucct1及rbe中干扰snhg1后cdkn1a基因的表达显著上调,j为westernblot实验验证在胆管癌细胞株hucct1及rbe中干扰ezh2后cdkn1a基因的表达显著上调,k为chip实验证实敲减snhg1后,ezh2与cdkn1a基因的启动子区的绑定风度降低,l为chip实验证实敲减snhg1后,cdkn1a基因启动子区h3k27me3的丰度降低。
图7为snhg1绑定ezh2表观抑制cdkn1a基因的表达图:a为收集的17对胆管癌和癌旁组织qpcr验证证实cdkn1a基因在胆管癌组织中显著下调,b为cck8试验结果,c为cck8试验结果,d为transwell试验结果,e为transwell试验结果,f为机制图解。
具体实施方式
下面对本发明的具体实施例进行详细描述,以便于进一步理解本发明。
本发明所使用的实验方法和研究技术:如总rna和蛋白质的提取、克隆技术、细胞转染、chip试验、rip试验、westernblot、荧光实时定量pcr、生物信息学数据库的使用等;所需要的实验材料如抗体、试剂盒等均可商购。
本发明团队依托南京医科大学,所需各设备,如荧光定量pcr仪、流式细胞仪、酶标仪、co2孵箱、低温高速离心机、荧光倒置显微镜、激光共聚焦显微镜等,以及实验动物,均可直接使用。
本发明中没有特殊说明的仪器、设备以及方法均为常规方法或通过常规手段可以获得的商品。
实验例1
(一)实验对象:收集17对2015年至2016年在南京医科大学第二附属医院生物治疗中心接受诊断和治疗的胆管癌患者以及不含有该疾病的健康志愿者的组织。组织样本收集的均为第一时间液氮或储存在-80℃,直至rna提取。
(二)实验步骤:
(1)生物信息学方法筛选并确定胆管癌中高表达snhg1并检测胆管癌组织标本中snhg1表达水平并分析其相关性。
a.入选标准进入geo数据库(http://www.ncbi.nlm.nih.gov/gds),查询“cholangiocarcinoma”和“cancerofbiliaryduct”,限制过滤条件“entrytype:series”、“organism:homosapiens”、“studytype:expressionprofilingbyarray”和“attributename:tissue”,获关于胆管癌的芯片研究查询结果,挑选符合下列要求的研究项目:胆管癌、同时含病例-对照(或癌-癌旁)、主流芯片平台(affy、agilent和illumina)、单通道芯片。
b.芯片数据分析
下载已有归一化数据或使用rmaexpress对原始数据进行归一化;计算差异表达倍数(fc);对归一化数据进行z分值变换;之后依据样本情况进行配对t检验或成组t检验,并计算fdr(错误发现率)值,将p值<0.001,fdr<0.05定义为显著性差异。
c.lncrnas探针注释
利用探针序列blast和biomart查询的方式对芯片平台的探针集进行lncrnas注释,最终获得显著性差异lncrnas。结果发现snhg1是在数据中显著性上调的一条lncrnas。
进一步收集胆管癌及癌旁组织标本,及其临床资料的整理。trizol法提取组织的总rna,取1μg的rna逆转录为cdna模板(takara)。采用qpcr在17对胆管癌组织及其癌旁组织中进行了验证,结果显示snhg1平均上调约3倍。定量pcr应用abi公司的7500型定量pcr仪(appliedbiosystem,fostercity,ca),结果采用2-△△ct值进行分析。以验证snhg1是否可作为胆管癌诊断、预后的标志物,其表达上调可能是胆管癌发生、发展的关键靶分子。
所用引物序列如下:
seqidno:2:
snhg1f:5’-acagcagttgagggtttgct-3’
seqidno:3:
snhg1r:5’-gggcctggatcatgtaagaa-3’
实验结果如图1所示:snhg1在癌-癌旁的差异表达情况:(a)tcga数据库的胆管癌表达谱数据显示:相对于癌旁或正常组织,snhg1在癌中高表达;(b)geo数据库的胆管癌表达谱数据显示:相对于癌旁或正常组织,snhg1在癌中高表达,纵坐标为标准化分数z值;(c)收集胆管癌组织样本,采用荧光实时定量pcr(qrt-pcr)技术在17对胆管癌组织及其癌旁组织中进行了验证,结果显示snhg1平均上调约3倍。
(2)snhg1促进胆管癌细胞恶性进展的研究
1)合成snhg1干扰序列(sirna)和过表达质粒,转染胆管癌细胞系;
干扰序列如seqidno:4和seqidno:5所示,即:
seqidno:4:
si-snhg11#:
ccuuaaaguguuagcagacacagau
aucugugucugcuaacacuuuaagg
seqidno:5
si-snhg12#:
cacuucgugucuguuccucuguaua
uauacagaggaacagacacgaagug。
2)qrt-pcr检测抑制和过表达效率,cck8、克隆形成、transwell、流式细胞技术检测封闭及过表达snhg1后对胆管癌增殖、凋亡及侵袭及细胞周期等细胞功能的影响。进一步评价snhg1在胆管癌细胞中的生物学功能,明确其癌基因功能。
结果显示在图2中:(a)snhg1在胆管癌上皮细胞(hucct1细胞)中的干扰效率最高可达80%;在人胆管癌细胞(rbe细胞)中的干扰效率可达85%。(b)克隆形成实验结果显示:干扰snhg1抑制hucct1细胞及rbe细胞的增殖;(c)cck8实验结果显示:干扰snhg1后抑制hucct1细胞及rbe细胞的增殖;(d)transwell实验结果显示:干扰snhg1抑制hucct1细胞及rbe细胞的侵袭转移。
图3:(a)流式细胞仪检测结果显示:干扰snhg1后,hucct1及rbe细胞的凋亡明显增多;(b)流式细胞仪检测结果显示:干扰snhg1后,rbe细胞细胞周期主要被阻滞在g1期。
(3)snhg1提高胆管癌细胞在体内的肿瘤形成能力
1)构建snhg1干扰和过表达的慢病毒载体,包装成病毒,转染hucct1细胞,筛选阳性稳转细胞株。
2)两种细胞分组注射入免疫缺陷小鼠(balb/c裸鼠),以构建皮下成瘤模型。待瘤体形成后,每3天测一次瘤体体积,16天后处死小鼠,取瘤体,测量重量。进一步评价snhg1对胆管癌细胞增殖能力的影响。
实验结果显示在图4中:(a-c)裸鼠皮下成瘤实验,观察并记录小鼠瘤体大小,待瘤体形成16天后处死小鼠,取出瘤体,拍照记录;同时量取瘤体的大小并称其重量;(d)瘤体检测,敲低sh-snhg1组小鼠瘤体的平均重量显著低于对照组瘤体的重量。
(4)高通量测序snhg1调节下游靶基因表达
利用转录组测序初步确定snhg1所调控的靶基因:在hucct1细胞系中利用sirna敲低snhg1,利用转录组测序技术高通量筛选snhg1所调控的重要靶基因,并运用qrt-pcr对测序结果进行验证。
a.总rna的提取(trizol法)
在hucct1细胞中敲低snhg148h后,分别在对照组和干扰组细胞中加入500ultrizol,放置10min;加入100μl氯仿,剧烈震动15s,室温静置5min;离心,4℃、12,000g、10min,将上清转移到一新的1.5ml离心管中。加入等体积的异丙醇,轻轻颠倒混匀,-20℃放置30min,离心,4℃、12,000g、20min,弃除上清。加入1ml预冷的75%乙醇,洗涤沉淀,离心,4℃、12,000g、5min,弃除上清,室温干燥10min。加入30-50μlrnase-free水,溶解rna,-80℃保存。
b.rna的质检
打开agilent2200机器,打开软件;装入相应的r6kagilentscreentape,排枪装入16个loading枪头;取出一个8联管,按顺序分别加入4μlr6ksamplebuffer与1μlrna样品;混匀后离心收集混合液,72℃3min,冰上2min;离心以收集管壁溶液,然后放入agilent2200样品板上;点击start开始质检。
c.文库构建
转录组rna片段化:poly(a)rna的获取;rna片段化;片段rna纯化构建文库:rna加接头;反转录;cdna纯化;cdna扩增;扩增产物纯化。文库质检:打开agilent2200机器,打开软件;装入相应的d6kagilentscreentape,排枪装入16个loading枪头;取出一个8连管,在第一管中加入3μld1kladder,在剩余的管中分别加入3μld1ksamplebuffer和1μlcdna样品,涡旋混匀5s;离心收集管壁溶液,然后放入agilent2200样品板上;点击start开始质检。
d.测序模板准备文库的稀释;乳滴pcr;珠子的清洗;阳性珠子的富集
e.上机测序
清洗测序仪;测序仪初始化;上样。
实验结果显示在图5中:(a)干扰snhg1后,转录组高通量测序所得snhg1下游影响的差异表达基因,颜色表示z分数;(b)go分析显示snhg1与细胞周期,细胞增殖,细胞凋亡等显著相关;(c-d)qpcr实验验证在胆管癌细胞株hucct1及rbe中干扰snhg1后下游靶基因显著上调。
(5)snhg1绑定ezh2表观抑制下游靶基因
1)核质分离实验确定snhg1在胆管癌细胞株中亚细胞定位。具体步骤如下:冰上pbs清洗细胞2次;胰酶消化细胞,离心收集细胞,pbs清洗细胞一次。离心细胞,加入细胞裂解液,吹打混匀,冰上孵育10min,离心,4℃、500g、5min。吸取上清加入等体积bindingbuffer,吹打混匀,加入等体积无水乙醇,吹打均匀;用细胞裂解液清洗细胞核沉淀一次去除细胞质rna污染,离心,4℃、500g、5min,去上清加入细胞核裂解液,冰上孵育5-10分钟,加入等体积bindingbuffer,吹打混匀,加入等体积的无水乙醇。混匀好的反应液加入收集柱中,离心,4℃、12000g、1min,直至所有反应液穿过收集柱。清洗缓冲液清洗收集柱2次,离心,4℃、12000g、1min,弃清洗液。将elutionbuffer加热到95-100摄氏度加入搜集柱中,离心,4℃、12000g、1min,得到所需rna;进行下一步逆转录,qrt-pcr检测。
在胆管癌细胞中通过rip技术以鉴定snhg1与ezh2蛋白结合。实验步骤为对rbe细胞及hucct1细胞用ezh2抗体免疫沉淀rnp复合物。将沉淀的总rna的抽提。无rna酶的dnaase1处理提取的总rna。对提取的rna进行逆转录并qrt-pcr检测。
2)snhg1表观调控胆管癌细胞恶性表型的机制:
a.设计特异性的snhg1干扰序列,用脂质体2000(英潍捷基tm)转染试剂将snhg1干扰或过表达载体瞬时转染胆管癌细胞,转染48小时后,收集细胞总rna和蛋白用于qrt-pcr及westernblot分别检测靶基因mrna和蛋白表达(以gapdh作为对照)。
b.设计特异性的ezh2的干扰序列,干扰序列如seqidno:6所示,即si-ezh2:gagguucagacgagcugauuu;aucagcucgucugaaccucuu。用脂质体2000(英潍捷基tm)转染试剂将瞬时转染胆管癌细胞,转染48小时后,收集细胞总rna和蛋白用于qrt-pcr及westernblot分别检测ezh2及靶基因,尤其是cdkn1a的mrna和蛋白表达(以gapdh作为对照)。
ezh2f:5’-tgcacatcctgacttctgtg-3’
ezh2r:5’-aagggcattcaccaactcc-3’
il32f:5’-ctcagtggagctgggtcatc-3’(seqidno:7)
il32r:5’-cctgtccacgtcctgattct-3’(seqidno:8)
il11f:5’-gagggcgatttgtctgagag-3’(seqidno:9)
il11r:5’-gcaacagagcgagactcca-3’(seqidno:10)
lrig1f:5’-gcctggaagaaagacaatgaa-3’(seqidno:11)
lrig1r:5’-gagccaaagtggttggtgat-3’(seqidno:12)
cmtm3f:5’-tgctggccttgtacttcctc-3’(seqidno:13)
cmtm3r:5’-gcaaacacgatggtagcaaa-3’(seqidno:14)
cdkn1af:5’-aaaggcccgctctacatctt-3’(seqidno:15)
cdkn1ar:5’-atgcccagcactcttaggaa-3’(seqidno:16)
pik3ip1f:5’-agcccaccctcctacagcta-3’(seqidno:17)
pik3ip1r:5’-gcaatgtttggaagccctta-3’(seqidno:18)
cd82f:5’-catcctggctaacatggtga-3’(seqidno:19)
cd82r:5’-ggagtgcagtagcacgatctc-3’(seqidno:20)
g0s2f:5’-gaccgagagagaggaatggagag-3’(seqidno:21)
g0s2r:5’-tttggtggatgcttgtggta-3’(seqidno:22)
gdf15f:5’-gaggtgcaagtgaccatgtg-3’(seqidno:23)
gdf15r:5’-cagtggcagtctttggctaac-3’(seqidno:24)
adam19f:5’-aagtaccatgacaacgcccaat-3’(seqidno:25)
adam19r:5’-cattctcggagtggtccatgt-3’(seqidno:26)
u1f:5’-gggagataccatgatcacgaaggt-3’
u1r:5’-ccacaaattatgcagtcgagtttccc-3’
gapdhf:5’-agccacatcgctcagacac-3’
gapdhr:5’-gcccaatacgaccaaatcc-3’
cdkn1achipprimersf:5’-cctccttcttcaggcttggg-3’(seqidno:27)
cdkn1achipprimersr:5’-caggcagcatagggatggag-3’(seqidno:28)
c.为鉴定在胆管癌细胞中snhg1是否与ezh2特异结合,进行了rna免疫共沉淀(rnaimmunoprecipitation,rip)实验对snhg1与ezh2在胆管癌细胞中的绑定进行了进一步验证(实验结果见图6d),结果提示在胆管癌细胞中snhg1可与ezh2特异结合。
ezh2是构成prc2复合物中唯一具有酶活性的亚基,prc2是一个作用于组蛋白h3赖氨酸位点k27的高度保守的组蛋白甲基转移酶,其生物功能是对分化基因的转录沉默。目前已知通过全基因组研究,在多种生物体中prc2的常作用靶点是转录因子和信号通路的关键位点。研究表明,ezh2可与长链非编码绑定介导组蛋白甲基化从而抑制下游靶基因的表达。且研究表明,敲低ezh2后也可引起cdkn1a基因上调(实验结果见图6e)。检索分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,cdkn1a基因均与ezh2存在显著相关性(实验结果见图6f)。进一步分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,相较于正常组织,cdkn1a基因发生下调,且具有统计学意义(实验结果见图6g)。chip实验证实敲减snhg1后,ezh2与cdkn1a基因启动子区的绑定风度降低及cdkn1a基因启动子区h3k27me3的丰度降低(实验结果见图6k-l)。综上,提示我们:snhg1可绑定ezh2介导组蛋白甲基化从而引起cdkn1a基因的抑制表达。
d.snhg1可能通过绑定ezh2表观抑制cdkn1a基因等抑癌基因的表达,从而促进胆管癌细胞恶性表型进展。
在收集的17对胆管癌和癌旁组织qpcr验证证实cdkn1a基因在胆管癌组织中显著下调(实验结果见图7a)。拯救实验证实过表达cdkn1a可以部分逆转因过表达snhg1引起的促进细胞增殖及细胞侵袭效应。(实验结果见图7b-e)。
上述实验的结果显示在图6及图7中,图6(a)核质分离实验结果表明:snhg1的转录本主要定位于细胞核中;(b)通过网站预测结果:snhg1能够和ezh2蛋白绑定(http://pridb.gdcb.iastate.edu/rpiseq/index.html)。(c)rip实验证实:snhg1能够和ezh2蛋白绑定;(d)qpcr实验验证在胆管癌细胞株hucct1及rbe中成功干扰ezh2基因。(e)qpcr验证在hucct1细胞中干扰ezh2后,下游靶基因基因显著上调。(6f)检索分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,cdkn1a基因与ezh2存在显著负相关性。(6g)进一步检索分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,cdkn1a基因与snhg1存在显著负相关性。(6h)进一步分析数据库gse76297发现,在91例胆管癌组织及92例正常组织标本中,相较于正常组织,cdkn1a基因发生下调,且具有统计学意义。(6i)westernblot实验验证在胆管癌细胞株hucct1及rbe中干扰snhg1后cdkn1a基因的表达显著上调。(6j)westernblot实验验证在胆管癌细胞株hucct1及rbe中干扰ezh2后cdkn1a基因的表达显著上调。(6k)chip实验证实敲减snhg1后,ezh2与cdkn1a基因的启动子区的绑定风度降低;(6l)chip实验证实敲减snhg1后,cdkn1a基因启动子区h3k27me3的丰度降低。
图7(7a)在收集的17对胆管癌和癌旁组织qpcr验证证实cdkn1a基因在胆管癌组织中显著下调。(7b-c)拯救实验证实过表达cdkn1a可以部分逆转因过表达snhg1引起的促进细胞增殖效应。(7d-e)拯救实验证实过表达cdkn1a可以部分逆转因过表达snhg1引起的促进细胞侵袭效应。(7f)snhg1绑定ezh2表观抑制cdkn1a基因的表达从而促进胆管癌恶性进展的机制图。
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!