一种长链非编码RNASNHG6在乳腺癌诊断或治疗中的应用的制作方法
本发明涉及基因治疗和医学诊断领域,具体涉及一种长链非编码rnasnhg6在乳腺癌诊断或治疗中的应用。
背景技术
作为全球做常见的女性恶性肿瘤之一和中国女性发病率和死亡率最高的恶性肿瘤之一,乳腺癌在女性中持续频繁发生是一个全球性挑战[1]。尽管目前对于乳腺癌的治疗有手术、化疗、放疗、消融、激素治疗和联合治疗等不同治疗方法,但仍具有较高的复发率和死亡率,治疗效果仍不理想[2]。因此,对乳腺癌的发病机制进行研究具有重要的临床意义。
血管扩张刺激磷蛋白(vasodilator-stimulatedphosphoprotein,vasp),是广泛存在于不同细胞和组织中的一种肌动蛋白相关的骨架蛋白[3]。它能促进细胞内actin单体接入到f-actin的装置末端,从而促进f-actin组装、延长,在调控细胞侵袭和迁移过程中发挥重要作用[4]。在我们研究前期发现在乳腺癌细胞中vasp存在过表达并且参与细胞的增殖、侵袭和迁移[5]。
越来越多证据表明非编码rna(ncrna)能够参与调控各种病理和生理过程,并基于ncrna的长度分为长链非编码rna(lncrna)和短链非编码rna[6]。目前已有多篇研究报道lncrnas能够参与调控包括肿瘤在内的多种疾病[7-9],因此,lncrna已成为近年来肿瘤研究的新热点。snhg6(u87hg)是5’top家族的管家基因,它可以编码两种非编码rna[10],snhg6转录的cdna序列如seqidno:7所示。有研究表明snhg6能够参与肿瘤的生长和转移,但目前尚未报道其在乳腺癌中的作用及作用机制[11-13]。
参考文献
[1]siegelrl,millerkdandjemala.cancerstatistics,2017.cacancerjclin2017;67:7-30.
[2]benedettir,dell'aversanac,giorgioc,astorrirandaltuccil.breastcancervaccines:newinsights.frontendocrinol(lausanne)2017;8:270.
[3]zimmerm,finkt,fischerl,hauserw,schererk,lichterpandwalteru.cloningofthevasp(vasodilator-stimulatedphosphoprotein)genesinhumanandmouse:structure,sequence,andchromosomallocalization.genomics1996;36:227-233.
[4]dertsizl,ozbilimg,kayisliy,gokhanga,demircanaandkayisliua.differentialexpressionofvaspinnormallungtissueandlungadenocarcinomas.thorax2005;60:576-581.
[5]zhangy,hang,fanb,zhouy,zhoux,weilandzhangj.greentea(-)-epigallocatechin-3-gallatedown-regulatesvaspexpressionandinhibitsbreastcancercellmigrationandinvasionbyattenuatingrac1activity.eurjpharmacol2009;606:172-179.
[6]memczaks,jensm,elefsiniotia,tortif,kruegerj,rybaka,maierl,mackowiaksd,gregersenlh,munschauerm,loewera,zieboldu,landthalerm,kocksc,lenoblefandrajewskyn.circularrnasarealargeclassofanimalrnaswithregulatorypotency.nature2013;495:333-338.
[7]bhana,soleimanimandmandalss.longnoncodingrnaandcancer:anewparadigm.cancerres2017;77:3965-3981.
[8]mirzaah,kaursandpociotf.longnon-codingrnasasnovelplayersinbetacellfunctionandtype1diabetes.humgenomics2017;11:17.
[9]huangx,luoyl,maoysandjijl.thelinkbetweenlongnoncodingrnasanddepression.progneuropsychopharmacolbiolpsychiatry2017;73:73-78.
[10]gogolevskayaik,makarovaja,gauseln,kulichkovava,konstantinovaimandkramerovda.u87rna,anovelc/dboxsmallnucleolarrnafrommammaliancells.gene2002;292:199-204.
[11]changl,yuany,lic,guot,qih,xiaoy,dongx,liuzandliuq.upregulationofsnhg6regulateszeb1expressionbycompetitivelybindingmir-101-3pandinteractingwithupf1inhepatocellularcarcinoma.cancerlett2016;383:183-194.
[12]birganimt,hajjarim,shahrisaa,khoshnevisana,shojaz,motaharipandfarhangib.longnon-codingrnasnhg6asapotentialbiomarkerforhepatocellularcarcinoma.patholoncolres2018;24:329-337.
[13]yank,tianj,shiw,xiahandzhuy.lncrnasnhg6isassociatedwithpoorprognosisofgastriccancerandpromotescellproliferationandemtthroughepigeneticallysilencingp27andspongingmir-101-3p.cellphysiolbiochem2017;42:999-1012.
技术实现要素:
为了克服现有技术存在的不足,本发明采用tcga数据库分析乳腺癌组织和癌旁组织中snhg6表达水平的差异,分析结果显示乳腺癌组织中snhg6表达水平有升高趋势。基于数据分析结果,本发明进一步通过实验检测乳腺癌组织和细胞中snhg6表达,结果显示,与正常的乳腺细胞和癌旁组织相比,乳腺癌细胞和组织中snhg6存在显著高表达。
本发明通过si-rna敲降snhg6,探究snhg6对vasp的表达及对乳腺癌细胞增殖、侵袭和迁移能力的调控及作用机制。结果显示snhg6能够作为竞争性内源性rna结合mir-26a,从而减弱mir-26a对vasp翻译的抑制作用,进而促进乳腺癌细胞的增殖和迁移。
基于以上结果本发明的目的是提供长链非编码rnasnhg6的新的医药用途,即在制备用于乳腺癌辅助诊断或者疗效预测试剂中的应用。
本发明的另一目的是提供长链非编码rnasnhg6在制备乳腺癌治疗药物中的应用。
本发明的目的通过以下技术方案实现:
本发明提供一种长链非编码rnasnhg6在制备用于乳腺癌辅助诊断或者疗效预测试剂或试剂盒中的应用。
所述的试剂,为检测生物样品中长链非编码rnasnhg6表达量的试剂。
所述的试剂盒,包含检测生物样品中长链非编码rnasnhg6表达量的试剂。
所述的检测生物样品中长链非编码rnasnhg6表达量的试剂,选自:对长链非编码rnasnhg6具有检测特异性的探针、基因芯片,或pcr引物。
所述的生物样品选自:获自对象的新鲜组织或细胞、福尔马林固定或石蜡包埋组织或细胞、血液或体液。
第二方面,本发明提供长链非编码rnasnhg6在制备乳腺癌治疗药物中的应用,该治疗药物是指抑制或降低长链非编码rnasnhg6表达量的试剂。
所述的抑制或降低长链非编码rnasnhg6表达量的试剂,包括但不限于:sirna、shrna。
优选地,本发明提供长链非编码rnasnhg6在制备乳腺癌治疗药物中的应用,该治疗药物是sirna,序列如下:
si-snhg6#1正义链:5’-gaggugcaagaaagccuuutt-3’(seqidno:1)
反义链:5’-aaaggcuuucuugcaccuctt-3’(seqidno:2);
si-snhg6#2正义链:5’-gcggcauguauugagcauatt-3’(seqidno:3)
反义链:5’-uaugcucaauacaugccgctt-3’(seqidno:4);
si-snhg6#3正义链:5’-gcuucguuaccucaagugutt-3’(seqidno:5)
反义链:5’-acacuugagguaacgaagctt-3’(seqidno:6);
上述序列中,3’端加tt是为了加强sirna的稳定性。
所述的治疗药物是用于抑制乳腺癌细胞的增殖、侵袭和迁移。
本发明阐明了snhg6在乳腺癌中的作用机制,为乳腺癌的诊断和治疗提供新的靶点。并对snhg6进行si-rna干扰从而抑制乳腺癌细胞的增殖、侵袭和迁移,这一手段对于开发新的乳腺癌治疗药物和提高乳腺癌的治疗效果具有重要意义,具有很大的应用前景和经济价值。
附图说明
图1为tcga数据库中乳腺癌组织和癌旁组织中snhg6、mir-26a和vasp的表达水平图;
图2为tcga数据库中乳腺癌患者的预后snhg6,vasp和mir-26a的表达水平图;
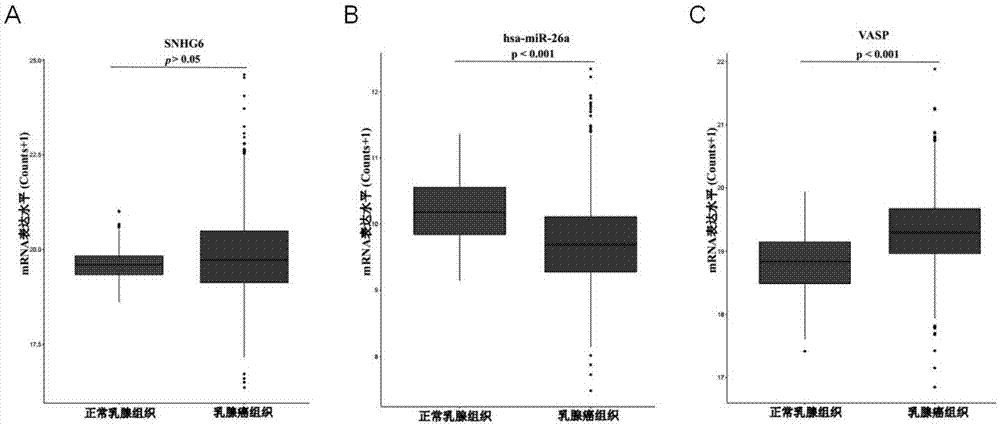
图3为本发明检测的乳腺癌组织和癌旁组织中snhg6、mir-26a和vasp的表达水平图;
图4为本发明检测的乳腺癌细胞和正常的乳腺细胞中snhg6、mir-26a和vasp的表达水平图;
图5为合成的3条si-snhg6均能显著敲降snhg6的表达水平图;
图6为cck-8实验敲降snhg6对mcf-7和mda-mb-231细胞增殖能力影响图;
图7为平板克隆实验敲降snhg6对mcf-7和mda-mb-231细胞增殖能力影响图;
图8为edu染色实验敲降snhg6对mcf-7和mda-mb-231细胞增殖能力影响图;
图9为细胞周期检测敲降snhg6对mcf-7和mda-mb-231细胞增殖能力影响图;
图10为划痕实验检测敲降snhg6对mcf-7和mda-mb-231细胞的迁移能力影响图;
图11为transwell实验检测敲降snhg6对mcf-7和mda-mb-231细胞的侵袭能力影响图;
图12为transwell实验检测敲降snhg6对mcf-7和mda-mb-231细胞的迁移能力影响图;
图13为在mcf-7和mda-mb-231细胞中,敲降snhg6对vasp和mir-26a的表达水平影响图;
图14为在mcf-7和mda-mb-231细胞中,mir-26a对vasp和snhg6的表达水平影响图;
图15为westernblotting实验检测敲降snhg6对mcf-7和mda-mb-231细胞的vasp的蛋白表达水平影响图;
图16为westernblotting实验检测mir-26a对mcf-7和mda-mb-231细胞的vasp的蛋白表达水平影响图;
图17为免疫荧光染色检测敲降snhg6对mcf-7和mda-mb-231细胞的vasp的蛋白表达水平影响图;
图18为生物信息学分析mir-26a与vasp,以及mir-26a与snhg6的结合序列,和突变的结合序列;
图19为mir-26a对vasp3’utr报告基因活性和vasp3’utrmut报告基因活性的影像图;
图20为mir-26a对snhg6报告基因活性的影像图;
图21为敲降snhg6对vasp3’utr报告基因活性的影像图;
图22为干扰snhg6或mir-26ainhibitor对mcf-7和mda-mb-231细胞的vasp的蛋白表达水平影响图;
图23为敲降vasp或snhg6或vasp或其组合对mda-mb-231细胞的增殖的影响图;
图24为敲降vasp或snhg6或vasp或其组合对mda-mb-231细胞的迁移的影响图;
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件。
【实施例1】snhg6在乳腺癌组织和细胞中差异性表达
1、下载tcga数据库中乳腺癌高通量测序数据,分析乳腺癌组织和癌旁组织中snhg6、mir-26a和vasp的表达水平差异。同时通过kaplan-meier生存分析乳腺癌患者的预后与snhg6,vasp和mir-26a的表达之间的关系。
如图1a-1c,与癌旁组织相比,乳腺癌组织中vasp的表达水平明显上调,mir-26a的表达水平明显下调,而snhg6的表达尽管无显著性差异但也呈现增高趋势。如图2a-2c,乳腺癌患者的预后与vasp的表达呈负相关,与mir-26a呈正相关,与snhg6的表达尽管无统计学差异,但仍存在负相关的趋势。
2、rna提取
按照操作手册步骤用trizol试剂(invitrogen,carlsbad,ca)提取冰冻的乳腺癌及其邻近正常组织的rna,并提取乳腺癌细胞和正常乳腺细胞的rna进行分析。
3、逆转录和实时荧光定量pcr
用revertaidfirststrandcdnasynthesiskit(thermoscientific,usa)按操作手册对mrna进行逆转录,用实时荧光定量pcr(appliedbiosysteminc.)来对mrna进行定量分析。snhg6的实时荧光定量pcr的上游引物为5’-cctactgacaacatcgacgttgaag-3’下游引物为5’-ggagaaaacgcttagccatacag-3’;内参gapdh的实时荧光定量pcr的上游引物为5’-aatggacaactggtcgtggac-3’,下游引物为5’-ccctccaggggatctgtttg-3’。
如图3a-3c、4a-4c所示,相对于正常的乳腺细胞和组织,在乳腺癌细胞和乳腺癌组织中vasp和snhg6的mrna表达水平增高,而mir-26a的表达水平显著降低。
4、设计si-rna并转染
在基因序列查询网站(http://www.ncbi.nlm.nih.gov/gene)查找snhg6的基因序列,然后设计针对snhg6的si-rna,同时设计与目的基因无同源性的negativecontrol(si-nc)。
选择3条设计得到的si-rna及si-nc序列进行合成,序列如下:
si-snhg6#1正义链:5’-gaggugcaagaaagccuuutt-3’
反义链:5’-aaaggcuuucuugcaccuctt-3’;
si-snhg6#2正义链:5’-gcggcauguauugagcauatt-3’
反义链:5’-uaugcucaauacaugccgctt-3’;
si-snhg6#3正义链:5’-gcuucguuaccucaagugutt-3’
反义链:5’-acacuugagguaacgaagctt-3’;
si-nc正义链:5’-uucuccgaacgugucacgutt-3’
反义链:5’-acgugacacguucggagaatt-3’。
上述rna均购自苏州吉玛基因股份有限公司。通过转染试剂将3条si-snhg6分别转染至mda-mb-231和mcf-7细胞中,检测其敲降snhg6的效果。如图5所示,合成的3条si-snhg6均能显著敲降snhg6的表达水平。在后续试验中,将si-snhg6#1,si-snhg6#2和si-snhg6#3联合使用(以si-snhg6表示),以下调snhg6的表达。
【实施例2】snhg6促进乳腺癌细胞的增殖和迁移能力
1、细胞培养
人乳腺癌细胞系mda-mb-231用完全rpmi-1640培养基培养,mcf-7用完全dmem培养基培养。所有的培养基包含10%胎牛血清和抗生素(10000u/ml青霉素,10ug/ml链霉素)。细胞培养箱环境为37℃,湿润,5%co2。
2、cck-8实验
mda-mb-231和mcf-7细胞培养于35mm培养皿中,用snhg6小干扰rna和阴性对照rna瞬时转染mda-mb-231细胞和mcf-7细胞。用胰酶消化吹散,接种到96孔细胞培养板中,细胞悬液浓度约为3×103/ml,每孔100μl。置于细胞培养箱中37℃继续培养,分别在0、24、48h时每孔加入10μl的cck-8溶液,充分混匀后继续培养2h,用酶标仪测定每孔在450nm处吸光度。
结果如图6,和对照组相比,敲降snhg6能够显著抑制mcf-7和mda-mb-231细胞的增殖能力。
3、平板克隆实验
mda-mb-231和mcf-7细胞培养于35mm培养皿中,用snhg6小干扰rna和阴性对照rna瞬时转染mcf-7和mda-mb-231细胞。继续培养约一周,计算细胞的克隆形成数目。
如图7所示,和对照组相比,敲降snhg6能够显著抑制mcf-7和mda-mb-231细胞的增殖能力。
4、edu染色实验
edu染色实验常常被用来检测细胞的增殖增殖能力。将细胞(4×103~1×105细胞/孔)接种于24孔板中培养24小时,然后在含有适当浓度edu(cell-lighttmeduapoiio567invitrokit,ribobio,china)的细胞培养基中继续培养2小时。基于edu和apollo594荧光染料的特异性反应,可用来快速检测细胞增殖能力。
如图8所示,和对照组相比,敲降snhg6能够显著抑制mcf-7和mda-mb-231细胞的增殖能力。
5、细胞周期检测
mda-mb-231和mcf-7细胞培养于35mm培养皿中,用snhg6小干扰rna和阴性对照rna瞬时转染mcf-7和mda-mb-231细胞。培养48h后用胰酶消化吹散,按照细胞周期检测试剂盒规范化的步骤操作,然后使用流式细胞仪检测细胞周期。
结果如图9,敲降snhg6能够显著将mcf-7和mda-mb-231细胞阻滞在g0/g1期,抑制细胞的增殖能力。
6、划痕实验
mda-mb-231和mcf-7细胞培养于100mm培养皿中,用snhg6小干扰rna和阴性对照rna瞬时转染mcf-7和mda-mb-231细胞。培养至细胞密度约90%,在培养皿底部用200ul枪头做一划痕,继续培养0、24、48h时分别观察划痕愈合程度,划痕愈合越快即代表细胞的迁移能力越强。
如图10所示,和对照组相比,敲降snhg6能够显著抑制mcf-7和mda-mb-231细胞的迁移能力。
7、transwell实验
mda-mb-231和mcf-7细胞培养于35mm培养皿中,用snhg6小干扰rna和阴性对照rna瞬时转染mcf-7和mda-mb-231细胞。用胰酶消化吹散,制成浓度约为1×105/ml的细胞悬液,每个小室的上室加入100μl细胞悬液,下室加入500μl含有20%fbs的完全培养基。置于细胞培养箱中37℃继续培养12h。取出小室,4%的多聚甲醛溶液固定后再用0.5%结晶紫溶液染色。用棉签擦去上室内表面没有穿过膜的细胞,然后显微镜下观察拍照。transwell实验既可以检测细胞的侵袭能力也可以检测细胞的迁移能力,所不同的是,它用于检测细胞的侵袭能力时,孔径为8μm的小室中涂有基质胶。
如图11所示,和对照组相比,敲降snhg6能够显著抑制mcf-7和mda-mb-231细胞的侵袭能力;如图12所示,和对照组相比,敲降snhg6能够显著抑制mcf-7和mda-mb-231细胞的迁移能力。
【实施例3】snhg6在乳腺癌中的作用机制研究
1、实时荧光定量pcr
实验操作步骤如实施例1所示,其中vasp上游引物序列为5’-atggcaacaagcgatggct-3’,下游引物序列为5’-cgatggcacagttgatgacca-3’。mir-26a上游引物序列为5’-ttcaagtaatccaggataggct-3’,下游引物序列为通用引物(qiagen,germany)。另外,分别合成mir-26amimics和mir-26ainhibitor,转染到细胞中用来过表达和敲降mir-26a。
mir-26amimic正义链:5'-uucaaguaauccaggauaggcu-3'
反义链:5'-agccuauccuggauuacuugaa-3'
mir-26ainhibitor:5'-agccuauccuggauuacuugaa-3'
如图13a、13b所示,在mcf-7和mda-mb-231细胞中,敲降snhg6能够显著抑制vasp和mir-26a的表达水平;如图14a、14b所示,在mcf-7和mda-mb-231细胞中,过表达mir-26a能够显著抑制vasp和snhg6的表达水平,敲降mir-26a则显著促进vasp和snhg6的表达水平。
2、westernblotting实验
制备sds-聚丙烯酰胺凝胶,将配好的蛋白样品加入上样孔中。通过电泳、转膜将蛋白质结合到pvdf膜上,用5%牛奶封闭膜上的非特异性位点后,用5%的牛血清白蛋白按比例溶解一抗(gapdh1:1000,vasp1:1000)摇床孵育过夜。次日,回收抗体,用1xtbst洗去多余抗体,常温孵育二抗,两小时后洗膜三次。在膜上加入ecl发光液后显影,并分析结果。
如图15所示,在mcf-7和mda-mb-231细胞中,敲降snhg6能够显著抑制vasp的蛋白表达水平;如图16所示,mcf-7和mda-mb-231细胞中,过表达mir-26a能够显著抑制vasp的蛋白表达水平,敲降mir-26a则显著促进vasp的蛋白表达水平。
3、免疫荧光染色
将对数生长期mcf-7和mda-mb-231细胞接种在玻璃板上,并将无菌圆形玻片置于24孔平板上,37℃培养。当细胞成功接种时,转染细胞48h,固定、通透、封闭处理后,加入1:500的vasp抗体稀释液,于4℃孵育一夜。第二天,清洗玻璃板,加入荧光标记的二抗(此步骤开始避光),处理2h,然后冲洗。用封片剂封片,并在荧光显微镜下观察染色结果。
结果如图17,在mcf-7和mda-mb-231细胞中,敲降snhg6能够显著抑制vasp的蛋白表达水平。
4、生物信息学分析以及报告基因质粒构建
如图18a和18b所示,通过生物信息学分析mir-26a与vasp,以及mir-26a与snhg6的结合序列,然后分别将结合序列以及突变的结合序列克隆至报告基因载体pmir-report中,构建得到pmir-report-vasp3’utr,pmir-report-vasp3’utrmut,pmir-report-snhg6,pmir-report-snhg6mut,以及阴性对照载体pmir-report-con。
5、luciferaseassay检测启动子活性
将mir-26amimics和mir-26ainhibitor分别与pmir-report-vasp3’utr,pmir-report-vasp3’utrmut,pmir-report-snhg6,pmir-report-snhg6mut,以及阴性对照载体pmir-report-con转染到hek293t细胞中,继续培养48h。按照双荧光素酶报告基因检测试剂盒说明书(promega,madison,wi,usa),检测各组报告基因活性。
如图19所示,过表达mir-26a能够显著抑制vasp3’utr报告基因活性,而敲降mir-26a则显著增强vasp3’utr报告基因活性,但是对vasp3’utrmut报告基因活性无影响。如图20所示,过表达mir-26a能够显著抑制snhg6报告基因活性,而敲降mir-26a则显著增强snhg6报告基因活性,但是对snhg6mut报告基因活性无影响。另外,如图21所示,敲降snhg6能够显著抑制抑制vasp3’utr报告基因活性。以上结果表明mir-26a能够同时靶向vasp3’utr和snhg6,抑制vasp3’utr和snhg6报告基因活性。
另外,如图22所示,干扰snhg6能够显著抑制vasp的蛋白表达水平,而mir-26ainhibitor能够显著逆转干扰snhg6对vasp蛋白表达的抑制作用。如图23-24所示,分别敲降vasp或snhg6均可显着抑制mda-mb-231细胞的增殖和迁移,而mir-26ainhibitor可显著促进mda-mb-231细胞的增殖和迁移。mir-26ainhibitor可显著逆转snhg6或vasp敲降对mda-mb-231细胞增殖和迁移的抑制作用。以上结果表明snhg6能够作为cerna结合mir-26a,从而减弱mir-26a对vasp翻译的抑制作用,进而促进乳腺癌细胞的增殖和迁移。
本发明验证了非编码长链rnasnhg6对乳腺癌细胞增殖迁移能力的调控,并探究了snhg6对乳腺癌进程的调控是通过上调vasp的表达从而促进乳腺癌增殖、侵袭和迁移,这为乳腺癌的诊断与治疗提供了新的靶点,对开发新的乳腺癌靶向治疗药物和提升乳腺癌的治疗效果具有重要意义。
序列表
<110>武汉大学
<120>一种长链非编码rnasnhg6在乳腺癌诊断或治疗中的应用
<160>18
<170>siposequencelisting1.0
<210>1
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>1
gaggugcaagaaagccuuu19
<210>2
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>2
aaaggcuuucuugcaccuc19
<210>3
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>3
gcggcauguauugagcaua19
<210>4
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>4
uaugcucaauacaugccgc19
<210>5
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>5
gcuucguuaccucaagugu19
<210>6
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>6
acacuugagguaacgaagc19
<210>7
<211>727
<212>dna
<213>人工序列(artificialsequence)
<400>7
ctttcccgcgcgaccggcgagggaggaagaagcgcgaagagccgttagtcatgccggtgt60
ggtggcggcggcggagactgcgggcccgtagctgggctctgcgaggtgcaagaaagcctt120
tgaggtgaaggtgtatgaaagtcatcataacagatgttttccaaaaacttgtagaaggtt180
gtgaaaaaactactaggatcacgcggcatgtattgagcatataggttgctgtagatgaat240
gttcttagctgtcatgtttaaaaatacttctgcttcgttacctcaagtgtggcatgcagc300
attttggaaggaaaattgaagacgtgttcaagaaaacatgaacagaagcaaatgatgaaa360
atgagcattttacttgatgttgataacatcacaataaattatggagaaaaatacatattt420
ggctaacttttaattgctgaacaataaagtgttttcttttaaatcaactctaaatagctc480
cattctcatagtcactagtcagacctgttttgaacatattcgaaagattataatcttgtc540
aataattagcttatttatgggtggtgattctcattgaggctgacagctggggagacattg600
cttgtacctctaggttccctgtctggcttccccttcagagcctgctgttgtaccaggtgg660
ttgaatcttaaaactctttaataccaaatagcaatcaaattcccccttacaaaaaaaaaa720
aaaaaaa727
<210>8
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>8
cctactgacaacatcgacgttgaag25
<210>9
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>9
ggagaaaacgcttagccatacag23
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>10
aatggacaactggtcgtggac21
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
ccctccaggggatctgtttg20
<210>12
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>12
uucuccgaacgugucacgu19
<210>13
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>13
acgugacacguucggagaa19
<210>14
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>14
atggcaacaagcgatggct19
<210>15
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>15
cgatggcacagttgatgacca21
<210>16
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>16
ttcaagtaatccaggataggct22
<210>17
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>17
uucaaguaauccaggauaggcu22
<210>18
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>18
agccuauccuggauuacuugaa22
- 还没有人留言评论。精彩留言会获得点赞!