一种发卡林醇类化合物对映异构体及其合成方法及应用与流程
本发明属于医药化工领域,具体地说,涉及联二萘酚(binol)配体催化合成发卡林醇类化合物对映异构体方法及其在抗hela肿瘤细胞方面的应用。
背景技术:
手性发卡林醇类化合物具有共轭二炔醇类结构,在抗肿瘤,神经保护,抗真菌和抗炎等方面有显著的生物活性,具有巨大的潜在研究价值。其特定构型和其生物活性之间存在很大关系,但由于受到该类化合物结构种类的限制,其生物活性研究也受到限制,尤其是手性发卡林醇类化合物的立体结构对hela肿瘤细胞的抗增殖活性影响尚未见报道。
目前,对手性共轭二炔醇类化合物的化学合成,主要包括二种方法:一种常用方法是先制备关键中间体手性炔丙醇,再通过炔丙醇与单炔烃之间的偶联反应来合成手性二炔醇类似物;另一种方法是直接通过1,3-二炔类化合物对羰基化合物的不对称加成反应合成。后者能在新碳-碳键形成的同时形成手性中心,在操作步骤上更为快捷,但是由于两个碳-碳三键共轭相连,其反应活性限制了在化学合成中的应用。
在通过1,3-二炔类化合物对醛的不对称加成反应合成发卡林醇类化合物的方法中,较成功的催化体系主要有两个:一个是手性binol催化体系,另一个是手性氨基醇配体催化体系。
其中,手性binol催化体系一般可直接使用商业可得的(s)-binol和(r)-binol原料;而手性氨基醇配体催化体系一般有两个手性中心,需要多步合成目标配体。然而,在手性binol催化体系中,所采用的zn试剂对潮湿空气十分敏感,操作处理程序较为复杂,催化体系中还需要加入额外的有机碱添加剂,制约了发卡林醇类化合物的简便制备及规模化生产;此外,醛的底物适用范围和产物的对映选择性方面均有限。
技术实现要素:
为了解决上述问题,本发明提供一种可直接利用商业可得的binol配体,在更简单的操作程序下,高选择性催化合成光学活性的发卡林醇类似物的新方法,并对获得的两个异构体进行抗hela肿瘤细胞增殖活性评价,包括两个对映异构体不同比例混合组分与其ic50值的关系。
本发明所采用的技术方案如下。
一种发卡林醇类化合物对映异构体,其结构通式如i、ii所示:
其中,r1选自三异丙基硅基、正己烷基;
r2选自芳基取代基团、包含环烷烃结构的脂肪烃取代基团;优选地,所述r2选自
手性炔醇的第5号碳原子构型为r和s构型。
所述发卡林醇类化合物对映异构体优选下列化合物中的一种或多种:
本发明还提供上述发卡林醇类化合物对映异构体的合成方法,包括:在常温,有机溶剂及binol催化体系存在条件下,端基1,3-二炔类化合物对醛底物进行不对称加成反应。
具体合成路线如下:
进一步地,所述有机溶剂选自甲苯、二氯甲烷、四氢呋喃、氯仿、乙醚、乙酸乙酯或正己烷中的任意一种或多种。
进一步地,所述binol催化体系由锌试剂、binol配体、卤化物和ti试剂按照摩尔比(50-0.5):(50-0.5):(50-0.5):(50-0.5)组成;优选(14-16):(0.5-1.5):(7-8):(0.5-1);进一步优选15:1:7.5:0.625组成。
其中,所述锌试剂选自二甲基锌、二乙基锌、三氟甲磺酸锌、单质锌粉中的任意一种或多种。
其中,所述binol配体为(s)-binol、(r)-binol。
其中,所述卤化物选自碘甲烷、碘乙烷、溴乙烷、氯乙烷中的任意一种或多种。
其中,所述ti试剂选自ticl4、ti(oipr)4、ti(oipr)2cl2中的任意一种或多种。
进一步地,所述端基1,3-二炔类化合物选自:1-(三异丙基硅基)-1,3-丁二炔和/或1-(正己烷基)-1,3-丁二炔。
其中,所述1-(三异丙基硅基)-1,3-丁二炔由如下方法制得:
(1)0℃下,将溴滴加到饱和koh水溶液中,搅拌,加入2-甲基-3-丁炔-2-醇,继续搅拌;反应混合物萃取,干燥,蒸去溶剂,分离得到4-溴2-甲基丁-3-炔-2醇;
(2)将cucl加入到丁胺水溶液中,加入盐酸羟胺及三异丙基硅基乙炔,进行反应;反应结束后,冰浴冷却;
(3)向步骤(2)所得反应体系中加入4-溴2-甲基丁-3-炔-2醇,于0℃反应,继续搅拌,并每隔2分钟加入盐酸羟胺;反应结束,萃取,合并有机相,洗涤,干燥,分离,得到2-甲基-6-三异丙基-己3,5-二炔-2-醇;
(4)将2-甲基-6-三异丙基-己3,5-二炔-2-醇置于含koh的甲苯溶液中,回流,除去溶剂,分离,得到1-(三异丙基硅基)-1,3-丁二炔。
进一步地,所述醛底物选自芳基取代苯甲醛或包含环烷烃结构的脂肪醛,优选被f、cl或och3取代的苯甲醛,进一步优选为2-氟苯甲醛、3-甲氧基苯甲醛。
进一步地,所述锌试剂、binol配体、卤化物、ti试剂、端基1,3-二炔类化合物、醛底物按照摩尔比(50-0.5):(50-0.5):(50-0.5):(50-0.5)组成;优选(14-16):(0.5-1.5):(7-8):(0.5-1);进一步优选15:1:7.5:0.625:3:1.5组成。
进一步地,所述不对称加成反应是在干燥空气、氮气或氩气中进行,反应时间为1~24小时或更长。
进一步地,所述反应结束后,采用饱和氯化铵溶液淬灭,并用常规后处理程序包括萃取、干燥、过滤和浓缩等处理。经柱层析分离纯化,手性hplc验证以及旋光测定后,分别获得光学活性发卡林醇类化合物的两个对映异构体,然后对两个异构体及其不同比例混合组分进行抗hela肿瘤细胞增殖活性评估检测。经细胞增殖活性检测发现,两个异构体中的一个异构体具有更强的抗hela肿瘤细胞增殖活性,两个对映异构体不同比例混合组分与其抗肿瘤细胞活性的ic50值呈现线性关系。
本发明还提供上述发卡林醇类化合物对映异构体在抗hela肿瘤细胞方面的应用;
和/或,所述手性发卡林醇类似物在制备抗hela肝癌细胞药物中的应用。
本发明所述方案取得的有益效果如下:
(1)本发明在常温下,将锌试剂、卤化物、ti试剂分别与(s)-binol和(r)-binol混合后,在特定条件下实现1,3-二炔类化合物对芳香醛或脂肪醛的不对称加成,高对映选择性合成光学活性发卡林醇类化合物的s和r对映异构体产物,两个异构体中的一个异构体具有更强的抗hela肿瘤细胞增殖活性,两个对映异构体不同比例混合组分与其抗肿瘤细胞活性的ic50值呈现线性关系。
(2)本方法合成反应条件温和,手性试剂原料简单易得,立体选择性高,可合成发卡林醇类化合的两个对映异构体,其中一个异构体具有更强的抗hela肿瘤细胞增殖活性,适合于此类手性发卡林醇类化合物的制备及规模化生产。
附图说明
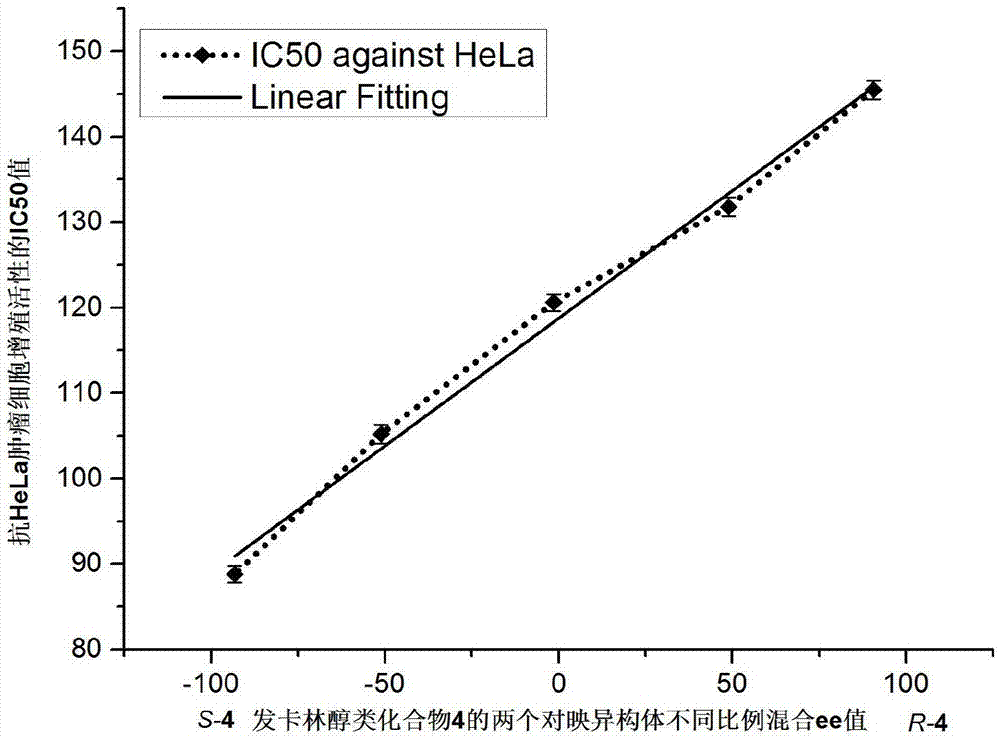
图1为发卡林醇类化合物4的两个对应异构体不同比例混合ee值。
图2为发卡林醇类化合物17的两个对应异构体不同比例混合ee值。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
以下实施例中使用的binol配体、锌试剂、钛试剂、卤化物、醛等均购自阿拉丁试剂网、探索平台、伊诺凯、安耐吉试剂公司、北京百灵威科技有限公司等。
实施例1:(s)-1-(2-溴苯基)-5-(三异丙基硅基)-戊烷-2,4-二炔-1-醇和(r)-1-(2-溴苯基)-5-(三异丙基硅基)-戊烷-2,4-二炔-1-醇,即s-4和r-4的制备(entry4)
1、1-(三异丙基硅基)-1,3-丁二炔的制备
0℃下,将溴5ml(97.6mmol)滴加到饱和koh水溶液中搅拌30分钟后,加入2-甲基-3-丁炔-2-醇10ml(108.2mmol)并继续搅拌30分钟。反应混合物用乙醚萃取后干燥,蒸去溶剂,硅胶柱层析分离得到4-溴2-甲基丁-3-炔-2醇黄色油状液体待用,收率90%。将cucl加入到丁胺水溶液中,加入10g盐酸羟胺及三异丙基硅基乙炔40.3g(220.8mmol)后进行反应,反应结束后置于冰浴冷却。向上述反应体系中加入4-溴2-甲基丁-3-炔-2醇30.0g(184.0mmol)后,于0℃反应,继续搅拌,并每隔2分钟加入2g盐酸羟胺。反应2小时18后,用乙醚萃取。合并有机相并用饱和氯化钠溶液洗涤,干燥后硅胶柱层析分离得到2-甲基-6-三异丙基-己3,5-二炔-2-醇黄色油状液体,收率89%。将2-甲基-6-三异丙基-己3,5-二炔-2-醇置于含koh的甲苯溶液中回流4小时,除去溶剂后经柱层析分离得到1-(三异丙基硅基)-1,3-丁二炔浅黄色液体,收率89%,1hnmr(400mhz,cdcl3):δ2.07(s,1h),1.09(s,21h)。
2、s-4和r-4的制备
在氩气氛条件下,将锌粉(5.1mmol,10.2equiv)分别与(s)-binol和(r)-binol(0.34mmol,0.68equiv)在烧瓶中混合,接着加入碘乙烷(10.2mmol,20.4equiv)、异丙氧基钛(0.85mmol,1.70equiv)和三异丙基硅基1,3-丁二炔(1mmol,2equiv),在四氢呋喃溶剂中室温下搅拌反应24小时,然后再加入2-氟苯甲醛(0.5mmol,1equiv),室温下搅拌12h,反应用饱和nh4cl淬灭,二氯甲烷萃取,有机相用无水硫酸钠干燥,之后再抽滤,浓缩,除溶剂得粗品,柱层析(300~400目,pe/ea=10:1)后,分别得到产物s-4和r-4,产率分别为74%和69%。
产物经hplc分析检测,采用手性chiracelod柱子,流动相正己烷/异丙醇为95/5,流速1ml/min,检测波长220nm,保留时间分别为t1=6.6min,t2=9.8min,ee值分别为91%和91%,旋光值分别为[α]d20=+68(c=1.02,chcl3)和[α]d20=-67.4(c=1.03,chcl3)。
1hnmr(400mhz,cdcl3)δ7.74(d,j=5.1hz,1h),7.57(d,j=5.1hz,1h),7.39(d,j=5.5hz,1h),7.22(d,j=5.6hz,1h),5.87(s,1h),2.50(s,1h),1.08(s,21h).13cnmr(101mhz,cdcl3)δ138.50,133.11,130.30,128.73,128.07,122.66,88.67,86.17,74.51,72.01,64.65,18.57,11.24。
3、s-4和r-4的抗hela肿瘤细胞增殖活性评价
hela肿瘤细胞培养液为胎牛血清,青霉素-链霉素溶液,1640培养基,配制比例依次10:1:89,胎牛血清-20℃冰箱保存,其余4℃冰箱保存。在超净工作台上取对数生长期的细胞,用无菌吸管吸出瓶内旧培养液,pbs缓冲液清洗2次,用胰蛋白酶消化液1.5ml消化hela细胞4min左右,倒置显微镜下观察细胞,当细胞回缩变圆、间隙增大,加4ml各自对应的培养液终止消化。细胞悬液加入10ml无菌离心管中,离心机离心,弃上清液,再加入4ml培养液轻轻吹打成细胞悬液,吸取适量细胞悬液于细胞计数板。倒置显微镜下观察细胞计数板上4个格子里的细胞数目,细胞的密度按照下列计算公式计算:细胞密度=(4格细胞数目之和/4)×10000,调节细胞种板密度为4-60000个/ml于细胞加样槽,用3ml无菌吸管轻轻吹打混匀,用100μl的移液枪加100μl细胞悬液于96孔板,每加7孔,吹打50-60次,周围一圈加100μl的pbs。细胞最终种板密度为4000-6000个/孔,将96孔板放入37℃、5%co2培养箱中常规培养。
准确称量样品s-4和r-4,加入dmso进行母液配制,放入超净工作台,用注射器吸取,过滤到一个无菌ep管中,标记,封口胶封口,4℃冰箱保存。使用前取出样品进行稀释,用10μl的移液枪吸取上述母液10μl,用纯培养基稀释,用涡旋震荡仪震荡后得到工作液,用10μl的移液枪吸取过滤后工作液,用纯培养基稀释,用涡旋震荡仪震荡后获得补加液。样品的稀释采用现用现配,96孔板在37℃,5%co2培养箱中培养23h-25h后,加入配好的样品,用羊水负压器吸除每孔培养液,每孔加入药品100μl,药品复孔数目为2个和4个。加完药品后放入培养箱中培养47h-49h后,用纯培养基调节cck-8的浓度,调节成7%浓度的cck-8工作液。用羊水负压器吸除每孔含药培养基,向每孔加入100μlcck-8工作液,放入培养箱中孵育40min,在酶标仪上检测,测定各孔吸光度od值,检测波长450nm。
用excel2016和graphpadprism5.01算出样品s-4和r-4对hela肿瘤细胞的ic50值,结果表明s-4异构体(88.8μm)比r-4异构体(145.5μm)具有更强的抗hela肿瘤细胞增殖活性,两个对映异构体不同比例混合组分与其抗肿瘤细胞活性的ic50值呈现线性关系如图1所示。
实施例2:(r)-1-(3-甲氧基苯基)十一烷-2,4-二炔-1-醇和(s)-1-(3-甲氧基苯基)十一烷-2,4-二炔-1-醇,即r-17和s-17的制备(entry17)
1、1-(正己烷基)-1,3-丁二炔的制备
同实施例1的描述。实施例1中所述偶合炔烃为1-辛炔,收率89%,1hnmr(400mhz,cdcl3):δ2.26(t,2h,j=7.0hz),1.95(s,1h),1.34(m,6h),0.89(t,3h,j=6.6hz),1.54(p,2h,j=6.6hz)。
2、r-17和s-17的制备
同实施例1的描述,所加入底物为3-甲氧基苯甲醛(1equiv,0.5mmol),分别得到产物r-17和s-17,产率80%和82%,产物通过hplc分析检测,采用手性chiralcelod柱,流动相正己烷/异丙醇为80/20,流速0.9ml/min,检测波长254nm,保留时间分别为t1=5.5min,t2=7.2min,对映选择性ee值分别为94%和95%,旋光值分别为[α]d20=-10.4(c=1.06,chcl3)和[α]d20=+12.5(c=1.00,chcl3)。
1hnmr(400mhz,cdcl3)δ7.30(d,j=6.3hz,1h),7.09(d,j=9.0hz,2h),6.92-6.85(m,1h),5.48(s,1h),3.83(s,3h),2.29(d,j=5.4hz,2h),2.22(s,1h),1.54(d,j=6.2hz,1h),1.42-1.23(m,6h),0.89(d,j=5.0hz,3h)。
13cnmr(101mhz,cdcl3)δ159.85,141.45,129.78,118.89,114.28,112.00,82.82,74.53,71.77,64.98,64.32,55.34,31.28,28.53,28.08,22.53,19.33,14.08。
3、r-17和s-17的抗hela肿瘤细胞活性评价
同实施例1的描述,r-17异构体(119.2μm)比s-17异构体(198.0μm)具有更强的抗hela肿瘤细胞增殖活性,两个对映异构体不同比例混合组分与其抗肿瘤细胞活性的ic50值呈现线性关系如下图2。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!