一种提高L-蛋氨酸产量的方法与流程
本发明涉及一种利用重组大肠杆菌发酵提高蛋氨酸产量的方法。
背景技术:
l-蛋氨酸(l-methionine)是八种必需氨基酸中唯一的含硫氨基酸,又名甲硫氨酸。分子式为c5h11no2s,相对分子质量为149.21,性状为白色薄片状结晶或结晶型粉末,有特殊气味,味微甜,溶于水(3.3g/100ml,25℃)、稀酸或稀碱。蛋氨酸参与动物体内甲基的转移及磷的代谢,降解可生成肌酸,而肌酸和磷酸肌酸在能量储存及利用中起重要作用。同时,还参与动物机体肾上腺素、胆碱的合成,许多试验表明蛋氨酸可增加禽类的日增重,缩短育肥周期,降低养殖成本。因此蛋氨酸为家禽饲料里必不可少的添加剂。除此之外。l-蛋氨酸还广泛应用于食品、化妆品和医药等行业。
目前国内外市场上的蛋氨酸以化学法合成为主,化学法有丙烯醛法(海因法)、氨基内酯法、丙二酸酯法、固液相转移催化等方法。其中以甲硫醇、丙烯醛为原料的海因法是各大厂家的主要生产方式,化学法生产蛋氨酸具有工艺简单、收率高等优势,但其在生产过程中能耗高、生产安全要求高,光学纯度低,并且产生大量含氮、含硫有机物废水(如剧毒的氰化物原料、中间体和废物),如果工艺流程不合理,对废水、废气的处理不当,将对周边环境造成严重污染。因此,相对而言,生物法合成蛋氨酸具有很大的市场潜力与良好的应用前景。
目前除l-蛋氨酸外其它天冬氨酸家族氨基酸均己实现微生物发酵法生产,因此如何实现l-蛋氨酸的发酵法生产成为研究热点。从上世纪70年代开始就有学者对蛋氨酸的微生物发酵合成方法进行探索,虽然目前已有一些关于微生物生产l-蛋氨酸的文献和专利报道,但由于微生物发酵合成蛋氨酸代谢调控体系复杂,菌种产量低等问题,导致生物法合成l-蛋氨酸难以实现工业化生产。
目前,研究使用的l-蛋氨酸生产菌株主要是传统诱变菌株和基因工程改造菌株。印度学者chattopadhyay等首先筛选到一株e.colik12抗5bu的突变菌,该菌能以葡萄糖为底物,合成1g/l的l-蛋氨酸。随后他们又通过对该菌株进行ntg连续诱变,得到一株能抗苏氨酸结构类似物和l-蛋氨酸结构类似物突变菌,该菌能以葡萄糖为底物,过量合成l-蛋氨酸和苏氨酸(均为2g/l)。日本学者nakamori等用ntg处理e.colijm109,得到数株能够抗乙硫氨酸的突变株,其中e.colijm109-tni在添加1%酵母粉的培养基上,以葡萄糖为底物合成0.91g/l的l-蛋氨酸。马燕等考察了培养基中不同碳源和氮源对菌体生长及蛋氨酸产量的影响,表明甘油和葡萄糖有利于芽孢杆菌属菌株mv0073产蛋氨酸,有机氮有利于菌体生长,但不利于l-蛋氨酸的积累。闵伟红等重点考察了发酵过程中的碳源种类及浓度、ph及发酵时间等因素对北京棒杆菌as1.299的影响,表明以葡萄糖浓度为10%作为碳源进行发酵产l-蛋氨酸量为最高,菌体浓度为最大,ph6.5有利于菌体生长和l-蛋氨酸生成。
目前主要问题是国内蛋氨酸的发酵制备水平仍然较低,因此利用发酵代谢调控手段对发酵过程进行优化,提高蛋氨酸产量,对于蛋氨酸的工业化生产来说具有极其重要的意义。
技术实现要素:
为了解决现有技术中存在的问题,本发明目的在于通过碳源、氮源及硫源的筛选,并添加ca2+、赖氨酸和辅因子vb12,基因改造,提供一种提高l-蛋氨酸发酵水平的方法,同时,在实验过程中发现了ca2+离子的重要作用,它对l-蛋氨酸发酵产量的提高具有显著影响。
本发明采用的技术方案:
本发明提供一种提高l-蛋氨酸产量的方法,所述方法为:将重组大肠杆菌w3110接种至含ca2+和50mg/lamp(氨苄西林)的发酵培养基,在28℃、200r/min下培养发酵到od600=0.6~1.0时,添加终浓度为0.1mm的iptg,继续培养至48h后发酵结束,获得含l-蛋氨酸的发酵液,将发酵液分离提取,获得l-蛋氨酸;所述发酵培养基的终浓度组成:甘油20-50g/l(优选40g/l),(nh4)2so416g/l,kh2po42g/l,酵母提取物2g/l,na2s2o31-11g/l(优选7g/l),金属离子混合溶液1ml/l,溶剂为蒸馏水,ph自然(优选5~7);所述金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水;所述重组大肠杆菌w3110是将丝氨酸到半胱氨酸途径中编码丝氨酸乙酰转移酶的基因cyse(geneid:948126)、编码高半胱氨酸-n5-甲基四氢叶酸转甲基酶基因meth(geneid:948522)、编码5-亚甲基叶酸还原酶基因metf(geneid:948432)、编码高胱氨酸合成基因metbl(geneid:948433,948434)启动子均替换为trc启动子(seqidno.1所示)后,导入宿主菌构建而成;所述宿主菌是将大肠杆菌e.coliw3110中metj、meti和lysa基因敲除(即赖氨酸合成支路、蛋氨酸摄取系统和合成蛋氨酸的全局阻遏蛋白)后导入ptrc99a/meta*/yjeh质粒构建而成的e.coliw3110δmetjδmetiδlysa/ptrc99a/meta*/yjeh,其中ptrc99a/meta*/yjeh质粒添加了蛋氨酸外分泌蛋白yieh,过表达了编码催化高丝氨酸和琥珀酰-coa合成琥珀酰高丝氨酸的高丝氨酸o-琥珀酰转移酶meta*构建获得的;本发明重组大肠杆菌w3110基因型为e.coliw3110δmetjδmetiδlysatrc-methtrc-metftrc-cysetrc-metbl/ptrc99a/meta*/yjeh。
进一步,所述ca2+在发酵培养基中的终浓度为0.01-1mol/l,优选0.1mol/l,更优选添加10g/lcaco3,不仅能够维持发酵过程ph为5.5-7.0,而且还能提高l-蛋氨酸产量。
进一步,所述发酵培养基中还添加有赖氨酸和辅因子,所述辅因子为vb1、vb6、vb7、vb12、天冬氨酸(asp)或柠檬酸钠(cit-na)中的一种,优选vb12;所述赖氨酸添加终浓度为30-160mg/l,更优选150mg/l,辅因子添加终浓度0.1-2mg/l,更优选辅因子为终浓度1.5mg/lvb12。
本发明最优选所述发酵培养基终浓度组成为:甘油40g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o37g/l、vb121.5mg/l,赖氨酸150mg/l,金属离子混合溶液1ml/l,溶剂为蒸馏水,ph自然;所述金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水。
进一步,所述重组大肠杆菌w3110发酵前先进行种子扩大培养,再将种子液以体积浓度5%的接种量接种至发酵培养基,所述种子扩大培养为:将重组大肠杆菌w3110接种至含50mg/lamp种子培养基,在37℃、200r/min培养12h,获得种子液;所述种子培养基组成如下:蛋白胨10g/l,nacl10g/l,酵母提取物5g/l,溶剂为蒸馏水,ph自然。
本发明的有益效果主要体现在:利用本发明方法构建重组大肠杆菌w3110,通过在蛋氨酸发酵培养时,碳氮源种类及浓度的优化、前体氨基酸及辅因子的添加提高了蛋氨酸的发酵产量;并且发现ca2+离子的加入可以显著地提高蛋氨酸的发酵产量。
附图说明
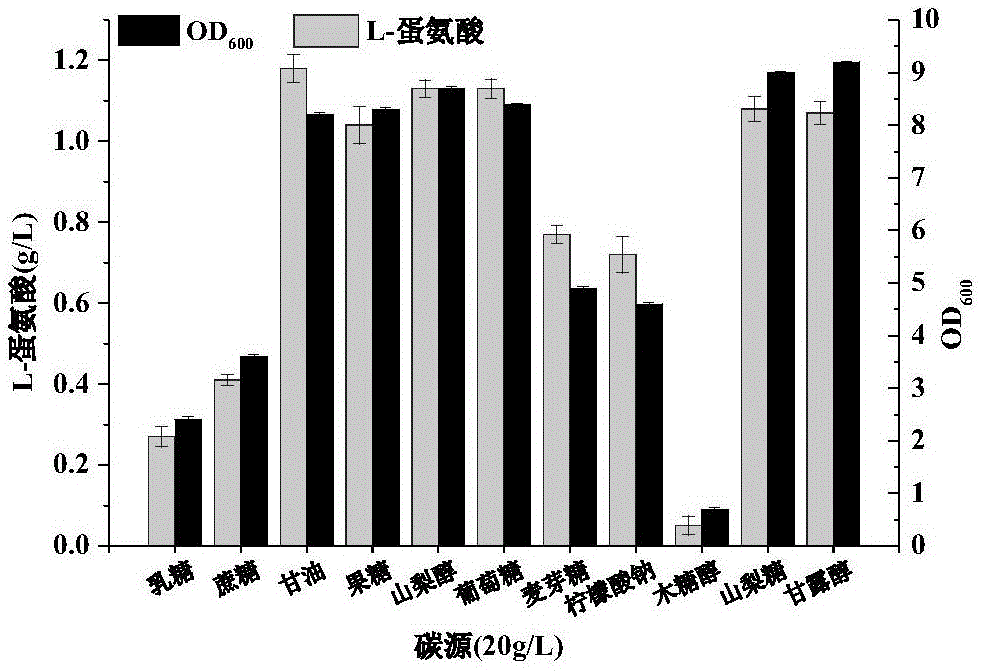
图1为碳源种类对l-蛋氨酸产量的影响。
图2为氮源的种类对l-蛋氨酸产量的影响。
图3为不同的甘油浓度对l-蛋氨酸产量的影响。
图4为不同的硫代硫酸钠浓度对l-蛋氨酸产量的影响。
图5为赖氨酸及浓度对l-蛋氨酸产量的影响。
图6为生长因子及前体氨基酸添加对l-蛋氨酸产量的影响。
图7为vb12及浓度对于l-蛋氨酸产量的影响。
图8为氨水控制ph对l-蛋氨酸产量的影响。
图9为钙离子对于l-蛋氨酸产量的影响。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:重组大肠杆菌w3110的构建
(1)以e.coliw3110δmetjδmeti/ptrc99a/meta*/yjeh(jiangfenghuangetal.2016.metabolicengineeringofescherichiacoliformicrobialproductionofl-methionine.biotechnologyandbioengineering.114:843-851)为出发菌株,使用crispr-cas9介导的基因编辑技术(yujiangetal.2015multigeneeditingintheescherichiacoligenomeviathecrispr-cas9system.appliedenvironmentalmicrobiology.81:2506-2514),用来源于ptrc99a的trc启动子(核苷酸序列如seqidno.1所示),在基因组中置换meth、metf、cyse、metbl基因的原有启动子因。
(2)使用表1引物构建ptarget质粒。
表1构建用于启动子置换的ptarget质粒的引物
表2中的除ptargetr-common外的引物具有相同的结构特征,前8个碱基表示保护碱基和bcui酶切位点,加粗部分20个碱基表示与基因组同源的n20序列,斜体部分20个碱基与模版ptarget质粒(购自addgene)中n20后的序列相同,ptargetr-common引物前5个碱基为保护碱基,中间6个碱基为bcui酶切位点,最后13个碱基与模版ptarget质粒相同。用ptargetr-common引物与其余任意一条引物组合,以ptargetf质粒(addgeneplasmid#62226)为模版,可以扩增获得meth、metf、cyse、metbl基因对应的新的线性ptarget质粒片段,pcr产物经过dpni和bcui在37℃保温消化3h,cleanup试剂盒回收dna片段,再用t4连接酶连接10h转化到e.colitop10,壮观酶素平板筛选,测序验证获得所述基因相应的ptarget质粒,用于后续基因编辑。
(3)使用表2引物扩增donordna片段。
表2构建donordna的引物序列
表2中的除trcv外的引物具有相同的结构特征,引物1是待上调基因原始启动子-35区上游500bp位置的一段20nt的引物,引物2中下划线部分序列为trc启动子序列,其余部分与基因原始启动子-35区上游20nt的序列互补,引物3中下划线部分序列为trc启动子序列,其余部分与基因开放阅读框的前20nt相同,引物4与距离基因起始密码子(atg)500bp的一段20nt序列互补,引物v为基因原始启动子-35区上游1000bp位置一段20nt的引物,引物trcv为trc启动子-10到-35区之间的一段互补序列。以e.coliw3110基因组为模版,引物1与引物2为引物扩增获得donordna的上游部分(f1),引物3和引物4为引物扩增获得donordna的下游部分(f2),胶回收纯化pcr片段,然后以引物1和引物4为引物,f1和f2为模版,拼接pcr扩增获得表2所示基因的完整donordna片段,用于后续基因编辑。
(4)将pcas质粒(addgeneplasmid#62225)导入e.coliw3110δmetjδmeti(jiangfenghuangetal.2016.metabolicengineeringofescherichiacoliformicrobialproductionofl-methionine.biotechnologyandbioengineering.114:843-851)中,单克隆接种到lb试管中,30℃过夜培养,再以体积浓度1%的接种量接种到含50mllb培养基的250ml摇瓶中,并加入500μl1mol/l的l-阿拉伯糖,150rpm,30℃培养至od6000.4~0.6,4000rpm,4℃离心10min收集细胞,制备电转化感受态,详细过程见(molecularcloning:alaboratorymanual,3ededition,99-102)的描述。
(5)取5μl表3基因对应的donordna,1μl表1基因对应的ptarget质粒与100μl电击感受态细胞混合,转入预冷的2mm电击杯中,冰浴1min左右,用电穿孔仪(microplusertm,bio-rad)进行电击转化,电击完成后立即加入1mllb培养基并立即轻柔吸出,转移到1.5ml离心管中,30℃复苏2-3h后涂布含0.05mg/l卡那霉素和0.05mg/l壮观霉素的lb平板,37℃倒置培养12-16h,以引物v和trcv为引物进行菌落pcr验证,若能成功克隆出一段1000bp左右的片段,则证明是阳性菌落,构建一系列不同基因型的菌株(表3)。
表3启动子置换构建的新型菌株
(6)构建e.coliw3110δmetjδmetitrc-methtrc-metf/ptrc99a/meta*/yjeh
在e.coliw3110δmetjδmeti/ptrc99a/meta*/yjeh菌株中同时上调metf和meth基因,构建e.coliw3110δmetjδmetitrc-methtrc-metf/ptrc99a/meta*/yjeh。
(7)构建e.coliw3110δmetjδmetitrc-methtrc-metftrc-cyse/ptrc99a/meta*/yjeh
在e.coliw3110δmetjδmetitrc-methtrc-metf/ptrc99a/meta*/yjeh基础上上调cyse基因,构建e.coliw3110δmetjδmetitrc-methtrc-metftrc-cyse/ptrc99a/meta*/yjeh。
(8)构建e.coliw3110δmetjδmetiδlysatrc-methtrc-metftrc-cyse/ptrc99a/meta*/yjeh
在e.coliw3110δmetjδmetitrc-methtrc-metftrc-cyse/ptrc99a/meta*/yjeh基础上敲除lysa基因,构建e.coliw3110δmetjδmetiδlysatrc-methtrc-metftrc-cyse/ptrc99a/meta*/yjeh。
表4lysa敲除用的引物
(9)构建e.coliw3110δmetjδmetiδlysatrc-methtrc-metftrc-cysetrc-metbl/ptrc99a/meta*/yjeh
在构建的e.coliw3110δmetjδmetiδlysatrc-methtrc-metftrc-cyse/ptrc99a/meta*/yjeh基础上上调metbl,构建e.coliw3110δmetjδmetiδlysatrc-methtrc-metftrc-cysetrc-metbl/ptrc99a/meta*/yjeh。
实施例2重组大肠杆菌e.coliw3110的培养
(1)重组e.coliw3110种子培养:
从lb平板培养基上挑取一个重组e.coliw3110单菌落接入至含50mg/lamp种子培养基,培养温度37℃,摇床转速200r/min,培养12h,获得种子液;所述种子培养基组成如下:蛋白胨10g/l,nacl10g/l,酵母提取物5g/l,溶剂为水,ph自然,115℃灭菌30min;
(2)重组e.coliw3110发酵培养:
将培养12h的种子液以体积浓度5%的接种量接入含10g/lcaco3和50mg/lamp的原始发酵培养基中,28℃,摇床转速200r/min条件下培养发酵到od600=0.6~1.0时,添加终浓度为0.1mm的iptg,继续培养至48h后发酵结束。发酵培养基中添加的10g/lcaco3控制ph5.5-7。
原始发酵培养基的组成如下:葡萄糖20g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o31g/l,金属离子混合溶液1ml/l,溶剂为蒸馏水,ph自然;所述金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水。
(3)碳源优化:将原始发酵培养基中的碳源葡萄糖分别替换为甘油、乳糖、果糖、麦芽糖、蔗糖、柠檬酸钠、山梨糖、木糖醇、山梨醇和甘露醇,添加量均为20g/l,在发酵培养结束后测定l-蛋氨酸的含量及od600,48h时l-蛋氨酸产量及生物量如图1所示。由结果可以看出,碳源对l-蛋氨酸产量和生物量影响较大,其中山梨糖和甘露醇作为碳源时,其生物量生长较好,而甘油、山梨醇和葡萄糖作为碳源时l-蛋氨酸的产量较好,其中甘油作为碳源时,产量达到1.18g/l,后续实验考虑碳源成本、生物量及l-蛋氨酸的产量,选取了甘油为碳源。
发酵液中l-蛋氨酸含量检测采用hplc法。样品预处理:取1ml发酵液置于2ml离心管中,12000r/min离心2min,弃沉淀、收集上清液;采用dnfb柱前衍生高效液相色谱法检测上清液中的蛋氨酸含量,上清液与0.5mnahco3、衍生化试剂dnfb按体积比1:1:1混合,60℃静置避光反应1h,冷却至室温后加入7倍体积的ph7.0磷酸缓冲溶液,12000r/min离心1min,收集上清液采用0.45μm微滤膜过滤,滤液采用岛津hplc分析。hplc流动相配制:准确称取2.05g无水ch3coona,用超纯水溶解并定容至1000ml,0.45μm微滤膜过滤;滤液与色谱纯甲醇按体积比1:1混合,采用冰乙酸调节ph至6.8,并采用超声波脱除气体。hplc分析条件:岛津lc-20at泵,岛津spd-20a紫外-可见光检测器,色谱柱为c18柱(unitary4.6mm×150mm),流动相比例采用甲醇:水=1:1,流速为1.0ml/min,紫外检测波长为365nm,进样量为10μl,柱温40℃。
(4)氮源对l-蛋氨酸产量的影响:将步骤(2)原始发酵培养基葡萄糖替换为甘油20g/l,再分别将(nh4)2so4替换为胰蛋白胨、nh4cl、(nh4)2hpo4、尿素、豆粕、牛肉膏,添加量均为16g/l。相同条件下28℃培养至发酵结束,测定l-蛋氨酸的含量和od600,结果如图2所示,在所试验的几种氮源中,以硫酸铵为最优氮源。
实施例3:
为了提高l-蛋氨酸的产量,实验考察了甘油浓度对l-蛋氨酸产量的影响,考察不同的甘油浓度对l-蛋氨酸产量的影响。将实施例2步骤(2)原始发酵培养基中葡萄糖替换为不同浓度甘油,其中甘油浓度分别为25、30、35、40、45g/l,以20g/l甘油为对照,采用相同的条件进行发酵培养,发酵48h后测定发酵液中l-蛋氨酸的含量,结果如图3。
由实验结果总结可得,过高浓度的甘油(>40g/l)会对l-蛋氨酸的合成具有抑制作用,且过高的甘油浓度在48h内存在利用不完全、增加发酵时间的缺点,因此后续实验以40g/l甘油为作为碳源。由图3可知,40g/l甘油产l-蛋氨酸产量为1.84g/l,比对照组提高约55.9%。
实施例4:
由于l-蛋氨酸为含硫氨基酸,因此实验考察了硫源的浓度对l-蛋氨酸产量的影响。将实施例2步骤(2)原始发酵培养基中葡萄糖改为甘油40g/l,na2s2o3浓度选择1、3、5、7、9、11g/l,采用相同的条件进行发酵反应,考察不同的na2s2o3浓度对l-蛋氨酸产量和菌体生长的影响,发酵48h后测定发酵液中l-蛋氨酸的含量,以甘油40g/l和na2s2o31g/l为对照,结果如图4。
由实验结果总结可得,过高浓度的na2s2o3(>7g/l)不再提高l-蛋氨酸的产量,说明7g/l的na2s2o3能满足菌体生长和产l-蛋氨酸。且硫源对l-蛋氨酸产量的影响较大。7g/l时,蛋氨酸产量为2.38g/l,较对照组提高了约29.3%。
实施例5:
考虑到本实验所用菌株敲除了lysa基因,该基因编码二氨基庚二酸脱羧酶(dapdc),该酶将二氨基庚二酸(dap)转化为l-lys,二氨基庚二酸是细胞壁形成的重要前体物质,因此dapdc对细菌的生长和生存至关重要。实验考察了赖氨酸及其浓度对l-蛋氨酸发酵产量的影响。
将实施例2步骤(2)原始发酵培养基改为优化发酵培养基,优化发酵培养基组成为:甘油40g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o37g/l,金属离子混合溶液1ml/l,赖氨酸30-180mg/l,溶剂为蒸馏水,ph自然;所述金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水。
赖氨酸终浓度分别为30mg/l、60mg/l、90mg/l、120mg/l、150mg/l和180mg/l,以不添加赖氨酸为对照,考察赖氨酸的添加及浓度对l-蛋氨酸和菌体生长的影响,实验条件同实施例2步骤(2),结果如图5所示。
结果表明赖氨酸对l-蛋氨酸产量有明显的促进作用,在30~180mg/l范围内,l-蛋氨酸的产量随赖氨酸浓度的增加而增加。当赖氨酸浓度为150mg/l时,l-蛋氨酸的产量最高为2.72g/l,较对照组提高了约13.9%,但从生物量来看,赖氨酸浓度的增加并未使生物量明显增加,说明一定浓度范围内的赖氨酸能维持细胞生长并使代谢通量趋于l-蛋氨酸的合成而不是细胞的生长,最终优选150mg/l赖氨酸的添加量为最优。
实施例6:生长因子及其氨基酸前体物质对l-蛋氨酸发酵产量的影响
大肠杆菌代谢合成l-蛋氨酸的途径较为复杂,其中涉及多种辅酶与氨基酸前体,因此,本实验在上述实验的基础上考察了几种生长因子及其氨基酸前体物质对l-蛋氨酸发酵产量的影响。
将实施例2步骤(2)原始发酵培养基改为对照发酵培养基,组成为:甘油40g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o37g/l,金属离子混合溶液1ml/l,溶剂为蒸馏水,ph自然;金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水。
向上述对照发酵培养基中分别添加vb1、vb6、vb7、vb12、前体物质天冬氨酸(asp)及柠檬酸钠(cit-na),使其终浓度均为1mg/l,以不添加上述物质为对照,考察维生素及前体物质对l-蛋氨酸和菌体生长的影响,实验条件同实施例2步骤(2),结果如图6所示。
结果表明,vb6、vb7和vb12对菌体生长均有明显促进作用,与对照组相比,生物量分别提高了17.8%、19.4%和7%,但对比l-蛋氨酸的产量可知,vb12对l-蛋氨酸的产量具有明显的促进作用,较对照组提高了约11%,而vb6、vb7及天冬氨酸的添加使l-蛋氨酸的产量明显减少,说明vb6、vb7和天冬氨酸能够促进菌体生长,同时可能有助于其他物质的产生而非l-蛋氨酸的合成,最终选择在培养基中加入维生素vb12以提高l-蛋氨酸的发酵产量。
实施例7:
实施例6表明vb12对l-蛋氨酸产量有明显的促进作用,因此实验考察了vb12的浓度对l-蛋氨酸发酵产量的影响。
将实施例2步骤(2)原始发酵培养基改为对照发酵培养基,组成为:甘油40g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o37g/l,金属离子混合溶液1ml/l,溶剂为蒸馏水,ph值自然;金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水。
向上述对照发酵培养基中添加vb12,使其终浓度分别为0.1mg/l、0.5mg/l、1mg/l、1.5mg/l和2mg/l,以不添加vb12为对照,考察vb12的添加及浓度对l-蛋氨酸和菌体生长的影响,实验条件同实施例2步骤(2),结果如图7所示。
在0.1~1.5mg/l范围内,l-蛋氨酸的产量随vb12浓度的增加而增加。当vb12浓度为1.5mg/l时,l-蛋氨酸的产量为3.05g/l,较对照组提高了约12.5%。但从生物量来看,vb12浓度的增加对生物量几乎没有影响。
通过对培养基组分的优化和添加赖氨酸及vb12,其最优发酵培养基组分为:甘油40g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o37g/l、vb121.5mg/l,赖氨酸150mg/l,金属离子混合溶液1ml/l,溶剂为蒸馏水,ph自然;金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水。按照实施例2步骤(2)培养,最终蛋氨酸浓度为3.05g/l,为优化前l-蛋氨酸产量的2.56倍。
实施例8:ca+离子对l-蛋氨酸的影响
将实施例6中最优发酵培养基在5l发酵罐上进行放大验证试验。培养基如实施例6,接种量为5%,并向发酵培养基中添加50mg/lamp,不添加10g/lcaco3,在发酵罐中采用30%氨水水溶液控制ph,搅拌转速300r/min,28℃下培养60h,结果如图8所示,实验发现发酵罐中l-蛋氨酸产量仅为2.5g/l,比摇瓶中优化的结果(3.05g/l)降低了18%,分析结果发现在摇瓶与发酵罐中培养过程的区别在于ph控制方式的不同,摇瓶中采用caco3控制ph,而发酵罐中采用氨水控制。
由此我们进一步在发酵罐中验证了ca2+及co32-的作用。首先,在上述最优培养基中添加10g/lna2co3,与摇瓶中结果进行对比,发现co32-离子对l-蛋氨酸基本无影响。后续,在发酵罐中进一步考察了ca2+的影响。具体实验操作如下:实验中对照组发酵培养基组成为:甘油20g/l,(nh4)2so416g/l,kh2po41g/l,酵母提取物2g/l,na2s2o37g/l,vb121.5mg/l,赖氨酸150mg/l,金属离子混合溶液1ml/l,溶剂为蒸馏水,ph值自然;金属离子混合溶液组成为:mgso4·7h2o500g/l,mnso4·8h2o5g/l,feso4·7h2o5g/l,znso45g/l,溶剂为蒸馏水,实验条件同实施例2步骤(2),并向发酵培养基中添加50mg/lamp,不添加10g/lcaco3,发酵过程中采用30%氨水调节ph为6.8。
其余三组在上述对照发酵培养基中分别添加:10g/lcaco3调节ph;添加10g/lcacl2并采用氨水调节ph为6.8;以及添加10g/lcaco3并采用30%氨水调节ph为6.8,实验条件同实施例2步骤(2),向发酵培养基中添加50mg/lamp,考察ca2+离子对生物量及l-蛋氨酸产量的影响。
由图9实验结果可以看出,在对照组中,l-蛋氨酸产量仅为0.94g/l,而在其余三组添加ca2+离子后,其产量分别提高至1.64g/l、1.49g/l及1.5g/l,分别比对照组提高了74.46%、58.51%和59.57%,说明钙离子对l-蛋氨酸的产量有促进作用,添加碳酸钙并同时用氨水调节ph对l-蛋氨酸的影响相差不大,因此氨水未对l-蛋氨酸的产量产生影响。综上所述,说明碳离子的添加有利于l-蛋氨酸的合成。
序列表
<110>浙江工业大学
<120>一种提高l-蛋氨酸产量的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>74
<212>dna
<213>未知(unknown)
<400>1
ttgacaattaatcatccggctcgtataatgtgtggaattgtgagcggataacaatttcac60
acaggaaacagacc74
- 还没有人留言评论。精彩留言会获得点赞!