一种燕麦及燕麦片加工副产物中β-葡聚糖的提取方法与流程
本发明涉及植物有效成分精制加工技术领域,具体是一种燕麦及燕麦片加工副产物中β-葡聚糖的提取方法。
背景技术:
β-葡聚糖是存在于燕麦胚乳和糊粉层细胞壁中的一种非淀粉多糖,是由均一的d-吡喃葡萄糖单位通过β-(1,3)和β-(1,4)糖苷键连接而成的线性大分子,是一种高分子聚合物。β-葡聚糖具有改善人体免疫系统,调节血糖,维持肠道微生物环境等诸多生理功能,作为一种水溶性活性多糖,燕麦β-葡聚糖还具有良好的水溶性,乳化性,粘稠性等特点,因此在食品工业上可以用作增稠剂、食品功能性因子、稳定剂等。在美容护肤行业,因其具有抗衰老、抗辐射等生物活性,可作为化妆品植物功效添加剂。
燕麦是一种低糖、高营养、高能食品,燕麦性味甘平,能益脾养心、敛汗,有较高的营养价值。燕麦片是燕麦粒轧制而成,使其食用更加方便,口感也得到改善,成为深受欢迎的保健食品。但目前我国对于燕麦的研发还停留在浅加工方面,如制成燕麦片、燕麦饼干等,对其功能成分的提取,如β-葡聚糖的深度开发和利用仍有不足,因此加强β-葡聚糖产业化开发,进一步扩展燕麦产业发展的领域,不仅能获得功能性成分,还可以使加工副产物得到充分的利用,具有极广的应用前景。
技术实现要素:
本发明的目的在于提供一种燕麦及燕麦片加工副产物中β-葡聚糖的提取方法,解决现有技术中β-葡聚糖的提取纯度不高的问题。
为实现上述目的,本发明采用如下技术方案:
一种燕麦或燕麦片加工副产物中β-葡聚糖的提取方法,包括以下步骤:
(1)原料预处理:将原料燕麦或燕麦片加工副产物粉碎,过60目筛,加入终浓度为75%w/v的乙醇脱脂脱色;4000r/min离心10min,得到沉淀1;
(2)β-葡聚糖提取及去除淀粉:将沉淀1和水按质量体积比1:5-1:30g:ml混合,调节ph至2.0-11.0,在30-90℃条件下,超声辅助提取30-180min,按酶底比20-100u/g加入α-淀粉酶,60-90℃提取10-100min;4000r/min离心20min,得到上清液2;
(3)去除蛋白:将上清液2的ph调至6.0,按酶底比4000-12000u/g的比例加入木瓜蛋白酶,45-65℃,30r/min酶解30-90min;酶解结束后,调整ph至4.7,室温静置4h;4000r/min离心20min,得到上清液3;
(4)浓缩醇沉:将上清液3的ph调节至7.0,真空浓缩上清液3的体积至原体积的1/10;浓缩液加入终浓度为50%v/v的乙醇,使分子量小于5000da的多糖絮凝出来,4000r/min离心10min,得到沉淀4;
(5)除杂多糖:将沉淀4加水复溶,加水量以沉淀完全溶解为准,加入终浓度为25-30%m/v的硫酸铵,静置4h去除杂多糖,4000r/min离心20min,得到沉淀5;
(6)醇沉除硫酸铵:将沉淀5加水复溶,加水量以沉淀完全溶解为准,加入终浓度为50%v/v的乙醇去除硫酸铵,4000r/min离心10min,得到沉淀6,将沉淀6加水复溶,冷冻干燥后即获得β-葡聚糖产品。
一种燕麦中β-葡聚糖的提取方法,包括以下步骤:
(1)原料预处理:将原料燕麦粉碎,过60目筛,加入终浓度为75%w/v的乙醇脱脂脱色;4000r/min离心10min,得到沉淀1;
(2)β-葡聚糖提取及去除淀粉:将沉淀1和水按质量体积比1:24g:ml混合,调节ph至6.0,在54℃条件下,超声辅助提取120min,按酶底比80u/g加入α-淀粉酶,70℃提取40min;4000r/min离心20min,得到上清液2;
(3)去除蛋白:将上清液2的ph调至6.0,按酶底比8000u/g的比例加入木瓜蛋白酶,65℃,30r/min酶解30min;酶解结束后,调整ph至4.7,室温静置4h;4000r/min离心20min,得到上清液3;
(4)浓缩醇沉:将上清液3的ph调节至7.0,真空浓缩上清液3至原体积的1/10;浓缩液加入终浓度为50%v/v的乙醇,使分子量小于5000da的多糖絮凝出来,4000r/min离心10min,得到沉淀4;
(5)除杂多糖:将沉淀4加水复溶,加水量以沉淀完全溶解为准,加入终浓度为30%m/v的硫酸铵,静置4h去除杂多糖,4000r/min离心20min,得到沉淀5;
(6)醇沉除硫酸铵:将沉淀5加水复溶,加水量以沉淀完全溶解为准,加入终浓度为50%v/v的乙醇去除硫酸铵,4000r/min离心10min,得到沉淀6,将沉淀6加水复溶,冷冻干燥后即获得β-葡聚糖产品。
一种燕麦片加工副产物中β-葡聚糖的提取方法,包括以下步骤:
(1)原料预处理:将燕麦片加工副产物粉碎,过60目筛,得到燕麦麸皮粉,加入终浓度为75%w/v的乙醇脱脂脱色;4000r/min离心10min,得到沉淀1;
(2)β-葡聚糖提取及去除淀粉:将沉淀1和水按质量体积比1:25g:ml混合,调节ph至3.5,在70℃条件下,超声辅助提取140min,按酶底比40u/g加入α-淀粉酶,60℃提取10min;4000r/min离心20min,得到上清液2;
(3)去除蛋白:将上清液2的ph调至6.0,按酶底比8000u/g的比例加入木瓜蛋白酶,45℃,30r/min酶解30min;酶解结束后,调整ph至4.7,室温静置4h;4000r/min离心20min,得到上清液3;
(4)浓缩醇沉:将上清液3的ph调节至7.0,真空浓缩上清液3的体积至原体积的1/10;浓缩液加入终浓度为50%v/v的乙醇,使分子量小于5000da的多糖絮凝出来,4000r/min离心10min,得到沉淀4;
(5)除杂多糖:将沉淀4加水复溶,加水量以沉淀完全溶解为准,加入终浓度为25%m/v的硫酸铵,静置4h去除杂多糖,4000r/min离心20min,得到沉淀5;
(6)醇沉除硫酸铵:将沉淀5加水复溶,加水量以沉淀完全溶解为准,加入终浓度为50%v/v的乙醇去除硫酸铵,4000r/min离心10min,得到沉淀6,将沉淀6加水复溶,冷冻干燥后即获得β-葡聚糖产品。
本发明的优点在于:
(1)去除淀粉与提取同时进行,有效的解决了包裹在淀粉颗粒中的燕麦β-葡聚糖难以提取的问题,同时简化了工艺降低了成本;
(2)采用酶解与等电点结合方法去除蛋白质,解决了蛋白质残留的问题;
(3)二次醇沉体系乙醇终浓度为50%。采用此方法可以有效去除硫酸铵,起到脱盐的效果,与现有的透析和色谱柱脱盐法相比,该工艺成本低,效率高,同时也有效地提高了燕麦β-葡聚糖产品的纯度。
附图说明
图1为ph对燕麦中β-葡聚糖提取率的影响。
图2为料液比对燕麦中β-葡聚糖提取率的影响。
图3为温度对燕麦中β-葡聚糖提取率的影响。
图4为时间对燕麦中β-葡聚糖提取率的影响。
图5-a为温度和时间对燕麦中β-葡聚糖提取率的交互影响。
图5-b为温度和ph值对燕麦中β-葡聚糖提取率的交互影响。
图5-c为时间和料液比对燕麦中β-葡聚糖提取率的交互影响。
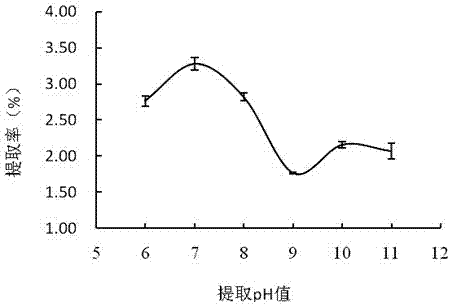
图6为ph对燕麦麸皮粉中β-葡聚糖提取率的影响。
图7为时间对燕麦麸皮粉中β-葡聚糖提取率的影响。
图8为料液比对燕麦麸皮粉中β-葡聚糖提取率的影响。
图9为温度对燕麦麸皮粉中β-葡聚糖提取率的影响。
图10-a为提取时间和ph值对燕麦麸皮粉中β-葡聚糖提取率的交互影响。
图10-b为料液比和ph值对燕麦麸皮粉中β-葡聚糖提取率的交互影响。
图10-c为提取温度和ph值对燕麦麸皮粉中β-葡聚糖提取率的交互影响。
图10-d为料液比和提取时间对燕麦麸皮粉中β-葡聚糖提取率的交互影响。
图10-e为提取温度和提取时间对燕麦麸皮粉中β-葡聚糖提取率的交互影响。
图10-f为提取温度和料液比对燕麦麸皮粉中β-葡聚糖提取率的交互影响。
具体实施方式
实施例1燕麦中燕麦β-葡聚糖的提取
(1)原料预处理
将原料燕麦粉碎,过60目筛,加入终浓度为75%w/v的乙醇脱脂脱色;4000r/min离心10min,得到沉淀1。
(2)淀粉酶法去除淀粉
将沉淀1和水按质量体积比1:24g:ml混合,调节ph至6.0,54℃超声辅助提取120min后,加入耐高温α-淀粉酶反应。选择时间、温度、酶底比3个因素,设置4个水平根据正交表l16(45)进行正交实验,根据实验结果进行极差和方差分析,得到最优酶解工艺为酶解时间为40min,温度为70℃,酶底比为80u/g,此条件下提取液中淀粉含量为1.317μg/ml,占β-葡聚糖提取物的0.047%。
(3)β-葡聚糖的提取
(a)ph对燕麦β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1:15g:ml混合,调节ph至6.0、7.0、8.0、9.0、10.0、11.0,80℃超声辅助提取60min后,按酶底比80u/g加入耐高温α-淀粉酶,70℃提取40min,4000r/min离心20min。取上清液,测定不同提取ph条件下的β-葡聚糖提取率,结果见图1,β-葡聚糖提取率在提取ph值为7.0时达到最大值,随后呈下降趋势,可能原因是在提取过程中加入的酸碱试剂导致了部分β-葡聚糖的降解,使其体系溶解性降低,溶出率下降。根据单因素实验结果,选择7.0作为最佳提取ph值。
(b)料液比对燕麦β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1:5、1:10、1:15、1:20、1:25、1:30g:ml混合,调节ph至7.0,80℃超声辅助提取60min后,按酶底比80u/g加入耐高温α-淀粉酶,80℃提取60min,4000r/min离心20min。取上清液,测定不同料液比条件下的β-葡聚糖提取率,结果见图2,在一定范围内,β-葡聚糖提取率随着料液比的增大呈上升趋势,出现峰值后逐渐下降并趋于平缓,由于料液比的增大,溶液体系变大有利于β-葡聚糖的溶出,因此提取率不断提高,当大部分溶液中β-葡聚糖已被提取出来,再增大料液比是没有意义的,反而会增加试验的经济成本。综合实验结果和经济性考虑,本实验最佳提取料液比为1:20。
(c)温度对燕麦β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1:20g:ml混合,调节ph至7.0,分别在温度为40、50、60、70、80、90℃的条件下,超声辅助提取60min后,按酶底比80u/g加入耐高温α-淀粉酶,80℃提取60min,4000r/min离心20min。取上清液,测定不同提取温度条件下的β-葡聚糖提取率,结果见图3,提取温度达到50℃时提取率最高,之后β-葡聚糖提取率随着温度的上升呈下降趋势,可能原因是由于温度的升高,燕麦种子中的淀粉因为高温糊化,而导致淀粉溶出率升高,影响β-葡聚糖的溶出,从而提取率下降;也可能由于β-葡聚糖的溶出,导致体系黏度增加,阻碍了后续的β-葡聚糖溶出。
(d)时间对燕麦β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1:20g:ml混合,调节ph至7.0,50℃超声辅助提取30、60、90、120、150、180min后,按酶底比80u/g加入耐高温α-淀粉酶,80℃提取60min,4000r/min离心20min。取上清液,测定不同提取时间条件下的β-葡聚糖提取率,结果见图4,β-葡聚糖的提取率随着提取时间的延长,呈先上升后下降的趋势,在90min时出现提取率峰值,可能原因是在提取前期,体系中有大量的β-葡聚糖未溶出,随着提取时间的延长,大部分的β-葡聚糖被提取出来,体系中只剩余少量未溶出,因此再增加提取时间也无法提高提取率,并且提取时间过长,有可能导致溶液中的β-葡聚糖被降解,使其提取率逐渐下降。
(e)响应面法获得最佳工艺参数
在单因素实验的基础上,根据box-behnken的中心组合试验设计原理,选择影响燕麦β-葡聚糖提取率的4个主要影响因素:ph值、料液比、时间、温度进行组合,每个因素取3个水平,以(-1,0,1)编码,以0为中心点,-1,1为最低值与最高值。试验因素编码与水平见表1。
表1燕麦β-葡聚糖提取响应面分析设计因素编码与水平
采用design-expert软件生成具体实验设计方案见表5,试验号1~24是析因试验,试验号25~29是中心试验。29个试验点分为析因和零点,零点为区域的中心点,零点实验重复5次,用以估计实验误差。根据表2中的实验号进行提取实验,提取结束后采用刚果红法测定上清液中的β-葡聚糖含量,将结果写入表中。
表2响应面试验设计和结果
表3响应面方差分析表
由表3可以看出,在模型显著性检验中(pr>f<0.05),即模型是显著的,此实验具有统计学意义,实验结果能够用于后续工艺的优化设计;失拟项(pr>f>0.05)不显著,表明该模型在试验区域内拟合度较好,无失拟因素存在。
拟合的回归方程为:y=3.84-0.41a+0.10b-0.18c+0.13d+0.000ab-0.31ac+0.000ad-7.500e-003bc+0.10bd+0.14cd-0.22a2-0.12b2-0.29c2-9.250e-003d2
表4回归方程误差统计分析
由表4可以看出,r2表示多元相关系数,r2=0.9793,相关性较好;变异系数cv=2.17%,进一步说明模型拟合度好;校正r2和预测r2两个值都较高且差值不超过0.2则说明该模型不存在其他影响显著的因子,能充分解释工艺;信噪比(即有效信号与噪声的比值)=30.665>4即为理想。证明该回归方程能较好的适应该工艺过程。
由图5-a~5-c的三维立体响应曲面和等高线图可以直观地看出各个因子的交互影响,等高线呈椭圆形证明交互作用显著。由图5-a可以看出,随着温度和时间值的增大,β-葡聚糖提取率有所下降,可能是温度过高,时间过长导致了一部分β-葡聚糖的降解;由图5-b可以看出,在所选ph值范围内存在最大值,且等高线呈椭圆形,说明温度和ph值交互作用显著;由图5-c可以看出,时间和料液比交互作用显著且在所选范围内存在最大响应值。
由软件求解最佳工艺,可得当ph=6.0,料液比1:24,温度54℃,时间120min,β-葡聚糖提取率的预测值为4.29%。对最佳工艺进行验证实验,β-葡聚糖提取率为4.23%,真实值与预测值相差1.40%,证明模型能拟合真实的工艺过程。
(4)酶解结合等电点法去除蛋白质工艺
燕麦中蛋白质含量大多在16%左右,为了获得高纯度β-葡聚糖,本实验采用蛋白酶解正交试验结合等电点的方法法获得蛋白质最佳去除工艺,以考马斯亮蓝法测定提取液中蛋白质含量,判断蛋白质是否去除。
(a)等电点的确定
称取种子原料粉6.0000g,按照提取最佳工艺进行β-葡聚糖提取。提取结束后,离心,得到样品液。吸取样品液10.0ml,再加入5.0ml配制的木瓜蛋白酶酶溶液(800u/ml),调ph至4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0,4℃静置过夜后,离心。测定其上清液蛋白含量,上清液蛋白含量最低所对应的ph值为样品液的等电点值,等电点pi=4.7。
(b)酶法去除蛋白质
称取种子原料粉1.0000g,按照提取最佳工艺进行β-葡聚糖提取,提取结束后,离心得到上清液。选取时间、温度、酶底比3个因素,设置3个水平按照正交表l9(34)设计进行正交实验,根据实验结果进行极差和方差分析,得到最优酶法去除蛋白质工艺为时间30min,温度65℃,酶底比8000u/g。此条件下提取液中蛋白质含量为0.084mg/ml,占β-葡聚糖提取物的4.76%。
(5)醇沉
加入无水乙醇调体系终浓度为50%进行醇沉,静置过夜。
(6)除杂多糖
将醇沉得到的溶液离心,沉淀加水复溶后,将其放置磁力搅拌器上,一边加入硫酸铵固体一边剧烈摇荡使硫酸铵充分溶解,使硫酸铵最终体系浓度达到30%,静置后4000r/min离心20min。
(7)醇沉除硫酸铵
取盐析后得到的沉淀加水复溶,加入无水乙醇至体系终浓度为50%,静置离心,沉淀加水复溶,冷冻干燥即得到β-葡聚糖提取物,按照以下公式对β-葡聚糖含量进行计算。
△a—样品吸光值与反应空白吸光值的差值;
f—100(μg葡萄糖)/100μg葡萄糖的吸光值;
w—样品重量(mg)。
据aoac995.16酶法对只醇沉和经醇沉、30%盐析、再醇沉后所得的β-葡聚糖提取物进行纯度测定,结果见表5
表5分离纯化结果
由表5可知,进行盐析再醇沉后的纯化处理能有效的提高燕麦种子中β-葡聚糖纯度,可能原因是硫酸铵纯化能够去除一些杂多糖和小分子物质,在盐析之后进行一次醇沉能够有效除去提取液中剩余硫酸铵,使β-葡聚糖纯度达到81.13%。
实施例2燕麦片加工副产物中β-葡聚糖的提取
(1)原料预处理
将原料燕麦麸皮粉碎,过60目筛,加入终浓度为75%w/v的乙醇脱脂脱色;4000r/min离心10min,得到沉淀1。
(2)淀粉酶法去除淀粉
将沉淀1和水按质量体积比1:24g:ml混合,调节ph至6.0,54℃超声辅助提取120min后,加入耐高温α-淀粉酶反应。选择时间、温度、酶底比3个因素,设置4个水平根据正交表l16(45)进行正交实验,根据实验结果进行极差和方差分析,得到最优酶解工艺为酶解时间10min,温度60℃,酶底比40u/g,此条件下淀粉含量占β-葡聚糖提取物的0.44%。
(3)β-葡聚糖的提取
(a)ph对燕麦麸皮粉β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1:25g:ml混合,调节ph至2.0、3.0、4.0、5.0、6.0、7.0,70℃超声辅助提取150min后,按酶底比40u/g加入耐高温α-淀粉酶,60℃提取10min,4000r/min离心20min。取上清液,测定不同提取ph条件下的β-葡聚糖提取率,结果见图6,当ph值为4.0时,β-葡聚糖的提取率达到最大值,当ph值升高提取率呈下降趋势,可能是有其他杂质溶出,阻碍了β-葡聚糖的溶出,导致提取率下降,所以选择提取的ph值为4.0。
(b)时间对燕麦麸皮粉β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1:25g:ml混合,调节ph至4.0,70℃超声辅助提取,设定提取时间为30、60、90、120、150、180min,提取结束后按酶底比40u/g加入耐高温α-淀粉酶,60℃提取10min,4000r/min离心20min。取上清液,测定不同提取时间下的β-葡聚糖提取率,结果见图7,在提取30-150min范围内,β-葡聚糖提取率随提取时间的增加逐渐增加,150min达到峰值,150min后,随着提取时间的延长,溶液中的β-葡聚糖浓度增大、粘度增大,不利于β-葡聚糖的溶出,因此选择150min为最适的提取时间。
(c)料液比对β-葡聚糖提取率的影响
将沉淀1和水按质量体积1︰5、1︰10、1︰15、1︰20、1︰25、1︰30g:ml混合,调节ph至4.0,70℃超声辅助提取150min后,按酶底比40u/g加入耐高温α-淀粉酶,60℃提取10min,4000r/min离心20min。取上清液,测定不同料液比条件下的β-葡聚糖提取率,结果见图8,随着料液比的增加,β-葡聚糖的提取率明显上升,当料液比为1︰25时多糖得率不再增加,根据固液萃取基本理论,随着溶剂量的增加,溶质的扩散和溶出也随之增加,当料液比1︰25到达最大值而后趋于平衡,因此本实验的最佳料液比为1︰25。
(d)温度对β-葡聚糖提取率的影响
将沉淀1和水按质量体积比1︰25g:ml混合,调节ph至4.0,在30、40、50、60、70、80℃条件下超声辅助提取150min后,按酶底比40u/g加入耐高温α-淀粉酶,60℃提取10min,4000r/min离心20min。取上清液,测定不同料液比条件下的β-葡聚糖提取率,结果见图9,随着温度的上升,物质传递速度加快,β-葡聚糖的溶出增加,提取率呈递增趋势,在70℃达到最大,最佳提取温度为70℃。
(e)燕麦麸皮粉中β-葡聚糖提取响应面试验
在单因素实验的基础上,根据box-behnken的中心组合试验设计原理,选择影响β-葡聚糖提取率的4个主要影响因素:提取液ph值、时间、料液比、温度进行组合,每个因素取3个水平,以(-1,0,1)编码,以0为中心点,-1,1为最低值与最高值。试验因素编码与水平见表6。
表6β-葡聚糖提取响应面分析设计因素编码与水平表
具体实验设计方案见表7,试验号1~24是析因试验,试验号25~29是中心试验。29个试验点分为析因和零点,零点为区域的中心点,零点实验重复5次,用以估计实验误差。根据表7中的实验方案进行提取实验,用刚果红法测定上清液中的β-葡聚糖含量并计算提取率,结果见表7。
表7响应面实验设计和结果
表8响应面方差分析
注:**非常显著,*显著。
由表8可以看出,在模型显著性检验中(pr>f<0.05),即模型是显著的,此实验具有统计学意义,实验结果能够用于后续工艺的优化设计;失拟项(pr>f>0.05)不显著,表明该模型在试验区域内拟合度较好,无失拟因素存在。
拟合的回归方程为:
y=2.66-0.018a-0.22b-0.032c+0.12d+0.22ab-0.12ac+0.10ad+0.18bc+0.09bd+0.22cd-0.048a2-0.66b2-0.38c2-0.3d2
表9回归方程误差统计分析
由表9可得,r2表示多元相关系数,r2=0.9842,相关性较好;变异系数(cv%)3.62%,进一步说明模型拟合度好;校正r2和预测r2两个值都较高且差值不超过0.2,则说明该模型不存在其他影响显著的因子,能充分解释工艺;信噪比(即有效信号与噪声的比值)=26.059>4即为理想。证明该回归方程能较好的适应该工艺过程。
由图10-a~10-f的三维立体响应曲面和等高线图可以直观地看出各个因子的交互影响,等高线呈椭圆形证明交互作用显著。由图10-a可以看出,在提取的ph值一定时,提取时间对β-葡聚糖的提取率的影响呈抛物线状,说明在提取过程中存在最佳的提取时间;由图10-b可以看出,在提取的ph值一定时,料液比对β-葡聚糖的提取率影响不是很明显,表现为曲线比较平缓;由图10-c可以看出,在所选ph值范围内存在最大值,且等高线呈椭圆形,说明温度和ph值交互作用显著;由图10-d可以看出,时间和料液比交互作用显著且在所选范围内存在最大响应值;图10-e、10-f的椭圆轴线与坐标轴存在较大的角度,提取温度比较小时,提取时间和料液比对β-葡聚糖的提取率影响非常显著,响应曲面比较陡,说明在提取温度不是很高时,提高提取时间和料液比能明显提高β-葡聚糖的提取率。
由软件进行最佳工艺求解,得到ph为3.5,料液比1:25,温度70℃,时间140min,β-葡聚糖提取率的预测值为2.71%。对最佳工艺进行验证实验可得β-葡聚糖提取率为2.44%,证明模型能拟合真实的工艺过程。
(4)酶解结合等电点法去除蛋白质工艺
(a)等电点的确定
准确称取5g燕麦麸皮粉,按照前面实验得到的最佳提取工艺提取,得到提取液。分别取10.0ml加入离心管中,再加入5.0ml木瓜蛋白酶溶液(800u/mg),调ph至4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0,4℃静置过夜,离心,测定上清液中蛋白质的残留量。蛋白质残留量最低的上清液的ph值为去除蛋白质的等电点,等电点pi=4.7。
(b)酶解去除蛋白质
准确称取1g燕麦麸皮粉,按照前面实验得到的最佳提取工艺提取,得到提取液。根据参考文献选择3个主要影响燕麦麸皮中蛋白质酶解的因素(酶解时间、温度、酶底比),每个因素设置3水平,设计l9(34)进行正交实验,得到最佳等电点结合酶法去除蛋白质的工艺,为酶解时间30min、温度45℃、酶底比8000u/g,此条件下,蛋白质含量占β-葡聚糖提取物的5.23%。
(5)醇沉
用无水乙醇调体系终浓度为50%进行醇沉,静置过夜。
(6)除杂多糖
将醇沉得到的试样离心(4000r/min,10min),取沉淀复溶,将其放置在磁力搅拌器上,一边加入硫酸铵固体一边剧烈搅拌使硫酸铵充分溶解,溶液体系中的硫酸铵终浓度为25%m/v,静置片刻。
(7)醇沉除硫酸铵
取盐析后得到的沉淀加水复溶,加入无水乙醇调体系终浓度为50%,静置离心,4000r/min,10min,沉淀复溶,冷冻干燥即得到β-葡聚糖提取物,通过以下公式计算β-葡聚糖含量。
△a—样品吸光值与反应空白吸光值的差值;
f—100(μg葡萄糖)/100μg葡萄糖的吸光值;
w—样品重量(mg)。
用aoac995.16酶法对只经过醇沉以及经25%盐析后再醇沉得到的β-葡聚糖提取物进行纯度测定。结果见表10。
表10纯化结果
由表10可知,经盐析再醇沉得到的β-葡聚糖纯度明显提高,原因是硫酸铵盐析纯化去除了大部分的杂多糖和一些小分子化合物,再一次醇沉目的是除去残留的硫酸铵,得到纯度为84.36%的β-葡聚糖提取物。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!