一种靶向性外泌体的制备方法及其应用与流程
本发明涉及生物医学
技术领域:
,特别涉及一种靶向性外泌体的制备方法及其应用。
背景技术:
rna治疗技术,尤其是sirna,反义寡核苷酸以及crispr-cas9基因组编辑介导的rnas属于新兴的可编程治疗技术,以高特异性和高度可变性为显著特征。然而由于低摄取效率和高细胞毒性目前大多数可编程rna药物治疗方法不适合临床应用。因此,将rna药物输送到大多数原发性组织和癌细胞,包括白血病细胞和实体瘤细胞的安全有效的策略仍然未得到有效开发(usmanetal.,2018)。外泌体(exosomes)是细胞经过"内吞-融合-外排"等一系列调控过程而形成的直径在30~150nm的圆形单层膜结构的细胞外小囊泡。外泌体由机体众多类型细胞释放,并广泛分布于唾液、血浆、乳汁、尿液等体液当中,可以携带蛋白,运送rna,在细胞间物质和信息转导中起重要作用。外泌体的发现丰富了研究者们对细胞间通讯方式的认识,加深了对机体生理、病理过程的理解,2013年诺贝尔生物/医学奖授予了三位在细胞囊泡方面贡献突出的科学家,使外泌体的研究达到全新的高度。外泌体与哺乳动物细胞的天然生物相容性表明,它可以克服大多数细胞屏障和药物传递障碍,如核糖核酸酶敏感性、内体累积、吞噬作用、多药耐药性、细胞毒性和免疫原性(usmanetal.,2018)。理论上外泌体是未来rna治疗技术的最理想载体,得到众多研究者的关注和开发。外泌体通过与细胞膜直接融合、与细胞膜表面特异性受体结合进而通过主动运输(内吞、脂筏等)进入细胞内。其中外泌体上的特异性蛋白与细胞表面的相应受体的特异性结合,是实现外泌体靶向运输的重要方式。目前在rna治疗技术中,对于外泌体的表面修饰的研究报道较少,已有的研究均为利用重组质粒将靶向短肽和外泌体表面膜蛋白在外泌体分泌细胞上进行重组表达,通过收集释放的外泌体,达到对外泌体的表面修饰。由于该方法存在质粒转染效率较低,特别是间充质干细胞或红细胞这两类最有应用前景的外泌体母细胞的质粒转染效率低,难以通过基因工程质粒转染进行大规模制备分泌母细胞。由于外泌体上表面膜蛋白是一个复合的三维结构,靶向短肽融合外泌体膜蛋白上进行表达,融合蛋白的三维结构折叠是一个非常复杂的系统性过程,因而靶向肽在融合蛋白上的表达构象难以有效确定。另外目前外泌体的分离一般采用经典的差速离心法,分离的效率较低。由于以上所述的原因,难以实现大规模靶向性外泌体的制备。因此,研发一种新型高效的外泌体表面修饰方法,对于外泌体作为运输载体的研究具有非常重要的意义。技术实现要素:为解决上述
背景技术:
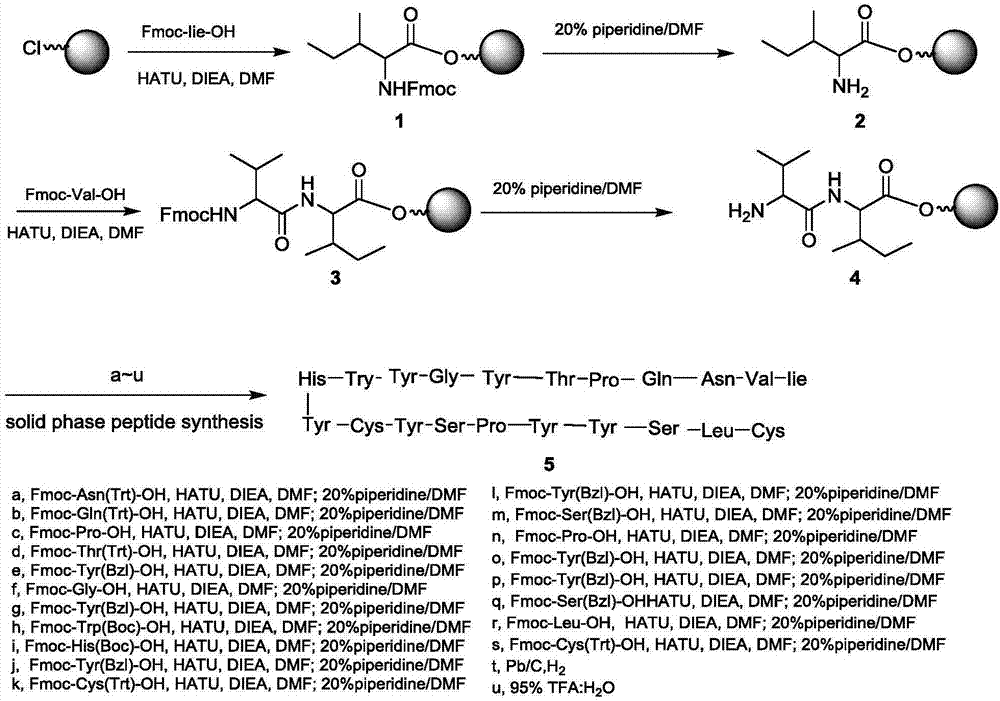
中提到外泌体修饰效率低的问题,本发明提供一种靶向性外泌体的制备方法:将psp1多肽与靶向肽或具有促进免疫功能的短肽共价结合形成psp1靶向肽后,再与外泌体进行结合,即获得具有靶向性外泌体。进一步地,所述靶向肽至少包括egfr靶向肽、nachr靶向肽和肝癌细胞靶向肽中的一种。进一步地,所述egfr靶向肽为ge11多肽;所述ge11多肽的氨基酸序列为:yhwygytpqnvi;将所述psp1多肽与所述ge11多肽进行合成,得到psp1-ge11靶向肽,所述psp1-ge11靶向肽的氨基酸序列为:clsyypsycyhwygytpqnvi。进一步地,所述nachr靶向肽为嗜神经性病毒衍生肽,其氨基酸序列为:ytiwmpenprpgtpcdiftnsrgkrasng;将psp1多肽、嗜神经性病毒衍生肽和6个组氨酸残基进行合成,得到psp1-rvg29-6his靶向肽;所述psp1-rvg29-6his多肽的氨基酸序列为:clsyypsycytiwmpenprpgtpcdiftnsrgkrasnghhhhhh。进一步地,psp1-rvg29-6his靶向肽的合成的方法包括以下步骤:步骤a、合成5’端和3’端各含有bamhi、xhoi限制性内切酶酶切位点的147对dna序列:5’-ggatcctgcctgtcctattatccgtcctattgctacactatttggatgccggaaaatccgcgtccgggtaccccatgcgacatcttcaccaactcccgtggtaaacgcgcgtctaacggccaccatcaccaccaccattaactcgag-3’;步骤b、将步骤a中的147对dna和pgex-4t-1质粒均采用bamhi和xhoi限制性内切酶,分别进行双酶切后分离纯化;选取需要的dna条带进行切割,并分别提取psp1-rvg29-6hisdna及pgex-4t-1线性化质粒;步骤c、在酶切后提取的pgex-4t-1线性化质粒进行去磷酸化处理;步骤d、将酶切后提取的psp1-rvg29-6his与去磷酸化后的pgex-4t-1质粒按照5:1的比例进行混合后反应;步骤e、反应后导入感受态e.colik12,通过氨苄青霉素的筛选出阳性菌落;步骤f、将阳性的表达菌落通过psp1-rvg29-6his的iptg诱导进行原核表达后收集,破碎收集到的细菌后离心,并收集上清液进行纯化后,即获得gst/psp1-rvg29-6his多肽;步骤g、纯化后的gst/psp1-rvg29-6his多肽用凝血酶进行gst解离,而后通过分离获得psp1-rvg29-6his靶向肽。进一步地,步骤b中,采用bamhi和xhoi限制性在37℃下进行双酶切4h,并采用琼脂糖凝胶电泳分离纯化。进一步地,步骤c中的去磷酸化处理过程为:酶切后的pgex-4t-1线性质粒溶液中加入ciap和10×ciapbuffer,并用ddw补齐至20μl,于37℃下反应30min后,经dna纯化,具体可根据提取试剂盒按说明书进行纯化。进一步地,步骤f中,将阳性的表达菌株通过pgex5':gggctggcaagccacgtttggtg和pgex3':ccgggagctgcatgtgtcagagg)进行dna测序,以验证目标基因是否导入,并将经测序验证后阳性的表达菌株通过psp1-rvg29-6his的iptg诱导进行原核表达后收集。进一步地,步骤f中,采用超声破碎收集到的细菌后离心收集上清,并用谷胱甘肽琼脂糖树脂,进行纯化。进一步地,所述肝癌细胞靶向肽为sp94多肽,所述sp94多肽的氨基酸序列为:sfsiihtpilpl;采用化学偶联法,将所述psp1多肽与所述ge11多肽进行合成,得到psp1-sp94多肽,所述psp1-sp94多肽的氨基酸序列为:clsyypsycsfsiihtpilpl。进一步地,将所述psp1多肽与所述ge11多肽进行合成后,采用高效液相色谱法进行纯化。进一步地,psp1靶向肽与外泌体进行结合时,包括以下步骤:在外泌体中加入所述psp1靶向肽,4℃条件下进行混合后,采用离心超滤,并用pbs进行冲洗,即得到具有靶向性的外泌体。本发明还提供一种采用如上任意所述靶向性外泌体的制备方法所制备的靶向性外泌体。本发明还提供一种采用如上任意所述靶向性外泌体的制备方法所制备的靶向性外泌体在制备药物上的应用。本发明提供通过大量的测试和实验,首次提出了先将psp1多肽或者与psp1具有80%以上同源性的序列的多肽与靶向肽或具有促进免疫功能的短肽进行结合,形成双向靶向性的多肽;一方面psp1部分与能够靶向与外泌体高效结合,提高外泌体的表面修饰效率,另一方面由于psp1结合了靶向肽或具有促进免疫功能的短肽,能够使经表面修饰的外泌体具有更好的细胞靶向性。本发明通过以上发明构思,克服了现有的质粒转染等表面修饰方法存在的转染效率低难以大规模生产的问题,提高了外泌体表面的修饰效率,实现了靶向性外泌体的大规模制备,为靶向性外泌体提供了一种高效、简便的修饰手段,对于外泌体作为运输载体的研究和应用具有非常重要的意义。具体地,本发明的原理在于:细胞的细胞膜上,由于atp依赖性氨基磷脂翻转酶持续不断地将磷酯酰丝氨酸由膜的外层转运到内层,造成磷酯酰丝氨酸仅分布于细胞膜的内层。当细胞凋亡时,半胱天冬酶(caspases)降解了翻转酶,从而导致这种不对称的分布被破坏,允许磷脂酰丝氨酸在细胞表面的暴露。这是细胞凋亡通过annexinv结合磷脂酰丝氨酸进行检测的原理基础。类似的,外泌体分泌出细胞后,由于与胞质分离得不到由线粒体长生的atp的持续供应,最终外泌体内的atp耗尽,atp依赖性氨基磷脂翻转酶缺乏能量来源停止主动运输,最终外泌体膜上的磷脂酰丝氨酸在膜表面暴露(nakaietal.,2016)。psp1多肽(clsyypsyc)是由narendrathapa等人通过噬菌体展示技术筛选到的高磷脂酰丝氨酸亲和性的多肽,应用于细胞凋亡检测(thapaetal.,2008)。本发明经过研究,利用了psp1多肽(clsyypsyc)与磷脂酰丝氨酸的高结合力,且通过psp1多肽与其它靶向肽或具有促进免疫功能的短肽共价结合,使得其它靶向肽或具有促进免疫功能的短肽连接到外泌体表面,最终达到外泌体表面靶向修饰的目的。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。图1为固相合成多肽psp1-ge11的路线示意图;图2为psp1-rvg29-6his的sds-page电泳实验结果图;图3为psp1-rvg29-6his的westernblot实验结果图;图4为固相合成多肽sfsiihtpilpl的示意图;图5为固相合成多肽clsyypsyc的示意图;图6为psp1与sp94的偶联路线示意图;图7为psp1-rvg29-6his修饰外泌体的的westernblot实验结果图;图8为psp1-ge11修饰外泌体转染靶细胞的实验结果图;图9为psp1-rvg29-6his修饰外泌体转染靶细胞的实验结果图;图10为psp1-sp94修饰外泌体转染靶细胞的实验结果图。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提供一种靶向性外泌体的制备方法,将psp1多肽与任意一种靶向肽或具有促进免疫功能的短肽共价结合形成psp1靶向肽后,再与外泌体进行结合,即获得具有靶向性外泌体;其中,所述psp1多肽的氨基酸序列为:clsyypsyc,或者与psp1具有80%以上同源性的序列的多肽。现分别以egfr靶向肽(ge11)、nachr靶向肽(rvg29)和肝癌细胞靶向肽(sp94)和psp1多肽结合形成psp1靶向肽:psp1-ge11、psp1-rvg29-6his及psp1-sp94,再对外泌体表面进行修饰作为实施例1、实施例2和实施例3;当然,本发明所述的不仅仅为以上靶向肽,而是在本发明构思下的所有靶向肽或具有促进免疫功能的短肽,即以上实施例仅为“将psp1多肽与任一种靶向肽或具有促进免疫功能的短肽共价结合形成psp1靶向肽后,再与外泌体进行结合”构思下的可行实施例;其中,psp1多肽的氨基酸序列为clsyypsyc;具体制备方法如下:一、外泌体的提取将hek293t细胞用10%fbs+dmem培养基贴壁培养至70%左右融合后,换成无外泌体胎牛血清培养基(10%外泌体freefbs+dmem)继续培养48小时,收集细胞培养上清液;4℃条件下500g离心5min后收集离心管上清液,再经4℃条件下3000g离心30min去除细胞碎片和蛋白聚合物后,再次收集上清过0.22um滤膜获即得去除细胞、细胞碎片等的外泌体粗提液;而后4℃条件下10000g离心1h,去除大的细胞外囊泡,收集上清,收集到的上清液经4℃条件100000g离心1.5h,用等体积的pbs缓冲溶液重悬沉淀,同等条件下再次离心1.5h,而后沉淀用500μl的pbs重悬,置于-80℃冰箱内保存备用。nta检测提取到的外泌体浓度与粒径,结果如下:浓度:2.3±0.23×109particles/ml,粒径:102±8nm经nta检测,制得的外泌体浓度与粒径符合实验要求,可应用于后续的实验。二、psp1靶向肽靶向肽的制备实施例1:psp1-ge11的制备ge11是一个具有12个氨基酸残基的多肽(氨基酸序列为:yhwygytpqnvi)具有egfr靶向性,且为非egf来源,无egfr激活活性。采用化学合成法,直接合成氨基酸序列为:clsyypsycyhwygytpqnvi的具有磷酯酰丝氨酸及egfr双向结合能能力的21个氨基酸残基多肽,即制得psp1-ge11。其中,化学合成方法可以采用化学或生物领域中的任一种合成方法,本发明提供fmoc固相多肽合成法作为其中一种实施例,利用2-cl-trt(2-氯三苯甲基氯)树脂作为固相载体。其合成路线如图1所示;具体步骤如下:1、将一定量2-cl-trt树脂(1eq)和适量diea(n、n二异丙基乙胺,5eq)加入到适量无水dmf(n、n二甲基甲酰胺)中,然后在零度下将fmoc-iie-oh(5eq)加入到上述反应液中,在室温下搅拌5小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到产物1。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次,干燥后即得到连接了第一个氨基酸的产物2。2、将fmoc-val-oh(3eq)溶于适量dmf中,并加入hatu(2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐,5eq)和diea(5eq)在零度下混合均匀,并于室温搅拌30分钟。然后把产物2(1eq)溶于适量dmf中并加入到上述溶液中,室温下搅拌2小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到产物3。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次,干燥后即得到连接了第二个氨基酸的产物4。3、重复步骤2的操作,按照路线中a-u的反应条件,依次合成目标产物,终产物经hplc纯化得到氨基酸序列为clsyypsycyhwygytpqnvi的目标多肽分子。上述仅为制得psp1-ge11的方法之一,本领域技术人员在本发明的构思下,也可通过化学或生物学的其它方法来合成psp1-ge11以及其它带有psp1和ge11氨基序列的异构变形物。实施例2:psp1-rvg29-6his的制备嗜神经性病毒衍生肽(rvg29)(氨基酸序列为:ytiwmpenprpgtpcdiftnsrgkrasng)来源于狂犬病病毒衣壳上的rvg蛋白,能被神经细胞表面的尼古丁乙酰胆碱受体(nachr)特异性地识别。通过生物表达的方式,构建了带有6个组氨酸残基的psp1-rvg29-6his(clsyypsycytiwmpenprpgtpcdiftnsrgkrasnghhhhhh)原核表达系统,具体步骤如下:步骤a、合成5’端和3’端各含有bamhi、xhoi限制性内切酶酶切位点的147对dna序列:5’-ggatcctgcctgtcctattatccgtcctattgctacactatttggatgccggaaaatccgcgtccgggtaccccatgcgacatcttcaccaactcccgtggtaaacgcgcgtctaacggccaccatcaccaccaccattaactcgag-3’;步骤b、psp1-rvg29-6his的147对dna序列及pgex-4t-1质粒均用bamhi、xhoi限制性内切酶37℃进行双酶切4h,并琼脂糖凝胶电泳分离纯化,染色后紫外灯下观察选取需要的目的dna条带进行切割,需要的目的dna条带根据酶切后dna在琼脂糖凝胶上电泳后条带的分子量大小进行选择,采用dna提取试剂盒提取psp1-rvg29-6hisdna及pgex-4t-1线性化质粒。步骤c、质粒去磷酸化:在酶切后的线性质粒溶液中加入ciap(1u/μg质粒),10×ciapbuffer,ddw补齐至20μl,37℃反应30min,经dna纯化后待用;其中,calfintestinalalkalinephosphatase,简称ciap,中文名称为小牛肠碱性磷酸酶,是一种可以催化dna、rna、核糖核苷酸和脱氧核糖核苷酸水解释放5′末端或3′末端磷酸基团的酶。步骤d、将酶切后回收的psp1-rvg29-6his与去磷酸化后的pgex-4t-1质粒按照5:1的比例进行混合后在16℃条件下过夜连接;而后通过化学导入法转入感受态的e.colik12;通过含有氨苄青霉素的lb平板筛选出阳性菌落,并通过dna测序(pgex5':gggctggcaagccacgtttggtgpgex3':ccgggagctgcatgtgtcagagg)验证目标基因是否导入到菌落中。本步骤中的化学导入法和dna测序方法为现有技术中常用到的方法,在此不做具体描述。步骤e、经测序验证后阳性的表达菌株用于进行psp1-rvg29-6his的iptg诱导原核表达,超声破碎收集到的细菌后离心收集上清,而后按照谷胱甘肽琼脂糖树脂(piercetmglutathioneagarose货号:16100)的使用说明书进行融合蛋白的纯化,获得gst/psp1-rvg29-6his。步骤f、纯化后获得的gst/psp1-rvg29-6his用sigma的凝血酶(thrombin,t4648,1ku)进行gst解离,而后通过层析分离获得psp1-rvg29-6his纯蛋白。将本上述方法制备的gst/psp1-rvg29-6his纯蛋白(标记为1)、thrombin酶解后的gst/psp1-rvg29-6his蛋白(标记为2),及层析分离后获得的psp1-rvg29-6his(标记为3),将超声破碎后的菌液上清(标记为4)纯蛋白经sds-page电泳,实验结果如图2所示,由图2可知:gst/psp1-rvg29-6his蛋白在原核细胞中进行了表达,而后通过谷胱甘肽琼脂糖树脂分离,thrombin酶解,层析分离获得了高纯度的psp1-rvg29-6his(标记为3)。将psp1-rvg29-6his蛋白(标记为2)与gst/psp1-rvg29-6his蛋白(标记为1)用his抗体(sigmasab1306084)进行westernblot验证,实验结果如图3所示,由图3可知:纯化得到的两种蛋白均被his抗体标记,且蛋白分子量与理论数据一致证实纯化到的蛋白为目标蛋白。通过sds-page及westernblot实验结果证明,采用上述方式,即构建的原核表达系统,生成并提纯到了psp1-rvg29-6his。上述仅为制得psp1-rvg29-6his的方法之一,本领域技术人员在本发明的构思下,也可通过生物学或化学的其它方法来合成psp1-rvg29-6his以及其它带有psp1和rvg29氨基序列的异构变形物。实施例3:psp1-sp94的制备sp94(sfsiihtpilpl)是由lo等人通过噬菌体展示技术筛选到的结合位点未知但特异性靶向人肝癌细胞的12个氨基酸残基构成的多肽(lo,lin,&wu,2008);分别在体外通过化学方法分别合成了psp1(clsyypsyc)和sp94(sfsiihtpilpl),而后通过化学偶联的方式将其偶联在一起,合成psp1-sp94(clsyypsycsfsiihtpilpl),最后通过hplc纯化获得纯度为95%的psp1-sp94(clsyypsycsfsiihtpilpl)。其中,化学合成方法可以采用生物领域中的任一种合成方法,本发明提供以下合成方法:1)首先序列为sfsiihtpilpl多肽的合成路线如图4所示:具体步骤为:1、将一定量2-cl-trt树脂(1eq)和适量diea(n、n二异丙基乙胺,5eq)加入到适量无水dmf(n、n二甲基甲酰胺)中,然后在零度下将fmoc-leu-oh(5eq)加入到上述反应液中,在室温下搅拌5小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到产物6。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次,干燥后即得到连接了第一个氨基酸的产物7。2、将fmoc-pro-oh(3eq)溶于适量dmf中,并加入hatu(2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐,5eq)和diea(5eq)在零度下混合均匀,并于室温搅拌30分钟。然后把产物7(1eq)溶于适量dmf中并加入到上述溶液中,室温下搅拌2小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到产物8。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次,干燥后即得到连接了第二个氨基酸的产物9。重复步骤2的操作,按照路线中a-j的反应条件,依次合成目标产物,最终可得到侧链被保护的氨基酸序列为sfsiihtpilpl的目标多肽片段10。2)序列clsyypsyc的多肽合成,合成路线如图5所示;具体步骤如下:1、将一定量2-cl-trt树脂(1eq)和适量diea(n、n二异丙基乙胺,5eq)加入到适量无水dmf(n、n二甲基甲酰胺)中,然后在零度下将fmoc-cys(pmebzl)-oh(5eq)加入到上述反应液中,在室温下搅拌5小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到产物11。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次,干燥后即得到连接了第一个氨基酸的产物12。2、将fmoc-tyr(bzl)-oh(3eq)溶于适量dmf中,并加入hatu(2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐,5eq)和diea(5eq)在零度下混合均匀,并于室温搅拌30分钟。然后把产物12(1eq)溶于适量dmf中并加入到上述溶液中,室温下搅拌2小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到产物13。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次,干燥后即得到连接了第二个氨基酸的产物14。重复步骤2的操作,按照路线中a-h的反应条件,依次合成目标产物,最终可得到侧链和n端被保护的氨基酸序列为clsyypsyc的目标多肽片段15。3)psp1与sp94的偶联,合成路线如图6所示;具体步骤如下:把psp1(clsyypsyc)片段15(2eq)溶解于适量的dmf中,并加入diea(5eq)在零度下混合均匀,并于室温搅拌30分钟。然后把产物10(1eq)溶于适量dmf中并加入到上述溶液中,室温下搅拌2小时。最后将反应液抽滤,滤饼分别用dcm(二氯甲烷)、dmf、甲醇洗涤3次,即得到psp1和sp94偶联的中间体。然后把所得产物用含有吡啶20%的dmf在室温下搅拌5小时,以脱掉fmoc保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次。把得到的产物溶于适量甲醇中,并加入钯碳(10%w/w),在氢气中还原脱除苄基类保护基。将反应液抽滤,滤饼分别用、dmf、dcm(二氯甲烷)洗涤3次。最后用含有tfa(三氟乙酸)95的水溶液处理产物,使得产品从树脂上脱落,过滤,将滤液旋干,通过hplc纯化得到最终氨基酸序列为clsyypsycsfsiihtpilpl的多肽分子。上述仅为制得psp1-sp94的方法之一,本领域技术人员在本发明的构思下,也可通过化学或生物学的其它方法来合成psp1-sp94以及其它带有psp1和sp94氨基序列的异构变形物。三、采用psp1靶向肽对外泌体表面进行修饰在外泌体中加入所述psp1靶向肽,4℃条件下进行混合后,采用离心超滤,并用pbs进行冲洗,即得到具有靶向性的外泌体。将本发明制备的靶向肽进行以下外泌体标记验证实验以实施例2进行外泌体标记验证:如上实施例2所述方法,采用合成的双链dna5’-ggatcctacactatttggatgccggaaaatccgcgtccgggtaccccatgcgacatcttcaccaactcccgtggtaaacgcgcgtctaacggccaccatcaccaccaccattaactcgag-3’通过原核表达系统生成不带有psp1氨基酸残基的rvg29-6his(ytiwmpenprpgtpcdiftnsrgkrasnghhhhhh)多肽,作为对照样本。将psp1-rvg29-6his作为样本,同时以rvg29-6his(ytiwmpenprpgtpcdiftnsrgkrasnghhhhhh)作为对照,在1×109particles外泌体中,分别加入100μg的psp1-rvg29-6his和rvg29-6his,4℃条件下,摇床缓慢混合过夜,用100kda离心超滤管(ultra-15),并用10ml的pbs重复3次进行冲洗。洗涤后,将样品浓缩至100ul后,进行sds-page电泳,并以his-tag抗体检测,实验结果如图7所示,其中1为对照rvg29-6his样本,2为psp1-rvg29-6his样本,由westernblot结果证明psp1-rvg29-6his可以特异性地标记到外泌体上。将本发明制备的靶向性外泌体进行细胞转染效率测试实验1、pkh26荧光标记外泌体实验提取到的外泌体按照pkh26(sigma公司)的使用说明书与pkh26室温下于暗室内共同孵育5min,而后用无外泌体的胎牛血清终止反应。4℃条件100000g离心1.5h后用100μlpbs重悬。采用配备488nm激光光源的nanosightns300system(malverninstruments,malvern,uk)对标记后的外泌体进行总颗粒浓度与532nm滤光片下的荧光颗粒浓度检测,以及粒径检测。实验结果如表1所示,被pkh26标记上的外泌体占总数的57.89%。表1总颗粒浓度(×109particles/ml)粒径(nm)总外泌体1.9±0.18105±9pkh26阳性外泌体1.1±0.13108±62、靶向标记外泌体高效转染靶标细胞测试将经过pkh26标记的外泌体,分别用psp1-ge11、psp1-rvg29-6his及psp1-sp94进行标记和纯化;同时以化学合成的ge11、rvg29-6his、及sp94作为对照样品进行相同的标记和纯化;将得到的样品分别与非小细胞肺癌细胞株a549、神经胶质瘤细胞株ln-18,以及人肝癌细胞株mahlavu进行孵育,流式检测pe通道下,阳性细胞比例作为最终结果进行统计分析,具体实验过程如下:a、分别将psp1-ge11、psp1-rvg29-6his、psp1-sp94、ge11、rvg29-6his、sp94及作为空白对照的pbs对pkh26染色的外泌体进行多肽标记和纯化。b、细胞株a549(对应psp1-ge11、ge11)、细胞株ln-18(对应ppsp1-rvg29-6his、rvg29-6his)、细胞株mahlavu(对应psp1-sp94、sp94)均用10%fbs+dmem培养基培养,以1×106cells/孔的量接种到6孔板中,其中每孔培养基量为2ml,培养4小时。c、每孔加入等量的1×108particles的经过多肽标记或未经过标记的pkh26染色外泌体(每个样品重复5孔平行试验),用pbs补齐至加入液体总量为200ul,再次培养4小时;再设一个对照组添加1×108particlespkh26染色外泌体及10ugge11、rvg29-6his、sp94多肽。d、吸出培养基,用预冷的pbs反复冲洗3次后,胰酶消化细胞脱壁后用培养基终止消化,而后pbs离心洗涤3次,流式检测pe通道阳性的细胞占总细胞数百分比,后进行实验数据统计分析。测试结果如图8、9、10所示,由图可知,通过本发明提供的靶向性外泌体明显增强对相应细胞的靶向能力。本发明所述的靶向肽不仅包括egfr靶向肽、nachr靶向肽和肝癌细胞靶向肽sp94,还包括其它靶向肽或具有促进免疫功能的短肽,在本发明构思下,通过psp1提高外泌体表面修饰效率的技术方案均属于本发明的保护范围。本发明还提供经本发明制备的靶向性外泌体的制备方法所制备的靶向性外泌体在制备药物上的应用,能够有效增强抗药物的抗肿瘤效果,对治疗肿瘤疾病有着积极的作用,具有重要的应用价值和巨大的社会效益。本发明专利中涉及的参考文件如下:lo,a.,lin,c.t.,&wu,h.c.(2008).hepatocellularcarcinomacell-specificpeptideligandfortargeteddrugdelivery.molcancerther,7(3),579-589.doi:10.1158/1535-7163.mct-07-2359nakai,w.,yoshida,t.,diez,d.,miyatake,y.,nishibu,t.,imawaka,n.,...hanayama,r.(2016).anovelaffinity-basedmethodfortheisolationofhighlypurifiedextracellularvesicles.scirep,6,33935.doi:10.1038/srep33935thapa,n.,kim,s.,so,i.s.,lee,b.h.,kwon,i.c.,choi,k.,&kim,i.s.(2008).discoveryofaphosphatidylserine-recognizingpeptideanditsutilityinmolecularimagingoftumourapoptosis.jcellmolmed,12(5a),1649-1660.doi:10.1111/j.1582-4934.2008.00305.xusman,w.m.,pham,t.c.,kwok,y.y.,vu,l.t.,ma,v.,peng,b.,...le,m.t.n.(2018).efficientrnadrugdeliveryusingredbloodcellextracellularvesicles.natcommun,9(1),2359.doi:10.1038/s41467-018-04791-8最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;实施例中涉及到试剂浓度以及其它参数为在本发明构思下的一种可行方式,并不限制于本实施例中所限定的相关实验参数;在本发明构思下,能够解决相关技术问题,达到本发明技术效果的相关实验参数均在本发明保护的范围内;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1