miR-101b-3p在诊断和辅助治疗广州管圆线虫中的应用的制作方法
本发明涉及广州管圆线虫的诊断和治疗技术领域,更具体地,涉及mir-101b-3p在诊断和辅助治疗广州管圆线虫病中的应用。
背景技术:
广州管圆线虫(angiostrongyluscantonensis)是我国重要的食源性人兽共患寄生虫之一,于1934年由中山大学的陈心陶教授首次在广州近郊捕获的褐家鼠肺动脉中发现并命名该病原体。大鼠是其适宜宿主,人和小鼠是其非适宜宿主。广州管圆线虫病是人因进食了含广州管圆线虫幼虫的生或半生螺肉或被软体动物分泌物污染的食物而感染。幼虫常侵及人中枢神经系统(cns)进而导致嗜酸性粒细胞增多性(≥10%)脑膜脑炎或脑膜炎。主要高发于东南亚、加勒比海、太平洋岛屿等热带地区,散发于美国、欧洲、巴西等地区,在我国呈现散在分布。在我国浙江、云南、福建、北京等地均报道过广州管圆线虫病群体暴发流行病例。此外,还有更多的病例被医疗工作者及社会忽视。因此,广州管圆线虫病的早期诊断已成为有效防治这一新发传染病的关键。
临床常规采用脑脊液病原体镜检、特异性抗原或抗体检测等方法用于广州管圆线虫病的检测。但脑脊液中寄生虫数量较低,血清学存在交叉反应,急性发病期抗体检测缺乏敏感性等问题制约着广州管圆线虫病的快速检出。
mirna是一种生物体内的小片段非编码rna,广泛的参与了基因表达的转录后水平调控,及各种生理及病理过程。现阶段并没有mirna诊断和治疗广州管圆线虫感染的相关研究报导。
技术实现要素:
本发明针对广州管圆线虫在终宿主中的寄生适应性特征,比较分析了适宜宿主大鼠和非适宜宿主小鼠中差异表达的microrna,通过干预mir-101b-3p的量,来调节虫体sod基因表达,实现对虫体的干预,达到辅助治疗广州管圆线虫感染的目的。
本发明的第一个目的是为了克服现有技术的不足,提供mir-101b-3p或其模拟物或其激活剂在作为广州管圆线虫病基因治疗或药物筛选的标志物或靶基因方面的应用。
本发明的第二个目的是为了克服现有技术的不足,提供mir-101b-3p或其模拟物或其激活剂在设计、制备或筛选可缓解或/和治疗广州管圆线虫感染的药物和/或生物学制剂方面的应用。
本发明的第三个目的是为了克服现有技术的不足,提供mir-101b-3p或其模拟物或其激活剂在制备缓解或/和治疗广州管圆线虫感染的药物和/或生物学制剂方面的应用。
本发明的第四个目的是为了克服现有技术的不足,提供mir-101b-3p在作为广州管圆线虫感染的诊断标志物的应用。
本发明的第五个目的是为了克服现有技术的不足,提供一种缓解或/和治疗广州管圆线虫感染的药物。
本发明的第六个目的是为了克服现有技术的不足,提供mir-101b-3p在靶向抑制acsod3基因中应用。
本发明的第七个目的是为了克服现有技术的不足,提供mir-101b-3p在作为或制备acsod3基因的激活剂中应用。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
大鼠是广州管圆线虫的适宜宿主,小鼠是广州管圆线虫的非适宜宿主,本发明发现mir-101b-3p在感染小鼠血清中的表达水平比感染大鼠高,感染小鼠和大鼠血清的mir-101b-3p表达符合acsod3的表达谱,表明mir-101b-3p靶向acsod3调节基因表达。由于,广州管圆线虫acsod3是调节虫体对抗宿主来源活性氧的关键酶,所以调控mir-101b-3p可以影响广州管圆线虫对宿主的感染情况。
所以,本发明要求保护,mir-101b-3p或其模拟物或其激活剂在作为广州管圆线虫病基因治疗或药物筛选的标志物或靶基因方面的应用。
所述模拟物(mimic)是运用化学方法合成的mirna,能模拟细胞中内源性成熟mirna的高水平表达。
所述激活剂是使得mirna的表达量提高的物质。
mir-101b-3p或其模拟物或其激活剂在设计、制备或筛选可缓解或/和治疗广州管圆线虫感染的药物和/或生物学制剂方面的应用。
mir-101b-3p或其模拟物或其激活剂在制备缓解或/和治疗广州管圆线虫感染的药物和/或生物学制剂方面的应用。
mir-101b-3p在作为广州管圆线虫感染的诊断标志物的应用。
优选地,所述mir-101b-3p为mmu-mir-101b-3p,其核苷酸序列如seq.id.no.3所示。
优选地,所述mir-101b-3p为rno-mir-101b-3p,其核苷酸序列如seq.id.no.4所示。
优选地,所述mir-101b-3p模拟物为化学合成经过特殊化学修饰的成熟mirna模拟物,其序列与mir-101b-3p相同。
一种缓解或/和辅助治疗广州管圆线虫感染的药物含有mir-101b-3p或其模拟物或其激活剂。
优选地,所述药物能够抑制宿主体内广州管圆线虫acsod3的基因表达,进而增加宿主对线虫的氧化损伤,从而缓解或/和治疗广州管圆线虫病。
mir-101b-3p在靶向抑制acsod3基因中应用,acsod3基因的核苷酸序列如seq.id.no.1所示,所编码的acsod3蛋白的氨基酸序列如seq.id.no.2所示。
mir-101b-3p在作为或制备acsod3基因的抑制剂中应用。
与现有技术相比,本发明具有如下有益效果:
本发明首次发现mir-101b-3p参与调节大鼠和小鼠中acsod3基因和蛋白的差异表达,从而调节虫体对抗宿主来源的活性氧,调节虫体在适宜和非适宜宿主体内的不同抗氧化能力,从而调节其在适宜和非适宜宿主体内的寄生适应性。因此,mir-101b-3p的表达水平将是证明诊断非适宜宿主感染广州管圆线虫的重要诊断指标和治疗靶标。揭示了广州管圆线虫在终宿主中存活的关键机制,从而为完善优化现有防控广州管圆线虫病的策略提供新思路。
附图说明
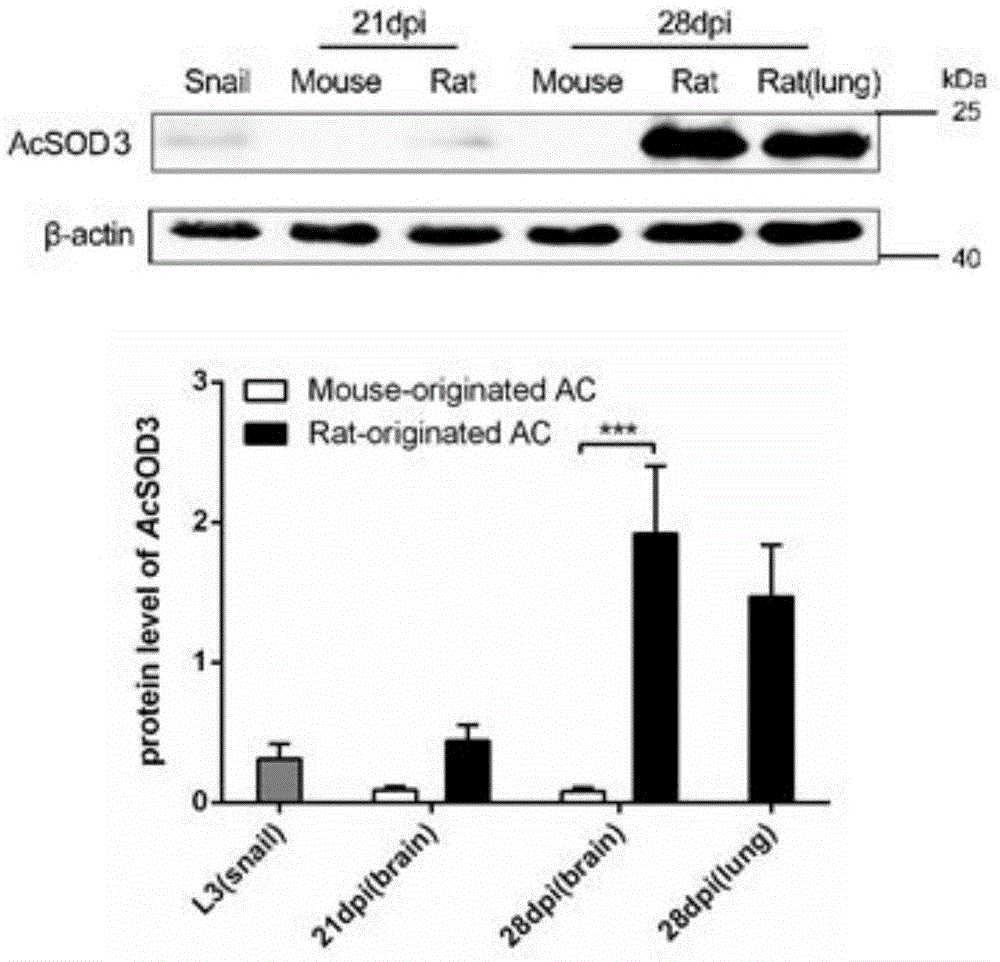
图1为westernblot检测acsod3在不同宿主来源幼虫中的蛋白表达谱;所有数据均用均数±标准差表示。采用非参数检验进行统计学分析(***,p<0.0005)。
图2为广州管圆线虫acsod3对虫体具有抗氧化保护作用;(a)acsod3蛋白处理后幼虫的活动力;(b)acsod3蛋白处理后幼虫的残留ros的检测;(c)acsod3蛋白处理后的幼虫体型变化的sem观察,ss:侧传感器,mp:口器,mt:乳突,ms:口传感器,cg:横纹,lg:纵纹;标尺均为20μm;(d)acsod3蛋白处理后的幼虫tem观察,sl:表面层,ml:中间层,fl:纤维层,bl:基底层,m:肌肉细胞,cj:肌肉细胞连接,n:核仁,nm:核膜,标尺均为1μm。
图3为mir-101b-3p通过与基因结合抑制acsod3的表达;(a)mir-101b-3p与acsod3的cds结合的核酸序列;(b)含有野生型或突变型的acsod3cds序列的荧光素酶报告质粒与mir-101b-3p或无关mirna模拟物共转hek293t细胞;*,p<0.05,**,p<0.005,nc:阴性对照,b,空白对照。
图4为qpcr检测广州管圆线虫在mir-101b-3p的模拟物和抑制剂处理下的acsod3mrna表达情况,nc:non-specificcontrol非特异对照。
图5为westernblot检测acsod3的蛋白表达情况;所有数据均为三次独立实验所得,用均数±标准差表示。采用非参数检验进行统计学分析;*,p<0.05;**,p<0.005;***,p<0.0005,nc:non-specificcontrol非特异对照;pc:positivecontrol阳性对照。
图6为广州管圆线虫感染的小鼠和大鼠0/21/28天后血清中mir-101b-3p的表达水平;所有数据均为三次独立实验所得,用均数±标准差表示,采用非参数检验进行统计学分析(▽&▼&▲&*:p<0.05,△△&**:p<0.005,△△△&***:p<0.0005,△△△△&****:p<0.0001;△小鼠血清组与对照组比较,▲大鼠血清组与对照组的比较,▽与小鼠血清21天感染组比较,▼与大鼠血清21天感染组比较)。
图7为广州管圆线虫在21和28天大小鼠血清处理下的acsod3mrna表达情况;所有数据均为三次独立实验所得,用均数±标准差表示,采用非参数检验进行统计学分析(*:p<0.05,**:p<0.005)。
图8为westernblot检测acsod3的蛋白表达情况;所有数据均为三次独立实验所得,用均数±标准差表示,采用非参数检验进行统计学分析(*:p<0.05,**:p<0.005)。
图9为mir-101b-3p处理感染28天大鼠、小鼠来源的虫体;(a)mir-101b-3p模拟物或抑制物处理后的幼虫的活动力;(b)mir-101b-3p模拟物或抑制物处理后的幼虫的残留ros的检测;(c)mir-101b-3p模拟物或抑制物处理后的幼虫体型变化的sem观察,ss:侧传感器,mp:口器,mt:乳突,ms:口传感器,cg:横纹,lg:纵纹。标尺均为20μm;(d)mir-101b-3p模拟物或抑制物处理后的幼虫tem观察,sl:表面层,ml:中间层,fl:纤维层,bl:基底层,m:肌肉细胞,cj:肌肉细胞连接,n:核仁,nm:核膜,标尺均为1μm。
图10aav介导的mir-101b-3ptud处理对虫体表皮的影响;(a)感染21天后大鼠来源幼虫;(b)感染21天后小鼠来源幼虫;(c)aav-shrna病毒处理感染21天后小鼠来源幼虫;(d)aav-mir101b-3ptud病毒处理感染21天后小鼠来源幼虫。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1广州管圆线虫体acsod3的获得
一、实验材料
广州管圆线虫l3期幼虫取自感染了l1期幼虫21天的光滑双脐螺。感染后21、28天从大、小鼠脑组织内取出虫体,感染后28天同时可以在大鼠肺部取出成虫。
实验中所用试剂盒:premixtaqtm(takarataqtmversion2.0),tirzol(invitrogen),revertaidfirststrandcdnasynthesiskit(thermoscientific)。
设计并合成特异性real-timepcr引物,β-actin做为内参对照,具体序列如下表:
二、实验方法
广州管圆线虫总rna提取的具体操作步骤为:
样品在4℃磁珠破碎,样品加200μltrizol后破碎,加入800μltrizol后加入氯仿,震荡摇匀后12000rpm离心10分钟,吸取上层清液加入等量异丙醇摇匀后12,000rpm离心,弃去上清,加入乙醇洗涤二次,弃去乙醇稍晾干后加入20μl无酶水溶解。
逆转录的具体操作步骤为:
取定量rna溶液加入1μloligodt,加水至12μl后65℃反应5min,加入revertaidtm逆转录酶1μl,ribolocktm核糖核酸酶抑制剂1μl,5x反应缓冲液4μl,10mmdntp混合物2μl后42℃反应1hr然后72℃反应5min终止反应。
pcr的具体操作步骤为:
加入premixtaq10μl,cdna模板2μl,acsod3上下游引物各1μl,双蒸水7μl,其反应程序为95℃预变性5min,95℃变性30sec,60℃退火30sec,72℃延伸1min并进行35个循环后,72℃延伸5min。
三、实验结果
获得acsod3基因全长为3,278bp核苷酸序列如seq.id.no.1所示,编码185个氨基酸残基氨基酸序列如seq.id.no.2所示,n端含有疏水性信号肽的acsod3基因,表达蛋白为19kda。
实施例2不同宿主来源广州管圆线虫体acsod3的表达特征
一、实验材料
广州管圆线虫l3期幼虫取自感染了l1期幼虫21天的光滑双脐螺。感染后21、28天从大、小鼠脑组织内取出虫体,感染后28天同时可以在大鼠肺部取出成虫。
小鼠抗鼠β-actin单克隆抗体,羊抗小鼠荧光二抗,羊抗大鼠荧光二抗(abcam公司),ecl化学发光显色法检测标记辣根过氧化物酶(hrp)的抗体及其关联的抗原(millipore)。
二、实验方法
western印迹检测acsod3表达量的具体操作步骤为:
(1)样品在4℃磁珠破碎,样品量与ripa细胞裂解液加同等量后破碎,离心12000rpm,20分钟后收集上清。将电泳完毕的凝胶、半干转滤纸、硝酸纤维素膜(nc膜)浸润于转膜缓冲液中。平衡5分钟后,按照
(2)转膜结束后,取出nc膜浸润于tbs中5分钟,之后放入封闭液(含有5%脱脂奶粉的tbst,亦用作westernblot实验过程的抗体孵育液)室温封闭1小时。根据预染蛋白marker的条带位置,将含有β-actin和acsod3蛋白的nc膜剪下,并分别孵育相应的一抗,4℃轻摇过夜。随后tbst洗膜3次,每次5分钟。再将含有目的条带的nc膜孵育hrp标记的相应二抗,室温轻摇1小时。使用tbst清洗nc膜3次,每次5分钟。
(3)按照荧光、化学发光成像分析系统的操作方法,观察分析蛋白印迹。
三、实验结果
通过western印迹检测来自感染21天和28天小鼠和大鼠的幼虫的基因和蛋白质表达(图1)。从感染28天的大鼠脑和肺组织中分离的幼虫的acsod3表达水平明显高于从感染小鼠中分离的幼虫的基因和蛋白表达。说明虫体acsod3可能是虫体抗宿主氧化的重要sod,与其宿主适应性密切相关。
实施例3重组表达acsod3蛋白的抗氧化保护效应
一、实验材料
过氧化氢、acsod3重组表达蛋白处理虫体,培养板,dmem和青霉素(100iu/ml),两性霉素b(0.25μg/ml)和链霉素(100μg/ml),5%二氧化碳培养箱。
二、实验方法
体外条件下,检测重组表达的acsod3蛋白对过氧化氢处理幼虫的抗氧化保护效应。具体操作步骤为:
1、经过凝胶电泳纯化回收的pcr产物及质粒载体pgex-4t-1用限制性内切酶smai和xhoi酶切,反应体系如下:4管
37℃,酶切反应时间30min。pcr产物、质粒产物各一版,通过1%琼脂糖凝胶电泳检测,并用takara柱式pcr产物纯化试剂盒纯化。nanodrop测浓度
酶切后的片段利用t4dna连接酶连接,反应体系如下:(pcr扩增产物:酶切质粒=3-10:1)
置于22℃1hr。连接酶易降解,注意低温。
重组sod蛋白racsod3在大肠杆菌中的大量表达,取鉴定保存的pgex-4t-1-acsod3工程菌液,转接到5ml含amp+的lb液体培养基中,37℃,250rpm振摇培养12h-16h后转移到200mllb中,37℃,250rpm振摇培养过夜。次日转接至2000mllb液体培养基中,37℃,250rpm振摇培养约2小时,使得菌液的od值达到0.6-0.8,加入iptg至终浓度1mmol/l,在37℃,250rpm摇床上继续培养4h上继续后收菌。细菌收集与破碎,将上述摇好的菌液在4℃,8000rpm下离心10分钟;弃去上清,沉淀用40ml预冷的pbs重悬;加入4ml溶菌酶(1:1000),充分混匀,4℃作用20用分混匀分钟后,置于-80℃冰箱,从-80℃冰箱冷冻后用室温自来水解冻,反复三次;冰上超声破碎,仪器程序为75%功率,超声30分钟,超声1秒,停2秒。完成以上破碎后,4℃,12000rpm离心30分钟,收集上清及沉淀。将上清用0.45um滤膜过滤;在过滤好的上清中加入0.5%的dtt,然后加入到gst填料柱中;加入约40mlpbs(含千分之一的dtt)于gst填料柱中;加入thrombin酶(1mlpbs含thrombin酶50u)酶切目的蛋白;待酶完全渗透至填料中后加1mlpbs,22℃作用16-22小时;次日加入1mlpbs于柱内,用ep管收集已纯化的蛋白;同时经过sds-page鉴定该蛋白。将沉淀用15ml基础液(50mmtrishcl,100mmnacl,ph8.0)悬浮,吹吸5分钟,12000rpm,10分钟,4℃弃上清;沉淀用a液(1%tritonx-100的基础液)重悬12000rpm,4℃,10分钟,洗3次;沉淀用2m尿素的基础液重悬,10ml,静置30分钟,4℃,10分钟,洗3次,分别收集上清;沉淀用4m尿素的基础液重悬,10分钟,静置30分钟,4℃,10分钟,洗3次,分别收集上清;沉淀用6m尿素的基础液重悬,10ml,静置30分钟,4℃,10分钟,洗3次,分别收集上清;沉淀用8m尿素的基础液重悬,10ml,静置30分钟,4℃,10分钟,洗3次,分别收集上清;最后的沉淀用跑胶浓度不错的浓度尿素重悬过夜,得到澄清的液体,12000rpm离心30分钟,保留上清。
2、在超净台中将从感染28天大鼠脑组织中取出的虫体,置于24孔板中,dmem培养液中加入青霉素(100iu/ml),两性霉素b(0.25μg/ml)和链霉素(100μg/ml)。10条一组,共3组,在28℃培养箱分别孵育6小时:(a)无处理组为对照组、(b)0.2mm过氧化氢处理组和(c)0.2mm过氧化氢+acsod3纯化蛋白处理组。
3、虫体表皮的扫描电子显微镜观察
挑出虫体后用预冷pbs(ph=7.4)反复吹洗后,用2.5%的戊二醛固定液对虫体进行24小时前固定。完成后,ep管底可以观察到样品,将样品转移入干净的1.5mlep管中,加入1mlpbs缓冲液轻柔洗去虫体表面的固定液。吸走缓冲液后对虫体进行乙醇梯度脱水,即按顺序加入并吸走浓度为50%、75%、80%、90%、100%配制的乙醇,每个操作时间间隔为7~10分钟。梯度脱水后,加入丙酮置换残留的无水乙醇,室温放置30分钟,完成后加入100%醋酸异二酯置换丙酮,室温放置30分钟后。离心使虫体汇集在ep管底,弃去醋酸异二酯,将虫体放置于滤纸上,待滤纸干燥后折叠使虫体包裹在内部后,放置于二氧化碳真空零界点干燥器脱去虫体中的酯类。零界点干燥完成后用毛笔尖将虫体小心转移至观察台上,随后放入白金喷镀机中喷镀,即可进行扫描电子显微镜观察,拍摄样品的表面结构。
4、虫体体内的透射电子显微镜观察
挑出虫体后用预冷pbs(ph=7.4)反复吹洗后,用2.5%的戊二醛固定液对虫体进行24小时前固定。pbs(ph=7.4)缓冲液对虫体进行3次冲洗后,加入2%饿酸在4℃避光环境下固定1小时。用pbs(ph=7.4)缓冲液充分冲洗虫体的饿酸。按顺序加入并吸走浓度为30%、50%、70%、80%、90%、95%、100%的丙酮进行脱水,30%~95%丙酮每个浓度梯度静止5分钟,100%丙酮静止3次,每次10分钟。混合4种包埋剂epon812、ddsa、nma、dmp-30(6.8:2.5:3.9:0.25),每小时往样本溶液加入1~2滴包埋剂混合物,一共滴4次。放置在恒温37℃的烘箱内进行12小时的聚合,然后调节至45℃再聚合12小时,最后调节至60℃聚合24小时,操作结束后关闭电源,待温度降至室温后将包埋板取出,转至干燥皿中,利用超薄切片机对样本进行切片,切片置于滤纸晾干。铀铅染色后,样品可直接在feitecnaig透射电子显微镜下进行观察和拍照。
三、实验结果
重组表达的acsod3蛋白在体外条件下,对过氧化氢处理幼虫的抗氧化保护效应(图2),重组acsod3对虫体的头部、表皮、肌肉组织及细胞的完整性均有保护作用(图2),提示广州管圆线虫的acsod3在虫体受到过氧化物损害时对虫体具有抗氧化保护作用。因此,广州管圆线虫acsod3是调节虫体对抗宿主来源活性氧的关键酶,是一个重要的靶标。
实施例4靶向acsod3的宿主来源mir-101b-3p调节acsod3的表达
一、实验材料
实验动物和虫株同实施例1。mir-101-b-3p模拟物(锐博生物,货号mir10000616)、抑制物(锐博生物,货号mir20000616)及对照(锐博生物);293t细胞株来源于atcc,细胞培养条件为dmem+10%fbs,37℃,5%co2。双荧光素酶报告基因检测试剂盒(promega),其他试剂同前。
二、实验方法
1、mmu-mir-101b-3p(其核苷酸序列如seq.id.no.3所示)刺激对虫体acsod3表达的影响
取感染后28天大小鼠脑内虫体,10条一组置于24孔板中,大鼠虫体分别加入40%感染28天大鼠血清和pbs缓冲液(pc)、阴性对照(nc)(锐博生物,货号mir01204)、mmu-mir-101b-3p(seq.id.no.3)的模拟物(锐博生物,货号mir10000616);小鼠虫体分别加入40%感染28天小鼠血清和pbs(pc)、阴性对照(锐博生物,货号mir02204)、mir-101b-3p的抑制物(锐博生物,货号mir20000616),28℃,5%co2孵育48小时,虫体用pbs洗三次后收集。
虫体活性观察,以连续观察2分钟,在此期间计算虫体的折叠式扭动次数。
2、real-timepcr检验acsod3表达
利用收集的虫体进行acsod3表达,设计并合成特异性real-timepcr引物,β-actin做为内参对照,具体序列如下表:
具体操作步骤为:
(1)幼虫虫体总rna提取
取约100μg广州管圆线虫放入去rna酶的1.5毫升ep管中,加入trizol用于提取虫体总rna。
样品rna逆转录合成cdna
按逆转录试剂盒操作说明书进行,反应体系为20μl:
将0.5mlep管放在冰上,加入:
混匀试剂,将ep管置于65℃水浴5分钟后,立刻置于冰上冷却,置于冰上再加入以下组分:
混匀离心。42℃水浴60分钟。70℃灭活5分钟,终止反应,-80℃冻存。
(2)real-timepcr反应体系如下:
反应条件为:预变性95℃,时间为10分钟;变性95℃,时间为15秒,退火温度为60℃,时间为30秒,延伸温度72℃,时间为15秒,循环数为40;每个样品均设置三个复孔,每次循环结束后进行融解曲线分析,检测温度为70℃~95℃,升温速率为0.4/℃次,恒温时间为1秒/次。
(3)使用lightcyler480进行数据分析,相对表达量分析使用2-δδct法,内参基因设置为β-actin。使用prism6.0统计学软件统计所得结果,进行ttest检验,当p<0.05时认为有统计学意义。
3、westernblot检验acsod3表达
利用收集的虫体进行acsod3表达,操作同实施例1。
4、荧光素酶报告实验
根据预测的mir-101b-3p与acsod3cds结合位点,合成野生型和突变型acsod3cds(cagtgctgt>gtcacgaca),连接到荧光素酶报告载体(genecopoeia)。
将正常293t细胞接种于48孔板(细胞量:2万/孔),将细胞铺板后24小时,使用lipofectamine2000转染试剂进行转染。将mir-101b-3p的模拟物mimic或抑制物inhibiter与质粒共转染细胞,实验对转染质粒分别为luc-acsod3-cds、luc-acsod3-cds-mut的两组细胞进行检测,每组又分为空白组、无关对照模拟物组、mirna模拟物组,每组设3个复孔。转染48小时后收集细胞裂解液进行luciferase活性检测,将dual-luciferasereporterassaysystem中5×裂解液用pbs稀释至1×后,每孔加入100μl,水平摇床振摇20分钟,混匀。每组各取30μl细胞裂解液加入酶标板中,加入20μlfirefly,快速混匀,读值2秒,继续加入20μlrenilla,快速混匀,读值2秒。保存数据,检测数据分析,萤火虫萤光素酶活性值为f,海肾萤光素酶活性值为r,结果以△活性倍数=(r/f)样品/(r/f)对照表示。
三、实验结果
荧光素酶报告系统实验的结果显示:mmu-mir-101b-3p(其核苷酸序列如seq.id.no.3所示)可以靶向结合acsod3基因序列(图3);相似的,rno-mir-101b-3p(其核苷酸序列如seq.id.no.4所示)已有相同的靶向结合acsod3基因序列的结果。根据acsod3表达谱的差异分析,筛选到宿主来源的mir-101b-3p分子具有调节acsod3表达的特性(图3)。
在体外实验条件下,将mir-101b-3p的模拟物和抑制物处理幼虫,qpcr和westernblot结果显示mir-101b-3p模拟物使大鼠来源广州管圆线虫的acsod3基因和蛋白表达水平显著下降,而mir-101b-3p抑制物使小鼠来源广州管圆线虫的acsod3表达水平显著升高(图4和图5)。
实施例5小鼠血清对大鼠来源虫体基因表达的影响
一、实验材料
实验动物和虫株的制备同上。mirneasyminikit(qiagen,venlo,netherlands)试剂盒用于提取虫体和大小鼠血清中的总rna,mir-xtmmirnafirst-strandsynthesiskit(clontechlaboratories,ca,usa)用于反转录rna成cdna。其它qpcr检测试剂同上。
二、实验操作
1、qpcr检测大小鼠血清中候选mirna分子的表达量。
(1)样品处理及rna提取
取广州管圆线虫感染的0/21/28天后大、小鼠各200μl血清于去rna酶的1.5mlep管中,加入1mltrizol后,幼虫虫体总rna提取步骤同上。检测样品rna提取纯度和浓度。
(2)mirna逆转录
在0.2mlpcr管中配制以下反应溶液
将反应管置于pcr仪中,37℃放置60分钟,反应结束后95℃,5分钟使反转录酶失活,然后放置冰上。
(3)real-timepcr
设计并合成特异性real-timepcr引物,β-actin做内对照,具体序列如下表:
real-timepcr反应程序同上。
2、在体外实验条件下,检测大小鼠血清对不同来源广州管圆线虫幼虫acsod3基因水平的影响。
(1)虫体培养方法同上。大鼠来源的虫体处理分为四组:(a)无处理组为对照组、(b)0.2mm过氧化氢处理组、(c)0.2mm过氧化氢+感染21天大鼠血清组和(d)0.2mm过氧化氢+感染28天大鼠血清组。小鼠来源虫体处理分为两组:(a)0.2mm过氧化氢处理感染28天小鼠血清组和(b)0.2mm过氧化氢处理感染28天小鼠血清组。
(2)大小鼠血清处理对不同来源广州管圆线虫幼虫acsod3基因水平分析虫体acsod3基因水平的qpcr检测步骤同上。
3、在体外实验条件下,检测大小鼠血清对不同来源广州管圆线虫幼虫acsod3蛋白水平的影响。
(1)虫体处理方法同实施例3。
(2)western-blotting检测虫体acsod3蛋白表达水平同实施例1。
三、实验结果
采用qpcr对感染后大小鼠血清中mir-101b-3p表达量进行检测。mmu-mir-101b-3p在大鼠血清中的表达水平比小鼠低。感染小鼠和大鼠血清的mir-101b-3p表达符合acsod3的表达谱。表明mir-101b-3p靶向acsod3调节基因表达(图6)。
在体外实验条件下,分别采用感染广州管圆线虫的大小鼠血清处理大小鼠来源的幼虫,观察到感染28天的小鼠血清处理大鼠来源虫体,可使虫体acsod3基因和蛋白表达水平显著下降,而感染28天的大鼠血清处理小鼠来源虫体,可使acsod3基因和蛋白表达水平显著升高。结果显示,感染广州管圆线虫的宿主血清中存在调控acsod3基因和蛋白表达水平的调控因子(图7和图8)。
实施例6mir-101b-3p调节过氧化氢对广州管圆线虫的氧化损伤
一、实验材料
实验动物和虫株同实施例1。实验mirna模拟物、抑制物及对照(mir-101b-3p)(锐博合成)。
二、实验方法
1、虫体培养方法同实施例1。
在28℃培养箱分为四组孵育6小时。
大鼠来源的虫体处理分为四组:无处理组为对照组、0.2mm过氧化氢处理组、0.2mm过氧化氢+感染28天大鼠血清处理组、0.2mm过氧化氢+感染28天大鼠血清+mir-101b-3p模拟物组。小鼠来源虫体处理分为两组,0.2mm过氧化氢+感染28天小鼠血清、0.2mm过氧化氢+感染28天小鼠血清+mir-101b-3p抑制物组。
2、虫体活性观察
以连续观察2分钟,在此期间计算虫体的折叠式扭动次数。
3、虫体表皮的扫描和透射电子显微镜观察方法同实施例2。
三、实验结果
利用扫描电镜和透射电镜观察体外条件下,过氧化氢处理虫体,检测mirna对acsod3表达的调控及对虫体抗氧化能力的影响,将来自感染21天大鼠或小鼠的幼虫分别在感染的大鼠或小鼠血清、过氧化氢、mir-101b-3p模拟物或抑制剂中孵育。除了表面上小规模的水泡和病变之外,用感染28天大鼠血清处理的大鼠来源的幼虫显示与无过氧化氢处理组相比没有显着变化。然而,加入mir-101b-3p模拟物诱导大鼠来源的幼虫在有大鼠血清存在的情况下发生口部扩张,表皮出现严重变形,大量水泡和不明确的中间层,纤维层,基底层,肌肉细胞,肌肉细胞连接和模糊的核膜,与用感染28天小鼠血清和过氧化氢处理的幼虫组及过氧化氢处理组情况相似(图9)。值得注意的是,mir-101b-3p抑制剂处理组显示幼虫清晰的皮层和皮下结构,表明抑制小鼠血清中的mir-101b-3p可以减轻过氧化氢损害幼虫的情况。
结合上述结果,mir-101b-3p会增强过氧化氢对虫体头部、表皮、肌肉组织、细胞的损害。此外,mir-101b-3p在大鼠血清中的表达水平比小鼠低。该结果进一步证实了大小鼠体内的mir-101b-3p可以抑制小鼠幼虫acsod3的基因表达,最终通过啮齿动物产生的ros增加宿主对幼虫的氧化损伤。
实施例7aav介导的mir-101b-3ptud对广州管圆线虫的影响
一、实验材料
实验动物和虫株同实施例1。1ml胰岛素注射器、小鼠固定器、移液枪、无酶枪头、75%酒精棉球、p2实验服一套、高压无菌pbs,独立装手套、口罩、无酶ep管。
二、实验方法
1、构建mir-101b-3ptud封闭序列的腺相关病毒载体(aav)尾静脉注射一周后,再感染广州管圆线虫iii期幼虫。病毒液体离心,用pbs将病毒液体稀释至目的病毒滴度为1.5×1011/200μl。将小鼠固定在小鼠固定器上,通过尾静脉注射到小鼠体内。感染21天后,收集小鼠大脑,取虫计数后准备做电镜。
2、虫体表皮的扫描和透射电子显微镜观察方法同实施例2。
3、虫体表皮的扫描电子显微镜观察同实施例2。
4、虫体acsod3基因表达检测同实施例3。
三、实验结果
利用扫描电镜观察慢病毒介导的mir-101b-3ptud处理对虫体的影响。阻断mir-101b-3p的功能,可以提高acsod3蛋白的表达8.09±0.69倍。虫体的表皮损伤严重减缓,状态与适宜宿主大鼠来源的幼虫相近,有效改善虫体的损伤(图10)。
结合上述结果,证实了小鼠体内的mir-101b-3p可以抑制小鼠幼虫acsod3的基因表达,最终增强了小鼠脑内ros对幼虫的氧化损伤。
序列表
<110>中山大学
<120>mir-101b-3p在诊断和辅助治疗广州管圆线虫中的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>558
<212>dna
<213>广州管圆线虫(angiostrongyluscantonensis)
<400>1
atgatgttgctacgtgctctgctcatctccactattttcgcagctgttcacgtgtctatc60
gctcagtgctgtatcggaggacgacctgtgttgagggctcgtgcgaatatgcgtagagcc120
gttgcaaatgccggtccagctgagacgattggttccgttgattttgaacagaatggaaat180
gtcgttacgattaacggcagcgtatctggattgactccaggtcttcatggaattcatatc240
catgagataggtgatctaggtaatggttgtctaaacgctcgtggtcattacaatccgacc300
aataaccctcatggagcaccgtctgataggattcggcatgtcggcgatcttggaaacctc360
atcacaccggatagcggcaatacgccgatttccatcagggatactgtggtgagactcgac420
ggtgtgcatagcgtgattggacgagctctcgtcattcatgccgctggcgacgatctcaac480
cgtggcctctcaccacagagtagcctgaccggcaacgcagggggtcgggtatcctgcgga540
atcatcgagatcgtctaa558
<210>2
<211>185
<212>prt
<213>广州管圆线虫(angiostrongyluscantonensis)
<400>2
metmetleuleuargalaleuleuileserthrilephealaalaval
151015
hisvalserilealaglncyscysileglyglyargprovalleuarg
202530
alaargalaasnmetargargalavalalaasnalaglyproalaglu
354045
thrileglyservalaspphegluglnasnglyasnvalvalthrile
505560
asnglyservalserglyleuthrproglyleuhisglyilehisile
65707580
hisgluileglyaspleuglyasnglycysleuasnalaargglyhis
859095
tyrasnprothrasnasnprohisglyalaproseraspargilearg
100105110
hisvalglyaspleuglyasnleuilethrproaspserglyasnthr
115120125
proileserileargaspthrvalvalargleuaspglyvalhisser
130135140
valileglyargalaleuvalilehisalaalaglyaspaspleuasn
145150155160
argglyleuserproglnserserleuthrglyasnalaglyglyarg
165170175
valsercysglyileilegluileval
180185
<210>3
<211>19
<212>rna
<213>musmusculus
<400>3
guacaguacugugauagcu19
<210>4
<211>21
<212>rna
<213>rattusnorvegicus
<400>4
uacaguacugugauagcugaa21
- 还没有人留言评论。精彩留言会获得点赞!