DHRS2基因及检测DHRS2基因表达的试剂的应用的制作方法
本发明涉及基因标志物在卵巢癌诊断及治疗中的应用,具体涉及dhrs2在卵巢癌诊断和治疗中的应用。
背景技术:
卵巢癌是女性生殖器官常见的恶性肿瘤之一,其发病率列居女性各类妇科癌症的第三位,单死亡率居首,对女性生命健康造成严重威胁,由于卵巢的胚胎发育,组织解剖及内分泌的功能较为复杂,目前其发病机制仍未研究清楚。卵巢癌预后差主要归咎于对其缺乏有效的早期诊断手段以及肿瘤细胞对化疗极易产生耐药。
肿瘤细胞的生物学行为建立在基因表达之上。dna链与组蛋白和非组蛋白构成染色体。组蛋白的表观修饰,例如磷酸化,甲基化,泛素化和乙酰化等可以调节众多基因的表达水平。其中,组蛋白乙酰化因为可以调控基因转录受到广泛关注。组蛋白的乙酰化水平由组蛋白乙酰化与去乙酰化的程度决定,进一步决定了基因的转录水平。此外,组蛋白去乙酰化酶亦通过构建转录辅阻遏物或者通过与转录因子相互作用从而调控基因表达,这些转录因子包括p53,stat3,e2f等。因此,组蛋白去乙酰化酶成为肿瘤及炎症治疗领域的有效靶点。
组蛋白去乙酰化酶抑制剂(hdaci)作为新的表观遗传学药物,通过破坏去乙酰化酶的作用,进而间接升高组蛋白乙酰化水平,进而调控基因表达增高。组蛋白去乙酰化酶抑制剂已被证实在卵巢癌患者的治疗中有效。组蛋白去乙酰化酶抑制剂一个显著特点是对于细胞系的作用具有选择性。然而,对于组蛋白去乙酰化酶抑制剂在卵巢癌个体化治疗中的目标群体尚不清楚。
对细胞凋亡相关基因的调节是组蛋白去乙酰化酶抑制剂抗肿瘤效应的重要机制。寻找组蛋白去乙酰化酶抑制剂导致凋亡过程中的关键基因能够更好的指导组蛋白去乙酰化酶抑制剂在卵巢癌个体化治疗中的应用。对于组蛋白去乙酰化抑制剂的耐药性进行研究有助于寻找降低耐药性的方法。
技术实现要素:
本发明为解决至少上述一种问题,提供了一种与卵巢癌发生发展相关的分子标记物及其应用。发明人研究发现,dhrs2在卵巢癌组织中低表达,且dhrs2mrna水平的低表达与卵巢癌患者较短的疾病无进展生存时间(pfs)及较短的总生存时间有关。
本发明解决上述技术问题的技术方案如下:
检测dhrs2基因表达的试剂在制备诊断卵巢癌的产品中的应用。
检测dhrs2基因表达的试剂在制备卵巢癌预后评估产品中的应用。
检测dhrs2基因表达的试剂在卵巢癌组蛋白去乙酰化酶抑制剂耐药风险评估中的应用。
进一步,所述试剂包括通过rt-pcr、实时定量pcr、免疫检测、原位杂交、芯片或高通量测序平台检测dhrs2基因表达水平的试剂。
进一步,所述通过rt-pcr检测dhrs2基因表达水平的试剂至少包括一对特异性扩增dhrs2基因的引物;所述通过实时定量pcr检测dhrs2基因表达水平的试剂至少包括一对特异性扩增dhrs2基因的引物;所述通过免疫检测检测dhrs2基因表达水平的试剂包括与dhrs2蛋白特异性结合的抗体;所述通过原位杂交检测dhrs2基因表达水平的试剂包括与dhrs2基因的核酸序列杂交的探针;所述通过芯片检测dhrs2基因表达水平的试剂包括蛋白芯片和基因芯片,所述蛋白芯片包括与dhrs2蛋白特异性结合的抗体,所述基因芯片包括与dhrs2基因的核酸序列杂交的探针。
进一步,一对所述特异性扩增dhrs2基因的引物序列分别如seqidno:1和seqidno:2所示。
本发明还提供了dhrs2基因在制备改善卵巢癌组蛋白去乙酰化酶抑制剂耐药性药物中的应用。
本发明的有益效果是:本发明发现了一种与卵巢癌相关的生物标记物,并且提供了一种新的评估卵巢癌患者预后的生物标记物,可以对卵巢癌的预后进行评估,并且首次发现了dhrs2在卵巢癌对组蛋白去乙酰化酶抑制剂的反应中起重要作用,在卵巢癌组织中dhrs2的高表达的患者更容易对组蛋白去乙酰化酶抑制剂敏感,并提供了一种新的逆转卵巢癌去乙酰化酶抑制剂耐药性的分子靶点。
附图说明
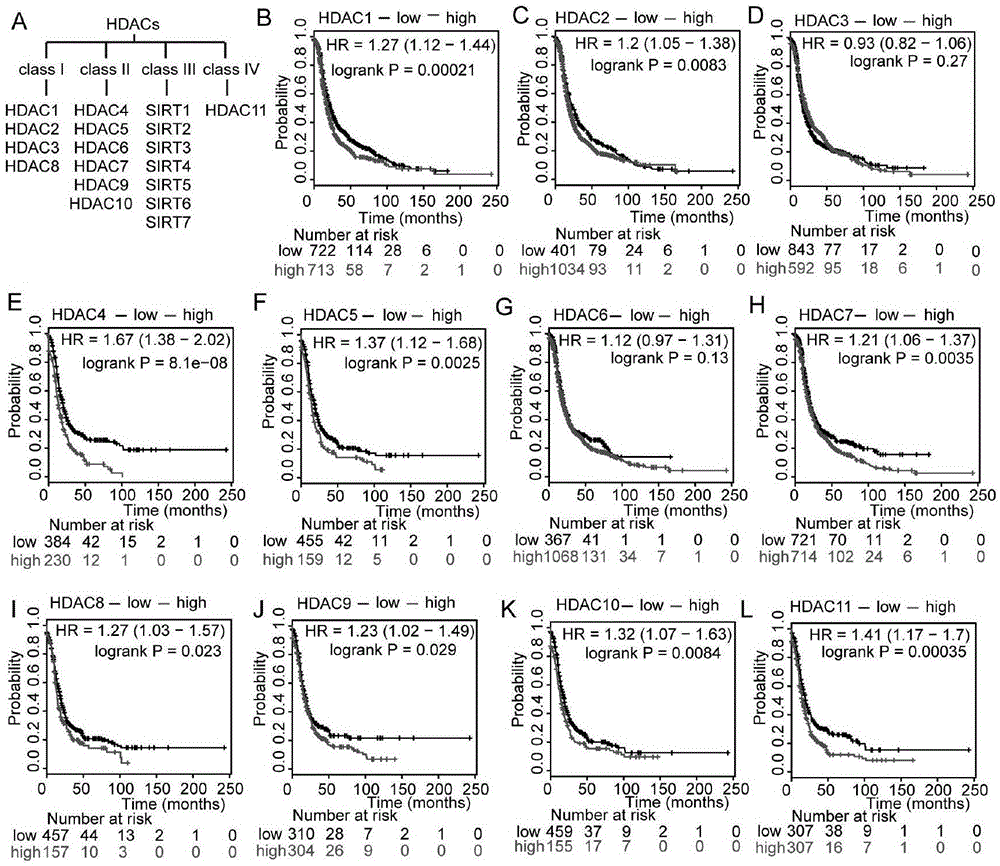
图1为本发明组蛋白去乙酰化酶与卵巢癌无进展生存期之间的关系图;
图2为本发明分别用saha、tsa和apicidin处理后的a2780细胞和es2细胞中的dhrs2的mrna表达水平和蛋白免疫印迹图;
图3为本发明不同浓度的tsa分别对es2细胞和a2780细胞的生长浓度的影响图;
图4为本发明不同浓度的saha分别对于es2细胞和a2780细胞的生长浓度的影响图;
图5为本发明不同浓度的apicidin分别对于es2细胞和a2780细胞的生长浓度的影响图;
图6为tsa、saha和apicidin分别对于es2细胞和a2780细胞的半抑制浓度(ic50)以及半抑制浓度下se2细胞和a2780细胞中dhrs2基因的mrna表达水平;
图7为分别用两个sirna(dhrs2si-1和dhrs2si-2)转染es2细胞后,dhrs2基因mrna的表达水平;
图8为分别用tsa、saha和apicidin对分别用两个sirna(dhrs2si-1和dhrs2si-2)转染的es2细胞进行处理后,es2细胞的结晶紫染色结果;
图9为用tsa对分别用两个sirna(dhrs2si-1和dhrs2si-2)转染的es2细胞进行处理后,es2细胞的细胞凋亡结果图;
图10为分别用saha和apicidin对分别用两个sirna(dhrs2si-1和dhrs2si-2)转染的es2细胞进行处理后,es2细胞的细胞凋亡结果图;
图11为分别用tsa、saha和apicidin对分别用两个sirna(dhrs2si-1和dhrs2si-2)转染的es2细胞进行处理后,es2细胞处于不同细胞周期的细胞数量;
图12为分别用tsa、saha和apicidin对分别用两个sirna(dhrs2si-1和dhrs2si-2)转染的es2细胞进行处理后,es2细胞处于不同细胞周期的细胞的比例;
图13为分别用tsa、saha和apicidin处理es2细胞和通过sirna降低dhrs2表达的es2细胞,细胞中dhrs2蛋白、mcl-1蛋白和cleavedparp蛋白的蛋白免疫印迹图;
图14为dhrs2的高表达和低表达分别与卵巢癌的无进展生存期和总生存期的关系;
图15为正常卵巢癌组织芯片和卵巢癌组织芯片中dhrs2蛋白免疫祖华分析结果;
图16为不同病理分级的卵巢癌组织中dhrs2的组化评分;
图17为卵巢癌化疗敏感性与dhrs2表达水平的关系;
图18为卵巢癌的不同化疗反应与dhrs2表达水平的关系;
图19为卵巢癌化疗病例中化疗敏感组与化疗耐药组的dhrs2的组化评分。
具体实施方式
以下结合附图及具体实施例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
dhrs2基因
dhrs2位于人14号染色体上,一种代表性的人dhrs2基因的核苷酸序列如seqidno:3
组蛋白去乙酰化酶包括由18个基因转录翻译而成的一群高度保守的酶,这些酶一般分成4组,利用数据库进行生存分析,结果如图1所示,除了组蛋白去乙酰化酶3和组蛋白去乙酰化酶6,在卵巢癌中其他几种组蛋白去乙酰化酶mrna水平升高提示更短的无进展生存期,该结果表明组蛋白去乙酰化酶抑制剂可作为药物治疗卵巢癌。
本发明提供了dhrs2基因以及检测dhrs2基因表达的试剂的应用:
检测dhrs2基因表达的试剂在制备诊断卵巢癌的产品中的应用。
检测dhrs2基因表达的试剂在制备卵巢癌预后评估产品中的应用。
检测dhrs2基因表达的试剂在卵巢癌组蛋白去乙酰化酶抑制剂耐药风险评估中的应用。
进一步,所述试剂包括通过rt-pcr、实时定量pcr、免疫检测、原位杂交、芯片或高通量测序平台检测dhrs2基因表达水平的试剂。
进一步,所述通过rt-pcr检测dhrs2基因表达水平的试剂至少包括一对特异性扩增dhrs2基因的引物;所述通过实时定量pcr检测dhrs2基因表达水平的试剂至少包括一对特异性扩增dhrs2基因的引物;所述通过免疫检测检测dhrs2基因表达水平的试剂包括与dhrs2蛋白特异性结合的抗体;所述通过原位杂交检测dhrs2基因表达水平的试剂包括与dhrs2基因的核酸序列杂交的探针;所述通过芯片检测dhrs2基因表达水平的试剂包括蛋白芯片和基因芯片,所述蛋白芯片包括与dhrs2蛋白特异性结合的抗体,所述基因芯片包括与dhrs2基因的核酸序列杂交的探针。
进一步,一对所述特异性扩增dhrs2基因的引物序列分别如seqidno:1和seqidno:2所示。
本发明还提供了dhrs2基因在制备改善卵巢癌组蛋白去乙酰化酶抑制剂耐药性药物中的应用。
实施例1组蛋白去乙酰化酶抑制剂的作用靶点
分别取卵巢癌细胞系es2和a2780,在正常培养条件下分别将卵巢癌细胞es2和a2780接种到10个6cm2的培养皿上,待细胞密度达到60%左右即细胞生长达对数增长期后,每个培养皿分别加入组蛋白去乙酰化酶抑制剂,选用的组蛋白去乙酰化酶抑制剂为三种,包括saha、tsa和apicidin,第1至10个培养皿中的加药情况分别为空白、0.1μmsaha,1μmsaha,10μmsaha,0.1μmtsa,1μmtsa,10μmtsa,0.1μmapicidin,1μmapicidin,10μmapicidin,加药后24小时收取细胞渣,将收取的细胞渣分成两份,一份提取rna进行实时荧光定量pcr检测dhrs2的mrna水平,用trizol试剂提取细胞rna,用takara逆转录试剂盒将rna逆转录为cdna,实时荧光定量pcr的dhrs2的引物序列分别为seqidno:1(cctctggtagggagcactct)和seqidno:2(ccagcgccactactggatta),内参选用gapdh,内参的引物序列分别为seqidno:4(gcctcgtcccgtagacaaaa)和seqidno:5(gatgggcttcccgttgatga),另一份提取蛋白质进行蛋白免疫印记(westernblot)检测dhrs2的蛋白水平,(抗体购自武汉三鹰公司,货号15735-1-ap),westernblot的具体步骤如下:用来自碧云天的含有pmsf细胞裂解液裂解细胞,提取蛋白,每个样品取蛋白40μg,用4–12%丙烯酰胺胶进行跑胶,然后转至pvdf膜,室温下5%牛血清白蛋白(bullserumalbumin,bsa)封闭1小时后封闭一抗4℃过夜,第二天封闭二抗并用li-cor奥德赛红外扫描仪显色。结果如图2所示,saha,tsa以及apicidin三种组蛋白去乙酰化酶药物都能够诱导a2780细胞和es2细胞的dhrs2的mrna水平增高,且具有浓度依赖性,同样,两株细胞的蛋白水平也相应增加,说明,dhrs2是组蛋白去乙酰化酶抑制剂的一个作用靶点。
实施例2dhrs2表达水平与卵巢癌细胞对组蛋白去乙酰化酶抑制剂反应性的关系
分别取卵巢癌细胞系es2和a2780,在正常培养条件下分别将卵巢癌细胞es2和a2780接种到6cm2的培养皿上,待细胞密度达到60%左右即细胞生长达对数增长期后,胰蛋白酶消化并接种到96孔板,每个孔6000个细胞,并贴壁12小时,分别加入组蛋白去乙酰化酶抑制剂,选用的去乙酰化酶抑制剂为三种,包括saha、tsa和apicidin,添加量分别为0.014、0.04、0.12、0.37、1.1、3.3、10μmol,放置细胞培养箱培养48小时。然后每个孔加入10μlcck8试剂,37℃孵育2小时。在450nm处通过测量od值并计算药物抑制率及半抑制浓度(ic50),结果如图3/4/5所示,a2780细胞tsa(图3),saha(图4),apicidin(图5)的ic50分别为0.225、0.891、1.126μmol,es2细胞tsa(图3),saha(图4),apicidin(图5)的ic50分别为1.513、3.003、2.897μmol。提取a2780细胞和es2细胞中的rna,并检测细胞中dhrs2的mrna水平,如图6所示,细胞a2780中dhrs2mrna的水平比es2细胞中的高,且对三类组蛋白去乙酰化酶抑制剂更敏感,说明dhrs2mrna高表达的卵巢癌细胞更能获益于组蛋白去乙酰化酶抑制剂,对组蛋白去乙酰化酶抑制剂的耐药性更低。
实施例3dhrs2基因沉默
用sirna降低es2细胞系中dhrs2在mrna水平上的表达量,具体方法如下:待es2细胞生长至对数生长期,接种至六孔板,用lipo3000转染sirna,具体步骤参见lipo3000说明书,分别选取两个sirna,(dhrs2si-1和dhrs2si-2),其中dhrs2si-1的双链核苷酸序列分别为seqidno:6(cacuagaacacuggcauug)和seqidno:7(gugaucuugugaccguaac),dhrs2si-2的双链核苷酸序列分别为seqidno:8(cugggugucuacaauguca)和seqidno:9(ugacauuguagacacccag),转染ncsirna(无意义sirna)的细胞作为对照组(nc),转染72h后收取细胞渣提取rna,进行实施荧光定量pcr,结果如图7所示,两条sirna都可以降低dhrs2的mrna水平,并且sirna-2的敲减效果最佳。
利用两条sirna分别转染es2细胞后,分别加入药物tsa(1μmol)、saha(2μmol),apicidin(3μmol),对照组设置四组,一组转染ncsirna(无意义sirna)且不用药物处理(nc+dmso),另外三组不进行转染但是分别用tsa、saha和apicidin进行药物处理,加药48h后直接进行结晶紫染色,结晶紫染色可以直观反映残存细胞数。结果如图8示,在无tsa、saha和apicidin药物作用下,nc组和dhrs2沉默组细胞数目相当,提示dhrs2基因沉默本身对卵巢癌细胞生存无明显影响。但是在tsa、saha和apicidin药物作用下,dhrs2沉默组细胞数量较nc组多,提示在hdaci药物作用下,dhrs2沉默的细胞明显有生存优势。
利用两条sirna分别转染es2细胞后,分别加入药物tsa(1μmol)、saha(2μmol),apicidin(3μmol),对照组设置四组,一组转染ncsirna且不用药物处理(nc+dmso),另外三组转染ncsirna但是分别用tsa、saha和apicidin进行药物处理,加药48小时后,用annexinv-fitc/pi细胞凋亡检测试剂盒检测细胞凋亡(凋亡试剂盒来自bd公司,货号556547,并按照其说明书进行操作)。annexinv-fitc/pi细胞凋亡检测试剂盒原理为annexin-ⅴ(膜联蛋白-v)可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合,pi是一种核酸染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但可以透过凋亡晚期和坏死细胞的细胞膜而使细胞核染红。因此同时annexin-ⅴ与pi阳性(右上象限)即为凋亡细胞。结果如图9示,利用sirna沉默dhrs2基因的表达后,在saha药物作用下,细胞的凋亡效率明显较对照组(nc组)低(凋亡率:nc+dmso6.79%,nc+saha31%,dhrs2si-1+dmso6.82%,dhrs2si-1+saha16.8%,dhrs2si-2+dmso4.94%,dhrs2si-2+saha13.3%)。如图10所示,在tsa及apicidin药物作用下,细胞的凋亡效率明显较对照组(nc组)低(凋亡率:nc+dmso7.61%,nc+tsa19.2%,nc+apicidin24.3%,dhrs2si-1+dmso4.78%,dhrs2si-1+tsa14.3%,dhrs2si-1+apicidin18.1%,dhrs2si-2+dmso4.02%,dhrs2si-2+tsa6.84%,dhrs2si-2+apicidin13.1%)。提示在tsa、saha、apicidin药物作用下,dhrs2沉默后细胞凋亡数更少。
利用两条sirna分别转染es2细胞后,分别加入药物tsa(1μmol)、saha(2μmol),apicidin(3μmol),对照组设置四组,一组转染ncsirna且不用药物处理(nc+dmso),另外三组转染ncsirna但是分别用tsa、saha和apicidin进行药物处理,加药48小时后,收取细胞渣,将细胞固定在75%的冷乙醇中24小时,然后用pbs洗涤,在pbs和pi中加入rnase(0.2mg/ml),上流式细胞仪分析细胞周期。其原理是碘化丙啶(propidium,简称pi)是一种双链dna的荧光染料。碘化丙啶和双链dna结合后可以产生荧光,并且荧光强度和双链dna的含量成正比,因此dna含量为2n的可以视为g0/g1期,4n处可视为g2/m期,2n-4n之间为s期。结果如图11/12示,在tsa、saha,apicidin药物作用下,利用sirna沉默dhrs2基因的表达后,阻滞在g2/m期的细胞数量明显比对照组少。
利用两条sirna分别转染es2细胞后,分别加入药物tsa(1μmol)、saha(2μmol),apicidin(3μmol),对照组设置四组,一组转染ncsirna且不用药物处理(nc+dmso),另外三组转染ncsirna但是分别用tsa、saha和apicidin进行药物处理,加药48小时后,收取细胞渣,进行蛋白免疫印记分析检测细胞中dhrs2蛋白、mcl-1蛋白、cleaved-parp蛋白的含量变化,蛋白免疫印记的方法同实施例1(dhrs2抗体、mcl-1抗体、gapdh抗体均购自武汉三鹰公司,cleavedparp抗体购自abcam),结果如图13所示,经过saha、tsa和apicidin处理的es2细胞,mcl-1在蛋白水平上降低,c-parp在蛋白水平上升高,但是经sirnas降低细胞中dhrs2表达量之后,再用这三类组蛋白去乙酰化酶抑制剂处理细胞,在蛋白水平上mcl-1的降低和cleaved-parp的升高都减弱,已知mcl-1在组蛋白去乙酰化酶抑制剂促进细胞凋亡和周期阻滞中起到关键性作用,cleaved-parp是凋亡标记。由此得出,在组蛋白去乙酰化酶抑制剂的作用下,dhrs2表达升高,并抑制mcl-1表达,进而促进组蛋白去乙酰化酶抑制剂诱导的细胞凋亡及周期阻滞。
实施例4
自kmplotter数据库收集了1816例卵巢癌恶性肿瘤基因表达数据和生存信息,以此对基因在卵巢癌恶性肿瘤的预后影响进行在线分析,利用kmplotter根据dhrs2的表达量将样本分为两组,高表达组和低表达组,以无进展生存期和总生存期为截尾数据,分析dhrs2在卵巢癌患者预后的作用,结果如图14所示,发现卵巢癌患者中dhrs2低表达与更短的无进展生存期和总生存期有明显关系,提示高表达dhrs2的患者预后更好。
实施例5
对含有正常卵巢癌组织的卵巢癌组织芯片(购自西安艾丽娜)进行免疫组化技术分析,具体方法参照武汉三鹰公司实验指南(http://www.ptgcn.com/support/protocols/),结果如图15所示,dhrs2蛋白在卵巢癌组织中表达量降低且主要定位于细胞质(卵巢上皮组平均表达量8,卵巢癌组平均表达量5.97,p<0.05有统计学意义)。
“csiovdb”数据库包括3431例人卵巢癌的转录组芯片侧序数据。用该数据库进行进一步的分析发现,如图16所示,在病理分级1级卵巢癌中dhrs2在mrna水平上高于其它分级卵巢癌,这个结果与我们的免疫组化结果相一致。
对于卵巢癌患者,其对化疗的敏感性是一个影响预后的重要因素。通过分析“csiovdb”数据库发现,dhrs2表达水平升高的患者对化疗更敏感。
为了进一步证明dhrs2对提示卵巢癌化疗敏感性的指导意义,利用癌症基因组图谱计划(atcc)数据库中的“ucscxena”,将卵巢癌患者dhrs2表达量下载,分为部分缓解/反应组和完全缓解/反应组,发现对化疗后部分缓解/反应的病人相比较,完全缓解/反应的病人dhrs2mrna表达量更高,统计学方法,t检验,p<0.05。
我们征集了20例经顺铂化疗方案系统治疗的卵巢癌标本,进行免疫组织化学染色,并根据化疗后ca125表达水平分为化疗敏感组和化疗耐药组,将dhrs2组化得分进行t检验,同样发现,对化疗敏感的患者其dhrs2表达更高(化疗敏感组dhrs2平均组化得分5.24,化疗耐药组dhrs2平均组化得分2.59,p<0.001)。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>华中科技大学同济医学院附属同济医院
<120>dhrs2基因及检测dhrs2基因表达的试剂的应用
<160>9
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
cctctggtagggagcactct20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ccagcgccactactggatta20
<210>3
<211>906
<212>dna
<213>人(homosapiens)
<400>3
gttcgttgcaacaaattgatgagcaatgcttttttataatgccaactttgtacaaaaaag60
ttggcatgagcagcaccgggatagacaggaagggcgtcctggctaaccgggtagccgtgg120
tcacggggtccaccagtgggatcggctttgccatcgcccgacgtctggcccgggacgggg180
cccacgtggtcatcagcagccggaagcagcagaacgtggaccgggccatggccaagctgc240
agggggaggggctgagtgtggcgggcattgtgtgccacgtggggaaggctgaggaccggg300
agcagctggtggccaaggccctggagcactgtgggggcgtcgacttcctggtgtgcagcg360
caggggtcaaccctctggtagggagcactctggggaccagtgagcagatctgggacaaga420
tcctaagtgtgaacgtgaagtccccagccctgctgctgagccagttgctgccctacatgg480
agaacaggaggggtgctgtcatcctggtctcttccattgcagcttataatccagtagtgg540
cgctgggtgtctacaatgtcagcaagacagcgctgctgggtctcactagaacactggcat600
tggagctggcccccaaggacatccgggtaaactgcgtggttccaggaattatcaaaactg660
acttcagcaaagtgtttcatgggaatgagtctctctggaagaacttcaaggaacatcatc720
agctgcagaggattggggagtcagaggactgtgcaggaatcgtgtccttcctgtgctctc780
cagatgccagctacgtcaacggggagaacattgcggtggcaggctactccactcggctct840
gcccaactttcttgtacaaagttggcattataagaaagcattgcttatcaatttgttgca900
acgaac906
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
gcctcgtcccgtagacaaaa20
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
gatgggcttcccgttgatga20
<210>6
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>6
cacuagaacacuggcauug19
<210>7
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>7
gugaucuugugaccguaac19
<210>8
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>8
cugggugucuacaauguca19
<210>9
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>9
ugacauuguagacacccag19
- 还没有人留言评论。精彩留言会获得点赞!