用于胃癌诊断、化疗和预后检测的分子组合物及试剂盒的制作方法
本发明涉及分子生物制药技术领域,具体涉及一种用于胃癌诊断、化疗和预后检测的分子组合物及试剂盒。
背景技术:
核因子活化b细胞κ轻链增强子(nuclearfactorkappalightchainenhancerofactivatedbcells,nf-κb)呈现持续的激活状态,在肿瘤发生发展以及侵袭转移的过程中起着至关重要的作用。临床研究表明,对胃黏膜癌变发生发展起到先导和推动作用的幽门螺旋杆菌(helicobacterpylori,hp)感染,可致nf-κb信号通路呈激活状态,nf-κb的活化与hp相关胃炎、胃溃疡及胃癌的发生发展、生存预后密切相关。胃癌患者体内nf-κb异常活化与不良预后显著相关。nf-κb可通过抑制肿瘤细胞凋亡,进而促进肿瘤细胞的增殖,诱导肿瘤细胞迁移和侵袭,且与肿瘤治疗过程中耐药的产生密切相关。在临床应用中nf-κb信号通路抑制剂具有明显的抗肿瘤作用,如通过调控nf-κb上游关键抑制分子iκb-α的表达,或通过抑制iκb-α磷酸化修饰阻止其降解等。因而以nf-κb信号通路分子为靶标的治疗干预被认为是抑制肿瘤生长、改善肿瘤化疗耐药的有效举措。
金属硫蛋白2a(metallothionein2a,mt2a)属于金属硫蛋白家族(metallothioneins,mt)。多项研究表明mt分子在肿瘤发生发展、癌症患者预后、肿瘤化疗耐药等方面具有重要作用,如基因敲除mt2a可增加小鼠炎症相关胃癌、致癌物诱发肝癌的发生率,并发现在肝癌肿瘤组织中,超氧阴离子的增加与nf-κb异常激活相关。研究发现,mt2a能够通过转录调控iκb-α的表达并抑制其磷酸化修饰从而抑制nf-κb信号通路的活性。大蒜衍生物己二烯三硫化物(diallyltrisulfide,dats)可通过表观调控机制上调mt2a表达、进而抑制nf-κb活性,发挥其对胃癌细胞体内外增殖的抑瘤效应;dats联合多西他赛(docetaxel,doc)具有协同抑制胃癌肿瘤细胞增殖、提高化疗敏感性的效果,通过分析41例临床接受doc治疗前后的胃癌患者组织中mt2a与nf-κb信号通路分子的表达,我们发现在接受doc等药物治疗的早期,胃癌患者体内mt2a的表达与doc治疗效果相关。揭示“上调mt2a-抑制nf-κb活性”可能是dats和doc等化疗药物抑癌增敏的重要分子通路。
mt2a作为金属转运蛋白可螯合金属离子并结合转录因子进入细胞核,参与基因的表达调控。根据“mt2a能够通过转录调控iκb-α的表达”这一前期研究结果,认为dats抑制人胃癌细胞增殖、增强化疗敏感性的效应,可能是经由mt2a通过金属离子“招募”或结合某种转录因子,调控iκb-α基因的表达进而抑制nf-κb异常活化实现的。为此,我们通过
mzf1是锌指蛋白kruppel家族成员之一,最初在人慢性髓性白血病人的外周血细胞中被鉴定出,因此被视为造血发育过程中的转录因子。mzf1在肿瘤中具有双向转录调控作用,在人乳腺癌细胞中,mzf1可结合到组织蛋白酶b(cathepsinsb)基因第一个内含子上的erbb2反应增强元件,激活其表达,从而促进肿瘤细胞的侵袭;weberce等最近报道了肿瘤细胞分泌的骨桥蛋白(osteopontin,opn)可通过mzf1作用于tgf-β1,促进人乳腺癌细胞的生长和转移;mzf1还可调控pkcα转录表达从而促进人肝细胞癌的生长。反之,另有一些研究表明,mzf1可通过增加ferroportin的表达,抑制人前列腺癌细胞增殖;过表达mzf1通过转录抑制mmp2启动子活性,从而抑制人宫颈癌细胞侵袭和迁移的能力。因此,mzf1与mt2a相似,在不同肿瘤中呈现不同的表达模型,表达呈现组织细胞特异性,mzf1在细胞中的差异性表达能够影响细胞增殖和细胞的侵袭迁移,并在肿瘤的发生发展中起到重要的作用。
虽然近期一些研究表明mzf1有可能与某些基因相互作用,共同转录调控另一个基因的表达。如人肝癌细胞株中mzf1与elk-1(ets-likeprotein-1)结合成为复合物,共同调控pkcα的转录;在t细胞淋巴瘤细胞株中过表达转录因子mzf1和ik-1(ikarosisoform1)可通过下调i型胰岛素样生长因子受体(typeiinsulin-likegrowthfactorreceptor,igf-ir)抑制淋巴瘤细胞的增殖与迁移。但目前关于mzf1在肿瘤中的研究主要是针对其作为转录因子的作用机制,对其在胃癌中表达调控及其改变肿瘤行为的作用机制,目前尚不清楚。
技术实现要素:
本发明的目的在于提供一种用于胃癌诊断、化疗和预后检测的分子组合物,以解决上述背景技术中存在的技术问题。
为了实现上述目的,本发明采取了如下技术方案:
一方面,本发明提供一种用于胃癌诊断、化疗和预后检测的分子组合物,该分子组合物包括由金属硫蛋白mt2a和转录因子骨髓锌指基因1mzf1组合成的信号通路抑制分子mt2a/mzf1。
第二方面,本发明一种如第一方面提供的分子组合物在制备胃癌诊断、化疗和预后检测药物中的应用,所述mt2a/mzf1在胃粘膜组织细胞恶性变过程中及胃癌组织中表达共同呈现逐渐下降模式-mt2a/mzf1low,所述药物中含有检测mt2a/mzf1low的分子标记物。
第三方面,本发明提供一种如第一方面提供的分子组合物作为药物靶点在胃癌诊断、化疗和预后检测药物中的应用,mt2a/mzf1通过抑制iκb-α基因的表达抑制nf-κb信号通路的活化。
第四方面,本发明提供一种如第一方面提供的分子组合物在制备用于胃癌诊断、化疗与预后检测的试剂盒中的应用。
本发明有益效果:在提高化疗敏感性的个体化精准治疗应用中,具有重要的科学意义和临床价值,为胃癌患者的个体化精准治疗提供有效的分子靶标,为干预新策略提供依据,提供了更可靠的胃癌诊断和预后预测。
本发明附加的方面和优点将在下面的描述中部分给出,这些将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例所述的过表达mzf1对人胃癌细胞增殖、迁移和致瘤性的抑制作用示意图。
图2为本发明实施例所述的mzf1对胃恶性肿瘤的影响作用示意图。
图3为本发明实施例所述的mt2a对mzf1表达的转录调节结果示意图。
图4为本发明实施例所述的mzf1与mt2a合作靶向nfkbia启动子结果示意图。
图5为本发明实施例所述的研究mt2a/mzf1在人胃细胞恶性病变过程中与胃癌中的表达的方法示意图。
具体实施方式
下面详细描述本发明的实施方式,所述实施方式的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的模块。下面通过参考附图描述的实施方式是示例性的,仅用于解释本发明,而不能解释为对本发明的限制。
本技术领域技术人员可以理解,除非特意声明,这里使用的单数形式“一”、“一个”、“所述”和“该”也可包括复数形式。应该进一步理解的是,本发明的说明书中使用的措辞“包括”是指存在所述特征、整数、步骤、操作、元件和/或模块,但是并不排除存在或添加一个或多个其他特征、整数、步骤、操作、元件、模块和/或它们的组。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
为便于对本发明实施例的理解,下面将结合附图以具体实施例为例做进一步的解释说明,且实施例并不构成对本发明实施例的限定。
本领域普通技术人员应当理解的是,附图只是一个实施例的示意图,附图中的部件或装置并不一定是实施本发明所必须的。
实施例1
实验一mzf1抑制胃癌的恶性行为
将mzf1转染到胃癌bgc823胃癌细胞中建立具有过表达的mzf1(胃癌bgc823-mzf1)或载体对照(胃癌bgc823-vector)的稳定细胞系,以评估mzf1在体外和体内胃肿瘤发生中的潜在作用。
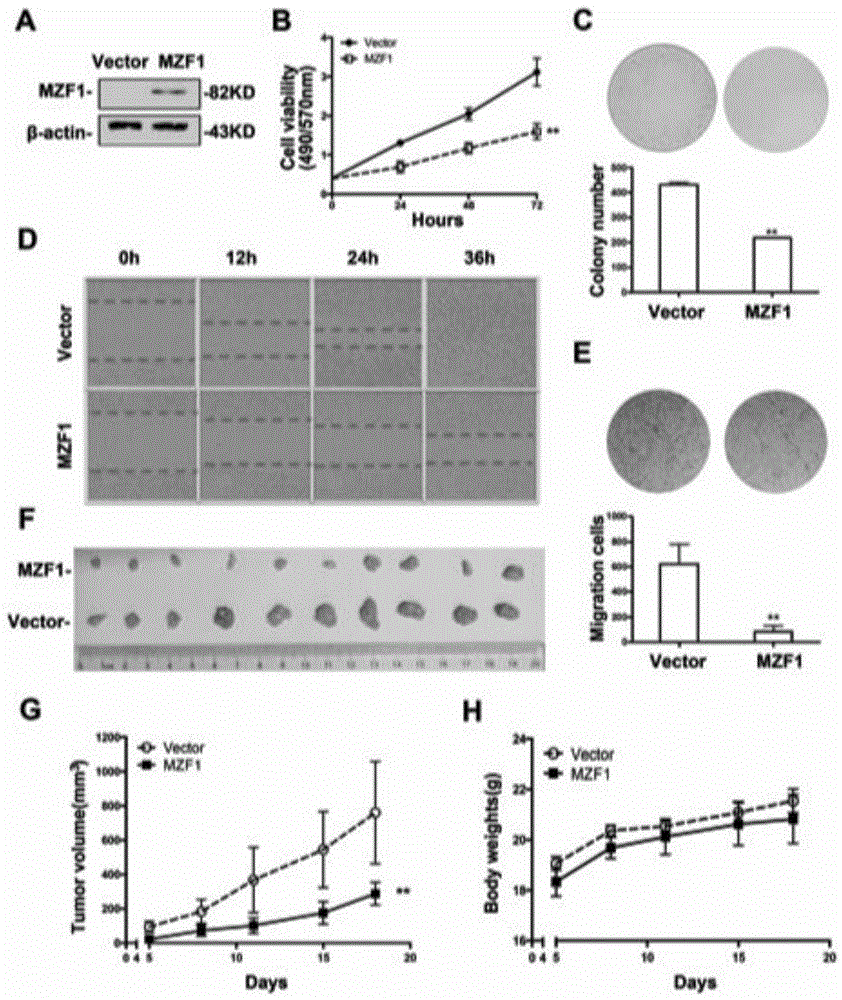
如图1中,a为用mzf1或载体对照转染的mzf1的蛋白质水平的western印迹分析。β-肌动蛋白作为样品上样对照。
b为mtt测定显示mzf1过表达的胃癌bgc823细胞(胃癌bgc823-mzf1)或载体对照(胃癌bgc823-vector)的存活力。结果表示为平均值±sd。**与对照相比,p<0.01。
c为胃癌bgc823-mzf1或胃癌bgc823-vector细胞在软琼脂中形成菌落2周。顶部面板:代表性形象;下图:计数的菌落数显示为平均值±sd。**与对照相比,p<0.01。
d为细胞单层划痕测定显示不同时间点具有或不具有prss3表达的胃癌bgc823细胞的细胞侵袭能力的。
e为transwell迁移试验评估具有或不具有mzf1表达的胃癌bgc823细胞的细迁移能力。代表性图像显示在顶部面板上,图像底部显示的数据量化为平均值±sd。**与对照相比,p<0.01。
f-h表示通过将胃癌bgc823-mzf1或胃癌bgc823-vector细胞皮下注射到裸鼠的左侧和右侧(n=2个侧翼×每组5只小鼠)中来评估mzf1对人胃癌细胞致瘤性的影响。其中,f为在第20天从胃癌bgc823-mzf1或胃癌bgc823-载体细胞解剖的胃癌bgc823异种移植肿瘤的照片;g和h为在所示时间测量荷瘤小鼠的肿瘤体积(g)和体重(h)。显示的结果代表平均值±sd,**p<0.01(非配对t检验),与对照相比。
如图1所示,mzf1在胃癌bgc823细胞中稳定过表达(胃癌bgc823-mzf1)以评估其潜在作用(图1a)。与载体转染的对照细胞(胃癌bgc823-vector)相比,胃癌bgc823-mzf1中的细胞活力显著降低(图1b)。通过集落形成测定证实了结果,其中胃癌bgc823-mzf1细胞比载体对照细胞形成更少的集落(图1c)。我们接下来检测了mzf1对胃癌细胞侵袭能力的影响。在细胞单层划痕试验中,胃癌bgc823-mzf1细胞的迁移能力的被显著抑制(图1d)。与此一致,过表达mzf1能够显著抑制胃癌细胞的迁移能力(图1e)。为了评估mzf1在体内胃癌肿瘤发生中的作用,将胃癌bgc823-mzf1和胃癌bgc823-vector细胞皮下注射到裸鼠中。过表达mzf1能够明显减小裸鼠中异种移植肿瘤体积,而不影响小鼠的体重(图1f-h)。这些结果表明mzf1抑制人胃癌细胞的肿瘤发生。
如图2所示,为了进一步验证mzf1在抑制胃恶性肿瘤中的作用,用mzf1特异性shrna(ges-1-shmzf1)或乱序shrna作为阴性对照(ges-1-shnc)稳定转染ges-1细胞,以评估mzf1在胃癌发育中的潜在作用。
a表示ges-1-shmzf1或ges-1-shnc细胞中mzf1的western印迹分析图。
b为mtt测定显示用shmzf1或shnc转染的ges1细胞的活力结果示意图。
c为在软琼脂中将ges-1-shmzf或ges-1-shnc细胞集落形成2周示意图。上:代表形象;下图:定量分析显示为平均值±sd。*与对照相比,p<0.05。
d为细胞单层划痕试验,用于监测shmzf1或shnc转染的ges-1细胞的侵袭能力。
e为使用transwell迁移测定评估shmzf1或shnc转染ges-1细胞的迁移能力。结果显示为代表性图像(上图)和定量分析(下图:平均值±sd。*p<0.05,相对于shnc)。
用mzf1特异性短发夹rna(shmzf1)转染具有组成型mzf1表达的永生化人胃粘膜上皮细胞系ges-1,以建立mzf1敲低细胞系(ges-1-shmzf1)(图2a)。与对照细胞相比,shmzf1显著增加ges-1细胞在软琼脂中形成的增殖速率和集落数(图2b和2c)。此外,特异性shmzf1转染显著增强了ges-1细胞的迁移能力(图2d和e)。因此,mzf1的存在降低了胃癌细胞的恶性程度。
试验二mt2a调节mzf1的表达
如图3所示,为了探索mzf1在胃癌中mt2a-nf-κb途径中的作用,我们首先检测了在胃癌bgc823-mt2a细胞中敲除异位mt2a(胃癌bgc823-mt2a/shmt2a)后mzf1的表达。
a和b为mt2a过表达的胃癌bgc823细胞(胃癌bgc823-mt2a)用mt2a特异性shrna(胃癌bgc823-mt2a/shmt2a)或乱序shrna作为阴性对照(胃癌bgc823-mt2a/shnc)转染示意图。通过蛋白质印迹(a)或rt-qpcr(b)分别测定mt2a和mzf1的表达。用mt2a特异性shrna(ges-1-shmt2a)或阴性对照(ges-1-shnc)转染ges-1细胞。
c和d分别为通过western印迹和rt-qpcr测定mt2a和mzf1的表达结果图。
e和f为通过二烯丙基三硫化物(dats)(40μm,12小时)处理具有或不具有shmt2a转染的胃癌bgc823和ges-1细胞,对细胞进行rt-qpcr分析(e)和western印迹(f)结果试图。
g和h为在shmzf1转染后,胃癌bgc823-mt2a细胞(g)或ges1细胞(h)中mt2a和mzf1表达的定量rt-pcr分析结果示意图。以条形图结果显示相对于gapdhmrna水平,mrna水平的倍数变化的平均值±sd。相对于对照,*p<0.05,**p<0.01。
如图3a和b所示,在胃癌bgc823-mt2a中mzf1表达在蛋白质和mrna水平均恢复,但在胃癌bgc823-mt2a/shmt2a细胞中减少,表明mt2a对mzf1表达具有调节作用。然后我们研究了在ges-1细胞中mzf1的表达是否与mt2a相关。在ges-1细胞中用特异性shmt2a转染敲除mt2a显着降低了mzf1的表达,如图3c、d所示,证实了mt2a对mzf1的转录表达具有调节作用。
我们之前已经显示了dats在胃癌细胞中诱导mt2a表达的能力。因此,我们研究了dats处理后mzf1和mt2a在胃癌bgc823和ges-1细胞中的相互作用。如图3e和f所示,在胃癌bgc823细胞中dats处理诱导mzf1在mrna和蛋白质水平上的表达与mt2a表达相关。胃癌bgc823细胞中敲低mt2a抑制了dats诱导的mzf1表达。在ges-1细胞中,尽管mzf1和mt2a的表达不受dats的影响,但是在dats处理时,shmt2a的引入也减弱了mzf1和mt2a的表达。有趣的是,用shmzf1敲低mzf1降低了胃癌bgc823-mt2a(图3g)和ges-1细胞(图3h)中mt2a的表达,表明mzf1和mt2a在转录水平上呈正反馈相互作用。
实验三mzf1关联mt2a结合nfkb启动子区
如图4所示提供研究mzf1关联mt2a结合nfkb启动子的试验过程及结果示意图。
a为过量表达mt2a(mt2a)或对照(vector)的胃癌bgc823细胞用mzf1或mt2a抗体进行免疫沉淀(ip),然后分别使用mt2a或mzf1抗体进行免疫印迹(ib)。用igg的ip作为阴性对照。用β-肌动蛋白抗体输入的ib用作样品上样对照。
b为在用dats(40μm,24小时)或多西紫杉醇(doc)(10μm,24小时)或dats/doc处理的胃癌bgc823细胞上进行具有mzf1或mt2a抗体的ip,然后用mt2a或mzf1抗体进行ib。igg和β-肌动蛋白抗体用作所述的阴性或上样对照。
c为用转染mt2a或不转染或用dats(40μm,12小时)处理的ges-1细胞或胃癌bgc823细胞中mt2a和mzf1共聚焦免疫荧光染色。通过dapi染色显示细胞核(蓝色)。显示了两个可比实验的结果。比例尺,10μm。
d为用flag-mzf1或gst-mt2a表达质粒转染胃癌bgc823细胞。用纯化的gst或gst-mt2a将带有flag标记的mzf1蛋白质拉下。将1/10分数的样品输入物和沉淀物分别用抗mzf1或抗mt2a进行免疫印迹。
e为nfkbia的启动子区的示意图,显示5'agtgggga3'的共有序列(nfkbia启动子的498/-493区)以及先前实验中的chip-pcr引物组p4的位置。
f为使用抗mzf1或mt2a抗体或igg作为对照,对ges-1和胃癌bgc823细胞进行chip。通过qpcr分析在nfκb1的启动子区富集的mzf1或mt2a的chipdna片段。结果表示为输入的百分比。
g为用或不用dats(40μm,12小时)处理的ges-1细胞chip。chip在ges-1和胃癌bgc823细胞上,或igg作为对照。通过qpcr分析抗mzf1或mt2a抗体的沉淀dna。结果表示为输入的百分比。
为了研究mzf1和mt2a之间的相互作用,在胃癌bgc823-mt2a中进行免疫共沉淀(co-ip)显示在分别通过针对mzf1或mt2a的抗体下拉的细胞裂解物中检测到mt2a或mzf1,如图4a示,表明mzf1和mt2a之间的物理作用。我们最近的研究表明,dats通过增强mt2a表达来抑制nf-κb活化,从而增加了胃癌细胞对多西紫杉醇(doc)的敏感性。图4b用dats或doc或dats/doc处理的胃癌细胞中显示了mzf1与mt2a的结合,表明mzf1参与胃癌中由dats/doc引发的mt2a-nf-κb途径。免疫荧光成像显示mzf1与mt2a共定位于ges-1细胞的细胞核,或具有mt2a表达的胃癌bgc823,或用dats处理后的胃癌bgc823细胞,如图4c所示。为了检测mzf1是否直接与mt2a结合,我们使用从胃癌bgc823细胞纯化的gst-mt2a和flag-mzf1进行gst下拉测定。结果显示gst-mt2a降低flag-mzf1,而单独的gst不能与flag-mzf1结合,表明mt2a直接与mzf1结合,如图4d所示。这些数据表明mzf1与mt2a具有相互调节功能。
在胃癌细胞中由dats诱导的mt2a可能通过直接增强nf-κbα转录来抑制nf-κb活化。在
试验四随着胃癌的恶性转变,mzf1、mt2a的表达逐渐减少
为了探讨mzf1与mt2a的相互作用在胃癌发生中的临床相关性,我们分析了它们在293个组织样本中的表达,其中包括36个慢性浅表性胃炎(csg),85个慢性萎缩性胃炎(cag),69个肠上皮化生(im),47发育不良(dys)和54胃癌,以及4个正常粘膜组织样品作为对照。临床标本的免疫组织学染色显示mzf1和mt2a的表达随着胃恶性转化程度而逐渐降低如图5a、b所示,并且与胃癌的发生显著相关(p<0.001)。组群样本中mt2a(mt2alow)的低表达与mzf1(mzf1low)(p=0.005)的低表达和幽门螺杆菌(h.pylori)感染相关(p=0.02),但与其他参数无关。通过组群交叉制表分析进一步证实了组群样品中mt2a和mzf1的表达降低。这些临床数据表明在胃恶性转化过程中mt2a/mzf1的表达下调。
试验五较高水平的mt2a/mzf1与胃癌患者的良好预后效果相关
为了检测mzf1与胃癌中mt2a的关联,我们测定了6对胃癌组织中mzf1的表达,先前已证实mt2a的表达降低。结果显示,与配对的正常组织相比,所有胃癌组织中mzf1表达均降低,如图5c所示。为了分析mt2a/mzf1的共表达与胃癌预后之间的关系,对来自胃癌群组的肿瘤样品(n=255)进行针对抗mzf1和抗mt2a抗体的免疫染色。如补充表4所示,85.10%(255个中的217个)胃癌患者在肿瘤组织中mzf1低表达,与不良的临床病理学特征显着相关,包括tnm分期(p=0.011),侵袭深度(p=0.002),淋巴结转移(p=0.028),并且对于在肿瘤中mt2a低表达的患者更显着(81.57%,255中的208)。与其他参数无关。图5d显示mt2a低mzf1低,mt2a低mzf1高,mt2a高mzf1低和mt2a高mzf1高的患者数分别为202,6,15和32。在208例mt2alow胃癌患者中,202例(97.07%)同时表达低mzf1(mt2a低mzf1低),而6例(2.93%)患者(p<0.001)mzf1高表达(mt2alowmzf1high)中,表明mzf1与mzf1密切相关。胃癌患者临床病理特征和预后的logistic回归分析显示,mzf1low和mt2alow患者的生存时间明显缩短(p<0.001),而mzf1lowmt2alow定义了不同组中间时间最短的患者。与单独使用mzf1low或mt2alow的患者相比,患者的kaplan-meier生存分析显示mzf1lowmt2alow肿瘤的总体5年存活时间显著缩短(p=0.001),如图5e所示。虽然临床病理特征和分子特征的多变量cox回归分析表明mzf1表达是胃癌患者的独立阳性预后因素(95%ci=0.112-0.453,p<0.001),但mt2a高mzf1低的患者表现出与mt2a高mzf1高患者相当的总生存时间(p=0.57),如图5e所示。因此,这些结果表明,具有mt2alowmzf1的胃癌患者的临床结果较差,这表明mt2a/mzf1提供了更可靠的胃癌诊断和预后预测。
实施例2
胃癌诊断与预后检测的分子标志物的免疫组化检测方法
如图5所示,通过a和b免疫组织化学染色以确定恶化前和恶性胃病变的胃粘膜活检标本群中mt2a和mzf1的表达。根据所述方法,结果分别表示为mt2alow,mt2ahigh,mzf1low或mzf1high。csg:慢性浅表性胃炎,cag:慢性萎缩性胃炎,im:肠上皮化生,dys:发育异常,胃癌:胃癌。
a为mt2a和mzf1的代表性免疫组织化学染色。放大倍数为200倍。
b为分析恶化前和恶性胃病变相关的mt2a和mzf1的表达。
c为先前鉴定mt2a表达的6对胃癌样品中mzf1的表达。上:qpcr;底部:蛋白质印迹。
d和e为在胃癌组织中mt2a和mzf1免疫组织化学染色(n=255)。其中d.表示分析mt2a和mzf1在胃癌患者肿瘤中的共表达。通过χ2检验分析不同组之间的意义。e表示kaplan-meier分析胃癌患者的生存与mt2a或mzf1及其组合的表达相关。*p<0.05,**p<0.01,分别对应于mt2ahigh,mzf1high。
使用抗mzf1或mt2a抗体对来自胃癌患者的胃粘膜活检标本或肿瘤切片进行免疫组化。mzf1或mt2a的表达分别定义为mt2alow,mt2ahigh,mzf1low或mzf1high。
如前所述进行免疫组化。使用针对mzf1(1:100,bs5810)或mt2a(1:50;ab12228)的抗体对来自胃癌患者的胃粘膜活检标本或肿瘤切片进行免疫染色。用于评估免疫染色的阳性对照来自正常胃粘膜组织。缺乏mzf1或mt2a表达的肿瘤用作阴性对照。在该研究中,使用显示重现性的先前方法对mzf1或mt2a的表达进行评分。基于阳性细胞的百分比和染色强度,将染色读数指定为0-12的综合评分。由三位病理学家以盲法方式独立地以200倍放大率在每个样品的五个随机选择的区域中评估切片。阅读之间差异超过10%的不一致病例由高级病理学家审查,并根据共识意见重新分配。根据阳性肿瘤细胞的百分比分配0-4的分数(0=0%;1=1-10%;2=11-50%;3=51-75%;4=76-100%)。标本染色强度评分为0,阴性;1,弱;2,温和;3,强大。将两个评分相乘以得到0-12的总体评分,其中0被认为是阴性,1-4是弱阳性,5-8中等阳性和9-12高度阳性。中位数分数用作表达截止点(mzf1或mt2a中位数分数=4)。mzf1或mt2a的表达定义为低(分级分数:0-4)或高(分级分数:5-12)。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!