一种鸭源性成分的ddPCR检测方法及引物与流程
本发明属于畜产品生物检测技术领域,具体涉及一种鸭源性成分的ddpcr检测方法及引物。
背景技术:
食品掺假是食品行业中一个非常严重的问题,特别是肉类加工产品,其中,用低廉的鸭肉掺入羊肉中来谋取利润是最常见的不法商家的造假行为。这不仅造成肉制品的营养价值问题,而且对食品安全和宗教限制等都存在重大影响。
人们对外观难辨真伪的肉制品质量的担忧日益增长,为了保护消费者权益,职能监督部门迫切需要可靠、快速和准确的方法和技术对肉制品进行监管。
目前,对于动物物种的鉴别方法主要分为蛋白质分析和dna分析,相较于蛋白质来说dna具有耐热性强的特点,更适合进行物种鉴定。常用的基于dna的检测鉴定方法包括传统的pcr扩增、多重pcr检测法、荧光定量pcr(quantitativereal-timepcr)检测法、环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)检测方法等。这些方法在鸭源性成分的检测中存在灵敏度不高的问题,qpcr方法需要建立标准曲线,对于掺有鸭肉的羊肉,不能直接测出掺假比例。
荧光定量pcr是目前最为常见的鉴定方法,其定性检测灵敏度高,重复性好,保证了样品检测结果的可靠性和稳定性。但是,需要对样品进行定量分析用以区分无意污染和故意掺假时,qpcr定性检测难以满足需求,而qpcr的定量检测需要配置标准品用来构建标准曲线,才能通过计算得出dna的浓度。
ddpcr是近年来迅速发展起来的一种突破性的检测和定量核酸的技术,利用油包水将dna模板极度稀释,形成无数个小的pcr反应体系,实现理论上的单分子扩增,反应结果无需建立标准曲线,可直接通过采用泊松概率分布公式计算出样本的原始浓度。
ddpcr检测可消除外源dna背景对靶基因检测的影响,实现一次性定性定量检测,可直接读出靶基因和内参基因的含量比值,目前,还没有报道用双通道ddpcr检查羊肉掺鸭肉的相关研究。
技术实现要素:
本发明的目的在于提供一种鸭源性成分的ddpcr检测方法及引物,与其他物种无交叉扩增,特异性好,灵敏度高,检测灵敏度可以达到12pg/μl,能准确快速检测出混合肉中是否掺有鸭源成分,以及混合肉中鸭源成分所占比例。
为了达到上述目的,本发明提供如下技术方案:
一种鸭源性成分的ddpcr检测方法,包括以下步骤:
1)提取待测样品的dna作为模板,模板浓度10~50ng/;
2)将鸭的ddpcr引物对和探针加入到扩增反应体系中,利用微滴式数字pcr系统进行ddpcr扩增反应;反应过程:95℃预变性10min;94℃变性15~30s,58~62℃退火1min,35~45个循环;98℃固化10min;其中,ddpcr引物对包括上游引物和下游引物;
3)扩增结束后,读取信号,使用quantasoftversion软件分析数据,获得检测结果。
进一步,步骤2)中,所述ddpcr引物对和探针序列如下:
上游引物:5’-gattctacttcaccgccctac-3’;
下游引物:5’-ctacgaagtgtcagtatcaggc-3’;
探针:5’-fam-atccaccttcctaaccgtctgcc-mgb-3’。
进一步,所述扩增反应体系中,还添加了对照物种的ddpcr引物对和探针。
进一步,所述对照物种为羊,羊的ddpcr引物对和探针序列如下:
上游引物:5’-ccaacatgcctttaaaccctcaa-3’;
下游引物:5’-ggaactgtagccttctgactcg-3’;
探针:5’-hex-tgcctttccttccccgccagtctc-bhq1-3’。
优选地,所述扩增反应体系中,各组分的终浓度为:各组分的终浓度为:鸭的上游引物0.5-0.9μmol/l下游引物0.5-0.9μmol/l、鸭的探针0.2-0.25μmol/l。
优选地,所述扩增反应体系中,各组分的终浓度为:鸭的上游引物和下游引物各0.5-0.9μmol/l、鸭的探针0.2-0.25μmol/l,对照物种的上游引物和下游引物引物各0.5-0.9μmol/l、对照物种的探针0.2-0.25μmol/l。
又,所述扩增反应体系中,总体系为20μl,包括:10μl2×ddpcrmastermix,浓度为10μmol/l的鸭的上游引物、下游引物、对照物种的上游引物和下游引物引物各1-1.8μl、鸭的探针0.4-0.5μl,对照物种的探针0.4-0.5μl,dna模板1μl,h2o余量。
一种检测鸭源性成分的ddpcr引物对和探针,具体序列如下:
上游引物:5’-gattctacttcaccgccctac-3’;
下游引物:5’-ctacgaagtgtcagtatcaggc-3’;
探针:5’-fam-atccaccttcctaaccgtctgcc-mgb-3’。
所述检测鸭源性成分的ddpcr引物对和探针在qpcr检测方法中的应用。
本发明以ncbigenebank数据库中鸭的线粒体基因组序列(mf069251)为模板,使用primer5设计鸭源性特异性引物及探针,并利用ncbi在线比对软件blast分析比对相近物种的基因序列,选取与其他物种序列匹配度低、差异大的引物序列,采用fam荧光基团标记鸭探针的5’端,淬灭基团mgb标记鸭探针的3’端,尽量降低本底对扩增的影响。
本发明的鸭源性ddpcr引物与探针具有较好的特异性,重复性良好,在40个循环内与其他物种的dna无交叉反应。利用本发明鸭的ddpcr引物对和探针仅在鸭肉dna模板的反应体系中有明显的扩增曲线,且扩增曲线的重复性较好,而其他肉类样品(如羊肉、鸡肉、牛肉和猪肉)dna作为模板的反应体系和空白对照组均无扩增曲线。
与现有技术相比,本发明具有如下有益效果:
本发明的ddpcr引物与探针具有较好的特异性,利用本发明检测鸭源性成分,具备高灵敏度和良好重复性,还可以直接读出靶dna的浓度,不需要构建标准曲线,无需建立、储存参考标准,使得测定过程快捷方便,ddpcr更节省劳力和时间。
本发明对单模板鸭肉的样品检测下限可达到12pg/μl,在12pg/μl-241.7ng/μl(对应的拷贝数为9.4copies/μl-1.88x105copies/μl)内的各个浓度梯度都能够正常扩增,各浓度梯度的扩增条带重复性好。
利用本发明,对于鸭肉dna含量在5-90%的混合模板进行检测,可以准确测定混合dna样品中的鸭源dna含量,可以很直观地读出鸭源dna的浓度和对照物种的dna浓度之比,从而区分不同鸭源dna含量的样品,误差率在0.4%以下,这在现有技术中是难以实现的。
附图说明
图1为本发明实施例中鸭源性引物与探针的特异性检测结果。
图2为本发明实施例中鸭源性引物与探针的灵敏度检测结果,其中,1号为100%的鸭肉dna,2号为10%的鸭肉dna,3号为1%的鸭肉dna,4号为0.1%的鸭肉dna,5号为0.01%的鸭肉dna,6号为0.005%的鸭肉dna。
图3为鸭源检测体系的荧光定量标准曲线。
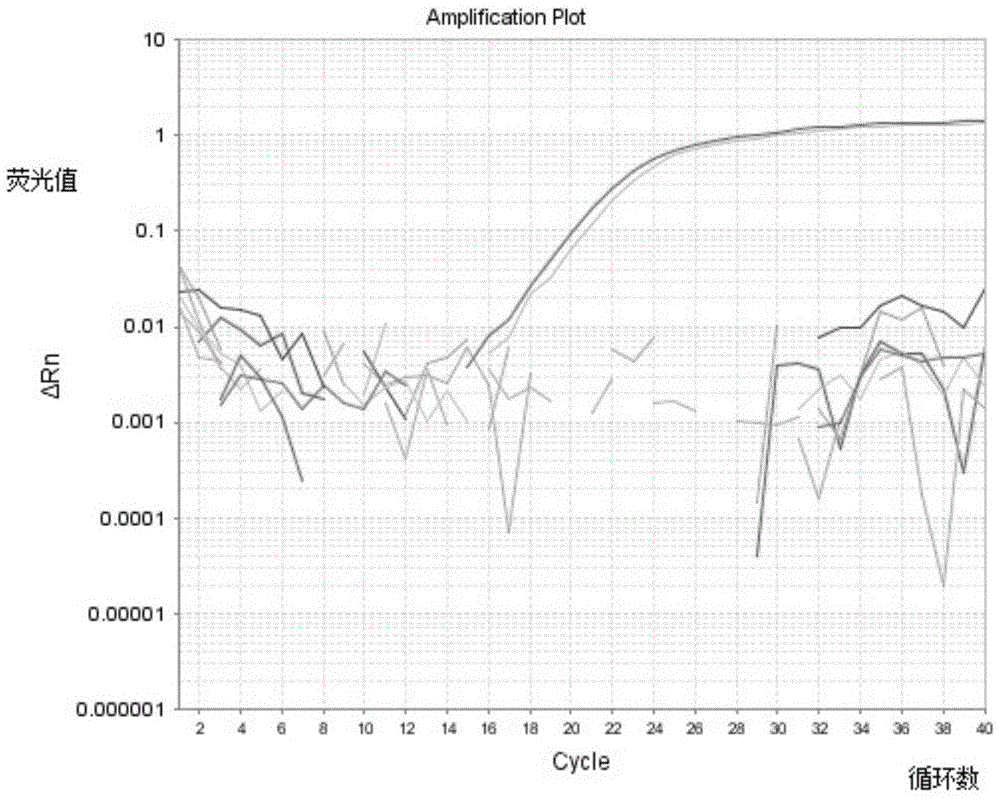
图4为混合模板的荧光定量检测结果,其中,1:100%的鸭肉dna、90%的鸭肉dna、50%的鸭肉dna的扩增曲线;2:20%的鸭肉dna和80的羊肉dna的扩增曲线;3:10%的鸭肉dna和90%的羊肉dna的扩增曲线;4:5%的鸭肉dna和95%的羊肉dna的扩增曲线;5:1%的鸭肉dna和99%的羊肉dna的扩增曲线。
具体实施方式
以下结合具体实施例对本发明作进一步说明。
本发明实施例所用鸭肉、羊肉、鸡肉、猪肉、牛肉均购于上海市超市和农贸市场,冰冻羊肉卷,肉串,羊肉饺子、牛肉粒,牛肉干等购于上海市超市和农贸市场。
quant-ittm
实施例1
1.ddpcr引物设计
以ncbigenebank数据库中鸭的线粒体基因组序列(mf069251)为模板,使用primer5设计鸭源性特异性引物及探针,并利用ncbi在线比对软件blast分析比对相近物种的基因序列,选取与其他物种序列匹配度低、差异大的引物序列,采用fam荧光基团标记鸭探针的5’端,淬灭基团mgb标记鸭探针的3’端,尽量降低本底对扩增的影响。
羊源引物与探针引用自
表1
2.特异性和灵敏度的验证
2.1特异性验证
为了检测所设计的鸭的引物与探针的特异性,采用实时荧光pcr分析了鸭源性引物与探在鸭肉、羊肉、鸡肉、牛肉和猪肉基因组dna中的扩增情况,分别提取鸭肉、羊肉、鸡肉、牛肉和猪肉的dna为模板,进行扩增,每个样品做三个重复。
qpcr扩增体系的体积为20μl,probeqpcrmix(2×)10μl,引物(10μm)各0.4μl,探针0.8μl,模板2μl,rox(50×)0.4μl,和灭菌水6μl。
反应条件为:95℃预变性30s;95℃变性5s,60℃退火延伸30s,反应循环数为40个循环。
结果如图1显示,引物只在鸭肉dna模板的反应体系中有明显的扩增曲线,且两条扩增曲线的重复性较好,而其他肉类样品dna作为模板的反应体系和空白对照组均无扩增曲线。
说明本发明的鸭源性引物与探针具有较好的特异性,重复性良好,在40个循环内与其他物种的dna无交叉反应。
2.2灵敏度验证
鸭肉的原始dna浓度为241.7ng/μl,拷贝数为1.88x105copies/μl,以10倍比进行稀释,即稀释为dna原液的100%、10%、1%、0.1%、0.01%和0.005%,对应dna原液的100%、10%、1%、0.1%、0.01%和0.005%浓度,稀释后的鸭肉的模板dna拷贝数为:1.88x105copies/μl、1.88x104copies/μl、1.88x103copies/μl、1.88x102copies/μl、18.8copies/μl、9.4copies/μl,每个梯度均取2μl为模板,每个样品三个重复,按照2.1的方法进行qpcr扩增,扩增结果如图2,可见,各个浓度梯度都能够正常扩增,三组重复性条带都基本重合,六个浓度梯度的扩增条带重复性好,6号扩增曲线为鸭肉dna浓度梯度中最低的,为12pg/μl。
构建的标准曲线方程为:ct=-3.125gm+29.126,r2=0.999(见图3),结果表明引物的检测灵敏度较高,可达到pg级。
实施例2利用ddpcr检测方法对混合模板的检测
1)将羊和鸭的dna都稀释到浓度为150ng/μl,分别按照鸭dna的比例为100%、90%、50%、20%、10%、5%进行dna混合,模拟市场上在羊肉制品中掺入鸭源成分的情况;每个模板重复3个平行检测;
2)将表1中鸭和羊的ddpcr引物对、探针加入到扩增反应体系中,利用微滴式数字pcr系统进行ddpcr扩增反应;
ddpcr扩增体系为20μl,包括10μl2×ddpcrmastermix,浓度为10μmol/l的上游引物和下游引物各1.8μl(两对)、浓度为10μmol/l的探针0.5μl(两条),dna模板1μl,h2o0.8μl。
反应过程:95℃预变性10min;94℃变性30s,60℃退火1min,40个循环;98℃固化10min;
扩增曲线参见图4,可见,对鸭肉含量在5-100%的区间中都能准确地读出鸭肉dna的含量。
3)扩增结束后,将96孔板置入微滴读取仪中读取信号,使用软件quantasoftversion1.7分析数据,获得检测结果,参见表2,使用的实验仪器为美国bio-rad公司的qx200型微滴式数字pcr系统。
表2
可见,测量值和真实值基本一致,鸭源含量比较高的样品,测量值和真实值误差比较小,鸭源含量比较低的样品,测量值和真实值的误差相对较大,但误差都在0.5%以内。
利用本发明的鸭源特异引物与探针的体系,进行ddpcr反应,对鸭源成分最低检测限为12pg/μl,对鸭肉含量在5-100%的区间中都能准确地读出鸭肉dna的含量。
- 还没有人留言评论。精彩留言会获得点赞!