基于微流控技术的超顺磁纳米微粒分离装置或分离系统在外泌体分离中的应用的制作方法
本发明属于磁分离装置技术领域,具体涉及基于微流控技术的超顺磁纳米微粒分离装置或分离系统在外泌体分离中的应用。
背景技术:
目前外泌体的分离方式包括超速离心,免疫沉淀,尺寸排阻,免疫亲和,免疫磁珠法等。超速离心是目前最常用的外泌体分离方式,但其耗时长,操作繁琐,以及特殊的仪器要求限制了该方法的临床应用;免疫沉淀法分离的外泌体存在较多的杂蛋白污染,影响外泌体的纯度;尺寸排阻等基于外泌体大小的分离方式适用于大体积样本,例如尿液,胸腹水等外泌体的分离,但存在分离时间长,滤孔易阻塞的特点,不适用于临床外泌体的分离;免疫磁珠法是基于抗原抗体的特异性反应的原理,将识别外泌体表面蛋白分子的抗体偶联在磁珠表面,增加了抗体与外泌体表面蛋白结合的表面积,可更加有效的在体液中分离外泌体。
然而,外泌体的免疫磁珠分离方法大多采用磁分离架或分离柱来实现磁珠的分离,但这些方法稳定性差,磁珠的回收率低,并且直径为3~50nm的超顺磁纳米微粒富集难度大,导致外泌体的分离效率大大降低。
技术实现要素:
有鉴于此,本发明的目的在于基于微流控技术的超顺磁纳米微粒分离装置或分离系统在外泌体分离中的应用,实现外泌体的高效分离。
本发明提供基于微流控技术的超顺磁纳米微粒分离装置或超顺磁纳米微粒分离系统在外泌体分离中的应用;
所述超顺磁纳米微粒分离装置包括分离柱和磁分离装置,所述分离柱包括分离柱柱体、连接在所述分离柱柱体一端的进样管道和连接在所述分离柱柱体另一端的出样管道;所述分离柱柱体中填充有磁性颗粒材料;
所述超顺磁纳米微粒分离系统包括所述超顺磁纳米微粒分离装置、精密微量注射泵和进样器。
优选的,所述分离柱柱体的内径为1.0~5.0mm;所述分离柱柱体的外径为1.5~5.5mm;所述分离柱柱体的垂直高度为1~8cm。
优选的,所述出样管道的内径为0.2~0.8mm;所述出样管道的外径为0.4~1.2mm;所述出样管道的长度为8~15cm。
优选的,所述进样管道的内径为0.2~0.8mm;所述进样管道的外径为0.4~1.2mm;所述进样管道的长度为8~15cm。
优选的,所述进样管道、出样管道或分离柱柱体的材料为聚四氟乙烯。
优选的,所述磁性颗粒材料为球形磁性颗粒材料;所述球形磁性颗粒材料的粒径为10~1000μm。
优选的,所述磁性颗粒材料包括镍、铬、铁或铁氧化物磁性材料。
优选的,所述外泌体分离的方法,包括以下步骤:
(1)将生物素标记的外泌体表面蛋白抗体溶液与亲和素包被的超顺磁纳米颗粒溶液混合,得到外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物;
(2)将所述外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物和外泌体样品混合反应,封闭,得到反应液;
(3)将所述分离柱预先置于磁分离装置上,将进样器吸取所述步骤(2)中的反应液后,与进样管道连接;再将进样器固定在精密微量注射泵上,设定微量注射泵的参数后进样;
(4)所述进样完成后,用进样器吸取磷酸盐缓冲液在通过精密微量注射泵控制下对所述分离柱进行冲洗;
(5)所述洗涤完成后,将所述分离柱从磁分离装置上移开,静置5~10min,在精密微量注射泵控制下洗脱捕获有外泌体的超顺磁纳米微粒。
优选的,所述微量注射泵的参数如下:通道数量优选为1~20个通道;进样速度为0.5~2ml/h,最大行程为140mm;行程分辨率为0.03125μm;线速度调节分辨率为1~5μm/min;行程控制精度为误差≤±0.5%;额定线性推力为>90n。
本发明提供了基于微流控技术的超顺磁纳米微粒分离装置或所述的超顺磁纳米微粒分离系统在外泌体分离中的应用。所述超顺磁纳米微粒分离装置是镍颗粒填充的超顺磁纳米微粒的分离柱,基于微流控技术和磁分离技术相结合,利用柱体内磁性颗粒材料在高强度外加磁场的作用下形成梯度势能场,其远大于超顺磁纳米微粒-外泌体复合物在柱内的动能,实现磁分离过程的稳定性以及有效性从而提高超顺磁纳米微粒的富集率,进而提高超顺磁纳米微粒捕获目标物的回收率。所述超顺磁纳米微粒分离系统在精密微量注射泵的精确流速控制下最大限度减少超顺磁纳米微粒-超顺磁纳米微粒-外泌体复合物的动能,使得外泌体的分离捕获效率得到显著提升。本发明基于微流控技术和磁分离技术相结合,通过增强超顺磁纳米颗粒的磁场受力,提高磁分离过程的超顺磁纳米颗粒和磁性颗粒材料结合的稳定性以及有效性,同时本发明还利用以外泌体表面蛋白抗体包被的超顺磁纳米颗粒,最大限度增加了免疫磁珠与外泌体的接触面积,实现外泌体的高效捕获。实验证明,分离外泌体达到94%的回收率,同时具有较高精密度,最低检测限为2.63×105/μl个外泌体。
附图说明
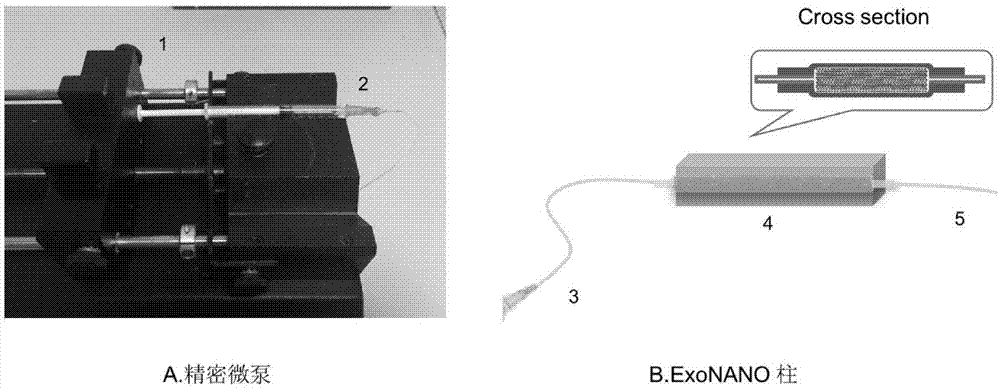
图1为本发明基于微流控技术的超顺磁纳米微粒分离系统,其中图1-a为本发明所述分离系统中的精密微量注射泵和进样器实物图,图1-b为本发明提供的超顺磁纳米微粒分离装置的实物图和示意图;1精密微量注射泵,2进样器,3进样管道,4分离柱柱体,5出样管道;
图2为实施例3中基于微流控技术的超顺磁纳米微粒分离方法分离健康志愿者血清的外泌体wb结果图;
图3为实施例3中基于微流控技术的超顺磁纳米微粒分离方法分离血清外泌体的电镜结果图,其中红色箭头标注的为外泌体,白色箭头标注的为本发明使用超顺磁纳米微粒;
图4为实施例4中基于微流控技术的超顺磁纳米微粒分离方法结合化学发光免疫分析方法检测外泌体的校准曲线图;
图5为实施例5中基于微流控技术的超顺磁纳米微粒分离方法结合化学发光免疫分析方法检测不同临床标本外泌体的结果图。
具体实施方式
本发明提供了一种基于微流控技术的超顺磁纳米微粒分离装置,包括分离柱(exonano柱)和磁分离装置,所述分离柱包括分离柱柱体、连接在所述分离柱柱体一端的进样管道和连接在所述分离柱柱体另一端的出样管道;所述分离柱柱体中填充有磁性颗粒材料。
在本发明中,本发明提供的超顺磁纳米微粒分离装置的实物图和示意图见图1-b。本发明提供的分离装置包括分离柱。所述分离柱包括分离柱柱体、进样管道和出样管道。所述分离柱柱体的内径优选为1.0~5.0mm,更优选为2~4mm,最优选为3mm。所述分离柱柱体的外径优选为1.5~5.5mm,更优选为2.5~4.5mm,最优选为3.5mm。所述分离柱柱体的垂直高度优选为1~8cm,更优选为2~7cm,最优选为5cm。所述分离柱柱体的材料为聚四氟乙烯。
在本发明中,所述磁性颗粒材料优选为球形磁性颗粒材料。所述磁性颗粒材料包括镍、铬、铁或铁氧化物磁性材料。所述球形磁性颗粒材料的粒径优选为10~1000μm,更优选为100~800μm,最优选为500μm。所述磁性颗粒材料的填充度为100%。
在本发明中,所述出样管道的内径优选为0.2~0.8mm,更优选为0.3~0.6密码,最优选为0.5cm。所述出样管道的外径优选为0.4~1.2mm,更优选为0.5~1.0mm,最优选为0.6mm。所述出样管道的长度优选为8~15cm,更优选为10~14cm,最优选为12cm。所述出样管道的材料优选为聚四氟乙烯。
在本发明中,所述进样管道的内径优选为0.2~0.8mm,更优选为0.3~0.6密码,最优选为0.5cm。所述进样管道的外径优选为0.4~1.2mm,更优选为0.5~1.0mm,最优选为0.6mm。所述进样管道的长度优选为8~15cm,更优选为10~14cm,最优选为12cm。所述进样管道的终端为进样口。所述进样管道、的材料优选为聚四氟乙烯。
在本发明中,所述分离柱柱体、进样管道和出样管道的内径、外径和长度的设置与分离时样品流速形成统一,有利于使分离载体充分暴露在强磁场力条件下,达到稳定高效富集的目的。
在本发明中,本发明提供的磁分离装置包括磁分离架。本发明对所述磁分离架的来源没有特殊限制,采用本领域技术人员所熟知的磁分离架的来源即可。
本发明提供了一种基于微流控技术的超顺磁纳米微粒分离系统,包括所述超顺磁纳米微粒分离装置、精密微量注射泵和进样器。
在本发明中,所述超顺磁纳米微粒分离系统见图1。其中图1-a为精密微量注射泵和进样器的实物图。本发明对所述精密微量注射泵的来源没有特殊限制,采用本领域技术人员所熟知的精密微量注射泵即可。在本发明实施例中,所述精密微量注射泵购买harvardapparatus公司。所述进样器优选为注射器。所述注射器的规格优选为1~5ml,更优选为1ml。本发明对所述注射器的来源没有特殊限制,采用本领域所熟知的注射器即可。
基于所述超顺磁纳米微粒分离装置或超顺磁纳米微粒分离系统的高效富集超顺磁纳米颗粒的能力,本发明提供了超顺磁纳米微粒分离装置或所述的超顺磁纳米微粒分离系统在外泌体分离中的应用。
在本发明中,所述外泌体分离的方法,优选包括以下步骤:
(1)将生物素标记的外泌体表面蛋白抗体溶液与亲和素包被的超顺磁纳米颗粒溶液混合,得到外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物;
(2)将所述外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物和外泌体样品混合反应,封闭,得到反应液;
(3)将所述分离柱预先置于磁分离装置上,将进样器吸取所述步骤(2)中的反应液后,与进样管道连接;再将进样器固定在精密微量注射泵上,设定微量注射泵的参数后进样;
(4)所述进样完成后,用进样器吸取磷酸盐缓冲液在通过精密微量注射泵控制下对所述分离柱进行冲洗;
(5)所述洗涤完成后,将所述分离柱从磁分离装置上移开,静置5~10min,在精密微量注射泵控制下洗脱捕获有外泌体的超顺磁纳米微粒。
本发明将生物素标记的外泌体表面蛋白抗体溶液与亲和素包被的超顺磁纳米颗粒溶液混合,得到外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物。
本发明对所述外泌体表面蛋白抗体没有特殊限制,采用本领域所熟知的外泌体表面蛋白抗体即可。在本发明中,所述生物素标记的外泌体表面蛋白抗体中外泌体表面蛋白抗体优选为cd63抗体。所述生物素标记的外泌体表面蛋白抗体的制备方法,优选包括以下步骤:
a.0.1mg的外泌体表面蛋白抗体和1ml的0.1mol/l,ph8.0的碳酸盐缓冲液混合,4℃透析2h,得到第一溶液;
b.0.1mgn-羟基琥珀酰亚胺生物素(nhsb)和1ml的二甲亚砜(dmso)溶液,得到第二溶液;
c.将所述第一溶液和第二溶液按体积比1:0.12混合,搅拌孵育4h后,添加1mol/lnh4cl溶液,25℃搅拌10min,反应混合液在pbs缓冲液中4℃透析,去除未标记成功的生物素,得到的生物素标记的外泌体表面蛋白抗体置于4℃保存。
在本发明中,pbs缓冲液优选包括含有0.15m氯化钠的0.01m磷酸钠混冲液,所述pbs缓冲液的ph值优选为7.4。
在本发明中,所述亲和素包被的超顺磁纳米颗粒的粒径优选为3~50nm,更优选为5~20nm,最优选为7nm。所述亲和素包被的超顺磁纳米颗粒购自oceannanotech公司。
在本发明中,所述生物素标记的外泌体表面蛋白抗体溶液和所述亲和素包被的超顺磁纳米颗粒溶液的体积比为1:10。所述生物素标记的外泌体表面蛋白抗体溶液的浓度为0.8ng/μl~2.0ng/μl,更优选为1.2ng/μl。所述所述亲和素包被的超顺磁纳米颗粒溶液的浓度优选为0.5nmol/ml~1.5nmol/ml,更优选为0.86nmol/ml。
得到外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物后,本发明将所述外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物和外泌体样品混合反应,封闭,得到反应液。
在本发明中,所述外泌体样本优选将培养的细胞利用采用差速离心的方法提取纯化外泌体。差速离心的转速为110000g。
在本发明中,所述外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物和外泌体样品的体积比为1:20。所述封闭优选采用10%牛血清白蛋白溶液。所述牛血清白蛋白溶液的加入体积与反应液加入体积呈3:1。所述反应持续时间优选为1h。外泌体表面蛋白抗体-超顺磁纳米颗粒偶合物通过外泌体表面蛋白抗体与外泌体样品中外泌体表面表达的蛋白发生特异性结合,实现与外泌体结合形成复合物。
得到反应液后,本发明将所述分离柱预先置于磁分离装置上,将进样器吸取所述反应液后,与进样管道连接;再将进样器固定在精密微量注射泵上,设定微量注射泵的参数后进样。
在本发明中,所述微量注射泵的参数优选如下:通道数量优选为1~20个通道;进样速度为0.5~2ml/h,最大行程为140mm;行程分辨率为0.03125μm;线速度调节分辨率为1~5μm/min;行程控制精度为误差≤±0.5%;额定线性推力为>90n。显示参数选择包括注射液量、流量、线速度和注射时间等;外形尺寸优选为280×250×140(mm3);噪声优选为≤20db(a);电源参数优选的为90v~260v/20w;工作环境温度为0℃~40℃;工作环境相对湿度<80%。
所述进样完成后,本发明用进样器吸取磷酸盐缓冲液在通过精密微量注射泵控制下对所述分离柱进行冲洗。
在本发明中,所述磷酸盐缓冲液的冲洗体积为1.5ml。所述磷酸盐缓冲液的浓度为0.1mol/l。所述冲洗的目的是除去未结合的超顺磁纳米颗粒偶合物和杂质。所述冲洗的速度同进样时的流速。
所述洗涤完成后,本发明将所述分离柱从磁分离装置上移开,静置5~10min,在精密微量注射泵控制下洗脱捕获有外泌体的超顺磁纳米微粒。
在本发明中,将所述分离柱从磁分离装置上移开的目的是使超顺磁纳米微粒磁力完全消失,从而实现和镍颗粒的分离。
在本发明中,所述洗脱用溶液优选为冲洗用磷酸盐缓冲液。洗脱用溶液的体积为200μl。所述洗脱时的流速同进样时流速。所述洗脱的目的是使捕获有外泌体的超顺磁纳米微粒从分离柱中洗脱出来。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
基于微流控技术的超顺磁纳米微粒分离系统及方法
基于微流控的超顺磁纳米微粒分离系统,结构如图1所示;具体包括精密微泵(图1-a)以及exonano分离柱(图1-b)。其中,精密微泵优选1ml注射器推注模式,具体包括精密微泵(1),注射器(2),exonano分离柱的结构包括进样管道(3),分离柱柱体(4)和出样管道(5),所述进样管道(3)和出样管道(5)的内径为0.2~0.8mm;所述进样管道(3)及出样管道(5)的外径为0.4~1.2mm;所述进样管道(3)及出样管道(5)长度优选为8.0~15.0cm;所述分离柱柱体(4)内球形镍微粒填充物的粒径优选的为10~1000μm;所述分离柱柱体(4)内径为1.0~5.0mm;所述分离柱柱体(4)外径的为1.5~5.5mm;所述分离柱柱体(4)长度为1~8cm。在本发明中,所述进样管道,出样管道及分离柱柱体的材料为聚四氟乙烯管。
利用微流控技术,使用精密微泵控制进样速度,优选的进样速度为0.5~2ml/h;微泵进样器优选为1~5ml注射器。
在本发明具体实施过程中,将所述exonano柱吸附在磁铁上,用注射器吸取已反应完全的样本,然后与进样口连接;再将注射器固定在精密微量注射泵上,调整微量注射泵的泵速和体积后,点击开始进样。进样完成后,用进样器吸取1.5ml磷酸盐缓冲液(pbs),在通过精密微量注射泵控制下对分离柱内物质进行冲洗;洗涤完毕后,转移exonano柱,静置5~10min,待超顺磁纳米微粒磁力完全消失后,通过精密微量注射泵用200μlpbs缓冲液冲洗分离柱内超顺磁纳米微粒。本发明中所述精密微量注射泵进样流速0.5~2ml/h;洗涤流速调节范围为0.1~5.0ml/h;所述精密微量注射泵的通道数量为1~20个通道;进样速度为0.5~2ml/h,最大行程为140mm;行程分辨率为0.03125μm;线速度调节分辨率为1~5μm/min;行程控制精度误差≤±0.5%;额定线性推力>90n。
实施例2
基于微流控技术的超顺磁纳米微粒分离系统分离培养上清的外泌体
用含10%胎牛血清(fbs)的rpmi1640培养胰腺癌细胞系panc-1,采用差速离心的方法提取纯化外泌体并用本领域常规westernblot方法鉴定外泌体上蛋白cd9、cd63、tsg101、gapdh、β-actin的表达,利用纳米颗粒追踪技术检测检测外泌体的浓度及粒径。
将生物素标记的cd63抗体与亲和素包被的超顺磁纳米颗粒以及相应体积的外泌体加入到1.5ml离心管,加入等量10%牛血清白蛋白(bsa)室温混匀反应1h。
用实施例1中的分离方法,将所述exonano柱吸附在磁铁上,用注射器吸取已反应完全的样本,然后与进样口连接;再将注射器固定在精密微量注射泵上,调整微量注射泵的泵速和体积后,点击开始进样。进样完成后,用进样器吸取1.5ml磷酸盐缓冲液(pbs)洗涤液,在通过精密微量注射泵控制下对分离柱内物质进行冲洗;洗涤完毕后,转移exonano柱,静置5~10min,待超顺磁纳米微粒磁力完全消失后,通过精密微量注射泵用100μlpbs冲洗分离柱内超顺磁纳米微粒及外泌体。利用纳米颗粒追踪技术检测分离后的外泌体个数,计算回收率。实验结果显示对外泌体分离率达94%。
实施例3
基于微流控技术的超顺磁纳米微粒分离系统分离健康志愿者血清的外泌体
收集健康志愿者的血清,10000g离心30min去除大囊泡后,取100μl血清加入生物素标记的cd63抗体与亲和素包被的超顺磁纳米颗粒,室温混匀反应1h。
用实施例2中的分离方法,将所述exonano柱吸附在磁铁上,用注射器吸取已反应完全的样本,然后与进样口连接;再将注射器固定在精密微量注射泵上,调整微量注射泵的泵速和体积后,点击开始进样。进样完成后,用进样器吸取1.5ml磷酸盐缓冲液(pbs)洗涤液,在通过精密微量注射泵控制下对分离柱内物质进行冲洗;洗涤完毕后,转移exonano柱,静置5~10min,待超顺磁纳米微粒磁力完全消失后,通过精密微量注射泵用100μl蛋白裂解液(ripa)冲洗分离柱内超顺磁纳米微粒。冰上裂解40min后,取裂解液经过westernblot鉴定捕获的外泌体上蛋白cd9、cd63、tsg101、gapdh、β-actin的表达,结果见图2。将超顺磁纳米微粒收集到相应试管内,经过透射电镜观察,结果如图3显示:分离到的囊泡大小为100~150nm,使用超顺磁纳米微粒分离到外泌体。
实施例4
基于微流控技术的超顺磁纳米微粒的分离方法结合化学发光免疫分析方法定量检测外泌体
用含10%胎牛血清(fbs)的rpmi1640培养胰腺癌细胞系panc-1,采用差速离心的方法提取纯化外泌体并用westernblot鉴定外泌体上蛋白cd9、cd63、tsg101、gapdh、β-actin的表达。采用纳米粒子跟踪分析技术分析外泌体的浓度,分装并-80℃保存,作为后续实验的校准品原液使用。
将生物素标记的cd63抗体与亲和素包被的超顺磁纳米颗粒以及定量的样本加入50μl胎牛血清,模拟基质效应,反应1h。
用实施例2中的分离方法,将所述exonano柱吸附在磁铁上,用注射器吸取已反应完全的样本,然后与进样区的进样口连接;再将注射器固定在精密微量注射泵上,调整微量注射泵的泵速和体积后,点击开始进样。进样完成后,用进样器吸取1.5ml磷酸盐缓冲液(pbs)作为洗涤液,在通过精密微量注射泵控制下对分离柱进行冲洗;洗涤完毕后,转移exonano柱,静置5~10min,待超顺磁纳米微粒磁力完全消失后,通过精密微量注射泵用150μl过氧化氢溶液(h2o2)冲洗分离柱内超顺磁纳米微粒。将超顺磁纳米微粒收集到相应试管内,加入150μl氢氧化钠溶液(naoh)后。本发明中优选的对校准品进行赋值后,绘制以校准品中外泌体个数为横坐标,以发光值为纵坐标的标准曲线,结果如图4完成定量检测外泌体的标准曲线。
实验结果显示本专利方法定量检测外泌体的性能指标如下:
(1)精密度:本发明的基于微流控技术的超顺磁纳米微粒的分离方法结合化学发光免疫分析方法定量检测外泌体,具有较高精密度,其批内变异系数(cv)<10%,日间变异系数(cv)<15%。
(2)分析线性测量范围:本发明的方法在2.92×105~2.80×108particles/μl之间呈现良好的线性关系(r2=0.9913)。
(3)最低检测限:本发明方法的最低检测限为2.63×105/μl外泌体。
实施例5
基于微流控技术的超顺磁纳米微粒的分离方法结合化学发光免疫分析方法检测临床标本外泌体
收集血液,尿液,唾液,脑脊液,胸水和腹水标本,各标本在4℃下300g离心30min去除细胞,10000g离心20min去除大囊泡,去掉沉淀留取上清。
将生物素标记的cd63抗体与亲和素包被的超顺磁纳米颗粒以及定量的样本加入50μl胎牛血清,模拟基质效应,反应1h。
采用具体实施方案4中方法,将所述exonano柱吸附在磁铁上,用注射器吸取已反应完全的样本,然后与进样区的进样口连接;再将注射器固定在精密微量注射泵上,调整微量注射泵的泵速和体积后,点击开始进样。进样完成后,用进样器吸取1.5ml磷酸盐缓冲液(pbs)洗涤液,在通过精密微量注射泵控制下对分离柱进行冲洗;洗涤完毕后,转移exonano柱,静置5~10min,待超顺磁纳米微粒磁力完全消失后,通过精密微量注射泵用150μl过氧化氢溶液(h2o2)冲洗分离柱内超顺磁纳米微粒。将超顺磁纳米微粒收集到相应试管内,加入150μl氢氧化钠溶液(naoh)后。测试得到的结果带入相应的标准曲线,得到相应的外泌体浓度,检测结果如图5所示。基于微流控技术的超顺磁纳米微粒的分离方法结合化学发光免疫分析方法可检测临床标本外泌体血液,尿液,唾液,脑脊液,胸水和腹水标本。
由上述实施例可知,本发明提供的一种基于微流控技术的超顺磁纳米微粒分离外泌体的系统及方法,在磁性分子筛和高强度外加磁场的共同作用下实现对结合有外泌体的超顺磁纳米微粒的快速有效分离。利于实现简便、快速分离捕获外泌体的超顺磁纳米微粒的、利于定量检测特异性外泌体。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!