用于检测和鉴别微生物培养样品中的微生物的方法、系统和装置与流程
本发明所公开的主题涉及用于检测、鉴别和定量培养样品中的微生物的方法、系统和装置。更具体地说,所述主题涉及使用指示剂粒子来检测和鉴别能够支持微生物生长的生物防护样品中的一种或多种微生物。
背景技术:
检测微生物培养物中的临床样品(例如,血液、粪便、尿液等)中的低水平的微生物(包括病原体)的能力在近年来已经获得了显著的重要性。类似地,微生物培养对于检测如食品、化妆品和药品等工业样品中的微生物(包括病原体)的公共卫生是重要的。检测这些微生物的能力不仅提供了用于处理已经被暴露的人们的技术,而且用于可以防止暴露的情况,例如当测试食品样品时。
食源性疾病不仅在卫生方面、而且在卫生保健成本方面对社会有显著影响。据cdc估计,每年约1/6的美国人(或4800万人)患病,128,000人住院,并且3,000人死于食源性疾病(参看http://www.cdc.gov/foodsafety/facts.html)。还估计,食源性疾病在美国每年造成1520亿美元用于卫生相关的花费,特别是对于由弯曲菌属的种(campylobacterspp.)、沙门氏菌(salmonella)、单核细胞增生性李斯特菌(listeriamonocytogenes)和大肠杆菌(e.coli)引起的细菌感染(参看http://www.producesafetyproject.org/admin/assets/files/health-related-foodborne-illness-costs-report.pdf-1.pdf)。
在美国所见的食品安全的当前水平是政府法规与受市场激励(如法律责任、品牌价值、信誉和出售更多食品产品的希望)影响的行业自我监测组合的结果。在美国,负责食品安全的主要机构是美国农业部(u.sdepartmentofagriculture;usda)食品安全检验局(foodsafetyandinspectionservice;fsis),其负责肉类、家禽和经加工的蛋制品的安全;以及食品和药物管理局(foodanddrugadministration;fda),其负责几乎所有的其它食品。在1996年,usda的fsis颁布了病原体减少危害分析关键控制点(pr/haccp)条例,其例如授权屠宰厂进行通用大肠杆菌测试。其它fsis法规对两种致命的病原体-即食肉类和家禽中的单核细胞增生性李斯特菌和碎牛肉中的大肠杆菌o157:h7强制执行零界限(参看http://www.ers.usda.gov/briefing/foodsafety/private.htm)。最近,国会批准通过了食品安全现代化法案(foodsafetymodernizationact),在过去几年里食源性疾病的持续爆发--从菠菜到胡椒到花生强调了这项立法的迫切性。
食品测试可以对食品样品本身进行,即最终产品材料、中间物或引入的原材料。另外,实施haccp(危害分析和关键控制点(hazardanalysisandcriticalcontrolpoint))计划以控制生产环境,从而使病原体引入到食品样品中的风险最小化。作为许多haccp计划的一部分,从表面、地板、排水管和加工设备获取环境样品,然后针对病原性生物体的存在和不存在进行分析。如果检测到病原体的话,那么可以将其分离并且对其进行进一步确认性测试。
现今,所进行的所有食品病原体测试都需要培养步骤来富集样品中所含的潜在低水平的微生物。在培养样品之后,移出一部分并且针对病原体的存在进行测试。培养后的病原体测试可以通过免疫试验(例如,biomerieux的
对于临床样品(如血液)来说存在类似的问题。自从20世纪80年代中期以来,伴随着免疫功能不全的患者群体的规模扩大,由机会性病原体(如酵母、真菌和分枝杆菌)引起的败血症的发生率已经上升。菌血症(血流中存在细菌)和真菌血症(血流中存在真菌或酵母)通常通过收集静脉血液样品并且将血液样品安置在含有适合于促进所关注的细菌或真菌生长的生长培养基的血液培养瓶中来检测。一般参看reimer等人,"updateondetectionofbacteremiaandfungemia",clinicalmicrobiologyreviews10(3),444-465(1997)。然后,可以将血液培养样品孵育一段时间并且间歇性地检查细菌或真菌生长的指征。
在本领域中已知用于监测血液培养瓶中的细菌或真菌生长的仪器化方法通常检测血液培养瓶中二氧化碳和/或氧浓度的变化。这些仪器检测微生物的存在和不存在,但不是特异性地针对所存在的特定类型的生物体。对于名义上无菌的样品(如血液)来说,样品中的微生物检测可以指示严重的疾病。然而,阳性结果被认为是部分或初步结果并且通常不是可行的。因为疾病的最佳治疗依赖于生物体的鉴别以及其抗生素敏感性的确定,所以实验室人员必须可推进阳性培养物到完全鉴别(id)和抗微生物敏感性测试(ast)。生物体的鉴别需要实验室人员取得阳性血液培养样品用于进一步样品处理。
阳性血液培养结果,即指示微生物的存在但没有指示微生物的身份的结果之后的样品处理常常包括将微生物归类为两大类生物体之一:革兰氏阳性或革兰氏阴性。基于在培养过程中检测co2或o2的血液培养试验无法区分如金黄色葡萄球菌(s.aureus)的病原性生物体与如表皮葡萄球菌(s.epidermidis)的污染物,因为这些方法仅仅对生长和不存在生长敏感。生物体的分类和鉴别是在检测血液培养样品中的生长之后进行。举例来说,试剂盒可用于区分葡萄球菌(staphylococcus)和链球菌(streptococcus)种与其它生物体。试剂盒还可用于区分如金黄色葡萄球菌和表皮葡萄球菌的生物体。然而,这些试剂盒需要从血液培养瓶中移出至少等分试样的血液培养样品以及可能潜在地使操作人员暴露于病原体或破坏一部分可以用于其它分析的血液培养物的其它程序。试剂盒还通常需要受培训的实验室工作人员可进行测试,这潜在地导致了当实验室人员不可进行另外测试(例如,在仅单班作业的医院中)时在血液培养样品变成阳性的情况下可行的临床结果的延迟。
虽然现今存在仪器来检测血液中微生物的存在或不存在(例如,通过使用二氧化碳或氧传感器),但这些仪器通常不适用于非无菌样品,如粪便或食品样品。对于如食品等样品来说,预期存在显著浓度的良性微生物,并且因此用二氧化碳或氧传感器检测生物体本质上不适用。对于食品样品来说,关键是在高的良性微生物群落的背景下检测低水平的病原性生物体的存在以避免食源性疾病的传播。
因此,需要用于不仅检测在名义上无菌的样品的培养步骤期间生物体的存在或不存在,而且鉴别生物体的方法、系统和装置。对于如粪便和食品等非无菌样品来说,还需要用于以生物防护方式鉴别培养物中潜在有害的生物体的方法、系统和装置。这些方法、系统和装置使使用者干预最小化,从而使时间、受培训的人员加上人员和环境对病原体的潜在暴露减到最少。
技术实现要素:
本发明所公开的主题的实施方案提供了用于检测微生物培养物中的特定微生物的存在、量和/或身份的方法、系统和装置。根据一个实施方案,本发明所公开的试验可以在培养器皿内进行,以使得特定微生物的检测和/或鉴别与培养相结合来进行,而不需要使用者干预。一种或多种微生物可以在单一培养物内鉴别。可以对培养器皿完全进行生物防护以使得微生物的生长以及微生物的检测和鉴别可以在不暴露使用者或周围环境的情况下发生。此外,归因于培养物的生物防护,培养物的分析可以在不需要使用者取得培养物或洗涤培养物的情况下发生。
光学活性的指示剂粒子,如各自与对所关注的一种或多种微生物具有亲和力的一种或多种特异性结合成员缔合的表面增强拉曼散射(surfaceenhancedramanscattering;sers)活性纳米粒子,可以与微生物培养样品中的特定微生物形成复合物。因此,光学活性的指示剂粒子可以是能够产生光信号的任何粒子,这种光信号可以在没有洗涤步骤的情况下在培养样品中检测到。此外,也与对所关注的一种或多种微生物具有亲和力的一种或多种特异性结合成员(其和与指示剂粒子缔合的特异性结合成员可以是相同的或不同的)缔合的磁性捕获粒子可以用于捕获微生物-指示剂粒子复合物并且使复合物集中在试验器皿的局部区域中以供后续检测。重要地,本发明所公开的方法、系统和装置的实施方案允许“实时”检测和鉴别正在发生微生物的活性生长的样品中的微生物。样品可以包括包含以下的微生物培养物:生长培养基和来自人或动物(驯养的或原种的)的临床样品,如血液、粪便、尿液或脑脊液。样品还可以包括包含以下的微生物培养物:生长培养基和工业样品,如食品、奶制品、饮料、水、环境、农产品、个人护理产品(包括化妆品)、生物技术或药品。重要地,试验可以在不使使用者或环境暴露于样品(“封闭系统”)的情况下以生物防护方式进行,并且可以通过在培养进行时随着时间监测试验信号来提供自动的、昼夜不停的微生物检测和鉴别。检测和鉴别与微生物培养的组合可以使得可行的结果较早可用。
通过本发明对微生物的检测可以直接或间接进行。对于在培养物中生长的微生物的直接检测来说,与磁性捕获粒子和指示剂粒子缔合的特异性结合成员可以对基本完好的微生物具有亲和力,例如通过结合到细菌或酵母的表面。对于间接检测来说,与磁性捕获粒子和指示剂粒子缔合的结合成员可以对微生物的副产物具有亲和力。副产物的实例可以包括(但不限于)分泌蛋白、毒素和细胞壁组分。直接和间接检测模式可以单独或组合使用。
根据本发明的另一个实施方案,提供一种用于计量所需量的培养样品的器皿。所述器皿包括用于在其中接收培养样品的容器,其中所述容器具有开口端和封闭端。所述器皿还包括被配置成以流体密封连接方式啮合容器的开口端的盖子。另外,所述器皿包括耦合到盖子并且包括一个或多个储集器的筐体,其中所述筐体被安置在所述容器的开口端与封闭端之间。在使用多个储集器的情况下,每个储集器被配置成容纳不同体积的培养样品。此外,所述器皿包括一个或多个与盖子啮合的针组件,其中所述针组件包括在相应的储集器内延伸的针。每个针被配置成选择性地抽取相应的储集器中所含的样品,其中每个针被进一步配置成啮合小瓶用于以生物防护方式将样品从储集器转移到所述小瓶。因此,所述器皿可以适合于计量所需量的样品用于在单一容器中进行两种不同的试验(例如,沙门氏菌或李斯特菌),同时有助于以生物防护方式将样品转移到检测小瓶。在本发明的另一个实施方案中,用于接收样品的试验小瓶由被配置成保持真空的塞子或隔片和顶帽密封。在试验小瓶顶帽与计量器皿上的含有针的兼容端口连接时,样品以生物防护方式转移。小瓶顶帽含有用以保留外部挤出的流体以防转移并且保护使用者以免与转移表面接触的特征。
本发明的另一个实施方案是针对一种用于自动处理多个含有培养样品的管的系统。所述系统包括用于在其中接收多个样品管的孵育箱,其中所述孵育箱被配置成在预定温度下孵育样品管。举例来说,这些管可以水平地并且彼此相邻地定位。根据一个实施方案,孵育箱可以被配置成在不同温度下孵育不同试验。所述系统进一步包括耦合到托盘并且被配置成在孵育箱内移动样品管的第一平移装置(例如,沿着y轴移动的“y台”),其中第一平移装置被进一步配置成将样品管从孵育箱移动到检测区并且搅动检测区内的样品管。举例来说,第一平移装置可以沿着其纵轴移动样品管。所述系统还包括被配置成将磁场施加到检测区内的多个样品管的磁体组件,以及被配置成询查检测区内的多个样品管中的每一个用于检测一种或多种微生物的光学装置。所述系统包括耦合到光学装置并且被配置成移动检测区内的光学装置用于询查样品管中的每一个的第二平移装置(例如,沿着x轴移动的“x台”)。所述系统还可以包括耦合到磁体组件和光学装置并且被配置成移动检测区内的磁体组件和光学装置以接近垂直堆叠在第一托盘上方的管的另一个托盘的第三平移装置(例如,沿着z轴移动的“z台”)。因此,所述系统提供了用于在孵育培养管期间实时处理多个样品的自动化和高通量系统。
附图说明
已经这样概括地描述了本发明所公开的主题,现在将参考附图,这些附图不一定按比例绘制,并且其中:
图1是示出根据本发明的一个实施方案检测和鉴别培养样品中的微生物的方法的示意图。
图2是示出根据本发明的一个实施方案用于容纳和转移培养样品的富集器皿和检测小瓶的示意图。
图3是示出根据本发明的一个实施方案间歇性地检测和鉴别培养样品中的微生物的方法的示意图。
图4是示出根据本发明的一个实施方案实时检测和鉴别培养样品中的微生物的方法的示意图。
图5a-5e说明了根据本发明的一个实施方案的富集器皿的各种视图。
图6是根据本发明的一个实施方案的富集器皿的横断面视图。
图7是根据本发明的一个实施方案的富集器皿的分解图。
图8是根据本发明的一个实施方案的富集器皿的盖子的底视图。
图9a-9c是根据本发明的一个实施方案的富集器皿的筐体的各种视图。
图10a和10b说明了根据本发明的一个实施方案的检测小瓶的顶帽。
图11a和11b说明了根据本发明的一个实施方案的检测小瓶的顶帽。
图12是根据本发明的一个实施方案啮合检测小瓶的顶帽的横断面视图。
图13a和13b是根据本发明的一个实施方案啮合检测小瓶的顶帽的透视图和分解图。
图14a和14b是根据本发明的一个实施方案啮合检测小瓶的顶帽的透视图和分解图。
图15是根据本发明的一个实施方案啮合富集器皿的检测小瓶的横断面视图。
图16和17是根据本发明的一个实施方案啮合富集器皿的检测小瓶的横断面视图。
图18是示出根据本发明的一个实施方案在培养瓶内的磁性捕获粒子-微生物-sers活性指示剂粒子复合物的示意图。
图19描绘了根据本发明的一个实施方案的sers活性指示剂粒子。
图20描绘了根据本发明的一个实施方案的sers活性指示剂粒子。
图21描绘了根据本发明的一个实施方案的sers活性指示剂粒子。
图22示出了根据本发明的一个实施方案与4,4'-联吡啶(dipy)拉曼活性染料缔合的sers活性指示剂粒子的代表性sers光谱。
图23示出了根据本发明的一个实施方案针对沙门氏菌在整个培养时间上绘制的代表性sers信号。
图24描绘了根据本发明的一个实施方案用于实时监测微生物生长的系统。
图25描绘了根据本发明的另一个实施方案用于实时监测微生物生长的系统。
图26-29说明了根据本发明的一个另外的实施方案用于实时监测微生物生长的系统的各种视图。
图30是根据本发明的一个实施方案用于固持样品管的托盘的透视图。
图31说明了根据本发明的一个实施方案用于将样品管加载到托盘中,将托盘加载到孵育箱中以及从孵育箱中移出托盘的顺序步骤。
图32是根据本发明的另一个实施方案用于固持样品管的托盘的透视图。
图33a-33c是根据本发明的多个实施方案用于固持样品管的托盘的部分视图。
图34是根据本发明的一个实施方案的孵育箱的透视图。
图35-39是图26-29中所示的系统的各种横断面视图。
图40是根据本发明的一个实施方案的孵育箱的后门的放大视图。
图41是根据本发明的一个实施方案的x台的透视图。
图42是根据本发明的一个实施方案的磁体组件、x台和z台的透视图。
图43是根据本发明的一个实施方案处于降低位置的磁体组件、团化/读出组件、x台、y台和z台的侧视图。
图44是图26-29中所示的系统的另一个透视图。
图45和46是根据本发明的一个实施方案的磁体组件、团化/读出组件和x台的部分透视图。
图47是根据本发明的一个实施方案的磁体组件和y台的部分透视图。
图48a-48b是根据本发明的实施方案用于实时监测在柜中密封的微生物生长的系统的透视图。
图49说明了根据本发明的一个实施方案用于搅动和团化培养样品的方法。
图50描绘了根据本发明的一个实施方案的团化和光学系统。
图51和52说明了根据本发明的实施方案用于团化培养样品的替代性磁体排列。
图53描绘了根据本发明的一个实施方案的金黄色葡萄球菌和表皮葡萄球菌的多重检测。
图54示出了比较在有和没有适合用于本发明的多个实施方案中的sershnw试剂的情况下血液培养样品的大肠杆菌生长的检测时间的实验的结果。
图55示出了根据本发明的一个实施方案监测团化对肠道沙门氏菌(salmonellaenterica)亚种血清型鼠伤寒肠道沙门氏菌(entericaserovartyphimurium),此后被称作鼠伤寒沙门氏菌(salmonellatyphimurium)(或其它血清型沙门氏菌名称)的生长的影响的图表。
图56示出了根据本发明的一个实施方案说明团化对微生物生长的影响的图表。
图57说明了根据一个实施方案在用固定磁体团化之后水中的sers-磁性珠粒预复合物(pc)的图像。
图58a-58b是根据一个实施方案使用固定磁体和不同搅动频率在sdix沙门氏菌二级培养基中pc团块形成的图像。
图59a-59b是根据一个实施方案使用耦合磁体和不同搅动频率在sdix沙门氏菌二级培养基中pc团块形成的图像。
图60示出了根据本发明的一个实施方案使用单重sers检测比较血液中的白色念珠菌(c.albicans)的检测时间的图表。
图61示出了根据本发明的一个实施方案使用多重sers方法比较血液中的白色念珠菌的检测时间的图表。
图62示出了根据本发明的一个实施方案使用多重sers方法比较血液中的大肠杆菌和表皮葡萄球菌的检测时间的图表。
图63说明了根据本发明的一个实施方案使用需氧培养基和抗生素吸收树脂实时检测血液中的大肠杆菌的图表。
图64示出了根据本发明的一个实施方案针对不同样品体积检测血液中的大肠杆菌的图表。
图65a示出了根据一个实施方案在鼠伤寒沙门氏菌的二次富集期间带有在多个时间捕获的图像的sers曲线。
图65b示出了根据一个实施方案在阴性样品的二次富集期间带有在多个时间捕获的图像的sers曲线。
图65c示出了根据一个实施方案在鼠伤寒沙门氏菌的二次富集期间带有在多个时间捕获的图像的sers曲线。
图66示出了根据一个实施方案在鼠伤寒沙门氏菌的二次富集期间对于不同搅动速率的叠加sers曲线。
图67示出了根据本发明的一个实施方案分别对于阳性样品和阴性样品的团块的图像。
图68a-68c说明了根据本发明的实施方案在食品样品的培养期间实时检测大肠杆菌的sers曲线。
图69说明了根据本发明的一个实施方案在食品样品的培养期间实时检测肠炎沙门氏菌(salmonellaenteritidis)的sers曲线。
图70说明了根据本发明的一个实施方案在培养期间实时检测从不锈钢上擦拭的李斯特菌的sers曲线。
图71示出了根据本发明的一个实施方案使用线性搅动检测鼠伤寒沙门氏菌的阶段的流程图。
图72说明了根据本发明的一个实施方案在鼠伤寒沙门氏菌、肠炎沙门氏菌和阴性样品的二次富集期间的叠加sers曲线。
图73示出了根据本发明的一个实施方案在鼠伤寒沙门氏菌的二次富集期间形成的团块的图像。
图74示出了根据一个实施方案在肠炎沙门氏菌(s.enteritidis)和肯塔基沙门氏菌(s.kentucky)的二次富集期间从摇摆搅动和线性搅动获得的sers曲线。
图75示出了根据本发明的一个实施方案在有和没有sers试剂的情况下含有在edta兔血浆中的金黄色葡萄球菌和表皮葡萄球菌的样品管的图像。
图76示出了根据本发明的一个实施方案在有和没有sers试剂的情况下使用金黄色葡萄球菌和表皮葡萄球菌的乳胶凝集试验的图像。
图77是根据本发明的一个实施方案的磁性粒子与sers标签的混合物的革兰氏染色的放大图像。
图78是根据本发明的一个实施方案在有磁性粒子和sers标签的情况下金黄色葡萄球菌和大肠杆菌的革兰氏染色对照的放大图像。
图79示出了根据本发明的实施方案在有sers试剂的情况下使用金黄色葡萄球菌和表皮葡萄球菌的血液培养物划线的chromagar金黄色葡萄球菌板的图像。
图80是根据本发明的一个实施方案在有sensi-disctm测试纸锭的情况下使用大肠杆菌的血液培养物划线的琼脂板的图像。
图81是示出根据本发明的一个实施方案在有和没有试剂的情况下大肠杆菌的区直径测量值的表格。
图82是示出根据本发明的一个实施方案在有和没有sers试剂的情况下使用bdsensi-discstm和多种微生物的人工抗生素敏感性测试的结果的汇总的表格。
图83示出了根据本发明的一个实施方案在有和没有试剂的情况下使用大肠杆菌和白色念珠菌的血液培养物划线并且覆盖有抗真菌bdtaxotm纸锭的琼脂板的图像。
图84是示出根据本发明的一个实施方案在沙门氏菌二级培养基中使用不同搅动频率和团化时间形成的团块的图像的表格。
图85是示出根据本发明的一个实施方案的搅动频率对团块分散的影响的表格。
图86说明了根据本发明的另一个实施方案的富集器皿。
图87是根据本发明的一个实施方案的注射器的横断面视图。
图88是根据本发明的一个实施方案与富集器皿啮合的注射器的横断面视图。
图89a-89c是根据本发明的多个实施方案与富集器皿啮合的注射器的放大横断面视图。
图90a和90b是根据本发明的一个实施方案的注射器的放大横断面视图。
图91是根据本发明的一个实施方案的注射器的横断面视图和柱塞的透视图。
图92是根据本发明的另一个实施方案的注射器的横断面视图和柱塞的透视图。
图93-95说明了根据本发明的多个实施方案的复原台。
图96是根据本发明的一个实施方案的所制造的荧光二氧化硅纳米粒子的图像。
图97示出了描绘根据本发明的一个实施方案的所制造的荧光二氧化硅纳米粒子和常规sers标签的信号强度的图表。
图98示出了描绘根据本发明的一个实施方案用于检测菠菜中李斯特菌的存在的所制造的荧光二氧化硅纳米粒子和常规sers标签的信号强度随时间而变的图表。
图99示出了描绘根据本发明的一个实施方案用于检测甘蓝中李斯特菌的存在的所制造的荧光二氧化硅纳米粒子和常规sers标签的信号强度随时间而变的图表。
图100是根据本发明的一个实施方案的富集器皿的容器的透视图。
图101是根据本发明的一个实施方案的富集器皿的盖子的顶视图。
图102是图101中所示的盖子的底视图。
图103是图101中所示的盖子的底透视图。
图104是图101中所示的盖子的侧视图。
图105是图101中所示的盖子的横断面视图。
图106是根据本发明的一个实施方案的富集器皿的筐体的侧视图。
图107是图106中所示的筐体的顶视图。
图108是图106中所示的筐体的底视图。
图109是图106中所示的筐体的透视图。
发明详述
现在将在下文中参考附图来更充分地描述本发明所公开的主题,在这些附图中示出了本发明所公开的主题的一些但不是所有实施方案。本文中阐述的本发明所公开的主题的许多修改和其它实施方案将被具有前述描述和相关图示中所呈现的教义的权益的本发明所公开的主题所属领域的技术人员所想到。因此,应了解,本发明所公开的主题并不限于所公开的特定实施方案,并且修改和其它实施方案意图被包括在随附权利要求书的范围内。尽管本文中采用特定术语,但其仅以一般和描述性的意义使用并且不是出于限制的目的。
术语“一个(a/an)”和“所述”当在本申请(包括权利要求书)中使用时指的是“一个或多个”。因此,举例来说,提及“一个样品”包括多个样品,除非上下文明显是相反的(例如,多个样品),等等。
在本说明书和权利要求书通篇,词语“包含”以非排他的意义使用,上下文另有要求的情况除外。
如本文所用的术语“约”当指的是一个值时意味着涵盖指定值和其变化。这些变化可以是在一些实施方案中指定量±100%、在一些实施方案中±50%、在一些实施方案中±20%、在一些实施方案中±10%、在一些实施方案中±5%、在一些实施方案中±1%、在一些实施方案中±0.5%以及在一些实施方案中±0.1%,因为这些变化适于进行所公开的方法或采用所公开的组成。
此外,当量、浓度或其它值或参数以范围、优选范围、或上限优选值和下限优选值的清单给出时,这应被理解为特定地公开由任何对的范围上限或优选值和任何范围下限或优选值形成的所有范围,不论范围是否独立地公开。在本文中叙述数值的范围的情况下,除非另有规定,否则范围意图包括其端点以及在这个范围内的所有整数和分数。本发明所公开的主题的范围并不意图限于在定义范围时所叙述的特定值。
本发明的实施方案提供了利用指示剂粒子(例如,表面增强拉曼散射(sers)活性指示剂粒子),用于通过均质免洗试验(hnw)检测和/或鉴别细菌培养样品中的一种或多种微生物的系统和方法。更具体地说,本发明的实施方案描述了用于随着样品内的微生物水平随时间而增加来“实时”监测微生物浓度的技术。指示剂粒子与对受测试的一种或多种微生物具有亲和力的一种或多种特异性结合成员缔合。当与含有所关注的一种或多种微生物的微生物培养样品接触时,在所关注的一种或多种微生物和与特异性结合成员缔合的指示剂粒子之间可以形成复合物,一般在本文中被称作指示剂粒子-微生物复合物。指示剂粒子-微生物复合物可以被磁性捕获粒子捕获并且集中起来以在局部区域(即,“测量区”)中形成团块以用于通过测量信号(例如,sers光谱)和/或视觉检查团块的图像进行检测。如本文所用的术语“团块”并不意味着限制,并且在一个实施方案中指的是通过施加磁场而促进定位在局部区域中的多个指示剂粒子和磁性捕获粒子的集合,其中这个团块使用视觉、光学或其它适合手段可检测。团块还可以包括在之间捕获的微生物(如果存在的话),并且其它组分和/或微生物可以非特异性地附接到磁性粒子。团块可以暂时形成,因为如下文更详细地论述,在去除磁场后团块即可分散。
此外,本发明的多个实施方案关于通过随着时间形成、分散和再形成团块而在相同微生物培养样品内重复进行hnw试验的能力。这能够在微生物培养样品内实时监测特定分析物的浓度并且当微生物浓度随时间变化(例如,响应于细菌生长)时特别有价值。更具体地说,本发明的实施方案关于在微生物培养器皿内进行hnw试验,从而同时检测和鉴别生长中的微生物的能力。另外,这种技术可以与监测培养样品的其它方法(如气体传感器或图像分析)联合使用。
根据本发明的一个实施方案,在器皿中进行样品的微生物培养,所述器皿还含有hnw试剂。将培养器皿插入到允许在受控的温度下孵育并且含有光学装置(例如,拉曼光学装置、拉曼激光器和分光计)的仪器中。在培养期间以规律的时间间隔施加磁场,并且从磁性团块读出sers信号。团块在读数之间分散以允许试剂与样品继续相互作用。随着目标生物体浓度在整个富集过程中增加,一旦微生物浓度达到sers技术的检测阈,即通过这种技术进行微生物的检测和鉴别。在培养期间连续监测sers信号的能力确保了使用最低必需培养时间并且当检测和鉴别微生物时仪器可以自动地向使用者发警报。
另一个实施方案使用相机来监测在hnw试验期间团块的形成和尺寸,所述试验在培养器皿内含有经偶联的指示剂粒子和磁性珠粒以及经靶向的病原体。随着hnw试验进行,从相机视图的图像显示,团块尺寸增大,并且在一些情况下团块消失。团块尺寸的生长和/或团块的消失是经靶向的病原体存在的指示。在含有经偶联的指示剂粒子和磁性珠粒并且没有病原体的样品分析期间所捕获的图像显示团块尺寸没有变化并且没有团块消失。这种检测方法可以单独或与另一种检测方法联合使用。
i.检测和鉴别微生物培养样品中的微生物的一般考虑
如本文所用的术语“微生物培养样品”指的是包含具有含微生物的潜力的“临床”或“工业”样品的组合物,这种样品被安置在培养基(例如,血液培养肉汤)中、与培养基混合或以其它方式组合,这种培养基能够支持疑似存在于样品中的一种或多种微生物的生长。更具体地说,本发明所公开的主题的实施方案提供了用于检测微生物培养样品中的微生物的方法、系统和装置,其包括能够支持如血液、粪便、尿液或脑脊液的临床样品中或如食品、环境棉签或海绵、水、化妆品、卫生产品、药品或打算被动物或人类使用或消耗的其它产品的工业产品样品中的微生物生长的培养基。
尤其使用光学或光谱测定方法检测和/或鉴别微生物培养样品中的微生物,由于样品基质的复杂性而可能存在许多挑战。临床样品,特别是如血液或粪便的那些样品,是光吸收的,这使得在没有洗涤或溶胞步骤来去除原始样品的光学干扰组分的情况下难以检测光学或光谱信号。工业样品,如食品或化妆品样品,可能是光吸收的,再次需要洗涤或溶胞步骤来去除原始样品中的光学干扰物。尽管已经报道了在血液和食品样品存在下应用sers来检测哺乳动物细胞和微生物并且诊断应用sers活性指示剂粒子来检测多种分析物,但应用sers活性指示剂粒子来“实时”监测细菌和真菌浓度,因为尚未报道由于微生物生长引起的浓度变化。如本文所用的“实时”并不意味着限制并且可以指的是连续或以预定的时间增量监测培养样品。举例来说,可以在没有打开样品管,从而维持样品的生物防护的情况下,经预定的孵育时段,以预定的时间增量(例如,每30分钟、1小时等)重复测试培养样品。如本文所用的“生物防护”也并不意味着限制并且可以指的是培养样品处于封闭系统中,以使得培养样品所局限的容器外的周围环境并不暴露于所培养的微生物。
此外,本发明所公开的方法允许在微生物培养物中以不会抑制受检测的微生物的生长的方式诊断使用指示剂粒子。
检测在微生物生长期间病原体的存在或不存在的当前方法,例如血液培养柜,并不特异性地检测生物体,而是检测代谢的非特异性产物(例如,二氧化碳)。因此,这些传感器可能潜在地被其它过程所产生的二氧化碳误触发,这些过程如氧化、降解以及作为血液样品中的正常菌丛的血液培养细胞(例如,哺乳动物细胞)的呼吸。这种显著的‘血液背景’信号是重要的噪声源,这使正性算法变复杂并且降低总体分析灵敏度。如本发明所公开的方法中所描述,由特异性结合事件产生的信号将为病原体存在的明显指示并且将不太可能被曲解。
本发明的多个实施方案允许全部处于单一小瓶的几何形状内的连续生长、检测和鉴别。sershnw技术能够使得培养系统能提供关于生长的阳性样品连同另外的鉴别信息(例如,革兰氏染色信息或鉴别)的昼夜不停的(24小时/一周7天)警报。与当前市场上的检测生长的不存在或存在的血液培养系统成对比,sershnw试验可以提供微生物或微生物种类的鉴别。可以选择偶联到sers和磁性粒子的抗体以特异性地鉴别革兰氏阳性对比革兰氏阴性细菌。重要地,sers技术的固有的多重能力是血液培养和工业应用的关键。
现有基于气体的传感器,如血液培养柜中所用的那些,不适合于检测其中存在预期高水平的背景良性微生物的样品(例如粪便、食品或环境样品)中病原性微生物的存在。当前没有已知的用于食品或环境样品内的实时病原体检测的方法,因为这些类型的样品通常具有在培养期间也生长的背景(良性)微生物,所以基于生长的传感器不能区分背景生物体的生长与目标病原体的生长。
另外,用于微生物鉴别的现有方法需要样品制备和/或洗涤步骤的组合来去除干扰组分,使背景信号减到最小,和/或产生光学透明的样品。因为样品制备和洗涤的需要,所以不能在正在进行的培养中应用这些方法。
sers-hnw试验通过产生可以在脏的或未分离的样品中读出的拉曼信号来克服需要洗涤步骤的问题。这个试验还能够在复杂基质中进行多重检测和鉴别,从而使其适用于血流感染或食品病原体的多重检测。先前已经公开了hnw试验的这些属性。然而,在所有已知的先前公开中,将hnw试验单次应用到单一样品,即,形成一个团块并且读出以产生“应答”(鉴别+检测)。尚未指示hnw试验的进行将与培养中的实时监测的特定要求相容,具体地说:
-需要维持培养物的活力(与微生物形成复合物不能抑制生长);
-一旦磁性团块已经形成,即能够可靠地并且可重现地分散磁性团块以使sers和磁性试剂能够与样品继续相互作用;
-sershnw试验信号能够响应目标浓度的连续变化而增加和减小;以及
-能够以大体积进行hnw试验,例如通常用于血液培养和工业应用中的大体积,因为将初始预期试剂体积要求将是成本高昂的和/或将不能形成代表整个体积的团块。(将预期任何大小合理的磁场仅仅从局部微环境牵引磁性粒子。)
根据本发明的一个实施方案的hnw试验可以用于检测在食品或环境样品中生长的病原体,如大肠杆菌、李斯特菌、沙门氏菌等。因为甚至单一的受损生物体的存在是显著的,所以通常培养样品以使病原体恢复并选择性地生长到可检测水平。因为初始样品可能具有一定范围的病原体浓度、不同水平的病原体损伤和/或高度可变的竞争性背景微生物,所以达到任何给定的分析方法的检测限所需的培养时间可以广泛变化。出于这个原因,通常制定检测方案用于“最坏情况”的情形,即,选择培养时间长度以确保单一的受损病原体生长到可检测水平。然后,在培养完成时进行病原体的检测和鉴别(例如,通过免疫试验或pcr)。因为预先不能知晓在任何给定的样品中病原体的初始负荷,所以对所有样品进行这个长培养方案以确保没有漏掉病原体。然而,可能许多样品在较短的培养方案之后将得到阳性检测和鉴别,从而向测试者提供样品有问题的较早通知。基于sers的hnw试验与培养的组合允许在整个培养中实时监测样品中的病原体负荷,从而提供在培养方案中尽可能早地检测具有较高病原体负荷的样品的显著优势。
ii.用于鉴别微生物培养样品中的微生物的系统、方法和装置
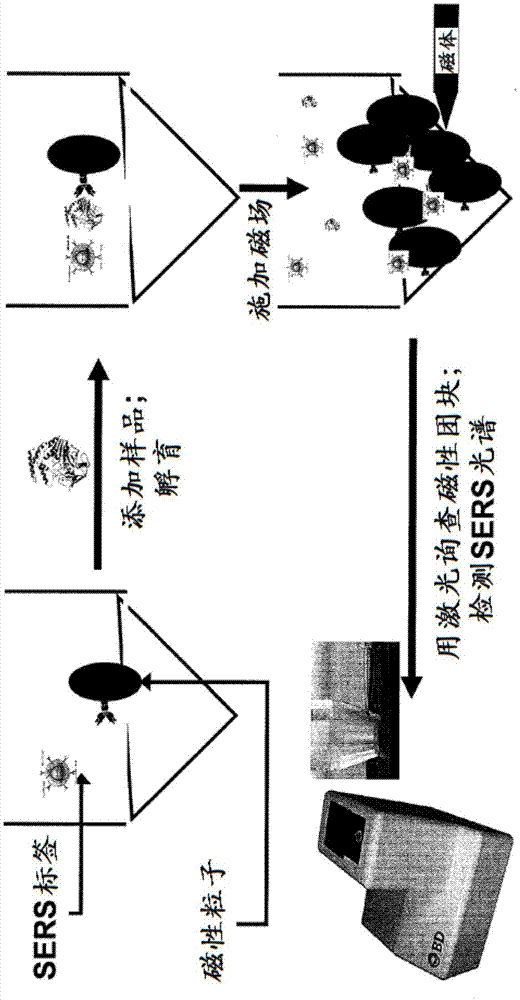
本发明的实施方案是针对用于检测和鉴别培养样品中的微生物的方法、系统和装置。参考图1,过程一般包括在器皿中提供多个指示剂粒子、结合成员和磁性捕获粒子以及添加可能包括一种或多种微生物的样品。器皿还可以包括培养或生长培养基以有助于微生物的选择性或另外生长。然后孵育样品并且搅动一段预定的时间。在孵育过程中在所选的时间点或按预定的时程,将磁场施加到器皿以形成团块。然后用光源询查团块以产生检测和分析的可检测信号(例如,sers光谱)。然后可以使团块分散并且在下一个确定的时间点重复这个过程。
图2示出了可以用于检测和鉴别培养样品中的微生物的方法和装置的一个实施方案。在这点上,图2说明了获得所需体积的环境样品(例如,约1l或更少)、食品样品(例如,约25g至375g,得到约250ml至3l的体积)或临床样品(例如,约100ml或更少)并且放在富集器皿中。在这种情况下,富集器皿被配置成有助于沙门氏菌或李斯特菌试验的分析。将富集器皿孵育一段预定的时间,之后以生物防护方式将预定量的样品转移到检测小瓶,这将在下文进一步详细地解释。然后,将检测小瓶放在实时sers系统中用于进一步孵育和使用sers技术自动分析,这也在下文进一步详细地论述。
根据一个实施方案,sers系统被配置成容纳多个检测小瓶并且从而提供高通量系统。sers系统还可以被配置成有助于多个不同试验的自动分析。举例来说,sers系统可以包括用于每个试验的处理和分析的专用区。
根据本发明的实施方案的系统和方法提供微生物培养样品中的微生物生长的实时监测。图3示出了微生物生长的间歇性监测的实施方案或终点实施方案。在这个实施方案中,将sershnw试剂1添加到进行培养的器皿2中。将培养基3和样品4添加到器皿2中,并且将器皿2放到孵育箱5中以允许微生物(例如细菌、酵母或细胞)生长。在使用者选择的时间点(在培养期间或在培养时段结束时),将器皿从孵育箱5中移出并且放在sers读出器6中,所述读出器(在适当混合样品之后)形成磁性团块并且读出拉曼信号。然后,如果没有检测到拉曼信号,那么可以将器皿再插入到孵育箱5中以给予进一步生长的时间。
图4示出了在细菌生长期间连续监测sers信号的替代性实施方案。在这个实施方案中,将孵育箱和sers读出器集成为单一仪器7,所述单一仪器在规定的时间点形成磁性团块,读出sers信号,并且使试剂分散,而不需要使用者干预。
a.富集器皿和检测小瓶
在一些实施方案中,适合与本发明所公开的方法、系统和装置一起使用的微生物培养瓶、管、注射器、小瓶、器皿等(例如,富集器皿和检测小瓶)可以由玻璃或塑料制成。在一些应用中,多层塑料对于控制透气性是理想的。在微生物培养器皿由多层塑料制成的那些实施方案中,瓶子可以是注塑成型或吹塑成型的并且具有聚酯、聚丙烯、聚乙烯、聚氯乙烯、聚碳酸酯、聚对苯二甲酸乙二醇酯(pet)、环烯烃共聚物(coc)或其任何共聚物或混合物的内层和外层,其由尼龙、乙烯乙烯醇(evoh)、聚乙烯乙烯醇或其共聚物或混合物的中间层隔开。然而,应了解,器皿在其它实施方案中可能不是多层的并且使用类似技术(例如,注塑成型或吹塑成型)形成。在一些应用中,可以用表面涂布或化学方法处理器皿的组分以控制器皿/样品相互作用或物理特性。在一些实施方案中,器皿可以对可见光辐射透明,不过在特定实施方案中,这种透明度不是必需的。另外,在一些实施方案中,本发明所公开的器皿可以适合灭菌。此外,在一些实施方案中,器皿适合于需氧或厌氧培养。在一个实施方案中,器皿是透气的。另外,器皿可以包括沿着其长度恒定的壁厚,这可以增强团化和光学分析。
图5a-5e和图7描绘了根据本发明的一个实施方案的富集器皿50。任选地,富集器皿50可以容纳经干燥的培养基或肉汤。富集器皿一般包括盖子52、筐体54、针组件56和容器58。盖子52与筐体54啮合并且被配置成以流体密封连接方式啮合并密封容器58,例如使用螺纹或卡扣配合附接。在一个实例中,盖子52可以被拧到容器58上,但将包括一个或多个回退特征以防止在没有另外脱离回退特征(例如,下压并旋转盖子以去除)的情况下拧松盖子。因此,盖子52、针组件56和筐体54可以耦合在一起以使得能够作为一个单元啮合并脱离容器58。举例来说,盖子52和筐体54可以按卡扣配合方式或使用其它适合的技术耦合在一起,这些技术如粘合剂、热熔或紧固件。在这点上,图9c说明了筐体54可以包括紧固件孔60用于与紧固件62啮合以将盖子和筐体紧固在一起(也参看图5a)。图8示出了包括多个孔65的盖子底部,这些孔与筐体上的相应的孔60对齐(参看图9c)用于接收通过其的紧固件62。同样地,针组件56可以使用类似的紧固技术附接到盖子52,这些技术如压紧配合、螺纹啮合或粘合剂。容器58被配置成在内部容纳所需量的样品,并且因此根据需要可以是各种尺寸和形状。举例来说,图5a-5c、图7和图100说明了容器58的示例性的形状。在一个实施方案中,筐体54和容器58可以是透明的或半透明的以促进容器内的可见性并且特别是储集器64、66内的样品的可见性。另外,图100说明了容器58可以包括一个或多个体积线59用于使容器中所含的样品量可见。图7还说明了器皿50可以包括用于确保盖子52与容器58之间的流体密封连接的垫圈68或其它密封元件。
富集器皿50包括一对针组件56和储集器64、66。然而,应了解,在替代性实施方案中可以存在一个或多个针组件56和储集器64、66。在所说明的实施方案中,一个针组件56和储集器64或66经过配置以供与特定类型的试验(例如,沙门氏菌或李斯特菌)一起使用。因为使用不同培养基和样品尺寸来培养不同微生物,所以富集器皿有助于使用单一筐体用于不同试验。
图9a-9c中更详细地示出了筐体54。筐体54包括一对储集器64、66,其中每个储集器被配置成容纳预定的样品体积。如所示,储集器64、66远离容器58的底部隔开,其中这个空间被配置成容纳所需的样品。在这点上,第一储集器66被配置成容纳比第二储集器64更大的体积。在一个特定实施方案中,第一储集器66被配置成容纳约5ml并且第二储集器64被配置成容纳约100μl。如所示,储集器64、66可以经过定形以有助于样品计量以及与相应的针组件56对齐。举例来说,图5a-5c和图6说明了每个针70被插入到储集器64、66内并且达到其中的最低位置以确保移出基本上所有经计量的样品。因此,针70的长度可以视储集器的尺寸作调整,这是因为在第一储集器66内延伸的针长于在第二储集器64内延伸的针。储集器64、66的形状可以是适合于保留所需量的样品的任何形状。举例来说,图5a、5b、5c、5e和9b示出了第二储集器64具有一般呈圆锥的形状,而第一储集器66具有沿着针和锥体朝着针的基底延伸的表面。
图9c特别说明了筐体54包括通过其界定的许多孔72、74。通常,容器58中的样品量在容器处于直立位置时将低于孔72,但将至少低于每个储集器64、66的入口以使得可以计量所需的体积。孔72可以被界定于邻近储集器的筐体内,而孔74可以被界定通过邻近盖子啮合部分78的筐体的上表面76。定位于邻近储集器64、66的孔72被配置成排出相应的储集器内的过量样品。就是说,当富集器皿50从直立水平位置倾斜以填充储集器64、66之一时,使器皿返回到直立位置使得储集器被样品过度填充并且过量样品将随后通过孔72排出。这样的话,在每个储集器64、66内以可重复的方式计量所需的体积。在筐体54的上表面76中界定的孔74可以用于允许样品进入储集器64、66,同时也防止样品中不需要的颗粒被转移到储集器中。应了解,筐体54可以视将要计量的样品量和样品的类型作修改,例如通过修改储集器64、66的尺寸和深度以及孔的尺寸和深度。在这点上,图9c说明了孔72、74可以在彼此不同的方向上呈锥形以帮助排出,其中邻近储集器的孔72的入口大于筐体的上表面76中的孔74的入口。较小孔入口可以用于过滤任何不合需要的粒子以免进入储集器。另外,图106-109说明了这样一个实施方案,其中筐体54包括大约相同尺寸的孔72、74。此外,筐体54还可以包括被配置成帮助流体通过筐体排出的肋条75或其它凸起表面。具体地说,肋条75可以处于筐体54的中心以通过向能够排出高于筐体的过量流体的表面提供与筐体的上表面76中的其余孔不同的排出特征而有助于在过滤和排出期间排气。图106和108说明了这样一个实施方案,其中储集器64、66的底表面可以包括一个或多个凸出119,其通过从储集器中吸收流体并且允许来自多个排出孔72的流体合并来帮助排出。
如图9b中所示,每个储集器64、66与筐体的上表面76被相应的顶部空间80、82分隔开。顶部空间80、82允许当容器倾斜时样品容易地进入相应的储集器64、66。因此,当容器58倾斜时,样品通过在筐体54的上表面76中界定的孔74进入到顶部空间80或82中,并且进入储集器64或66。当容器58返回到直立位置时,储集器64或66由于过量样品位于顶部空间80或82中而被过度填充,其中过量样品然后通过邻近储集器界定的孔72排出并且回到容器中。如图9b中所示,邻近储集器64、66界定的孔72定位在通到储集器中的开口下方以有助于排出和计量所需量的样品。
每个储集器64、66与如图5a-5c和图6中所示的相应的针组件56对齐。在一个实施方案中,盖子52包括盖子啮合部分78,其中盖子啮合部分被配置成如上文所论述将筐体54和盖子耦合在一起。盖子啮合部分78和筐体54具有比容器58的开口的内径小的外径以被配置成插入到容器内。盖子啮合部分78还可以包括用于接收延伸到储集器64、66中的相应的针组件56的开口。针70定位在盖子啮合部分78内以使得针被配置成啮合如下文进一步详细论述的检测小瓶。在这点上,盖子啮合部分78包括与相应的开口102、104相对的圆锥或锥形表面105,这个开口被配置成接收针组件56并与其啮合。针70进一步延伸通过在圆锥表面105的底部界定的相应的开口到达顶部空间80、82中以及相应的储集器64、66内(参看图5a-5c和图6)。图6说明了每个针组件56可以与盖子啮合部分78啮合以使得针70延伸到最接近储集器64、66。图6说明了盖子52还可以包括在内部界定的排气口86以允许任何无害的气态副产物从容器中逸出,从而防止在培养期间压力积累。图102-103和105说明了一个替代性实施方案,其中排气柱125从盖子52的底表面延伸。排气柱125界定通过其的开口用于接收和啮合过滤器以过滤退出容器58的任何气态副产物。排气柱125与排气口86对齐。在这点上,排气柱125被配置成引导无害的气态副产物通过排气柱中的开口并且通过在盖子52的上表面中界定的排气口86。
图102-103和105还说明了盖子52可以进一步包括从盖子的底表面向外延伸的啮合柱127。如图106、107和109中所示,啮合柱127被配置成与从筐体54的上表面向外延伸的对应的啮合柱129对齐并啮合。如所说明,啮合柱127具有比啮合柱129小的直径,不过这些柱的相对尺寸必要时可以反过来。另外,图103-105中所示的啮合部分78被配置成啮合在筐体54的上表面上界定的对应的啮合部分121(参看图106、107和109)。具体地说,啮合部分78可以定尺寸并且被配置成覆盖并包围啮合部分121。啮合121表面的外周可以界定多个肋条123。当使啮合表面78和121彼此啮合(例如,通过相对于彼此滑动和/或旋转)时,肋条可以被配置成压缩肋条123。压缩可以足够在盖子52与筐体54之间形成摩擦配合。在一个实施方案中,肋条123可以被压碎或以其它方式变形以形成摩擦配合。
每个针组件56被配置成啮合相应的检测小瓶100。检测小瓶100可以包括特定的顶帽配置用于与在盖子52中界定的相应的开口102、104搭配。因此,每个顶帽可以与特定类型的样品相结合以使得使用微生物的错误培养基的风险降到最低。举例来说,盖子52可以包括当顶帽被定向为啮合键槽110时仅允许与检测小瓶的顶帽搭配的键控开口104(参看图6)。图101示出了盖子52的一个替代性实施方案,其中键槽110被界定为沿着开口104的长度,包括沿着圆锥表面105。键槽110可以被界定在开口的内表面上(如图6中所示),或在开口的内表面和外表面两者上(如图101-103中所示)。
图10a和10b说明了适合与检测小瓶一起使用的顶帽106的一个示例性的实施方案。在这点上,顶帽106包括多个肋条108,这些肋条被配置成啮合在盖子52的开口104中界定的相应的键槽110(参看图5d)。因此,为了将顶帽106插入到开口104内,肋条108将需要在键槽110内径向对齐。另外,顶帽106包括多个啮合特征112,这些啮合特征被配置成以卡扣配合方式啮合检测小瓶100。卡扣连接可以使检测小瓶100的椭圆化以及在操作期间顶帽106的变位减到最小。应了解,顶帽106和检测小瓶100可以使用其它适合的技术紧固在一起,这些技术如螺纹或卷曲套管/顶帽啮合、粘合剂、超声波焊接和/或热熔。图13a说明了根据本发明的一个实施方案与检测小瓶100啮合的顶帽106。
如上文所提及,顶帽106可以具有用于不同试验的不同配置以使得使用不正确的检测小瓶100的风险被消除。举例来说,图11a和11b说明了一个替代性顶帽114配置,而图14a示出了与检测小瓶100啮合的顶帽114。如所说明,每个顶帽106、114可以包括多个肋条108和啮合特征112。顶帽114可以被配置成被接收在相应的开口102内,不过开口不需要包括对应的键槽。因此,顶帽114可以被接收在开口102内而与其径向取向无关,但顶帽114将不能被插入到开口104内。因此,顶帽106的肋条108可以防止接近盖子52中的开口102,正如顶帽114的外径可以防止接近开口104一样。
图12、图13b和图14b说明了根据本发明的一个实施方案的检测小瓶100和顶帽114的另外特征。就是说,顶帽114包括塞子116和安置在顶帽与塞子之间的吸收垫118。吸收垫118可以用于吸收在将样品从富集器皿50转移到检测小瓶中之后退出检测小瓶100的任何样品,从而使得对技术人员或环境的暴露减到最小。顶帽114还可以具有指状托脚117以防止可能潮湿的衬垫的偶然接触。此外,塞子116可以是任何适合的材料,其被配置成与检测小瓶100(即,液体和气体)形成流体密封连接,以及被针刺穿以在被针刺穿之后再密封成流体密封连接并且啮合检测小瓶。举例来说,塞子116可以是适合的橡胶或弹性体材料。图12还说明了啮合特征112与检测小瓶100的凸出115之间的啮合。因此,顶帽106、114可以按卡扣配合方式与检测小瓶100啮合,这将防止顶帽的无意去除或变位。凸出115的形状可以是将允许与啮合特征112保持卡扣配合的任何形状。
检测小瓶100可以包括试剂和任选的培养基,例如特定生长培养基,这取决于样品中正在测试的微生物。试剂和培养基可以按经干燥(例如,脱水)的形式或潮湿(例如,水合)的形式存在于检测小瓶中。举例来说,培养基和试剂可以经干燥。检测小瓶100还可以在塞子116与其啮合时容纳真空。因此,当将检测小瓶100插入到盖子52中的相应的开口102、104内时,塞子116和吸收垫118被针70刺穿,并且储集器64或66内的样品被牵引通过针并且进入检测小瓶中(参看图15-17)。在一个实例中,延伸到开口102或104中的针70的部分可以包括保护套管120,这个保护套管被配置成随着检测小瓶100被向下推并且与针啮合而被压缩。当保护套管120被压缩时,针70暴露出来并且穿透塞子116,从而允许真空牵引储集器64或66内所含的样品部分。在完成流体转移并且移出检测小瓶100之后,保护套管120返回到其原始形状,从而罩盖针70。这样的话,富集器皿50与检测小瓶100之间的样品转移以生物防护方式进行。每个检测小瓶100内的真空可以是足以从储集器中牵引所需量的样品的任何量(例如,对于5ml样品来说8-10ml的抽吸容量)。检测小瓶100中任何进一步过量的真空被来自储集器64或66的流体之后的空气排空。
检测小瓶100可以提供有试剂、有或没有培养基或生长培养基、塞子116、垫118和顶帽106或114、带真空或不带真空,这取决于最终使用者(例如,外包使用对比内部使用)。在这方面,检测小瓶100可以仅组装到塞子116用于仅保留试剂,而顶帽106或114向需要接近检测小瓶的内部的使用者独立地提供。或者,如图12中所示,检测小瓶100可以预组装有塞子116、垫118和顶帽106、114组合。此外,根据一个实施方案,培养基和试剂的量是由检测小瓶100而不是初始富集体积决定。
这样的话,富集器皿50和检测小瓶100的配置能够含有样品并且以生物防护方式转移,从而限制暴露于技术人员或设施。富集器皿50还有助于精确计量所需体积的样品,同时也被配置成容纳多种类型的样品。举例来说,这可以特别适用于沙门氏菌和李斯特菌,其中利用不同试验、培养基和样品量。富集器皿50和检测小瓶100也被配置成通过在富集器皿与检测小瓶之间并有搭配特征来降低不正确的小瓶将用于测试的风险。
图86和88说明了富集器皿125的另一个实施方案。如前述,器皿125包括以流体密封方式与容器128啮合的盖子126。如所示,富集器皿125包括从盖子126延伸并且进入容器128中的纵向注射器支柱130。注射器支柱130可以附接到盖子126,或可以与其一体成型。注射器支柱130包括被配置成在内部接收注射器134的开口132,并且一般定形为与注射器134成搭配关系。在注射器支柱130的基底处啮合包括针座133和针135的针组件,其中针座与注射器支柱啮合,并且针在容器128内延伸并且被配置成通过其抽吸样品。针135可以包括在注射器134内的针部分上延伸的可压缩盖罩141。如也在上文所论述,盖子126可以包括排气口131以允许无害的气态副产物从容器中逸出。
图87说明了注射器134的一个实施方案,其一般包括把柄136、耦合到把柄的柱塞杆137、顶帽138、耦合到柱塞杆末端的柱塞139、隔片140和密封件146。图87进一步说明了注射器134被配置成啮合开口132,例如使用扭锁式接口142,用于支持在将样品从容器128中抽吸出的同时所施加的牵引力。因此,柱塞137在注射器134内可纵向位移。隔片140被配置成用针刺穿并且在去除针后再密封。在其它实施方案中,隔片140还包括吸收垫和托脚特征以防止由于可能通过隔片逸出的任何流体而对使用者造成污染。密封件146与注射器134和顶帽138啮合以形成流体密封连接。注射器134还可以包括安置在开口132内的第一较大孔口149和包括第二较小孔口151的颈区157。如图87和88中所示,延伸段153从颈区157延伸并且进入较大孔口149中以使得较小孔口151的一部分在较大孔口149内延伸。如下文更详细地论述,可能存在一个或多个在延伸段153与颈区157的基底之间界定的狭缝或开口155。
图89a-89c说明了当将样品从容器128中移出并且进入注射器134中时,初始位置、“软”停止和“硬”停止的进程。如图89a中所示,当注射器134与注射器支柱130啮合时,柱塞139定位在邻近处于初始位置的针135并且被配置成压缩盖罩141以允许容器128与注射器134之间经由针流体连通。图88进一步说明了针135被配置成当注射器134与注射器支柱130啮合时穿透隔片140。随着柱塞杆137从注射器134向外牵引,样品的一部分144被牵引通过针135并且进入孔口151中,并且柱塞杆上的第一啮合特征145啮合密封件146以停止其进一步抽取。以这种方式,样品按所需的速率抽取,借此,流体能够追及真空以防止下吸样品。
在图89c中,柱塞杆137从注射器134进一步抽出,借此,柱塞杆137上的第二啮合特征147啮合密封件146以防止柱塞杆进一步抽出。另外,第一啮合特征145在密封件146中所界定的囊148内啮合,这防止柱塞杆137在注射器134外进一步位移。如图89c中所示,柱塞139可以被安置在注射器134的延伸段153内以使得由于柱塞杆137和柱塞139经过定位以使孔口151不再关闭而可能不会进一步抽真空。就是说,当柱塞139不再罩盖开口155时,孔口149和151彼此流体连通以使得不再抽真空。此外,柱塞杆137与密封件146的啮合防止柱塞杆牵引回到注射器134中,同时还防止使用者进一步抽出柱塞以及冒险暴露于样品。
图90a和90b说明了柱塞杆137的另一个实施方案。柱塞杆137包括被配置成在顶帽138内所界定的狭缝内滑动的纵向肋条159。此外,图90b示出了柱塞137能够被扭转而使肋条159与狭缝脱离并且啮合顶帽138以防止柱塞返回到注射器134中。
图91和92说明了替代性的柱塞杆和柱塞,其可以用于从容器128中抽取不同体积。在这点上,图91对应于结合图87、88和图89a-c所描述者。因此,柱塞139适合于抽取较小体积到较小孔口151中(例如,约125μl)。因此,柱塞的尺寸和柱塞杆的长度可以根据需要而变化。在另一个实施方案中,图92示出了柱塞161,其适合于抽取样品到较大孔口149中(例如,约5ml)。因此,注射器134适合与不同柱塞一起使用以抽取不同体积的样品,这在测试不同微生物(例如,李斯特菌和沙门氏菌)时是适用的。此外,使用者可以接收预组装的注射器134和柱塞/柱塞杆,或使用者能够添加试剂、复原流体等,然后将柱塞/柱塞杆组装到注射器。
根据本发明的一个实施方案用于检测和鉴别微生物培养样品中的一种或多种微生物的方法可以在微生物培养器皿中进行。微生物培养器皿可以在内部安置有一种或多种指示剂粒子和一种或多种磁性捕获粒子,各自与对受测试的一种或多种微生物具有亲和力的一种或多种结合成员(例如,抗体)缔合。指示剂粒子和磁性捕获粒子可以在内部安置疑似含有受测试的一种或多种微生物的临床或工业样品之前、同时或之后被安置在微生物培养器皿中。培养物生长培养基可以在添加临床或工业样品之前、同时或之后被安置在微生物培养器皿中。一旦已经将指示剂粒子、磁性捕获粒子、培养基和临床或工业样品引入到培养器皿中,然后即连续或间歇性地搅动培养器皿以混合指示剂粒子和磁性捕获粒子与组合的样品和培养基。在本文所描述的优选实施方案中,搅动型态(例如,速度和/或位移)可以在培养或读出周期的不同阶段变化。当存在于临床或工业样品中时,受测试的一种或多种微生物可以结合与指示剂粒子和磁性捕获粒子缔合的一种或多种结合成员以形成磁性捕获粒子-微生物-指示剂粒子复合物。
在指示剂粒子是sers活性的情况下,图18示出了在培养器皿2内的磁性捕获粒子-微生物-sers活性指示剂粒子复合物的一个实例。sers活性指示剂粒子10与对受测试的一种或多种微生物12具有亲和力的一种或多种特异性结合成员11缔合。磁性捕获粒子13也与对受测试的一种或多种微生物12具有亲和力的一种或多种特异性结合成员14缔合。磁性捕获粒子13可以结合到一种或多种微生物12,这一种或多种微生物还可以结合到sers活性粒子10,以形成磁性捕获粒子-微生物-sers活性粒子复合物,在本文中也被称作夹心复合物,其中微生物同时被一种以上特异性结合成员结合。在这种特定的夹心复合物中,至少一种特异性结合成员14附接到磁性捕获粒子13,并且至少一种其它特异性结合成员11附接到sers活性指示剂粒子10。因此,微生物12被“夹入”磁性捕获粒子13与sers活性指示剂粒子10之间。
磁场经由磁体15施加到样品以吸引磁性捕获粒子13,从而使磁性捕获粒子-微生物-sers活性指示剂粒子复合物局部化为在培养器皿2内部的测量区9内的团块用于检测sers信号。然后可以在团块处引导来自光源16的辐射,并且可以通过拉曼检测器17来检测sers信号。光源16和检测器17分别用于诱导和测量由sers活性指示剂粒子10产生的拉曼特征图。磁性捕获粒子-微生物-sers活性指示剂粒子复合物的局部化提供了sers信号,其强度反映微生物浓度,这是通过使结合到磁性粒子的sers活性指示剂粒子局部化到检测区中而达成,从而使其与保留在溶液中的未结合的sers活性指示剂粒子隔离来达成。
在一些实施方案中,测量区可以沿着微生物培养瓶或器皿的内表面定位。举例来说,就瓶而言,测量区可以沿着以下内表面定位:在瓶颈内或邻近瓶颈的内表面;包含瓶中部的内表面;或沿着邻近例如独立的传感器的瓶基底的内表面,这种传感器如基于荧光的传感器或基于比色的传感器;或在不存在独立的传感器的实施方案中,沿着微生物培养瓶的基底(即,底部)的内表面定位。在一个优选实施方案中,测量区沿着一般处于培养瓶或器皿的中部的内表面定位。因此,测量区可以定位在瓶或器皿的中心或相比瓶或器皿的末端更接近瓶或器皿的中心(例如,在器皿的中间50%以内)。
只有在微生物在团块中作为结合成员-微生物-指示剂粒子复合物的一部分而结合时才实现所关注的一种或多种微生物的检测和/或鉴别。就是说,当一种或多种微生物不存在于微生物培养样品中,或如果存在的话,微生物不具有由与指示剂粒子缔合的结合成员识别的表位时,不会产生信号。在这样的情况下,指示剂粒子基本上不存在于测量区中。
如果在施加磁场并且光学询查团块后没有观测到显著的sers信号,那么牵引到团块中的磁性粒子可以分散回到溶液中以与样品继续相互作用。如果微生物的存在低于技术的检测限,那么微生物浓度可以在微生物于培养基中生长时随着时间而增加以使得最终在未来施加磁场后即在测量区中检测到sers信号。本质上,形成磁性团块,进行光学询查,分散,使其与样品相互作用,然后以指定的频率再形成,直到从结合成员-微生物-指示剂粒子复合物观测到信号或确定样品对于所关注的微生物呈阴性。在这整个过程中的多个阶段搅动培养器皿可以起到关键作用。搅动是为了多种目的。第一,其确保了sers和磁性粒子与样品和培养基的混合,从而允许形成结合成员-微生物-指示剂粒子复合物。第二,其确保了磁性粒子在形成团块后即分散回到溶液中。第三,在一个优选实施方案中,搅动可以在施加磁场的同时发生。在施加磁场期间的搅动使来自培养器皿内的各个空间点的流体进入局部化磁场的区域中,从而确保从局部化磁场外部的样品区域收集磁性粒子。最后,在含有颗粒(例如树脂、木炭或碳酸钙)的样品中,在团化之前和期间的搅动可以限制沉降到检测区域中并且干扰光信号的这些颗粒的数目。不同搅动速率和型态可以对于这些不同功能中的每一个是最佳的。
举例来说,不同搅动速率(即,频率)和“行程”(即,沿着轴的小瓶位移)可以用于测量周期的不同阶段。在一个示例性的实施方案中,测量周期可以包括混合、预先团块分散、团化、读出和分散,其中每个阶段具有特定的搅动速率和行程。在这点上,混合包括在孵育期间发生搅动的阶段,而预先团块分散在混合之后和团化之前发生。团化在预先团块分散之后进行并且继之以读出阶段。读出阶段对应于通过读出头询查小瓶,而分散阶段是为了将要在小瓶内再分散的团块而提供。在阶段之间可能存在或可能不存在延迟。在一个实施方案中,阶段的搅动速率和行程可以分别在约0至3hz和约0至100mm的范围内。举例来说,根据本发明的实施方案可以使用以下搅动速率和行程:混合-约0.5至1.5hz和25至75mm;预先团块分散-约1至2hz和25至75mm;团化-约0.5至2hz和25至75mm;读出-0hz和0mm;以及分散-约1至2hz和约25至75mm。此外,每个阶段的特定时间段也可以变化。举例来说,混合阶段可以比预先团块分散、团化、读出和分散阶段(例如,每个阶段约5至120秒)明显更长(例如,约5至60分钟)。
图23示出了对于沙门氏菌来说被磁性捕获粒子捕获的结合成员-微生物-指示剂粒子复合物的时间依赖性sers信号强度的一个实例。一般来说,sers信号上坡的开始可以指示微生物的存在。在这点上,在约6小时的培养时间之后,可以指示微生物的存在,而在约9小时处的峰指示更高浓度的微生物。然而,如也在图23中所示,在sers信号下坡时,微生物可以继续存在,例如在约12小时处。在这种情况下,下坡也可以表示微生物的存在,其可以提供在某些情况下鉴别正性的有用手段,例如当在孵育开始时存在大量微生物的时候。这样的话,sers信号的上坡或下坡可以指示培养样品中微生物的存在。在这点上,可以在孵育时段期间随着时间定期进行读出以鉴别sers信号的这些变化。
b.指示剂粒子
如本文所用的“指示剂粒子”可以是能够产生信号的任何粒子,这种信号可以在培养样品中直接检测而无需移出样品,例如进行洗涤步骤。举例来说,指示剂粒子当被询查(例如,使用光源)时可以产生任何光信号(例如,荧光或拉曼或光学图像)。指示剂粒子的实例包括sers活性粒子、量子点、近红外荧光团或近红外荧光粒子。
“表面增强拉曼散射”或“sers”指的是当拉曼活性分子被吸附到某些金属(例如,金或银)的表面上或非常接近这个表面(例如,在约
如本文所用的术语“辐射”指的是呈电磁辐射形式的能量,这种电磁辐射可以诱导受测试的样品中的表面增强拉曼散射,这种样品如包含具有一种或多种与其缔合的sers活性报道分子的sers活性纳米粒子的样品。更具体地说,术语“辐射”指的是呈电磁辐射形式的能量,这种电磁辐射使得纳米粒子的表面诱导、发出、支持或以其它方式引起最接近纳米粒子表面的报道分子中的光散射,例如拉曼散射。
如本文所用的“报道分子”指的是当用适当波长的辐射照射时能够产生拉曼光谱的任何分子或化合物。“报道分子”在本文也可以被称作“标记”、“染料”、“拉曼活性分子”或“sers活性分子”,其中每一个都可以互换使用。
本领域的一般技术人员将了解,多种分子可以充当sers报道分子。举例来说,一些荧光染料分子也可以被用作sers报道分子。参看例如。2008年6月6日提交的thomas等人的美国专利申请号12/134,594以及2008年6月6日提交的thomas等人的pct国际专利申请号pct/us2008/066023,其中每一个以全文引用的方式并入。一般来说,适合用作sers报道分子的分子可以是小分子、大分子或络合分子,不过分子不需要络合来充当sers报道分子。在一些实施方案中,sers报道分子可以具有至少一个芳环。此外,不希望受任何一个特定理论约束,键极化率的变化为拉曼活性所需。而且,对称分子倾向于展现特定和强烈的拉曼信号。有利地,报道分子展现高拉曼散射截面和充分表征的光谱特征图。
如本文中所提到的sers活性纳米粒子包括具有诱导、引起或以其它方式支持表面增强拉曼光散射(sers)或表面增强共振拉曼光散射(serrs)的表面的纳米粒子。许多表面能够产生sers信号,包括粗化表面、纹理化表面和其它表面,包括平滑表面。
适合与本发明所公开的试验一起使用的sers活性指示剂粒子包括诱导拉曼效应的核心,并且可以进一步包括位于核心的外表面上的一层或多层和一个或多个类型的sers活性材料,以及任选地部分或完全封装核心或sers活性材料的封装物。
图19-21示出了sers活性指示剂粒子的各种实例。图19示出了具有单一sers活性纳米粒子21作为核心的sers活性指示剂粒子20,其具有位于纳米粒子核心的外表面上的报道分子22以及完全封装核心和报道分子的一层二氧化硅23。这些sers活性指示剂粒子描述于natan的美国专利号6,514,767中,这个专利以全文引用的方式并入本文中。
如本文所用的术语“纳米粒子”指的是至少一个尺寸在约1nm至约1000nm的范围内,包括介于1nm与1000nm之间的任何整数值(包括约1、2、5、10、20、50、60、70、80、90、100、200、500和1000nm)的粒子。在一些实施方案中,sers活性指示剂粒子的核心是金属纳米粒子。在一些实施方案中,sers活性指示剂粒子是球形粒子或基本上呈球形的粒子,其直径介于约2nm与约200nm之间(包括约2、5、10、20、50、60、70、80、90、100和200nm)。在一些实施方案中,sers活性指示剂粒子的直径介于约2nm与约100nm之间(包括约2、5、10、20、30、40、50、60、70、80、90和100nm),并且在一些实施方案中介于约20nm与100nm之间(包括约20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99和100nm)。
适合与本发明所公开的试验一起使用的sers活性指示剂粒子还可以包括包含两种或更多种纳米粒子的核心。图20示出了在核心中具有第一sers活性纳米粒子31和第二sers活性纳米粒子32的sers活性指示剂粒子30,其具有位于第一31与第二32sers活性纳米粒子之间的报道分子33。这些sers活性指示剂粒子描述于natan的美国专利号6,861,263中,这个专利以全文引用的方式并入本文中。关于另一个实例,还参看2003年12月18日公布的kreimer等人的美国专利申请公布号2003/0232388,其以全文引用的方式并入本文中。因此,sers活性指示剂粒子的核心可以包括单一纳米粒子或可以包括聚集在一起的多个纳米粒子。如本文进一步公开,这些聚集体也可以被封装起来。
适合与本发明所公开的方法一起使用的sers活性指示剂粒子的核心通常包含至少一种金属,即,至少一种选自元素周期表的通常被称为金属的元素。适合的金属包括11族金属,如cu、ag和au,或本领域的技术人员已知的支持sers的任何其它金属,如碱金属。在一些实施方案中,核心纳米粒子基本上包含单一金属元素。举例来说,金纳米粒子的制备由frens,g.,nat.phys.sci.,241,20(1972)描述。在其它实施方案中,核心纳米粒子包含至少两种元素的组合,如合金,例如二元合金。在一些实施方案中,核心纳米粒子是磁性的。
在其它实施方案中,sers活性指示剂粒子的核心包括两种组分,其中第一种材料形成内核,其被由第二种材料形成的外壳包围,如au2s/au核壳粒子。图21示出了具有被由au形成的外壳42包围的au2s的内核41作为核心的这种sers活性指示剂粒子40,其具有位于核心的外表面上的报道分子层43以及完全封装核心和报道分子层的一层二氧化硅44。已经报道了au2s/au核壳粒子具有广泛可调谐的近ir光学共振。参看averitt,r.d.等人,"ultrafastopticalpropertiesofgoldnanoshells",josab,16(10),1824-1832(1999)。此外,可以使用ag核/au壳粒子,如cao,y.w.等人,"dna-modifiedcore-shellag/aunanoparticles",j.am.chem.soc.,123(32),7961-7962(2001)所描述的那些,或au核/ag壳粒子,或涉及sers活性金属的任何核壳组合。适合用于核壳粒子中的其它组合也适合与本发明所公开的主题一起使用,包括au或ag功能化的二氧化硅/氧化铝胶体、au或ag功能化的tio2胶体、au纳米粒子包覆的au纳米粒子(参看例如mucic等人,"dna-directedsynthesisofbinarynanoparticlenetworkmaterials",j.am.chem.soc.,120(48),12674(1998));au纳米粒子包覆的tio2胶体;以及具有si核心与金属外壳(即,“纳米壳”)的粒子,如银包覆的sio2胶体或金包覆的sio2胶体。参看例如jackson等人,proc.natl.acad.sci.u.s.a.101(52):17930-5(2004);还参看oldenburg等人的美国专利号6,344,272和6,685,986,其中每一个以全文引用的方式并入本文中。在生物传感应用中这些纳米壳的使用已有描述。参看west等人的美国专利号6,699,724,其以全文引用的方式并入本文中。
适合用作sers活性指示剂粒子的核心的另一类纳米粒子包括具有内表面的纳米粒子。这些纳米粒子包括空心粒子和空心纳米晶体或多孔或半多孔纳米粒子。参看例如ostafin等人的美国专利号6,913,825,其以全文引用的方式并入本文中。在一些实施方案中,具有内表面的核/壳和纳米粒子可以展现改进的sers信号。
虽然认识到粒子形状和纵横比可以影响纳米粒子的物理、光学和电子特征,但内表面区域的特定形状、纵横比或存在/不存在不会对作为纳米粒子的粒子的限制条件产生影响。因此,适合用作sers活性指示剂粒子的核心的纳米粒子具有多种形状、尺寸和组成。此外,纳米粒子核心可以是实心的,或在一些实施方案中,如上文刚才所描述是空心的。用作核心的适合纳米粒子的非限制性实例包括胶态金属空心或经填充的纳米棒、磁性、顺磁性、导电或绝缘纳米粒子、合成粒子、水凝胶(胶体或棒),等等。本领域的一般技术人员将了解,纳米粒子可以按多种形状存在,包括(但不限于)球体、杆、圆盘、棱锥、立方体、圆柱体、纳米螺旋、纳米弹簧、纳米环、杆状纳米粒子、箭头状纳米粒子、泪珠状纳米粒子、四角状纳米粒子、棱柱状纳米粒子,以及多个其它几何和非几何形状。
此外,适合用作sers活性指示剂粒子的核心的纳米粒子可以是各向同性或各向异性的。如本文中所提到的各向异性纳米粒子具有一定长度和宽度。在一些实施方案中,各向异性纳米粒子核心的长度是平行于产生纳米粒子的孔隙的尺寸。在一些实施方案中,各向异性纳米粒子核心具有约350nm或更小的直径(宽度)。在其它实施方案中,各向异性纳米粒子核心具有约250nm或更小的直径(宽度),并且在一些实施方案中具有约100nm或更小的直径(宽度)。在一些实施方案中,各向异性纳米粒子核心的宽度介于约15nm至约300nm之间。此外,在一些实施方案中,各向异性纳米粒子核心具有一定长度,其中这个长度介于约10nm与350nm之间。
大量sers文献(实验和理论)表明,各向异性粒子(杆、三角形、棱柱)可以提供与球体相比增大的拉曼信号增强。举例来说,所谓的“天线效应”预示着拉曼增强预期在更高曲率的区域处更大。各向异性粒子的许多报道最近已有描述,包括银(ag)棱柱和“分枝的”金(au)粒子。
各向异性的au和ag纳米棒可以通过以类似于产生
也适合用于本发明所公开的方法中的sers活性指示剂粒子包括复合纳米结构,例如卫星结构和核壳结构,如2008年3月20日提交的weidemaier等人的pct国际专利申请号pct/us2008/057700中所公开,这个申请以全文引用的方式并入本文中。
用于检测培养样品中的微生物的sers试验和装置的实施方案的一个优点是可以制备的sers活性纳米粒子的多样性,这些纳米粒子各自具有独特的sers特征图。适用于本发明所公开的方法的代表性sers活性指示剂粒子包括(但不限于)来自oxonicainc.(mountainview,california)的sers活性指示剂粒子。这些sers活性指示剂粒子包括经sers报道分子标记并且封装于玻璃外壳中的纳米粒子核心。
代表性的非限制性报道分子包括4,4'-联吡啶(dipy)、d8-4,4'-联吡啶(d8dipy)、反-1,2-双(4-吡啶基)-乙烯(bpe)和2-喹啉硫醇(qsh),其中每一个已经在2006年2月23日公布的natan等人的美国专利公布号2006/0038979中被公开为有用的拉曼活性报道染料,这个公布以全文引用的方式并入本文中。用于本发明所公开的方法的适合的报道分子的另外非限制性实例包括1,2-二(4-吡啶基)乙炔(bpa)、4-偶氮双(吡啶)(4-azp)、、gm19、1-(4-吡啶基)-1-氰基-2-(2-氟-4-吡啶基)-乙烯(cnfbpe)、1-氰基-1-(4-喹啉基)-2-(4-吡啶基)-乙烯(cqpe)、染料10和4-(4-羟基苯偶氮)吡啶(136-7)。经4,4'-联吡啶(dipy)标记的sers活性纳米粒子的代表性sers光谱提供于图22中。如图22中所示,dipy染料分子在约1601cm-1处具有主峰。
适合与本发明所公开的方法一起使用的sers活性指示剂粒子包括(但不限于)2008年6月6日提交的thomas等人的美国专利申请号12/134,594和2008年6月6日提交的thomas等人的pct国际专利申请号pct/us2008/066023(其中每一个以全文引用的方式并入)中所公开的包含表面增强拉曼散射(sers)活性报道分子的纳米粒子核心,以及2008年3月20日提交的weidemaier等人的pct国际专利申请号pct/us2008/057700(其以全文引用的方式并入本文中)中所公开的多种sers活性指示剂粒子。
在一些实施方案中,sers活性指示剂粒子包含封装物。sers活性纳米粒子具有在水溶液中聚集的趋势并且一旦聚集就难以再分散。此外,一些拉曼活性分子的化学组成与用于将其它分子(如蛋白质)连接到金属纳米粒子的化学法不相容。这些特征可以限制拉曼活性分子、附接化学法以及将要连接到金属纳米粒子的其它分子的选择。因此,在一些实施方案中,本发明所公开的方法包括sers活性指示剂粒子,其中报道分子当贴附,例如吸附或共价连接到纳米粒子核心时,可以被包覆或封装在例如不同材料的外壳中,这种材料包括介电材料,如聚合物、玻璃、金属、金属氧化物(如tio2和sno2)、金属硫化物或陶瓷材料。制备这些sers活性指示剂粒子的方法描述于natan的美国专利号6,514,767中,其以全文引用的方式并入本文中。
封装物的厚度可以视sers活性指示剂粒子所需的物理特性而变化。取决于纳米粒子核心、封装物和染料的特定组合,封装物的厚涂层,例如大约1微米或更厚的涂层,可以潜在地减弱拉曼信号。此外,薄涂层可能导致封装物表面上的分子干扰相关微生物的拉曼光谱。同时,物理特性,如沉降系数,可以受封装物的厚度影响。一般来说,封装物越厚,金属纳米粒子核心上的sers活性染料与周围溶剂的隔离越有效。
在封装物是玻璃的实施方案中,玻璃的厚度通常可以在约1nm至约70nm的范围内。在示例性的非限制性实施方案中,sers活性指示剂粒子包含具有在约50nm至约100nm的范围内的直径的金纳米粒子,其被封装在具有在约5nm至约65nm、在一些实施方案中约10nm至约50nm、在一些实施方案中约15nm至约40nm的范围内并且在一些实施方案中约35nm的厚度的玻璃球体中。本发明所公开的sers活性指示剂粒子的尺寸的最佳化可以由本领域的一般技术人员来实现。
此外,包含sers活性染料的sers活性指示剂粒子可以用可以结合到目标微生物的分子功能化,这种分子如结合对的特异性结合成员。在结合目标微生物后,sers活性报道分子的sers信号以可以确定目标微生物的存在或量的方式变化。功能化的sers活性指示剂粒子的使用具有优于非功能化的指示剂粒子的几个优点。第一,官能团通过提供与目标微生物的特异性相互作用而对指示剂粒子提供一定程度的特异性。第二,目标微生物本身不需要是拉曼活性的;其存在可以通过观测连接到纳米粒子核心的拉曼活性染料的sers信号的变化来确定。这些测量在本文中被称作“间接检测”,其中培养样品中目标微生物的存在或不存在是通过检测不是直接从所关注的微生物发出的sers信号来确定。
在其它实施方案中,sers活性指示剂粒子包含sers活性纳米粒子作为核心,没有报道分子或封装物存在。核心的表面可以用可以结合到目标微生物的分子功能化,这种分子如结合对的特异性结合成员。在结合目标微生物后,检测目标微生物本身的sers光谱以确认目标微生物的存在或量。这些测量在本文中被称作“直接检测”,其中血液培养样品中目标微生物的存在或不存在是通过检测直接从所关注的微生物发出的sers信号来确定。
sers活性指示剂粒子可以经过功能化以按至少两种不同方式结合到目标分析物。在一些实施方案中,sers活性报道分子,即,sers活性染料,可以与结合对的特异性结合成员偶联,而在其它实施方案中,结合对的特异性结合成员可以直接连接到纳米粒子核心。在纳米粒子核心至少部分被封装外壳包围的实施方案中,结合成员可以连接到封装外壳的外表面。
c.特异性结合成员
如本文所用的术语“特异性结合成员”和其语法派生形式指的是存在至少一个独立的互补结合分子的分子。特异性结合成员是与特定分子(例如,所关注的微生物)结合、连接或以其它方式缔合的分子。当特定类型的特异性结合成员结合特定类型的分子时,特异性结合成员被称作“特异性结合对”。举例来说,抗体将特异性地结合抗原。因此,“特异性结合对”指的是两种不同分子,其中分子之一经化学或物理手段特异性地结合第二分子。在这个意义上,受测试的微生物是特异性结合对的互相起作用的成员。适合与受测试的特定微生物一起使用的代表性结合成员提供于下文中。
此外,特异性结合对可以包括作为原始特异性结合伴侣的类似物的成员,例如,具有类似于分析物的结构的分析物类似物。所谓“类似”意味着,举例来说,使用本领域中熟知的比对程序和标准参数与分析物的氨基酸序列相比,分析物类似物具有至少约60%或65%序列同一性、约70%或75%序列同一性、约80%或85%序列同一性、约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的氨基酸序列同一性的氨基酸序列。
特异性结合成员当例如与sers活性指示剂粒子偶联时,以能够产生可检测的拉曼信号的方式与受测试的特定微生物相互作用,这种拉曼信号当特定微生物存在或不存在时或当特定微生物随着时间以不同浓度存在时可辨别。
术语“产生可检测信号”指的是以能够检测结合成员-微生物复合物的方式识别报道基团的存在或报道基团的特性变化的能力,这种报道基团如sers活性报道分子。此外,可检测信号的产生可以是可逆的或不可逆的。信号产生事件包括连续的、程序化的和阶段性的方式,包括一次性或可再用的应用。可逆的信号产生事件可以是瞬时的或可以是时间依赖性的,只要确立与分析物的存在或浓度的关联性即可。
特异性结合成员与例如微生物之间的结合、连接或缔合可以是化学或物理的。术语“亲和力”指的是在特定结合位点处结合对的一个结合成员与另一个成员之间的吸引力的强度。术语“特异性”和其派生形式指的是结合成员将优先结合到结合对的另一个预期成员(与样品中的其它组分相对的目标)的可能性。结合对的一个结合成员(例如,结合蛋白)与另一个结合成员(例如,配体或分析物)之间的这种结合可以是可逆的。
此外,如2008年6月6日提交的thomas等人的美国专利申请号12/134,594和2008年6月6日提交的thomas等人的pct国际专利申请号pct/us2008/066023(其中每一个以全文引用的方式并入)中所公开,在一些实施方案中,聚乙二醇(peg)连接子可以用于将特异性结合成员连接到sers活性指示剂粒子、磁性捕获粒子,或连接到固体支撑物。在本发明所公开的方法中,连接子分子,例如peg,还可以用于将特异性结合成员连接到sers活性指示剂粒子,或磁性捕获粒子。peg连接子的使用可以减少本发明所公开的试验中的非特异性结合。消除非特异性吸附可能成为试验性能的重大挑战。举例来说,在磁性捕获试验中,非特异性结合可以包括来自溶液的蛋白质或其它生物分子粘附到呈现目标分析物的结合成员的磁性捕获粒子或sers活性指示剂粒子的表面的过程,或磁性捕获粒子和sers活性纳米粒子的表面经由非特异性相互作用彼此粘附的过程。在一些实施方案中,peg连接子包含具有在线性分子的任一个末端上的官能团的双功能peg分子,这个官能团由两个或更多个乙二醇子单元隔开。在一些实施方案中,peg分子包含2个与约1000个之间的乙二醇子单元。在特定实施方案中,peg连接子包含至少12个乙二醇子单元。此外,peg连接子的特征可以为具有约200da至约100,000da的分子量。
取决于结合成员,本领域的一般技术人员在回顾本发明所公开的主题后将认识到,可以使用除peg以外的连接子。举例来说,烷硫醇可以用作抗体和肽的连接子。短链烷硫醇,包括(但不限于)s-乙酰基硫代乙酸n-琥珀酰亚胺酯(sata)和s-乙酰基硫代丙酸n-琥珀酰亚胺酯(satp),在巯基脱保护之后可以用作连接子。其它特性也可以决定连接子的选择,例如连接子链的长度。举例来说,peg可能是理想的,因为其还用来保护试剂的表面并且是柔性的,这可以增强试剂结合到所关注的分析物的能力。
在一些实施方案中,特异性结合成员是免疫球蛋白,在本文中也被称作抗体,其包含结合到目标微生物上或由其分泌的抗原的抗原结合区。
适合用于本发明所公开的方法和装置中的抗体和其片段可以是天然存在的或重组来源的,并且可以包括(但不限于)多克隆抗体、单克隆抗体、多特异性抗体、人抗体、人源化抗体、灵长源化抗体或嵌合抗体、单链抗体;表位结合片段,例如fab、fab'和f(ab')2、fd、fv、单链fv(scfv)、二硫键连接的fv(sdfv)、包含可变轻域(vl)或可变重域(vh)的片段、由fab表达文库产生的片段;以及抗独特型(抗id)抗体。在所有情况下,抗体或其片段将具有一个或多个对目标抗原具特异性的互补决定区(cdr)。出于本发明的目的,“抗体的互补决定区”是结合到表位的抗体的那个部分,包括对于这种结合所必需的任何骨架区,并且其可以由人重链v、d和j区、人轻链v和j区和/或其组合所编码的氨基酸残基的子组所组成。
本领域的技术人员能够使用标准的领域公认的技术来制备任何这类抗体衍生物。举例来说,jones等人(1986)nature321:522-525公开了将人抗体的cdr用来自小鼠抗体的那些cdr置换。marx(1985)science229:455-456论述了具有小鼠可变区和人恒定区的嵌合抗体。rodwell(1989)nature342:99-100论述了来源于抗体cdr信息的较低分子量的识别元件。clackson(1991)br.j.rheumatol.3052:36-39论述了经遗传工程改造的单克隆抗体,包括fv片段衍生物、单链抗体、融合蛋白嵌合抗体和人源化啮齿动物抗体。reichman等人(1988)nature332:323-327公开了大鼠高变区已经接枝到上面的人抗体。verhoeyen等人(1988)science239:1534-1536教导了将小鼠抗原结合位点接枝到人抗体上。
d.磁性捕获粒子
适合与本发明所公开的实施方案一起使用的磁性捕获粒子可以包含约15%至约100%的磁性材料,例如磁铁矿,包括约15%的磁铁矿、约20%的磁铁矿、约25%的磁铁矿、约30%的磁铁矿、约35%的磁铁矿、约40%的磁铁矿、约45%的磁铁矿、约50%的磁铁矿、约55%的磁铁矿、约60%的磁铁矿、约65%的磁铁矿、约70%的磁铁矿、约75%的磁铁矿、约80%的磁铁矿、约85%的磁铁矿、约90%的磁铁矿、约95%的磁铁矿以及约15%与约100%之间的任何整数。此外,磁性捕获粒子可以具有在约100nm至约12微米的范围内的直径。在一些实施方案中,磁性捕获粒子具有在约400nm至约8微米的范围内的直径。在其它实施方案中,磁性捕获粒子具有在约800nm至约4微米的范围内的直径。在另外的其它实施方案中,磁性捕获粒子具有在约1.6微米至约3.5微米的范围内的直径,包括(但不限于)约1.6、约1.7、约1.8、约1.9、约2.0、约2.1、约2.2、约2.3、约2.4、约2.5、约2.6、约2.7、约2.8、约2.9、约3.0、约3.1、约3.2和约3.3、约3.4、约3.5以及约4.5微米。适合用作磁性捕获粒子的代表性粒子可以获自bangslaboratories,inc.(fishers,indiana)、lifetechnologies(carlsbad,ca)或polysciencelaboratories(warrington,pennsylvania)。
粒子的磁性捕获可以使用本领域中已知的任何方法来实现,包括(但不限于)在试验器皿的局部区域放置强磁体或诱导磁场。局部化磁场可以例如用一个或多个永磁体、电磁体和/或材料(例如,铁类金属)来诱导以引导、限制或聚焦磁场。如图18中所描绘,其代表一个实施方案,磁体15用于使磁性捕获粒子-微生物-sers活性指示剂粒子复合物局部化到测量区9内。然后,可以使所需波长的入射辐射(例如激光束)聚焦在集中的磁性捕获粒子-微生物-sers活性指示剂粒子复合物的团块上,并且从复合物获得sers信号。
e.用于监测微生物培养样品中的生长的实时系统
图24描绘了实时系统150的一个实施方案,其提供了微生物培养样品中的微生物生长的实时监测用于自动检测临床和工业样品中的病原体。系统150包括在温度控制的壳体内固持多个培养器皿154的圆盘传送带152。举例来说,可以使用多达25个微生物培养器皿。在这个实施方案中,器皿154被放在圆盘传送带152的边缘周围,所述圆盘传送带旋转以将每个器皿依次以可程序化的频率(例如,每10-60分钟读出一次)呈递到团化和读出台156。团化和读出台156包括用以形成团块的磁体组件连同含有用于落射照明和信号收集的适当过滤器和透镜的光学读出头。举例来说,照明可以由785nm波长稳定的激光来提供,并且在适于拉曼光谱法的分光计上检测所收集的信号。在团化和读出给定的样品之后,圆盘传送带152旋转以将圆盘传送带中的下一个样品呈递到团化和读出台156。依次继续直到圆盘传送带152中的所有样品都被读出,届时圆盘传送带进入自旋模式,其中圆盘传送带连续旋转直到下一个测量周期。圆盘传送带以及团化和读出台被安装到从摇摆平台延伸的臂上。所得“偏移式摇摆”运动通过线性和摇摆运动来提供搅动。摇摆平台以针对测量周期的所有阶段所选的频率操作,历时实验的持续时间。搅动是为了多个目的。第一,从一个测量周期的结束到下一个测量周期的开始,其确保了sers和磁性粒子与样品和培养基的混合,从而允许形成结合成员-微生物-指示剂粒子复合物。第二,在已经读出团块之后,其确保了磁性粒子分散回到溶液中。第三,在团化期间,搅动将来自样品器皿内的各个空间点的流体中的磁性粒子运载到局部化磁场的区域中,确保从局部化磁场外部的样品区域收集磁性粒子。最后,在含有颗粒(例如树脂、木炭或碳酸钙)的样品中,在团化之前和期间的搅动可以防止这些颗粒沉降到检测区域中并且干扰光信号。随着目标生物体的浓度在整个富集过程中增加,一旦微生物浓度达到技术的检测阈,就通过光学,例如sers技术对微生物进行检测和鉴别。在培养期间连续监测sers信号的能力确保了使用最低必需培养时间并且当检测和鉴别到病原体或微生物时仪器可以自动地向使用者发警报。
图25示出了系统200的另一个实施方案,其被配置成处理多个样品。在这个特定实施方案中,平行地处理微生物培养样品中的每一个并且在相同的高温区内孵育。在这个实施方案中,样品管在同一水平面中对齐。系统200可以被放在形成高温区的壳体内。
所有样品一起搅动用于试剂结合、团化和团块分散阶段。在一个实施方案中,在团化之后,所有样品停止搅动,并且其被相继读出。平行处理需要与第一系统150配置中所用的圆盘传送带不同的样品安排。在这里,样品管202在平坦的托盘204中定位成彼此邻近。在这个实施方案中,通过沿着管202的纵轴进行线性往复运动来实现搅动,这可以在整个试验中针对不同频率和型态而程序化。这允许不同类型和水平的搅动用于团块形成、团块分散和试剂结合阶段。其还允许搅动停止以供读出。通过平行样品处理方法使得在每个阶段不同搅动的程序化成为可能。
图25中所示的系统200包括磁体组件206,其被配置成绕枢轴转动到邻近管202的位置用于团化,然后绕枢轴转动远离样品管用于询查。对于图25中所示的系统200的实施方案来说,光学询查可以使用在团块形成之后绕枢轴转动远离样品管202的磁体组件206来进行以允许光学读出头208接近样品管的测量区。在这种配置中可能抽出磁体组件206,因为样品在读出期间不搅动。替代地,一对磁体可以按提供狭缝的方式排列,通过这个狭缝用读出头208获取读数,其中磁体在团化之后维持在原位。因此,读出头208被配置成沿着磁体之间的狭缝移动以询查每个管。这通过消除了在管的团化与读出之间移动磁体的需要而提供优势。
图26-29说明了用于自动和实时监测培养样品中的微生物生长的系统250的另一个实施方案。系统250被配置成同时自动处理一个或多个不同试验。一般来说,系统250包括由单一的团化/读出组件254服务的多个孵育箱252,所述团化/读出组件在孵育箱后面移动以在检测区中一次一个地服务(团化和读出)每个托盘256。每个孵育箱252被配置成接收固持多个样品管258的托盘256。管的每个托盘256被配置成从孵育箱252移动到团化/读出组件254,在此形成团块并且在检测区中收集数据。团化/读出组件254包括用以形成团块的磁体组件260和用以收集光信号的光学组件(例如,拉曼光学装置、激光器和分光计)。
在一个实施方案中,系统250包括多个孵育箱252。各种试验可以在不同温度下孵育培养样品。因此,系统250可以包括可以在不同温度下操作的多个高温区262(孵育区),其中每个区包括一个或多个孵育箱。同时处理每个孵育箱252中的试验,其中每个孵育箱可以包括固持一个或多个样品管258的一个或多个托盘256。然而,样品管258可能不一定一批处理。在这点上,每个样品管258可以在不同时间被放在孵育箱252中,从而对于其测试时段来说具有不同的起始时间。样品管258在其测试时段期间可以全部暴露于相同的重复测试周期。大多数样品管258可以成批地一起引入。如图26和27中所示,系统包括四个孵育箱252,其被分成两个高温区262。高温区262可以垂直排列以使得两个孵育箱252与相应的高温区相结合。相同的高温区262如图27中所示垂直堆叠。然而,应了解,高温区262必要时可以水平或并排地排列。每个区262可以包括维持在相同的孵育箱水平下的一个或多个孵育箱252,其在常用温度下操作。在一个示例性的实施方案中,区262经过配置以供处理沙门氏菌和李斯特菌试验,所述试验被维持在不同温度下(例如,分别为约42℃和30℃)。因此,系统250被配置成处理不同样品管258(例如,检测小瓶)而与试验的类型无关。
在一个实施方案中,每个孵育箱252形成适合于在内部接收托盘256并且维持对于培养特定样品所必需的预定温度的壳体。孵育箱252的一个实例示于图34中。孵育箱252可以包括基块264,其包括底表面和侧表面、前门和后门266、268以及顶表面270。孵育箱252可以由适合于提供温度控制的壳体的多种材料形成。举例来说,孵育箱252可以由单一的机加工金属基块264(例如,铝)构造,所述机加工金属基块形成温度控制的区域的底面和侧面,而金属板(例如,铝)形成顶表面270。孵育箱252还可以包括在基块左侧的通道272,其被配置成支撑皮带传动机274用于在y台278的控制下使托盘256在y方向上振荡。托盘256的运动范围延伸超出经加热区的深度以将托盘冲程提供到在孵育箱252后面的团化/读出区域中。因此,每个托盘256的运动范围将基于适当搅动管258以及将管在孵育箱252外部重定位用于由团化/读出组件254进行团化和图像分析所需的行进量。
在一个实施方案中,孵育箱252包括前门266和后门268,其中这些门与顶表面270和基块264协作以形成壳体。前门266被配置成由操作人员选择性地打开和关闭(参看例如图31)。举例来说,前门266可以被配置成向下摆动以使得托盘256可以从孵育箱252的前部延伸最小距离,并且这个门将不会阻碍管的接取或可见性。前门266可以使用多种技术来安装以有助于打开和关闭。举例来说,前门266可以被安装在扭转弹簧加载的铰链上,所述扭转弹簧加载的铰链在托盘退回到孵育箱252中之后即关闭这个门。推送机构可以从托盘的前部的一侧或两侧延伸以帮助打开门。根据一个方面,信号旗位于前门266的内部,其被配置成中断安装在孵育箱252的内侧壁上的光学传感器以在关闭前门时进行传感。
类似地,后门268可以被配置成在托盘256退出和再进入孵育箱252的后部之后打开和关闭(参看图40)。因此,随着托盘256退出孵育箱252,托盘被配置成将后门268推到至少部分打开状态。如同前门266一样,后门268可以被安装在扭转弹簧加载的铰链上,并且随着托盘从孵育箱252的后部露出,在托盘256的后部的特征可以被配置成将后门推到打开状态。护套276被配置成接收退出孵育箱252后的托盘256,并且经过配置以沿着z轴运动,如下文进一步详细解释。一旦后门268部分打开,护套276可以被配置成随着护套沿着z轴上升以与孵育箱252对齐来完全打开后门。使用保持门打开的护套276,托盘256在团化/读出区域中自由移动而不受来自后门268干扰。后门268被配置成当托盘256回缩到孵育箱252中并且护套276下降时关闭。孵育箱252可以包括传感器用于指示托盘256适当定位在其中。举例来说,在后门268内部的信号旗可以被配置成中断安装在孵育箱的内侧壁上的光学传感器以在关闭后门时进行传感。所述传感器也可以用作托盘256的本地指示器。因此,后门传感器可以确立从孵育箱252的后部进去或出来的托盘256位置。第二本地传感器在每次偏移到团化/读出区域中期间可以相对于团化和光学硬件对于每个托盘256本地定位。
因为每个孵育箱252是温度控制的,所以孵育箱可以用绝缘材料包裹(例如,闭孔泡沫绝缘)。高温区262中的每一个也可以用绝缘材料隔开,其在这些区维持在不同温度下时适用。在区之间还可以存在间隙以限制区之间的串扰。另外,当一个孵育箱门266或268对前部或后部打开并且另一个门关闭时,绝缘材料可以用于防止热相互作用。绝缘隔离片可以隔开区262中的孵育箱。类似地,区262也可以使用隔离片和绝缘材料隔开。
每个孵育箱252使用加热元件来加热。举例来说,加热元件可以被配置成经基块264进行加热或在孵育箱内提供经加热的空气。根据一个实施方案,加热元件是粘附到基块264的底表面或以其它方式与基块264的底表面集成的平坦加热元件。加热元件的功率分布可以作调整以使跨越托盘256中的管258的热梯度减到最小,从而补偿通过孵育箱252左侧的y传动机278组件的热损失。每个孵育箱252可以提供有一个或多个传感器用于监测其中的温度,例如孵育箱内基块264和/或空气的温度。
如上文所论述,每个孵育箱252被配置成在内部接收相应的托盘256。图30-32说明了适合定位在相应的孵育箱内的托盘256的示例性的实施方案。每个孵育箱252中的托盘256被配置成容纳多个管258。在所说明的实施方案中,托盘256固持15个管258以使得每个高温区262固持30个管,不过可以使用任何数目的管。管258可以在托盘256中的每一个中水平排列成平面阵列。在图31中所示的一个实施方案中,技术人员手动地将样品管258放到可移出的样品托盘256中。技术人员然后将托盘256放到孵育箱252中。当确定阳性结果时或当结果保持阴性持续一段预定的时间时,试验完成。当完成试验时,技术人员移出托盘256以用新的管258再装填。或者,技术人员可以在需要时个别地移出和/或添加管到托盘中,而不停止在托盘或邻近的孵育箱中的其它管内已经处于进行中的试验。可以隔离阳性样品用于进一步分析。在另一个实施方案中,托盘256是不可移出的。因此,管258可以个别地放到每个孵育箱252中的不可移出的托盘256中。在又另一个实施方案中,在孵育箱252包括用于在内部固持管258的适合构件的情况下,托盘256可能是多余的。
在托盘256中管258的水平和并排排列有助于从孵育箱252的前部加载个别的样品管或托盘。前部加载避免了在系统的前部使用工作台空间或岛状空间,因为顶部加载的托盘将需要延伸出系统的前部接近管的长度以有助于顶部加载。此外,当使用者将过度的压力施加在悬臂式延伸的托盘上时,托盘和滑动支座将需要承受高负荷。
每个托盘256可以具有多种尺寸和配置用于固持管258并且有助于放置在孵育箱252内。举例来说,图31说明了管258被插入在托盘256中所界定的相应的狭缝284内。管258可以使用力或安置在托盘256内的干涉配合或偏置元件保持在适当位置。在托盘256从孵育箱252中可移出的情况下,如图33a-33c中所示,托盘可以包括一个或多个夹持特征286,其允许技术人员固持托盘并且在孵育箱内操纵托盘。
在一个实施方案中,托盘256包括纵向狭缝284以使得管258的一部分透过托盘可见。纵向狭缝284还允许管258在托盘256的底表面下方凸出以提供与团化磁体288的接触区域。为了确保跨越托盘256与磁体充分接触,每个管258在托盘中可以具有垂直顺性。举例来说,随着磁体上升而碰到管,弹簧可以固持管258向下抵着磁体。弹簧还可以通过与振荡托盘运动相对地摩擦而保持管258在托盘256中。
根据一个实施方案,托盘256被配置成在y台278的控制下在每个孵育箱252中沿着y轴水平地振荡以搅动含有样品、培养基和试剂的管。这种水平运动可以实现几个功能:
a)搅动用于在孵育箱252中动力学混合;
b)使管延伸出孵育箱252的前部以供操作人员加载和卸载;
c)使管延伸出孵育箱252的后部到团化/读出组件254;
d)搅动管258以分散沉降的材料—例如,培养基或样品的固体组分;
e)在团化/读出组件254中搅动管258和磁体288以形成团块;
f)使管258定位在读出头290上方用于数据收集;
g)使管标签定位在条形码读出器上方用于样品id;
h)使团块定位在相机上方以使团块可见用于内部控制、基于图像的检测方法或远程诊断;
i)搅动管258以在读出后分散团块;
j)操作孵育箱前门266;
k)操作孵育箱后门268;
l)使空气在孵育箱252中循环以减小温度梯度。
如图34中所示,系统包括y台278用于沿着y轴移动托盘256,包括用于振荡或搅动托盘并且移动托盘进出孵育箱252的后部。如图27中所示,每个孵育箱252可以包括沿着z轴安置的相应的y台278以使得彼此垂直间隔。托盘256可以使用一个或多个托架282耦合到y台278。举例来说,托盘256可以从安装在线性导轨292上的托架282伸出悬臂,其中线性导轨被安装到孵育箱基块264上。y台278包括马达280用于绕着在导轨292两端的同步带轮传动皮带274。应了解,y台278被配置成以多种频率和振幅搅动托盘256,这取决于特定试验和应用。举例来说,托盘256在孵育箱252中的时候相比定位在团化/读出组件254中的时候可以更缓慢地振荡。
y台278组件还可以用绝缘材料密封,而传动y台的马达280在绝缘区域外部。托盘256和托架282可以移动通过绝缘材料中的开口。
系统250还包括位于孵育箱252后面的z台294(参看图39、42和43)。z台294被配置成沿着z轴运载护套276、磁体组件260、光学组件(例如,分光计308、拉曼探针310等)和x台296。z台294可以包括被配置成在垂直线性导轨300上搭载的托架298。马达302被配置成使z台在z方向上上升和下降(例如,使用安置在耦合到z台支架306的轴304内的线性螺钉和螺母)。传感器可以用于指示z台294何时处于其在z方向上行进的底部。分光计308、磁体组件260、护套276和x台296被安装到z台支架306上并且作为一个整体在z方向上全部一起行进。z台294被配置成在z方向上移动以容纳退出孵育箱252的每个托盘256。z台294也被配置成在底部孵育箱252下方行进,足以允许底部孵育箱后门268关闭。
如图42、45和46中所示,系统250还包括磁体组件260。磁体组件260可以包括安装到磁体框架318上的一个或多个磁体288,所述磁体框架被配置成将磁场施加到管258,从而有助于在每个管内形成团块。举例来说,图45和46说明了一对纵向磁体288,其间隔开一段足够的距离以允许读出头290延伸通过其来获得读数。因此,磁体288在团化之后并且在管258用读出头290读出的同时可以保持在原位。每个纵向磁体288可以是单一磁体或端对端排列的多个磁体的集合。
当使磁体288与水平定向的管258的底部接触或非常接近这个底部时,可以形成团块。管258和磁体288在团块形成期间轻轻地振荡以确保悬浮中的磁性粒子通过磁场并且被吸引到磁场聚焦点。根据一个实施方案,磁体组件260被安装到托架312上,所述托架在y方向上在贴附到z台支架306的导轨314上搭载(参看图46)。导轨314可以平行于y台导轨292。
当托盘256延伸出孵育箱252的后部并且进入团化/读出组件254中时,z台294可以从下方沿着z轴上升。如图42和47中所示,从磁体框架318向外延伸的引脚316被配置成与托盘256下面的孔啮合。一旦啮合,磁体框架318即与托盘256耦合,并且磁体框架和托盘能够在y方向上沿着导轨314一起移动。因此,在一个实施方案中,团化/读出组件254被配置成一次处理一个托盘256。团化振荡振幅可以视特定地针对特定试验的许多因素而变化。在一个实例中,振荡振幅可以高达约50mm。磁体框架318和托盘256可以在y台在y方向上完全行进的位置处耦合,而团化振荡的中心可以从耦合位置向前定位以容纳y方向上的1/2振幅。
在一个实施方案中,在振荡管258与磁体288之间的少量相对运动允许磁场将磁性粒子聚集成更密实的团块。因此,托盘256与磁体框架318之间的松散耦合可能是合乎需要的。这种耦合可以例如通过将框架318安装在保持于在两个弹簧之间的框架318中的狭缝中的块上来实现。随着托盘256在y方向上前后振荡,框架318相对于托盘移动,因为弹簧在第二次振荡运动中交替地压缩。松散耦合冲程可以是例如约5mm。将选择弹簧常数以提供最佳振荡频率。
根据本发明的一个实施方案,磁体组件260被配置成同时团化托盘256中的管258中的每一个。磁体288可以被配置成在管258用读出头290读出的同时保持在原位。或者,团块可以足够稳固以允许磁体288或管258远离彼此移动以供读出。
图41示出了耦合到z台294的x台296的一个实例。因此,x台296被配置成在z方向上由z台移动。x台296还有助于读出头290在x方向上运动用于读出管258中的每一个。x台296扫描在管258的阵列下面的读出头290以在形成团块之后收集试验数据。在团化期间,x台296移动到x位置,这允许耦合的托盘256移动而不干扰读出头290和磁体组件260。在团化之后,在托盘256保持固定下,x台296平移到每个管258,从而暂停收集数据直到所有管都被读出。x台296然后在托盘256移动之前重定位到其初始位置。在一个示例性的实施方案中,x台传动机(例如,马达320和皮带322)被安装在z台支架306中的通道324中,并且利用与y台278类似的设计。读出头290被安装到托架326上,所述托架被配置成沿着x台296的导轨328移动。柔性套管330可以用于将读出头290的电缆和柔性纤维光缆从z台294导引到移动读出头。柔性套管330被配置成不仅保护光导纤维束,而且允许纤维在x方向上弯曲并且提供所需的弯曲半径。
根据另一个实施方案,x台296被配置成运载条形码读出器(未示出)用于读出管258中的每一个上的条形码或其它标识符。举例来说,条形码读出器可以用于确认管258处于正确的高温区262中,从而防止假阴性。条形码可以包括其它资料,如鉴别和试验信息。如上文所论述,管258可以包括纵向狭缝284,其有助于用条形码读出器进行这种读出。另外,条形码读出器可以提供关于团块的成像资料用于内部控制、基于图像的检测方法和/或远程诊断。
如上文所论述,护套276被配置成在托盘退出孵育箱252的后部时接收每个托盘256。具体地说,绝缘的护套276在z台294上运载并且被配置成与每个孵育箱252对齐以当托盘256延伸出孵育箱的后部到团化/读出区域254中时包围这个托盘。在托盘256延伸出孵育箱252的时候,绝缘的护套276使托盘温度变化减到最小。护套276提供绝缘的套管并且阻碍气流冷却托盘256和其中所含的管258。而且,护套276是由使其热质量降到最低并且因此在与前一个区的温度不同的温度下与托盘256的热能交换降到最低的材料来构造。举例来说,护套276可以包含用绝缘材料包围的薄铝结构。在一个特定实施方案中,进入约42℃下的护套的约30℃下的托盘的温度将不会增加超过约0.5℃。
可以存在在孵育箱252与对齐的护套276之间界定的间隙332,使得孵育箱不能完全调节护套中的温度。在孵育箱252中的温度高于环境温度的那些情况下,包围护套276的空气可以比托盘256更冷,因此来自护套的热传递将朝向更低的托盘温度。然而,一些试验具有由托盘256从孵育箱252到护套276中的移动引起的变化所应有的可接受的温度容限。举例来说,对于42℃下的沙门氏菌和30℃下的李斯特菌,试验相比温度上升(例如+0.5℃)更容忍短暂的负温度下降(例如约-2℃)。因此,可能没必要与孵育箱252形成良好的热密封,只要负偏移在可接受的容限内即可。
除了包围延伸的托盘256之外,护套276还可以密封如图42中所示的磁体组件260。因此,如上文所论述,护套276可以定尺寸以使z台294能够与磁体组件260垂直移动用于耦合和解耦合托盘256。此外,护套276可以包括切口以向沿着护套底部的读出头290并且向经由y台278沿着侧面移动的托架282提供空隙。护套276的顶部也可以包括切口用于孵育箱后门268。
如图48a和48b中所示,系统250的前述组件可以密封于柜334中。皮革形成在孵育箱252和团化/读出区域254周围的柜334以控制气流并且添加热控制。柜334还可以提供在里面操作光学组件(例如,激光器)的安全壳体。系统250可以进一步包括一个或多个可见或可听信号用于指示试验的状况。举例来说,一个或多个led336可以用于指示试验正在进行中以及何时出现阳性结果。出于这种目的,每个管258和/或托盘256可以包括相关联的led336。当孵育箱252的前门266打开或关闭时,不同的led颜色可以用于不同的指示,其中颜色可以是可见的。
孵育箱252通常维持在高于周围环境的温度下。为了帮助实现这个温度差并且确保过量的热不会传递到延伸到护套276中的托盘256,可以采用气流路径。还可以使用具有过滤器的风扇向柜334加压以减少灰尘渗透,并且可以使用其它热耗散技术用于如马达等组件。其它技术,如热电冷却器,可以用于进一步冷却柜334。
如本领域的一般技术人员所知,各种电气组件可以用于与系统250经接口连接并且控制系统250。举例来说,各种马达驱动板可以用于控制马达并且提供与如传感器和编码器的其它装置的接口。其它板可以用于提供另外的功能性,例如向读出头290和分光计308提供功率和接口信号以及驱动加热器并且读出相关联的热敏电阻。另外,系统250可以采用如微控制器的各种其它组分用于以本领域的一般技术人员所知的自动化方式来控制系统。
e.搅动和团化技术
图49描述了根据本发明的一个实施方案的搅动和团化方法,其已经被开发出来以使试剂体积减到最小并且获得代表大体积(例如,高达250ml)的读数。这主要通过在施加磁场期间沿着纵轴搅动培养器皿来实现。在管的侧面上沿着纵轴的方向形成团块。可以选择样品比管体积(例如1:2)、管长度/宽度纵横比(例如7:1)和搅动参数的结果的组合以使性能优化。搅动通过确保来自更大体积的粒子与磁体非常接近来促进更有效的团块形成。另外,搅动通过施加远离磁场方向的力而帮助保持非复合的细胞、微生物和松散固体(例如血液培养样品中的树脂)在团块外部。
图50描绘了用于形成和询查磁性团块的装置的一个实施方案。这个装置可以用于图24中所示的圆盘传送带系统150的实施方案中。在图50中所说明的实施方案中,磁体组件由包围含有物镜的光学读出头部分并且与其共线的环形磁体的堆叠组成。空心的锥形钢尖将磁场聚焦在锥体的尖端,使得团块在读出头的焦点处形成。这种安排使团块与读出头的焦点自动对齐并且放松了关于管、磁体和读出头的对齐的限制。团块、磁体和读出头的一致对齐对于在试验过程中跨越所有样品的一致测量是重要的,并且这种设计跨越样品管、经过在试验过程中的多次读出以及跨越仪器提供了可靠且可重复的团块形成。
图51和52示出了形成团块的替代方法,其已经根据上文所描述的系统来使用。管在水平面中的对齐允许光信号使用在团化后抽出或维持在团化位置的磁体读出。这允许测试各种磁体几何形状。两种已经证实尤其有效。一种被称为“正北向上”,其使用具有与管正交定向的磁化的条形磁体(图52)。这形成了对于使用读出头读出来说理想的对称圆形团块。另一种几何形状被称为“正北面向正北对”(图51),其中两个条形磁体定位于彼此邻近和平行。磁化贯穿每个磁体的厚度沿着与磁体正交的线定向,使得北极面向彼此。在磁体之间存在适当间隔下,最高场梯度的区域处于磁体之间的区域中,使得团块聚焦在磁体之间的区域中,这可容易接近以供使用适当位置的磁体读出。
在本发明的另一个实施方案中,还添加相机到测试台以监测在sers-hnw试验期间团块的形成和尺寸,这个试验在培养器皿内含有经偶联的sers指示剂粒子和磁性珠粒以及经靶向的病原体。随着hnw试验进行,从相机视图显示,团块尺寸增大,并且在一些情况下团块消失。团块尺寸的生长和/或团块的消失是经靶向的病原体存在的指示。在含有经偶联的sers指示剂粒子和磁性珠粒并且没有病原体的样品分析期间所捕获的图像显示团块尺寸没有变化并且没有团块消失。这种病原体检测方法可以单独或与另一种检测方法联合使用,另一种检测方法如先前所描述的作为验证的手段的sers分析。
本发明所公开的方法的实施方案可以使用本领域中已知的任何适合的分光计或拉曼分光计系统来进行,包括例如多模式多分光计拉曼分光计(centice,morrisville,northcarolina,unitedstatesofamerica),例如brady等人的美国专利号7,002,679中所公开的拉曼分光计系统,所述专利以全文引用的方式并入本文中。适合的分光计或拉曼分光计系统的其它非限制性实例包括hamamatsuc9405ca和intevacreporter,并且包括光纤耦合和自由空间光学配置。适合与本发明所公开的sers活性指示剂粒子一起使用的另外仪器公开于2008年3月20日提交的weidemaier等人的pct国际专利申请号pct/us2008/057700中,所述申请以全文引用的方式并入本文中。
用于进行基于液体的磁性捕获sers试验的代表性方法公开于2008年3月20日提交的weidemaier等人的pct国际专利申请号pct/us2008/057700中,所述申请以全文引用的方式并入本文中。如也在pct/us2008/057700中所公开,这些方法可以包括用于补偿磁性团块尺寸、形状或定位的变化的参考和对照方法,以及用于在基于液体的磁性下引试验中产生改进的拉曼参考光谱和光谱分析的方法。此外,多个报道分子可以用于形成内部参考信号,这种信号可以用于将背景噪声与信号检测区分开来,特别是在展现或预期展现相对弱的信号的样品中。
此外,如2008年6月6日提交的thomas等人的美国专利申请号12/134,594和2008年6月6日提交的thomas等人的pct国际专利申请号pct/us2008/066023(其中每一个以全文引用的方式并入)中所公开,适合用作sers活性指示剂粒子中的报道分子的染料通常展现具有窄线宽的相对简单的拉曼光谱。这种特征允许检测相同样品体积中的几个不同的拉曼活性种类。因此,这种特征允许制造多个sers活性指示剂粒子,每个包括不同的染料,使得每种染料的拉曼光谱可以在不同类型的指示剂粒子的混合物中区分出来。这种特征允许多重检测小样品体积中的几个不同的目标种类,在本文中被称作多重试验。
因此,在一些实施方案中,一种以上类型的结合成员可以连接到sers活性指示剂粒子。举例来说,连接到sers活性指示剂粒子的结合成员的类型可以变化以提供对不同目标微生物具有不同亲和力的多种试剂。以这种方式,试验可以检测所关注的一种以上微生物,或对一种以上微生物展现不同的选择性或敏感性。sers活性指示剂粒子可以针对培养样品作调整,在培养样品中一种或多种微生物的存在或一种或多种微生物的浓度可以变化。
sers试验的试剂可以包括一种以上类型的标记,例如,一种以上类型的sers活性报道分子,这取决于试验的需要。举例来说,在不同波长处展现拉曼信号的sers活性报道分子可以用于形成对于所关注的特定微生物来说独特的拉曼“指纹”,从而增强试验的特异性。不同报道分子可以连接到已经连接有不同的特异性结合成员的纳米粒子核心以提供能够检测所关注的一种以上微生物(例如,所关注的多种微生物)的试剂。
在本发明的一个实施方案中,sershnw技术的多重能力用于鉴别引起血流感染的最常见生物体中的六种。六种不同类型或“风格”的sers活性指示剂粒子存在于血液培养瓶中,每种与对将要检测的六种生物体之一具特异性的抗体偶联。器皿中还有能够与sers活性指示剂粒子形成夹心的磁性捕获粒子。磁性捕获粒子可以经过配置以使得存在将多个sers活性指示剂粒子夹在中间的常见捕获抗体或抗体组,或者,六种独立的磁性偶联物可以存在于器皿中,其中每种磁性偶联物独特地能够与六种sers活性指示剂粒子中的每一个形成夹心。当形成磁性团块并且从团块读出sers信号时,所测量的拉曼光谱将为来自团块中所存在的sers活性指示剂粒子的每种风格的贡献;sers活性指示剂粒子的存在指示了sers活性指示剂粒子对其具特异性的微生物的存在。去卷积算法可以有效地区分六种个别的sers活性指示剂粒子的光谱与所测量的总光谱。
图53示出了仅使用两种sers活性指示剂粒子的多重实施方案的示意图。在一个优选实施方案中,保留了标准气体传感器(例如bactectm),以便同时监测sers信号和ph传感器信号。这能够有效检测不被sershnw抗体识别的任何微生物。
如2008年3月20日提交的weidemaier等人的pct国际专利申请号pct/us2008/057700中进一步公开,在涉及sers活性指示剂粒子的本发明所公开的试验中,可以通过添加第二等分试样的报道分子来放大sers光谱,这些报道分子能够产生可检测信号并且与对至少一种sers活性报道分子具有亲和力的至少一种特异性结合成员缔合,在将样品和/或至少一种sers活性报道分子安置在内部之前、同时或之后这至少一种sers活性报道分子与一种或多种sers活性指示剂粒子缔合,其中第二等分试样的报道分子和与sers活性指示剂粒子缔合的至少一种sers活性报道分子是相同的。在一些实施方案中,第二等分试样的报道分子包含与能够产生sers信号的sers活性指示剂粒子缔合的sers活性报道分子。在将第二等分试样的报道分子安置到试验器皿中的那些实施方案中,第二等分试样的报道分子的特异性结合成员不会识别包含捕获区或连接到磁性捕获粒子的一种或多种特异性结合成员。
f.工作流程实例
根据一个示例性的实施方案,用于检测和鉴别沙门氏菌的培养样品可以与前述实施方案联合提供。在一个实施方案中,首先在富集器皿内的非选择性培养基中培养沙门氏菌,接下来以生物防护方式转移到含有检测试剂和第二选择性培养基的检测小瓶中。一般来说,沙门氏菌测试包括将具有任选的补充物的培养基添加到培养基制备器皿中。然后使培养基分散到富集器皿中,并且将样品添加到富集器皿中。任选地,在添加到富集器皿中之前使样品均化(例如,通过消化或掺合)。在这种情况下,将来自培养基制备器皿的培养基连同样品一起添加到均化器中。在均化之后,将样品转移到富集器皿中,并且将盖子附接到器皿。一旦已经将培养基和样品添加到富集器皿中并且已经附接富集器皿的盖子,可以读出器皿上的条形码用于监管链鉴定的目的。然后孵育富集器皿一段预定的时间。在孵育之后,可以用条形码读出器扫描富集器皿和检测小瓶。检测小瓶包括选择性培养基和特定地检测沙门氏菌的检测试剂。在检测小瓶中的培养基脱水的情况下,将复原流体添加到检测小瓶中,并且倒置小瓶以供混合。然后倾斜富集容器以用所需量的样品(例如,100μl)填充相应的储集器。将检测小瓶插入到富集器皿中以啮合开口内的针用于以生物防护方式将样品转移到检测小瓶中。然后将检测小瓶插入到实时自动化系统内用于样品的孵育和自动测试,包括样品的团化和光学分析。在检测阳性样品后,可以移出检测小瓶,用条形码扫描器扫描,并且发送用于进一步处理。
在一个替代性的示例性实施方案中,用于检测和鉴别李斯特菌的培养样品可以与前述实施方案联合提供。在一个优选实施方案中,在检测小瓶内李斯特菌的培养在富集器皿中所用的相同培养基中进行,以使得在整个工作流程中使用单一培养基。一般来说,李斯特菌测试包括将具有任选的补充物的培养基添加到培养基制备器皿中。然后使培养基分散到富集器皿中,并且将样品添加到富集器皿中。任选地,在添加到富集器皿中之前使样品均化(例如,通过消化或掺合)。在这种情况下,将来自培养基制备器皿的培养基连同样品一起添加到均化器中。在均化之后,将样品转移到富集器皿中,并且将盖子附接到器皿。一旦已经将培养基和样品添加到富集器皿中并且已经附接富集器皿的盖子,还可以读出器皿上的条形码用于监管链鉴定的目的。然后孵育富集器皿一段预定的时间。在孵育之后,可以用条形码读出器扫描富集器皿和检测小瓶。检测小瓶包括特定地检测李斯特菌的检测试剂。然后倾斜富集容器以用所需量的样品(例如,5ml)填充相应的储集器。将检测小瓶插入到富集器皿中以啮合端口内的针用于以生物防护方式将样品转移到检测小瓶中。然后将检测小瓶插入到实时自动化系统内用于样品的孵育和自动测试,包括样品的团化和光学分析。在检测阳性样品后,可以移出检测小瓶,用条形码扫描器扫描,并且发送用于进一步处理。
g.复原台
图93-95说明了可以与本发明的实施方案联合使用的复原台。如上文所论述,在检测小瓶中的培养基脱水的情况下,可以将复原流体添加到检测小瓶中。复原台有助于计量所需体积并且能够在不排空检测小瓶内所保留的真空的情况下添加复原流体。图93说明了一个实施方案,其中复原台350包括具有夹管阀354的囊状物352或类似的二级储集器。复原台350通过重力加料以使得流体被配置成自主储集器行进,通过管道358,并且当阀354打开时进入囊状物352中。举例来说,杠杆356可以顺时针旋转以啮合或夹紧管道358,从而在阀354处关闭管道。使用者然后能够将检测小瓶360插入到进入口362中,使得安置在进入口内的针啮合塞子364以将复原流体抽取到管中。在检测小瓶360从进入口362移出之后,塞子364被配置成密封检测小瓶以维持内部的真空。此外,囊状物352被配置成自动再填充以使得复原台350始终是准备好的。
或者,图94说明了根据另一个实施方案包括旋转阀376的复原台375。在这点上,复原流体被储存在储集器378中并且通过重力加料到第二储集器或囊状物中。当旋转阀376处于“关闭”位置时,没有流体由于从囊状物中泄漏而可以从进入口380逸出。为了转移流体,旋转阀376可以旋转到“打开”位置。将检测小瓶382插入到进入口380内,借此,当塞子啮合安置在进入口内的针时,然后可以从囊状物中移出流体。将阀376旋转到打开位置还关闭了进料到囊状物中的重力管线。当阀376旋转回到关闭位置时,囊状物能够自动再填充。旋转阀376可以用旋钮或其它适合的机构操作用于打开和关闭阀,不过旋转动作不是为了实现阀的这种打开和关闭所必需的(例如,阀通过线性运动而启动)。
图95描绘了根据本发明的另一个实施方案包括与旋转阀404流体连通的注射器402的复原台400。不同于先前的实施方案,复原台400不是通过重力加料,使得通过启动注射器将复原流体从储集器406中抽取并且进入注射器402中。在这点上,注射器402可以被配置成当旋转阀404处于关闭位置时抽取所需量的复原流体到注射器或安置在其中的囊状物中。一旦填充注射器,将阀404旋转到打开位置允许通过将检测小瓶插入到进入口408内并且啮合安置在进入口408内的针来取得注射器内所含的流体。将阀404旋转到打开位置关闭了从储集器406向囊状物进料的管线。再次,应了解,旋转阀404可以是有助于阀的打开和关闭的任何适合的机构。同样地,注射器402可以是被配置成从储集器406中抽取所需量的复原流体的任何适合的装置。
所描绘的实例展示了不需要外部电源的复原台。本领域的技术人员还可以预想到被供电的流体计量系统。
iii.代表性微生物
本发明的实施方案可以用于检测由菌血症和真菌血症引起的疑似血流感染。通常以不同时间间隔从受试者,例如患者的独立的静脉中收集多个血液样品,时间间隔取决于受试者的症状,例如发热的观测,或一些其它初始诊断。一定体积的血液样品,例如对于成人约3ml至约10ml以及对于儿科样品约1ml,在收集之后可以被安置到血液培养生长瓶中。通常,对于每个收集周期来说,将一个样品安置在适合于需氧生物体的血液培养生长瓶中并且将一个样品安置在适合于厌氧生物体的血液培养生长瓶中。
不同于本领域中已知的检测产气量的增加作为血液培养样品中微生物生长的量度的方法,本发明所公开的方法有利地允许检测细胞内病原体(例如,细菌、病毒)。细胞内微生物或病原体在其它细胞(例如,真核细胞)内生长和繁殖,并且因此不能使用本领域中已知的气体传感器来检测。可以使用本发明所公开的方法检测的代表性的细胞内微生物包括(但不限于)沙眼衣原体(chlamydiatrachomatis)和结核分枝杆菌(mycobacteriumtuberculosis)。
表1中所呈现的微生物作为菌血症或败血症的病因而通常在受试者中发现,并且以其在受试者中发现的次序来排序。表2中还注释了共同代表血液培养样品中所有阳性结果的80%的那些微生物以及被认为受处理的那些微生物。
食品、水、化妆品、药品和环境样品通常针对微生物进行筛选,这些微生物包括(但不限于)肠毒性大肠杆菌(etec)、肠病原性大肠杆菌(epec)、肠出血性大肠杆菌(ehec)、肠侵袭性大肠杆菌(eiec)、肠聚集性大肠杆菌(eaec)、弥散粘附性大肠杆菌(daec)、产志贺毒素大肠杆菌(stec)、大肠杆菌o157、大肠杆菌o157:h7、大肠杆菌o104、大肠杆菌o26、大肠杆菌o45、大肠杆菌o103、大肠杆菌o111、大肠杆菌o121和大肠杆菌o145、志贺菌种(shigellaspecies)、沙门氏菌种、邦戈尔沙门氏菌(salmonellabongori)、肠道沙门氏菌、弯曲杆菌种、小肠结肠炎耶尔森菌(yersiniaenterocolitica)、假结核耶尔森菌(yersiniapseudotuberculosis)、弧菌种(vibriospecies)、霍乱弧菌(vibriocholerae)、李斯特菌种、单核细胞增生性李斯特菌、格氏李斯特菌(listeriagrayii)、无害李斯特菌(listeriainnocua)、依氏李斯特菌(listeriaivanovii)、斯氏李斯特菌(listeriaseeligeri)、威氏李斯特菌(listeriawelshmeri)、葡萄球菌种、凝固酶阴性葡萄球菌种、金黄色葡萄球菌(staphylococcusaureus)、蜡样芽孢杆菌(bacilluscereus)、枯草芽孢杆菌(bacillussubtilis)、产气荚膜梭菌(clostridiumperfringens)、肉毒梭状芽胞杆菌(clostridiumbotulinum)、破伤风梭状芽胞杆菌(clostridiumtetani)、产芽胞梭状芽胞杆菌(clostridiumsporogenes)、克罗诺杆菌种(cronobacterspecies)、阪崎克罗诺杆菌(cronobactersakazakii)(正式称为阪崎肠杆菌(enterobactersakazakii))、链球菌种、化脓链球菌(s.pyogenes)、微球菌种(micrococcusspecies)、假单胞菌种(psuedomonasspecies)、绿脓假单胞菌(p.aeruginosa)、荧光假单胞菌(p.fluorescens)、恶臭假单胞菌(p.putida)、军团菌种(legionellaspecies)、沙雷氏菌种(serratiaspecies)、肺炎克雷伯菌、肠杆菌种(enterobacterspecies)、产碱杆菌种(alcaligenesspecies)、无色杆菌种(achromobacterspecies)、酵母和霉菌,如曲霉种(aspergillusspecies)、青霉种(penicilliumspecies)、枝顶孢霉种(acremoniumspecies)、枝孢霉种(cladosporiumspecies)、镰孢霉种(fusariumspecies)、毛霉种(mucorspecies)、根霉种(rhizopusspecies)、葡萄穗霉种(stachybotrysspecies)、木霉种(trichodermaspecies)、交链孢霉种(alternariaspecies)、地霉种(geotrichumspecies)、脉孢菌种(neurosporaspecies)、根毛霉种(rhizomucorspecies)、根霉种、黑粉菌种(ustilagospecies)、弯颈霉种(tolypocladiumspecies)、米佐卡霉种(mizukabispecies)、伞菌霉种(spinellusspecies)、枝孢霉种、交链孢霉种、葡萄孢种(botrytisspecies)、丛梗孢种(moniliaspecies)、红曲霉种(manoscusspecies)、被孢霉种(mortierellaspecies)、粉孢种(oidiumspecies)、卵孢霉种(oosproaspecies)、枝霉种(thamnidiumspecies)、念珠菌种(candidaspecies)、酵母种(saccharomycesspecies)、发癣菌种(trichophytonspecies)。
另外,这些样品通常是针对指示生物体进行筛选,这些生物体包括(但不限于)大肠菌群(coliform)、粪大肠菌群(fecalcoliform)、大肠杆菌、肠杆菌(enterobacteriaceae)、肠球菌种(enterococcusspecies)、大肠杆菌噬菌体或细菌噬菌体。
另外,一些样品是针对微生物的临床上显著的耐抗生素菌株进行筛选,这些菌株包括(但不限于)耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌种。
可以根据本发明的实施方案检测的微生物包括(但不限于)革兰氏阴性细菌、革兰氏阳性细菌、耐酸性革兰氏阳性细菌,以及真菌,包括酵母。根据本发明的一个实施方案,作为本发明所公开的血液培养试验的目标的代表性细菌和真菌微生物(即,抗原)紧接着在下文中提供。如在本文中的其它地方所提到,对紧接着在下文中呈现的抗原具有特异性的抗体可以包括(但不限于)多克隆抗体、单克隆抗体、fab'、fab”、重组抗体、单链抗体(sca)、人源化抗体或嵌合抗体。在所有情况下,抗体将具有对紧接着在下文中列出的抗原具特异性的一个或多个cdr。抗体在本领域中是已知的并且可容易地用于所选抗原。在一些情况下,抗原存在于细胞表面上。在其它情况下,抗原从细胞中分泌并且以“游离抗原”的形式存在于血液培养基中。在另外的其它情况下,可以同时测量游离和经结合的抗原以确认菌血症或真菌血症。
与在培养器皿中探寻的诊断信息无关,特异性结合成员将通常具有广泛特异性。特异性结合成员可以是泛菌株、泛血清群、泛种或泛属。
细菌细胞壁是复杂的半硬性结构,其界定生物体的形状,包围下面的脆弱细胞质膜,并且保护细菌细胞免受外部环境影响侵扰。细菌细胞壁由被称为肽聚糖的大分子网状物构成,其包含形成在细菌细胞周围的网格的碳水化合物和多肽。细菌细胞壁向细菌细胞提供机械稳定性并且防止渗透性溶解。与本发明最相关的是细胞壁的化学组成,其用于区分细菌的主要种类。
不同种类的细菌的细胞壁在厚度、结构和组成方面可能大不相同。然而,存在两种主要类型的细菌细胞壁,并且给定种类的细菌具有一种或另一种类型的细胞壁一般可以通过细胞对某些染料的反应来确定。用于将细菌染色的大多数广泛使用的染料可能是革兰氏染色剂。当用这种结晶紫和碘染色剂染色时,保留染色剂的细菌被称为革兰氏阳性的,并且不保留染色剂的那些细菌被称为革兰氏阴性的。
如本文所用的"革兰氏阳性细菌"意味着当暴露于革兰氏染色剂时保留染料并且因此被染成蓝紫色的细菌的菌株、类型、种类或属。
如本文所用的"革兰氏阴性细菌"意味着当暴露于革兰氏染色剂时不保留染料并且因此不会被染成蓝紫色的细菌的菌株、类型、种类或属。一般熟练的从业者当然将认识到,取决于染料的浓度和暴露的时长,革兰氏阴性细菌可以吸收很少量的革兰氏染色剂并且变得染成淡蓝紫色。然而,与用相同配方的革兰氏染色剂染色相同的时间量的革兰氏阳性细菌相比,革兰氏阴性细菌与革兰氏阳性细菌相比蓝紫色将淡得多。
代表性革兰氏阴性细菌包括(但不限于)肠杆菌科的细菌。肠杆菌科的代表性革兰氏阴性细菌包括(但不限于)埃希氏菌属(escherichiagenus)的细菌,如大肠杆菌种(模型)。对肠杆菌科的革兰氏阴性细菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合脂多糖(lps)或外膜蛋白(omp)的那些抗体。lps脂质a组分、lpso区域以及具有内核和外核区域的lps核心可以充当对埃希氏菌属的革兰氏阴性细菌具有亲和力的特异性结合成员的适合抗原。
埃希氏菌属的代表性成员包括:非脱羧埃希氏菌(e.adecarboxylata)、艾伯特埃希氏菌(e.albertii)、蟑螂埃希氏菌(e.blattae)、大肠杆菌、弗格森埃希氏菌(e.fergusonii)、赫氏埃希氏菌(e.hermannii)和伤口埃希氏菌(e.vulneris)。
肠杆菌科的另一个代表属是克雷伯菌属,包括(但不限于)肺炎克雷伯菌(klebsiellapneumoniae)(模型)。对克雷伯菌属的革兰氏阴性细菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合lps、荚膜多糖(cps)或k抗原(具有约50至约70kda的分子量的高分子量荚膜多糖)或omp的那些。
克雷伯菌属的代表性成员包括肉芽肿克雷伯菌(k.granulomatis)、移动克雷伯菌(k.mobilis)、解鸟氨酸克雷伯菌(k.ornithinolytica)、产酸克雷伯菌(k.oxytoca)、臭鼻克雷伯菌(k.ozaenae)、植生克雷伯菌(k.planticola)、肺炎克雷伯菌、鼻硬结克雷伯菌(k.rhinoscleromatis)、新加坡克雷伯菌(k.singaporensis)、土生克雷伯菌(k.terrigena)、特氏克雷伯菌(k.trevisanii)和黑座克雷伯菌(k.varricola)。
革兰氏阴性细菌还包括属于衣原体科(chlamydiaceaefamily)的细菌。衣原体科的代表性革兰氏阴性细菌包括(但不限于)衣原体属(chlamydiagenus)的细菌,如沙眼衣原体种(c.trachomatisspecies)(模型)。对衣原体科的革兰氏阴性细菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合脂多糖(lps)或外膜蛋白(omp),包括主要外膜蛋白(momp)的那些。
衣原体属的代表性成员包括:鼠衣原体(c.muridarum)、猪衣原体(c.suis)和沙眼衣原体。
适合的革兰氏阴性细菌还可以包括属于以下的那些细菌:假单胞菌属(pseudomonasgenus),包括(但不限于)绿脓假单胞菌(模型);寡养单胞菌属(stenotrophomonasgenus),包括(但不限于)嗜麦芽寡养单胞菌(s.maltophilia)(模型);以及不动杆菌属(acinetobactergenus),包括(但不限于)鲍曼不动杆菌(a.baumannii)(模型)。由对假单胞菌属的革兰氏阴性细菌具有亲和力的特异性结合成员识别的适合抗原包括(但不限于)lps、omp、铁调节膜蛋白(irmp)、鞭毛蛋白、胞外粘液多糖(mep)和外膜蛋白f(oprf)。由对寡养单胞菌属的革兰氏阴性细菌具有亲和力的特异性结合成员识别的适合抗原包括(但不限于)lps、鞭毛蛋白、主要细胞外蛋白酶、omp、结合到iggfc的30kda暴露蛋白,以及48.5kda膜蛋白。由对不动杆菌属的革兰氏阴性细菌具有亲和力的特异性结合成员识别的适合抗原包括(但不限于)lps、具有d-rhamos的lps、bap(生物膜相关因子)、荚膜多糖(cps)和omp。
代表性革兰氏阳性细菌包括(但不限于)微球菌科(micrococcaceaefamily)的细菌。微球菌科的革兰氏阳性细菌包括(但不限于)葡萄球菌属的细菌,包括表皮葡萄球菌种(模型)。对革兰氏阳性细菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合到脂磷壁酸(lta)、肽聚糖、生物膜抗原(包括140/200-kda生物膜抗原)和20-kda多糖(ps)或脂质s(磷酸甘油-糖脂)的那些。对葡萄球菌属的革兰氏阳性细菌(包括(但不限于)金黄色葡萄球菌)具有亲和力的其它适合结合成员包括特异性地结合以下的那些:磷壁酸、识别粘附基质分子的微生物表面组分(mscramms)、铁应答表面决定子a(isda)、110kda、98kda和67kda蛋白质、rnaiii活化蛋白(rap)、rnaiii活化蛋白的靶标(trap)、α毒素、聚-n-琥珀酰基β-1-6-葡糖胺(pnsg)、脂肪酶、葡萄球菌溶血素、fnbpa、fnbpb、免疫显性葡萄球菌抗原、荚膜多糖,或与甲氧西林耐药性相关的细胞表面抗原。
葡萄球菌属的代表性成员包括:金黄色葡萄球菌、耳葡萄球菌(s.auricularis)、头状葡萄球菌(s.capitis)、山羊葡萄球菌(s.caprae)、科氏葡萄球菌(s.cohnii)、表皮葡萄球菌、猫葡萄球菌(s.felis)、溶血葡萄球菌(s.haemolyticus)、人葡萄球菌(s.hominis)、中间葡萄球菌(s.intermedius)、路邓葡萄球菌(s.lugdunensis)、皮氏葡萄球菌(s.pettenkoferi)、腐生葡萄球菌(s.saprophyticus)、施氏葡萄球菌(s.schleiferi)、模仿葡萄球菌(s.simulans)、小牛葡萄球菌(s.vitulus)、沃氏葡萄球菌(s.warneri)和木糖葡萄球菌(s.xylosus)。
其它代表性的革兰氏阳性细菌包括肠球菌属的细菌,包括(但不限于)粪肠球菌(也被称为d群链球菌)和屎肠球菌。对粪肠球菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合到脂磷壁酸(lta)、胶原蛋白结合表面抗原(cna)、聚集物质(as)、荚膜多糖、磷壁酸样荚膜多糖、esp基因产物、gls24、epa基因产物、ace(ecm结合子)或肽聚糖的那些。对粪肠球菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合到acm蛋白质(胶原蛋白结合子)或saga蛋白质的那些。
代表性的耐酸性革兰氏阳性细菌包括(但不限于)分枝杆菌科(mycobacteriaceaefamily)的细菌。分枝杆菌科的耐酸性革兰氏阳性细菌包括(但不限于)分枝杆菌属(mycobacteriumgenus)的细菌,如牛分枝杆菌(m.bovis)(模型)种和结核分枝杆菌(m.tuberculosis)的种(模型)。对耐酸性革兰氏阳性细菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合到阿拉伯甘露聚糖(am)、脂阿拉伯甘露聚糖(lam)或38kda抗原的那些。
分枝杆菌属的代表性成员包括:脓肿分枝杆菌(m.abscessus)、非洲分枝杆菌(m.africanum)、田野分枝杆菌(m.agri)、爱知分枝杆菌(m.aichiense)、蜂房分枝杆菌(m.alvei)、阿朋分枝杆菌(m.arupense)、亚洲分枝杆菌(m.asiaticum)、欧巴涅分枝杆菌(m.aubagnense)、牡牛分枝杆菌(m.aurum)、南非分枝杆菌(m.austroafricanum)、鸟分枝杆菌复合群(mycobacteriumaviumcomplex;mac)(包括鸟分枝杆菌(m.avium)、鸟型分枝杆菌副结核亚种(m.aviumparatuberculosis)、鸟分枝杆菌森林土壤亚种(m.aviumsilvaticum)、鸟分枝杆菌“人和猪亚种(hominissuis)”)、波氏分枝杆菌(m.boenickei)、波希米亚分枝杆菌(m.bohemicum)、博氏分枝杆菌(m.bolletii)、波特尼分枝杆菌(m.botniense)、牛分枝杆菌、德氏分枝杆菌(m.branderi)、布里斯班分枝杆菌(m.brisbanense)、雾分枝杆菌(m.brumae)、加那利群岛分枝杆菌(m.canariasense)、山羊分枝杆菌(m.caprae)、隐藏分枝杆菌(m.celatum)、龟分枝杆菌(m.chelonae)、嵌合分枝杆菌(m.chimaera)、千田分枝杆菌(m.chitae)、氯酚分枝杆菌(m.chlorophenolicum)、楚布分枝杆菌(m.chubuense)、哥伦比亚分枝杆菌(m.colombiense)、康赛医院分枝杆菌(m.conceptionense)、汇合分枝杆菌(m.confluentis)、出众分枝杆菌(m.conspicuum)、库氏分枝杆菌(m.cookii)、染料分枝杆菌(m.cosmeticum)、迪尔诺弗分枝杆菌(m.diernhoferi)、多利分枝杆菌(m.doricum)、杜氏分枝杆菌(m.duvalii)、象分枝杆菌(m.elephantis)、诡诈分枝杆菌(m.fallax)、鼻疽分枝杆菌(m.farcinogenes)、转黄分枝杆菌(m.flavescens)、佛罗伦萨分枝杆菌(m.florentinum)、食突蒽分枝杆菌(m.fluoroanthenivorans)、偶发分枝杆菌(m.fortuitum)、偶发分枝杆菌解乙酰氨亚种(m.fortuitumsubsp.acetamidolyticum)、腓特烈斯堡分枝杆菌(m.frederiksbergense)、加地斯分枝杆菌(m.gadium)、胃分枝杆菌(m.gastri)、日内瓦分枝杆菌(m.genavense)、浅黄分枝杆菌(m.gilvum)、古地分枝杆菌(m.goodii)、戈登分枝杆菌(m.gordonae)、嗜血分枝杆菌(m.haemophilum)、哈斯分枝杆菌(m.hassiacum)、半岛分枝杆菌(m.heckeshornense)、海德堡分枝杆菌(m.heidelbergense)、爱尔兰分枝杆菌(m.hiberniae)、霍氏分枝杆菌(m.hodleri)、荷斯坦分枝杆菌(m.holsaticum)、休斯顿分枝杆菌(m.houstonense)、免疫原分枝杆菌(m.immunogenum)、中庸分枝杆菌(m.interjectum)、中间分枝杆菌(m.intermedium)、胞内分枝杆菌(m.intracellulare)、堪萨斯分枝杆菌(m.kansasii)、科莫斯分枝杆菌(m.komossense)、库比尔分枝杆菌(m.kubicae)、熊本分枝杆菌(m.kumamotonense)、拉克丝分枝杆菌(m.lacus)、缓黄分枝杆菌(m.lentiflavum)、麻风分枝杆菌(m.leprae)、鼠麻风分枝杆菌(m.lepraemurium)、马达加斯加分枝杆菌(m.madagascariense)、马德里分枝杆菌(m.mageritense)、玛尔摩分枝杆菌(m.malmoense)、海分枝杆菌(m.marinum)、马赛分枝杆菌(m.massiliense)、田鼠分枝杆菌(m.microti)、摩纳哥分枝杆菌(m.monacense)、摩特弗分枝杆菌(m.montefiorense)、莫里奥卡分枝杆菌(m.moriokaense)、产粘液分枝杆菌(m.mucogenicum)、墙壁分枝杆菌(m.murale)、内布拉斯加分枝杆菌(m.nebraskense)、新金色分枝杆菌(m.neoaurum)、新奥尔良分枝杆菌(m.neworleansense)、无色分枝杆菌(m.nonchromogenicum)、新卡城分枝杆菌(m.novocastrense)、奥布分枝杆菌(m.obuense)、沼泽分枝杆菌(m.palustre)、副偶发分枝杆菌(m.parafortuitum)、副瘰疬分枝杆菌(m.parascrofulaceum)、帕尔马分枝杆菌(m.parmense)、外来分枝杆菌(m.peregrinum)、草分枝杆菌(m.phlei)、福西亚分枝杆菌(m.phocaicum)、海豹分枝杆菌(m.pinnipedii)、猪分枝杆菌(m.porcinum)、多孔分枝杆菌(m.poriferae)、假石氏分枝杆菌(m.pseudoshottsii)、粉尘分枝杆菌(m.pulveris)、耐冷分枝杆菌(m.psychrotolerans)、食花分枝杆菌(m.pyrenivorans)、罗得西亚分枝杆菌(m.rhodesiae)、萨斯喀彻温分枝杆菌(m.saskatchewanense)、瘰疬分枝杆菌(m.scrofulaceum)、塞内加尔分枝杆菌(m.senegalense)、首尔分枝杆菌(m.seoulense)、脓毒分枝杆菌(m.septicum)、下出分枝杆菌(m.shimoidei)、石氏分枝杆菌(m.shottsii)、猿分枝杆菌(m.simiae)、耻垢分枝杆菌(m.smegmatis)、泥炭藓分枝杆菌(m.sphagni)、斯氏分枝杆菌(m.szulgai)、土地分枝杆菌(m.terrae)、耐高温分枝杆菌(m.thermoresistibile)、东海分枝杆菌(m.tokaiense)、三重分枝杆菌(m.triplex)、次要分枝杆菌(m.triviale)、结核分枝杆菌复合群(mycobacteriumtuberculosiscomplex;mtbc)(包括结核分枝杆菌)、牛分枝杆菌、牛分枝杆菌bcg、非洲分枝杆菌、卡氏分枝杆菌(m.canetti)、山羊分枝杆菌、海豹分枝杆菌'、托斯卡纳分枝杆菌(m.tusciae)、溃疡分枝杆菌(m.ulcerans)、母牛分枝杆菌(m.vaccae)、土壤分枝杆菌(m.vanbaalenii)、沃林斯基分枝杆菌(m.wolinskyi)和蟾蜍分枝杆菌(m.xenopi)。
代表性真菌(包括酵母)包括(但不限于)酵母菌科(saccharomycetaceaefamily),包括念珠菌属,如白色念珠菌(模型)。对属于念珠菌属的真菌具有亲和力的适合结合成员(例如,抗体)包括(但不限于)特异性地结合到甘露聚糖、磷酸甘露聚糖、甘露糖蛋白58(mp58)、半乳甘露聚糖、β-d-葡聚糖、金属阿拉伯糖醇、细胞壁相关的甘油醛-3-磷酸脱氢酶、烯醇酶-(47/48kda)、分泌型天门冬氨酰蛋白酶(sap)或热休克蛋白90(hsp-90)的那些。
念珠菌属的代表性成员包括:阿塞念珠菌(c.aaseri)、白色念珠菌、安帕念珠菌(c.amapae)、安托米念珠菌(c.anatomiae)、安库登念珠菌(c.ancudensis)、安替兰念珠菌(c.antillancae)、阿匹考念珠菌(c.apicola)、蜜蜂念珠菌(c.apis)、大西洋念珠菌(c.atlantica)、阿莫非念珠菌(c.atmosphaerica)、奥净念珠菌(c.auringiensis)、奥曲玛念珠菌(c.austromarina)、阿兹玛念珠菌(c.azyma)、比奇念珠菌(c.beechii)、贝塔念珠菌(c.bertae)、伯塞特念珠菌(c.berthetii)、布兰克念珠菌(c.blankii)、博伊丁念珠菌(c.boidinii)、博替考念珠菌(c.boleticola)、博比念珠菌(c.bombi)、水解念珠菌(c.bombicola)、布尼丝念珠菌(c.buinensis)、丁酸念珠菌(c.butyri)、卡塔尔念珠菌(c.cantarellii)、卡瑟替卡念珠菌(c.caseinolytica)、卡斯特念珠菌(c.castellii)、卡斯滕念珠菌(c.castrensis)、链状念珠菌(c.catenulata)、智利念珠菌(c.chilensis)、奇普特念珠菌(c.chiropterorum)、柯氏念珠菌(c.chodatii)、西弗念珠菌(c.ciferrii)、考泊莫念珠菌(c.coipomoensis)、球聚念珠菌(c.conglobata)、圆柱念珠菌(c.cylindracea)、登德卡念珠菌(c.dendrica)、登若玛念珠菌(c.dendronema)、肉苁蓉念珠菌(c.deserticola)、迪丹氏念珠菌(c.diddensiae)、叉开念珠菌(c.diversa)、德迪斯念珠菌(c.drimydis)、都柏林念珠菌(c.dubliniensis)、艾达克念珠菌(c.edax)、嗜虫念珠菌(c.entomophila)、加斯藤念珠菌(c.ergastensis)、欧诺比念珠菌(c.ernobii)、乙醇念珠菌(c.ethanolica)、狼毒念珠菌(c.euphorbiae)、恩弗比念珠菌(c.euphorbiiphila)、费比恩念珠菌(c.fabianii)、法氏念珠菌(c.famata)、法氏念珠菌法氏变种(c.famatavar.famata)、法氏念珠菌弗兰变种(c.famatavar.flareri)、芬尼卡念珠菌(c.fennica)、费替卡念珠菌(c.fermenticarens)、非蒙塔念珠菌(c.firmetaria)、叶生壳念珠菌(c.floricola)、弗伐利斯念珠菌(c.fluviatilis)、弗里斯念珠菌(c.freyschussii)、弗里德假念珠菌(c.friedrichii)、弗土司念珠菌(c.fructus)、卡拉狄加念珠菌(c.galacta)、戈卡瑞斯念珠菌(c.geochares)、光滑念珠菌(c.glabrata)、团念珠菌(c.glaebosa)、格鲁索非念珠菌(c.glucosophila)、葛罗氏念珠菌(c.gropengiesseri)、季也蒙念珠菌(c.guilliermondii)、季也蒙念珠菌季也蒙变种(c.guilliermondiivar.guilliermondii)、季也蒙念珠菌璞膜变种(c.guilliermondiivar.membranaefaciens)、希木龙念珠菌(c.haemulonii)、虫群念珠菌(c.homilentoma)、短小念珠菌(c.humilis)、异常念珠菌(c.incommunis)、平常念珠菌(c.inconspicua)、虫生念珠菌(c.insectalens)、虫念珠菌(c.insectamans)、昆虫念珠菌(c.insectorum)、中间念珠菌(c.intermedia)、斯瓦达念珠菌(c.ishiwadae)、卡拉维念珠菌(c.karawaiewii)、乳酒念珠菌(c.kefyr)、克瑞斯念珠菌(c.krissii)、克鲁伊念珠菌(c.kruisii)、克鲁斯氏念珠菌(c.krusei)、炼乳念珠菌(c.lactis-condensi)、劳瑞丽念珠菌(c.laureliae)、溶脂念珠菌(c.lipolytica)、兰奎恩斯念珠菌(c.llanquihuensis)、罗德念珠菌(c.lodderae)、葡萄牙念珠菌(c.lusitaniae)、乐克索念珠菌(c.lyxosophila)、木兰念珠菌(c.magnoliae)、麦牙糖念珠菌(c.maltosa)、海洋念珠菌(c.maris)、滨海念珠菌(c.maritima)、口津念珠菌(c.melibiosica)、璞膜念珠菌(c.membranifaciens)、肠系膜念珠菌(c.mesenterica)、美索萨念珠菌(c.methanosorbosa)、米氏念珠菌(c.milleri)、莫格念珠菌(c.mogii)、莫塔那念珠菌(c.montana)、穆戈米念珠菌(c.multigemmis)、穆萨念珠菌(c.musae)、纳登念珠菌(c.naeodendra)、那他念珠菌(c.natalensis)、奈莫念珠菌(c.nemodendra)、挪威念珠菌(c.norvegensis)、诺维吉念珠菌(c.norvegica)、奥丁瓦念珠菌(c.odintsovae)、橄榄念珠菌(c.oleophila)、奥里戈念珠菌(c.oregonensis)、卵形念珠菌(c.ovalis)、抗草甘膦念珠菌(c.palmioleophila)、帕鲁迪格念珠菌(c.paludigena)、近平滑念珠菌(c.parapsilosis)、近皱褶念珠菌(c.pararugosa)、薄膜念珠菌(c.pelliculosa)、盾状念珠菌(c.peltata)、裴休斯念珠菌(c.petrohuensis)、匹纳丽念珠菌(c.pignaliae)、松木层念珠菌(c.pini)、杨树念珠菌(c.populi)、拟间型念珠菌(c.pseudointermedia)、拟郞比可念珠菌(c.pseudolambica)、嗜冷念珠菌(c.psychrophila)、铁红念珠菌(c.pulcherrima)、桔念珠菌(c.quercitrusa)、栎柱念珠菌(c.quercuum)、瑞氏念珠菌(c.railenensis)、拉考夫念珠菌(c.reukaufii)、鹬虻念珠菌(c.rhagii)、粗壮念珠菌(c.robusta)、皱膜念珠菌(c.rugopelliculosa)、皱褶念珠菌(c.rugosa)、萨托安念珠菌(c.saitoana)、清酒念珠菌(c.sake)、赛丽达念珠菌(c.salida)、萨地念珠菌(c.salmanticensis)、圣塔玛丽埃念珠菌(c.santamariae)、散本司念珠菌(c.santjacobensis)、萨沃尼卡念珠菌(c.savonica)、沙塔夫念珠菌(c.schatavii)、瑟曲恩丝念珠菌(c.sequanensis)、休哈塔念珠菌(c.shehatae)、休哈塔念珠菌因赛托变种(c.shehataevar.insectosa)、休哈塔念珠菌利诺萨变种(c.shehataevar.lignosa)、休哈塔念珠菌休哈塔变种(c.shehataevar.shehatae)、马肠念珠菌(c.silvae)、林木念珠菌(c.silvanorum)、丝瓦替卡念珠菌(c.silvatica)、丝维库念珠菌(c.silvicultrix)、马铃薯念珠菌(c.solani)、索诺拉念珠菌(c.sonorensis)、索非瑞纳念珠菌(c.sophiae-reginae)、索伯非那念珠菌(c.sorbophila)、蝇粪念珠菌(c.sorbosa)、山梨木糖念珠菌(c.sorboxylosa)、斯潘多维念珠菌(c.spandovensis)、星形念珠菌(c.stellata)、萨菲念珠菌(c.succiphila)、司西念珠菌(c.suecica)、坦扎瓦丝念珠菌(c.tanzawaensis)、塔佩念珠菌(c.tapae)、埃切念珠菌(c.techellsii)、纤细念珠菌(c.tenuis)、托雷斯念珠菌(c.torresii)、热带念珠菌(c.tropicalis)、特苏奇亚念珠菌(c.tsuchiyae)、产朊念珠菌(c.utilis)、瓦辛尼念珠菌(c.vaccinii)、瓦尔维亚念珠菌(c.valdiviana)、粗状念珠菌(c.valida)、范德念珠菌(c.vanderwaltii)、瓦尔念珠菌(c.vartiovaarae)、耐盐念珠菌(c.versatilis)、糖尿念珠菌(c.vini)、维斯念珠菌(c.viswanathii)、魏氏念珠菌(c.wickerhamii)、赞斯托念珠菌(c.xestobii)和涎沫念珠菌(c.zeylanoides)。
对耐甲氧西林金黄色葡萄球菌(mrsa)菌株具有特异性的治疗性抗体(如aurograbtm)也可以在捕获或指示表面上使用。同样地,对热休克蛋白hsp90具有特异性的治疗性单克隆抗体(mab)myograbtm(依芬古单抗(efungumab))可以用于检测白色念珠菌。
本发明所公开的sers活性指示剂粒子可以与许多其它可以存在于培养环境中的光学活性物质区分开来,这些光学活性物质如用于支持生长的培养基的组分、全血、sps抗凝剂、食品颗粒和添加剂。此外,特异性sers活性指示剂粒子展现必要的信号强度以允许检测少量的细菌细胞。另外,多种sers活性指示剂粒子,各自具有独特的sers特征图,允许血液培养样品针对可以通常在哺乳动物(例如人)血液中发现的多个微生物(例如,二十个)中的任一者进行询查。在这些实施方案中,每种特定微生物的检测可以同时进行,这在本文中被称作“多重试验”。
根据一个实施方案,例如血液培养,本发明所公开的多重试验的主要目标包括:凝固酶阴性葡萄球菌、金黄色葡萄球菌、粪肠球菌、大肠杆菌、肺炎克雷伯菌、屎肠球菌、草绿色链球菌(viridansgroupstreptococci)、绿脓假单胞菌、肺炎链球菌、阴沟肠杆菌、粘质沙雷氏菌、鲍曼不动杆菌、奇异变形杆菌、无乳链球菌、产酸克雷伯菌、产气肠杆菌、嗜麦芽寡养单胞菌、弗氏柠檬酸杆菌、化脓链球菌和鸟肠球菌。在一些实施方案中,这多个目标可以通过本发明所公开的多重试验同时检测。
iv.代表性培养基
适合与本发明的实施方案一起使用的代表性培养基紧接着在下文中提供。本领域的一般技术人员将认识到,本发明所公开的配方可以作修改以满足特定的性能需求。另外,取决于特定应用,这些配方中可以安置有co2、o2、n2和其组合,以形成适合于需氧、厌氧或微量需氧的生长的环境。任选地,一些培养基含有吸附剂以从培养基中分离(即,去除)干扰物,如抗生素,或可以存在于受试者的血液样品中的免疫元素,或在培养期间产生的代谢物。参看例如美国专利号5,624,814,其以全文引用的方式并入本文中。举例来说,bdbactectmmediaplusanaerobic/f、bdbactectmplusaerobic/f和bdbactectmpedsplus/f,其中每一个可获自becton,dickinson,andcompany(franklinlakes,newjersey),全部含有用于分离抗生素的树脂,这些抗生素以其它方式可以抑制血液培养基中的微生物生长。树脂的直径基本上大于血液的任何组分并且比血液中所发现的哺乳动物细胞更坚硬。培养吸收剂的另一个实例是用于选择性地培养食品和环境样品中的沙门氏菌的各种连四硫酸盐肉汤配方中所发现的沉淀碳酸钙(1%-2.5%w/v)。碳酸钙颗粒中和了通过使沙门氏菌生长而还原连四硫酸盐所产生的硫酸。
a.bdbactectmmyco/f溶解培养小瓶
bdbactectmmyco/f溶解培养小瓶支持需氧微生物的生长和检测。更具体地说,bdbactectmmyco/f溶解培养小瓶是将要用作需氧血液培养基的辅助物的非选择性培养基用于从血液样本中回收分枝杆菌以及从血液和无菌体液中回收酵母和真菌。
结核分枝杆菌(mtb)和除结核分枝杆菌之外的分枝杆菌(mott),尤其是鸟分枝杆菌复合群(mac),变得复兴起来。从1985年到1992年,mtb病例的数目据报道增加了18%。在1981年与1987年之间,aids病例监控指示,5.5%的aids患者具有播散性非结核分枝杆菌感染,例如mac。截止1990年,播散性非结核分枝杆菌感染的病例增加已经导致7.6%的累计发病率。自20世纪80年代早期以来,真菌血症的发病率也稳步地增加。这些增加加强了对用于真菌血症和结核菌血症的有效诊断程序的需要。
本发明所公开的配方的组分可以包括(但不限于)提供用于分枝杆菌和真菌的特定菌株的铁源的柠檬酸铁铵或等价物、皂角苷或等价的血液溶解剂,以及用以提供营养补充物的特定蛋白质和糖。
b.bdbactectm12b分枝杆菌培养小瓶middlebrook7h12
定性的bactectm12b分枝杆菌培养基可以用于从临床样本、唾液、胃液、尿液、组织、粘液脓性样本、其它体液和其它呼吸道分泌物中培养和回收分枝杆菌,区分结核分枝杆菌复合群与其它分枝杆菌,以及结核分枝杆菌的药物敏感性测试。
c.bactectmlytic/10anaerobic/f培养小瓶
bactectmlytic/10anaerobic/fbactectmlytic/10anaerobic/f培养基还适用于本发明的实施方案。
d.bactectmplusaerobic/f*和plusanaerobic/f*培养小瓶大豆酪蛋
白消化肉汤
bactectmplusaerobic/f和plusanaerobic/f培养基提供了用于从血液中培养和回收微生物(细菌和酵母)的定性程序并且已经过配制以允许添加多达10ml的血液。添加这些更大的样品体积使得总检测率更高和检测时间更早。
e.bdbactectmstandardanaerobic/f培养小瓶大豆酪蛋白消化
bdbactectmstandardanaerobic/f培养小瓶大豆酪蛋白消化肉汤提供了用于从血液中培养和回收厌氧微生物的定性程序。
f.bdbactectmpedsplustm/f培养小瓶
bactectm培养小瓶类型pedsplustm/f(含co2的富集大豆酪蛋白消化肉汤)意图与需氧培养一起使用并且提供了从体积一般小于3ml的儿科和其它血液样本中培养和回收需氧微生物(主要是细菌和酵母)。
g.standard/10aerobic/f培养小瓶
bactectmstandard/10aerobic/f培养小瓶(含co2的富集大豆酪蛋白消化肉汤)意图用于需氧血液培养中并且提供了从血液中培养和回收需氧微生物(细菌和酵母)。
h.bact/alerttm培养小瓶
bact/alerttmfan、bact/alerttmfn和bact/alerttmsn培养小瓶(biomérieux,durham,nc)意图用于厌氧血液培养中并且提供了从血液中培养和回收厌氧微生物(细菌和酵母)。
i.选择性大肠杆菌培养基
具有丙酮酸盐(mbpwp)和吖啶黄-头孢磺啶-万古霉素(acriflavin-cefsulodin-vancomycin;acv)补充物的改良缓冲蛋白胨水是由fda细菌学分析手册(bacteriologicalanalyticalmanual;bam)指定的用于富集样品以供检测致泻性大肠杆菌的培养基。
j.选择性李斯特菌培养基
frasier肉汤基础和fraser肉汤补充物用于选择性地富集和检测李斯特菌种。usda微生物实验室指南(microbiologicallaboratoryguidebook;mlg)推荐在测试红肉、家禽、鸡蛋和环境样品中的单核细胞增生性李斯特菌(l.monocytogenes)时使用fraser肉汤(usdamlg第8.07章,修订8/3/09)。
k.选择性沙门氏菌培养基
连四硫酸盐基础肉汤hajna是经设计用于选择性富集沙门氏菌的培养基。连四硫酸盐是通过在正要富集之前添加碘和碘化钾来产生。usda微生物实验室手册(microbiologicallaboratorymanual)规定这种肉汤用于选择性富集肉类、家禽、巴氏杀菌蛋和鲶鱼产品中的沙门氏菌(usdamlg第4.05章,1/20/11修订)。
l.沙门氏菌培养基
除了上文所列的培养基以外,存在若干种在本领域中通常已知的肉汤来培养或维持沙门氏菌,包括(但不限于)脑心浸液肉汤、亮绿磺胺增菌液(bddifcotm)、改良亮绿肉汤(bddifcotm)、缓冲蛋白胨水(bddifcotm)、缓冲蛋白胨酪蛋白水(bddifcotm)、dey-engly肉汤(bddifcotm)、ee肉汤mossel增菌液(bddifcotm)、革兰氏阴性肉汤(bddifcotm)、革兰氏阴性肉汤hajna(bddifcotm)、乳糖肉汤(bddifcotm)、letheen肉汤(bddifcotm)、赖氨酸脱羧酶肉汤、m肉汤(bddifcotm)、丙二酸盐肉汤(bddifcotm)、mr-vp肉汤、营养肉汤、沙门氏菌一步法肉汤(oxoid)、酚红碳水化合物肉汤(bdbbltm)、氰化钾肉汤、紫色碳水化合物肉汤(bdbbltm)、
m.李斯特菌培养基
除了上文所列的培养基以外,存在若干种在本领域中通常已知的肉汤来培养或维持李斯特菌,包括(但不限于)脑心浸液(bhi)肉汤、缓冲李斯特菌增菌肉汤(bleb)、营养肉汤、紫色碳水化合物发酵肉汤基础(m13015)(含有葡萄糖、七叶苷、麦芽糖、鼠李糖、甘露糖醇和木糖的0.5%溶液)、sim培养基、含0.6%酵母提取物的胰化酪蛋白大豆肉汤、胰蛋白胨肉汤、改良佛蒙特大学(uvm)肉汤、吗啉丙磺酸缓冲李斯特菌增菌肉汤(mops-bleb)、demi-frasier、fraser肉汤、李斯特菌增菌肉汤(bddifcotm,oxoid)、李斯特菌one肉汤(oxoid)、含补充物的
v.代表性样品
存在于受测试的样品中的一种或多种微生物的量可以用浓度表示。浓度可以表示为定性值,例如阴性或阳性型结果,例如“是”或“否”的应答,这指示了微生物的存在或不存在,或表示为定量值。此外,培养样品中给定微生物的浓度可以用相对量或绝对量报道,例如“定量值”。
微生物的量(即,浓度)可以等于零,这指示了所探寻的特定分析物不存在或特定分析物的浓度低于试验的检测限。所测量的量可以是信号,例如sers信号,而没有任何另外的测量或操作。或者,所测量的量可以表示为特定微生物的测量值与另一种化合物(包括(但不限于)标准微生物或另一种微生物)的测量值的差异、百分比或比率。差异可以是负的,这指示了所测量的微生物的量减少。量还可以表示为在不同时间点测量的微生物本身的差异或比率。微生物的量可以直接从所产生的信号确定,或所产生的信号可以用于算法中,其中这种算法经设计以将所产生的信号的值与样品中微生物的量相关联。如上文所论述,本发明的实施方案可与能够实时测量一种或多种微生物的浓度的装置一起使用。
具体实施方式
已经包括了以下实施例以向本领域的一般技术人员提供指导来实施本发明所公开的主题的代表性实施方案。鉴于本公开和本领域中的一般技术水平,技术人员可以了解,以下实施例意图仅仅是示例性的并且在不脱离本发明所公开的主题的范围的情况下可以采用众多变化、修改和变更。以下实施例是作为说明并且不是作为限制而提供。
实施例1
sershnw试剂对大肠杆菌的检测时间的影响
图54示出了比较在有和没有适合用于本发明的多个实施方案中的sershnw试剂的情况下血液培养样品的大肠杆菌生长的检测时间的实验的结果。
在这个实施例中,通过用70%乙醇洗涤使未偶联的sers活性指示剂粒子(sers440标签)和未偶联的磁性捕获粒子(
实施例2
重复团化与微生物生长相容
图55示出了在实验过程中监测鼠伤寒沙门氏菌生长以确定团化是否负面影响生物体生长的实验的结果。
在这个实施例中,在42℃下在含补充物的sdix沙门氏菌选择性初级培养基中的过夜培养物中使鼠伤寒沙门氏菌(s.typhimurium)(atcc14028)生长。以1:100稀释到sdix沙门氏菌二级培养基中。通过在营养琼脂板上进行板计数来确定二级培养基中的起始接种量是1.8×107cfu/ml。然后,将经接种的二级培养基放到多个管中,全部含有偶联到sdix沙门氏菌抗体的sers标签和磁性粒子。将管放置在系统150(参看图24)中用于在42℃下生长期间进行监测。在生长期间每隔0.5小时使管团化并进行询查。在这个实验中,在1个、3个、6个、9个和11个团化和读出周期之后从仪器中移出管。通过将稀释液涂到营养琼脂板上来对这些管进行计数。可以看出,鼠伤寒沙门氏菌的生长不会由于sers标签和磁性粒子的存在而受损,也不会由于重复团化和用激光询查团块而受损。
实施例3
调整团化频率的影响
在检查重复团化对微生物生长和试验性能的影响的实验中,从bdbbltm营养琼脂划线板中拣选肯塔基沙门氏菌(salmonellakentucky)(atcc9263)的单一集落,并且在42℃下在含60μl噬菌体补充物的6mlsdix
图56示出了来自实验的代表性数据集。示出了来自两个系统的数据,其中强度轴按比例绘制以供比较。(注意,由于光学效率的差异而不应比较在仪器之间标签权重的绝对强度。)生长曲线的形状几乎相同,这指示了团块形成、测量和分散的周期数增加不会阻碍生长或检测。唯一显著的差异在于具有更高频率读出的曲线在生长动力学上提供了更好的分辨率。
实施例4
样品管和磁体的相对运动的影响
可重现的团块形成是获得可重现的试验信号的关键步骤。这个实施例涉及两种用以形成团块的不同方式。在第一种(固定磁体)中,磁体保持固定在适当位置,而管在磁体上方移动搅动行程的全程。在图49中所示的第二种优选配置(耦合)中,磁体连同管一起移动。在一系列实验中,sers标签共价连接到甲苯磺酰基活化的磁性粒子以形成sers-磁性珠粒预复合物(pc)。预复合的珠粒是通过经由sers表面上的硫醇(-sh)基团与磁性粒子表面上的甲苯磺酰基(tos)基团反应使sers粒子共价连接到
图57示出了在用固定磁体团化之后水中pc的图像。通过以0.5hz的搅动频率和25mm的行程使管在固定条形磁体上方移动来将水中的pc团化1.5分钟。停止搅动,并且在移动条形磁体远离管之前使磁体保持30秒。如图57中所示,形成单一团块。这个图像突出了用磁体拖曳磁性复合物通过水的能力。
相比之下,图58a和58b示出了使用固定磁体和两种不同的搅动频率在sdix沙门氏菌二级培养基中的pc团块形成。通过以2hz(21a)或0.5hz(21b)的搅动频率和25mm的行程使管在固定条形磁体上方移动来将sdix二级培养基中的pc团化3分钟。停止搅动,并且在移动条形磁体远离管之前使磁体保持30秒。如图58a中所示,将磁性复合物的两个团块牵引到管的底部,位于管与磁体之间相对运动的界限处。对于较缓慢的搅动(图58b)来说,在沿着连接团块的不明确线的磁体行进的结尾处形成两个团块。由于使用密集的、可重现放置的团块最佳地获得可重现的sers信号,因此图58a和58b突出了固定磁体配置的缺点,其似乎不能拖曳磁性珠粒通过sdix沙门氏菌二级培养基,这可能归因于这种培养基中所存在的固体颗粒。
图59a示出了使用耦合磁体配置的一个优选实施方案。通过以1.5hz的搅动频率和25mm的行程移动与条形磁体耦合的管来将sdix沙门氏菌二级培养基中的pc团化1.5分钟。停止搅动,并且在移动条形磁体远离管之前使磁体保持30秒。在条形磁体接触样品管的地方形成单一的密集团块。与使用固定磁体配置形成的团块相比,如图59a中所示,使用耦合磁体形成的团块更加紧实和密集。图59b示出了使用耦合磁体的类似实验,其仅使用0.8hz的搅动频率。尽管形成单一团块,但沉降的培养基干扰了牵引密集团块的能力,如在团块的中心处散开的粒子所证实。
图57-59中所说明的结果示出,对于25mm的行程来说,固定磁体团化方法未能在sdix沙门氏菌二级培养基存在下使用多种搅动频率形成单一的密集团块。这种培养基含有固体颗粒,这些固体颗粒迅速地沉降并且干扰了磁体沿着管的底部拖曳磁性复合物的能力。尽管快速搅动将阻止固体培养基沉降,但在管与磁体之间相对运动的界限处形成两个团块。随着搅动缓慢停止,这些团块不能被拖曳通过培养基以形成单一团块。因为磁性复合物可以被拖曳通过水,所以固定磁体方法可以用于使水中的pc团化。
耦合磁体团化方法在sdix沙门氏菌二级培养基存在下以多种搅动频率形成单一的密集团块。磁体与管耦合用于团化不需要磁性复合物沿着管的底部拖曳,因为其被牵引到公共点以形成单一团块。
使用耦合磁体,快速搅动与缓慢搅动相比形成更密集的团块。这可能是归因于使用缓慢搅动而沉降并且干扰团块形成的固体培养基。使用快速搅动,固体悬浮于溶液中并且磁性复合物可以被牵引到团块中而受培养基的干扰较小。
实施例5
人血液中的白色念珠菌的单重检测
图60示出了检测和鉴别用于单重形式的血液培养样品(加标血液)内的微生物的一个实施例。在这个实验中,在30℃下于振荡培养中在来自单一集落的沙氏葡萄糖肉汤(sabourauddextrosebroth)中的过夜培养物中使白色念珠菌(candidaalbicans)(atcc10231)生长。将培养物稀释并且以3cfu/ml或0cfu/ml接种到人血液中作为阴性对照。将阳性和阴性样品接种到没有检测试剂的bactectmstd10aerobic/f瓶中以及含有bactectmstd10aerobic/f培养基和检测试剂(与virostat6411抗白色念珠菌抗体偶联的sers标签和磁性粒子)的管中。总血液与培养基的比率是1:8。将接种物涂在bbltmchromagartm上用于计数。将检测管插入到圆盘传送带系统150(参看图24)中,并且将bactectm瓶插入到bactectmfx仪器中用于在35℃下生长期间进行实时监测。在18小时检测阳性sers管,并且bactectm瓶在30小时呈阳性。sers信号提供了在bactectmfx用于人血液中的这个单重试验之前至少12小时的检测和id。
实施例6
以4重试验形式检测白色念珠菌
图61示出了检测和鉴别用于多重形式的血液培养样品(加标血液)内的微生物的一个实施例。在用于检测白色念珠菌、大肠杆菌0157、肺炎克雷伯菌和金黄色葡萄球菌的这个4重试验中,具有四种不同的拉曼报道体的sers标签各自偶联到针对四种生物体之一的抗体。(偶联到sers标签virostat6411多克隆抗白色念珠菌、biodesignmav119-499单克隆抗大肠杆菌o157:h7、biodesignc55573m单克隆抗葡萄球菌和santacruzbiotechnologysc-80861单克隆抗肺炎克雷伯菌的抗体)。所有四种sers标签类型连同与针对四种微生物的捕获抗体偶联的磁性珠粒一起都存在于试验混合物中。存在于试验中的磁性珠粒是由
在图61中所描绘的实验中,在30℃下于振荡培养中在来自单一集落的沙氏葡萄糖肉汤中的过夜培养物中使白色念珠菌(atcc10231)生长。将培养物稀释并且以3cfu/ml或0cfu/ml接种到人血液中作为阴性对照。将阳性和阴性样品接种到bactectmstd10aerobic/f瓶以及含有bactectmstd10aerobic/f培养基与检测试剂的样品管中。最终样品中血液与培养基的比率是1:8。将白色念珠菌接种物涂在bbltmchromagartm上用于计数。将含有sers试剂的样品管插入到圆盘传送带系统(参看图24)中,而将没有检测试剂的bactectm瓶插入到bactectmfx仪器中用于在35℃下生长期间进行实时监测。
在16.6小时用sers检测白色念珠菌,而bactectm气体传感器在28小时得到阳性检测。此外,用sers检测是通过将微生物鉴别为白色念珠菌来实现,而bactectm仪器没有提供鉴别信息。如图61中可见,以多重形式用sers检测白色念珠菌没有引起来自其它(非白色念珠菌)sers标签的明显sers信号。
实施例7
兔血液中的大肠杆菌和表皮葡萄球菌共感染的检测
图62示出了用于模型共感染的血液培养样品(加标血液)内的微生物的多重检测和鉴别的一个实施例。在37℃下于振荡培养中在来自单一集落的bd营养肉汤中的过夜培养物中使大肠杆菌o157:h7(atcc700728)和表皮葡萄球菌(atcc55133)独立地生长。将培养物稀释并且以2.6cfu/ml(对于大肠杆菌o157:h7)和12.5cfu/ml(对于表皮葡萄球菌)共接种到兔血液中。将阳性和阴性样品接种到bactectmstd10aerobic/f瓶(没有sers试剂)以及实施例6中所描述的含有bactectmstd10aerobic/f培养基和检测试剂的管中。(偶联到virostat6411、biodesignmav119-499、biodesignc55573m和santacruzbiotechnologysc-80861的sers标签,以及偶联到virostat6411、biodesignc55573m和affinitybioreagentspa1-7226的
实施例8
在含有颗粒的样品中的实时sers检测
在这个实施例中,将大肠杆菌o157:h7(atcc700728)从甘油储备液解冻并且接种到以1:8的比率稀释于bactectmplusaerobic/f培养基中的兔血液中。bactectmplusaerobic/f培养基含有树脂粒子(17%w/v)以增强生物体的回收而不需要特殊处理。通过板计数对经接种的血液加上培养基进行计数以确认5cfu/ml的接种量。将样品放在含有sers和磁性珠粒偶联物(biodesignmav119-499和g5v119-500抗体)的三个重复管中。将检测管插入到圆盘传送带系统150(参看图24)中用于在35℃下生长期间进行实时监测。结果示于图63中。圆盘传送带系统能够在树脂存在下有效地形成和询查团块。
实施例9
在大体积中的检测
在团化期间提供的搅动允许有效地捕获磁性珠粒,甚至是在大样品体积中或在低磁性珠粒浓度下。
在一个实施例中,在sers和磁性粒子试剂的体积保持恒定下进行试验,同时改变样品体积以获得一定范围的试剂浓度。在针对大样品体积作修改的基于圆盘传送带的试验系统(参看例如图24)上的50mlfalcontm管中测试5、10、20、30、40和50ml的兔血液于bdbactectmstandard10aerobic/f血液培养基中的1:10稀释液的样品。将大肠杆菌o157从冷冻储备液中解冻并且以104cfu/ml加标到每个样品中。在六天的过程中,一式三份测试每个体积,其中每天仅测试给定体积的一个样品。
在每个管中,通过在795μl的1:10血液与培养基中将125μlsers标签与80μl磁性粒子组合来形成通常用于5ml样品的主混物。将所得1ml主混物添加到每个测试样品中。使用与biodesignmav119-499抗大肠杆菌抗体偶联的sers标签,以及来自lifetechnologiestm的
在35℃下将样品放在基于圆盘传送带的试验系统(参看例如图24)中,其中团化60秒,入射激光功率是50mw,ccd积分时间是5秒,摇杆以约0.5转/秒操作,并且读出频率是5次/小时。
每个体积的代表性样品的结果示于图64中。尽管信号强度在较低试剂浓度下减小,但系统能够甚至在比标准低10倍的浓度下有效地形成团块并检测生长。可以看出,这个试验有效地检测多种体积的生长。
实施例10
在圆盘传送带系统中使用快速搅动未能团化
在圆盘传送带系统(参看例如图24)中,在形成磁性团块的同时搅动样品以确保来自全流体体积的磁性复合物通过局部化磁场。相机在激光询查期间捕获团块的图像以监测整个试验中的团块形成。
图65a示出了107cfu/ml鼠伤寒沙门氏菌(atcc14028)在圆盘传送带系统150(参看图24)中以快速搅动频率二次富集的几小时内未能形成团块的一个实施例。在42℃下在含补充物的sdix
对于极高负荷的沙门氏菌来说,团块变得特别大,这是因为团块中存在许多病原体。当搅动太快时,磁场不能克服流体动力学,并且团块未能形成。
图65b示出了在阴性样品(培养基中经偶联的磁性珠粒和经偶联的sers标签)的二次富集期间的sers曲线和对应的图像。这个数据示出了在试验期间持续低的拉曼信号和一致的团块尺寸。
通过在107cfu/ml鼠伤寒沙门氏菌(atcc14028)的二次富集期间将搅动频率减缓到1hz,在整个试验中持续形成团块。在42℃下在含补充物的sdix
实施例11
在夹心免疫试验中使用团块的视觉检查来确定经靶向的病原体的存在
在这个实施例中,描述了根据本发明的一个实施方案用于检测微生物样品内的微生物的方法,其可以消除对激光器、光学装置和分光计的需要。这种方法涉及使用相机在读出期间捕获图像以监测在sers-hnw试验的过程中团块的形成。
在实施例11中所描述和图65a、65b和65c中所示的实验中,微生物的存在引起团块的尺寸生长(图65a和65c)。相比之下,当微生物不存在时,团块尺寸和sers信号都保持稳定。在不存在经靶向的病原体的情况下,不能形成夹心,这导致没有拉曼信号并且团块尺寸没有增大。图67示出了在圆盘传送带系统(参看例如图24)中在二次富集3小时之后与阳性样品的团块尺寸相比阴性样品的团块尺寸。这个图示出了与阴性样品相比阳性样品形成更大的团块。
在含有经偶联的sers标签和磁性珠粒以及经靶向的病原体的样品的二次富集期间,图像显示团块尺寸增大,并且在一些情况下随着试验进行而团块未能形成。团块尺寸的生长和/或团块的消失是经靶向的病原体存在的指示。在含有经偶联的sers标签和磁性珠粒并且没有病原体的样品读出期间捕获的图像显示团块尺寸没有变化并且没有团块消失。使用图像分析监测团块尺寸可以呈现一种检测试验中的微生物的方法。这种检测方法可以单独使用或与另一种检测方法联合使用。
实施例12
在食品样品中培养期间大肠杆菌0157:h7的实时检测
图68a、68b和68c示出了使用用于检测经消化的碎牛肉、菠菜清洗物和牛乳固体中的大肠杆菌0157的圆盘传送带系统(参看例如图24)获取的代表性数据。
根据usda微生物实验室指南(mlg第5章)制备生碎牛肉。在兜袋中使用225ml含新生霉素(novobiocin)的mtsb稀释25g碎牛肉样品。然后,在seward
根据fda细菌学分析手册(bam第4a章)制备菠菜清洗物样品。将等重量的巴特菲尔德磷酸盐缓冲液(butterfield'sphosphatebuffer)添加到可再密封的塑料袋中的菠菜叶中,并且用手搅动5分钟。然后,将菠菜清洗物添加到等体积的双强度(×2)mbpwp中。在37℃下于振荡培养中在来自单一集落的营养肉汤中的过夜培养物中使大肠杆菌o157:h7(atcc43888)生长。将培养物连续稀释并且以103或0cfu/ml的浓度接种到菠菜清洗物+(×2)mbpwp中。将这些样品的5ml等分试样添加到含有sers标签和磁性粒子偶联物的管中。
根据fda细菌学分析手册(bam第4a章)制备牛乳样品。使全牛乳以10,000×g离心10分钟。倒掉上清液层,并且使沉淀再悬浮于原始牛乳体积的1.125倍的mbpwp中。在37℃下于振荡培养中在来自单一集落的营养肉汤中的过夜培养物中使大肠杆菌o157:h7(atcc43888)生长。将培养物于营养肉汤中稀释到5000cfu/ml。将经稀释的大肠杆菌o157:h7培养物或营养肉汤(阴性对照)的50ul等分试样添加到再悬浮的牛乳培养物加试验试剂的5ml管中。
将所有接种物涂在bdbbltmchromagartm板上用于计数。将管插入到圆盘传送带系统中用于在35℃下生长8小时期间进行实时监测。
实施例13
在食品样品中培养期间沙门氏菌的实时检测
图69示出了在碎牛肉加培养基中实时生长期间检测热应激肠炎沙门氏菌(atcc13076)的一个实施例。在37℃下于振荡培养中在来自单一集落的营养肉汤中的过夜培养物中使肠炎沙门氏菌生长。将培养物于营养肉汤中以1:100稀释并且在54℃下热应激20分钟。将热应激样品于营养肉汤中进一步稀释到200cfu/ml。用肠炎沙门氏菌的经稀释的热应激培养物的1ml等分试样接种生碎牛肉的两个25g样品。将接种物涂在营养琼脂板上用于计数。将经接种的碎牛肉样品在兜袋中用手按摩2分钟以充分地混合接种物。将225ml含补充物的sdix
实施例14
环境样品中的李斯特菌的检测
图70示出了在不锈钢试样上检测单核细胞增生性李斯特菌(atcc19115)。在30℃下于振荡培养中在来自单一集落的脑心浸液肉汤中的过夜培养物中使单核细胞增生性李斯特菌(atcc19115)生长。将培养物于pbs+5%牛乳中稀释到5×104或0cfu/ml。将0.1ml等分试样放在1"×1"不锈钢试样上并且使其风干过夜。第二天,将用d/e中和肉汤湿润的棉签在表面上擦几次。然后,将棉签添加到管中5ml含补充物、sers标签和磁性粒子的sdix李斯特菌培养基中。然后,将管插入到圆盘传送带系统(参看图24)中用于在30℃下生长期间进行实时监测。在约19小时与27小时之间检测到阳性样品,而阴性样品得到平坦的检测曲线。
实施例15
使用平坦底床系统检测沙门氏菌
在这个实施例中,使用线性搅动和平坦底床系统(参看例如图25)来检测沙门氏菌。在42℃下在含补充物的sdix
这个实施例中所用的系统是平坦底床配置(参看例如图25)。在这种配置中,通过沿着管轴进行线性往复运动来搅动,这可以在整个试验中针对不同频率和型态而程序化。每个周期由以下阶段组成:混合、预先团块分散、团化、读出和分散。这个实施例中所用的磁体配置是n极面向样品的单一条形磁体。一旦形成团块,就移动条形磁体远离样品以允许读出。图71示出了用于每个阶段的搅动频率和行程。实验运作约19小时,其中每隔约20分钟重复周期。
预先团块分散阶段意图在团化之前使沉降的固体再悬浮于sdix二级培养基中。从培养基中沉降的固体据知干扰磁性复合物的团化。在搅动期间使单一条形磁体与管接触,并且团化样品60秒。停止搅动5秒,并且移动磁体远离样品管以允许光学发动机询查每个团块。相机还捕获每个团块的图像。恢复搅动以分散团块并且周期重复。
图72示出了在鼠伤寒沙门氏菌(atcc14028)、肠炎沙门氏菌(s.enteriditis)(atcc13076)和阴性样品的二次富集期间的sers曲线。可以看出,sers曲线是平滑的并且可以容易地与阴性区分开来。图73示出了在鼠伤寒沙门氏菌的二次富集期间在多个时间形成的团块的图像。可以看出,使用平坦底床仪器在整个试验中持续形成圆的密集团块。
实施例16
线性搅动对比摇摆搅动
在这个实施例中,在两个圆盘传送带系统(参看例如图24)上使用不同的搅动方法运作相同的沙门氏菌试验:沿着管轴进行线性往复运动和摇摆振荡。在42℃下在含补充物的sdix
图74示出了在肠炎沙门氏菌和肯塔基沙门氏菌的二次富集期间从摇摆搅动和线性搅动圆盘传送带系统获得的sers曲线。可以看出,使用两种方法都获得了良好的结果。
在这个实施例中,线性搅动得到优于摇摆运动的一些优点。与摇摆相比使用线性搅动的团化性能更好,这是因为使用线性搅动在读出头的中心始终形成团块。摇摆搅动系统不会绕着摇臂对称地振荡,这使得管轮偏向于向前运动。这种不对称的流体运动使得团块上的流体力偏向于管的前侧。归因于与摇摆搅动相比的机械简易性,线性搅动是优选的搅动方法。
实施例17
实时免洗试验与后续样品处理的相容性
在这个实施例中,测试基于sers的实时试验与样品处理测试的相容性,这些样品处理测试通常在用常规气体传感器检测阳性血液培养样品之后进行。这些测试可以用于从阳性血液培养瓶当中提供生物体鉴别。这些测试包括标准管凝固酶试验、乳胶凝集试验、革兰氏染色、产色培养基显色、手动抗生素敏感性测试以及对涂板培养物的抗真菌抑制。
标准管凝固酶试验是通过从划线板独立地选择金黄色葡萄球菌或表皮葡萄球菌的几个集落并且使其乳化到bactectm培养基中来进行。将有或没有sers试剂(在试验浓度下)的经乳化细菌的50μl样品添加到500μledta兔血浆中并且在37℃下孵育。有和没有sers试剂的金黄色葡萄球菌样品都在4小时内使血浆凝固(图75)。表皮葡萄球菌样品不会在4小时内使兔血浆凝固。因此,sers试剂的存在不会阻碍经由凝固酶活性区分金黄色葡萄球菌与表皮葡萄球菌的能力,甚至是在相对高的sers试剂浓度下。
还针对由sers试验粒子引起的任何干扰来评估用于金黄色葡萄球菌鉴别的乳胶凝集测试。如上文所描述来制备有和没有sers试剂(在试验浓度下)的金黄色葡萄球菌和表皮葡萄球菌样品。然后,将一滴bdbbltmstaphyloslidetm测试乳胶添加到试验卡片中,也添加一滴对照乳胶。向每种类型的乳胶中添加10μl的以下样品:1)带有sers试剂的表皮葡萄球菌,2)没有sers试剂的表皮葡萄球菌,3)带有sers试剂的金黄色葡萄球菌,以及4)没有sers试剂的金黄色葡萄球菌。将溶液混合并且摇摆约20秒。图76示出了具有表皮葡萄球菌(左侧卡片)和8型金黄色葡萄球菌(右侧卡片)的卡片。将带有sers试剂的细菌样品添加到顶行中,而将没有sers试剂的样品添加到底行中。结果对于有和没有试剂的样品来说是相同的,其中只有金黄色葡萄球菌样品显示凝集。只有显示凝集的样品是有和没有sers试剂的金黄色葡萄球菌样品,这证明了sers试剂不会阻碍在金黄色葡萄球菌存在下的乳胶凝集,不会误凝集对照乳胶,并且不会在表皮葡萄球菌存在下误凝集测试乳胶。
还使用试验试剂进行革兰氏染色作为下游处理相容性的测试。将缓冲液中的sers标签和磁性粒子添加到含有金黄色葡萄球菌atcc25923(革兰氏阳性球菌)和大肠杆菌atcc25922(革兰氏阴性杆菌)的bdbbl对照革兰氏载片中,并且使用如临床中通常使用的100x油浸物镜成像。图77示出了没有对照生物体的磁性粒子和sers标签。磁性粒子以大的棕色球体形式明显可见。磁性粒子在颜色和尺寸方面也是均匀的,这有效地充当显微镜法的内部尺寸标准(约3μm)。直径为0.1-0.2μm的sers标签不可见。图78示出了以100x成像的在金黄色葡萄球菌(紫色球菌)与大肠杆菌(粉红色杆菌)的混合物存在下的磁性粒子。磁性粒子明显未被染色并且可容易地与这个图像中的微生物相区分。
chromagartm产色培养基允许用固体培养基中显现的单色来鉴别、区分和分离单一病原体。将来自含有sers试剂的8型金黄色葡萄球菌和表皮葡萄球菌的过夜血液培养物的样品划线到chromagartm板上。所获得的结果(图79)指示,sers试剂不会影响获得单一集落的能力并且不会阻碍种类特异性chromagartm显色,其中金黄色葡萄球菌在左侧示出并且表皮葡萄球菌在右侧示出。正如预期,当划线在bdbbltmchromagartm金黄色葡萄球菌板上时,金黄色葡萄球菌集落是紫红色的,而表皮葡萄球菌集落是白色的。
在sers试剂存在下还测试了使用琼脂纸锭扩散法(bdsensi-disctm)的手动抗生素测试。将具有sers试剂的大肠杆菌o157的过夜血液培养物划线在bdbbltmmuellerhintonii琼脂板上,并且将三个bdbbltmsensi-disctm测试纸锭放在顶部,并且使培养物在37℃下生长过夜。第二天,测量抑制区(图80)(mm),并且与sensi-disctm区直径解释性图表相比较用于确定敏感性、抑制性或耐药性分离株。图80示出了氨比西林-10(ampicillin-10)(左上方)、左氧氟沙星-5(levofloxacin-5)(右上方)、万古霉素-30(底部)。区直径测量值在带有试剂的大肠杆菌培养物与没有试剂的培养物之间不会变化超过1-2mm(图81)。使用其它血液培养细菌和酵母重复这个过程(表82),其显示了使用纸锭扩散法确定微生物的抗生素敏感性的能力不受sers试剂的存在所影响。
为了测试酵母,使用nystatintaxotm纸锭。这些纸锭并不用于敏感性测试,但用于从具有细菌和酵母的样本中区分和分离细菌。因此,测试稍微不同的方法。将带有和没有sers试剂的大肠杆菌和白色念珠菌的混合血液培养物划线到tsaii板上。将nystatintaxotm纸锭放在顶部,并且使培养物在37℃下生长过夜。在带有(图83的左侧图像)和没有(图83的右侧图像)试验试剂的两种样品中,白色念珠菌生长的nystatin抑制得到经分离的大肠杆菌集落的区域。
实施例18
搅动频率和团化时间对团块形成的影响
这个实施例涉及使用其中管耦合到磁体的配置进行团化(参看例如图49)以使得磁体与管一起移动并且在整个搅动中与管保持处于相同的相对位置。在一系列实验中,将sers标签共价连接到甲苯磺酰基活化的磁性粒子以形成sers-磁性珠粒预复合物(pc)。预复合的珠粒是通过经由sers表面上的硫醇(-sh)基团与磁性粒子表面上的甲苯磺酰基(tos)基团反应使sers粒子共价连接到
图84示出了使用三种不同的搅动频率和三种不同的团化时间使用sdix沙门氏菌二级培养基中的pc形成的团块的图像的表格。通过在不同的搅动频率下以50mm的行程(振幅)搅动与条形磁体耦合的管来团化sdix二级培养基中的pc。停止搅动,并且在移动条形磁体远离管之前使磁体保持5秒。一旦移动条形磁体远离管,就捕获团块的图像。
如图84中所示,快速搅动与缓慢搅动相比形成更密集的团块。这可能是归因于使用缓慢搅动而沉降并且干扰团块形成的固体培养基。使用快速搅动,固体悬浮于溶液中并且磁性复合物可以被牵引到团块中而受培养基的干扰较小。使用0.7hz搅动频率以30、60和90秒团化时间形成的团块中可见,沉降的培养基干扰了牵引密集团块的能力,如散开的团块所证实。
实施例19
搅动频率对团块分散的影响
这个实施例涉及测量使用多种搅动行程(振幅)和频率完全分散团块所需的时间。在每种情况下,使用其中管耦合到磁体的配置形成团块(参看例如图49)以使得磁体与管一起移动并且在整个搅动中与管保持处于相同的相对位置。这个实施例中所用的磁体是n极面向样品管的单一条形磁体,例如图52中所示。
在这个实施例中,在每个测试之前用手振荡管以充分混合培养基(sdix
如图85中所示,快速搅动与缓慢搅动相比在更短的时间内分散团块。而且,对于给定的搅动频率来说,团块以更长的搅动行程更快速地分散。基于这个实施例中的观测结果,二级培养基中的固体培养基在高于2.5hz的搅动频率下以25mm行程并且在高于1.5hz的搅动频率下以50mm行程保持悬浮于溶液中。
实施例20
在食品存在下荧光hnw试验可行性测试
这个实施例展示了与使用近红外(“nir”)荧光粒子替代sers标签的培养联合进行均质免洗试验的可行性。在这个实施例中,使用合并有硅烷-nir染料偶联物(为了提供荧光信号)和硫醇化硅烷(为了提供用于抗体偶联的化学把柄)的经修改的stober生长技术来制造荧光二氧化硅纳米粒子。粒子通过透射电子显微镜法(“tem”)、uv/vis消光光谱法和荧光光谱法来表征,并且发现其为相对单分散的和明亮的。图96说明了nir荧光二氧化硅纳米粒子的tem图像(比例尺是200nm),而图97说明了nir荧光纳米粒子(od0.5)的荧光光谱和标准es/hbsers标签(od1.2)的拉曼光谱。使用标准偶联方案将荧光纳米粒子与李斯特菌ab偶联,这种方案经过修改以说明荧光纳米粒子浓度、表面积和质量相对于sers标签的差异。在李斯特菌hnw试验中在圆盘传送带系统150(参看图24)上使用菠菜和甘蓝的10%w/v掺合样品来测试经偶联的荧光二氧化硅纳米粒子。使用具有菠菜和甘蓝样品的sers标签来进行对照测试。
荧光标签能够成功地检测两种食品样品中的李斯特菌。图98描绘了使用nir荧光纳米粒子标签和sers标签收集的菠菜资料,而图99描绘了使用nir荧光纳米粒子标签和sers标签收集的甘蓝资料。发现荧光标签的信号和背景都高于sers标签,然而,在约4:1的相对高的信号与背景的比率下检测是成功的。
尽管已经出于清楚理解的目的经由说明和实施例相当详细地描述了前述主题,但本领域的技术人员应了解,可以在随附权利要求书和其等价物的范畴内实施某些变化和修改。
所有公布、专利申请、专利和其它参考文献都以引用的方式并入本文中,引用的程度如同每个个别的公布、专利申请、专利和其它参考文献特定地和个别地指示以引用的方式并入一样。应了解,尽管本文中参考许多专利申请、专利和其它参考文献,但这种参考并不承认这些文献中的任一者形成本领域中的公共常识的一部分。
前面的描述意图示范本发明的各种实施方案。本领域的技术人员应了解,在不脱离随附权利要求书中所定义的本发明的范围和精神的情况下可以对所公开的实施方案作出各种变化和修改。
本发明的具体实施方案包括:
1.一种用于检测样品中的一种或多种微生物的方法,所述方法包括:
(a)提供疑似含有一种或多种微生物的样品;
(b)将所述样品安置在试验小瓶中,其中所述试验小瓶在内部安置有能够支持微生物生长以形成培养样品的培养基和包含与对所述一种或多种微生物具有亲和力的至少一种特异性结合成员缔合的一种或多种指示剂粒子的试剂;以及与对所述一种或多种微生物具有亲和力的至少一种特异性结合成员缔合的一种或多种磁性捕获粒子,其中与所述指示剂粒子缔合的所述结合成员和与所述磁性捕获粒子缔合的所述结合成员可以是相同的或不同的;
(c)如果所述一种或多种微生物存在于所述样品中,那么孵育所述培养样品一段预定的时间以形成磁性捕获粒子-微生物-指示剂粒子复合物;
(d)搅动所述试验小瓶;
(e)使所述磁性捕获粒子-微生物-指示剂粒子复合物暴露于磁场以诱导所述复合物迁移到所述试验小瓶的局部区域;
(f)光学询查所述试验小瓶的所述局部区域以诱导所述指示剂粒子产生可检测信号来检测所述样品中的所述一种或多种微生物;
(g)分散所述磁性捕获粒子-微生物-指示剂粒子复合物;以及
(h)重复步骤(c)-(g)一次或多次。
2.根据具体实施方案1所述的方法,其中重复步骤(c)-(g)以规律的时间间隔发生。
3.根据具体实施方案1所述的方法,其中步骤(c)和(d)同时发生。
4.根据具体实施方案1所述的方法,其中步骤(e)形成包含磁性捕获粒子-微生物-指示剂粒子复合物的团块。
5.根据具体实施方案4所述的方法,其中所述团块是使用视觉或光学手段可检测的。
6.根据具体实施方案1所述的方法,其中所述样品包括血液样品。
7.根据具体实施方案1所述的方法,其中所述样品包括食品样品。
8.根据具体实施方案1所述的方法,其中所述样品包括环境样品。
9.根据具体实施方案1所述的方法,其中所述样品包括农业样品。
10.根据具体实施方案1所述的方法,其中将所述样品安置在试验小瓶中包括从器皿中连同任选的培养基一起转移所需量的所述样品,其中所述器皿包括:
容器,其用于在内部接收培养样品,所述容器具有开口端和封闭端;
盖子,其被配置成以流体密封连接方式啮合所述容器的所述开口端;
筐体,其耦合到所述盖子并且包括至少一个储集器,所述筐体被安置在所述容器的所述开口端与所述封闭端之间,所述储集器被配置成在内部容纳一定体积的培养样品;以及
至少一个针组件,其与所述盖子啮合,所述针组件包括在所述储集器内延伸的针,
其中所述针被配置成选择性地抽取所述储集器中所含的样品,并且其中所述针被进一步配置成啮合小瓶用于以生物防护方式将所述样品从所述储集器转移到所述小瓶。
11.根据具体实施方案1所述的方法,其中将所述样品安置在试验小瓶中包括以生物防护方式从其中不存在所述磁性粒子和指示剂粒子的器皿中连同任选的培养基一起提取所述样品。
12.一种用于计量所需量的样品的器皿,所述器皿包括:
容器,其用于在内部接收样品,所述容器具有开口端和封闭端;
盖子,其被配置成以流体密封连接方式啮合所述容器的所述开口端;
筐体,其耦合到所述盖子并且包括至少一个储集器,所述筐体被安置在所述容器的所述开口端与所述封闭端之间,所述储集器被配置成在内部容纳一定体积的样品;以及
至少一个针组件,其与所述盖子啮合,所述针组件包括在所述储集器内延伸的针,
其中所述针被配置成选择性地抽取所述储集器中所含的样品,并且其中所述针被进一步配置成啮合小瓶用于以生物防护方式将所述样品从所述储集器转移到所述小瓶。
13.根据具体实施方案12所述的器皿,其中所述容器是由对可见光辐射透明的材料构造。
14.根据具体实施方案12所述的器皿,其中所述筐体界定第一储集器和第二储集器,并且其中所述盖子界定具有在所述第一储集器内延伸的第一针的第一针组件和具有在所述第二储集器内延伸的第二针的第二针组件。
15.根据具体实施方案14所述的器皿,其中所述第一针和所述第一储集器被配置成以供与第一种类型的试验一起使用,其中所述第二针和所述第二储集器被配置成以供与第二种类型的试验一起使用,并且第一种类型的试验不同于所述第二种类型的试验。
16.根据具体实施方案15所述的器皿,其中所述第一储集器被配置成容纳约5ml,并且其中所述第二储集器被配置成容纳约100μl。
17.根据具体实施方案12所述的器皿,其中所述筐体界定被配置成帮助流体通过所述筐体排出的肋条。
18.根据具体实施方案12所述的器皿,其进一步包括在所述至少一个储集器上方的顶部空间以使得当所述容器倾斜时所述样品能够容易地进入所述至少一个储集器。
19.根据具体实施方案18所述的器皿,其中所述筐体界定至少一个孔,其中所述孔被配置成使得在所述容器被返回到直立位置之后过量样品能够排入到所述容器中。
20.根据具体实施方案12所述的器皿,其中所述盖子界定排气口用于允许任何无害的气态副产物从所述容器中逸出以防止所述容器内的压力积累。
21.根据具体实施方案12所述的器皿,其进一步包括从所述盖子的底表面延伸的排气柱,其中所述排气柱界定通过其的开口用于接收和啮合过滤器以过滤退出所述容器的气态副产物。
22.根据具体实施方案12所述的器皿,其进一步包括从所述盖子的底表面向外延伸的第一啮合柱和从所述筐体的上表面向外延伸的第二啮合柱,其中所述第一啮合柱被配置成与所述第二啮合柱对齐并啮合。
23.根据具体实施方案12所述的器皿,其中所述盖子界定至少一个被配置成允许搭配所述小瓶的特定顶帽的键控开口。
24.根据具体实施方案12所述的器皿,其中所述针包括罩盖所述针的保护套管,其中所述保护套管被配置成随着所述小瓶被向下推并且与所述针啮合而被压缩,并且其中所述保护套管被配置成随着所述小瓶离开与所述针的啮合而返回其罩盖所述针的原始形状以能够进行所述生物防护方式的转移。
25.根据具体实施方案12所述的器皿,其中所述盖子进一步包括至少一个回退特征以防止在没有另外脱离所述回退特征的情况下拧松所述盖子。
26.一种与用于计量所需量的样品的容器一起使用的盖子组件,所述盖子组件包括:
盖子,其被配置成以流体密封连接方式啮合容器的所述开口端,所述盖子任选地含有垫圈;
筐体,其耦合到所述盖子并且包括至少一个储集器,所述储集器被配置成在内部容纳一定体积的样品;以及
至少一个针组件,其与所述盖子啮合,所述针组件包括在所述储集器内延伸的针,
其中所述针被配置成啮合小瓶用于以生物防护方式将样品从所述储集器转移到所述小瓶。
27.根据具体实施方案26所述的盖子组件,其中所述筐体界定第一储集器和第二储集器,并且其中所述盖子界定具有在所述第一储集器内延伸的第一针的第一针组件和具有在所述第二储集器内延伸的第二针的第二针组件。
28.根据具体实施方案27所述的盖子组件,其中所述第一针和所述第一储集器被配置成以供与第一种类型的试验一起使用,其中所述第二针和所述第二储集器被配置成以供与第二种类型的试验一起使用,并且第一种类型的试验不同于所述第二种类型的试验。
29.根据具体实施方案28所述的盖子组件,其中所述第一储集器被配置成容纳约5ml,并且其中所述第二储集器被配置成容纳约100μl。
30.根据具体实施方案26所述的盖子组件,其中所述筐体界定被配置成帮助流体通过所述筐体排出的肋条。
31.根据具体实施方案26所述的盖子组件,其中所述盖子界定排气口用于允许任何无害的气态副产物逸出。
32.根据具体实施方案26所述的盖子组件,其进一步包括从所述盖子的底表面延伸的排气柱,其中所述排气柱界定通过其的开口用于接收和啮合过滤器以过滤气态副产物。
33.根据具体实施方案26所述的盖子组件,其进一步包括从所述盖子的底表面向外延伸的第一啮合柱和从所述筐体的上表面向外延伸的第二啮合柱,其中所述第一啮合柱被配置成与所述第二啮合柱对齐并啮合。
34.根据具体实施方案26所述的盖子组件,其中所述盖子界定至少一个被配置成允许搭配小瓶的特定顶帽的键控开口。
35.根据具体实施方案26所述的盖子组件,其中所述针包括罩盖所述针的保护套管,其中所述保护套管被配置成随着小瓶被向下推并且与所述针啮合而被压缩,并且其中所述保护套管被配置成随着小瓶离开与所述针的啮合而返回其罩盖所述针的原始形状以能够进行所述生物防护方式的转移。
36.根据具体实施方案26所述的盖子组件,其中所述盖子进一步包括至少一个回退特征以防止在没有另外脱离所述回退特征的情况下拧松所述盖子。
37.一种检测小瓶,其用于以生物防护方式将样品从储集器转移到所述小瓶,其中所述检测小瓶包括:
主体,其具有开口;以及
顶帽,其用于啮合所述主体并且密封所述开口,其中所述顶帽包括被配置成保持内部真空的塞子并且任选地包括吸收垫,其中所述顶帽界定被配置成在器皿的盖子的键控开口内配合的多个肋条。
38.根据具体实施方案37所述的检测小瓶,其中所述主体沿着长度界定恒定的壁厚以增强团化和光学分析。
39.一种检测小瓶,其用于以生物防护方式从储集器转移样品,其中所述检测小瓶包括:
主体,其具有开口;以及
顶帽,其用于啮合所述主体并且密封所述开口,其中所述顶帽包括被配置成保持内部真空的塞子并且任选地包括吸收垫,其中所述顶帽可以被配置成配合指定的转移口。
40.根据具体实施方案39所述的检测小瓶,其中所述主体沿着长度界定恒定的壁厚以增强团化和光学分析。
41.一种注射器,其用于以生物防护方式将样品从储集器转移到所述注射器,其中所述注射器包括:
主体;
把柄;
柱塞杆,其耦合到所述把柄;
顶帽;
柱塞,其耦合到所述柱塞杆的末端并且被配置成在所述主体内纵向位移;
隔片;以及
密封件。
42.一种用于自动处理多个含有培养样品的管的系统,所述系统包括:
孵育箱,其用于在内部接收多个样品管,所述孵育箱被配置成在预定温度下孵育所述样品管;
第一平移装置,其耦合到所述样品管并且被配置成移动所述样品管用于搅动所述样品管,所述第一平移装置被进一步配置成将所述样品管从所述孵育箱移动到检测区并且搅动所述检测区内的所述样品管;
磁体组件,其被配置成将磁场施加到所述检测区内的所述多个样品管;
光学装置,其被配置成询查所述检测区内的所述多个样品管中的每一个用于检测一种或多种微生物;以及
第二平移装置,其耦合到所述光学装置并且被配置成移动所述检测区内的所述光学装置用于询查所述样品管中的每一个。
43.根据具体实施方案42所述的系统,其中所述磁体组件被配置成绕枢轴转动远离所述样品管以用所述光学装置询查。
44.根据具体实施方案42所述的系统,其中所述系统界定可以在不同温度下操作的多个高温区,其中每个高温区被配置成含有一个或多个孵育箱。
45.根据具体实施方案42所述的系统,其进一步包括至少一个被配置成加热所述孵育箱的加热元件。
46.根据具体实施方案42所述的系统,其中所述孵育箱被配置成接收用于固持多个样品管的托盘。
47.根据具体实施方案46所述的系统,其中所述第一平移装置被配置成沿着所述孵育箱的轴水平地振荡所述托盘。
48.根据具体实施方案42所述的系统,其中所述磁体组件包括一对间隔开的纵向磁体,并且其中所述光学装置包括在所述对的纵向磁体之间延伸的读出头。
- 还没有人留言评论。精彩留言会获得点赞!