一种体外重现肠道微生物组的系统及其应用方法与流程
本发明属于仿生学、人体生理学、微生物学、营养学及分析测试技术领域,具体涉及一种体外重现肠道微生物组的系统及其应用方法,在离体条件下,利用粪便重现胃肠道微生物组的系统装置。该系统装置因属于微型而有利于多个样本同时进行培养,从而达到高通量重现胃肠微生物组的技术要求。
背景技术:
作为完整生物体的一部分,肠道菌群除了参与维持机体健康活动外,它们也与很多疾病的发生和发展有着密切的相关性。肠道菌群与宿主的生理和病理状态均具有很密切的关系。肠道菌群对宿主的营养、代谢、上皮细胞的生长与分化、免疫功能的调节以及保护宿主免受外界侵袭方面起到非常重要的作用,同时它们与宿主的某些疾病也具有紧密联系。
肠道正常菌群的种类、数量和分布是相对稳定的,受饮食、内分泌、卫生习惯、地理环境、年龄及卫生条件的影响而变动。一般认为,健康人体的粪便菌群与肠道各部位菌群组成基本一致。因而可以对大规模肿瘤癌患进行粪便样本采集,并对这些人群进行追踪,使用分子生态学方法对用药过程中患者的胃肠道菌群组成进行动态分析,以期找到癌患在服药过程中胃肠道菌群的规律性变化。由于粪便样本的采集是非损伤性的样本采集方法,对肠道菌群的组成与数量进行动态监控有可能成为一种非损伤性的判断肿瘤癌患胃气重建的重要依据。
对于人体胃肠道仿生系统的建立及方法的研究,国外起步较早,受重视程度也比较高,而我国的研究相对滞后,目前只有为数不多的机构进行着装置和方法的研究,如实用新型专利授权号cn201634678u公开了一种模拟肠道环境的小型发酵装置,该装置可用于实验室好氧、厌氧、产气、不产气等微型发酵,可准确收集与计量发酵所产生的气体体积。发明专利授权号cn102533543b公开了一种能模拟人体肠道环境用于肠道微生物培养的装置,该装置能提供并维持相对恒定的温度、湿度、并可有一定的振荡,达到模拟肠道环境的效果。实用新型专利授权号cn202658158u公开了一种智能化生物体胃肠道消化系统模拟控制装置,该装置可通过计算机控制,模拟胃肠道消化系统。发明专利授权号cn101482460b公开了一种单位动物仿生消化系统及基于该系统模拟单位动物消化的方法,该系统及方法实现了体外条件下模拟动物胃肠道消化吸收饲料的过程。发明专利授权号cn101665758b公开了一种体外条件下重现人体胃肠道及微生态系统的模拟试验方法,该方法基于由比利时根特大学引进的人体肠道微生态系统模拟装置,针对东方人群的生活习性进行技术改进达到在体外条件重现人体胃肠道系统。发明专利授权号cn103740589a公开了一种人体胃肠道仿生系统及基于该系统的模拟实验方法,实现在体外条件下,利用该系统和方法可以真实地模拟人体胃肠道对摄入食物的消化、吸收及肠道微生态系统。
目前,国内所申请胃肠道仿生系统的专利中,无人能够保证采样的厌氧环境,无人能够做到微型,同时进行多个样本的培养,而达到高通量的技术要求。
技术实现要素:
本发明的目的是提供一种体外重现胃肠道微生物组的系统及其应用方法。
本发明由如下技术方案实现的:一种体外条件重现胃肠道微生物组的系统,由取样装置、模拟装置、注射装置、培养装置,其中:取样装置为针管式采样器;模拟装置包括底部设置有超滤膜且置于离心管内的厌氧管,厌氧管顶部设置丁基胶塞,丁基胶塞上设置氮气导管和空气导管,氮气导管伸入丁基胶塞内底部,空气导管伸入至厌氧管底部;注射装置为连续注射器;培养装置为恒温摇床;
所述针管式采样器为1ml玻璃采样器;厌氧管为2ml;离心管顶部与厌氧管过盈配合;所述超滤膜为微孔滤膜,孔径为0.001um,耐酸碱度ph1.0-2.5,温度37℃。
利用所述的一种体外条件重现胃肠道微生物组的系统进行重现胃肠道微生物组的方法,步骤如下:
(1)采集样品:用玻璃取样器将胃液和食物营养液体积比为2:1的混合液注入粪便中,抽取混合物,反复抽取3次,最后抽取粪便、胃液和食物营养液混合物0.5ml;
(2)胃中微生物重现:用连续注射器将1ml食物营养液和胃液以体积比为2:1的比例混合的混合物注入厌氧管内,添加0.05m盐酸和0.5m碳酸氢钠,ph保持在1.0-2.5;丁基胶塞密封厌氧管,然后通氮气3-5s,排出空气,管内达到无氧环境;用取样器将步骤(1)所提取的粪便混合物注入厌氧管内。将重现系统置于恒温摇床上,设置摇床温度为37℃,振荡频率200r/min;培养时间为2-4h,过程中每30min抽取菌液测定其在600nm处的吸光度值,根据测量值,od值为0.8-1时即为培养结束时;
(3)培养完成,抽取取菌液样本,采用高通量的测序方法进行胃中微生物组的分析;
(4)小肠中微生物重现:用连续注射器向培养完成的厌氧管中加入小肠液0.5ml,加入0.5m氢氧化钠,调节ph为6.0-7.5,然后将厌氧管置于恒温摇床控制摇床温度为37℃,振荡频率100r/min,进行肠道微生物组的培养4-6h;培养过程中,开始培养30min,进行第一次排气,接下来培养过程中,每间隔1.5h进行一次排气,直至培养结束。每次排气完成后,将装置置于离心机上进行离心操作,离心速度为8000-12000r/min,至管内没有液体。离心完成后要对管内进行小肠液的补充,以及添加氢氧化钠调节ph为6.0-7.5,培养4h后,每30min抽取一次菌液,测定其在600nm处的吸光度值,根据测量值,od值为0.8-1时即为培养结束时。
(5)培养完成,抽取菌液样本,采用高通量的测序技术进行微生物组的分析;
其中:胃液的制备方法为:2gnacl、3.2g胃蛋白酶,置于100ml容量瓶中,加入36.5%浓hcl7ml,然后添加无菌蒸馏水定容至100ml,配制好的胃液置于4℃冰箱保存;
胰液的制备方法为:0.9g胰蛋白酶、6g胆汁盐、12.5gnahco3,用无菌蒸馏水溶解并用1000ml容量瓶定容,配制好的胰液置于4℃冰箱保存;
食物营养液的制备方法为:月示蛋白胨15g、胰酪蛋白胨10g、大豆蛋白胨3g、酵母浸粉5g、牛肉粉2g、消化血清粉13.5g、牛肝浸粉1.2g、葡萄糖3g、磷酸氢二钾2.5g、氯化钠3g、可溶性淀粉0.3g、l-半胱氨酸0.3g、硫乙醇酸钠0.15g加入1l蒸馏水中,将ph调至7.2,25℃灭菌30min。
本发明主要重现胃和小肠的微生态环境。通过调整胆盐比例,以及根据微生物的培养条件调整系统参数,即可有效地模拟大肠环境。
与现有技术相比,本发明具有以下优点:(1)利用针管式采样器采样,将装有胃液和食物营养液的混合液注入粪便,反复抽取三次,保证样本采集的厌氧环境。(2)重现装置为2ml的厌氧管,胃和小肠的模拟在同一个厌氧管中进行。微生物培养装置为恒温摇床,能够保证相对恒定的温度、湿度,并且可以调节振荡频率,模拟胃肠蠕动,达到模拟人体胃肠道环境的效果。重现系统微型,可同时进行多个样本的培养,能达到高通量的技术要求。(3)重现系统设有超滤膜,培养过程中利用离心机离心,可实现对代谢产生的小分子代谢产物的实时吸收,并避免对肠道定植菌群的扰动,模拟逼真,更接近于肠道对代谢物质的真实吸收,更优于传统肠道模拟装置的培养模式。
附图说明
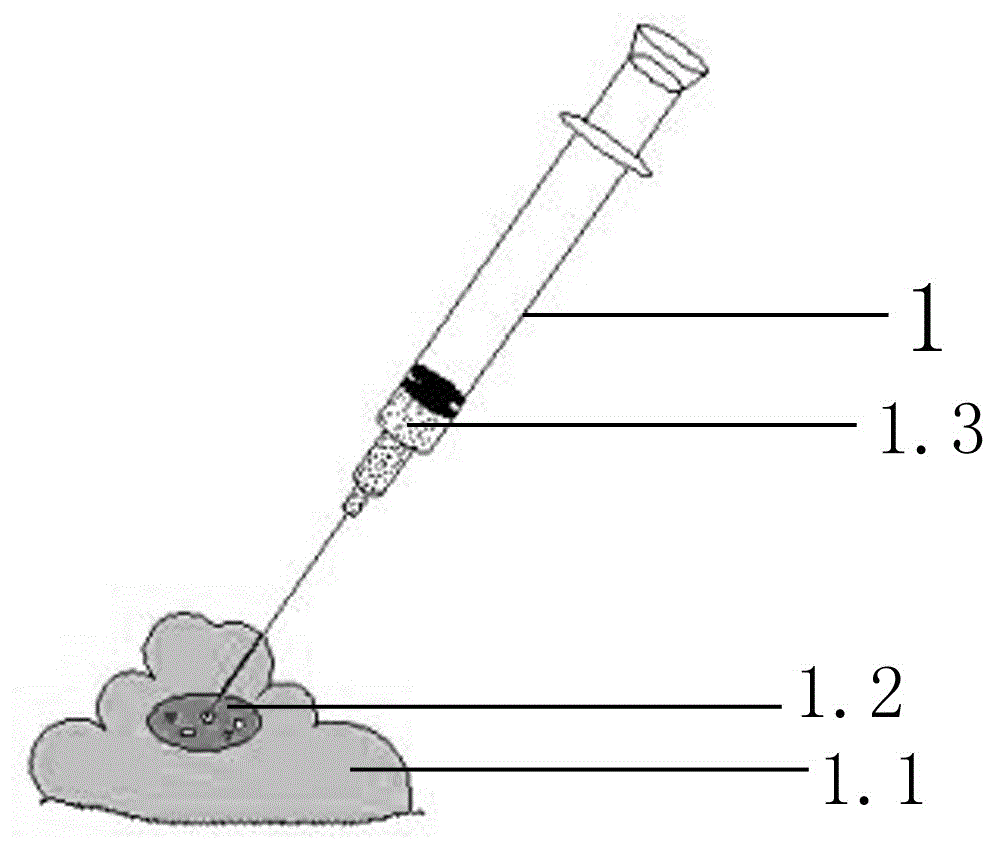
图1为取样装置示意图;图2为重现系统装置示意图;图中:1-取样装置;1.1-粪样;1.2-胃液、食物营养液与粪样混悬液;1.3-脱气处理的胃液、食物营养液混悬液;2-厌氧管;3-超滤膜;4-离心管;5-丁基胶塞;6-氮气导管;7-空气导管。
具体实施方式
一种体外条件重现胃肠道微生物组的系统,如附图2所示,由取样装置、模拟装置、注射装置、培养装置,其中:取样装置为针管式采样器;模拟装置包括底部设置有超滤膜且置于离心管内的厌氧管,厌氧管顶部设置丁基胶塞,丁基胶塞上设置氮气导管和空气导管,氮气导管伸入丁基胶塞内底部,空气导管伸入至厌氧管底部;注射装置为连续注射器;培养装置为恒温摇床,培养过程中利用针管头插入丁基胶塞对管内进行抽气。
所述针管式采样器为1ml玻璃采样器;厌氧管为2ml;离心管顶部与厌氧管过盈配合;所述超滤膜为微孔滤膜,孔径为0.001um,耐酸碱度ph1.0-2.5,温度37℃。
利用所述的一种体外条件重现胃肠道微生物组的系统进行重现胃肠道微生物组的方法,步骤如下:
(1)样品采集:用玻璃取样器将胃液和食物营养液的混合液注入粪便中,抽取混合物,反复抽取3次,最后抽取粪便、胃液和食物营养液混合物0.5ml;采样方法用2ml的注射器,装入经过脱气处理的胃液和食物营养液体积比为2:1的混合液1ml,将其注入粪便内部,利用针头进行小范围的搅动,再将其混悬液吸入注射器内,反复进行3次。最终抽取粪样、胃液和食物营养液的混悬液1ml左右。
(2)胃中微生物重现:用连续注射器将1ml食物营养液和胃液混合物注入2ml厌氧管内,添加0.05m盐酸和0.5m碳酸氢钠,ph保持在1.0-2.5;丁基胶塞密封厌氧管,然后通氮气3-5s,排出空气,管内达到无氧环境;用取样器将步骤(1)所提取的粪便混合物注入厌氧管内,重现系统建立;将重现系统置于恒温摇床上,设置摇床温度为37℃,振荡频率200r/min;培养时间为2-4h,过程中每30min抽取一次菌液,测定其在600nm处的吸光度值,根据测量值,od值为0.8-1时即为培养结束时。
(3)培养完成,取菌液样本,采用高通量的测序技术进行胃中重现微生物组的分析;
(4)小肠中微生物重现:用连续注射器向培养完成的厌氧管中加入小肠液0.5ml,加入0.5m氢氧化钠,调节ph为6.0-7.5,然后将厌氧管置于恒温摇床控制摇床温度为37℃,振荡频率100r/min,进行肠道微生物组的培养4-6h;培养过程中,开始培养30min,进行第一次排气,接下来培养过程中,每间隔1.5h进行一次排气,直至培养结束。每次排气完成后,将装置置于离心机上进行离心操作,离心速度为8000-12000r/min,至管内没有液体。离心完成后要对管内进行小肠液的补充,以及通过加氢氧化钠调节ph为6.0-7.5,培养4h后,每30min抽取一次菌液,测定其在600nm处的吸光度值,根据测量值,od值为0.8-1时即为培养结束时。
(5)培养完成,抽取菌液样本,采用高通量的测序技术进行微生物组的分析。
其中:胃液的制备方法为:2gnacl、3.2g胃蛋白酶,置于100ml容量瓶中,加入36.5%浓hcl7ml,然后添加无菌蒸馏水定容至100ml,配制好的胃液置于4℃冰箱保存;
胰液的制备方法为:0.9g胰蛋白酶、6g胆汁盐、12.5gnahco3,用无菌蒸馏水溶解并用1000ml容量瓶定容,配制好的胰液置于4℃冰箱保存;
食物营养液的制备方法为:月示蛋白胨15g(南京茂捷微生物科技有限公司)、胰酪蛋白胨10g、大豆蛋白胨3g、酵母浸粉5g、牛肉粉2g、消化血清粉13.5g、牛肝浸粉1.2g、葡萄糖3g、磷酸氢二钾2.5g、氯化钠3g、可溶性淀粉0.3g、l-半胱氨酸0.3g、硫乙醇酸钠0.15g加入1l蒸馏水中,将ph调至7.2,25℃灭菌30min。
实验例1:系统稳定性的可行性评估
1.研究对象与方法
选用spf级健康昆明种10周龄雄性大鼠3只,体重300-400克,由山西中医药大学实验动物中心提供,实验动物生产许可证号:scxk(晋)2018-0002,实验动物质量合格证号:0081670。整个试验分为两组,第一组为采集健康大鼠粪便,利用该系统进行大鼠的胃肠微生物组的重现,第二组直接取采集完粪样的大鼠胃肠内容物。提取两组样本dna,对提取后的dna进行纯化,然后进行琼脂凝胶电泳检测。对检测合格的dna进行pcr扩增,并对扩增产物进行质量检测和纯化,利用高通量测序平台对两组样本菌群16srdna的一段区域进行测序。根据测序结果总体分析比较两组胃肠道菌群之间的相似性差异性,评估重现系统的稳定性及可行性。
实验主要仪器见表1,实验主要试剂见表2。
表1:实验主要仪器
表2:实验主要试剂
2.实验步骤
(1)样本采集:
按压大鼠腹部刺激其排便,用灭菌的镊子夹取大鼠粪便,快速放入装有大鼠胃液的培养基中,以备后续使用。每只大鼠采样约1g。
颈椎脱臼法处死采集完粪样的大鼠,无菌环境下移取胃和肠,用镊子夹取,放置在冰的锥形瓶内,然后用无菌剪刀分离出小肠部位。取出胃及小肠内容物,并用刀片刮取胃及小肠黏膜。液氮冷冻样本,然后储存在-80℃冰箱内,以备后续dna提取。
(2)微生物组培养
模拟器用丁基胶塞密封,通过进气口通氮气,管内空气从排气口排出,使管内达到无氧环境。通过注射器将采集的三只大鼠的粪样分别注入3个模拟器内。设置恒温摇床的温度为37℃,设置振荡频率200r/min。将3个模拟器放入恒温摇床中培养,培养开始2h后,每隔30min抽取菌液测定其在600nm处的吸光度。培养3h时,od值显示在1附近,即微生物在胃模拟环境中培养完成。通过连续注射器向培养完成的模拟管中加入小肠液0.5ml,添加氢氧化钠(0.5m),调节ph值为7.0。设置恒温摇床的温度为37℃,设置振荡频率为100r/min,将模拟器放入恒温摇床中进行肠道微生物组的培养4-6h。培养过程中,开始培养30min,进行第一次排气,接下来培养过程中,每间隔1.5h进行一次排气,直至培养结束。每次排气完成后,将装置置于离心机上进行离心操作,离心速度为8000-12000r/min,至管内没有液体。离心完成后要对管内进行食物营养液和小肠液的补充,以及维持ph为6.0-7.5,培养4h后,每30min抽取一次菌液,每30min抽取一次菌液,测定其在600nm处的吸光度值,根据测量值,od值为0.8-1时即为培养结束时。
(3)样本微生物组实验
样本基因组dna使用e.z.n.atm粪便dna提取试剂盒进行提取。为保证结果的准确性,将所得样本菌群dna进行纯度检测,对于样本菌群dna不符合要求的样本进行再次dna抽提,对于多次抽提不合格的样本进行dna纯化。凝胶糖凝胶电泳检测,利用pcr仪对样本菌群16sdnav3-v6区进行pcr扩增,按照试剂盒说明书步骤用qiaquickgelextractionkit试剂盒对pcr扩增产物进行纯化。采用roche454高通量测序技术进行测序。
(4)生物信息学分析
本实验分析所用软件为qiime(quantitativeinsightsintomicrobialecology),该微生物种群分析软件包包含了rdpclassifier,pynast,以及fasttree等。otu(operationaltaxonomicunits)分析使用uclust程序对所有可用于分析的序列进行聚类,把相似度为97%的序列聚成一个out。样品α丰富度分析通过绘制稀释曲线来进行检验,稀释曲线是用来评价测序量是否足以覆盖所有类群,间接反映样品中物种的丰富程度。
3.结果与分析
(1)多样性分析:群落生态学研究微生物多样性时,通常计算chao1指数、simpson指数、shannon指数来分析单个样品的多样性,otu数、chao1指数反应样品中群落的丰富程度,丰富度指数越高,说明样品的多样性越高。simpson和shannon指数主要反应群落的多样性,其可受样品群落中物种均匀度和丰富度的影响。simpson指数越小,表示多样性越高。shannon指数越大,表明生物多样性越高。
胃内菌群多样性分析:结果见表3,重现的大鼠胃微生物组样本获得高质量序列总数96003条,平均每个样本32001条,大鼠胃内容物样本获得高质量序列总数112005条,平均每个样本37335条。经过系统重现组otu数为193.75±26.02个,直接取胃内容组otu数为192.63±36.12个,两组间无显著差异;经过系统重现组chao1指数为203.27±23.03,直接取胃内容组chao1指数为208.00±35.45,两组间无显著差异;simpson指数在经过系统重现组是0.25±0.07,在直接取胃内容物组是0.22±0.05,两组间无显著差异;经过系统重现组shannon指数为2.44±0.38,直接取胃内容组shannon指数为2.57±0.29,两组间无显著差异。通过两组间丰富度及多样性参数(otu数、chao1指数、simpson指数、shannon指数)之间的比较说明大鼠粪样经过重现系统组和之间取大鼠胃内容物组在菌群的丰度及多样性之间无显著差异。
表3:重现胃微生物的多样性
肠道内菌群多样性分析:结果见表4,重现的大鼠小肠微生物组样本获得高质量序列总数112236条,平均每个样本37412条,大鼠小肠内容物样本获得高质量序列总数132035条,平均每个样本44012条。经过系统重现组otu数为226.75±26.55个,直接取小肠内容组otu数为256.63±45.36个,两组间无显著差异;经过系统重现组chao1指数为236.36±35.03,直接取小肠内容组chao1指数为266.37±37.56,两组间无显著差异;simpson指数在经过系统重现组是0.35±0.06,在直接取小肠内容物组是0.35±0.04,两组间无显著差异;经过系统重现组shannon指数为2.74±0.58,直接取小肠内容组shannon指数为2.97±0.29,两组间无显著差异。通过两组间多样性参数(otu数、chao1指数、simpson指数、shannon指数)之间的比较说明大鼠粪样经过重现系统组和之间取大鼠小肠内容物组在菌群的丰度及多样性之间无显著差异。
表4:重现小肠微生物的多样性
(2)样本菌群结构分析
胃内菌群结构分析:胃内菌群在门分类水平上两组间的分析结果见表5,在门水平上,我们发现两组胃内菌群主要隶属于4大菌门,包括拟杆菌门(bacteroidetes)、厚壁菌门(firmicutes)、变形菌门(proteobacteria)以及放线菌门(actinobacteria)。在重现胃内菌群中,拟杆菌门(60.2%)和厚壁菌门(34.9%)占绝对优势,其次为变形菌门(3.4%)、放线菌门(0.3%);胃内容物菌群中,拟杆菌门(65.2%)和厚壁菌门(27.8%)同样所占比例最多,其次为变形菌门(6.9%)、放线菌门(0.2%)。
表5:胃内菌群在门分类水平上两组间的分析
胃内菌群重现组和胃内容物菌群组属水平分析结果见表6,在属水平上,两组主要菌群为拟杆菌属(bacteroides),胃内菌群重现组为48.9%,肠道内容物菌群组为53.6%,其次胃内菌群重现组和胃内容物组的菌群分别是普氏菌群(provetella)(5.1%vs4.8%)、butyricimonas(0.1%vs0.3%)、odoribacter(0.2%vs0.5%)、梭菌属(clostridium)(0.1%vs0.1%)、anaerostipes(0.3%vs0.2%)、blautia(0.5%vs0.4%)、faecalibacterium(4.3%vs4.6%)、粪球菌属(coprococcus)(0.6%vs0.5%)、dorea(0.4%vs0.2%)、roseburia(0.1%vs1.6%)、颤螺菌属(oscillospira)(0.7%vs0.9%)、毛螺菌属(lachnospira)(3.3%vs1.6%)、瘤胃球菌属(rumincoccus)(0vs0.7%)、韦荣氏球菌属(veillonella)(0vs1.5%)、链球菌属(streptococcus)(0.7%vs1.0%)、双歧杆菌(bifidobacterium)(0.7%vs0.8%)、萨特氏菌属(sutterella)(0.9%vs1.5%)、嗜胆菌属(bilophila)(0%vs0.1%)。
表6:胃内菌群重现组和胃内容物菌群组属水平主要菌群均值(mean±sd)比较
肠道内菌群结构分析:肠内菌群在门分类水平结果见表7,在门水平上,我们发现两组肠道菌群主要隶属于4大菌门,包括拟杆菌门(bacteroidetes)、厚壁菌门(firmicutes)、变形菌门(proteobacteria)以及放线菌门(actinobacteria)。在重现肠道菌群中,拟杆菌门(58.2%)和厚壁菌门(36.9%)占绝对优势,其次为变形菌门(2.4%)、放线菌门(0.2%);肠道内容物菌群中,拟杆菌门(63.2%)和厚壁菌门(26.9%)同样所占比例最多,其次为变形菌门(8.8%)、放线菌门(0.1%)。
表7肠内菌群在门分类水平上两组间的分析
肠道菌群重现组和肠道内容物菌群组属水平结果见表8,在属水平上,两组主要菌群为拟杆菌属(bacteroides),肠道菌群重现组为46.9%,肠道内容物菌群组为51.6%,两组之间稍有差异(p=0.07),其次肠道菌群重现组和肠道内容物组的菌群分别是普氏菌群(provetella)(6.1%vs4.8%)、parabacteroides(2.3%vs2.5%)、butyricimonas(0.3%vs0.4%)、梭菌属(clostridium)(0.1%vs0.1%)、blautia(0.5%vs0.4%)、faecalibacterium(4.3%vs4.6%)、粪球菌属(coprococcus)(0.6%vs0.5%)、颤螺菌属(oscillospira)(0.7%vs0.9%)、毛螺菌属(lachnospira)(3.3%vs1.6%)、瘤胃球菌属(rumincoccus)(0.7%vs0.7%)、考拉杆菌属(phascolarctobacterium)(1.6%vs1.2%)、韦荣氏球菌属(veillonella)(0%vs1.5%)、链球菌属(streptococcus)(0.7%vs1.0%)、双歧杆菌(bifidobacterium)(0.7%vs0.8%)、萨特氏菌属(sutterella)(0.9%vs1.5%)、嗜胆菌属(bilophila)(0%vs0.1%)。
表8:肠道菌群重现组和肠道内容物菌群组属水平主要菌群均值(mean±sd)比较
4.结论:通过重现大鼠胃和大鼠胃内容菌群多样性及结构的比较,以及重现大鼠小肠与大鼠小肠内容菌群多样性及结构的比较,菌群多样性及丰度无显著差异性,综合评价该系统具有较高的可行性。
- 还没有人留言评论。精彩留言会获得点赞!