一种射干苷元Mannich碱衍生物及其制备方法和应用与流程
本发明属于化学医药领域,具体涉及一种射干苷元mannich碱衍生物及其制备方法和应用。
背景技术:
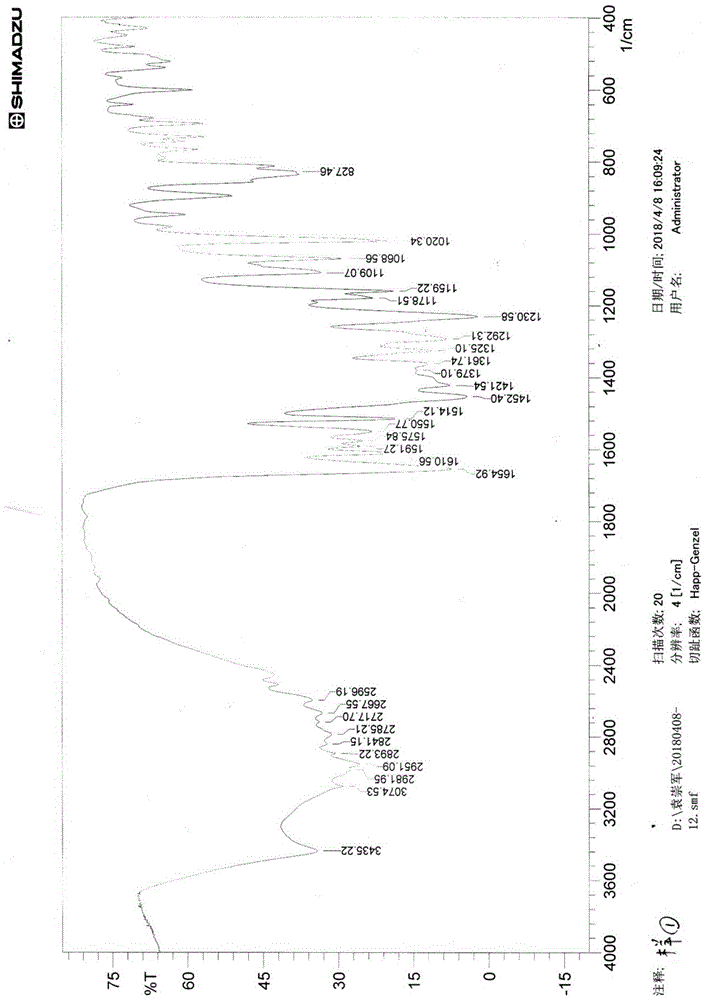
:肿瘤是人体组织细胞在内外各种有害的因素长期作用下,发生基因突变,表达紊乱,调节失控,产生过度增生及异常分化形成的新生物或赘生物。这种新生物或赘生物并非机体所需要,不按正常规律生长或不可遏止的生产,已丧失正常组织细胞功能,并可破坏原来器官组织结构,进而危及生命。肿瘤是一种常见病、多发病,其中恶性肿瘤是仅次于心血管疾病的第二位造成人类高死亡率的疾病。因为肿瘤治疗的特殊性,患者需要全程或终身接受正规治疗以延缓肿瘤进展或防止肿瘤复发,且费用昂贵,因此各国政府、研究机构、制药公司长期以来对抗肿瘤药物研究予以高度重视。已有一些研究证明射干苷元具有抗肿瘤作用。黄文哲等证实射干苷元对胃癌细胞和白血病增殖有一定程度的抑制作用,并呈剂量依耐性;汪新亮等通过实验证明鸢尾苷元对smmc-7721人肝癌细胞株增殖具有明显的抑制作用,其机制可能与促进癌细胞凋亡有关;thelen等用射干的提取物治疗裸鼠前列腺癌,证实其中的射干苷元可调癌基因的异常表达;fang等证实射干苷元具有细胞毒性,能抑制细胞分裂;zheng等证实射干苷元可通过抑制cox-2的诱导作用而抑制tpa或辛酸刺激的腹膜巨噬细胞前列腺素e2(pge2)的产生,即可抑制新生血管生成,而对肿瘤的发生、发展及预后起着重要作用;潘静用mtt比色法观察从川射干提取的异黄酮类成分对人胃癌细胞株sgc7901的作用,结果,射干苷元对人胃癌细胞有抑制作用。射干苷元属于黄酮类化合物,黄酮类化合物一般难溶或不溶于水,难以注射给药;而大部分口服给药的黄酮类化合物在胃肠道即发生代谢。因此,黄酮类化合物普遍存在吸收差的弊端。其进入人体后吸收较差,严重影响治疗效果。所以,提供一种既具有良好的治疗效果,又能被人体吸收的射干苷元衍生物,对于治疗肿瘤药物的研究具有重要意义。技术实现要素:本发明的目的是提供一种射干苷元mannich碱衍生物及其制备方法和应用。本发明提供了式ⅰ所示化合物或其药学上可接受的盐:其中,r1和r2分别独立的选自h、c1~c10烷基、乙醇基、取代或未取代的芳杂环;所述取代基为c1~c10烷基;所述芳杂环的杂原子为n、o或s;所述芳杂环的杂原子为0~2个。进一步地,r1和r2分别独立的选自h、c1~c4烷基、乙醇基、未取代的芳杂环;所述芳杂环的杂原子为n;所述芳杂环的杂原子为1个。进一步地,r1和r2分别独立的选自h、c2烷基、乙醇基、未取代的芳杂环;所述芳杂环的杂原子为n;所述芳杂环的杂原子为1个。进一步地,所述化合物选自如下结构式之一:本发明还提供了一种制备前述化合物或其药学上可接受的盐的方法,它包括以下步骤:取射干苷元,加入无水乙醇溶解,再加入甲醛和反应试剂,混匀,水浴回流2~4h,冷却,冰箱放置过夜,析出结晶,过滤、无水乙醇洗涤、60℃减压干燥,即得;其中,所述无水乙醇的用量是射干苷元的10倍(v/w);和/或,所述甲醛的用量是射干苷元的1倍(v/w);和/或,所述反应试剂为乙醇胺、2-氨基吡啶、二乙胺或乙胺中的一种,优选的,所述反应试剂的用量是射干苷元的0.5~1倍(v/w或w/w);和/或,所述过滤为使用g3垂熔玻砂漏斗过滤。进一步地,所述射干苷元的制备方法如下:(1)取射干原生药,干燥,粉碎,95%乙醇加热回流提取3次,每次1h,趁热过滤,合并滤液,60℃减压回收溶剂,得浸膏;(2)将上述浸膏加95%乙醇搅拌均匀,抽滤,得射干苷粗品;(3)取射干苷粗品,95%乙醇加热回流1h,静置过夜,析出沉淀,过滤,将95%乙醇将沉淀重结晶1次,得射干苷精品;(4)取射干苷精品与50%乙醇混合,搅拌均匀,加入浓盐酸,混匀,加热回流3~5h,趁热过滤,静置过夜,析出针晶;(5)将针晶过滤并用去离子水洗涤至流出液ph近中性,95%乙醇加热溶解针晶,过滤,滤液趁热倒入沸水,静置过夜,析晶,过滤,60℃减压干燥,得射干苷元精品。进一步地,所述步骤(1)中,每次提取95%乙醇用量为射干原生药量的4倍(v/w);和/或,所述步骤(2)中,95%乙醇用量为射干原生药量的1/5(v/w);和/或,所述步骤(3)中,95%乙醇用量为射干苷粗品的2倍(v/w);和/或,所述步骤(4)中,50%乙醇用量为射干苷精品的5倍(v/w);和/或,所述步骤(4)中,浓盐酸用量为射干苷精品的1/2(v/w)。本发明还提供了前述化合物或其药学上可接受的盐在制备抗癌药物中的应用。进一步地,所述癌症为结肠癌、肺癌和肝癌。本发明还提供了一种药物,它是以前述的化合物或其药学上可接受的盐,加上药学上可接受的辅料或者辅助性成分制备而成的制剂。试验结果表明,本发明制备的射干苷元mannich碱衍生物克服了射干苷元吸收差的缺点。同时,本发明制备的射干苷元mannich碱衍生物具有良好的抗肿瘤效果,特别是对结肠癌、肺癌和肝癌有良好的抑制作用。因此,本发明制备的化合物或其药学上可接受的盐加上药学上可接受的辅料或者辅助性成分后,可用于制备治疗结肠癌、肺癌和肝癌的药物。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1为化合物1的ir图谱。图2为化合物1的ms图谱。图3为化合物1的1h-nmr图谱。图4为化合物1的13c-nmr图谱。图5为化合物2的ir图谱。图6为化合物2的ms图谱。图7为化合物2的1h-nmr图谱。图8为化合物2的13c-nmr图谱。图9为化合物3的ir图谱。图10为化合物3的ms图谱。图11为化合物3的1h-nmr图谱。图12为化合物3的13c-nmr图谱。图13为化合物4的ir图谱。图14为化合物4的ms图谱。图15为化合物4的1h-nmr图谱。图16为化合物4的13c-nmr图谱。具体实施方式药材与试剂川射干:四川新荷花中药材有限公司,批号:1601103;一乙醇胺:成都市科龙化工试剂厂,批号:2015120401;乙胺:成都市科龙化工试剂厂,批号:2016010201;二乙胺:成都市科龙化工试剂厂,批号:2015020301;2-氨基吡啶:成都市科龙化工试剂厂,批号:2015030101;甲醛:成都金山化学试剂有限公司,批号:20160316;无水乙醇:成都长联化学试剂有限公司,批号:20151208;所有试剂均由四川省中医药科学院后勤处统一购买。实施例1射干苷的制备川射干原生药60℃干燥,粉碎成粗粉过20目筛,置于提取容器内,用95%乙醇加热回流提取3次,每次时间1小时,每次溶媒用量为药材量的4倍(v/w)。趁热过滤,合并滤液,60℃减压回收溶剂,得比重1.2g/ml(60℃测定)的糖浆状物质(棕黄色浸膏),其得率为药材量的49~51%(w/w)。将上述浸膏加95%乙醇(乙醇用量为药材量的1/5,v/w)搅拌均匀,抽滤,得射干苷粗品。取射干苷粗品,加95%乙醇加热回流1小时(溶媒用量为射干苷粗品的2倍,v/w),静置过夜,析出淡黄色沉淀,过滤,沉淀再用95%乙醇如上操作重结晶1次,得射干苷精品(无色结晶性粉末,得率为药材量得4.5%,含量>98%)。实施例2射干苷元的制备取射干苷精品1000g置于10000ml圆底烧瓶中,加50%乙醇5000ml,搅拌均匀,再加浓盐酸500ml,摇匀。加热回流3~5小时,待薄层检查无射干苷斑点时停止水解反应。取出,趁热过滤,静置过夜,析出淡黄色细长针晶。过滤,用去离子水洗涤针晶至流出液ph近中性,针晶用2000ml95%乙醇加热溶解,过滤,滤液趁热倾入4500ml沸水,静置过夜,析晶。过滤,60℃减压干燥,得射干苷元精品(淡黄色细长针晶,得率为药材量得2.5%,含量>98%)。实施例3本发明化合物1的制备取射干苷元10g,加入无水乙醇100ml,水浴加热溶解,再加入甲醛10ml、乙醇胺10ml,混匀,水浴回流3小时,取出放冷,冰箱放置过夜,析出淡黄色细沙状结晶,g3垂熔玻砂漏斗过滤,无水乙醇洗涤,60℃减压干燥,即得化合物1,得量5g。经测定,该化合物uvλmaxnm为273.60nm(etoh);该化合物1的红外图谱(ir)、质谱(ms)、氢谱(1h-nmr)和碳谱(13c-nmr)见图1~4。元素分析c19h19no7(%):理论值为c60.88,h5.21,n3.74;计算值为c61.12,h5.13,n3.75。故鉴定此化合物为8-(n-羟乙基)-亚甲基胺基-5,7,4′-三羟基-6-甲氧基异黄酮。实施例4本发明化合物2的制备取射干苷元10g,加入无水乙醇100ml,水浴加热溶解,再加入甲醛10ml、2-氨基吡啶5g,混匀,水浴回流2小时,取出放冷,冰箱放置过夜,析出淡棕色粒状结晶,g3垂熔玻砂漏斗过滤,无水乙醇洗涤,60℃减压干燥,即得化合物2,得量2g。经测定,该化合物uvλmaxnm为273.00nm(etoh);该化合物2的红外图谱(ir)、质谱(ms)、氢谱(1h-nmr)和碳谱(13c-nmr)见图5~8。元素分析c22h18n2o6(%):理论值为c64.63,h4.58,n6.85;计算值为c65.02,h4.46,n6.90。故鉴定此化合物为8-(n-α-吡啶)-亚甲基胺基-5,7,4′-三羟基-6-甲氧基异黄酮。实施例5本发明化合物3的制备取射干苷元10g,加入无水乙醇100ml,水浴加热溶解,再加入甲醛10ml、二乙胺5ml,混匀,水浴回流4小时,取出放冷,冰箱放置过夜,析出淡黄色簇晶,g3垂熔玻砂漏斗过滤,无水乙醇洗涤,60℃减压干燥,即得化合物3,得量4g。经测定,该化合物uvλmaxnm:273.20nm(etoh);该化合物3的红外图谱(ir)、质谱(ms)、氢谱(1h-nmr)和碳谱(13c-nmr)见图9~12。元素分析c21h23no6(%):理论值为c65.24,h5.99,n3.61;计算值为c65.44,h6.01,n3.63。故鉴定此化合物为8-(n,n-二乙基)-亚甲基胺基-5,7,4′-三羟基-6-甲氧基异黄酮。实施例6本发明化合物4的制备取射干苷元10g,加入无水乙醇100ml,水浴加热溶解,再加入甲醛10ml、乙胺10ml,混匀,水浴回流2小时,取出放冷,冰箱放置过夜,析出淡黄色细沙状结晶,g3垂熔玻砂漏斗过滤,无水乙醇洗涤,60℃减压干燥,即得化合物4,得量5g。经测定,该化合物uvλmaxnm为273.60nm(etoh);该化合物4的红外图谱(ir)、质谱(ms)、氢谱(1h-nmr)和碳谱(13c-nmr)见图13~16。元素分析c19h19no6(%):理论值为c63.60,h5.58,n3.90;计算值为c63.86,h5.36,n3.92。故鉴定此化合物为8-(n-乙基)-亚甲基胺基-5,7,4′-三羟基-6-甲氧基异黄酮。实施例7本发明化合物对hct116、a549、hepg2细胞株体外增殖的影响分别取对数期的人结肠癌细胞株hct116、人肺癌细胞株a549、人肝癌细胞株hepg2,用胰酶消化,吹散,制备细胞混悬液,显微计数,调整细胞浓度,按6×103个/孔接种到96孔板,在37℃培养过夜。药物处理组中加入梯度稀释的实施例3~6制备的化合物1~4,同时设置空白对照组和射干苷元阳性药对照组,每个浓度做3个重复,放入37℃、5%co2培养箱中培养48h,试验结束前4h,将96孔板里的培养液吸出,加入100μlpbs缓冲液和10μl5mg/mlmtt溶液,37℃孵育4h。加100μl10%sds溶液。37℃孵育过夜。测定od570,计算ic50。结果见表1。表1本发明化合物对多种人癌细胞的体外抗肿瘤活性结果表明,本发明化合物1~4对hct116、a549、hepg2细胞株均显示出良好的抗肿瘤活性,且抗肿瘤活性均强于射干苷元阳性药对照组。其中,化合物3的抗肿瘤活性最好。实施例8本发明化合物对h22荷瘤小鼠的肿瘤增殖抑制作用研究取腹腔接种7d的h22细胞,配成1×107个/ml单细胞混悬液,在无菌条件下接种于小鼠右侧腋下,每只小鼠接种2×106个细胞。接种第2d,小鼠随机分为对照组、射干苷元阳性药对照组及实施例3~6制备的化合物1~4组,每组10只小鼠。分组后当天开始给药,腹腔注射,每天给药一次,连续2周。脱颈处死小鼠,剥离瘤块称重,按下式计算抑制率:抑制率%=(对照组肿瘤平均重量-给药组肿瘤平均重量)/对照组肿瘤平均重量×100%。结果见表2。表2本发明化合物对h22荷瘤小鼠的肿瘤增殖抑制作用分组剂量(mg/kg)瘤重(g)抑制率(%)对照组-2.36±0.530射干苷元1001.58±0.4833.0511001.05±0.5955.5121001.12±0.4352.5431001.01±0.2557.2041001.20±0.5049.15结果表明,本发明化合物1~4对小鼠h22荷瘤模型有较好的抑制作用,且均高于射干苷元。其中,化合物3的抑制效果最优,与射干苷元阳性药对照组相比,抑制率提高了73%。实施例9本发明化合物制剂的制备通过药理实验证明了本发明化合物1~4的药理活性,具有抗肿瘤作用。故本发明化合物可用于制备抗肿瘤疾病的药物,即本发明化合物加上药学上可接受的载体而制成不同的药物制剂,如注射剂、冻干粉针、片剂、散剂、颗粒剂、胶囊剂、丸剂、口服溶液等,其中片剂包括:普通压制片、咀嚼片、泡腾片、多层片、缓释片、控释片、包衣片、分散片、口含片、舌下片等;丸剂包括滴丸、含化滴丸、微丸等。胶囊剂包括:硬胶囊剂、软胶囊剂、肠溶胶囊剂、缓释胶囊剂、微囊等。注射剂的制备:采用常规注射剂的制备工艺制成,辅料可为聚乙二醇400(20%)、抗氧剂(亚硫酸氢钠,0.1%)等。每支2ml,含50mg化合物1或2或3或4。散剂的制备:将本发明的化合物加入适量辅料硬脂酸镁增加其流动性,分装,即得。颗粒剂的制备:将本发明的化合物与辅料粉碎后进行充分的混合,然后加入适当的粘合剂、润湿剂等进行制粒,干燥,整粒,分装,即得。胶囊剂的制备:胶囊剂分为软胶囊和硬胶囊,硬胶囊是将药物的粉末或者是颗粒进行装胶囊制得,软胶囊是把药液密封于球形或软质胶囊材料中。按干增塑剂(增塑剂为甘油、山梨醇或两者的混合物):干明胶:水=0.4~0.6:1.0:1.0,混合均匀,调配好作为软胶囊的囊壁,药物溶于聚乙二醇400、聚乙二醇6000按适当比例制成的溶媒中,然后采用滴制法或压制法制备本发明抗肿瘤药物软胶囊。同时,可以制成肠溶胶囊。此外,按照常规缓释胶囊的制备方法,选用不同的辅料如:乙基纤维素(ec),醋酸纤维素(ca),聚丙烯酸树脂等,作为缓控释成膜材料,制成缓、释控释的制剂骨架。将本发明化合物制成微囊,然后装入普通空胶囊中,即制成缓释/控释胶囊。滴丸或微丸的制备:取药物基质,如:聚乙二醇类、硬脂酸等加热后,将药液与基质混合均匀,置于滴丸机中保温,然后滴制到适当的冷凝剂中盛碗,洗除冷凝剂干燥整理,质检、包装,即得。片剂的制备:包括普通压制片、咀嚼片、泡腾片、多层片、缓释片、控释片,包衣片(糖衣片、薄膜衣片、肠溶衣片)、分散片、口含片、舌下片等。将本发明的药物与辅料粉碎后进行充分的混合,然后加入适当的粘合剂、润湿剂等进行制粒,压片,即得普通压制片。将本发明的药物与分散片用辅料混匀后制粒,压片,即得分散片。将制得的素片包衣,根据需要可包糖衣、薄膜衣、肠溶衣等,制得包衣片。用常规方法还可制得咀嚼片、泡腾片、多层片、口含片、舌下片等。综上,本发明制备的射干苷元mannich碱衍生物克服了射干苷元吸收差的缺点。同时,本发明制备的射干苷元mannich碱衍生物具有良好的抗肿瘤效果,特别是对结肠癌、肺癌和肝癌有良好的抑制作用。因此,本发明制备的化合物或其药学上可接受的盐加上药学上可接受的辅料或者辅助性成分后,可用于制备治疗结肠癌、肺癌和肝癌的药物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1