一种对磁力敏感的TRPV4-His499蛋白、磁调控工具和应用的制作方法
本发明涉及系统神经科学技术领域,具体涉及一种对磁力敏感的trpv4-his499蛋白、磁调控工具和应用。
背景技术:
目前,在对大多数动物行为学相关神经机制的解构中,以光遗传学为主的神经刺激技术已经得到了非常广泛的研发和使用。而磁遗传技术作为一种新型的,非侵入式的脑部深度刺激工具,也因其区别于光遗传的优势,在神经系统研究领域具有非常重要的应用潜能。
1.神经调控与行为学研究
在系统神经科学研究中,大脑是如何指导动物行为的发生是一个重要的研究目标。深度刺激神经系统进行人为的调控干预是研究脑部各区域的功能以及脑区之间相互关联的主要手段,并可对神经特定细胞类型进行精准靶向地调节。通过神经调控工具的实验性应用,以获得对神经系统活动的功能意义的因果关系洞察。目前常用的神经调控手段主要包括侵入式和非侵入式两类。侵入式的调控方式包括皮层内微电流刺激,光遗传刺激等;非侵入式调控手段包括经皮电刺激,经颅磁刺激,药物刺激,磁遗传刺激等。光遗传是一种当前神经科学研究较热门的领域,可以实现对神经刺激的远程控制。光遗传主要是通过病毒的转导,使特定的神经元可以稳定表达以chr2为代表的光敏感蛋白,在由埋植于体内的光电极引导的光刺激下,使表达有光敏蛋白的神经区域诱发突触反应。光遗传工具在对啮齿类行为调控中得到了非常广泛应用,同时帮助研究者们理解了多种与行为相关的特定神经通路的具体作用,并且对神经环路的研究,以及脑区间互作进行了深层次的解读和信息挖掘。光遗传学的方法可以精准地抑制或是激发神经回路,从毫秒级到多天的时间跨度,可以调节脑网络活动和动物行为。在临床应用方面,以光遗传刺激为代表的工具因为需要光电极的植入,使其局限为研究动物模型的脑环路的工具,故而需要继续开发其他的潜在临床治疗手段。
2.磁遗传的相关研究概述
磁遗传作为一种新兴的主要应用于神经调控的非侵入式工具,具有可深度、靶向刺激特定脑区,远程调控与动物行为相关的神经环路的特点。相较于光遗传工具,磁场的加载能够穿透更深的脑组织。目前该领域中基于磁感应蛋白ferritin的单一组分磁遗传工具,以及基于功能化的顺磁纳米粒的双组分磁遗传工具都发表在顶级的期刊上,并展示出磁遗传相关技术具有十分广阔的应用开发前景。我们也在分析学习国际研究热点的基础上,搭建了相对成熟的磁遗传研究的平台,力争创新性研发新的磁遗传工具,并实现在小鼠,大鼠,非人灵长类动物(猕猴)中实现对特定神经环路进行靶向刺激,并通过动物的行为学变化,明确磁遗传工具的有效性,并可试图研究未知的神经环路与相应行为的关系,将磁控应用到神经领域,更好地了解神经发育、功能和病理等等。目前已经发表的一些磁刺激神经环路的研究中,主要是通过激活trpv蛋白(transientreceptorpotentialvanilloid,trpv)引发细胞的钙内流;而钙离子作为第二信使,能够促进神经细胞的神经递质的分泌,产生动作电位,刺激动物诱发相应的行为学改变。来自北京大学的谢灿团队首度证实了magr作为磁感应蛋白的存在,随后有实验证明该磁蛋白可以感受磁场激活,并诱发细胞的钙内流现象。但之后也有文章实验证明,单独使用magr这一个蛋白并不能诱发显著的细胞钙瞬变。总之,magr这一磁性蛋白的功能的发现,也为磁遗传学的研究和应用提供了更新颖的方向。
2.磁遗传研究的主要工具
在目前的已经研发出的几种磁遗传工具中,trpv1、trpv4离子通道扮演了至关重要的角色。大部分研究都是通过外源转染或病毒转导基因改造的trpv蛋白家族中之一,使特定细胞群获得改造过的trpv非选择性的钙离子通道,并在磁场刺激下,打开trpv离子通道,促进钙离子进入细胞内,诱发神经细胞动作电位的发生,激活特定脑区和神经环路,直接或间接改变相应的动物行为。
首先,在2012年由美国rockefeller大学的研究人员发表在science杂志上的一篇文章中介绍了他们使用无线电波产生的低频磁场加热氧化铁纳米颗粒,能够特异性调节小鼠的血液葡萄糖的水平。他们利用在跨膜蛋白trpv1蛋白的第一个loop区插入了his标签,添加包裹了抗his抗体的顺磁性铁纳米颗粒,可以特异性吸附识别暴露在膜外的his标签。在低频磁场作用下,增强钙离子内流,促进携带nfat启动子的外源胰岛素基因的表达。转染表达融合蛋白ferritin,在细胞内包裹铁离子形成纳米粒子,在磁热作用下,使对温度敏感的trpv1通道打开。
2015年同样发表在science上的文章中报道了使用交互磁场刺激,在鼠的中脑腹侧被盖区(vta),可诱发脑部靶位点区的亚型神经元的激活。磁纳米粒在磁场作用下发热,引起周围的trpv1阳性神经细胞的可逆性放电的发生。注入的磁纳米颗粒会持续作用于脑部1个月,可形成无需植入且与靶点的慢性刺激。而且,进行了peg修饰的磁纳米粒,具有更低的细胞毒性和生物相容性,在磁热的作用下,可以引起trpv1阳性的细胞发生极化,引发钙内流,细胞内外源转染的钙指示蛋白gcamp6s与钙离子结合发绿色荧光。但在本实验中,并没有将磁纳米粒进行特异性修饰,具有很高的脱靶效应,不能精准靶向目的细胞,需要消耗大量的磁纳米粒和热量。
与此同时,2015年发表在naturemedicine杂志上的文章中也通过使用基因编码的磁性纳米颗粒实现远距离调节小鼠体内葡萄糖稳态的效果。他们提出了三种工具模式:1)共表达trpv1和胞浆铁蛋白ferritin(铁蛋白轻链-自由结合部flag标签-铁蛋白重链的融合方式);2)共表达trpv1和酰胺化的胞浆铁蛋白(引导其结合细胞膜);3)共表达n-端融合抗gfp的单个结构域的trpv1,和n-端结合gfp的胞浆铁蛋白(使gfp-铁蛋白与anti-gfp-trpv1在细胞膜上可以特异性结合)。实验中证实第三种构建方式具有良好的效果。
2016年,alidgüler团队发表在natureneuroscience上的这篇文章中首次通过磁遗传靶向调控神经系统影响动物的行为学改变。trpv4蛋白融合了ferritin蛋白在特定的与奖赏机制相关的神经元表达,磁场作用通过机械力开启trpv4通道引起钙内流,诱发神经细胞动作电位产生,在小鼠和斑马鱼的奖赏行为模式中表现出了出色的干预调控的效果,这一应用也为我们的实验设计奠定了基础。
紧接其后,在2017发表在elife杂志上的一篇文章报道了基于磁热效应可以深度脑刺激醒着且自由活动的小鼠的运动行为。使用包裹了能靶向神经元细胞特异表达蛋白的抗体的磁纳米粒,磁热引起的trpv1+细胞的极化,引发钙内流。行为学范式的选择方面他们主要针对小鼠的运动相关的神经位点进行了调控。首先,在motor皮层的磁热遗传刺激能够诱发小鼠发生行走行为;在striatum的深度脑刺激能引发以身体为轴的旋转;在ventral和dorsalstriatum的桥连区域的激活,能够引发步态冻结。
顺磁性磁纳米粒子本身对于神经系统的调控作用的研究也有报道,alidgüler团队在研究中证实,通过纳米磁粒磁力诱导皮层神经元发生钙内流,在神经细胞-纳米粒-磁铁芯片所构成的培养体系,采用高度平行的纳米磁铁芯片产生磁刺激,神经网络增加了10-15%的钙荧光信号,增强了动作电位的频率。而且对于n型钙离子通道的屏蔽使这种效果收到抑制,证明磁纳米粒引发的钙离子的内流是由n型钙离子通道介导的。
alidgüler团队的研究也基于磁纳米粒的机械力刺激,实现恢复神经网络机械敏感离子通道的平衡稳态。在短时磁场刺激下,神经细胞钙内流主要是由n型离子通道引起的,电压门控型通道不参与;在长期磁场慢性刺激下,可抑制神经元的n型离子通道蛋白的表达,从而形成神经元钙信号通路的平衡。基于磁纳米粒的磁力在芯片上实现工程化皮层神经元的极化发育。采用高度平行的纳米磁铁芯片,对皮层神经细胞发挥局部机械刺激作用此作用不依赖细胞内吞的磁纳米粒的量可通过微管相关蛋白tau来定量磁纳米粒介导对细胞骨架的力量机械刺激调控神经系统的极性发育。
技术实现要素:
本发明的目的在于提供一种对磁力敏感的trpv4-his499蛋白、磁调控工具和应用,所述trpv4-his499蛋白在磁纳米粒的作用下,能够感受磁场激活,并诱发细胞钙内流。将trpv4-his499蛋白和功能化修饰的磁纳米粒组合成磁调控工具后具有更好的靶向性,非侵入性,可操控性,可实现深度的脑部刺激;磁调控工具可显著提高钙内流的倍数,使神经信号得以更好地传递;基于磁纳米粒的磁调控工具具有更好的磁响应性。
本发明提供了一种对磁力敏感的trpv4-his499蛋白,通过分子克隆方法在trpv4蛋白的第499位氨基酸位置插入6×his标签得到。
本发明还提供一种磁调控的工具,所述磁调控工具包括上述技术方案所述的trpv4-his499蛋白和功能化修饰的磁纳米粒。
优选的,所述功能化修饰的磁纳米粒的制备方法包括:在羧基化的磁纳米颗粒上包裹抗his的抗体后得到。
本发明还提供了上述技术方案所述的磁调控工具在引发体外细胞钙内流中的应用。
本发明还提供了上述技术方案所述的磁调控工具在改变小鼠特定行为学中的应用。
本发明还提供了上述技术方案所述的磁调控工具在神经钙信号传导中的应用,所述trpv4-his499蛋白能够在功能化修饰的磁纳米粒的作用下,感受磁场并被激活,并引发细胞钙内流,用于体内神经钙信号传导。
本发明实施例的结果显示:在trpv4蛋白的第499位氨基酸位置插入6×his标签,加入抗his抗体修饰的磁纳米粒后,trpv4能够感受到磁场的作用,诱发细胞的钙内流现象;将trpv4-his499转入小鼠脑部,在抗his抗体修饰的磁纳米粒和磁场的作用下,激活脑部特定神经元放电,从而能够调控小鼠的特定行为。
附图说明
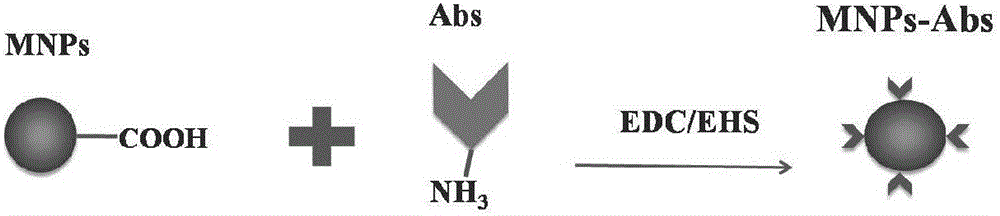
图1为mnps包裹抗体流程;
图2为小鼠行为学实验流程图;
图3为体外钙成像实验图,其中,a.磁纳米粒与细胞表面trpv4-his499蛋白结合共定位;b.在上述细胞磁刺激参数作用下,诱发细胞内的钙内流;c.细胞转染效率检测;d.所用电磁铁装置及场强标定;
图4为体内小鼠行为学实验图,其中,a.使用tracker软件分析小鼠在一个试验中的头部标记的轨迹,可以看到在刺激过程中的轨迹,显示了出较小的旋转圈的半径;b.统计分析了6只小鼠的12次trial的对侧旋转圈数,如图所示,在磁刺激过程中,具有显著性的差异;c.展示了实验中小鼠转圈的半径,在磁场刺激过程中,小鼠转圈半径明显减小,显示出以身体为轴的快速的对侧旋转;d.统计了在整个实验中同侧转圈的圈数,作为c图的对照;
图5为体外钙成像对照实验图,其中,a和b.在不同的磁场强度刺激下,钙离子的内流显示出明显的磁场依赖的现象;c和d.使用不含钙离子的钙成像缓冲液,trpv通道抑制剂rr,trpv4特异性抑制剂gsk2193874作为对照组,e图为代表性的实验结果;
图6为基于功能化磁纳米粒的trpv4蛋白的激活引发细胞钙内流的流程图。
具体实施方式
本发明提供了一种对磁力敏感的trpv4-his499蛋白,通过分子克隆方法在trpv4蛋白的第499位氨基酸位置插入6×his标签得到。本发明对所述trpv4蛋白插入6×his标签的分子克隆方法没有特殊限定,采用常规方法即可。在本发明中,所述trpv4-his499蛋白能够感受磁场激活,并引发细胞钙内流,用于神经钙信号传导。
在本发明中,所述trpv4蛋白的第499位氨基酸位置为trpv4蛋白的s1-s2loop区域。
本发明还提供了一种磁调控工具,所述磁调控工具包括上述技术方案所述的trpv4-his499蛋白和功能化修饰的磁纳米粒。
在本发明中,所述功能化修饰的磁纳米粒的制备方法优选包括:在羧基化的磁纳米颗粒上包裹抗his抗体后得到。
本发明对所述羧基化的磁纳米颗粒的来源没有特殊限定,使用商品化的产品即可。本发明对所述羧基化的磁纳米颗粒上包裹抗his抗体的包裹方法没有特殊限定,采用常规方法即可。
在本发明中,所述功能化修饰的磁纳米粒上的抗his抗体能够与trpv4-his499蛋白的的his标签进行特异性反应,使磁感应蛋白固定分散于细胞表面,在磁场作用下,通过磁力的效应特异性打开trpv4蛋白离子通道,引发细胞钙内流,用于神经钙信号传导。
在本发明中,当所述磁调控工具用于细胞实验时,所述磁场的磁场强度优选为50mt;当所述磁调控工具用于动物体内实验时,所述磁场的磁场强度优选为180~220mt,更优选为200mt。
本发明还提供了上述技术方案所述的磁调控工具在引发体外细胞钙内流中的应用。
本发明还提供了上述技术方案所述的磁调控工具在改变小鼠特定行为学中的应用。
本发明还提供了上述技术方案所述的磁调控工具在神经钙信号传导中的应用。
下面结合具体实施例对本发明所述的一种对磁力敏感的trpv4-his499蛋白、磁调控工具和应用做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
实施例1
一、实验试剂的准备
1.20nm的羧基化磁纳米粒,简称mnp(具有四氧化三铁核心)购于chemicell公司,并按照chemicell所提供的标准实验方法,进行抗体的包被(图1所示),得到磁纳米粒(mnps)。即在edc和nhs等化合物的催化作用下,磁纳米粒上的羧基与his抗体上的氨基可以反应形成酰胺键从而实现稳定键合,实现磁纳米粒的抗体包裹。
2.采用基因合成的方法合成trpv4-hi499片断,即在trpv4蛋白的第499位氨基酸位置插入6×his标签,将片断通过酶切位点连接到骨架质粒上,,得到pcdna3.1-trpv4-his499-p2a-mcherry,该质粒用于hek293t细胞转染。
3.分子构建trpv4-his499腺相关病毒质粒,并包装成腺相关病毒(brainvta公司),得到aav9-trpv4-his499-mcherry,用于动物脑区注射。
二、实验流程
1.体外实验验证:trpv4-his499-mcherry质粒在hek293t细胞中通过lipo3000转染过表达,随后加入抗体包裹的mnps,在电磁铁产生的低频磁场刺激下(大约50mt,0.1hz,90%dutycycle),通过fluorescence-4am染料,对细胞内的钙离子进行活细胞成像(仪器:活细胞工作站),并输出实验结果。
2.体内实验验证(即动物行为学验证):流程图见图2。雄性balb/c小鼠约20g用于实验。首先将aav9-trpv4-his499-mcherry病毒通过定位微量注射,注射600nl病毒到小鼠的纹状体位置(ap:0mmml:2.3mmdv:3mm),病毒表达三到五周后,在同样位置注射了1ul(10mg/ml)的抗体修饰后的磁纳米粒(mnps),随后第二天即可进行行为学的检测。小鼠放置于可自由活动的圆盘中,摄像头垂直检测小鼠活动。首先进行空间适应3~5min后,打开摄像机拍摄,加载磁场前的1min,随后立即在小鼠活动圆盘的下方放置一块钕铁硼永磁铁,并使小鼠头部可感受100~200mt的磁场;刺激1min后,撤掉磁铁,使小鼠进行恢复,并拍摄小鼠刺激后恢复的过程1min。
三、结果
1.体外实验验证
通过活细胞钙成像技术,验证了在磁场作用下,磁纳米粒特异性调控trpv4离子通道蛋白,引发hek293t细胞钙内流,并通过fluo-4am染料,指示细胞内发生的显著钙瞬变,相关实验结果如图3所示。
同时,我们也对不同梯度的磁场强度等对照组诱发的钙内流现象进行了检测(如图5所示)
2.动物行为学验证
在不同行为学模式中,使用微创开颅将aav9-trpv4-his499-mcherry病毒注射到小鼠脑部特定脑区位置,感染脑区内细胞,在外界磁场加载的条件下,通过观察动物相关行为学的变化,验证所构建的磁工具的可行性和执行效率。通过在小鼠的右侧纹状体进行特异性的刺激,实现了磁控小鼠以身体为轴向左旋转的行为,结果如图4所示。
由以上实施例可以得出,在trpv4蛋白的第499位氨基酸位置插入6×his标签,通过病毒转入小鼠脑部,在功能化修饰的磁纳米粒和磁场的作用下,能够引发神经细胞钙内流和放电,从而调控小鼠特定行为。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!