幽门螺旋杆菌噬菌体裂解酶及其制备方法与流程
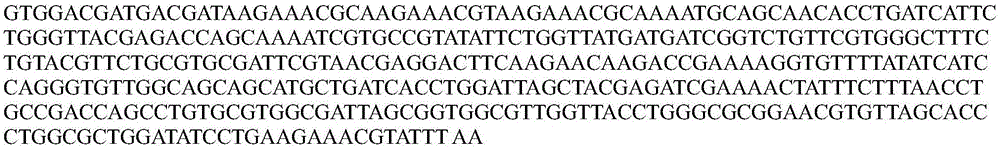
本发明属于生物技术领域,特别涉及一种幽门螺旋杆菌噬菌体裂解酶及其制备方法。
背景技术:
幽门螺杆菌(helicobacterpylori,hp)感染是慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织(malt)淋巴瘤和胃癌的主要致病因素。目前治疗幽门螺杆菌感染以下方案:1)两联疗法:祕制剂与抗生素联用。2)三联或四联疗法:祕剂+甲硝唑+四环素+奥美拉唑;奥美拉唑+阿莫西林+克拉霉素;祕剂+替硝唑+克拉霉素。这些治疗顺应性非常差,且多株hp出现了耐药性,甚至出现了多重耐药菌和超级细菌。因此,当务之急是寻找一种新型抗菌制剂来应对耐药菌的威胁因而,迫切需要新型药物来替代传统疗法,以达到根治幽门螺杆菌的目的。
噬菌体(bacteriophage)作为一种细菌病毒,具有特异性高、对人体无副作用等优点被科学家所重视,但是噬菌体作为一个独立的生命体在用作抗菌制剂时会产生抗噬菌体菌株,且生物安全性一直受到质疑。噬菌体裂解酶(bacteriophageendolysins)是dsdna噬菌体在感染细菌后期表达的一种水解酶。研究者认为噬菌体裂解酶具有以下优点:①特异性强,在杀灭病原菌的同时不会干扰正常菌群。②不易使细菌产生耐药性,由于裂解酶是噬菌体在与细菌共同进化的过程中产生的,针对细菌细胞壁上高度保守的肽聚糖,所以产生耐药性的几率很小。③能杀死在黏膜表面定植病原菌。裂解酶作为一种蛋白质大分子在体内可能会产生相应的抗体中和其杀菌能力,但是一些实验发现其抗体对其没有中和作用。噬菌体裂解酶与噬菌体相比不易产生耐药性,idelevich等发现嵌合酶prf-119对噬菌体抗性的金黄色葡萄球菌突变株,目前还没有相关的裂解酶抗性的报告。裂解酶在临床应用的安全性和药代动力学特性的实验正在准备,如裂解酶p128已经进入临床ⅱ期实验,测试其对人类鼻腔携带的金黄色葡萄球菌的杀菌效力。且裂解酶作为一种蛋白质的理化性质研究已经很成熟,可以对其进行修饰改造,所以噬菌体裂解酶具有新型抗菌制剂的潜力。
裂解酶在体内裂解细菌需要借助穴蛋白的穿孔作用,所以裂解酶从外至内裂解细菌时只能作用于没有细胞外膜的革兰阳性细菌。在没有穴蛋白的作用下,革兰阴性细菌细胞外膜能阻挡裂解酶与细菌细胞壁的有效结合,使裂解酶对革兰阴性菌无效。因此,如何在体外直接裂解革兰阴性细菌是裂解酶应用中的一个重大挑战。但最近的一些研究克服了裂解酶这一缺点。lukacik等对作用于革兰阴性菌的裂解酶的修饰改造做了很多工作,如将鼠疫菌素上能特异识别耶尔森氏菌细胞膜上离子通道的序列与t4裂解酶融合,所得到的重组蛋白能借助离子通道通过耶尔森氏菌的细胞膜,导致耶尔森氏菌的死亡,而且对大肠埃希菌也有明显的杀灭效果。briers等将铜绿假单胞菌噬菌体裂解obpgp279和沙门氏菌噬菌体pvp-se1gp146分别于多种外膜渗透剂(比如polycationicpeptide;hydrophobicpentapeptide;parasin1,lycotoxin1)组合成融合蛋白“artilysins”(outermembranepenetratingendolysins)在体外具有较好的裂菌活性。将能够渗透细菌外膜抗菌肽smap-29融合在裂解酶kz144的n端,组合成融合蛋白smap-29-kz144,这些融合蛋白通过大肠埃希菌表达纯化后,能够在其n端外膜渗透剂的帮助下通过细胞膜抵达细胞壁上的肽聚糖靶点,切割肽聚糖链键杀灭革兰阴性菌铜绿假单胞菌,而且沿用这种思路设计的系列抗菌肽裂解酶对铜绿假单胞菌的体内杀灭效果已经在线虫感染模型中得到了证实。
目前还没有关于幽门螺旋杆菌噬菌体裂解酶研究的文献或专利;幽门螺旋杆菌是革兰氏阴性菌,其裂解酶可能无法从外到内裂解幽门螺旋杆菌或作用微弱。本领域需要提供一种幽门螺旋杆菌噬菌体裂解酶的蛋白序列以及制备方法,可以实现从外到内裂解幽门螺旋杆菌的改造的噬菌体裂解酶。
技术实现要素:
本发明的目的之一是提供两种改造的幽门螺旋杆菌噬菌体裂解酶的蛋白序列。
本发明的另一个目的是提供两种改造的幽门螺旋杆菌噬菌体裂解酶基因在大肠杆菌中可溶性表达和纯化的方法,将该方法制备得到的两种改造的幽门螺旋杆菌噬菌体裂解酶应用于体外抑菌试验,研究其对标准幽门螺旋杆菌株的裂解作用。
为解决上述问题,本发明的技术方案如下:
首先,本发明提供两种改造的幽门螺旋杆菌噬菌体裂解酶的蛋白序列:
一种为:包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶的蛋白序列,其序列结构从n端到c端依次包括a1-a2-a3,核苷酸序列为seqidno.1,氨基酸序列为seqidno.2。
另一种为:包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶的蛋白序列,其序列结构从n端到c端依次包括a1-b1-a3,核苷酸序列为seqidno.3和氨基酸序列为seqidno.4。
a1为肠激酶识别位点vddddk。核苷酸序列为seqidno.5,氨基酸序列为seqidno.6。
a2为聚阳离子9肽,辅助裂解幽门螺旋杆菌外膜。核苷酸序列为seqidno.,7,氨基酸序列为seqidno.8。
a3为天然幽门螺旋杆菌噬菌体裂解酶。核苷酸序列为seqidno.11,密码子优化后的核苷酸序列为seqidno.12,氨基酸序列为seqidno.13。
b1为疏水小肽,辅助裂解幽门螺旋杆菌外膜。核苷酸序列为seqidno.9,氨基酸序列为seqidno.10。
本发明幽门螺旋杆菌噬菌体裂解酶基因序列是从已报到的幽门螺旋杆菌噬菌体全基因组中分析获得。在genbank中,具体参见seqidno.11和seqidno.12。
本发明是采用大肠杆菌为宿主,为了增加宿主的表达效率,本发明将改造幽门螺旋杆菌噬菌体裂解酶核苷酸序列进行密码子偏好性优化。在本发明优选的实施方式中,编码所述的两种幽门螺旋杆菌噬菌体裂解酶基因序列分别为seqidno.1和seqidno.3所示的核苷酸序列。
本发明进一步提供一类表达载体,包含编码所述的含两种幽门螺旋杆菌噬菌体裂解酶基因序列。该表达载体属于psumo,携带可溶性标签sumo蛋白。
为插入psumo中,在合成包含两种幽门螺旋杆菌噬菌体裂解酶基因序列时,两端分别添加了saci/xhoi酶切位点,序列参见seqidno.1和seqidno.3。再将其插入质粒psumo的saci/xhoi酶切位点。
另外,本发明提供一种幽门螺旋杆菌噬菌体裂解酶的制备方法,该方法是以大肠杆菌作为表达宿主的可溶性表达方法,包括以下步骤:
(1)培养分别包含两种幽门螺旋杆菌噬菌体裂解酶基因的工程菌并诱导两种幽门螺旋杆菌噬菌体裂解酶的表达;
(2)收集菌体;
(3)破碎菌体;
(4)收集上清;
(5)分别纯化上述sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白和sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白;
(6)分别酶切上述纯化后的sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白和sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白,分别产生成有活性的聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶和疏水小肽幽门螺旋杆菌噬菌体裂解酶;
(7)纯化上述两种幽门螺旋杆菌噬菌体裂解酶。
所述的(1)中工程菌为大肠杆菌bl21(de3),本发明的方法对大肠杆菌宿主的种类没有任何限制。优选那些能够直接表达构象正确的目的蛋白的宿主。将前述表达载体转化大肠杆菌bl21(de3)的转化方法在本领域是公知的,例如电穿孔法、cacl2转化法等。
所述的(1)中的诱导宿主表达蛋白的方法可采用本领域技术人员所公知的技术。在本发明优选的实施方式中,是在诱导表达过程中,使用浓度为0.lmm至10mm的iptg,在25℃温度下进行诱导,使得目的蛋白可以获得更高效的表达。
所述的(3)破碎菌体的方法包括高压匀浆、渗透压冲击、冻融、超声波破碎等。
本发明中的psumo载体含有组氨酸标签蛋白,所述的(5)中纯化步骤是采用ni2+-nta基质,并通过梯度为20mm至250mm的咪唑溶液洗脱带有组氨酸标签的包含sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白和sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白。
所述的(6)sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白活化包括前述sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白经肠激酶((1:200,肠激酶(g):sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白(g))在室温下酶解1-10小时后即可得到具有活性的聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶。
所述的(6)sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白的活化包括前述sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白经肠激酶((1:200,肠激酶(g):sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白(g))在室温下酶解1-10小时后即可得到具有活性的疏水小肽幽门螺旋杆菌噬菌体裂解酶。
所述的(7)有活性的聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶和疏水小肽幽门螺旋杆菌噬菌体裂解酶纯化步骤包括离子交换层析。
活性测定表明利用大肠杆菌可溶性表达制备得到聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶和疏水小肽幽门螺旋杆菌噬菌体裂解酶。体外抑菌试验表明聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶和疏水小肽幽门螺旋杆菌噬菌体裂解酶均具有很强的裂解幽门螺旋杆菌标准菌株atcc700392的能力。
相对于现有技术,本发明的优点如下,
本发明所提供的两种幽门螺旋杆菌噬菌体裂解酶,以及制备幽门螺旋杆菌噬菌体裂解酶的方法具有以下优点:
通过在序列中引入a2和b1序列,提高了幽门螺旋杆菌噬菌体裂解酶裂解幽门螺旋杆菌标准菌株atcc700392的能力。
在可溶性表达系统中进行诱导表达时,温度控制在25℃,表达sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶融合蛋白和sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白,无需经过变性和复性,且产量较高,其存在于菌体中,在直接酶切去除sumo蛋白即可得到有活性的幽门螺旋杆菌噬菌体裂解酶。
附图说明
图1.包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶cdna序列,1-18为vddddk基因序列,19-45为聚阳离子九肽基因序列,46-372为幽门螺旋杆菌噬菌体裂解酶cdna序列。
图2.包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶氨基酸序列,1-6为vddddk氨基酸序列,7-15为聚阳离子九肽氨基酸序列,16-123为幽门螺旋杆菌噬菌体裂解酶氨基酸序列。
图3.包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶cdna序列,1-18为vddddk基因序列,19-48为疏水小肽基因序列,49-375为幽门螺旋杆菌噬菌体裂解酶cdna序列。
图4.包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶氨基酸序列,1-6为vddddk氨基酸序列,7-16为疏水小肽的肽氨基酸序列,17-124为幽门螺旋杆菌噬菌体裂解酶氨基酸序列。
图5.包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶和疏水小肽的幽门螺旋杆菌噬菌体裂解酶工程菌表达与破碎后电泳图。其中:1为marker,2为聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶诱导前菌体,3为聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶诱导后菌体,4为聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶诱导后菌体破碎离心后上清液,5为聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶诱导后菌体破碎离心后沉淀,6为疏水小肽幽门螺旋杆菌噬菌体裂解酶诱导前菌体,7为疏水小肽的幽门螺旋杆菌噬菌体裂解酶诱导后菌体,8为疏水小肽的幽门螺旋杆菌噬菌体裂解酶诱导后菌体破碎离心后上清液,9为疏水小肽的幽门螺旋杆菌噬菌体裂解酶诱导后菌体破碎离心后沉淀。
图6.sumo-聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶融合蛋白纯化电泳图ni-nta层析纯化洗脱峰电泳图。其中:1为marker,2为柱前,3为穿出液,4为洗脱峰1,5为洗脱峰2前峰,6为洗脱峰2中间峰,7为洗脱峰2后峰(5-7峰为目的蛋白峰)。
图7.聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶阴离子纯化电泳图。其中:1为marker,2为穿出峰,3为洗脱峰1(目的蛋白峰),4为洗脱峰2,5为洗脱峰3。
图8.sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶融合蛋白纯化电泳图ni-nta层析纯化洗脱峰电泳图。其中:1为marker,2为柱前,3为穿出液,4为洗脱峰1,5为洗脱峰2前锋,6为洗脱峰2侯峰(5-6峰为目的蛋白峰)。
图9.疏水小肽幽门螺旋杆菌噬菌体裂解酶阴离子纯化电泳图。其中:1为marker,2为穿出峰,3为洗脱峰1前锋(目的蛋白峰),4为洗脱峰1后峰(目的蛋白峰),5为洗脱峰2,6为洗脱峰3。
具体实施方式
材料:
菌株和质粒:表达菌株bl21(de3)购自merck,质粒psumo购自淼灵生物科技有限公司。
酶和试剂:
实施例中涉及分子生物学操作所用的酶均购于购自takara,相应的操作步骤完全按照相关的产品说明书进行。
幽门螺旋杆菌液体培养基、幽门螺旋杆菌固体培养基、脱纤维绵羊血、幽门螺旋杆菌添加剂(含萘啶酮酸1mg、tmp0.5mg、万古霉素0.3mg、两性霉素b0.2mg)均购自青岛海博生物,相应的配制方法完全按照相关的产品说明书进行。幽门螺旋杆菌标准菌株atcc700392购自上海北诺生物科技有限公司。溶菌酶(对照品)购自sigma。
实施例中所涉及的编码包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶的核苷酸序列和包含疏水肽的幽门螺旋杆菌噬菌体裂解酶的基因合成和测序工作由南京金斯瑞有限公司完成。
其他未标明来源的原、辅料均为市售产品。
实施例1:
包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶的制备
一、包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶表达载体和工程菌的构建
1、构建包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶核苷酸序列:聚阳离子九肽和幽门螺旋杆菌噬菌体裂解酶的多肽和核苷酸序列分别如下(seqidno.7和seqidno.8,seqidno.11和seqidno.13)。按照大肠杆菌密码子偏好性对包含天然幽门螺旋杆菌噬菌体裂解酶的核苷酸进行优化,该优化方法为本领域技术人员所公知的技术,可参见例如内蒙古大学学报:大肠杆菌和酵母密码子使用对比,2006,voi.37,no.1:34-39;得到最终的核苷酸序列如下(seqidno.12)。在幽门螺旋杆菌噬菌体裂解酶的5’端加入聚阳离子九肽序列(基因序列为seqidno.7)和肠激酶酶切位点vddddk序列(基因序列为seqidno.5),获得包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶核苷酸序列。在包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶核苷酸序列两端引入saci/xhoi酶切位点和移码保护碱基,具体序列如下(seqidno.1)。
2、人工合成上述基因序列。通过saci/xhoi酶切位点插入到质粒psumo相应酶切位点中,构建成的重组质粒。
3、构建包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶工程菌:将上述重组质粒通过cac12转化的方法导入到bl21(de3)中,构建包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶工程菌。经测序,工程菌中的序列与设计一致。
二、工程菌的高密度发酵
接种工程菌阳性克隆100ul到20ml的lb培养基中,于37℃下摇床振荡培养过夜,按4%接种量接过夜菌于500ml的lb培养基,37℃下摇床振荡培养到对数期,接种到装有6l培养基的发酵罐中,初始参数为:发酵温度37℃,搅拌速度300rpm,通气量15l/min,ph为6.7,不断提高搅拌转速与通气量(转速最大1000rpm,通气量最大30l/min)以维持溶氧始终在30%以上,培养基配方如下:发酵培养基:酵母浸出粉30g/l,葡萄糖6g/l,十二水合磷酸氢二钠8g/l,磷酸二氢钾4g/l,硫酸按6g/l,七水硫酸镁1.13g/l,二水氯化钙0.073g/l,补料培养基:酵母浸出粉20g/l,葡萄糖30g/l,50%氨水和30%磷酸用于发酵过程中ph调控.
当培养基中养分耗尽,溶氧迅速上升时开始补料,控制补料速度、转速、通气保证控制溶氧在30%以上;补料4hr-6hr后,降温至25℃,调节ph至7.0,加入终浓度0.immol/l的iptg进行有氧诱导,溶氧不低于20%,继续培养10h后出罐,收集菌体。
出罐后离心得菌体湿重150g/l,发酵过程中菌体取样点电泳如图5。
发酵结束离心收集的菌体按重量体积比1:10加入破碎缓冲液(含250mmnacl,50mmnah2po4,ph8.0),高压均质机850bar破碎2遍后,在8500rpm,4℃条件下离心60min,收集上清,电泳如图5。
三、sumo-聚阳离子幽门螺旋杆菌噬菌体裂解酶的融合蛋白的纯化
将破碎离心上清用0.45um滤膜过滤,用ni2+-nta预装柱(上海博格隆)进行纯化,首先使用20mm咪唑进行洗脱以除去杂蛋白,然后250mm咪唑洗脱目的蛋白(sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白),收集组分峰,得到含有咪唑的sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白溶液。
将上述溶液用超滤柱(gehealthcare)去除咪唑,洗脱液包括20mmtris-hcl,ph为8.0的溶液,收集组分峰,如图6。
四、sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白活化
将脱盐后的sumo-聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白经肠激酶(1:200)在室温下过夜即可得到具有活性的聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶。
五、聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶的纯化
聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶溶液经阴离子交换进行纯化,阴离子交换条件:缓冲液a-20mmtris-hci,ph8.0;缓冲液b-20mmtris-hci+0.5mnaci,ph8.0;0-100%b线性梯度50cv;即可得到具有高纯度和活性聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶,经电泳分析,纯度达到90%以上(图7)。
六药敏试验:聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶的活性
幽门螺旋杆菌标准atcc700392活化:取atcc700392冻干粉,按照说明书溶解后,取100ul均匀涂抹于灭菌后的幽门螺旋杆菌固体培养基平皿中,至于37℃微氧环境(8%-10%co2,5%-8%o2,82%-87%n2),孵育72h后观察菌落形态,并同时做快速尿素酶试验,经验证atcc700392是幽门螺旋杆菌。挑取单菌落,接种于幽门螺旋杆菌液体培养基中增殖48h,并用10%葡萄糖稀释至10-5(1000菌/ml),待用。
聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶溶液配制:用无菌纯化水将聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶配制成5ug/ml、50ug/ml、500ug/ml三个浓度,0.22um滤膜过滤后,备用。
溶菌酶(对照品)配制:用无菌纯化水将溶菌酶配制成5ug/ml、50ug/ml、500ug/ml三个浓度,0.22um滤膜过滤后,备用。
药敏试验取100ul稀释至10-5的幽门螺旋杆菌涂布与幽门螺旋杆菌固体培养基平板,贴灭菌滤纸片7个,滤纸片上分别加入20ul的灭菌水(阴性对照)、20ul的5ug/ml溶菌酶(阳性对照,总量0.1ug)、20ul的50ug/ml溶菌酶(阳性对照,总量1ug)、20ul的50ug/ml溶菌酶(阳性对照,总量10ug)、20ul的5ug/ml聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶(样品总量0.1ug)、20ul的50ug/ml聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶(样品总量1ug)、20ul的50ug/ml聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶(样品总量10ug)。至于37℃微氧环境(8%-10%co2,5%-8%o2,82%-87%n2),孵育72h后记录抑菌圈直径,重复3个平板。
结果显示(表1)聚阳离子九肽幽门螺旋杆菌噬菌体裂解酶对幽门螺旋杆菌标准atcc700392具有较好的裂解作用。
表1聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶抑菌圈
实施例2:
包含疏水性小肽的幽门螺旋杆菌噬菌体裂解酶的制备
一、包含疏水性小肽的幽门螺旋杆菌噬菌体裂解酶表达载体和工程菌的构建
1、构建包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶核苷酸序列:疏水性小肽和幽门螺旋杆菌噬菌体裂解酶的多肽和核苷酸序列分别如下(seqidno.9和seqidno.10,seqidno.11和seqidno.13)。按照大肠杆菌密码子偏好性对包含天然幽门螺旋杆菌噬菌体裂解酶的核苷酸进行优化,得到最终的核苷酸序列如下(seqidno.12)。在幽门螺旋杆菌噬菌体裂解酶的5’端加入疏水小肽序列(基因序列为seqidno.9)和肠激酶酶切位点vddddk序列(基因序列为seqidno.5),获得包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶核苷酸序列。在包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶核苷酸序列两端引入saci/xhoi酶切位点和移码保护碱基,具体序列如下(seqidno.3)。
2、人工合成上述基因序列。通过saci/xhoi酶切位点插入到质粒psumo相应酶切位点中,构建成的重组质粒。
3、构建包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶工程菌:将上述重组质粒通过cacl2转化的方法导入到bl21(de3)中,构建包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶工程菌。经测序,工程菌中的序列与设计一致。
二、工程菌的高密度发酵
接种工程菌阳性克隆100ul到20ml的lb培养基中,于37℃下摇床振荡培养过夜,按4%接种量接过夜菌于500ml的lb培养基,37℃下摇床振荡培养到对数期,接种到装有6l培养基的发酵罐中,初始参数为:发酵温度37℃,搅拌速度300rpm,通气量15l/min,ph为6.7,不断提高搅拌转速与通气量(转速最大1000rpm,通气量最大30l/min)以维持溶氧始终在30%以上,培养基配方如下:发酵培养基:酵母浸出粉30g/l,葡萄糖6g/l,十二水合磷酸氢二钠8g/l,磷酸二氢钾4g/l,硫酸按6g/l,七水硫酸镁1.13g/l,二水氯化钙0.073g/l,补料培养基:酵母浸出粉20g/l,葡萄糖30g/l,50%氨水和30%磷酸用于发酵过程中ph调控.
当培养基中养分耗尽,溶氧迅速上升时开始补料,控制补料速度、转速、通气保证控制溶氧在30%以上;补料4hr-6hr后,降温至25℃,调节ph至7.0,加入终浓度0.immol/l的iptg进行有氧诱导,溶氧不低于20%,继续培养10h后出罐,收集菌体。
出罐后离心得菌体湿重160g/l,发酵过程中菌体取样点电泳如图5。
发酵结束离心收集的菌体按重量体积比1:10加入破碎缓冲液(含250mmnacl,50mmnah2po4,ph8.0),高压均质机850bar破碎2遍后,在8500rpm,4℃条件下离心60min,收集上清,电泳如图5。
三、sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白的纯化
将破碎离心上清用0.45um滤膜过滤,用ni2+-nta预装柱(上海博格隆)进行纯化,首先使用20mm咪唑进行洗脱以除去杂蛋白,然后250mm咪唑洗脱目的蛋白(sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白),收集组分峰,得到含有咪唑的sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白溶液。
将上述溶液用超滤柱(gehealthcare)去除咪唑,洗脱液包括20mmtris-hcl,ph为8.0的溶液,收集组分峰,电泳如图8。
四、sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白活化
将脱盐后的sumo-疏水小肽幽门螺旋杆菌噬菌体裂解酶的融合蛋白经肠激酶(1:200)在室温下过夜即可得到具有活性的疏水小肽幽门螺旋杆菌噬菌体裂解酶。
五、疏水小肽幽门螺旋杆菌噬菌体裂解酶的纯化
疏水小肽幽门螺旋杆菌噬菌体裂解酶溶液经阴离子交换进行纯化,阴离子交换条件:缓冲液a-20mmtris-hci,ph8.0;缓冲b-20mmtris-hci+0.5mnaci,ph8.0;0-100%b线性梯度50cv;即可得到具有高纯度和活性疏水小肽幽门螺旋杆菌噬菌体裂解酶,经电泳分析,纯度达到90%以上(图9)。
六药敏试验:疏水小肽幽门螺旋杆菌噬菌体裂解酶的活性
幽门螺旋杆菌标准atcc700392活化:取atcc700392冻干粉,按照说明书溶解后,取100ul均匀涂抹于灭菌后的幽门螺旋杆菌固体培养基平皿中,至于37℃微氧环境(8%-10%co2,5%-8%o2,82%-87%n2),孵育72h后观察菌落形态,并同时做快速尿素酶试验,经验证atcc700392是幽门螺旋杆菌。挑取单菌落,接种于幽门螺旋杆菌液体培养基中增殖48h,并用10%葡萄糖稀释至10-5(1000菌/ml),待用。
疏水小肽幽门螺旋杆菌噬菌体裂解酶溶液配制:用无菌纯化水将疏水小肽幽门螺旋杆菌噬菌体裂解酶配制成5ug/ml、50ug/ml、500ug/ml三个浓度,0.22um滤膜过滤后,备用。
溶菌酶(对照品)配制:用无菌纯化水将溶菌酶配制成5ug/ml、50ug/ml、500ug/ml三个浓度,0.22um滤膜过滤后,备用。
药敏试验取100ul稀释至10-5的幽门螺旋杆菌涂布与幽门螺旋杆菌固体培养基平板,贴灭菌滤纸片7个,滤纸片上分别加入20ul的灭菌水(阴性对照)、20ul的5ug/ml溶菌酶(阳性对照,总量0.1ug)、20ul的50ug/ml溶菌酶(阳性对照,总量1ug)、20ul的50ug/ml溶菌酶(阳性对照,总量10ug)、20ul的5ug/ml疏水小肽幽门螺旋杆菌噬菌体裂解酶(样品总量0.1ug)、20ul的50ug/ml疏水小肽幽门螺旋杆菌噬菌体裂解酶(样品总量1ug)、20ul的50ug/ml疏水小肽幽门螺旋杆菌噬菌体裂解酶(样品总量10ug)。至于37℃微氧环境(8%-10%co2,5%-8%o2,82%-87%n2),孵育72h后记录抑菌圈直径,重复3个平板。
结果显示(表2)疏水小肽幽门螺旋杆菌噬菌体裂解酶对幽门螺旋杆菌标准atcc700392具有较好的裂解作用。
表2.疏水小肽幽门螺旋杆菌噬菌体裂解酶抑菌圈
涉及序列:
seqidno.1.包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶cdna序列372bp
1-50gtggacgatgacgataagaaacgcaagaaacgtaagaaacgcaaaatgca
51-100gcaacacctgatcattctgggttacgagaccagcaaaatcgtgccgtata
101-150ttctggttatgatgatcggtctgttcgtgggctttctgtacgttctgcgt
151-200gcgattcgtaacgaggacttcaagaacaagaccgaaaaggtgttttatat
201-250catccagggtgttggcagcagcatgctgatcacctggattagctacgaga
251-300tcgaaaactatttctttaacctgccgaccagcctgtgcgtggcgattagc
301-350ggtggcgttggttacctgggcgcggaacgtgttagcaccctggcgctgga
251-372tatcctgaagaaacgtatttaa
seqidno.2.包含聚阳离子九肽的幽门螺旋杆菌噬菌体裂解酶氨基酸序列123aa
seqidno.3.包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶cdna序列375bp
1-50gtggacgatgacgataagggatccttcttcgtagcaccgggctcctccat
51-100gcagcaacacctgatcattctgggttacgagaccagcaaaatcgtgccgt
101-150atattctggttatgatgatcggtctgttcgtgggctttctgtacgttctg
151-200cgtgcgattcgtaacgaggacttcaagaacaagaccgaaaaggtgtttta
201-250tatcatccagggtgttggcagcagcatgctgatcacctggattagctacg
251-300agatcgaaaactatttctttaacctgccgaccagcctgtgcgtggcgatt
301-350agcggtggcgttggttacctgggcgcggaacgtgttagcaccctggcgct
351-375ggatatcctgaagaaacgtatttaa
seqidno.4.包含疏水小肽的幽门螺旋杆菌噬菌体裂解酶氨基酸序列124aa
seqidno.5.肠激酶酶切位点cdna序列18bp
1-18gtggacgatgacgataag
seqidno.6.肠激酶酶切位点氨基酸序列6aa
valaspaspaspasplys
seqidno.7.含聚阳离子九肽cdna序列27bp
1-27aaacgcaagaaacgtaagaaacgcaaa
seqidno.8.含聚阳离子九肽氨基酸序列9aa
lysarglyslysarglyslysarglys
seqidno.9.疏水小肽cdna序列30bp
ggatccttcttcgtagcaccgggctcctcc
seqidno.10.疏水小肽氨基酸序列10aa
glyserphephevalalaproglyserser
seqidno.11.天然幽门螺旋杆菌噬菌体裂解酶cdna序列327bp
1-50atgcagcagcatttaatcattttaggatatgaaacttcaaaaatcgtccc51-100gtatattttggtgatgatgatcggtttgtttgtggggtttttgtatgttt101-150taagggctataagaaatgaagattttaaaaacaaaaccgaaaaagtgttc151-200tatatcattcaaggcgttggatcgagcatgcttattacctggattagtta201-250cgaaatcgagaattatttttttaatttaccgactagtttgtgcgtagcga251-300ttagtggaggcgttgggtatttaggagcggagagggtgagcactttagcg301-327ttagatatcttgaaaaaaaggatatga
seqidno.12.天然幽门螺旋杆菌噬菌体裂解酶cdna序列327bp
1-50atgcagcaacacctgatcattctgggttacgagaccagcaaaatcgtgcc
51-100gtatattctggttatgatgatcggtctgttcgtgggctttctgtacgttc
101-150tgcgtgcgattcgtaacgaggacttcaagaacaagaccgaaaaggtgttt
151-200tatatcatccagggtgttggcagcagcatgctgatcacctggattagcta
201-250cgagatcgaaaactatttctttaacctgccgaccagcctgtgcgtggcga
251-300ttagcggtggcgttggttacctgggcgcggaacgtgttagcaccctggcg
301-327ctggatatcctgaagaaacgtatttaa
seqidno.13.天然幽门螺旋杆菌噬菌体裂解酶氨基酸序列108aa
需要说明的是上述实施例仅仅是本发明的较佳实施例,并没有用来限定本发明的保护范围,在上述基础上做出的等同替换或者替代均属于本发明的保护范围。
序列表
<110>江苏万邦医药科技有限公司
江苏万邦生化医药集团有限责任公司
<120>幽门螺旋杆菌噬菌体裂解酶及其制备方法
<160>13
<170>siposequencelisting1.0
<210>1
<211>372
<212>dna
<213>1(人工序列)
<400>1
gtggacgatgacgataagaaacgcaagaaacgtaagaaacgcaaaatgcagcaacacctg60
atcattctgggttacgagaccagcaaaatcgtgccgtatattctggttatgatgatcggt120
ctgttcgtgggctttctgtacgttctgcgtgcgattcgtaacgaggacttcaagaacaag180
accgaaaaggtgttttatatcatccagggtgttggcagcagcatgctgatcacctggatt240
agctacgagatcgaaaactatttctttaacctgccgaccagcctgtgcgtggcgattagc300
ggtggcgttggttacctgggcgcggaacgtgttagcaccctggcgctggatatcctgaag360
aaacgtatttaa372
<210>2
<211>123
<212>prt
<213>2(人工序列)
<400>2
valaspaspaspasplyslysarglyslysarglyslysarglysmet
151015
glnglnhisleuileileleuglytyrgluthrserlysilevalpro
202530
tyrileleuvalmetmetileglyleuphevalglypheleutyrval
354045
leuargalaileargasngluaspphelysasnlysthrglulysval
505560
phetyrileileglnglyvalglysersermetleuilethrtrpile
65707580
sertyrgluilegluasntyrphepheasnleuprothrserleucys
859095
valalaileserglyglyvalglytyrleuglyalagluargvalser
100105110
thrleualaleuaspileleulyslysargile
115120
<210>3
<211>375
<212>dna
<213>3(人工序列)
<400>3
gtggacgatgacgataagggatccttcttcgtagcaccgggctcctccatgcagcaacac60
ctgatcattctgggttacgagaccagcaaaatcgtgccgtatattctggttatgatgatc120
ggtctgttcgtgggctttctgtacgttctgcgtgcgattcgtaacgaggacttcaagaac180
aagaccgaaaaggtgttttatatcatccagggtgttggcagcagcatgctgatcacctgg240
attagctacgagatcgaaaactatttctttaacctgccgaccagcctgtgcgtggcgatt300
agcggtggcgttggttacctgggcgcggaacgtgttagcaccctggcgctggatatcctg360
aagaaacgtatttaa375
<210>4
<211>124
<212>prt
<213>4(人工序列)
<400>4
valaspaspaspasplysglyserphephevalalaproglyserser
151015
metglnglnhisleuileileleuglytyrgluthrserlysileval
202530
protyrileleuvalmetmetileglyleuphevalglypheleutyr
354045
valleuargalaileargasngluaspphelysasnlysthrglulys
505560
valphetyrileileglnglyvalglysersermetleuilethrtrp
65707580
ilesertyrgluilegluasntyrphepheasnleuprothrserleu
859095
cysvalalaileserglyglyvalglytyrleuglyalagluargval
100105110
serthrleualaleuaspileleulyslysargile
115120
<210>5
<211>18
<212>dna
<213>5(人工序列)
<400>5
gtggacgatgacgataag18
<210>6
<211>6
<212>prt
<213>6(人工序列)
<400>6
valaspaspaspasplys
15
<210>7
<211>27
<212>dna
<213>7(人工序列)
<400>7
aaacgcaagaaacgtaagaaacgcaaa27
<210>8
<211>9
<212>prt
<213>8(人工序列)
<400>8
lysarglyslysarglyslysarglys
15
<210>9
<211>30
<212>dna
<213>9(人工序列)
<400>9
ggatccttcttcgtagcaccgggctcctcc30
<210>10
<211>10
<212>prt
<213>10(人工序列)
<400>10
glyserphephevalalaproglyserser
1510
<210>11
<211>327
<212>dna
<213>11(人工序列)
<400>11
atgcagcagcatttaatcattttaggatatgaaacttcaaaaatcgtcccgtatattttg60
gtgatgatgatcggtttgtttgtggggtttttgtatgttttaagggctataagaaatgaa120
gattttaaaaacaaaaccgaaaaagtgttctatatcattcaaggcgttggatcgagcatg180
cttattacctggattagttacgaaatcgagaattatttttttaatttaccgactagtttg240
tgcgtagcgattagtggaggcgttgggtatttaggagcggagagggtgagcactttagcg300
ttagatatcttgaaaaaaaggatatga327
<210>12
<211>327
<212>dna
<213>12(人工序列)
<400>12
atgcagcaacacctgatcattctgggttacgagaccagcaaaatcgtgccgtatattctg60
gttatgatgatcggtctgttcgtgggctttctgtacgttctgcgtgcgattcgtaacgag120
gacttcaagaacaagaccgaaaaggtgttttatatcatccagggtgttggcagcagcatg180
ctgatcacctggattagctacgagatcgaaaactatttctttaacctgccgaccagcctg240
tgcgtggcgattagcggtggcgttggttacctgggcgcggaacgtgttagcaccctggcg300
ctggatatcctgaagaaacgtatttaa327
<210>13
<211>108
<212>prt
<213>13(人工序列)
<400>13
metglnglnhisleuileileleuglytyrgluthrserlysileval
151015
protyrileleuvalmetmetileglyleuphevalglypheleutyr
202530
valleuargalaileargasngluaspphelysasnlysthrglulys
354045
valphetyrileileglnglyvalglysersermetleuilethrtrp
505560
ilesertyrgluilegluasntyrphepheasnleuprothrserleu
65707580
cysvalalaileserglyglyvalglytyrleuglyalagluargval
859095
serthrleualaleuaspileleulyslysargile
100105
- 还没有人留言评论。精彩留言会获得点赞!