光合细菌的培养装置的制作方法
本实用新型涉及工业生物技术领域,具体涉及的是一种光合细菌的培养装置。
背景技术:
目前光合细菌,如深红红螺菌的培养粗犷,工艺落后,无法实时在线监测光合细菌的培养情况,无法对光合细菌的生长过程做出及时调控。因此,导致最终的菌体生长速率较低,对底物的利用低,生产成本偏高。
技术实现要素:
本实用新型的目的是为了解决上述问题,提供一种光合细菌的培养装置,利用氧化还原电位电极在线监测光合细菌的培养过程,提高菌体的生长速率和对底物的利用。
本实用新型采取的技术方案是:
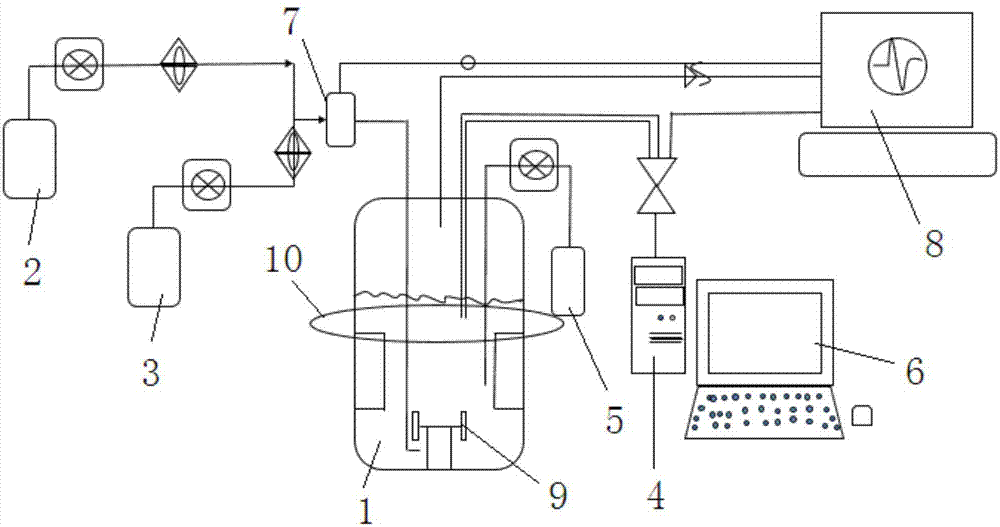
一种光合细菌的培养装置,其特征是,包括发酵罐、空气输入单元、氮气输入单元、氧化还原电位电极单元、pH值控制单元和主控单元,所述发酵罐内注有光合细菌菌液,所述空气输入单元和氮气输入单元通过管道连接至发酵罐内,所述氧化还原电位电极单元连接至发酵罐内,所述pH值控制单元通过管路连接至发酵罐,所述主控单元根据发酵罐中的参数信息,控制所述空气输入单元、氮气输入单元和pH值控制单元,使发酵罐中的光合细菌达到最高生长速率。
进一步,所述空气输入单元和氮气输入单元连接至混合单元,所述混合单元通过管道连接至所述发酵罐内。
进一步,所述培养装置还包括尾气单元,所述尾气单元连接至发酵罐内,接收发酵罐的排气。
进一步,所述pH值控制单元通过盐酸调节发酵罐内菌液的pH值。
进一步,在所述发酵罐中安装搅拌器。
进一步,所述发酵罐上方设置照明单元。
进一步,所述光合细菌为深红红螺菌。
本实用新型的有益效果是:
(1)利用氧化还原电位电极在线监测深红红螺菌的培养过程,对深红红螺菌的生长过程实施在线调控,促进深红红螺菌的生长和底物的代谢;
(2)改进了深红红螺菌粗放的培养工艺,实现了深红红螺菌培养过程的在线控制;
(3)将深红红螺菌培养密度OD由1.52提高到2.59,在生长周期内对琥珀酸利用提高了13.95%,对铵离子的利用提高了14.29%;
(4)适用于对深红红螺菌的大规模生产。
附图说明
附图1是本实用新型的培养装置的结构示意图。
附图中的标号分别为:
1.发酵罐; 2.空气输入单元;
3.氮气输入单元; 4.氧化还原电位电极单元;
5.pH值控制单元; 6.主控单元;
7.混合单元; 8.混合单元;
9.搅拌器; 10.照明单元。
具体实施方式
下面结合附图对本实用新型光合细菌的培养装置的具体实施方式作详细说明。
参见附图1,光合细菌的培养装置,包括发酵罐1、空气输入单元2、氮气输入单元3、氧化还原电位电极单元4、pH值控制单元5和主控单元6,发酵罐1内注有光合细菌菌液,空气输入单元2和氮气输入单元3通过管道连接至发酵罐1内,氧化还原电位电极单元4连接至发酵罐1内,pH值控制单元5通过管路连接至发酵罐1,主控单元6根据发酵罐1中的参数信息,控制空气输入单元2、氮气输入单元3和pH值控制单元5,使发酵罐1中的光合细菌达到最高生长速率。
空气输入单元2和氮气输入单元3连接至混合单元7,混合单元7通过管道连接至发酵罐1内。培养装置的后方尾气单元8,尾气单元8连接至发酵罐1内,接收发酵罐1的排气。在发酵罐1中安装搅拌器9,用于对菌液的搅拌,以促进菌体的生产。在发酵罐1上方设置照明单元10,补充自然光照的不足,为菌体提供充足的光照,利于菌体进行光合作用。pH值控制单元5通过盐酸调节发酵罐1内菌液的pH值。
以下以光合细菌为深红红螺菌为例,进行详细说明。
一组:深红红螺菌的培养基配方为酵母提取物0.3g/L、乙醇0.5ml/L、琥珀酸钠1g/L、乙酸铵0.5g/L、柠檬酸铁(0.1%)5ml/L,磷酸二氢钾0.5g/L、硫酸镁0.02g/L、氯化钠0.4g/L、氯化铵0.4g/L、二水氯化钙0.05g/L、维生素B12组分(0.01%)0.4ml/L和微量元素SL-6 1ml/L。微量元素SL-6包含七水硫酸锌0.1g/L、四水氯化锰0.03g/L、硼酸0.03g/L、六水氯化钴0.2g/L、二水氯化铜0.01g/L、六水氯化镍0.02g/L、二水钼酸钠0.03g/L,pH为7.5,培养温度为25-30℃,40w钨丝灯微好氧光照。对发酵罐的搅拌转速为100rpm,空气流量为1.8~3.2L/min,氮气流量为0.8~2.2L/min;保持微好氧环境。氧化还原电位的测得使用的是氧化还原电位(ORP)电极值。得到较佳菌体生产效果。
另一组:酵母提取物0.3g/L、乙醇0.5ml/L、琥珀酸钠1g/L、乙酸铵0.5g/L、柠檬酸铁(0.1%)5ml/L,磷酸二氢钾0.5g/L、硫酸镁0.02g/L、氯化钠0.4g/L、氯化铵0.4g/L、二水氯化钙0.05g/L、维生素B12组分(0.01%)0.4ml/L和微量元素SL-6 1ml/L。微量元素SL-6包含七水硫酸锌0.1g/L、四水氯化锰0.03g/L、硼酸0.03g/L、六水氯化钴0.2g/L、二水氯化铜0.01g/L、六水氯化镍0.02g/L、二水钼酸钠0.03g/L,pH6.8。发酵罐中搅拌转速为100rpm,空气流量为1.8~3.2L/min,氮气流量为0.8~2.2L/min;保持微好氧环境。也取得较佳菌体生产效果。
本实用新型中,使用722型紫外—可见光分光光度计;5L发酵罐为上海国强生化装备有限责任公司生产,发酵控制系统为国佳生化工程中心NCBbiostar发酵控制系统。
在培养的方法中,各步骤分别如下:
菌浓测定:将菌液适当稀释后于波长660nm处测定吸光值,以去离子水为对照。菌体的光密度值(OD660)=OD读数×稀释倍数。
铵离子测定:利用苯-次氯酸盐反应测定。
有机酸测定:Agilent 1100HPLC系统(Agilent公司),色谱柱:AquaSeq公司C8柱。样品采集:取10mL发酵液,7500rpm 4℃离心10min,取1.5mL上清液4℃12000rpm离心15min,再取上清液用0.22μm的膜过滤,滤液于-20℃保存待用。流动相:0.05M磷酸二氢钾(pH2.5):甲醇=95:5;流速:0.6mL/min。进样量:20μL。柱温:30℃。检测波长:210nm。
实验方案
初步的实验结果告诉我们随着菌体生长过程的进行,ORP会快速下降,而比生长速率会降低,pH值随着乙酸铵和琥珀酸钠的消耗会上升,当ORP值下降到-190mV时菌体的比生长速率接近0,一段时间后ORP开始缓慢回升。而我们通过测定相关底物的浓度,发现底物浓度并不是限制菌体生长的因素。而微好氧情况下ORP所表征的氧痕量很可能是限制菌体生长的关键。
所以从12h时就开始调控ORP,使ORP值维持在一个稳定值,发现当ORP在-130时,菌体24h的比生长速率高于其余值,此时琥珀酸和铵离子的比消耗速率也高于其余组。
以上所述仅是本实用新型的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本实用新型原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本实用新型的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!