肟基化合物的几何异构体的制造方法与流程
本发明涉及作为医药/农药有用的肟基化合物的几何异构体的制造方法。
背景技术:
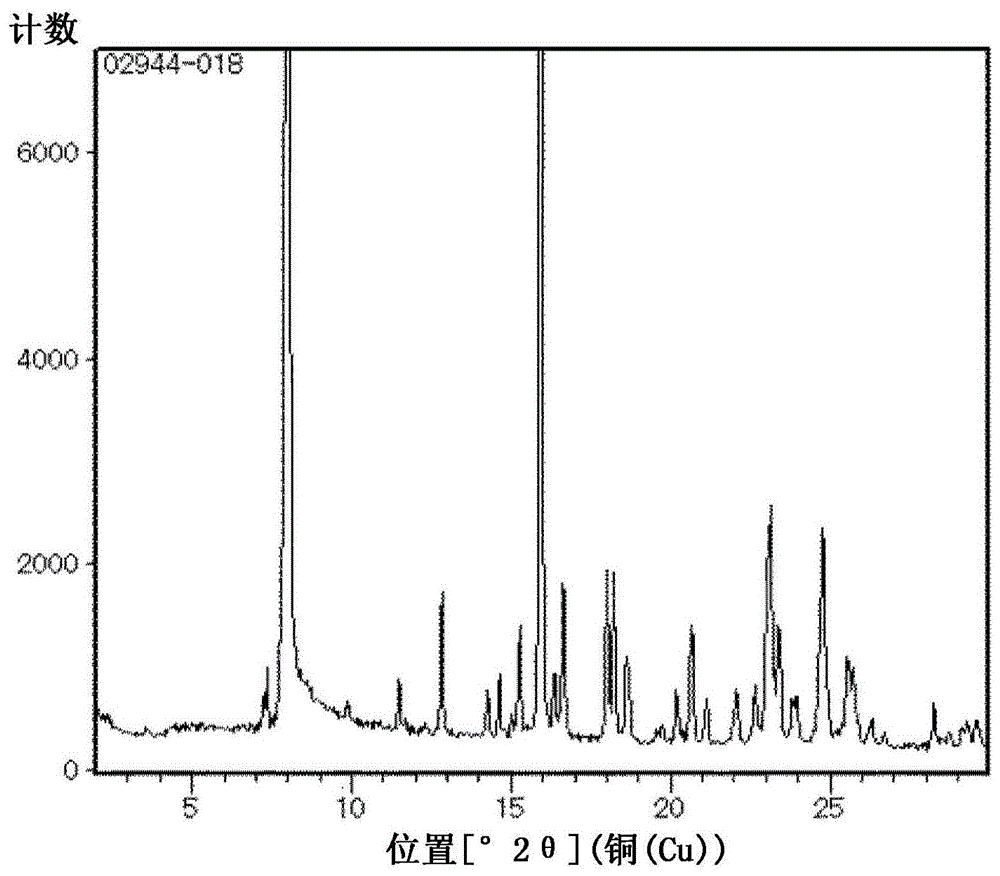
:已知某种肟基化合物是作为农药或医药有用的化合物(参照专利文献1~5)。通常肟基化合物具有肟基,因此存在e的立体构型的化合物[以下简称为e体]和z的立体构型的化合物[以下简称为z体]这两种几何异构体,已知从e体转换成z体、从z体转换成e体、或者从e体或z体转换成e体和z体的混合物的方法。例如已知通过照射光而由e体制造z体的方法(参照专利文献1和2);通过使用酸性化合物而由e体制造z体的方法(参照专利文献6);通过使用酸性化合物而由z体制造e体的方法(参照专利文献4、5、7和8);以及通过照射光而由e体制造e体和z体的混合物的方法(参照专利文献3)。现有技术文献专利文献专利文献1:国际公开第2014/010737号专利文献2:日本特开2016-011286号公报专利文献3:国际公开第2013/137075号专利文献4:日本特开平06-219986号公报专利文献5:欧州专利申请公开第0435687号说明书专利文献6:日本特开平10-195064号公报专利文献7:日本特开平09-143138号公报专利文献8:国际公开第2011/093423号技术实现要素:发明所要解决的课题通常在制造肟基化合物的情况下,以e体和z体的混合物的形式得到。e体和z体是相互非常接近的结构,因此例如通过柱层析等通常的纯化操作从e体和z体的混合物仅选择性减少e体或z体是非常困难的。另外,在使用一种几何异构体作为医药、农药等的情况下,另一种几何异构体作为杂质混入至制品中,成为给制品的品质和性能带来不良影响的原因。因此,期望开发出新颖的制造肟基化合物的方法,从不期望的几何异构体制造出期望的几何异构体。用于解决课题的手段本发明人为了解决上述课题进行了深入研究,结果发现使酸性化合物作用于作为e体和z体的混合物的式(ez)-1所表示的肟基化合物而进行异构化反应时,通过控制所用的酸性化合物的添加量,能够分别制作出e体和z体,从而完成了本发明。即,本发明是下述[1]~[11]所述的发明。[1]一种肟基化合物的立体选择性制造方法,其以下述式(ez)-1所表示的肟基化合物的几何异构体的混合物作为起始物质而制造下述式(e)-1所表示的肟基化合物的e体或者下述式(z)-1所表示的肟基化合物的z体;[化1][化2][化3]以上述式(e)-1所表示的肟基化合物的e体作为起始物质而制造上述式(z)-1所表示的肟基化合物的z体;或者以上述式(z)-1所表示的肟基化合物的z体作为起始物质而制造上述式(e)-1所表示的肟基化合物的e体,其特征在于,(i)以式(ez)-1所表示的化合物的几何异构体的混合物或式(z)-1所表示的肟基化合物的z体作为起始物质,将该起始物质和相对于该起始物质为0.1当量以下的酸性化合物在溶剂中混合而制造式(e)-1所表示的肟基化合物的e体;或者(ii)以式(ez)-1所表示的化合物的几何异构体的混合物或式(e)-1所表示的肟基化合物的e体作为起始物质,将该起始物质和相对于该起始物质为0.7当量以上的酸性化合物在溶剂中混合而制造式(z)-1所表示的肟基化合物的z体。[2]如上述[1]所述的肟基化合物的立体选择性制造方法,其中,起始物质是式(ez)-1所表示的化合物的几何异构体的混合物。[3]如上述[1]或[2]所述的肟基化合物的立体选择性制造方法,其中,使起始物质溶解于溶剂后,添加酸性化合物。[4]如上述[1]~[3]中的任一项所述的肟基化合物的立体选择性制造方法,其中,使用相对于起始物质为0.01当量以上0.07当量以下的酸性化合物来制造式(e)-1所表示的肟基化合物的e体。[5]如上述[1]~[3]中的任一项所述的肟基化合物的立体选择性制造方法,其中,使用相对于起始物质为1.0当量以上2.0当量以下的酸性化合物来制造式(z)-1所表示的肟基化合物的z体。[6]如上述[1]~[5]中的任一项所述的肟基化合物的立体选择性制造方法,其中,酸性化合物是卤化氢、硫酸或甲磺酸。[7]如上述[1]~[6]中的任一项所述的肟基化合物的立体选择性制造方法,其中,作为溶剂,使用选自由芳香族烃溶剂、醚溶剂、酮溶剂、酯溶剂和卤代烃溶剂组成的组中的一种以上的溶剂。[8]如上述[7]所述的肟基化合物的立体选择性制造方法,其中,作为溶剂,使用选自由甲苯、邻二甲苯、环戊基甲醚、叔丁基甲醚、二甲氧基乙烷、二乙二醇二甲基醚、甲基乙基酮、乙酸乙酯和1,2-二氯乙烷组成的组中的一种以上的溶剂。[9]如上述[1]~[8]中的任一项所述的肟基化合物的立体选择性制造方法,其中,包括下述工序:将起始物质和酸性化合物在溶剂中混合后,添加选自脂肪族烃溶剂的一种以上的溶剂。[10]如上述[9]所述的肟基化合物的立体选择性制造方法,其中,脂肪族烃溶剂是正庚烷。[11]如上述[1]~[10]中的任一项所述的肟基化合物的立体选择性制造方法,其中,将所析出的结晶、盐或其溶剂合物、或者溶剂合物从反应体系分离。发明效果根据本发明,能够高收率且高立体选择性制造作为医药/农药有用的肟基化合物,能够提供对工业生产有益的制造方法。附图说明图1是实施例1-1中得到的(e)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的粉末x射线衍射图表。图2是实施例1-2中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺盐酸盐0.5(1,2-二氯乙烷)合物的粉末x射线衍射图表。图3是实施例11中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺盐酸盐的粉末x射线衍射图表。图4是实施例12中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的粉末x射线衍射图表。图5是参考例4中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺硫酸盐的粉末x射线衍射图表。图6是参考例5中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的甲磺酸盐的粉末x射线衍射图表。图7是参考例6中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的对甲苯磺酸盐的粉末x射线衍射图表。图8是参考例7中得到的(z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的草酸盐的粉末x射线衍射图表。具体实施方式以下详细说明本发明。本发明所包含的肟基化合物由于肟基的存在而具有两种立体构型的异构体。在本说明书中,将两种异构体中的肟基具有e的立体构型的异构体表示为e体,将肟基具有z的立体构型的异构体表示为z体。另外,本发明所包含的上述e体的几何异构体的混合比为e体/z体=90/10~100/0,本发明所包含的上述z体的几何异构体的混合比为e体/z体=10/90~0/100,本发明所包含的上述e体与上述z体的混合物中,e体/z体=超过10/90且小于90/10。e体和z体的混合比可以通过高效液相色谱、气相色谱、核磁共振谱等任意测定方法进行定性分析、计算。在本说明书中的式[例如式(ez)-1]的记载中,肟基的波浪线的键合是指e体和z体的几何异构体的混合物。[化4]在本说明书中,n-是指正,i-是指异,s-是指仲,以及tert-或t-是指叔,o-是指邻,m-是指间,p-是指对。本说明书中,作为碱性化合物,可以举出无机碱或有机碱。作为无机碱,可以举出例如氢氧化锂、氢氧化钠、氢氧化钾、氢氧化铯、氢氧化镁、氢氧化钙、氢氧化钡、碳酸锂、碳酸钠、碳酸钾、碳酸铯、碳酸氢钠、碳酸氢钾、碳酸氢铯、碳酸氢铵、乙酸钠、乙酸钾、乙酸铯、乙酸钙、乙酸钡、磷酸钠、磷酸钾、磷酸氢二钠、磷酸氢二钾等。作为有机碱,可以举出例如氨、乙胺、二乙胺、三乙胺、二异丙基乙胺、三丁胺、吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶、2,3-二甲基吡啶、2,4-二甲基吡啶、2,6-二甲基吡啶、3,5-二甲基吡啶、二氮杂双环十一碳烯、1,4-二氮杂双环[2.2.2]辛烷、1,1,3,3-四甲基胍等。接着,对本发明的由式(ez)-1所表示的化合物[以下简称为混合物(ez)-1]制造式(e)-1所表示的化合物[以下简称为化合物(e)-1]的方法、由混合物(ez)-1制造式(z)-1所表示的化合物[以下简称为化合物(z)-1]的方法、由化合物(z)-1制造化合物(e)-1的方法以及由化合物(e)-1制造化合物(z)-1的方法进行详细说明。[制造方法1]反应式1[化5]将混合物(ez)-1和酸性化合物在溶剂(以下简称为溶剂a)中混合而进行反应后,能够使目标物以结晶的形式析出而得到。此时,通过控制所使用的酸性化合物的量,能够选择性制造化合物(e)-1或化合物(z)-1中的任意一种几何异构体。同样地,通过控制所使用的酸性化合物的量,能够由化合物(z)-1选择性制造化合物(e)-1,另外,能够由化合物(e)-1选择性制造化合物(z)-1。在制造化合物(e)-1的情况下所使用的酸性化合物的量相对于起始物质[混合物(ez)-1或化合物(z)-1]可以使用0.00001~0.1当量,优选可以使用0.001~0.1当量,更优选可以使用0.01~0.07当量。在制造化合物(z)-1的情况下所使用的酸性化合物的量相对于起始物质[混合物(ez)-1或化合物(e)-1]可以使用0.7~10当量,优选可以使用0.7~5当量,更优选可以使用0.7~2当量。作为所使用的酸性化合物,可以举出卤化氢、无机酸、羧酸、磺酸等。作为卤化氢,可以举出例如氟化氢、氯化氢、溴化氢、碘化氢等。作为无机酸,可以举出例如硝酸、硫酸、磷酸、氯酸、硼酸、高氯酸等。作为羧酸,可以举出例如甲酸、乙酸、三氟乙酸、三氯乙酸、丙酸、丁酸、戊酸、特戊酸、异戊酸、己酸、庚酸、辛酸、壬酸、辛酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、丙烯酸、甲基丙烯酸、顺芷酸、油酸、亚麻酸、亚油酸、花生四烯酸、草酸、丙二酸、琥珀酸、戊二酸、己二酸、富马酸、马来酸、苹果酸、乳酸、抗坏血酸、柠檬酸、苯乙醇酸、酒石酸、丙酮酸、苯甲酸、邻甲基苯甲酸、间甲基苯甲酸、对甲基苯甲酸、邻三氟甲基苯甲酸、间三氟甲基苯甲酸、对三氟甲基苯甲酸、邻氯苯甲酸、间氯苯甲酸、对氯苯甲酸、邻硝基苯甲酸、间硝基苯甲酸、对硝基苯甲酸、邻苯二甲酸、间苯二甲酸、对苯二甲酸、水杨酸、没食子酸、苯六甲酸、肉桂酸等。作为磺酸,可以举出例如甲磺酸、乙磺酸、10-樟脑磺酸、三氟甲磺酸、苯磺酸、邻甲苯磺酸、间甲苯磺酸、对甲苯磺酸、邻三氟甲基苯磺酸、间三氟甲基苯磺酸、对三氟甲基苯磺酸、邻氯苯磺酸、间氯苯磺酸、对氯苯磺酸、邻硝基苯磺酸、间硝基苯磺酸、对硝基苯磺酸等。作为酸性化合物,优选可以举出卤化氢、硫酸和甲磺酸,更优选可以举出氯化氢、溴化氢和硫酸。这些酸性化合物可以含有水。另外,这些酸性化合物也可以混合两种以上进行使用。在本发明中使用的混合物(ez)-1可以依据日本特开2016-011286号(jp2016-011286)记载的已知的方法合成,只要e体和z体的混合比为上述比例的范围即可。对于作为溶剂a使用的溶剂,可以举出芳香族烃溶剂、卤代烃溶剂、醇溶剂、醚溶剂、酯溶剂、酰胺溶剂、腈溶剂、酮溶剂、二甲基亚砜等。作为芳香族烃溶剂,可以举出例如苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、氯苯、1,2-二氯苯、1,3-二氯苯、1,4-二氯苯、硝基苯等。作为卤代烃溶剂,可以举出例如氯仿、二氯甲烷、二氯乙烷等。作为醇溶剂,可以举出例如甲醇、乙醇、1-丙醇、2-丙醇、1-丁醇、2-丁醇、叔丁醇等。作为醚溶剂,可以举出例如二乙醚、四氢呋喃、环戊基甲醚、叔丁基甲醚、1,4-二氧六环、二甲氧基乙烷、二乙二醇二甲基醚等。作为酯溶剂,可以举出例如乙酸甲酯、乙酸乙酯、乙酸丁酯、丙酸甲酯等。作为酰胺溶剂,可以举出例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮等。作为腈溶剂,可以举出例如乙腈、丙腈等,作为酮溶剂,可以举出例如甲基乙基酮、甲基异丁基酮等。作为溶剂a,优选可以举出芳香族烃溶剂、卤代烃溶剂、醚溶剂、酯溶剂、酮溶剂。更优选可以举出甲苯、邻二甲苯、1,2-二氯乙烷、环戊基甲醚、叔丁基甲醚、二甲氧基乙烷、二乙二醇二甲基醚、乙酸乙酯、甲基乙基酮。进一步优选可以举出1,2-二氯乙烷、乙酸乙酯。这些溶剂除了以一种进行使用以外,还可以混合两种以上进行使用。相对于起始物质,所使用的溶剂的量(将溶剂混合两种以上进行使用的情况下是它们的总和量)可以使用0.01~100质量份,优选可以使用0.1~50质量份,更优选可以使用0.5~20质量份,进一步优选可以使用1~10质量份。将起始物质和酸性化合物在溶剂中混合而进行反应时的反应温度通常为-20~150℃,优选为0~100℃,更优选为10~60℃。另外,使结晶析出时的温度通常为-20~150℃,优选为-10~80℃,更优选为10~50℃。将起始物质和酸性化合物在溶剂中混合而进行反应时的反应时间为1分钟~1000小时,优选为5分钟~100小时,更优选为10分钟~48小时。另外,使结晶析出时的时间根据反应基质的浓度、反应温度而变化,但通常为1分钟~1000小时,优选为5分钟~500小时,更优选为10分钟~100小时。对于反应后的处理方法没有特别限制,通过对所析出的结晶进行过滤,将目标物从反应体系分离而能够得到目标物。所得到的滤液中的肟基化合物根据需要进行浓缩后,能够作为本发明的制造方法的起始物质进行使用。所得到的结晶根据需要通过再结晶等任意的纯化方法进行纯化,由此能够得到更高纯度的目标物。通过反应生成的目标物根据情况以与反应中所用的酸性化合物的盐的形式得到。在以盐的形式得到的情况下,也能够通过与上述同样的方法得到,但也可以根据需要添加水,接着添加有机溶剂,根据需要溶解于有机溶剂后,添加例如氢氧化钠或其水溶液等碱性化合物而进行中和。中和后,根据需要添加水并进行分液,根据需要进行浓缩等通常的后处理,能够得到目标物。通过反应生成的目标物根据情况而与反应中所用的溶剂发生溶剂相容,由此以包含溶剂的合物(以下简称为溶剂合物)的形式得到。以溶剂合物的形式得到的情况下,也能够通过与上述同样的方法得到,但可以根据需要将所得到的溶剂合物溶解或悬浮于未溶剂相容的溶剂后,根据需要添加水并进行分液,根据需要进行浓缩等通常的后处理,能够得到目标物。通过反应生成的目标物根据情况而利用反应中所用的酸性化合物和溶剂以目标物的盐的溶剂合物的形式得到。该情况下,也能够通过与上述同样的方法得到,但根据需要将上述的后处理组合,由此能够得到目标物。[制造方法2]反应式2[化6]使混合物(ez)-1在溶剂(以下简称为溶剂a)中,在酸性化合物的存在下进行反应后,进一步添加溶剂(以下简称为溶剂b),由此能够以结晶的形式得到目标物。此时,通过控制所使用的酸性化合物的量,能够选择性制造化合物(e)-1或化合物(z)-1中的任意一种几何异构体。同样地,通过控制所使用的酸性化合物的量,能够由化合物(z)-1选择性制造化合物(e)-1,另外,能够由化合物(e)-1选择性制造化合物(z)-1。作为所使用的酸性化合物的量和种类,与制造方法1的记载相同。对于作为溶剂a使用的溶剂,可以举出例如制造方法1记载的溶剂。这些溶剂除了以一种进行使用以外,还可以混合两种以上进行使用。另外,所使用的溶剂的量与制造方法1的记载相同。对于作为溶剂b使用的溶剂,可以举出例如正戊烷、正己烷、环己烷、正庚烷、正辛烷、异辛烷等脂肪族烃溶剂。优选可以举出正戊烷、正己烷、正庚烷。更优选可以举出正庚烷。这些溶剂除了以一种进行使用以外,还可以混合两种以上进行使用。相对于起始物质,溶剂b的量(将溶剂混合两种以上进行使用的情况是它们的总和量)可以使用0.01~1000质量份,优选可以使用0.1~100质量份,更优选可以使用0.5~30质量份,进一步优选可以使用1~10质量份。作为溶剂b的添加方法,优选进行滴加的方法。可以相对于起始物质按照每小时0.001质量份~100质量份的速度进行添加,优选按照每小时0.01质量份~10质量份的速度进行滴加,更优选按照每小时0.1质量份~3质量份的速度进行滴加。对于反应后的处理方法没有特别限制,可以通过制造方法1记载的处理方法得到更高纯度的目标物。通过反应生成的目标物与制造方法1的记载同样地,根据情况而以与反应中所用的酸性化合物的盐的形式得到,根据情况而以与反应中所用的溶剂的溶剂合物的形式得到,根据情况而利用反应中所用的酸性化合物和溶剂以盐的溶剂合物的形式得到。根据需要进行制造方法1记载的后处理,由此能够得到目标物。通过使用本发明的制造方法,能够提供对肟基化合物的工业生产有益的制造方法。从工业生产的角度出发,高收率、高立体选择性的观点很重要,但例如副产物的降低、反应时间的短缩、以过滤等简便的操作得到目标物等观点也很重要。实施例以下将本发明的合成例作为实施例进行具体的叙述,由此对本发明进行更加详细的说明,但本发明并不受这些实施例限定。实施例和参考例记载的1h-nmr的表述表示质子核磁共振谱,以下同样地,hplc表示高效液相色谱,lc/ms表示液相色谱质谱仪,ic表示离子色谱,rt表示保留时间。1h-nmr使用四甲基硅烷作为基准物质,在重二甲硫醚溶剂中,利用300mhz进行测定。另外,后述的1h-nmr数据的符号表示下述的含义。s:单峰、d:双重峰、t:三重峰、sep:七重峰、m:多重峰。[定性分析]使用hplc的定性分析使用以下记载的测定条件来实施。柱:inertsilods-sp250mm5μm(glsciences公司制造)流速:1.0ml/分钟柱温度:40℃检测波长:uv254nm洗脱液:乙腈/水/三氟乙酸=600/400/1(体积比)样品溶解液:乙腈/三乙胺=98/2(体积比)[定量分析]在使用hplc的定量分析中,使用将4-甲基联苯作为内标物质的内标法,在与定性分析同样的测定条件下实施测定。测定用的样品按照样品为碱性的方式添加2.0体积%三乙胺/乙腈溶液进行调整。只要没有特别记载,关于通过制造得到的结晶中的z体和e体的含量,对于目标物通过上述的定量分析计算得到,对于相反的几何异构体,通过上述目标物的含量和hplc测定结果的峰面积的比例计算得到。此时,考虑了z体和e体的uv吸收的灵敏度(z体/e体=1.097)。另外,实施例记载的“定量收率”的表述通过上述z体和e体的含量之和计算得到,“z体/e体含有比例”的表述也通过上述z体和e体的含量计算得到。[质量分析]将基于lc/ms的质量分析的条件记载如下。柱:sunfirec1850mm2.5μm(waters公司制造)流速:0.3ml/分钟柱温度:40℃检测波长:uv254nm洗脱液:[表1]时间(分钟)a液:b液(体积比)090:100~590:10至5:95的梯度5~85:95a液:0.1体积%甲酸水溶液b液:乙腈[x射线衍射]粉末x射线结晶衍射在以下记载的测定条件下实施。测定装置:x’pertprompd(panalytical公司制造)x射线源:cu电压:45kv电流:40ma数据范围:2.0191~39.7471°2th.扫描轴:gonio步进尺寸:0.0260°2th.扫描步进时间:47.9400sec扫描的种类:continuouspsd模式:scanningpsd距离:3.35°2th.发散狭缝类型:自动辐射宽度:10.00mm试样宽度:10.00mm测定温度:25.00℃k-alpha1:1.54060ak-alpha2:1.54443ak-beta:1.39225ak-a2/k-a1比:0.50000测角器半径:240.00mm焦点-ds间的距离:100.00mm实施例记载的“质量份”的记载只要没有特别记载则是相对于原料的质量份,“当量”的记载只要没有特别记载则是相对于原料的当量。实施例记载的“4.5质量%氯化氢/乙酸乙酯溶液”的记载表示含有4.5质量%氯化氢的乙酸乙酯的溶液,使用富士纯药制造或东京化成工业制造的溶液。同样地,“4.4质量%氯化氢/乙酸乙酯溶液”是含有4.4质量%氯化氢的乙酸乙酯的溶液(富士纯药制造),“15.5质量%氯化氢/环戊基甲醚溶液”或“15.5质量%氯化氢/cpme溶液”是含有15.5质量%氯化氢的环戊基甲醚溶液(渡边化学工业制造)。[实施例1]依据上述制造方法2记载的方法,使用氯化氢作为酸性化合物,变更氯化氢的当量。[实施例1-1](e)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺[以下简称为化合物(e)-1]的制造方法[化7]将(ez)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺[以下简称为化合物(ez)-1](z体/e体=51.7/48.3)5.40g、相对于原料为1质量份的1,2-二氯乙烷5.40g、4.5质量%氯化氢/乙酸乙酯溶液0.243g(以氯化氢计为0.025当量)和相对于原料为2.5质量份的乙酸乙酯13.7g在25℃混合。在相同温度下搅拌该混合溶液30分钟。用时10小时向该反应溶液滴加正庚烷27.0g时,结晶析出。在25℃搅拌该悬浮液8小时。将该悬浮液冷却至5℃,在相同温度下搅拌3小时。对所析出的结晶进行过滤,利用正庚烷10.8g和乙酸乙酯2.7g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物4.02g[以化合物(e)-1计的定量收率为74.5%]。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为0.6/99.4(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为99.6%。熔点:113~114℃将实施例1-1中得到的化合物(e)-1的1h-nmr记载如下。1h-nmr:δ8.42(d,j=1.8hz,1h),8.30(t,j=5.7hz,1h),8.03(s,1h),7.91(d,j=1.8hz,1h),7.10(t,j=54.3hz,1h),4.42(d,j=5.7hz,2h),4.35(sep,j=6.6hz,1h),3.83(s,3h),1.60-1.50(m,1h),1.23(d,j=6.6hz,6h),0.95-0.85(m,2h),0.80-0.73(m,2h).[实施例1-2](z)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺盐酸盐0.5(1,2-二氯乙烷)合物[以下简称为化合物(z)-2]的制造方法[化8]将化合物(ez)-1(z体/e体=51.7/48.3)5.40g、相对于原料为1质量份的1,2-二氯乙烷5.40g和4.5质量%氯化氢/乙酸乙酯溶液14.6g(以氯化氢计为1.5当量:乙酸乙酯的量相对于原料为2.5质量份)在25℃混合。在相同温度下搅拌该混合溶液4小时时,结晶析出。用时10小时向该悬浮液滴加正庚烷27.0g,在25℃搅拌8小时。将该悬浮液冷却至5℃,在相同温度下搅拌3小时。对所析出的结晶进行过滤,利用正庚烷10.8g和乙酸乙酯2.70g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物6.12g[以化合物(z)-1计的定量收率为95.3%]。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为98.0/2.0(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为99.2%。利用下述的解析条件对所得到的结晶进行单晶x射线结构解析,结果确认到肟基的立体构型为z,上述的结晶为化合物(z)-2。将化合物(z)-2的1h-nmr记载如下。1h-nmr:δ8.52(t,j=6.0hz,1h),8.44(d,j=1.8hz,1h),8.14(s,1h),7.88(d,j=1.8hz,1h),7.11(t,j=54.3hz,1h),4.35-4.05(m,6h),3.85(s,2h,0.5分子的1,2-二氯乙烷),1.60-1.50(m,1h),1.05(d,j=6.3hz,6h),0.95-0.85(m,2h),0.75-0.70(m,2h).[解析条件]装置:smartapexiiultra(brukeraxs公司制造)x射线:cukα(50kv,50ma)测定温度:-50℃[实施例1-3~1-9]依据实施例1-1和1-2记载的方法,变更4.5质量%氯化氢/乙酸乙酯溶液的用量而进行反应。需要说明的是,乙酸乙酯按照相对于原料为2.5质量份的方式调整用量。在下述表2中记载有:氯化氢的当量(表中记载为“hcl当量”)、所得到的结晶中所含的化合物(z)-1或化合物(e)-1的定量收率(表中记载为“定量收率”)、使用hplc的定性分析所确认的z体和e体的合计纯度(表中记载为纯度)、通过使用hplc的定性分析的结果计算出的z体和e体之比(表中记载为“z体/e体比”)。[表2][实施例2]依据上述制造方法1记载的方法,变更溶剂的种类、酸性化合物的种类和当量。[实施例2-1]使用环戊基甲醚作为溶剂、使用甲磺酸作为酸性化合物的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g和3质量份的环戊基甲醚(以下简称为cpme)在40℃混合。向该混合溶液添加0.02当量的甲磺酸(85mg)后,在20℃搅拌60小时,使结晶析出。在结晶析出后,将该悬浮液冷却至5℃,然后搅拌5小时。对所析出的结晶进行过滤,使用1质量份与反应溶剂相同的cpme对所得到的结晶进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为73.1%、z体和e体含有比例为z/e=0.4/99.6。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.9%。[实施例2-6]使用环戊基甲醚作为溶剂、使用硫酸作为酸性化合物的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)2.0g和4质量份的cpme在40℃混合。向该混合溶液添加0.5当量的浓硫酸(218mg)后,在相同温度下搅拌1.5小时,使结晶析出。在结晶析出后,向该悬浮液添加0.6当量的浓硫酸(264mg),进一步搅拌20小时。将该悬浮液冷却至5℃后,搅拌3小时。对所析出的结晶进行过滤,利用与反应溶剂相同的cpme(2ml)对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(e)-1的定量收率为87.9%、z体和e体含有比例为z/e=94.6/5.4。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.8%。[实施例2-7]使用甲苯作为溶剂、使用硫酸作为酸性化合物的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)1.5g和4质量份的甲苯在30℃混合。向该混合溶液添加0.55当量的75质量%硫酸水溶液(240mg)后,在相同温度下搅拌2小时,使结晶析出。在结晶析出后,在相同温度下向该悬浮液添加0.55当量的75质量%硫酸水溶液(240mg),进一步搅拌16小时。将该悬浮液冷却至0℃后,搅拌3小时。对所析出的结晶进行过滤,使用2质量份与反应溶剂相同的甲苯对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为80.4%、z体和e体含有比例为z/e=95.1/4.9。定性分析的结果,z体和e体的峰的相对面积百分率之和为97.9%。[实施例2-2~2-5]依据实施例2-1记载的方法,变更溶剂和酸性化合物的种类而进行反应。将反应条件和结果记载于表3。表中,在“溶剂”中记载溶剂的种类,将溶剂的质量份记载于括号内。另外,在“酸性化合物”中记载酸性化合物的种类,将酸性化合物的当量记载于括号内。[表3][实施例3]依据上述制造方法1记载的方法,使用两种溶剂作为溶剂,使用浓硫酸作为酸性化合物。在下述的实施例3-1~3-8中使用甲苯作为第一溶剂a。[实施例3-1]使用叔丁基甲醚作为第二溶剂a的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g、2质量份的甲苯和3质量份的叔丁基甲醚(以下简称为tbme)在40℃混合。向该混合溶液添加0.05当量的浓硫酸(22mg)后,在15℃搅拌20小时,使结晶析出。在结晶析出后,将该悬浮液冷却至5℃,搅拌24小时。对所析出的结晶进行过滤,使用甲苯和正庚烷的混合溶液(体积比1:1)2ml对所得到的结晶进行清洗,由此得到白色结晶。定量分析的结果,化合物(e)-1的定量收率为70.0%、z体和e体含有比例为z/e=6.2/93.8。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.9%。[实施例3-2]使用环戊基甲醚作为第二溶剂a的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g、1质量份的甲苯和0.05质量份的cpme在40℃混合。向该混合溶液添加0.025当量的浓硫酸(11mg)后,在20℃搅拌24小时,使结晶析出。在结晶析出后,将该悬浮液冷却至10℃,搅拌1小时。对所析出的结晶进行过滤,使用甲苯和正庚烷的混合溶液(体积比1:1)2ml对所得到的结晶进行清洗,由此得到白色结晶。定量分析的结果,化合物(e)-1的定量收率为83.6%、z体和e体含有比例为z/e=0/100。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.7%。[实施例3-5]使用1,2-二甲氧基乙烷作为第二溶剂a的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)1.5g、3质量份的甲苯和0.5质量份的1,2-二甲氧基乙烷(以下简称为dme)在30℃混合。向该混合溶液添加0.5当量的浓硫酸(172mg)后,搅拌4小时,使结晶析出。在结晶析出后,向该悬浮液添加0.6当量的浓硫酸(207mg),搅拌72小时。将该悬浮液冷却至5℃后,搅拌3小时。对所析出的结晶进行过滤,利用2质量份的甲苯对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为87.3%、z体和e体含有比例为z/e=93.5/6.5。定性分析的结果,z体和e体的峰的相对面积百分率之和为96.7%。[实施例3-7]使用叔丁基甲醚作为第二溶剂a的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)1.5g、3质量份的甲苯和3质量份的tbme在40℃混合。向该混合溶液添加1.1当量的浓硫酸(379mg),在30℃搅拌42小时,使结晶析出。在结晶析出后,将该悬浮液冷却至20℃,搅拌1小时。对所析出的结晶进行过滤后,利用2质量份的甲苯对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为81.5%、z体和e体含有比例为z/e=96.0/4.0。定性分析的结果,z体和e体的峰的相对面积百分率之和为96.5%。[实施例3-8]使用环戊基甲醚作为第二溶剂a的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)3.0g、2质量份的甲苯和4.1质量份的cpme在40℃混合。向该混合溶液添加0.5当量的浓硫酸(344mg),搅拌8小时,使结晶析出。在结晶析出后,向该悬浮液添加0.8当量的浓硫酸(551mg),然后在30℃搅拌40小时。将该悬浮液冷却至0℃,搅拌2小时。对所析出的结晶进行过滤,利用2质量份的甲苯和2质量份的cpme的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为89.0%、z体和e体含有比例为z/e=93.7/6.3。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.4%。[实施例3-3、3-4和3-6]依据实施例3-2记载的方法进行实施例3-3和实施例3-4,依据实施例3-5记载的方法进行实施例3-6,变更第二溶剂a的种类而进行反应。将反应条件和结果记载于表4。表中,在“第二溶剂”中记载第二溶剂a的种类。“diglyme”的记载表示二乙二醇二甲基醚(以下相同)。[表4]在下述的实施例3-9和实施例3-10中,使用邻二甲苯作为第一溶剂a,使用环戊基甲醚作为第二溶剂a,变更所使用的浓硫酸的当量。[实施例3-9]化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g、1质量份的邻二甲苯和0.5质量份的cpme在50℃混合。向该混合溶液添加0.025当量的浓硫酸(11mg),在20℃搅拌24小时,使结晶析出。在结晶析出后,将该悬浮液冷却至5℃,搅拌1小时。对所析出的结晶进行过滤,利用1质量份的cpme对所得到的结晶进行清洗,由此得到白色结晶。定量分析的结果,化合物(e)-1的定量收率为80.7%、z体和e体含有比例为z/e=1.2/98.8。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.9%。[实施例3-10]化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)1.5g、3质量份的邻二甲苯和1质量份的cpme在30℃混合。向该混合溶液添加0.5当量的浓硫酸(172mg),搅拌14小时,使结晶析出。在结晶析出后,向该悬浮液添加0.6当量的浓硫酸(207mg),搅拌44小时。将该悬浮液冷却至20℃后,搅拌1小时。对所析出的结晶进行过滤,利用2质量份的邻二甲苯对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为82.7%、z体和e体含有比例为z/e=93.1/6.9。定性分析的结果,z体和e体的峰的相对面积百分率之和为95.8%。将上述的实施例3-9和实施例3-10的反应条件和结果记载于表5。表中,“邻二甲苯/cpme质量份”的记载表示邻二甲苯和cpme的质量份,例如“1/0.5”的记载表示使用邻二甲苯1质量份、cpme0.5质量份。[表5][实施例4]依据上述制造方法2记载的方法,变更溶剂a的种类和酸性化合物的种类。[实施例4-1]使用环戊基甲醚作为溶剂a、使用氯化氢作为酸性化合物的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)2.0g和3质量份的cpme在45℃混合。向该混合溶液添加0.05当量的15.5质量%氯化氢/cpme溶液(0.054g)。将该混合溶液冷却至25℃,用时2小时滴加2质量份的正庚烷时,结晶析出。在相同温度下搅拌该悬浮液24小时。对所析出的结晶进行过滤,使用cpme和正庚烷的混合溶液(体积比1:1)2ml对所得到的结晶进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为67.7%、z体和e体含有比例为z/e=0.4/99.6。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.3%。[实施例4-2]使用甲苯作为溶剂a、使用硫酸作为酸性化合物的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g和2质量份的甲苯在50℃混合。向该混合溶液添加0.03当量的85质量%硫酸水溶液(15mg)。在20℃搅拌该混合溶液14小时时,结晶析出。在相同温度下用时1小时向该悬浮液滴加1质量份的正庚烷后,搅拌22小时。将该悬浮液冷却至5℃后,搅拌2小时。对所析出的结晶进行过滤,利用2质量份的甲苯和1质量份的正庚烷的混合溶液进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为90.1%、z体和e体含有比例为z/e=7.1/92.9。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.9%。[实施例4-3]使用甲苯作为溶剂a、使用对甲苯磺酸作为酸性化合物的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)2.0g和4质量份的甲苯在40℃混合。向该混合溶液添加0.05当量的对甲苯磺酸一水合物(42mg)。将该反应溶液冷却至15℃后,搅拌20小时时,结晶析出。在20℃用时1小时向该悬浮液滴加1质量份的正庚烷,在相同温度下搅拌24小时。对所析出的结晶进行过滤,使用甲苯和正庚烷的混合溶液(体积比1:1)2ml进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为75.6%、z体和e体含有比例为z/e=1.8/98.2。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.5%。[实施例4-4]使用甲苯作为溶剂a、使用硫酸作为酸性化合物的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)1.5g和4质量份的甲苯在30℃混合。向该混合溶液添加1.1当量的85质量%硫酸水溶液(423mg)后,搅拌16小时时,结晶析出。在相同温度下用时3小时向该悬浮液滴加2质量份的正庚烷后,搅拌16小时。将该悬浮液冷却至0℃后,搅拌3小时。对所析出的结晶进行过滤,利用2质量份的甲苯和1质量份的正庚烷的混合溶液进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为82.4%、z体和e体含有比例为z/e=96.6/3.4。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.4%。将上述的实施例4-1~4-4的反应条件和结果记载于表6。表中,在“酸性化合物”中记载酸性化合物的种类,酸性化合物的当量记载于“当量”。[表6][实施例5]依据上述制造方法2记载的方法,使用两种溶剂作为溶剂a,变更酸性化合物的当量。下述的实施例5-1~5-8使用甲苯作为溶剂a中的一种,使用正庚烷作为溶剂b,使用浓硫酸作为酸性化合物。[实施例5-1]使用乙酸乙酯作为第二溶剂a的化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g、1质量份的甲苯和0.5质量份的乙酸乙酯在40℃混合。向该混合溶液添加0.025当量的浓硫酸(12mg)。在20℃搅拌该混合溶液24小时,使结晶析出。在相同温度下用时6小时向该悬浮液滴加3质量份的正庚烷后,搅拌12小时。将该悬浮液冷却至5℃后,搅拌2小时。对所析出的结晶进行过滤,利用2质量份的甲苯和1质量份的正庚烷的混合溶液进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为90.5%、z体和e体含有比例为z/e=3.5/96.5。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.9%。[实施例5-5]使用环戊基甲醚作为第二溶剂a的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)1.5g、3质量份的甲苯和3质量份的cpme在30℃混合。向该混合溶液添加1.1当量的浓硫酸(379mg),搅拌14小时使结晶析出。在相同温度下用时2小时向该悬浮液滴加1质量份的正庚烷后,搅拌22小时。将该悬浮液冷却至15℃后,搅拌2小时。对所析出的结晶进行过滤,利用2质量份的甲苯和1质量份的正庚烷的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-1的硫酸盐。定量分析的结果,化合物(z)-1的定量收率为89.3%、z体和e体含有比例为z/e=93.6/6.4。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.2%。[实施例5-2~5-4、5-6~5-8]依据实施例5-1记载的方法进行实施例5-2~5-4,依据实施例5-5记载的方法进行实施例5-6~5-8,变更溶剂的种类和硫酸的当量。将反应条件和结果记载于表7。表中,在“第二溶剂”中记载作为溶剂a使用的两种溶剂中的第二溶剂a的种类,将溶剂的质量份记载于括号内。表中,“acoet”的记载表示乙酸乙酯(以下同样),“mek”的记载表示甲基乙基酮。[表7]下述的实施例5-9和实施例5-10使用1,2-二氯乙烷和乙酸乙酯作为溶剂a,使用正庚烷作为溶剂b,使用氯化氢作为酸性化合物,变更氯化氢的当量。[实施例5-9]化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)100g、0.5质量份的1,2-二氯乙烷和2.0质量份的乙酸乙酯在25℃混合。向该混合溶液吹入0.042当量的氯化氢气体(340mg),在相同温度下搅拌1小时。在相同温度下用时12小时向该混合溶液滴加5质量份的正庚烷时,结晶析出。在相同温度下将该悬浮液搅拌16小时。将该悬浮液冷却至5℃后,搅拌2小时。对所析出的结晶进行过滤,利用3质量份的正庚烷和1质量份的乙酸乙酯的混合溶液对所得到的结晶进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为90.5%、z体和e体含有比例为z/e=1.1/98.9。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.8%。[实施例5-10]化合物(z)-2的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)5.0g、0.5质量份的1,2-二氯乙烷和2.0质量份的乙酸乙酯在25℃混合。向该混合溶液吹入1.17当量的氯化氢气体(475mg),在相同温度下搅拌5小时时,结晶析出。在相同温度下用时8小时向该悬浮液滴加5质量份的正庚烷后,搅拌8小时。将该悬浮液冷却至0℃后,搅拌5小时。对所析出的结晶进行过滤,利用3质量份的正庚烷和1质量份的乙酸乙酯的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到化合物(z)-2。定量分析的结果,化合物(z)-1的定量收率为94.4%、z体和e体含有比例为z/e=97.6/2.4。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.6%。将上述的实施例5-9和实施例5-10的反应条件和结果记载于表8。表中,在“溶剂”中记载溶剂a的种类,将溶剂的质量份记载于括号内。[表8][实施例5-11]化合物(e)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g、2质量份的甲苯和0.1质量份的diglyme在40℃混合。向该混合溶液添加0.025当量的浓硫酸(11mg)后,在20℃搅拌20小时时,结晶析出。在相同温度下用时1小时向该悬浮液滴加1质量份的正庚烷,在30℃搅拌100小时。将该悬浮液冷却至20℃后,搅拌1小时。对所析出的结晶进行过滤,使用甲苯和正庚烷的混合溶液(体积比1:1)2ml对所得到的结晶进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为74.5%、z体和e体含有比例为z/e=4.0/96.0。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.4%。[实施例6]以化合物(z)-1作为原料的化合物(e)-1的制造方法[化9]将参考例1得到的化合物(z)-1(z体/e体=99.7/0.3)50g和乙酸乙酯75g在室温下混合,在室温下向该混合溶液添加4.5质量%氯化氢/乙酸乙酯溶液2.25g(以氯化氢计为0.025当量)。在40℃搅拌该混合溶液24小时后,在相同温度下用时5小时滴加正庚烷250g。此时,在滴加正庚烷100g的阶段确认到结晶的析出。在正庚烷滴加结束后,在40℃搅拌该反应混合物4小时,接着在室温下搅拌16小时。对所析出的结晶进行过滤,利用正庚烷40g和乙酸乙酯10g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物46.7g[以化合物(e)-1计的定量收率为93.4%]。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为6.8/93.2(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为97.6%。[实施例7]以化合物(e)-1作为原料的化合物(z)-2的制造方法[化10]将(e)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺(z体/e体=6.4/93.6)3.60g和1,2-二氯乙烷7.20g在30℃混合。向该混合溶液添加4.5质量%氯化氢/乙酸乙酯溶液7.22g(以氯化氢计为1.11当量)后,在相同温度下搅拌6小时时,结晶析出。用时16小时向该悬浮液滴加正庚烷14.4g,在30℃搅拌16小时。将该悬浮液冷却至15℃,在相同温度下搅拌3小时。对所析出的结晶进行过滤,利用正庚烷7.20g和乙酸乙酯1.80g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物3.97g[以化合物(z)-1计的定量收率为89.4%]。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为98.1/1.9(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为97.5%。[实施例8]以化合物(e)-1作为原料的化合物(z)-1的制造方法[化11]将化合物(e)-1(z体/e体=0.1/99.9)3.60g和1,2-二氯乙烷7.20g在30℃混合。向该混合溶液添加4.5质量%氯化氢/乙酸乙酯溶液7.22g(以氯化氢计为1.11当量)后,在相同温度下搅拌4小时时,结晶析出。用时8小时向该悬浮液滴加正庚烷14.4g,在30℃搅拌8小时。将该悬浮液冷却至0℃,在相同温度下搅拌2小时。在0℃向该悬浮液滴加水10.8g后,滴加2.0mol/l碳酸钾水溶液6.0ml。在0℃搅拌该反应液2小时后,对所析出的结晶进行过滤,利用水10.8g对所得到的结晶进行清洗,接着利用水2.40g和乙醇4.80g的混合溶液对所得到的结晶进行清洗,由此以白色结晶的形式得到目标物2.93g(收率79.6%)。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为99.0/1.0(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为98.5%。[实施例9]依据上述制造方法1记载的方法,变更溶剂的种类、酸性化合物的种类和当量,为了使结晶析出,使用少量化合物(z)-1的盐而进行反应。[实施例9-1]使用cpme作为溶剂、使用氯化氢作为酸性化合物的化合物(z)-1的盐酸盐[以下简称为化合物(z)-3]的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)2.0g和1.45质量份的cpme在50℃混合。在50℃向该混合溶液添加1.2当量的15.5质量%氯化氢/cpme溶液(1.3g)。在相同温度下向该混合溶液添加2.0mg参考例3中制造的化合物(z)-3后,搅拌20分钟,由此使结晶析出。将该悬浮液冷却至25℃后,搅拌20小时。对所析出的结晶进行过滤,使用与反应溶剂相同的cpme2ml对所得到的结晶进行清洗,由此得到淡红色结晶。定量分析的结果,化合物(z)-1的定量收率为73.0%、z体和e体含有比例为z/e=90.8/9.2。定性分析的结果,z体和e体的峰的相对面积百分率之和为97.8%。[实施例9-2、9-3]依据实施例9-1记载的方法,变更溶剂的种类以及酸性化合物的种类和当量而进行反应。将反应条件和结果记载于表9。表中,在“溶剂”中记载溶剂的种类,将溶剂的质量份记载于括号内。在“酸性化合物”记载酸性化合物的种类,将酸性化合物的当量记载于括号内。[表9][实施例10]依据上述制造方法2记载的方法,变更溶剂的种类、酸性化合物的种类和当量,为了使结晶析出,使用少量化合物(z)-1的盐而进行反应。[实施例10-1]使用cpme作为溶剂a、使用氯化氢作为酸性化合物的化合物(z)-3的制造方法将化合物(ez)-1(z体/e体=48.8/51.2)2.0g和相对于原料为2.45质量份的cpme在45℃混合。向该混合溶液添加1.2当量的15.5质量%氯化氢/cpme溶液(1.3g)。在相同温度下向该混合溶液添加2.0mg参考例3中制造的化合物(z)-3后,搅拌20分钟,由此使结晶析出。用时2小时向该悬浮液滴加2质量份的正庚烷后,搅拌24小时。对所析出的结晶进行过滤,利用cpme(2ml)对所得到的结晶进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(z)-1的定量收率为79.1%、z体和e体含有比例为z/e=95.6/4.4。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.2%。[实施例10-2]使用甲苯和乙酸乙酯作为溶剂a、使用浓硫酸作为酸性化合物的化合物(z)-1的硫酸盐的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)2.0g、2质量份的甲苯和3质量份的乙酸乙酯在30℃混合。向该混合溶液添加1.1当量的浓硫酸(507mg)。在相同温度下向混合溶液添加2.0mg参考例4中制造的化合物(z)-1的硫酸盐后,搅拌14小时,由此使结晶析出。在相同温度下用时24小时向该悬浮液滴加1质量份的正庚烷后,搅拌18小时。将该悬浮液冷却至0℃后,搅拌4小时。对所析出的结晶进行过滤,利用2质量份的甲苯和1质量份的正庚烷的混合溶液对所得到的结晶进行清洗,由此得到淡黄色结晶。定量分析的结果,化合物(z)-1的定量收率为88.3%、z体和e体含有比例为z/e=97.0/3.0。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.8%。将上述的实施例10-1和实施例10-2的反应条件和结果记载于表10。表中,在“溶剂”中记载溶剂a的种类,将溶剂的质量份记载于括号内。将所用的酸性化合物的种类记载于“酸性化合物”,将酸性化合物的当量记载于括号内。[表10][实施例11]以化合物(e)-1作为原料的化合物(z)-3的制造方法[化12]将化合物(e)-1(z体/e体=0.1/99.9)3.60g和甲苯7.20g在30℃混合。向该混合溶液添加4.5质量%氯化氢/乙酸乙酯溶液7.39g(以氯化氢计为1.14当量)后,在相同温度下搅拌2小时。向该混合溶液添加36mg化合物(z)-3,搅拌2小时时,结晶析出。用时16小时向该悬浮液滴加正庚烷14.4g,在30℃搅拌5小时。将该悬浮液冷却至15℃,搅拌3小时。对所析出的结晶进行过滤,利用正庚烷7.20g和乙酸乙酯1.80g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物3.72g[以化合物(z)-1计的定量收率为92.2%]。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为98.1/1.9(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为97.6%。将所得到的结晶7.5mg和甲苯5.0ml在室温下混合,添加0.005mol/l氢氧化钠水溶液6.0ml。在相同温度下搅拌30分钟后,将水层和有机层分离。向有机层添加0.005mol/l氢氧化钠水溶液3.0ml,搅拌30分钟后,将水层和有机层分离。将所得到的水层混合。利用ic进行分析,结果确认到氯离子的含量为7.1质量%,化合物(z)-1与氯化氢的摩尔比为1:1。[实施例12]以化合物(ez)-1作为原料的化合物(z)-1的制造方法[化13]将化合物(ez)-1(z体/e体=42.4/57.6)4.04g和甲苯8.08g在25℃混合。向该混合溶液添加4.4质量%氯化氢/乙酸乙酯溶液8.93g(以氯化氢计为1.2当量)后,在相同温度下搅拌30分钟。向该混合溶液添加2.0mg的化合物(z)-3,搅拌6小时时,结晶析出。用时8小时向该悬浮液滴加正庚烷18.2g,在25℃搅拌9小时。将该悬浮液冷却至0℃,搅拌1小时。向该悬浮液滴加水20.2g后,添加乙酸乙酯18.2g。在0℃向该反应液滴加8.0质量%氢氧化钠水溶液6.74g,在相同温度下搅拌30分钟。在搅拌结束后,在25℃将有机层分液。利用水12.1g对所得到的有机层进行清洗,在减压下蒸馏除去溶剂。将所得到的残留物和甲苯12.1g混合后,在减压下蒸馏除去溶剂。将所得到的残留物和甲苯16.16g在室温下混合后,加热至70℃。向该混合溶液添加正庚烷8.08g后,在相同温度下搅拌30分钟。将该混合溶液冷却至40℃,在相同温度下添加4.0mg的化合物(z)-1。将该混合溶液冷却至20℃时,结晶析出。在相同温度下搅拌该悬浮液12小时后,冷却至0℃。在相同温度下搅拌该悬浮液5小时后,对所析出的结晶进行过滤,利用甲苯4.04g和正庚烷2.02g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物3.36g(收率83.3%)。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为97.3/2.7(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为98.2%。[实施例13]以化合物(ez)-1作为原料的化合物(z)-1的制造方法将化合物(ez)-1(z体/e体=50.4/49.6)5.04g、3质量份的甲苯和1质量份的dme在30℃混合。向该混合溶液添加1.1当量的浓流酸(1.27g)后,在相同温度下搅拌30分钟。向该混合溶液添加1.5mg的化合物(z)-1的硫酸盐,搅拌20.5小时时,结晶析出。将该悬浮液冷却至0℃,搅拌2.5小时。向该悬浮液滴加5质量份的水后,添加3质量份的甲苯。在0℃向该反应液滴加2.2当量的8.0质量%氢氧化钠水溶液(13.99g),在相同温度下搅拌30分钟。在搅拌结束后,在25℃将有机层分液后,利用3质量份的水清洗两次所得到的有机层。将所得到的有机层在减压下蒸馏除去溶剂。将所得到的残留物、4质量份的甲苯和2质量份的正庚烷在70℃混合。将该混合溶液冷却至40℃,在相同温度下添加5.0mg的化合物(z)-1,搅拌30分钟,由此使结晶析出。将该悬浮液冷却至0℃,搅拌13小时。对所析出的结晶进行过滤,利用1质量份的甲苯和0.5质量份的正庚烷的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到3.96g的化合物(z)-1(收率78.6%)。定性分析的结果,z体与e体的面积比为97.1/2.9,两个峰的相对面积百分率之和为99.2%。[实施例14]通过依据实施例1的方法进行反应,对所析出的结晶进行过滤后,将所得到的滤液中的肟基化合物作为起始物质使用。[实施例14-1]化合物(e)-1的制造方法通过依据实施例1-1的方法,使用化合物(ez)-1(z体/e体=48.8/51.2)10g、1质量份的1,2-二氯乙烷、0.025当量的4.5质量%氯化氢/乙酸乙酯溶液0.450g和乙酸乙酯25.4g,进行依据实施例1-1的操作,由此得到淡黄色结晶(8.45g)。定量分析的结果,化合物(e)-1的定量收率为82.8%。定性分析的结果,z体与e体的面积比为z/e=1.4/98.6,两个峰的相对面积百分率之和为99.9%。另一方面,对所得到的滤液进行定量分析,结果含有z体和e体的混合物1.62g(z体和e体含有比例为z/e=67.8/32.2)。将含有该化合物(ez)-1(z体/e体=67.8/32.2)1.62g的滤液在减压下进行浓缩,使用1质量份的1,2-二氯乙烷、0.025当量的4.5质量%氯化氢/乙酸乙酯溶液(0.073g)和乙酸乙酯4.11g,再次进行依据上述的操作,由此得到1.31g的淡黄色结晶。定量分析的结果,化合物(e)-1的定量收率为12.5%[通过10g的化合物(ez)-1计算得到],z体和e体含有比例为z/e=1.8/98.2。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.7%。如上述那样使用滤液反复进行反应,由此以合计收率95.3%得到化合物(e)-1。[实施例14-2~14-3]依据实施例14-1记载的方法,变更氯化氢/乙酸乙酯溶液的用量而进行反应。表中的表述与表2相同。[表11][参考例1]化合物(z)-1的制造方法使用hplc对通过日本特开2016-011286号记载的合成例27的方法得到的结晶进行定性分析,结果观测到保留时间为10.8分钟的峰。熔点:105~107℃1h-nmr:δ8.55-8.45(m,2h),8.14(s,1h),7.95-7.90(m,1h),7.16(t,j=54.3hz,1h),4.26(d,j=6.0hz,2h),4.30-4.20(m,1h),3.88(s,3h),1.65-1.55(m,1h),1.23(d,j=6.6hz,6h),0.95-0.85(m,2h),0.80-0.73(m,2h).将该结晶1mg和氯仿1ml混合,通过使用正己烷的蒸气扩散法,得到柱状结晶。在下述的解析条件下对所得到的结晶进行单晶x射线结构解析,结果确认到肟基的立体构型为z,上述结晶为化合物(z)-1。[解析条件]装置:smartapexiiultra(brukeraxs公司制造)x射线:cukα(50kv,24ma)测定温度:-75℃[参考例2]化合物(ez)-1的制造方法[化14]将参考例1中得到的化合物(z)-1(z体/e体=99.7/0.3)120g和乙酸乙酯180g在室温下混合。在室温下向该混合溶液添加4.5质量%氯化氢/乙酸乙酯溶液5.40g(0.025当量)后,在相同温度下搅拌48小时。在反应结束后,在室温下向该反应溶液添加水180g和碳酸钾369g(0.1当量),在相同温度下搅拌30分钟。将有机层分离后,按照饱和食盐水(100ml×2)、接着无水硫酸钠的顺序进行脱水/干燥,在减压下进行浓缩。在室温下向残留物添加正庚烷1800g和乙酸乙酯180g,在相同温度下搅拌24小时。对所析出的结晶进行过滤,利用正庚烷200g和乙酸乙酯20g的混合溶液进行清洗,由此得到乳白色结晶114.7g。使用lc/ms对所得到的结晶进行质量分析,结果观测到两个峰(保留时间为3.5分钟和4.0分钟),确认到两个峰的ms均为m/z:450(m+)。另外,使用hplc对所得到的结晶进行定性分析,结果观测到两个峰,两个峰的相对面积百分率之和为99.8%。另外,两个峰中的一个峰的保留时间为10.8分钟(相对面积百分率51.6%),另一个峰的保留时间为12.1分钟(相对面积百分率48.2%)。保留时间为10.8分钟的峰是作为原料使用的z体,通过上述lc/ms的质量分析的结果和1h-nmr的测定结果确认到保留时间为12.1分钟的峰为e体。如上所述,在使用hplc的定性分析中可知z体的保留时间为10.8分钟、e体的保留时间为12.1分钟。将(e)-n-[2-[3-氯-5-(环丙基乙炔基)吡啶-2-基]-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的1h-nmr记载如下。1h-nmr:δ8.42(d,j=1.8hz,1h),8.30(t,j=5.7hz,1h),8.03(s,1h),7.91(d,j=1.8hz,1h),7.10(t,j=54.3hz,1h),4.42(d,j=5.7hz,2h),4.35(sep,j=6.6hz,1h),3.83(s,3h),1.60-1.50(m,1h),1.23(d,j=6.6hz,6h),0.95-0.85(m,2h),0.80-0.73(m,2h).[参考例3]化合物(z)-1的盐酸盐[化合物(z)-3]的制造方法将化合物(z)-1(z体/e体=99.7/0.3)1.80g和甲苯3.60g在25℃混合。向该混合溶液添加氯化氢的乙酸乙酯溶液(4.5质量%)3.61g(以氯化氢计为1.11当量)后,在相同温度下搅拌30分钟。向该混合溶液添加化合物(z)-1的盐酸盐0.5(1,2-二氯乙烷)合物18mg,搅拌16小时时,确认到结晶的析出。将该悬浮液冷却至15℃,搅拌4小时。对所析出的结晶进行过滤,利用正庚烷2.70g和乙酸乙酯0.90g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物0.86g[以化合物(z)-1计的定量收率为40.7%]。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为98.4/1.6(rt=10.8分钟/12.1分钟),两个峰的相对面积百分率之和为96.3%。[参考例4]化合物(z)-1的硫酸盐的制造方法将化合物(z)-1(z体/e体=99.7/0.3)5.0g和5质量份的乙酸乙酯在0℃混合。向该混合溶液添加1.0当量的浓硫酸(1.13g),在相同温度下搅拌30分钟时,结晶析出。对所析出的结晶进行过滤,利用2质量份的乙酸乙酯和2质量份的正庚烷的混合溶液对所得到的结晶进行清洗,由此得到白色结晶6.00g。定量分析的结果,化合物(z)-1的定量收率94.6%、z体和e体含有比例为z/e=98.6/1.4。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.9%。将所得到的结晶1.0mg和甲苯2.0ml在室温下混合,添加0.005mol/l氢氧化钠水溶液10ml。在相同温度下搅拌30分钟后,将水层和有机层分离。利用ic对所得到的水层进行分析,结果确认到硫酸根离子的含量为17.9质量%,化合物(z)-1与硫酸的摩尔比为1:1。1h-nmr:δ8.51(d,j=6.0hz,1h),8.50(t,j=1.5hz,1h),8.16(s,1h),7.95(t,j=1.5hz,1h),7.41(brs,2h,硫酸),7.17(t,j=54.6hz,1h),4.30-4.20(m,3h),3.90(s,3h),1.65-1.55(m,1h),1.10(d,j=6.0hz,6h),1.00-0.90(m,2h),0.85-0.75(m,2h).[参考例5]化合物(z)-1的甲磺酸盐的制造方法将化合物(z)-1(z体/e体=99.7/0.3)20g和3质量份的乙酸乙酯在0℃混合。向该混合溶液添加1.0当量的甲磺酸(4.27g),在相同温度下搅拌1小时时,结晶析出。对所析出的结晶进行过滤,利用2质量份的乙酸乙酯和2质量份的正庚烷的混合溶液对所得到的结晶进行清洗,由此得到白色结晶。定量分析的结果,化合物(z)-1的定量收率为88.4%、z体和e体含有比例为z/e=99.1/0.9。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.2%。1h-nmr:δ8.90(brs,1h,甲磺酸),8.54(d,j=6.0hz,1h),8.50(t,j=1.5hz,1h),8.17(s,1h),7.96(d,j=1.5hz,1h),7.17(t,j=54.0hz,1h),4.30-4.20(m,3h),3.90(s,3h),2.40(s,3h,甲磺酸),1.65-1.55(m,1h),1.10(d,j=6.0hz,6h),1.00-0.90(m,2h),0.85-0.75(m,2h).[参考例6]化合物(z)-1的对甲苯磺酸盐的制造方法将对甲苯磺酸一水合物11.05g和10质量份的甲苯在室温下混合。在回流下搅拌该混合溶液2小时,使用dean-stark装置进行共沸脱水后,按照该混合溶液的重量为100g的方式添加甲苯。将化合物(z)-1(z体/e体=99.7/0.3)3.0g和2质量份的乙酸乙酯在0℃混合。向该混合溶液添加12.63g的上述混合溶液(含有1.1当量的对甲苯磺酸),在相同温度下搅拌30分钟时,结晶析出。对所析出的结晶进行过滤,利用2质量份的乙酸乙酯和2质量份的正庚烷的混合溶液对所得到的结晶进行清洗,由此得到淡黄色结晶2.15g。定量分析的结果,化合物(z)-1的定量收率为45.0%、z体和e体含有比例为z/e=95.5/4.5。定性分析的结果,z体和e体的峰的相对面积百分率之和为98.7%。1h-nmr:δ12.20(brs,1h,对甲苯磺酸),8.54(d,j=6.0hz,1h),8.50(t,j=1.5hz,1h),8.19(s,1h),7.96(t,j=1.5hz,1h),7.52(d,j=8.1hz,2h,对甲苯磺酸),7.18(t,j=54.9hz,1h),7.15(d,j=8.1hz,2h,对甲苯磺酸),4.30-4.20(m,3h),3.90(s,3h),2.30(s,3h,对甲苯磺酸),1.65-1.55(m,1h),1.10(d,j=6.0hz,6h),1.00-0.90(m,2h),0.85-0.75(m,2h).[参考例7]化合物(z)-1的草酸盐的制造方法将化合物(z)-1(z体/e体=99.7/0.3)1.0g和3质量份的甲苯在0℃混合。向该混合溶液添加1.0当量的草酸(200mg),在相同温度下搅拌20小时时,结晶析出。对所析出的结晶进行过滤,利用1质量份的甲苯对所得到的结晶进行清洗,由此得到白色结晶989mg。定量分析的结果,化合物(z)-1的定量收率为80.0%、z体和e体含有比例为z/e=99.3/0.7)。定性分析的结果,z体和e体的峰的相对面积百分率之和为99.8%。将所得到的结晶50mg和甲醇5.0ml在室温下混合。向该混合溶液添加0.005mol/l氢氧化钠水溶液。利用ic对所得到的混合溶液进行分析,结果确认到草酸根离子的含量为17.5质量%,化合物(z)-1与硫酸的摩尔比为1:1。1h-nmr:δ8.55-8.45(m,2h),8.16(s,1h),8.00-7.95(m,1h),7.18(t,j=54.3hz,1h),4.30-4.20(m,3h),3.90(s,3h),1.65-1.55(m,1h),1.10(d,j=6.0hz,6h),1.00-0.90(m,2h),0.85-0.75(m,2h).[参考例8]化合物(e)-1的粉末x射线衍射进行实施例1-1中得到的化合物(e)-1的粉末x射线衍射。将粉末x射线衍射光谱的图表示于图1。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):7.35、8.00、12.83、14.62、15.26、15.93、16.35、16.64、18.00、18.22、18.61、20.66、22.07、22.64、23.15、23.40、23.96、24.77、25.55、25.75和28.24。[参考例9]化合物(z)-2的粉末x射线衍射进行实施例1-2中得到的化合物(z)-2的粉末x射线衍射。将所得到的粉末x射线衍射光谱的图表示于图2。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):7.02、8.85、13.96、15.39、15.71、17.45、18.00、18.34、20.03、20.62、20.83、21.05、21.67、22.66、22.86、23.40、23.61、23.86、25.13、25.98和28.14。[参考例10]化合物(z)-3的粉末x射线衍射进行实施例11中得到的化合物(z)-3的粉末x射线衍射。将所得到的粉末x射线衍射光谱的图表示于图3。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):7.05、10.48、14.03、14.21、15.79、17.47、18.47、20.02、20.70、21.09、21.56、21.85、22.26、22.83、23.42、23.80、25.17和25.76。[参考例11]化合物(z)-1的粉末x射线衍射进行实施例12中得到的化合物(z)-1的粉末x射线衍射。将所得到的粉末x射线衍射图表示于图4。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):7.54、8.91、9.67、14.07、14.50、15.00、15.88、17.42、17.95、18.14、20.74、21.01、21.77、22.22、22.54、23.26、25.49、25.86和26.70。[参考例12]化合物(z)-1的硫酸盐的粉末x射线衍射进行参考例4中得到的化合物(z)-1的硫酸盐的粉末x射线衍射。将所得到的粉末x射线衍射光谱的图表示于图5。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):5.45、10.81、12.02、14.29、15.45、15.70、16.31、19.44、21.37、22.07、22.43、22.75、23.74、24.41、24.92和25.59。[参考例13]化合物(z)-1的甲磺酸盐的粉末x射线衍射进行参考例5中得到的化合物(z)-1的甲磺酸盐的粉末x射线衍射。将所得到的粉末x射线衍射光谱的图表示于图6。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):5.39、8.03、10.68、11.17、12.50、12.73、15.86、16.22、19.07、20.28、20.57、21.32、21.72、22.27、22.53、23.99、25.03、25.31、25.56和25.79。[参考例14]化合物(z)-1的对甲苯磺酸盐的粉末x射线衍射进行参考例6中得到的化合物(z)-1的对甲苯磺酸盐的粉末x射线衍射。将所得到的粉末x射线衍射光谱的图表示于图7。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):7.56、9.99、11.64、12.37、14.54、15.04、15.24、17.14、18.55、19.97、20.42、22.04、22.61、22.84、23.34、24.15、25.26、26.52和26.97。[参考例15]化合物(z)-1的草酸盐的粉末x射线衍射进行参考例7中得到的化合物(z)-1的草酸盐的粉末x射线衍射。将所得到的粉末x射线衍射光谱的图表示于图8。在粉末x射线衍射中,作为特征峰得到下述的峰值。需要说明的是,作为粉末x射线衍射的峰值的误差,通常可以取±0.2。衍射角度(2θ):6.60、9.26、10.76、13.17、14.55、14.78、15.67、18.97、19.75、20.02、21.37、22.92、23.82、25.45、27.09和28.03。[参考例16](z)-n-[2-(3,5-二氯吡啶-2-基)-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺的制造方法[化15]将按照国际公开第2014/010737号(wo2014/010737)所述的已知的方法合成的(ez)-n-[2-(3,5-二氯吡啶-2-基)-2-(异丙肟基)乙基]-3-(二氟甲基)-1-甲基-1h-吡唑-4-甲酰胺(z体/e体=15.2/84.8)168g和乙酸乙酯672g在室温下混合,在35℃向该混合溶液添加4.5质量%氯化氢/乙酸乙酯溶液20ml(以氯化氢计为0.056当量)。在相同温度下搅拌该混合溶液1小时后,在减压下蒸馏除去溶剂。在室温下向所得到的残留物添加乙酸乙酯,调整为乙酸乙酯溶液420g。在35℃向该乙酸乙酯溶液添加4.5质量%氯化氢/乙酸乙酯溶液20ml(以氯化氢计为0.056当量)。在相同温度下用时1小时向该反应液滴加正庚烷252g时,确认到结晶的析出。在正庚烷滴加结束后,在相同温度下搅拌该反应混合物1小时。在搅拌结束后,用时1小时滴加正庚烷252g,搅拌该反应混合物1小时。在搅拌结束后,用时1小时滴加正庚烷252g,搅拌该反应混合物1小时。接着,在室温下搅拌该反应混合物24小时。对所析出的结晶进行过滤,利用正庚烷268.8g和乙酸乙酯67.2g的混合溶液对所得到的结晶进行清洗,由此以淡黄色结晶的形式得到目标物144.5g(收率86.0%)。使用hplc对所得到的结晶进行定性分析,结果z体与e体的面积比为98.2/1.8,两个峰的相对面积百分率之和为98.6%。熔点:126.0~127.0℃1h-nmr:δ8.61(d,j=2.1hz,1h),8.55(t,j=6.3hz,1h),8.25(d,j=2.1hz,1h),8.14(s,1h),7.15(t,j=54.6hz,1h),4.35-4.20(m,3h),3.89(s,3h),1.10(d,j=6.3hz,6h).工业实用性本发明的几何异构体的制造方法在作为医药/农药有用的肟基化合物的有效的制造方法中极其有用。需要说明的是,将2017年02月08日提交的日本专利申请2017-021298号和2017年12月15日提交的日本专利申请2017-241013号的说明书、权利要求书和摘要的全部内容引用至此,作为本发明的说明书的公开内容记入本申请。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1