从孵化的爬行动物卵分离用于生产生物人造皮肤和皮革的细胞的制作方法
本发明涉及一种从已孵化的爬行动物卵分离出用于生产生物人造皮肤和皮革的细胞的方法。本发明允许分离出的细胞用于生产爬行动物皮肤和皮革,而不存在传统爬行动物养殖和为获取其皮肤而捕杀野生动物所涉及的道德问题。本发明还允许分离出的细胞用于生产那些不能大量作为产品的物种的皮革,例如,来自濒危物种的爬行动物皮革。此外,还可通过将分离出的细胞用于组织再生而用于减少因养殖动物形成瘢痕组织而造成的皮革浪费,从而可减少传统养殖中使用的动物。从已孵化的卵分离细胞的方法意味着将不会对动物产生负面影响,这与例如出于相同目的进行的活检不同。
背景技术:
人类使用皮革制作衣服等已有数千年的历史。然而,使用从传统爬行动物养殖或诱捕和杀害野生动物而获得的皮革涉及到许多道德问题。传统爬行动物养殖常见于没有动物福利立法的国家,通常都不会考虑动物在笼子环境、同伴关系等方面的需求。然而,由于对各个年龄段的爬行动物皮革的广泛需求,因此,因广泛的消费者需求不可能禁止使用爬行动物皮革。
鉴于此,能够通过体外方法从已孵化的爬行动物卵分离用于生产爬行动物皮革的细胞将是有利的,从而可以避免有关动物福利和仅为获取皮革而杀害动物的任何道德问题。此外,通过将分离出的细胞用于在农场受伤动物的无瘢痕组织再生可以减少传统养殖饲养和宰杀的动物数量。
先前技术并未表明已从孵化的爬行动物卵中分离出用于生产爬行动物皮革的细胞。
技术实现要素:
本发明的目的在于从已孵化的爬行动物卵中分离出细胞,因此避免从活检或从为皮革产业宰杀的动物获取原材料的传统方式所涉及到的所有道德问题。本发明的主要方面涉及一种从孵化的爬行动物卵的绒毛尿囊膜分离细胞的方法:
获得用于爬行动物皮革生产的细胞的体外方法,包括以下步骤:
-从孵化的爬行动物的卵中获得细胞,以及
-分离和/或培养角朊细胞、成纤维细胞、黑素细胞、干细胞或前体细胞。
所述细胞是从孵化的爬行动物的卵中分离出来的,该孵化卵已露出活的刚孵化出的卵生动物。孵化的爬行动物卵中细胞的来源之一是绒毛尿囊膜。孵化的爬行动物卵中细胞的其他可能来源包括尿囊、尿囊腔、羊膜、羊膜囊、蛋白、卵黄和卵黄囊。
所述干细胞可以是真皮干细胞或间充质干细胞。
所述细胞通过在适当的细胞培养基中进行培养分离出来,于所述培养基中,所述细胞可保持在干细胞或前体细胞状态或分化为成纤维细胞、角朊细胞和黑素细胞或体外生产爬行动物皮革所需的任何其他细胞类型,从而分离出本发明的细胞。替代地,如示例中所述,成纤维细胞和角朊细胞可直接从绒毛尿囊膜获得并可扩增成这些细胞的基本纯的培养物。预期黑素细胞同样可从绒毛尿囊膜分离出来或由前体细胞或干细胞分化成。
此外,为了避免形成瘢痕组织,可对从孵化的卵壳或特定爬行动物个体的绒毛尿囊膜分离出的细胞进行冻存,并在以后于在养殖设施中皮肤受损的情况下用于该特定个体的组织再生。
本发明的另一方面涉及一种通过上文所述方法获得的或可获得的生物人造爬行动物皮革。
本发明的再一方面涉及衣物或皮革制品,其包括至少一部分通过本文上述方法获得的或可获得的生物人造爬行动物皮革。
本发明的还一方面涉及从孵化的爬行动物卵获得的分离的角朊细胞、分离的真皮干细胞和间充质干细胞、黑素细胞或永生化成纤维细胞用于体外生产生物人造爬行动物皮革产品的用途。
此外,分离或分化的成纤维细胞、角朊细胞和黑素细胞可在体外成长用于生产爬行动物胶原蛋白。根据wo2013149083、wo2014201406和wo2017003999中描述的方法,爬行动物胶原蛋白可用于生产人造爬行动物皮革产品。
附图简要说明
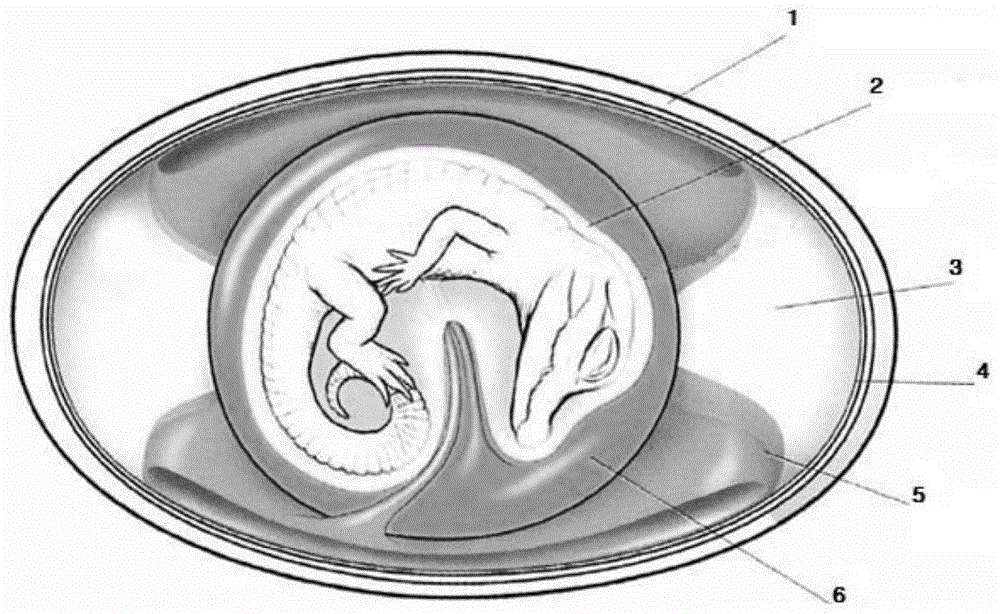
图1为爬行动物的卵的示意图,来源:(biologyandevolutionofcrocodylians,gordongrigganddavidkirshner,2015)。
图2示出了从爬行动物卵的绒毛尿囊膜分离出的角朊细胞。
图3示出了从爬行动物卵的绒毛尿囊膜分离出的成纤维细胞。
图4示出了实时pcr,其显示了干细胞标记cd90在从爬行动物卵的绒毛尿囊膜分离出的细胞中的高表达。
图5示出了实时pcr,其显示了干细胞标记cd166在从爬行动物卵的绒毛尿囊膜分离出的细胞中的高表达。
具体实施方式
皮革因其耐用性和柔韧性一直是人类在各种应用中的重要材料来源,例如,用于装订的服装(如,鞋、夹克、帽子、包、皮带)和家具覆盖物。特别是爬行动物皮革被认为是奢饰品。然而,在只为获取动物皮肤而杀害野生动物和/或养殖动物方面存在需要道德问题。
本发明涉及从爬行动物的孵化卵中分离细胞,用于完全通过体外方法由从孵化的爬行动物卵中分离出的细胞生产人造皮革。
本文中的爬行动物意指对术语“爬行动物”的常规理解。根据此定义,爬行动物是那些没有软毛或羽毛的羊膜动物。该组包括当今的(即,非灭绝的)龟(turtles)、鳄目动物(crocodilians)、蛇(snakes)、蚓蜥(amphisbaenians)、蜥蜴(lizards)及大蜥蜴(tuatara)。代表性爬行动物的示例包括海龟(turtles)、陆龟(tortoises)、鬣蜥(iguana)、飞蜥(agamas)、避役(chameleons)、石龙子(skinks)、变色蜥(anoles)、蜥蜴(lizards)、壁虎(geckos)、王蛇(boas)、水蛇(anacondas)、蟒蛇(pythons)、树眼镜蛇(mambas)、毒蛇(vipers)、蝰蛇(adders)、响尾蛇(rattlesnakes)、鳄鱼(crocodiles)、短吻鳄(alligators)及恒河鳄(gavials)。
与用于分离所需细胞的活检相比,从孵化的爬行动物卵中分离细胞来生产生物人工爬行动物皮革具有不会对动物产生任何负面影响的优势。分离出的细胞随后可仅通过使用体外方法来生产生物人工爬行动物皮革,从而避免了有关仅为了获取动物皮肤而捕杀野生动物的任何道德问题以及有关传统野生动物养殖的动物福利问题。从孵化的野生动物卵中分离出细胞的另一个优点在于可从濒临灭绝物种中分离出细胞,而没有对单个动物造成伤害的风险,从而可以保护整个物种。再一优点在于从特定爬行动物个体的绒毛尿囊膜分离出的细胞可以进行冻存。这些细胞在以后可用于在农场遭受皮肤创伤的动物的皮肤的无瘢痕组织再生。如果形成瘢痕组织,皮肤的一部分将不得不丢弃,不能用于奢侈品生产。通过无瘢痕组织再生,会丢弃较少的皮肤,从而可以减少用于生产一定数量的奢侈品的动物的数量。
根据本发明从孵化的爬行动物卵中分离出的细胞可用于生产人工爬行动物皮革,生产的人工爬行动物皮革可以传统使用爬行动物皮革的任意方式进行使用,例如,用于衣服、家具、衣服或家具上的应用和附件、以及其他爬行动物皮革服装(包括家居服)。
根据本发明从孵化的爬行动物卵中分离出的细胞优选是从自所选择的爬行动物的孵化卵获取的血管化绒毛尿囊膜分离出的细胞。如本文其他地方所述,也可以从孵化的爬行动物卵的其他部分获得细胞。优选分离出的细胞为角朊细胞(keratinocytes)、真皮干细胞(dermalstemcells)、间充质干细胞(mesenchymalstemcells)、黑素细胞(melanocytes)或成纤维细胞(fibroblastcells)。此外,根据本发明分离出的细胞可在之后从成纤维细胞、角朊细胞、黑素细胞等脱分化和/或转分化成具有干细胞特性的细胞,这些细胞可随后(再)分化成适用于在体外进行野生动物皮革生产或组织再生的细胞。
成纤维细胞和/或成纤维细胞系脱分化和/或转分化成具有干细胞特性的细胞(例如,祖细胞)可在从绒毛尿囊膜分离出细胞之后进行,这些祖细胞可进一步分化成适于在体外生产爬行动物皮革的细胞。本发明也可以利用角朊细胞脱分化和/或转分化成其祖细胞。本发明的脱分化和/或转分化可以是逆转素介导的(reversine-mediated)。
本发明的细胞分离可基于从任何目前可以或不可以从其获取皮革的爬行动物获取的绒毛尿囊膜,例如,鳄目(短吻鳄和鳄鱼)、龟鳖目(陆龟和海龟)、有鳞目(蜥蜴和蛇)及喙头目(大蜥蜴或喙头蜥(sphenodonpuntatus))。
方法
本发明的主要方面涉及一种从孵化的爬行动物卵中分离活细胞的方法:
-从孵化的爬行动物卵中获取细胞,及
-分离和/或培养角朊细胞、成纤维细胞、黑素细胞、干细胞或前体细胞。
图1示出了爬行动物的卵的不同成分,包括绒毛膜、尿囊腔(allantoicsac)、羊膜、羊膜囊、羊水、脐带、卵黄囊和卵黄。
孵化中期蛋白(3)在卵两端很显眼并且主要位于卵两端,蛋白(3)提供水源,随着发育的进行其逐渐变少形成橡胶似的垫。包含在卵黄囊(6)内的卵黄和在其羊膜囊(2)内发育的胚胎也很显眼。不太明显的是,卵的全部内容物都由膜性绒毛膜(4)包围。胚胎通过卵黄动脉和静脉由卵黄提供养分,卵黄动脉和静脉通过脐带离开和进入胚胎。这种方式让人想起发育中的胎盘哺乳动物从整个胎盘的母体血液供给获取营养的方式。尿囊像是一个从内脏层膨出的球囊,用于储存废物。在发育早期,排出气态氨,但这逐渐被尿素取代,其被储存在尿囊腔(5)中。尿囊开始时较小,逐渐扩张,直到它包住大部分的卵内容物。与绒毛膜结合,压靠外壳,形成绒毛尿囊膜,其通过卵壳和卵壳膜在胚胎和窝卵室穴(clutchcavity)大气之间进行o2和co2交换。随着胚胎对氧气需求的增加,绒毛尿囊膜逐渐增大,形成并扩展围绕卵中纬线的不透明带(1)。气体由通过脐带离开和进入胚胎的绒毛尿囊膜动脉和静脉携带。产卵时,胚胎在卵黄顶上,只有几毫米长,并且,卵内容物几乎全部是卵黄和蛋白。随着胚胎生长,卵黄和蛋白逐渐被消耗掉,随着胚胎和尿囊腔体积的增大其占据越来越小的空间(biologyandevolutionofcrocodylians,gordongrigganddavidkirshner,2015)。
在一实施例中,本发明的细胞是从孵化的爬行动物卵的绒毛尿囊膜分离出来的。也可以从孵化卵的其他部分分离出细胞。
在另一实施例中,本发明所称的爬行动物是濒危物种和/或选自由以下爬行动物组成的群组:鳄目动物(短吻鳄和鳄鱼)、龟鳖目(陆龟和海龟)、有鳞目(蜥蜴和蛇)及喙头目(大蜥蜴或喙头蜥)。
根据本发明的方法,从一种爬行动物的不同个体分离出细胞;或者,根据优选实施例,从一种爬行动物的一个相同个体分离出细胞。
在一优选实施例中,所述细胞未经基因修饰。
在一优选实施例中,可对来自绒毛尿囊膜的细胞进行繁殖和贮存以备后用,由此消除每次生产生物人工爬行动物皮革时对孵化卵进行采集的需要。此外,从孵化爬行动物卵获得的细胞还可作为该个体的供体细胞来源贮存,例如,用于修复对动物的爬行动物皮肤造成的损害。
制造爬行动物皮革的方法
在一个实施例中,可通过培养成纤维细胞、角朊细胞和黑素细胞并使这些细胞生长成皮肤来生产爬行动物皮革。为了增加皮肤或皮革的强度,这些细胞可在纤维载体或网状载体上生长。此外,可以添加着色剂以在皮肤上制作爬行动物图案。wo2016073453中描述了使细胞长成纤维或网状物增强皮革的方法。
在另一实施例中,分离出的爬行动物成纤维细胞、角朊细胞和黑素细胞在体外成长以产生胶原蛋白。可例如通过wo2013149083、wo2014201406和wo2017003999中描述的方法来收获胶原蛋白,并将其加工成人造爬行动物皮革。
角朊细胞、真皮干细胞、间充质干细胞、黑素细胞和/或永生化成纤维细胞
如本文所述的干细胞(如,真皮干细胞和间充质干细胞)、角朊细胞、黑素细胞和/或成纤维细胞可通过在细胞特异性培养基(cellspecificmedia)中进行培养分离出来。
在一个实施例中,通过培养分离出表皮干细胞和真皮干细胞。
通过在具有或不具有饲养层的tc处理的细胞培养板中的条件cnt-prime上皮细胞培养基(cellntec)中进行培养可分离出角朊细胞,其中,该培养基中加入了10%螯合fbs。
成纤维细胞可通过在tc处理的细胞培养板中的cnt-prime成纤维细胞培养基(cellntec)中进行培养分离出来。
间充质干细胞可通过在未经tc处理的细胞培养板中的dmem/f12(1:1)、20ng/mlegf、40ng/mlbfgf、2%b27中进行培养分离出来,其中,细胞在该细胞培养板中形成自由漂浮的球体。该培养也可以是在tc处理的板上的一种培养,其中,细胞附着在该培养板上,之后形成球体,并由粘附细胞释放。
根据本领域已知的方法,间充质干细胞可分化成成纤维细胞和角朊细胞以及其他细胞类型。间充质干细胞分化成成纤维细胞需要在生长培养基(例如,dmem/f12、2%b27、20μg/mlegf、40μg/mlfgf)中添加结缔组织生长因子。
通过在培养期间物理上分离细胞,例如,通过利用细胞之间以及细胞与它们生长表面之间不同程度的附着,可使某些细胞生长成基本上纯的培养细胞。
培养基
下表给出了可用于本发明的分离和培养的培养基名称和成分的非限定性列表。
示例
从绒毛尿囊膜制备混合细胞群
按照kjellandandkreamer,avianbiologyresearch5(3),2012先前描述的方法从刚孵化的美国短吻鳄(alligatormississippiensis)的卵中获取绒毛尿囊膜。
爬行动物一经露出立即通过使用无菌钳从卵内部采集血管化绒毛尿囊膜来对孵化后的卵进行采样。为了最大程度地减少细菌污染,通过将绒毛尿囊膜转移到含有25mldmem/f121:1、10%fbs、50μg/ml庆大霉素、1%psa(青霉素链霉素两性霉素b)、0.25μg/ml两性霉素b的试管中进行洗涤,并使其旋动来进行清洗。通过将绒毛尿囊膜转移到具有如上所述新鲜洗涤介质的试管中共重复洗涤过程3次。
然后,使绒毛尿囊膜在25mlaccutase中于31℃下消化30-60分钟,每5分钟轻轻摇动试管。抽吸accutase并将其转移到含有cntprime上皮细胞培养基(cellntech)的试管中,该培养基含有10%螯合fbs、1%青霉素/链霉素/两性霉素b。依次通过100μm、70μm和40μm细胞过滤器对细胞溶液进行过滤。将细胞以300xg离心10分钟,除去上层清液。将沉淀的细胞团重悬浮于含有10%螯合fbs、1%青霉素/链霉素/两性霉素b的条件cntprime上皮细胞培养基(cellntech)中。为避免细胞培养感染,也可以使用其他抗生素和抗真菌剂,例如,庆大霉素、制霉菌素。
此时,将一部分细胞用10%dmso/20%fcs/70%条件cnt-prime、10%fbs进行冻存。
为了分离出角朊细胞,将细胞溶液接种于不带有饲养层、具有条件cntprime上皮细胞培养基(cellntech)的tc处理的细胞培养板上,该条件cntprime上皮细胞培养基含有10%螯合fbs、1%青霉素/链霉素/两性霉素b(psa)。将细胞培养物在31℃、5%co2下进行培养。
7-10天后,出现细胞,参见图2(物种:美国短吻鳄)。
将经accutase处理的绒毛尿囊膜转移至含有25mldmem的试管中,该dmem含有0.2-1%胶原酶i。将试管在31℃下过夜培养进行消化。第二天,取回试管,向含有经消化的绒毛尿囊膜的细胞溶液中加入25mldmem/f12(1:1),10%fbs,1%psa。依次通过100μm、70μm和40μm细胞过滤器对细胞溶液进行过滤。将细胞在300xg下离心10分钟,除去上层清液。
此时,在不分离出特定细胞类型的情况下(使用10%dmso/20%fcs/70%细胞特异性培养基)对细胞的一部分进行冻存,剩余细胞则用于培养。
为了分离出成纤维细胞,将沉淀重悬浮于cnt-prime成纤维培养基、10%fbs、1%psa中,并接种于tc处理的细胞培养皿上。在31℃、5%co2下对细胞进行培养。图3示出了来自美国短吻鳄的成纤维细胞。
在之后的传代培养过程中,可以利用胰蛋白酶或分散酶(dispase)使细胞脱离,使其他附着力更强的细胞类型仍附着在培养皿上,而成纤维细胞将更快速地脱离,这将允许近100%成纤维细胞的传代培养。
为了分离出间充质干细胞,将细胞沉淀重悬浮于dmem/f12(1:1)、20ng/mlegf、40ng/mlbfgf、2%b27、1%psa中,并接种于未经tc处理的细胞培养皿上。在31℃、5%co2下对细胞进行培养。间充质干细胞将形成球体,并以球体形式进行增殖,通过利用球体除去培养基以及随后的离心可将细胞分离出来。某些其他细胞类型的去除将归因于其对培养皿的附着,而培养皿在利用球体去除培养基后即被丢弃。
通过实时pcr检测间充质干细胞标记物的存在
细胞复苏
将含有来自如上所述的从美国短吻鳄(属短吻鳄科)获取的经消化的尿囊绒毛膜的细胞悬浮液的冷冻瓶在室温(rt)下进行解冻。一经解冻,立即从31℃环境中取1ml完全培养液(dulbeccosmodifiedeagle培养基(dmem;euroclone,意大利))+10%热灭活胎牛血清(fbs,euroclone)和1%青霉素/链霉素(p/s;euroclone),缓慢加到所述瓶中。将细胞转移到装有5ml完全培养液的试管中。
室温下,以1200rpm的转速离心4分钟。除去上清液,加入1ml磷酸盐缓冲液(pbs;euroclone),洗涤细胞沉淀。
使用细胞计数器(countessii,thermofisherscientific,waltham,ma,usa)对一部分细胞悬浮液进行细胞计数,结果为3.05x10e5个细胞/ml。将剩余细胞在室温下以1200rpm的转速离心4分钟。
作为对照,使用与上述方法相同的方法对含有从属于短吻鳄科的爬行动物获取的成纤维细胞的小瓶进行解冻。对成纤维细胞对照样品进行细胞计数,结果是6.4x10e5个细胞/ml。
总rna分离
使用总rna纯化试剂盒(norgenbiotek,thorold,加拿大)按照制造商提供的方法从对照样品和测定样品分离出总rna。将350μlbufferrl加入到细胞沉淀中,然后转移到组装到收集试管上的gdna去除柱中。
将溶解产物在室温下以140000rpm的转速离心1分钟。收集流出物,并加到210μl无水乙醇中,随后装载在组装到新的收集试管的rna纯化柱上。将溶液在室温下以6000rpm的转速离心1分钟。
通过向柱子加入400μl洗涤液a(washsolutiona)来洗涤柱子。将柱子在室温下以14000rpm的转速离心1分钟。重复洗涤步骤3次。
通过向每个柱子加入20μl洗脱液a(elutionsolutiona)来稀释所收集的总rna,并以2000rpm的转速离心2分钟,随后在室温下以14000rpm的转速离心1分钟。
使用nanodroptmnd-1000(thermofisherscientific)测定样品和对照的rna质量和浓度。样品总rna测得为187ng/μl(260/280=1.95;260/230=1.81)。对照总rna测得为258.6ng/μl(260/280=2.06;260/230=1.91)。
cdna第一条链的合成
按照sensifasttmcdna合成试剂盒(bioline,新加坡)合成互补dna(cdna)。对于样品和对照,在20μl的反应体积中逆转录了500ng总rna。每个反应均包含4μl5xtransamp缓冲液、1μl逆转录酶和15μlrna(样品和对照各500ng)。使用以下程序在lifeprothermalcycler(中国杭州博日科技有限公司(bioertechnology))中进行反应:25℃下引物退火10分钟,42℃下逆转录15分钟,85℃下酶失活5分钟。将它们由此产生的cdna储存在-20℃下,直到进行实时pcr。
实时pcr
在rotor-gene3000(corbettresearch,澳大利亚悉尼)上进行实时pcr。将总共1.5μlcdna加入到15μl最终反应体积中。反应混合物由7.5μl2xsensifasttm
使用的引物序列为:cd90正向引物:agcaaggacgagggcacctaca,反向引物:tgggaggagatgggtggggaat;cd166正向引物:tcaaggtgttcaagcaacca,反向引物:ctgaaatgcagtcacccaac;β-肌动蛋白正向引物:tggtgggcatgggtcagaagga,反向引物:atgccgtgctcgatggggtact。
为了定量mrna转录,使用相对2δδct方法[pfaffl]。相对定量通常用于比较基因在不同样品中的表达水平。在研究基因表达时,需要针对不同样品之间的样品质量和数量的变化对目标基因转录本的数量进行标准化。为了保证相同的起始条件,使用β-肌动蛋白(actb)作为内部参照来对相对表达数据进行标准化。
结果表明,与对照(成纤维细胞)和管家基因β-肌动蛋白相比,cd90(也称为yhy1)的相对表达高约4300倍(图4);与对照(成纤维细胞)和管家基因β-肌动蛋白相比,cd166(也称为alcam)的相对表达高约580倍(图5);这证明了间充质来源的干细胞的存在。
参考文献
kjellandetkraemer,avianbiologiyresearch5(3),2012
changetal,intjdevbiol.2009;53(5-6):813–826
pfaffl,mw.anewmathematicalmodelforrelativequantificationinreal-timert-pcr.nucleicacidsres.2001;29(9):e45.
- 还没有人留言评论。精彩留言会获得点赞!