靶向至少CD3和HSA的异源二聚体多特异性抗体形式的制作方法
本发明涉及多个抗体可变结构域的新型异源二聚体多特异性形式,其包含两个分开的可变结构域对的核心,其中,两个可变轻结构域和两个同源可变重结构域分别串联位于两条独立的蛋白链上。
背景技术:
自从开发了第一种单克隆抗体[r17]以来的过去四十年间,抗体已成为用于研究、诊断和治疗目的越来越重要的一类生物分子。
抗体作为治疗剂正朝着更合理地设计功能发展,从而改善和扩大其固有性质。实例包括通过糖工程优化效应子功能[r18]、特异性定位如跨血脑屏障转移[r19]或通过例如增加对fcrn的结合来调节半衰期。
抗体功能化的补充方法是在一个分子中组合不同的靶标特异性以产生双特异性或多特异性抗体或抗体片段,从而能够有替代作用机制,如重新靶向t细胞,例如双特异性抗体博纳吐单抗(blinatumomab)或三特异性抗体卡妥索单抗(catumaxomab)。
尽管到目前为止已经开发了大量不同的多特异性抗体形式[r21],但是双特异性和多特异性抗体形式目前的种类仍然给工业化留下了相当大的技术挑战和很少的灵活性,只有很少的形式允许三特异性和多特异性结合,更少的形式支持形成异源二聚体蛋白。
过去已经提出了不同的多特异性形式。从概念上讲,这些形式可以分为三类:a)单链多特异性形式,其中不同的靶标结合结构域全部位于单个蛋白链上,由单个基因表达,b)同源二聚体和同源多聚体形式,其中不同的靶标结合结构域位于相同的蛋白链上,这些蛋白链通过利用多聚化结构域来组装,形成二价/多价和任选地还有多特异性复合物,以及c)异源二聚体形式,其中靶标结合结构域位于不同的蛋白链上,并且两条蛋白链的组装由异源二聚化结构域驱动。
原则上,异源二聚体多特异性形式提供了以下优点:通过两条异源二聚化蛋白链的简单置换,可以很容易地测试各种组合中具有不同特异性和亲和性的结合结构域,从而能够在最终形式中直接筛选特异性和亲和性的最佳组合,而不需要繁琐的克隆。
在各种结构域的结合性质和/或效力需要彼此谨慎匹配以获得双特异性蛋白的最佳效力,并同时使非特异性作用风险最小化的情况下,需要最终产物形式的这种筛选。在临床情况下,这将转化为在最低不良作用风险下的最佳功效。需要这种最佳组合的情况可能例如是同时阻断在疾病过程中产生的不同浓度的两种疾病驱动细胞因子。在这种情况下,治疗性双特异性蛋白应当能够在一个相同的治疗剂量下有效地阻断两种细胞因子。
多特异性分子的靶标结合结构域的特征必须协调一致的另一个实例是:用靶向肿瘤细胞上的两个细胞表面靶标的细胞毒性抗体来治疗癌症。虽然在这种情况下,抗体的两个细胞表面靶标可能仅在癌细胞上共表达,但它们可能在各种健康组织中单独表达。为了在肿瘤治疗中在最低的不良副作用风险下获得最好的功效,细胞毒性抗体应当优先与两个靶标共表达的细胞结合,而不应当与仅表达两个靶标之一的组织结合。为了实现这一点,需要调整这两个靶标结合结构域的亲和性,以使得一方面单独的结构域与其靶标的亲和力太弱而不能导致细胞裂解,并且另一方面由双特异性分子与癌细胞上的两个靶标同时结合而产生的协同亲和力足以诱导细胞裂解。由于与固定在细胞表面上的不同大分子同时结合而产生的几何约束,实现最大协同结合的结构域组合不仅是亲和力的函数,还是抗原表位的函数,并且仅可能通过测试实际产物形式中的不同结构域组合来确定。
天然igg型抗体可以被认为是同源二聚体形式。
为了增加采用传统igg结构作为支架的同源二聚体抗体形式的特异性数量,可以将额外的结合部分,例如单链fvs[r15]、fvs[r16]、单个结构域[例如nanobodies:huang等人,expertrevmoldiagn.10(2010):777-85]或替代支架[例如fynomers:schlatter等人,mabs.4(2012)497-508]附加到重链和轻链的氨基或羧基末端。该方法的一个优点是可以用传统igg作为核心结构域来产生双特异性至三特异性构建体,这使得能够利用大多数已经为传统igg建立的制造和修饰技术。然而,由于传统fc区域的同源二聚体性质,该方法将总是在每个分子中产生至少两个相同的结合结构域,并因此导致与某一靶标二价结合。这并不总是想要的,特别是(a)当只有与两个靶标协同结合才能产生预期作用时,或(b)当分子量不应当进一步增加时。此外,该方法经常遇到附加的结合部分的结构域稳定性较差的问题,使其不适合于药物开发。
融合另外的结合结构域以增加特异性的概念也可应用于fab片段[r14]或igg的其他抗原结合片段[r23]。由于由重链和轻链组成的fab的异源二聚体性质,fab片段可以用作异源二聚化结构域。例如,fab片段已被用于工程化设计所谓的三体(tribody)。在这种形式中,将scfv片段与fab的轻链和重链的羧基末端融合,形成真正的异源二聚体三特异性分子。fab的轻链-重链交联主要由cl-ch1之间的相互作用驱动,其另外通过共价二硫键连接[r2]。这种形式的挑战是:(a)最不稳定组分的稳定性限制,所述最不稳定组分将最有可能是附加的scfv,以及(b)最多三个靶标特异性的限制。
作为解决同源二聚体双特异性形式的限制的方法,引入了异源二聚体igg[r31]。从一个细胞简单共表达两种不同mab导致组装异源二聚体双特异性igg(其中两种不同的重链将彼此配对,并且两种不同的轻链将与其相对应的重链配对)的可能性非常低[r24]。然而,它还将导致a)具有不同特异性的重链和轻链的错配,以及b)不同重链组合的混合物,形成单特异性和双特异性变体。为了解决这些困难,已经采取了几种方法,这几种方法在分子中造成了人为的不对称性。“knob-into-hole”概念[r3,r4]使用重链/重链或重链/轻链接合处(interface)的工程化设计以驱动共表达链向预期构型交联。在另一种方法中,crossmab方法[r5]允许工程化的轻链/重链对选择性配对。这些方法的缺点是错配分子的任何残留级分都很难从产物中分离。因此,其他技术关注了通过改变单特异性和双特异性结合物的差异结合性质的分离问题[r22],另一方面还忍受由变体的随机分布引起的产量损失。
基于igg的异源二聚体形式的另外的限制是它们都必须包含fc效应子结构域。其中异源二聚化将由导向任意选择靶标的靶标结合结构域驱动的形式将能够在相同或更低的分子量下增加特异性/功能性的数量。具有较低分子量的分子能更有效地穿透靶标组织(例如实体癌),并因此有希望在相同或较低剂量下改善功效。然而,较小的形式具有血清半衰期较短的缺点。
另一种方法使用非抗体融合蛋白来赋予例如scfv部分预期的多特异性。这种融合蛋白的实例有dock-and-lock[r25]、barnase-barstar[r26]、jun-fos[r27]、tnf[r28]或hsa[r29]。这些概念的共同之处在于添加了至少一对结构域,以异源二聚体方式相互作用以将双特异性或多特异性结合结构域连接在一起。这些异源二聚化结构域不直接参与靶标结合,但是它们增加了蛋白的分子量——类似于三体形式中的恒定区1(c1)。此外,由于掺入了非人抗原表位和序列,它们可能具有增加的免疫原性风险。
与以上讨论的cl和ch1之间的相互作用相比,形成抗体结合部位的vl-vh结构域的交联通常被认为是弱的。然而,有几个仅由抗体可变结构域组成的异源二聚体抗体片段概念。如双抗体(diabody)[r6]、dart[r10]和tandabs[r7,r8]等方法提供了优雅且简约的方法以产生同源和异源二聚体双特异性和二价到四价组装体。这些形式策略的最重要的限制是(a)通过使例如scfv与双抗体的任一链的或dart的氨基或羧基末端融合来添加另外的特异性会导致可变轻结构域和可变重结构域的链内配对,从而使得两条蛋白链的异源二聚化非常具有挑战性,以及(b)由于过去经常观察到的可变轻链和可变重链之间的弱的结构域接合处结合,这些形式的单体稳定性差且生产性差,因此进一步的工程化设计,例如引入结构域间二硫键[r12]以稳定vl/vh接合处被认为是必要的。
为了构建多特异性单链串联fv抗体,kipriyanov等人[r30]提出了一种包含两条蛋白链的设计,每条蛋白链由两个以vl-(接头1)-vh-(接头2)-vl-(接头3)-vh顺序排列的分开的fv结构域组成。为了构建异源二聚体四特异性蛋白,异源二聚体将由具有以下结构的两条蛋白链组成。链1:vla-(接头1)-vha-(接头2)-vlb-(接头3)-vhc,和链b:vld-(接头1)-vhd-(接头2)-vlc-(接头3)-vhb,其中,fvb和fvc的组装将驱动两条链的异源二聚化(参见wo2016/202457的图10a)。为了防止链内组装形成串联的单链fv(scfv2)样形式,并为了促进两条单体蛋白链的异源二聚化,已经提议将“接头3”位置处的接头缩短为最多10个氨基酸(ep1293514a1)。然而,所提出的具有至少15个氨基酸的接头2的两个分开的可变结构域的组织安排导致第二可变结构域可能折叠回到n末端结构域上,导致由不匹配的vh/vl对组成的单链双抗体(scdb)样形式,因此可能无法与其靶标结合。另外,还有可能形成其中蛋白链1上的所有可变重链和轻链将分别与蛋白链2的可变轻链和重链配对的异源二聚体,从而阻止了末端scfv(scfva和scfvd)的形成并形成非同源可变结构域的配对。串联的scfv(scfv2)或scdb型副产物可能是在非多聚化的蛋白链的表观分子量下观察到非常高的蛋白级分的原因[r30]。
理论上,上述方法中scdb样结构的形成可通过同样缩短两个分开的可变结构域之间的第二接头(接头2)而进一步减少。然而,这将限制构建体的灵活性,这在许多情况下会对允许两个靶标同时结合的可用抗原表位的范围造成负面影响。当两种膜蛋白同时结合时,这些几何约束特别具有限制性。
另外,然而,最重要的是,两种单体都可能形成同源二聚体片段(参见wo2016/202457的图10b),因此统计上多达三分之二的二聚体产物由两种同源二聚体组成,而只有三分之一由需要的异源二聚体组成。
总而言之,对于允许以最终形式进行不同结合结构域的简单置换和随后的表征的异源二聚体多特异性形式,有强烈的行业需求。这种形式的主要挑战是(a)特异性异源二聚化的效率相对较差,导致生产产量不理想,以及(b)必须使用非靶标结合蛋白作为异源二聚化结构域或工程化的异源二聚体fc效应子结构域,其在调节血清半衰期方面具有较差的灵活性,并且限制了添加新功能而不增加分子量的灵活性。
因此,建议最佳的异源二聚体多特异性形式将仅由靶标结合结构域组成,并且将能够例如通过自由改变不同结合结构域之间的接头长度来调整分子的几何形状以适应由相互作用配偶体(partner)(靶标)限定的几何约束。作为该问题的解决方案,wo2015/058861和egan等人,mabs9(2017)68-84报道了一种新型异源二聚多特异性形式的开发,其包含两个分开的可变结构域对的核心,其中两个可变轻结构域和两个同源可变重结构域分别串联位于两条独立的蛋白链上,由此驱动两条蛋白链的同源二聚化。这种形式已被称为“通过同源异二聚化的基于多特异性抗体的治疗剂(match)”。至多两个额外的结合结构域,特别是基于抗体的结合结构域,例如scfv片段,与任一蛋白链的氨基末端和/或羧基末端融合,形成至多六特异性异源二聚体蛋白。
然而,尽管可以成功地证明其基本原理允许产生这种基于核心的异源二聚多特异性蛋白,所述核心包括对人cd3具有结合特异性的可变结构域对和对治疗靶标具有结合特异性的可变结构域对,例如wo2015/058861和egan等人中测试的match构建体可能需要根据具体情况对异源二聚体多特异性蛋白的性质进行微调,例如通过鉴定合适的vl和vh结构域框架、合适的接头和可选地用于形成链间二硫键的半胱氨酸残基的合适位置。认为这样的微调是必要的,因为似乎不可能完全预测这种包括新型可变结构域对的异源二聚多特异性蛋白质的异二聚化倾向。此外,已知这类多特异性分子(包含cd3结合结构域和至少一个与靶细胞上表达的抗原结合的结构域)的作用机理是基于免疫突触形成时靶细胞的裂解。通过与靶细胞膜上的肿瘤相关抗原(taa)相互作用引起的t细胞上cd3受体的交联和聚簇将导致t细胞活化以及随后细胞因子和细胞毒剂释放到突触中。不希望受到理论的束缚,可以预期这种免疫突触的形成是受多特异性蛋白质的几何形状和各个结合结构域的表位驱动的或至少从根本上受其影响,因此再一次似乎无法预期形成所述核心的可变结构域对的新型组合将按计划工作。因此,仍然没有满足找到一种更可靠的方法来可靠地产生这种异二聚体多特异性蛋白质的需求。
此外,本发明人意识到,为了增加靶细胞裂解的特异性,除了cd3结合结构域之外,t细胞结合分子还可以包含与靶细胞表面上表达的抗原同时结合的至少两个结构域。为了通过各自编码match复合体的两条蛋白链之一的表达质粒组合的置换来有效鉴定一起以最佳选择性与靶细胞结合的两个结合域,这两个结构域必须分别位于异源二聚体match复合物的不同蛋白链上。因此,需要鉴定驱动两条链的异二聚化的核心结构域,其将包含不参与靶细胞结合的结构域。
该问题的解决方案,即鉴定两个固定的可变结构域对的明确核心(其可以通过将一个或多个另外的靶向部分融合到单链蛋白中的一个或两个的n末端和/或c末端来扩展),迄今为止,在现有技术中都没有示出或暗示过。
技术实现要素:
本发明涉及多个抗体可变结构域的新型异源二聚体多特异性形式,其包含两个分开的可变结构域对的核心,其中两个可变轻结构域和两个同源可变重结构域分别串联位于两条独立的蛋白链上,由此驱动两条蛋白链的同源二聚化,其中所述核心由对人cd3具有特异性的第一可变结构域对和对人血清白蛋白具有特异性的第二可变结构域对形成。至多两个额外的结合结构域特别是基于抗体的结合结构域,例如scfv片段,与任一蛋白链的氨基末端和/或羧基末端融合,形成至多六特异性异源二聚体蛋白。除了形成了稳定且良好表达的、有望表现出长血浆半衰期的构建体外,还可以令人惊讶地证明,与包含相同cd3结合结构域和与靶细胞上表达的靶抗原结合的相同结构域的单链双抗体(scdb)形式相比,这类构建体表现出不同的药效学特征,显示出较慢的t细胞活化动力学和降低的细胞因子释放,而不会影响其最大的靶细胞裂解能力。这种类似效应大小下细胞因子释放的降低有望降低由于细胞因子释放引起的不良反应,因此有望带来有利的风险效益。
因此,第一方面,本发明涉及一种异源二聚体蛋白,其包含第一和第二单链蛋白,
其中所述第一单链蛋白包含第一氨基酸序列,所述第一氨基酸序列由以下组成(从n末端至c末端):
(ia)第一vl结构域,
(iia)第一多肽接头,以及
(iiia)第二vl结构域,并且
其中所述第二单链蛋白包含第二氨基酸序列,所述第二氨基酸序列由以下组成(从n末端至c末端):
(ib)第一vh结构域,
(iib)第二多肽接头,以及
(iiib)第二vh结构域,并且
其中所述第一vl结构域与所述第一或所述第二vh结构域形成对第一靶抗原具有特异性的第一可变结构域同源对,并且所述第二vl结构域与另一个所述vh结构域形成对第二靶抗原具有特异性的第二可变结构域同源对,其中所述靶抗原之一是人血清白蛋白,另一个所述靶抗原是人cd3,并且其中所述第一或所述第二单链蛋白中的至少一个还包含
(iv)至少一个作为第三功能结构域的额外的结构域,其通过第三多肽接头与所述第一或所述第二氨基酸序列融合。
第二方面,本发明涉及编码所述第一和第二单链蛋白的一种或两种核酸序列。
第三方面,本发明涉及包含所述一种或两种核酸序列的一种或两种载体。
第四方面,本发明涉及包含所述一种或两种载体的一种宿主细胞或多种宿主细胞。
第四方面,本发明涉及用于生产本发明的第一和第二单链蛋白或异源二聚体蛋白的方法,所述方法包含(i)提供根据本发明的一种核酸或多种核酸或根据本发明的一种载体或多种载体,表达所述一种核酸或多种核酸或所述一种载体或多种载体,并从表达系统收集所述第一和第二单链蛋白,或所述异源二聚体蛋白,或者(ii)提供本发明的一种宿主细胞或多种宿主细胞,培养所述一种宿主细胞或多种宿主细胞,并从细胞培养物收集所述第一和第二单链蛋白,或所述异源二聚体蛋白。
第五方面,本发明涉及一种药物组合物,其包含本发明的异源二聚体蛋白和药学上可接受的载体。
在第六方面,本发明涉及本发明的异源二聚体蛋白用于治疗疾病,特别是人类疾病,更特别是选自癌症、炎性疾病和自身免疫疾病的人类疾病,其中所述第三、第四、第五或第六功能结构域中的至少一个能够与相应疾病的治疗相关靶标特异性相互作用。
在第七方面,本发明涉及一种用于治疗患有疾病,特别是人类疾病,更特别是选自癌症、炎性疾病和自身免疫疾病的人类疾病的患者的方法,所述方法包括向受试者施用有效量的本发明的异源二聚体蛋白,其中所述第三、第四、第五或第六功能结构域中的至少一个能够与相应疾病的治疗相关靶标特异性相互作用。
在所附的从属权利要求中阐述了本发明的具体实施方案。
附图说明
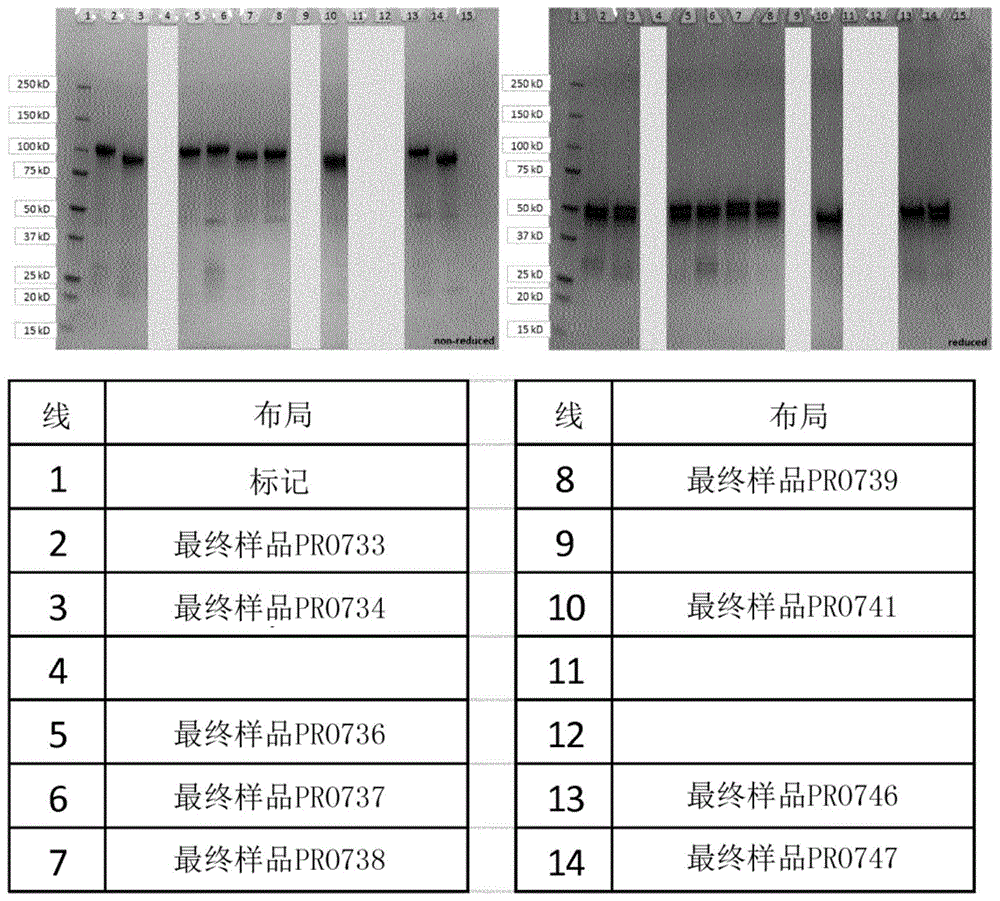
图1显示了在还原和非还原条件下对表2中描述的match构建体变体的sds-page分析。
图1显示了在不同浓度的match和标准scdb分子下,在靶细胞的存在下,t细胞活化的剂量反应。在孵育5小时和30小时后,将生理浓度的人血清白蛋白加入到细胞培养物中。
图3显示了在不同浓度的match和标准scdb分子下,在对照细胞的存在下,t细胞活化的剂量反应。
图4显示了由match和scdb标准分子诱导的t细胞的最大活化图,标准化为5小时的scdb信号幅度。
图5显示了研究期间测试分子的效价图。
图6显示了通过elisa在不同时间点对nfat活化测定的il-2浓度的测定。
图7显示了match和两个标准scdb的细胞裂解的剂量反应图。左图示出了表达il23r的靶细胞的特异性裂解,而右图显示无il23r阴性细胞的特异性裂解。
图8显示了活化的t细胞比例的剂量反应图。左图显示了在表达il23r的靶细胞存在下活化的t细胞的比例,而右图显示了在il23r阴性细胞存在下活化的t细胞的比例。
图9显示了由t细胞活化诱导的细胞毒性测定的各孔中il-2浓度的剂量反应。左图显示在表达il23r的靶细胞存在下诱导的il-2的浓度,右图显示在il23r阴性细胞存在下诱导的il-2的il-2浓度。
图10示出了使用具有抗cd3/抗hsa异源二聚体核心组装体的match的双重靶向的示意图。
图11显示了两个四特异性match组装体(pro821和pro824)的细胞裂解的剂量反应图。左上图显示了表达il23r的靶细胞的特异性裂解,而右上图显示了her2阳性细胞的特异性裂解。下图显示了抗原阴性细胞的特异性裂解。
图12示出了组装体1的示意图。
图13示出了组装体3的示意图。
图14示出了组装体5的示意图。
图15示出了组装体7的示意图。
具体实施方式
在本文,我们提出了一种新型形式,所述新型形式呈现出含有多抗体可变结构域的两条蛋白链的定量异源二聚体组装。这个形式由两个分开的可变结构域对(两个fv片段)的核心组成,其中,两个可变轻结构域和两个可变重结构域各自位于一条独立的蛋白链上,由此驱动两条蛋白链的同源二聚化,其中一对vl和vh结构域对人血清白蛋白具有特异性,另一对对人cd3具有特异性。至多两个具有高结构域内和结构域间稳定性的额外的结合结构域(例如,scfv形式)与任一肽链的氨基末端和/或羧基末端融合,形成至多六特异性异源二聚体蛋白。
因此,第一方面,本发明涉及一种异源二聚体蛋白,其包含第一和第二单链蛋白,其中所述第一单链蛋白包含第一氨基酸序列,所述第一氨基酸序列由以下组成(从n末端至c末端):
(ia)第一vl结构域,
(iia)第一多肽接头,以及
(iiia)第二vl结构域,并且
其中所述第二单链蛋白包含第二氨基酸序列,所述第二氨基酸序列由以下组成(从n末端至c末端):
(ib)第一vh结构域,
(iib)第二多肽接头,以及
(iiib)第二vh结构域,并且
其中所述第一vl结构域与所述第一或所述第二vh结构域形成对第一靶抗原具有特异性的第一可变结构域同源对,并且所述第二vl结构域与另一个所述vh结构域形成对第二靶抗原具有特异性的第二可变结构域同源对,其中所述靶抗原之一是人血清白蛋白,另一个所述靶抗原是人cd3,
并且,其中所述第一或所述第二单链蛋白中的至少一个还包含
(iv)至少一个作为第三功能结构域的额外的结构域,其通过第三多肽接头与所述第一或所述第二氨基酸序列融合。
在整篇说明书和随后的权利要求书中,除非上下文另有要求,否则词语“包含”将被理解为暗示包含所述整体、组合物或步骤或整体或步骤的组,而任意额外的整体、组合物或步骤或整体、组合物或步骤的组也可任选地存在,包括其中不存在额外的整体、组合物或步骤或整体、组合物或步骤的组的实施方案。关于这些后面的实施方案,术语“包含”因此包括范围较窄的术语“由......组成”。
在本说明书全文中引用了若干文献。无论是上文还是下文,本文引用的每个文件(包括所有专利、专利申请、科学出版物、制造商说明书、说明书、genbank登录号序列提交等)其整体通过引用并入本文至在相应专利法下可能的程度。本文中没有任何内容被解释为承认本发明无权通过在先发明早于这些公开。
在本发明的上下文中,术语“vl结构域”和“vh结构域”分别指抗体的可变轻链结构域和可变重链结构域。在本发明的上下文中,术语“抗体”是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即含有特异性结合抗原的抗原结合位点的分子,即包括至少包含抗体的抗原结合片段的抗体部分。
在本发明的上下文中,如果抗体或任意结合分子(一般而言)与作为靶标的抗原/同源结合配偶体具有100μm或更小,优选50μm或更小,优选30μm或更小,优选20μm或更小,优选10μm或更小,优选5μm或更小,更优选1μm或更小,更优选900nm或更小,更优选800nm或更小,更优选700nm或更小,更优选600nm或更小,更优选500nm或更小,更优选400nm或更小,更优选300nm或更小,更优选200nm或更小,甚至更优选100nm或更小,甚至更优选90nm或更小,甚至更优选80nm或更小,甚至更优选70nm或更小,甚至更优选60nm或更小,甚至更优选50nm或更小,甚至更优选40nm或更小,甚至更优选30nm或更小,甚至更优选20nm或更小,甚至更优选10nm或更小的解离常数kd,则所述抗体或任意结合分子被认为与所述抗原(对于抗体的情况)或与所述同源结合配偶体(通常对于结合分子的情况)“特异性结合”。
在本发明的上下文中,术语“功能结构域”是指具有预定义的功能,例如酶活性或与同源配体特异性结合的蛋白类(proteinaceous)结构域,其中所述蛋白类结构域是至少具有二级结构元件的结构域。用于确定多肽或蛋白质中二级结构的存在的方法,例如x-射线晶体法、圆二色谱法(cd)、振动圆二色谱法(vcd)、nmr或ft-ir,或用于预测多肽中二级结构的存在的方法,例如pep-fold(shen等人,j.chem.theor.comput.10(2014)4745-4758)是本领域技术人员所熟知的。在具体的实施方案中,所述蛋白类结构域是具有三级结构的结构化的结构域。在具体的实施方案中,所述蛋白类结构域包含至少约20个氨基酸残基(参见heitz等人,biochemistry38(1999)10615-25),特别是至少约50个氨基酸残基,更特别是至少约100个氨基酸残基。在具体的实施方案中,功能结构域是特异性结合同源配体的蛋白类结构域。在具体的实施方案中,功能结构域是特异性结合抗原的抗体或抗体的免疫学活性部分。
在本发明的上下文中,术语“多肽接头”是指由通过肽键连接的氨基酸残基的链组成的接头,其连接两个结构域,每个结构域与接头的一端连接。在具体的实施方案中,多肽接头具有2至30个氨基酸残基(例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸残基)的连续链。在具体的实施方案中,多肽接头是非结构化的多肽。如上所述,用于确定多肽中二级结构的存在的方法,例如x-射线晶体法、圆二色谱法(cd)、振动圆二色谱法(vcd)、nmr或ft-ir,或用于预测多肽中二级结构的存在的方法,流入pep-fold(shen等人,j.chem.theor.comput.10(2014)4745-4758)是本领域技术人员所熟知的。在具体的实施方案中,接头由选自甘氨酸和丝氨酸残基的氨基酸残基组成。
本发明的特征如下:
·使用抗体可变结构域来产生异源二聚体形式,其中至少两个vl结构域位于一条蛋白链上,而相应的vh结构域位于第二条蛋白链上。
·异源二聚体核心结构域允许附加额外的功能结构域,例如结合结构域,以产生三、四、五或六特异性实体。
·异源二聚体核心组装体的高效配对的多个实例。
·组合筛选共享一个共同的异源二聚体核心结构域的多个结合结构域混合物的简单解决方案。
在一个具体的实施方案中,本发明涉及一种异源二聚体蛋白,其中所述第一或所述第二单链蛋白还包含
(v)第四功能结构域,其通过第四多肽接头与所述第一或所述第二氨基酸序列融合。
在一个具体的实施方案中,本发明涉及一种异源二聚体蛋白,其中所述第一或所述第二单链蛋白还包含
(vi)第五功能结构域,其通过第五多肽接头与所述第一或所述第二氨基酸序列融合。
在一个具体的实施方案中,本发明涉及一种异源二聚体蛋白,其中所述第一或所述第二单链蛋白还包含
(vii)第六功能结构域,其通过第六多肽接头与所述第一或所述第二氨基酸序列融合。
在具体的实施方案中,所述异源二聚体蛋白包含所述第三和所述第四功能结构域。在这样的实施方案中,所述异源二聚体蛋白是四价的,在具体的实施方案中,所述异源二聚体蛋白是四特异性的。
在具体的实施方案中,所述异源二聚体蛋白包含所述第三、所述第四、所述第五和所述第六功能结构域。在这样的实施方案中,所述异源二聚体蛋白是六价的,在具体的实施方案中,所述异源二聚体蛋白是六特异性的。
在具体的实施方案中,所述异源二聚体蛋白不包含第一和第二免疫球蛋白恒定结构域的同源对,其中,所述第一免疫球蛋白恒定结构域被包含在所述第一单链蛋白中,并且其中,所述第二免疫球蛋白恒定结构域被包含在所述第二单链蛋白中。在具体的实施方案中,所述第一和所述第二单链蛋白中的至少一个不包含免疫球蛋白恒定结构域。在具体的实施方案中,所述第一和所述第二单链蛋白均不包含免疫球蛋白恒定结构域。
在具体的实施方案中,除了(i)所述第一vl结构域和所述第一vh结构域的同源对以及(ii)所述第二vl结构域和所述第二vh结构域的同源对,所述异二聚体蛋白不包含所述第一单链蛋白中包含的第一蛋白类相互作用结构域和所述第二单链蛋白中包含的第二蛋白类相互作用结构域的同源对。
在具体实施方案中,与包含相同靶抗原结合结构域和相同cd3结合结构域的单链双抗体(scdb)相比,所述异源二聚体蛋白(其中所述第三、所述第四、所述第五和所述第六功能结构域中的至少一个与靶细胞表面上表达的靶抗原结合)在相似t细胞活化的时间点触发的细胞因子水平降低,如通过在生理浓度的hsa存在下体外测量表达在nfat的控制下的荧光素酶报告基因的jurkatt细胞中的荧光素酶活性所评估的。在具体的实施方案中,所述细胞因子是与细胞因子释放综合征相关的t细胞衍生的细胞因子,例如il-2、il-10、il-6、tnf-α和/或干扰素-γ,优选il-2。在具体的实施方案中,与scdb相比,所述细胞因子水平低至少两倍,优选三倍,更优选四倍,最优选五倍。在具体的实施方案中,如实施例中所述进行荧光素酶活性和细胞因子水平的测定。
在具体实施方案中,与包含相同靶抗原结合结构域和相同cd3结合结构域的单链双抗体(scdb)相比,所述异源二聚体蛋白(其中所述第三、所述第四、所述第五和所述第六功能结构域中的至少一个与靶细胞表面上表达的靶抗原结合)达到相似t细胞活化的动力学较慢,如通过在生理浓度的hsa存在下体外测量表达在nfat的控制下的荧光素酶报告基因的jurkatt细胞中的荧光素酶活性所评估的。在具体的实施方案中,与scdb相比,所述动力学慢至少两倍,优选三倍,最优选四倍。在具体的实施方案中,如实施例中所述进行荧光素酶活性和细胞因子水平的测定。
在具体实施方案中,与包含相同靶抗原结合结构域和相同cd3结合结构域的单链双抗体(scdb)相比,所述异源二聚体蛋白(其中所述第三、所述第四、所述第五和所述第六功能结构域中的至少一个与靶细胞表面上表达的靶抗原结合)在相似t细胞活化的时间点引起的细胞因子水平降低,如通过在生理浓度的hsa存在下体外cd69表达所评估的。在具体的实施方案中,所述细胞因子是与细胞因子释放综合征相关的t细胞衍生的细胞因子,例如il-2、il-10、il-6、tnf-α和/或干扰素-γ,优选il-2。在具体的实施方案中,与scdb相比,所述细胞因子水平低至少两倍,优选三倍,更优选四倍,最优选五倍。在具体的实施方案中,如实施例中所述进行cd69表达和细胞因子水平的测定。
在具体实施方案中,与包含相同靶抗原结合结构域和相同cd3结合结构域的单链双抗体(scdb)相比,所述异源二聚体蛋白(其中所述第三、所述第四、所述第五和所述第六功能结构域中的至少一个与靶细胞表面上表达的靶抗原结合)在生理浓度的hsa存在下在体外相似靶细胞裂解程度的时间点导致的细胞因子水平降低。在具体的实施方案中,所述细胞因子是与细胞因子释放综合征相关的t细胞衍生的细胞因子,例如il-2、il-10、il-6、tnf-α和/或干扰素-γ,优选il-2。在具体实施方案中,与scdb相比,所述细胞因子水平低至少两倍,优选三倍,更优选四倍,最优选五倍。在具体的实施方案中,如实施例中所述进行细胞因子水平的测定。
在具体实施方案中,与包含相同靶抗原结合结构域和相同cd3结合结构域的单链双抗体(scdb)相比,所述异源二聚体蛋白(其中所述第三、所述第四、所述第五和所述第六功能结构域中的至少一个与靶细胞表面上表达的靶抗原结合)在生理浓度的hsa存在下在体外达到相似靶细胞裂解程度的动力学较慢。在具体的实施方案中,与scdb相比,所述动力学慢至少两倍,优选三倍,最优选四倍。在具体实施方案中,如实施例中所述进行靶细胞裂解动力学的测定。
在具体实施方案中,与包含相同靶抗原结合结构域和相同cd3结合结构域的单链双抗体(scdb)相比,所述异源二聚体蛋白(其中所述第三、所述第四、所述第五和所述第六功能结构域中的至少一个与靶细胞表面上表达的靶抗原结合)具有达到相似最大靶细胞裂解的能力。在具体实施方案中,如实施例中所述进行靶细胞裂解的确定。
在具体的实施方案中,所述第一多肽接头由5至20个氨基酸残基,特别是由6至15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4;并且n选自1、2、3、4和5。
在具体的其他实施方案中,所述第一多肽接头由11至20个氨基酸残基,特别是由11至15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4;并且n选自3、4和5。
在具体的实施方案中,所述第二多肽接头由5至20个氨基酸残基,特别是由6至15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4;并且n选自1、2、3、4和5。
在具体的其他实施方案中,所述第二多肽接头由11至20个氨基酸残基,特别是由11至15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4;并且n选自3、4和5。
在具体的实施方案中,所述第三、第四、第五和/或第六多肽接头由8至20个氨基酸残基,特别是由10至15个氨基酸残基组成。在具体的实施方案中,所述多肽接头独立地具有序列(gms)n;其中m独立地选自2、3和4,特别是4;并且n选自1、2、3、4和5,特别是选自2和3。
在具体的实施方案中,所述第一vl结构域(ia)和所述第一vh结构域(ib)形成对第一靶抗原具有特异性的第一可变结构域同源对,并且所述第二vl结构域(iia)和所述第二vh结构域(iib)形成对第二靶抗原具有特异性的第二可变结构域同源对。在这样的实施方案中,所述第一和所述第二单链蛋白以所述单链蛋白的平行排列方式形成所述异源二聚体蛋白(参见图15)。
在具体的这种实施方案中,所述第一多肽接头由10至20个氨基酸残基,特别是由12至17个氨基酸残基,特别是由15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4,特别是4;并且n选自1、2、3、4和5,特别是3。
在具体的这种实施方案中,所述第二多肽接头由10至20个氨基酸残基,特别是由12至17个氨基酸残基,特别是由15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4,特别是4;并且n选自1、2、3、4和5,特别是3。
在具体的这种实施方案中,所述第三、第四、第五和/或第六多肽接头由10至20个氨基酸残基,特别是由12至17个氨基酸残基,特别是由15个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4,特别是4;并且n选自1、2、3、4和5,特别是3。
在具体的其他实施方案中,所述第一vl结构域(ia)和所述第二vh结构域(iib)形成对第一靶抗原具有特异性的第一可变结构域同源对,并且所述第二vl结构域(iia)和所述第一vh结构域(ib)形成对第二靶抗原具有特异性的第二可变结构域同源对。在这样的实施方案中,所述第一和所述第二单链蛋白以所述单链蛋白的反平行排列方式形成所述异源二聚体蛋白(参见图14)。
在具体的这种实施方案中,所述第一多肽接头由5至12个氨基酸残基,特别是由5至10个氨基酸残基,特别是由6个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4,特别是2;并且n选自1、2、3、4和5,特别是2。
在具体的这种实施方案中,所述第二多肽接头由5至12个氨基酸残基,特别是由6至10个氨基酸残基,特别是由8个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4,特别是3;并且n选自1、2、3、4和5,特别是2。
在具体的这种实施方案中,所述第三、第四、第五和/或第六多肽接头由10至20个氨基酸残基,特别是由8至12个氨基酸残基,特别是由10个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(gms)n;其中m独立地选自2、3和4,特别是4;并且n选自1、2、3、4和5,特别是2。
在反平行排列的另一个具体实施方案中,所述第一和所述第二多肽接头各自由10至20个氨基酸残基组成,包含40至60%的带电荷残基,特别是由12至16个氨基酸残基组成,包含50%的带电荷残基,在每种情况下,其中两个接头能够通过形成带正电荷的残基和带负电荷的残基的链间对而相互作用。在具体实施方案中,在所述第一接头和第二接头中的一个上的带电荷残基仅是带正电荷的残基,并且在所述第一接头和第二接头中的另一个上的带电荷残基仅是带负电荷的残基,特别地其中所述第一接头和第二接头选自:seqidno.16和17。
在具体的实施方案中,所述第三、第四、第五和/或第六功能结构域独立地选自下列:结合结构域、毒素、酶、激素和信号传导蛋白。
在具体的实施方案中,所述第三、第四、第五和/或第六功能结构域独立地选自结合结构域。
在具体的这种实施方案中,结合结构域独立地选自下列:基于抗体的结合结构域,包括但不限于scfv、fab和单个抗体可变结构域,基于来自鲨鱼的vnar结构的单结构域抗体,以及基于替代骨架的结合结构域,包括但不限于基于锚蛋白的结构域、菲诺体(fynomer)、avimer、模拟抗体(anticalin)、纤连蛋白和构建到抗体的恒定区的结合位点(例如f-star技术;参见例如wozniak-knoppetal.,proteineng.des.sel.23(2010)289-297)。
在具体的这种实施方案中,所述结合结构域是基于抗体的结合结构域,其选自:单链fv片段和单抗体可变结构域。
在某些这种实施方案中,这种单链fv片段中的可变结构域的顺序选自(从n端至c端)vl-(接头)-vh和vh-(接头)-vl。在某些实施方案中,对于包含在异源二聚体蛋白中的所有单链fv片段,可变结构域的顺序是相同的。在某些实施方案中,三个vl结构域分别通过所述第一多肽接头和所述第三、第四和第五多肽接头中的一个彼此连接,例如,其中顺序为vl-(接头)-vh的单链fv片段是所述第一氨基酸序列的c-末端。在某些实施方案中,三个vl结构域分别通过所述第二多肽接头和所述第三、第四和第五多肽接头中的一个彼此连接,例如,其中顺序为vl-(接头)-vh的单链fv片段是所述第二氨基酸序列的n-末端(参见图12、13和15)。因此,在某些实施方案中,所述第一和所述第二单链蛋白中的至少一个分别包含由通过两个多肽接头连接的三个vl结构域或三个vh结构域组成的氨基酸序列。
在某些其他实施方案中,通过相应的接头与所述第一或第二氨基酸序列的n-末端和/或c-末端直接相连的任意这种基于抗体的结合结构域的可变结构域是(a)在其与所述第一氨基酸序列融合的情况下,是vh结构域,以及(b)在其与所述第二氨基酸序列融合的情况下,是vl结构域。因此,vh结构域与vl-接头-vl核心区域的n-末端和/或c-末端融合,并且vl结构域与vh-接头-vh核心区域的n-末端和/或c-末端融合(例如参见图14)。
在具体的实施方案中,所述第三、第四、第五和/或第六结合结构域是单链fv片段。
在具体的这种实施方案中,连接所述单链fv片段的可变结构域的多肽接头由15至25个氨基酸残基,特别是20个氨基酸残基组成。在具体的实施方案中,所述多肽接头具有序列(ggggs)n,其中n选自3、5和4,特别是4。
在具体的实施方案中,至少一个所述抗体可变结构域包含源自亲本兔抗体的cdr区域,如兔cdr固有的特定模式所证明的。
在具体的实施方案中,至少一个所述抗体可变结构域包含人框架区域(frameworkregion)。
在具体的实施方案中,所述第一单链蛋白和所述第二单链蛋白通过至少一个二硫键交联。
在具体的实施方案中,所述二硫键在第一半胱氨酸残基与第二半胱氨酸残基之间形成,所述第一半胱氨酸残基侧接所述第一或所述第二vl结构域,所述第二半胱氨酸残基侧接所述第一或所述第二vh结构域。
在具体实施方案中,所述二硫键在第一半胱氨酸残基与第二半胱氨酸残基之间形成,所述第一半胱氨酸残基包含在所述第一或所述第二vl结构域的框架区域中,所述第二半胱氨酸残基包含在所述第一或所述第二vh结构域的框架区域中。
在具体实施方案中,所述第一半胱氨酸残基位于所述第一或所述第二vl结构域的141位,并且所述第二半胱氨酸残基位于所述第一或所述第二vh结构域的51位。
在本发明的上下文中,用于抗体可变结构域的编号系统基于根据honegger和plückthun(a.honegger&a.plückthun."yetanothernumberingschemeforimmunoglobulinvariabledomains:anautomaticmodelingandanalysistool".j.mol.biol,309(2001)657-670)的编号系统(“aho编号”)。
在一个具体的实施方案中,对人血清白蛋白具有特异性的所述可变结构域同源对包含存在于人抗体vl框架中选自seqidno:10、12和14的vl蛋白序列之一中的三个vlcdr,其中所述vl框架包含vκ框架fr1、fr2和fr3特别是vκ1框架,和框架fr4,所述框架fr4选自vκfr4特别是vκ1fr4,和vλ框架4,以及存在于人抗体vh框架(特别是vh3框架)中选自seqidno:11、13和15的vh蛋白序列之一中的三个vhcdr。
在本发明的上下文中,通过与wo97/08320中所示的人抗体的序列比对来进行对vκ、vλ和/或vh构架的分配。根据honegger&plückthun(在上文中引用)使用框架和cdr的定义。
在具体的这种实施方案中,至少一个所述vl结构域包含(i)人vκ框架区域fr1至fr3,特别是人vκ1框架区域fr1至fr3;(ii)cdr结构域cdr1、cdr2和cdr3;和(iii)框架区域iv,其选自
a.用于框架区域iv的人vλ种系序列,特别是选自下列的vλ种系序列:seqidno:24至30(根据wo2014/206561的seqidno.16至22);
b.基于vλ的序列,其是(bi)来自用于框架区域iv的人vλ种系序列的共有vλ序列,特别是seqidno:25(根据wo2014/206561的seqidno.17);或者是(bii)来自用于框架区域iv的重排的人vλ序列的共有vλ序列,特别是选自下列的vλ共有序列:seqidno:24和25(根据wo2014/206561的seqidno.16和17);和
c.基于vλ的序列,与用于框架区域iv的最接近的人vλ种系序列相比,其具有一个或两个突变,特别是一个突变。
在一个具体的实施方案中,对人血清白蛋白具有特异性的所述可变结构域同源对包含(i)与根据seqidno:10或seqidno:12或seqidno:14的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和/或(ii)与根据seqidno:11或seqidno:13或seqidno:15的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域。
在一个具体的实施方案中,对人血清白蛋白具有特异性的所述可变结构域同源对包含(i)与根据seqidno:10的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:11的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域;或(ii)与根据seqidno:12的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:13的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域;或(iii)与根据seqidno:14的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:15的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域。
在一个更具体的实施方案中,对人血清白蛋白具有特异性的所述可变结构域同源对包含
(i)与根据seqidno:10的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:10的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:11的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:11的vh序列的cdr结构域cdr1、cdr2和cdr3;或
(ii)与根据seqidno:12的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:12的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:13的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:13的vh序列的cdr结构域cdr1、cdr2和cdr3,优选地,其中所述vl结构域包含k50q和a51p(aho编号),并且所述vh结构域包含w54y、v103t和y105f(aho编号)。
在一个更具体的实施方案中,对人血清白蛋白具有特异性的所述可变结构域同源对包含与根据seqidno:14的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:14的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:15的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:15的vh序列的cdr结构域cdr1、cdr2和cdr3,优选地,其中所述vl结构域包含i2v、q3v、k50q和a51p(aho编号),并且所述vh结构域包含i55v、v103t、y105f(aho编号)。
在一个具体实施方案中,对人血清白蛋白具有特异性的所述可变结构域同源对包含vl结构域,所述vl结构域包含选自seqidno:10、12和14的蛋白质序列的至少5至140位,特别是至少3至145位,和vh结构域,所述vh结构域包含选自seqidno:11、13和15的蛋白质序列的至少5至140位,特别是至少3至145位(根据honegger&plückthun的位置,在上述引文中),特别地,其中对人血清白蛋白具有特异性的所述可变结构域同源对包含选自seqidno:10、12和14的vl结构域和选自seqidno:10、12和14的vh结构域。
在具体实施方案中,对人cd3具有特异性的所述可变结构域同源对包含存在于人抗体vl框架中选自seqidno:2、4、6和8的vl蛋白序列之一中的三个vlcdr,其中vl框架包含vκ框架fr1、fr2和fr3特别是vκ1框架,和框架fr4,所述框架fr4选自vκfr4特别是vκ1fr4,和vλ框架4,以及存在于人抗体vh框架(特别是vh3框架)中选自seqidno:3、5、7和9的vh蛋白序列之一中的三个vhcdr。
在具体的这种实施方案中,至少一个所述vl结构域包含(i)人vκ框架区域fr1至fr3,特别是人vκ1框架区域fr1至fr3;(ii)cdr结构域cdr1、cdr2和cdr3;和(iii)框架区域iv,其选自
a.用于框架区域iv的人vλ种系序列,特别是选自下列的vλ种系序列:seqidno:24至30(根据wo2014/206561的seqidno.16至22);
b.基于vλ的序列,其是(bi)来自用于框架区域iv的人vλ种系序列的共有vλ序列,特别是seqidno:25(根据wo2014/206561的seqidno.17);或者是(bii)来自用于框架区域iv的重排的人vλ序列的共有vλ序列,特别是选自下列的vλ共有序列:seqidno:24和25(根据wo2014/206561的seqidno.16和17);和
c.基于vλ的序列,与用于框架区域iv的最接近的人vλ种系序列相比,其具有一个或两个突变,特别是一个突变。
在一个具体实施方案中,对人cd3具有特异性的所述可变结构域同源对包含(i)与根据选自seqidno:2、4、6和8的序列的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和/或(ii)与根据选自seqidno:3、5、7和9的序列的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域。
在一个具体实施方案中,对人cd3具有特异性的所述可变结构域同源对包含(i)与根据seqidno:2的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:3的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域;或(ii)与根据seqidno:4的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:5的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域;或(iii)与根据seqidno:6的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:7的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域;或(iv)与根据seqidno:8的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,和与根据seqidno:9的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域。
在一个更具体的实施方案中,对人cd3具有特异性的所述可变结构域同源对包含
(i)与根据seqidno:2的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:2的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:3的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:3的vh序列的cdr结构域cdr1、cdr2和cdr3;优选地,其中所述vl结构域包含y44f、k50q、a51s和l54r(aho编号),并且所述vh结构域包含e53a、v103t和y105f(aho编号),或
(ii)与根据seqidno:4的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:4的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:5的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:5的vh序列的cdr结构域cdr1、cdr2和cdr3;优选地,其中所述vl结构域包含y44f、k50q、a51s和l54r(aho编号),并且所述vh结构域包含e53a、v103t和y105f(aho编号),或
(iii)与根据seqidno:6的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:6的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:7的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:7的vh序列的cdr结构域cdr1、cdr2和cdr3;或
(iv)与根据seqidno:8的vl序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vl结构域,其中所述vl结构域包含取自根据seqidno:8的vl序列的cdr结构域cdr1、cdr2和cdr3,和与根据seqidno:9的vh序列具有至少60、70、80、90、91、92、93、94、95、96、97、98或99%,优选至少90%序列同一性的vh结构域,其中所述vh结构域包含取自根据seqidno:9的vh序列的cdr结构域cdr1、cdr2和cdr3。
在具体实施方案中,对人cd3具有特异性的所述可变结构域同源对包含vl结构域,所述vl结构域包含选自seqidno:2、4、6和8的蛋白质序列的至少5至140位特别是至少3至145位,和vh结构域,所述vh结构域包含选自seqidno:3、5、7和9的蛋白质序列的至少5至140位特别是至少3至145位(根据honegger&plückthun的位置,在上述引文中),特别地,其中对人cd3具有特异性的所述可变结构域同源对包含选自seqidno:2、4、6和8的vl结构域和选自seqidno:3、5、7和9的vh结构域。
在具体的所述实施方案中,所述第三、第四、第五和/或第六结合结构域是对选自下列的靶标具有特异性的单链fv片段:癌症靶标,和存在于免疫效应细胞上的靶标。
在本申请的上下文中,术语“靶标”是指结合结构域的同源结合配偶体,例如由这种结合结构域特异性结合的抗体的抗原。
在具体的实施方案中,所述靶标是癌症靶标,特别是与非肿瘤细胞表面相比,其以增加的浓度和/或以不同的空间构型存在于一种或多种肿瘤细胞类型或肿瘤相关细胞的表面上的抗原或抗原表位。特别地,所述癌症靶标存在于一种或多种肿瘤或肿瘤基质细胞类型的表面上,但不存在于非肿瘤细胞的表面上。
在其他具体的实施方案中,所述靶标是优先在参与自身免疫疾病的细胞上表达的抗原或抗原表位。在其他实施方案中,所述抗原或抗原表位优先在参与炎症疾病的细胞上表达。
在某些实施方案中,所述第一和所述第二单链蛋白选自下列,其中,vla、vlb、vha和vhb分别对应于所述第一和第二vl和vh结构域,并且vlc、vld、vle、vlf、vhc、vhd、vhe和vhf是带有接头的单链片段的一部分,对应于分别通过第三、第四、第五和/或第六接头(接头3、接头4、接头5和接头6)与核心结构域(以粗体字母表示)连接的所述第三、第四、第五和/或第六功能结构域;所有构建体都以n-末端至c-末端的方向书写:
a(平行;6fvs):
链1:vlc-(接头)-vhc-(接头3)-vla-(接头1)-vlb-(接头4)-vld-(接头)-vhd
链2:vle-(接头)-vhe-(接头5)-vha-(接头2)-vhb-(接头6)-vlf-(接头)-vhf
b(反向平行6fvs):
链1:vlc-(接头)-vhc-(接头3)-vla-(接头1)-vlb-(接头4)-vld-(接头)-vhd
链2:vle-(接头)-vhe-(接头5)-vhb-(接头2)-vha-(接头6)-vlf-(接头)-vhf
c1(反向平行4fvs)(参见图12):
链1:vlc-(接头)-vhc-(接头3)-vla-(接头1)-vlb
链2:vld-(接头)-vhd-(接头4)-vhb-(接头2)-vha
c2(反向平行4fvs)(参见图14):
链1:vlc-(接头)-vhc-(接头3)-vla-(接头1)-vlb
链2:vhb-(接头2)-vha-(接头4)-vld-(接头)-vhd
c3(反向平行4fvs):
链1:vla-(接头1)-vlb-(接头3)-vlc-(接头)-vhc
链2:vld-(接头)-vhd-(接头4)-vhb-(接头2)-vha
c4(反向平行4fvs):
链1:vla-(接头1)-vlb-(接头3)-vlc-(接头)-vhc
链2:vhb-(接头2)-vha-(接头4)-vld-(接头)-vhd
d1(平行4fvs)(参见图15):
链1:vlc-(接头)-vhc-(接头3)-vla-(接头1)-vlb
链2:vld-(接头)-vhd-(接头4)-vha-(接头2)-vhb
d2(平行4fvs):
链1:vlc-(接头)-vhc-(接头3)-vla-(接头1)-vlb
链2:vha-(接头2)-vhb-(接头4)-vld-(接头)-vhd
d3(平行4fvs):
链1:vla-(接头1)-vlb-(接头3)-vlc-(接头)-vhc
链2:vld-(接头)-vhd-(接头4)-vha-(接头2)-vhb
d4(平行4fvs):
链1:vla-(接头1)-vlb-(接头3)-vlc-(接头)-vhc
链2:vha-(接头2)-vhb-(接头4)-vld-(接头)-vhd
在某些实施方案中,包含在根据异源二聚体形式a、b、c1至c4或d1至d4构建体中的一个或多个scfv片段中的vh和vl结构域的顺序为相反的顺序(例如,构建体的链1中vhc-(接头)-vlc-(接头3)-vla-(接头1)-vlb-(接头4)-vhd-(接头)-vld)。
在这些形式中,在一条蛋白链上的两个分开的可变重结构域vha和vhb以及在另一条蛋白链上的两个对应的可变轻结构域vla和vlb的定位(vh-vh/vl-vl)防止了链内结构域配对的形成,链内结构域配对的形成产生无活性的单链双抗体(scdb)样结构,如同使用传统双抗体的vh-vl/vh-vl取向——类似于kipriyanov等人提出的设计——来驱动异源二聚化的情况一样。相比之下,vh-vh/vl-vl取向迫使仅有异源二聚体双特异性至六特异性蛋白形成。
由于vha与vlb和vhb与vla的不适当配对会形成vha-vlb和vhb-vla对,理论上存在以下可能:结合靶标a和b的vha-vhb/vla-vlb核心结构域的vh/vl结构域配对将导致无活性核心结构域。出乎意料的且令人震惊的是,迄今为止还没有观察到这种无活性变体。不希望受理论束缚,由于相对于不匹配配对中发生的潜在的组装干扰,同源对的cdr的组装更有效,所以二聚化可以朝向同源配对驱动。
为了进一步驱动异源二聚化朝向vh-vh/vl-vl核心结构域中的活性配对,可以在vh-vh/vl-vl核心结构域的一个或两个(如果相互应用)vl/vh对中应用knob-into-hole或类似技术。因此,在某些实施方案中,所述异源二聚体蛋白的vh-vh/vl-vl核心结构域中的活性配对还被选自以下的技术支持:knob-into-hole(zhu等人,“remodelingdomaininterfacestoenhanceheterodimerformation”,proteinsci1997apr;6(4):781–788.)和链间半胱氨酸桥。
第二方面,本发明涉及编码所述第一和第二单链蛋白的一种或两种核酸序列。
第三方面,本发明涉及包含所述一种或两种核酸序列的一种或两种载体。
第四方面,本发明涉及包含所述一种或两种载体的一种宿主细胞或多种宿主细胞。
第四方面,本发明涉及用于生产本发明的第一和第二单链蛋白或异源二聚体蛋白的方法,其包含(i)提供根据本发明的一种核酸或多种核酸或根据本发明的一种载体或多种载体,表达所述一种核酸或多种核酸或所述一种载体或多种载体,并从表达系统收集所述第一和第二单链蛋白,或所述异源二聚体蛋白,或者(ii)提供本发明的一种宿主细胞或多种宿主细胞,培养所述一种宿主细胞或多种宿主细胞,并从细胞培养物收集所述第一和第二单链蛋白,或所述异源二聚体蛋白。
第五方面,本发明涉及一种药物组合物,其包含本发明的异源二聚体蛋白和药学上可接受的载体。药学上可接受的载体增强或稳定组合物,或促进组合物的制备。药学上可接受的载体包括生理上相容的溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等。
第六方面,本发明涉及本发明的异源二聚体蛋白,其用于治疗疾病,特别是人类疾病,更特别是选自癌症、炎性疾病和自身免疫疾病的人类疾病。在具体实施方案中,所述第三、第四、第五或第六功能结构域中的至少一种能够与相应疾病的治疗相关靶标特异性相互作用。
如本文所用,术语“治疗(treatment)”、“治疗(treating)”、“治疗(treat)”、“治疗(treated)”等是指获得期望的药理和/或生理效果。就部分或完全治愈疾病和/或归因于该疾病的不良影响或延迟疾病进展而言,该作用可能是治疗性的。如本文所用,“治疗”涵盖在哺乳动物例如在人类中对疾病的任何治疗,并且包括:(a)抑制疾病,例如阻止其发展;和(c)减轻疾病,例如使疾病消退。
第七方面,本发明涉及一种治疗疾病特别是人类疾病更特别是选自癌症、炎症和自身免疫疾病的人类疾病的方法,所述方法包括施用本发明的异源二聚体蛋白的步骤,其中,所述第三、第四、第五或第六功能结构域中的至少一种能够与相应疾病中的治疗相关性靶标特异性相互作用。特别地,本发明涉及用于治疗患有疾病的受试者的方法,所述疾病选自癌症、炎症和自身免疫疾病,所述方法包含向所述受试者施用有效量的本发明的异源二聚体蛋白,其中,所述第三、第四、第五或第六功能结构域中的至少一种能够与相应疾病中的治疗相关性靶标特异性相互作用。
术语“受试者”包括人类和非人类动物。非人类动物包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人类灵长类动物、绵羊、狗、牛、鸡、两栖动物和爬行动物。除非另有说明,否则术语“患者”或“受试者”在本文中可互换使用。
术语“有效量(effectiveamount)”或“治疗有效量”或“有效量(efficaciousamount)”是指当施用于哺乳动物或其他受试者以治疗疾病时足以引起对疾病的这种治疗的剂的量。“治疗有效量”将根据剂、疾病及其严重程度以及被治疗受试者的年龄、体重等而变化。
第八方面,本发明涉及本发明的异源二聚体蛋白在制备用于治疗疾病,特别是人类疾病,更特别是选自癌症、炎症和自身免疫疾病的人类疾病的药物中的用途,其中,所述vl和vh结构域的同源对的至少一种或所述第三、第四、第五或第六功能结构域中的至少一种能够与相应疾病中的治疗相关性靶标特异性相互作用。
第九方面,本发明涉及本发明的异源二聚体蛋白在治疗疾病,特别是人类疾病,更特别是选自癌症、炎症和自身免疫疾病的人类疾病中的用途,其中,所述vl和vh结构域的同源对的至少一种或所述第三、第四、第五或第六功能结构域中的至少一种能够与相应疾病中的治疗相关性靶标特异性相互作用。
文献
r1.skerra,a.,andplückthun,a.(1988).assemblyofafunctionalimmunoglobulinfvfragmentinescherichiacoli.science240,1038-1041.
r2.
r3.ridgwayetal.,1996.‘knobs-into-holes’engineeringofantibodych3domainsforheavychainheterodimerization.proteineng.9,617–621.
r4.zhu(1997)remodelingdomaininterfacestoenhanceheterodimerformation.proteinsci.6,781-788
r5.schaefer,w.,etal.,2011b.immunoglobulindomaincrossoverasagenericapproachfortheproductionofbispecificiggantibodies.proc.natl.acad.sci.u.s.a.108,11187–11192.
r6.holligeretal.,.“diabodies”:smallbivalentandbispecificantibodyfragments.proc.natl.acad.sci.u.s.a.90,6444–6448.
r7.arndtetal.,1999.abispecificdiabodythatmediatesnaturalkillercellcytotoxicityagainstxeno-transplantatedhumanhodgkin’stumors.blood94,2562–2568.
r8.kipriyanovetal.,1999.bispecifictandemdiabodyfortumortherapywithimprovedantigenbindingandpharmacokinetics.j.mol.biol.293,41–56.
r9.altetal.,1999.noveltetravalentandbispecificigg-likeantibodymoleculescombiningsingle-chaindiabodieswiththeimmunoglobulingamma1fcorch3region.febslett.454,90–94.
r10.johnsonetal.,2010.effectorcellrecruitmentwithnovelfv-baseddual-affinityre-targetingproteinleadstopotenttumorcytolysisandinvivob-celldepletion.j.mol.biol.399,436–449.
r11.dejongeetal.,(1995)productionandcharacterizationofbispecificsingle-chainantibodyfragments.mol.immunol.32,1405–1412.
r12.reiteretal.,(1994)engineeringinterchaindisulfidebondsintoconservedframeworkregionsoffvfragments:improvedbiochemicalcharacteristicsofrecombinantimmunotoxinscontainingdisulfide-stabilizedfv.proteineng.7,697–704.
r13.pack,p.,andplückthun,a.(1992).miniantibodies:useofamphipathichelicestoproducefunctional,flexiblylinkeddimericfvfragmentswithhighavidityinescherichiacoli.biochemistry31,1579-1584.
r14.schoonjansetal.,fabchainsasanefficientheterodimerizationscaffoldfortheproductionofrecombinantbispecificandtrispecificantibodyderivatives.jimmunol.2000dec15;165(12):7050-7.
r15.orcuttetal.,2009.amodularigg-scfvbispecificantibodytopology.pro-teineng.des.sel.23,221–228.
r16.wu,c.etal.,2007.simultaneoustargetingofmultiplediseasemediatorsbyadual-variable-domainimmunoglobulin.nat.biotechnol.25,1290–1297.
r17.“mabs”;
r18.
r19.yu,y.j.etal.sci.trans.med.3,84ra44(2011).
r20.hintonpr.etal.,2004.engineeredhumaniggantibodieswithlongerserumhalf-livesinprimates.jbiolchem.279(8):6213-6.
r21.spiessetal.,2015.alternativemolecularformatsandtherapeuticapplicationsforbispecificantibodies.molimmunol.2015jan27.
r22.davisetal.,2013.readilyisolatedbispecificantibodieswithnativeimmunoglobulinformat.uspatent8,586,713.regeneronpharmaceuticals,inc.
r23.shahiedls,etal.,bispecificminibodiestargetingher2/neuandcd16exhibitimprovedtumorlysiswhenplacedinadivalenttumorantigenbindingformat.jbiolchem.2004dec24;279(52):53907-14.epub2004oct7.
r24.milstein.candcuello.a.c.(1983)nature,305,537-54
r25.changetal.,thedockandlockmethod:anovelplatformtechnologyforbuildingmultivalent,multifunctionalstructuresofdefinedcompositionwithretainedbioactivity.clincancerres.2007sep15;13(18pt2):5586s-5591s.
r26.deyevetal.,(2003).designofmultivalentcomplexesusingthebarnase·barstarmodule.naturebiotechnology,21(12),1486-1492.
r27.pack,p.,andplückthun,a.(1992).miniantibodies:useofamphipathichelicestoproducefunctional,flexiblylinkeddimericfvfragmentswithhighavidityinescherichiacoli.biochemistry31,1579-1584.
r28.halinetal.(2003).synergistictherapeuticeffectsofatumortargetingantibodyfragment,fusedtointerleukin12andtotumornecrosisfactorα.cancerresearch,63(12),3202-3210.
r29.d.mülleretal.,improvedpharmacokineticsofrecombinantbispecificantibodymoleculesbyfusiontohumanserumalbuminj.biol.chem.,282(2007),pp.12650–12660
r30.ep1293514
r31.milsteinc,andcuelloac(1983)hybridhybridomasandtheiruseinimmunohistochemistry.nature305:537–540
r32.eskanderrn,tewariks:epithelialcell-adhesionmoleculedirectedtrifunctionalantibodyimmunotherapyforsymptommanagementofadvancedovariancancer.clinpharmacol2013,5:55-61.
r33.stieglmaierj,benjaminj,nagorsend:utilizingthebite(bispecifict-cellengager)platformforimmunotherapyofcancer.expertopinbiolther2015,15:1093-1099.
r34.bluemelc,hausmanns,fluhrp,sriskandarajahm,stallcupwb,baeuerlepa,kuferp:epitopedistancetothetargetcellmembraneandantigensizedeterminethepotencyoftcellmediatedlysisbybiteantibodiesspecificforalargemelanomasurfaceantigen.cancerimmunolimmunother2010,59:1197-1209.
r35.
r36.junttilatt,lij,johnstonj,hristopoulosm,clarkr,ellermand,wangbe,liy,mathieum,lig:antitumorefficacyofabispecificantibodythattargetsher2andactivatestcells.cancerres2014,74:5561-5571.
r37.laszlogs,gudgeoncj,harringtonkh,walterrb:t-cellligandsmodulatethecytolyticactivityofthecd33/cd3biteantibodyconstruct,amg330.bloodcancerj2015,5:e340.
r38.arndtc,feldmanna,vonboninm,cartellierim,ewene,koristkas,michalki,stamovas,berndtn,gochtaetal.:costimulationimprovesthekillingcapabilityoftcellsredirectedtotumorcellsexpressinglowlevelsofcd33:descriptionofanovelmodulartargetingsystem.leukemia2014,28:59-69.
r39.comptem,
r40.yarivmazor,krisf.sachsenmeier,chunningyang,annahansen,jessicafilderman,kathymulgrew,herrenwu&williamf.dall’acqua;enhancedtumor-targetingselectivitybymodulatingbispecificantibodybindingaffinityandformatvalence.scientificreports7,articlenumber:40098(2017)doi:10.1038/srep40098
r41.reitery,brinkmannu,leeb,pastani.,engineeringantibodyfvfragmentsforcancerdetectionandtherapy:disulfide-stabilizedfvfragments.natbiotechnol.1996oct;14(10):1239-45.
实施例
实施例1:多特异性形式的构建
方法与结果
构建体设计、表达和纯化
异源二聚体match分子被设计为在异源二聚体核心组装体的分开的可变结构域中包含对cd3ε和hsa的特异性。将结合il23r的scfv连接至每个异源二聚结构域的n-末端。为了使match的两条肽链共价结合并确认异源二聚化核心中相应结构域的正确组装,在抗cd3或抗has结构域的vl/vh接合处中引入了链间二硫键(在[11]中描述)。
产生了许多不同的实施方案,其变化的参数如match排列方式(平行或反平行)、使用的cd3结合结构域(克隆28-21-d09或09-24-h09)、使用的hsa结合结构域(克隆19-01-h04或23-13-a01)和不同的核心接头(seq16-20)。已经详细描述了match形式的两种可能的排列方式(平行或反平行)(wo2016202457),反平行排列方式(ap):链a(vl1-vh1-vh2-vh3)和链b(vl4-vh4-vl3-vl2);和平行排列方式(p):链a(vl1-vh1-vh2-vh3)和链b(vl4-vh4-vl2-vl3)。除了排列方式的变化以外,还对表1和表2中所示的核心结构域、scfv模块和核心接头的不同选择进行了测试:
表1:序列表,cdr残基以粗体突出显示
表2:构建体概述,列出了从n端到c端的序列的组合
为了产生上述构建体,将fv结构域和接头的氨基酸序列回译成相应的核酸序列,将其从头合成。通过标准分子生物学技术(例如sambrook,j.等人,molecularcloning:alaboratorymanual)组装编码序列并克隆到合适的表达载体(例如pcdna3.1,invitrogen)中用于重组蛋白分泌。
根据供应商的方案,使用chogro表达试剂盒(mirusbiollc)通过瞬时转染在cho-s细胞(thermofisher)中产生了match蛋白。待细胞活力降低到80%以下(在37℃和8%co2的回转式振荡下孵育6天后),立刻通过离心收集cho-s上清液,从其中纯化蛋白级分。纯化通过蛋白l亲和纯化完成,用captol树脂(gehealthcare)在固定于
单链双抗体(scdb)形式的标准蛋白如先前所述进行设计[10]。简而言之,将表1中列出的可变结构域以vla-s1-vhb-l1-vlb-s2-vha的方式排列,其中s1和s2是短gs4接头,并且l1是长(gs4)4接头。出于参考目的而产生的分子包括与match构建体相同的fv片段。
通过尺寸排阻高效液相色谱(se-hplc)和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析所有测试的蛋白质的纯度,并通过uv/vis光谱分析蛋白质含量。对于match构建体,通过非还原性sds-page证实了两个异源二聚体的定量二硫键连接。
结果
match构建体变体的sds-page分析在图1中显示,在非还原条件下,观察到了蛋白质条带向共价连接的异源二聚体几乎定量的移位。然而,在还原条件下,观察到了单个链大小的双带。
→由于指定的链间二硫键在vl/vh对的接合处中的位置,链错配的可能性极小,特别是结合spr实验中核心结构域的保守亲和力
通过表面等离子体激元共振(spr)进行亲和力测量
使用biacoret200(generalelectric)或mass-1(sierrasensors)设备通过表面等离子体共振(spr)测量了单链fv(scfv)形式的单个靶标结合结构域以及纯化的异源二聚体match构建体与重组靶标蛋白人il-23受体ecd(il23r)、人cd3γ-ε单链(cd3)和人血清白蛋白(hsa)的结合亲和力。简而言之,通过胺偶联化学将重组蛋白直接固定在cm5(biacore,generalelectric)或高容量传感器芯片(sierrasensors)上。注入不同浓度的靶标结合结构域作为分析物,并测量结合反应(以反应单位(ru)为单位)。在每次注射后,进行再生程序。两次减去(零分析物进样,标准流道)获得的结合数据,并使用相应的软件包进行分析。
结果
表3:异源二聚体match构建体的亲和力
异源二聚体match构建体对每个靶标的亲和力通常与以scfv或scdb形式测得的单个结合结构域的亲和力非常相似。值得注意的是,与scdb标准分子相比,match构建体对il23r的表观亲和力似乎增加了,这可以通过在每个match分子中掺入了两个il23r结合结构域而产生的亲和力效应来解释。
这些数据证明了match构建体中每个可变结构域都保持了结合活性,并证实了同源可变结构域对的正确组装与核心接头的选择、链间二硫键的位置、所用的抗cd3、抗has结构域或所连接的scfv模块无关。
对于各种构建体,观察到了与核心结构域的靶标的亲和力存在某些差异。对于在cd3域的vl/vh接合处中包含二硫键的构建体,pro746中使用的带电荷的核心接头组合(包含seq16和seq17)显示出最佳亲和力。
通过nfat报道基因测定检测的t细胞活化
nfat测定
通过亲本cho-k1细胞系的慢病毒转导产生了稳定表达在cmv启动子控制下的人il23ril12rβ1异源二聚体的cho-k1细胞系。将这些细胞用作nfat报告基因测定中的靶细胞,而亲本cho-k1细胞系用作对照。将在含有25g/l人血清白蛋白(hsa)的50μl测定培养基(rpmi1640,10%fcs)中稀释的25'000个活靶细胞铺在白色平底96孔板中。然后,将25μl在含hsa(25g/l)的测定培养基中稀释的4倍浓缩的测试蛋白添加到合适的孔中。最后,将25μl含50'000个jurkat细胞的含hsa的测定培养基添加到每个孔中,并将板在室温温和搅拌下孵育10分钟。对对应于在37℃、5%co2下的孵育时间的每个时间点(例如5h、22h或30h)制作一块板。为了检测荧光素酶活性,根据制造商的说明书使用了一步荧光素酶测定试剂盒(amsbio)。简而言之,在孵育时间结束时,将荧光素酶试剂底物与荧光素酶试剂缓冲液混合,并向每个孔中加入50μl,并将板在黑暗中于室温孵育15分钟。用topcount(pekinelmer)读取板。将在50μl测定培养基(rpmi1640,10%fcs)中稀释的25'000个活靶细胞铺在白色平底96孔板中。然后,将25μl在测定培养基中稀释的4倍浓缩的测试蛋白添加到合适的孔中。最后,将25μl含50'000个jurkat细胞的测定培养基添加到每个孔中,并将板在室温温和搅拌下孵育10分钟。对对应于在37℃、5%co2下的孵育时间的每个时间点(例如5h、22h或30h)制作一块板,含有或不含有生理浓度的人血清白蛋白。为了检测荧光素酶活性,根据制造商的说明书使用了一步荧光素酶测定试剂盒(amsbio)。简而言之,在孵育时间结束时,将荧光素酶试剂底物与荧光素酶试剂缓冲液混合,并向每个孔中加入50μl,并将板在黑暗中于室温孵育15分钟。用topcount(pekinelmer)读取板。
通过elisa进行il-2定量
在nfat报告基因检测期间的不同时间点,从含有250nm测试分子的孔中收集100μl上清液。根据制造商的说明书,使用il-2elisamaxstandard试剂盒(biolegend)对il-2进行定量。简而言之,将在稀释缓冲液(pbs,1%bsa,0.2%吐温20)中稀释的100μl捕获抗体涂在96孔板maxisorb(nunc)上在4℃过夜。第二天,将板用洗涤缓冲液(pbs,0.005%吐温20)洗涤3次。在室温下,将孔用300μl稀释缓冲液封闭1小时,然后用洗涤缓冲液洗涤3次。接下来,将100μl测试样品的上清液以及100μl每种浓度的标准曲线添加到合适的孔中,并将板在室温振荡下孵育2小时。将板用洗涤缓冲液洗涤3次,然后与检测抗体一起在室温下振荡孵育1小时。再次用洗涤缓冲液洗涤板3次,并向每个孔中加入100μlavidin-hrp,并在室温下振荡孵育30分钟。进行最后三次洗涤,然后添加100μltmb底物溶液。将板在黑暗中孵育15分钟,然后向每个孔中加入100μlstop溶液终止反应。在450nm和570nm处读取吸光度。从450nm处的吸光度减去570nm处的吸光度。
结果
表4:相对于板上(on-plate)标准cd3/hsascdb(pro389),不同match构建体在5小时时间点的t细胞活化测定的列表数据
孵育5小时后,在nfat报告基因测定中对match构建体变体进行功能分析,显示了激活t细胞的能力。为了在不同板之间进行比较,将数据归一化为板上标准。
为了进一步深入表征,使用了亲和力最高的match构建体(对于cd3)pro746,该构建体也显示出激活t细胞的最佳效能。此外,使用构建体pro821和pro824来:a)在不同的靶向结构域(在这种情况下为抗her2)的情况下评估hsa/cd3核心结构域的功能活性,和b)评估二硫键在hsa结合域而不是抗cd3结构域中的替代位置。
在多个时间点和分子浓度下,确定了在携带抗原的靶细胞和生理浓度的人血清白蛋白(hsa)的存在下,分子激活t细胞的能力(见图2)。将异源二聚体match(pro746)与具有cd3ε和il23r特异性的双特异性scdb(pro624)和结合了match异源二聚体核心(cd3ε和hsa)中的特异性的双特异性scdb作为阴性对照(pro811)进行了比较。数据显示,尽管阴性对照几乎未显示t细胞活化,但在早期时间点和晚期时间点,scdbpro624在表达il23r的靶细胞存在下均显示t细胞强烈活化。信号幅度在两个时间点都达到饱和,从5到30小时的孵育,ec50大约提高了七倍(从141.8pm到19.8pm)。有趣的是,从5到30小时的孵育大约是五倍。有趣的是,match分子pro746在t细胞活化中表现出明显的时间依赖性。尽管5小时响应仅显示出较低的信号幅度,但match-4的响应在30小时后达到了与scdb的scdb极为相似的信号幅度。在所有时间点,ec50均大致保持比scdb高五倍(5小时后为266.3pm,30小时后为102.2pm)(参见时间点(参见图4))。因此,两种形式的主要区别在于t细胞活化的动力学(另请参见图3),而不是最大活化潜能。
在没有靶蛋白的细胞的存在下,不同分子的t细胞活化图(图3)显示几乎没有t细胞活化,即使浓度远高于在存在靶细胞的情况下t细胞活化的ec50浓度。再加上pro811没有活化t细胞,证实了含有hsa/cd3核心结构域的分子需要靶细胞结合来活化t细胞。缺乏非特异性激活t细胞是避免t细胞募集疗法产生不良副作用的先决条件。
剂量响应信号在不同时间点的平稳值图(图4)显示,标准scdb(pro624)在5h孵育时诱导了几乎最大的信号幅度。另一方面,由match分子诱导的信号幅度开始于scdb值的20%以下,但是随着时间的推移稳定增加,最终在孵育30小时后达到相同的t细胞活化水平。
scdb和match分子的剂量响应曲线的ec50值图(图5)显示,ec50随着时间的推移而提高,但是有趣的是,两种分子的ec50的提高都遵循非常相似的模式,曲线彼此平行。因此,对于较小的scdb和包含hsa结合结构域的较大的match,效力(ec50)的动力学相似。但是,最大t细胞活化的动力学差异很大,match显示出较慢的活化。
对于分子pro624(scdb)和pro746(match)的nfat报告基因测定的样品,定量了t细胞活化标记物il-2的释放(见图6)。对于scdb标准分子,在30h的孵育过程中观察到了il-2浓度的强烈增加。有趣的是,当相应的t细胞活化信号几乎相同时,即使在30小时后,含有match分子的孔中存在的il-2的量在所有时间点都大大降低。
总之,我们的发现表明,包含hsa/cd3核心结构域的match形式具有相同的激活t细胞的能力,但是具有较慢的激活动力学。鉴于以下事实,这是有趣的,在给药的早期,用其他结合t细胞的双特异性抗体(例如博纳吐单抗/blincyto)与细胞因子释放相关的副作用最强。实际上,在治疗开始时仅耐受低剂量的博纳吐单抗/blincyto,而随后可耐受的剂量则高得多。对此的可能解释是在给药后立即发生了强烈的细胞因子爆发,这可能导致所谓的细胞因子释放综合征(crs)。因此,此处介绍的match由于其缓慢的t细胞活化动力学和相应降低的细胞因子释放可能导致毒性降低,而随着时间的推移它具有达到相同t细胞活化水平的能力。另外,即使在相似的t细胞活化水平下,细胞因子释放的降低也是pro746更令人惊讶的特征,这表明可以进一步降低频繁观察到的与t细胞募集疗法相关的细胞因子释放综合征的发生。
细胞毒性测定(t细胞驱动的靶细胞耗竭)
血细胞分离
根据制造商的说明书,使用淋巴细胞分离培养基lymphoprep(stemcelltechnologies)从健康志愿者的新鲜血液中分离外周血单个核细胞(pbmc)。简而言之,将血液用50ml离心管中的分离缓冲液(pbs,2%fcs,2mmedta)以1:1稀释,并加到含有推荐量的lymphoprep培养基的leucosep管中。将leucosep管在室温下以800g不中断地离心30分钟。然后,收集含有pbmc的细胞层并用分离缓冲液洗涤两次,并在室温下使用红细胞裂解缓冲液裂解红细胞5分钟。然后将细胞用分离缓冲液洗涤一次,并用测定培养基(rpmi-1640,10%fcs)洗涤一次。除去血小板后,将分离的pbmc以每毫升3×106个活细胞的密度重悬于含有25g/mlhsa的测定培养基中。
基于流式细胞术的体外细胞毒性测定和cd8+t细胞活化
通过亲本cho-k1细胞系的慢病毒转导产生了稳定表达在cmv启动子控制下的人il23ril12rβ1异源二聚体的cho-k1细胞系。将这些细胞用作细胞毒性中的靶细胞,而亲本cho-k1细胞系用作对照。另外,通过用全长her2cdna慢病毒转导亲代cho-k1细胞,也产生了稳定表达人her2的cho-k1细胞系。通过流式细胞术确定her2和il23r的表达水平。细胞表面的her2水平较il23r水平高得多。将预先用pkh67标记并在含有25g/l人血清白蛋白(hsa)的75μl测定培养基(rpmi-1640,10%fcs)中稀释的5'000个活靶细胞添加到96孔板中。接下来,将25μl在含hsa的测定培养基中稀释的6倍浓缩的测试蛋白质添加到合适的孔中。然后,为了使e:t比例为30:1,将在50μl含hsa的测定培养基中稀释的150'000个活效应细胞(pbmc)添加到每个孔中,并将板在室温下在nutating混合器上混合板,然后在37℃、5%co2下孵育。16小时后,将细胞用胰蛋白酶消化,重悬于染色缓冲液(pbs,2%bcs,2mmedta)中,并转移至非结合板中。
对细胞进行不同标记物如cd69、cd8、cd4、cd11c和annexin-v的染色。为了进行分析,重点是凋亡和死亡的靶细胞以及活化的cd8+t细胞。由此,通过绿色荧光(pkh67)鉴定靶细胞,并通过annexin-vapc分析其生存力。通过检测其表面的cd8(抗cd8percp-cy5.5)来鉴定效应细胞(cd8+细胞)。最后,通过定量cd69表达(抗cd69pe)来检测cd8+t细胞的活化。使用cd4来更好地区分cd8+和cd4+t细胞。使用cd11c来标记单核细胞和树突细胞并排除它们。对于每种标记物,除annexin-v抗体外,均在室温下在温和搅拌下孵育30分钟。用染色缓冲液洗涤细胞一次,用annexin结合缓冲液洗涤一次,并且在搅拌下在室温下将annexin-v染色进行30分钟。用annexin-v结合缓冲液洗涤细胞一次,并在novocyte流式细胞仪上进行流式细胞术分析。
根据以下公式计算特异性靶细胞裂解的百分比:
活化的cd8+t细胞的百分比与cd69+cd8+t细胞的比例相对应。
通过流式细胞术进行il-2定量
根据制造商的方案,使用流式微球阵列人th1/th2细胞因子试剂盒ii(cytometricbeadarrayhumanth1/th2cytokinekitii)(bdbiosciences)进行上清液中il-2的定量。简而言之,将50μl的混合的capturebeads加入分析的每种上清液以及il-2标准稀释液中。在黑暗中于室温孵育3小时后,将微球用洗涤缓冲液洗涤3次,并在novocyte仪器上通过流式细胞仪进行分析。
结果
细胞裂解数据显示了分子pro746(match-4抗taa2xcd3xhsa)和pro624(scdb;抗taaxcd3)诱导携带靶标的细胞的耗竭的特异性效力和特异性,而阴性对照pro811(scdb;抗-cd3xhsa)无法诱导靶细胞裂解(见图7)。与上面显示的nfat测定一致,与scdb相比,与match分子反应的ec50略微移至更高的浓度,而在孵育16小时后裂解了相似比例的靶细胞。
在这三种分子的剂量反应中,t细胞活化的定量与细胞裂解的观察结果一致(见图8)。通过这种读出,在不存在表达靶标的细胞的情况下,用cd3/il23rscdb(pro624)可以看到非特异性t细胞活化的信号。另一方面,match在高至最高测试浓度下仍没有显示出任何非特异性t细胞活化的迹象。
测量了孔中il-2的浓度(图9)。两个分子的il-2的最大浓度显著不同,match产生大大降低的il-2平稳期。在含靶标阴性细胞系的孔的定量中,只有cd3/il23rscdb在最高测试浓度的scdb下导致il-2浓度增加。与上述nfat报告基因测定中显示的数据一致,图8中的数据证实了与scdb(pro624)相比,在存在hsa的情况下,包含cd3/hsa核心结构域的match(pro746)的细胞因子释放降低。重要的是,两种分子具有相似的触发靶细胞裂解的能力,而它们的最大靶细胞裂解能力是相似的。
产生了四特异性组装体,以显示具有cd3/hsa异源二聚体核心的match组装体用于结合具有不同表达谱的肿瘤相关抗原的两种抗原特异性的潜力(参见图10)。
数据显示,可以利用附着于cd3/hsa核心结构域的“外围”scfv的两种特异性来有效地驱动一种单一分子对两个不同靶细胞群体的t细胞介导的耗竭(见图11)。它还显示了不同靶标表达对观察到的剂量响应曲线的影响,即较低的靶标表达将响应移至较高的浓度,这可以通过提供低表达靶标的多价结合来逆转,如图6所示。另一方面,对于高表达靶标,单价抗原结合已经导致高度有效的靶细胞耗竭。通过使分子优先靶向共表达两种细胞表面靶标的细胞而不是仅表达两种靶标之一的细胞,可以进一步利用这种双重靶向来增加作用机制的特异性。为了实现这一点,可以使用包含本文所述的cd3/has-核心结构域的match形式,以所有可能的组合测试与两种靶标之一具有不同亲和力的一系列结合剂,以选择具有最佳细胞裂解特异性的一种组合(见egan等人,mabs.2016)。
序列表
<110>努玛治疗有限公司
<120>靶向至少cd3和hsa的异源二聚体多特异性抗体形式
<130>114831p877pc
<150>us62/515,293
<151>2017-06-05
<160>30
<170>patentinversion3.5
<210>1
<211>264
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>1
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnalasergluasniletyrserphe
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrseralaserlysleualaalaglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnthrasnargtyrserasn
859095
proaspiletyrasnvalpheglythrglythrlysvalthrvalleu
100105110
glyglyglyglyglyserglyglyglyglyserglyglyglyglyser
115120125
glyglyglyglysergluvalglnleuvalgluserglyglyglyleu
130135140
valglnproglyglyserleuargleusercysalaalaserglyile
145150155160
asppheasnserasntyrtyrmetcystrpvalargglnalaprogly
165170175
lysglyleuglutrpileglycysiletyrvalglyserhisvalasn
180185190
thrtyrtyralaasntrpalalysglyargphethrileserargasp
195200205
asnserlysasnthrvaltyrleuglnmetasnserleuargalaglu
210215220
aspthralavaltyrtyrcysalathrserglyserservalleutyr
225230235240
phelysphetrpglyglnglythrleuvalthrvalserserglygly
245250255
glyglyserglyglyglyglyser
260
<210>2
<211>114
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>2
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnserserglnservalpheserasn
202530
asntyrleualatrppheglnglnlysproglyglnserprolysarg
354045
leuiletyrseralaserthrleualaserglyvalproserargphe
505560
serglyserglyserglythraspphethrleuthrileserserleu
65707580
glnprogluaspphealathrtyrtyrcysleuglysertyralacys
859095
serseralaaspcystyrvalpheglycysglythrlysvalthrval
100105110
leugly
<210>3
<211>119
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>3
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserleusersertyr
202530
aspmetsertrpvalargglnalaproglylyscysleualatrpile
354045
glyalasertyralaserglyprothrtyrtyralasertrpalalys
505560
glyargphethrileserargaspasnserlysasnthrvaltyrleu
65707580
glnmetasnserleuargalagluaspthralathrtyrphecysala
859095
argglyglytrpthrglythrserhisserasniletrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>4
<211>114
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>4
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnserserglnservalpheserasn
202530
asntyrleualatrppheglnglnlysproglyglnserprolysarg
354045
leuiletyrseralaserthrleualaserglyvalproserargphe
505560
serglyserglyserglythraspphethrleuthrileserserleu
65707580
glnprogluaspphealathrtyrtyrcysleuglysertyralacys
859095
serseralaaspcystyrvalpheglythrglythrlysvalthrval
100105110
leugly
<210>5
<211>119
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>5
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserleusersertyr
202530
aspmetsertrpvalargglnalaproglylysglyleualatrpile
354045
glyalasertyralaserglyprothrtyrtyralasertrpalalys
505560
glyargphethrileserargaspasnserlysasnthrvaltyrleu
65707580
glnmetasnserleuargalagluaspthralathrtyrphecysala
859095
argglyglytrpthrglythrserhisserasniletrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>6
<211>114
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>6
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnsersergluservaltyrasnasn
202530
lysargleusertrptyrglnglnlysproglylysalaprolysleu
354045
leuiletyrthralaserserleualaserglyvalproserargphe
505560
serglyserglyserglythraspphethrleuthrileserserleu
65707580
glnprogluaspphealathrtyrtyrcysglnglygluphethrcys
859095
serasnalaaspcysphethrpheglycysglythrlysvalthrval
100105110
leugly
<210>7
<211>123
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>7
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheproleusersertyr
202530
alametiletrpvalargglnalaproglylyscysleuglutrpile
354045
glymetileleuargalaglyasniletyrtyralasertrpvallys
505560
glyargphethrileserargaspasnserlysasnthrvaltyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
argarghistyrasnarggluglytyrproileglyileglyaspleu
100105110
trpglyglnglythrleuvalthrvalserser
115120
<210>8
<211>114
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>8
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnsersergluservaltyrasnasn
202530
lysargleusertrptyrglnglnlysproglylysalaprolysleu
354045
leuiletyrthralaserserleualaserglyvalproserargphe
505560
serglyserglyserglythraspphethrleuthrileserserleu
65707580
glnprogluaspphealathrtyrtyrcysglnglygluphethrcys
859095
serasnalaaspcysphethrpheglythrglythrlysvalthrval
100105110
leugly
<210>9
<211>123
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>9
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheproleusersertyr
202530
alametiletrpvalargglnalaproglylysglyleuglutrpile
354045
glymetileleuargalaglyasniletyrtyralasertrpvallys
505560
glyargphethrileserargaspasnserlysasnthrvaltyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
argarghistyrasnarggluglytyrproileglyileglyaspleu
100105110
trpglyglnglythrleuvalthrvalserser
115120
<210>10
<211>112
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>10
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnsersergluservaltyrserasn
202530
asnglnleusertrptyrglnglnlysproglyglnproprolysleu
354045
leuiletyraspalaseraspleualaserglyvalproserargphe
505560
serglyserglyserglythraspphethrleuthrileserserleu
65707580
glnprogluaspphealathrtyrtyrcysalaglyglypheserser
859095
serseraspthralapheglyglyglythrlysleuthrvalleugly
100105110
<210>11
<211>121
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>11
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserleuserserasn
202530
alametglytrpvalargglnalaproglylysglyleuglutyrile
354045
glyileileservalglyglyphethrtyrtyralasertrpalalys
505560
glyargphethrileserargaspasnserlysasnthrvaltyrleu
65707580
glnmetasnserleuargalagluaspthralathrtyrphecysala
859095
argasparghisglyglyaspserserglyalaphetyrleutrpgly
100105110
glnglythrleuvalthrvalserser
115120
<210>12
<211>112
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>12
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnsersergluservaltyrserasn
202530
asnglnleusertrptyrglnglnlysproglyglnproprolysleu
354045
leuiletyraspalaseraspleualaserglyvalproserargphe
505560
serglyserglyserglythraspphethrleuthrileserserleu
65707580
glnprogluaspphealathrtyrtyrcysalaglyglypheserser
859095
serseraspthralapheglycysglythrlysleuthrvalleugly
100105110
<210>13
<211>121
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>13
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserleuserserasn
202530
alametglytrpvalargglnalaproglylyscysleuglutyrile
354045
glyileileservalglyglyphethrtyrtyralasertrpalalys
505560
glyargphethrileserargaspasnserlysasnthrvaltyrleu
65707580
glnmetasnserleuargalagluaspthralathrtyrphecysala
859095
argasparghisglyglyaspserserglyalaphetyrleutrpgly
100105110
glnglythrleuvalthrvalserser
115120
<210>14
<211>110
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>14
aspvalvalmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnalaserglnileileserserarg
202530
seralatrptyrglnglnlysproglyglnproprolysleuleuile
354045
tyrglnalaserlysleualaserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglncysthrtyrileaspserasn
859095
pheglyalapheglyglyglythrlysleuthrvalleugly
100105110
<210>15
<211>121
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>15
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserpheserserser
202530
tyrtrpilecystrpvalargglnalaproglylysglyleuglutrp
354045
valglycysvalphethrglyaspglythrthrtyrtyralasertrp
505560
alalysglyargphethrileserargaspasnserlysasnthrval
65707580
tyrleuglnmetasnserleuargalagluaspthralathrtyrphe
859095
cysalaargprovalservaltyrtyrtyrglymetaspleutrpgly
100105110
glnglythrleuvalthrvalserser
115120
<210>16
<211>14
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>16
gluprogluprogluprogluprogluprogluproglupro
1510
<210>17
<211>14
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>17
lysprolysprolysprolysprolysprolysprolyspro
1510
<210>18
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>18
serglyglyglyglyserglyglyglyglyser
1510
<210>19
<211>15
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>19
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>20
<211>12
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>20
alaglualaalaalalysglualaalaalalysala
1510
<210>21
<211>258
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>21
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnaspvalasnthrala
202530
valalatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrseralaserpheleutyrserglyvalproserargphesergly
505560
serargserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnhistyrthrthrpropro
859095
thrpheglyglyglythrlysleuthrvalleuglyglyglyglygly
100105110
serglyglyglyglyserglyglyglyglyserglyglyglyglyser
115120125
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
130135140
serleuargleusercysalaalaserglypheasnilelysaspthr
145150155160
tyrilehistrpvalargglnalaproglylysglyleuglutrpval
165170175
alaargiletyrprothrasnglytyrthrargtyralaaspserval
180185190
lysglyargphethrileseralaaspthrserlysasnthralatyr
195200205
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
210215220
serargtrpglyglyaspglyphetyralametasptyrtrpglygln
225230235240
glythrleuvalthrvalserserglyglyglyglyserglyglygly
245250255
glyser
<210>22
<211>504
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>22
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnalasergluasniletyrserphe
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrseralaserlysleualaalaglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnthrasnargtyrserasn
859095
proaspiletyrasnvalpheglythrglythrlysvalthrvalleu
100105110
glyglyglyglyglyserglyglyglyglyserglyglyglyglyser
115120125
glyglyglyglysergluvalglnleuvalgluserglyglyglyleu
130135140
valglnproglyglyserleuargleusercysalaalaserglyile
145150155160
asppheasnserasntyrtyrmetcystrpvalargglnalaprogly
165170175
lysglyleuglutrpileglycysiletyrvalglyserhisvalasn
180185190
thrtyrtyralaasntrpalalysglyargphethrileserargasp
195200205
asnserlysasnthrvaltyrleuglnmetasnserleuargalaglu
210215220
aspthralavaltyrtyrcysalathrserglyserservalleutyr
225230235240
phelysphetrpglyglnglythrleuvalthrvalserserglygly
245250255
glyglyserglyglyglyglyseraspileglnmetthrglnserpro
260265270
serserleuseralaservalglyaspargvalthrilethrcysgln
275280285
serserglnservalpheserasnasntyrleualatrppheglngln
290295300
lysproglyglnserprolysargleuiletyrseralaserthrleu
305310315320
alaserglyvalproserargpheserglyserglyserglythrasp
325330335
phethrleuthrileserserleuglnprogluaspphealathrtyr
340345350
tyrcysleuglysertyralacysserseralaaspcystyrvalphe
355360365
glycysglythrlysvalthrvalleuglygluprogluproglupro
370375380
gluprogluprogluprogluproaspileglnmetthrglnserpro
385390395400
serserleuseralaservalglyaspargvalthrilethrcysgln
405410415
sersergluservaltyrserasnasnglnleusertrptyrglngln
420425430
lysproglyglnproprolysleuleuiletyraspalaseraspleu
435440445
alaserglyvalproserargpheserglyserglyserglythrasp
450455460
phethrleuthrileserserleuglnprogluaspphealathrtyr
465470475480
tyrcysalaglyglypheserserserseraspthralapheglygly
485490495
glythrlysleuthrvalleugly
500
<210>23
<211>518
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>23
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnalasergluasniletyrserphe
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrseralaserlysleualaalaglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnthrasnargtyrserasn
859095
proaspiletyrasnvalpheglythrglythrlysvalthrvalleu
100105110
glyglyglyglyglyserglyglyglyglyserglyglyglyglyser
115120125
glyglyglyglysergluvalglnleuvalgluserglyglyglyleu
130135140
valglnproglyglyserleuargleusercysalaalaserglyile
145150155160
asppheasnserasntyrtyrmetcystrpvalargglnalaprogly
165170175
lysglyleuglutrpileglycysiletyrvalglyserhisvalasn
180185190
thrtyrtyralaasntrpalalysglyargphethrileserargasp
195200205
asnserlysasnthrvaltyrleuglnmetasnserleuargalaglu
210215220
aspthralavaltyrtyrcysalathrserglyserservalleutyr
225230235240
phelysphetrpglyglnglythrleuvalthrvalserserglygly
245250255
glyglyserglyglyglyglysergluvalglnleuvalglusergly
260265270
glyglyleuvalglnproglyglyserleuargleusercysalaala
275280285
serglypheserleuserserasnalametglytrpvalargglnala
290295300
proglylysglyleuglutyrileglyileileservalglyglyphe
305310315320
thrtyrtyralasertrpalalysglyargphethrileserargasp
325330335
asnserlysasnthrvaltyrleuglnmetasnserleuargalaglu
340345350
aspthralathrtyrphecysalaargasparghisglyglyaspser
355360365
serglyalaphetyrleutrpglyglnglythrleuvalthrvalser
370375380
serlysprolysprolysprolysprolysprolysprolysproglu
385390395400
valglnleuvalgluserglyglyglyleuvalglnproglyglyser
405410415
leuargleusercysalaalaserglypheserleusersertyrasp
420425430
metsertrpvalargglnalaproglylyscysleualatrpilegly
435440445
alasertyralaserglyprothrtyrtyralasertrpalalysgly
450455460
argphethrileserargaspasnserlysasnthrvaltyrleugln
465470475480
metasnserleuargalagluaspthralathrtyrphecysalaarg
485490495
glyglytrpthrglythrserhisserasniletrpglyglnglythr
500505510
leuvalthrvalserser
515
<210>24
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>24
pheglythrglythrlysvalthrvalleugly
1510
<210>25
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>25
pheglyglyglythrlysleuthrvalleugly
1510
<210>26
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>26
pheglyglyglythrglnleuileileleugly
1510
<210>27
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>27
pheglygluglythrgluleuthrvalleugly
1510
<210>28
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>28
pheglyserglythrlysvalthrvalleugly
1510
<210>29
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>29
pheglyglyglythrglnleuthrvalleugly
1510
<210>30
<211>11
<212>prt
<213>人工序列
<220>
<223>重组抗体序列
<400>30
pheglyglyglythrglnleuthralaleugly
1510
- 还没有人留言评论。精彩留言会获得点赞!