用于氨基酸消耗疗法的组合物和方法与流程
本申请要求2017年8月16日提交的美国临时申请号62/546489和2017年11月27日提交的美国临时申请号62/591102的权益。这些以及所有其他参考的外部材料通过引用以其全部并入本文。在通过引用并入的参考文献中术语的定义或使用与本文提供的术语的定义不一致或相反的情况下,认为以本文提供的该术语的定义为准。
本发明的领域是精氨酸酶纯化、精氨酸酶修饰以及精氨酸酶和天冬酰胺酶的医学用途。
背景技术:
以下描述包括在理解本发明中可能有用的信息。并不是承认本文提供的任何信息是现有技术或与当前要求保护的发明有关,或明确或隐含引用的任何出版物均为现有技术。
越来越多的证据表明氨基酸剥夺可能是治疗癌症的有效候选。已经发现剥夺特定氨基酸(比如精氨酸、天冬酰胺或谷氨酰胺)可用于治疗不同类型的癌症(feun,youetal.2008;hensley,wastietal.2013;krall,xuetal.2016)。本文中的所有出版物通过引用并入,其引用程度与每个单独的出版物或专利申请被明确且单独地指示通过引用并入的程度相同。当在并入的参考文献中术语的定义或使用与本文提供的术语的定义不一致或相反时,适用本文提供的该术语的定义,而参考文献中该术语的定义不适用。氨基酸剥夺的有效性被认为是由于下游效应,比如mtorc1的失活和蛋白质合成的破坏。
重组人精氨酸酶(rharg)应用于消耗精氨酸已显示在体外抑制癌细胞生长方面有效(lam,wongetal.2009;tsui,lametal.2009)。选择精氨酸作为靶标氨基酸不仅是因为其在蛋白质合成中的半必需作用,而且还因为精氨酸在激活mtorc1中的作用(carroll,maetzeletal.2016;chantranupong,scariaetal.2016;krall,xuetal.2016;saxton,chantranupongetal.2016;zheng,zhangetal.2016)。发现精氨酸剥夺可以有效抑制各种癌细胞系,包括源自乳腺癌、结肠癌、肺癌和宫颈癌的细胞系。
酶精氨酸酶作用于精氨酸以产生鸟氨酸和尿素,并且是尿素循环的一部分。精氨酸酶被发现越来越多地用作化学治疗剂,其中其被用于降低血清中的精氨酸浓度。这些消耗的血清精氨酸水平可以有效地使癌细胞“饿死”(其许多变种都是在精氨酸方面存在营养缺陷的)。
使用精氨酸酶作为治疗剂需要大量和高纯度的人精氨酸酶的可用性。已经尝试提供高度纯化的重组人精氨酸酶。例如,美国专利号8,507,245(授予leung和lo)描述了一种用于纯化重组人精氨酸酶1的伪亲和色谱法,该重组人精氨酸酶1已被修饰以提供聚乙二醇化的单一位点。然而,所描述的方法限于包括聚组氨酸序列的形式,该序列允许与金属伪亲和介质复合形成。该伪亲和介质用于亲和力纯化步骤,该亲和力纯化步骤是在缀合反应中使用大量过量的反应性peg类似物所必需的。这样,如果不另外进行去除聚组氨酸序列的处理,通过这种方法纯化的精氨酸酶1不能被认为是完全人类的。
未修饰的精氨酸酶在血浆中是不稳定的,这严重限制了其治疗应用。已经进行了许多尝试来延长血浆半衰期,包括蛋白质与聚合物聚乙二醇的缀合(聚乙二醇化)。广泛使用的缀合策略是精氨酸酶的氨基(例如,赖氨酸的ε-胺)的非选择性乙二醇化,如美国专利号9,050,340(授予georgiou和stone)所述。这种方法需要使用显著摩尔过量的昂贵的胺反应性peg试剂,部分原因是这种试剂的相对较快的水解。这种随机缀合也使修饰的精氨酸酶的定性和定量表征复杂化,从而限制了其药用用途。使用这种途径,除非偶联反应是在非常严格控制的条件下进行,否则不太可能获得始终如一的产品质量,这通常不适合扩大规模。
因而,仍然需要能够以高纯度提供活性且有效且始终如一的聚乙二醇化的精氨酸酶的方法。
技术实现要素:
本发明的主题提供了用于制备和衍生高纯度精氨酸酶,以及利用如此制备的精氨酸酶与天冬酰胺酶组合来治疗癌症的组合物和方法。
本发明构思的一个实施方式是一种纯化精氨酸酶的方法,该方法是通过获得表达精氨酸酶的细胞(比如,细菌细胞),破坏该细胞以产生包含精氨酸酶的裂解物,并在cocl2(例如,至少20mm的浓度)存在下将裂解物的温度升高至沉淀温度(例如,至少50℃或约65℃)持续足以使污染物从裂解物中沉淀出来并产生包括第一部分纯化的精氨酸酶的上清液的时间(例如,约5至30分钟)。使该上清液与阴离子交换剂接触,该阴离子交换剂结合另外的污染物并提供包括部分纯化的co2+-精氨酸酶(即,其中mn2+被co2+替换的精氨酸酶)的流过级分(flowthroughfraction)。这种部分纯化的co2+-精氨酸酶可以具有约80%或更高的纯度。
在一些实施方式中,该方法包括另外的步骤:使流过级分与阳离子交换剂接触,以产生包括精氨酸酶和第二流过级分的结合级分。将洗脱缓冲液施加至阳离子交换剂,以洗脱纯化的co2+-精氨酸酶。这种纯化的co2+-精氨酸酶可以具有约90%或更高的纯度。精氨酸酶可以是人精氨酸酶1。然后使用的阴离子和阳离子交换剂可以是强离子交换剂。
本发明构思的另一个实施方式是通过获得包括至少一种半胱氨酸的蛋白质,使该蛋白质与peg-马来酰亚胺在2℃至15℃的温度下在ph值为6.5至7.0之间的缓冲液中接触,并将该蛋白质与peg-马来酰亚胺在2℃至15℃的温度下温育24小时至72小时以产生peg-衍生的蛋白质,来选择性地衍生蛋白质(比如,人精氨酸酶1或其突变)的方法。在这种方法中,peg-马来酰亚胺以相对于该蛋白质过量少于4倍的摩尔量存在。peg-马来酰亚胺可衍生自支化或直链peg。在一些实施方式中,精氨酸酶中的蛋白质具有消除了除一个半胱氨酸以外的所有半胱氨酸的突变。在一些实施方式中,该蛋白质不包括聚组氨酸序列。在一些实施方式中,该方法包括将peg衍生的蛋白质与未反应的或水解的peg-马来酰亚胺分离的增加步骤,例如通过透析、尺寸排阻色谱法和/或离子交换色谱法。
本发明构思的另一个实施方式是peg修饰的人精氨酸酶1的制备,其包括对应于seqidno1的肽序列,该肽序列与具有至少20kda的分子量的单一peg部分共价偶联。在这种制剂中,peg修饰的人精氨酸酶1占人精氨酸酶的至少90%,并且peg修饰的人精氨酸酶1不包括聚组氨酸序列。peg-修饰的人精氨酸酶的peg部分可以是直链或支化的(例如,具有“y”或“v”构型)。在一些这种实施方式中,peg修饰的人精氨酸酶1可以包括金属辅因子,比如锰、镍和/或钴。
本发明构思的另一个实施方式是通过降低用于培养癌细胞的培养基中的精氨酸浓度并降低该培养基中的天冬酰胺浓度来抑制癌细胞的方法。可使用精氨酸酶(例如,重组人精氨酸酶)降低精氨酸浓度。类似地,可以使用天冬酰胺酶(asnase)降低天冬酰胺的浓度。在一些这种实施方式中,癌细胞具有较低的天冬酰胺合成酶(asns)表达。在一些这这种实施方式中,该方法包括降低谷氨酰胺浓度的另外的步骤,例如,使用氨基转移酶抑制剂(比如,氨基氧乙酸盐)。
本发明构思的另一个实施方式是用于抑制癌细胞的组合物,其包括精氨酸还原酶和天冬酰胺还原酶。精氨酸还原酶可以是精氨酸酶,比如重组人精氨酸酶。类似地,天冬酰胺还原酶可以是天冬酰胺酶(asnase)。在一些这种实施方式中,癌细胞具有较低的天冬酰胺合成酶(asns)表达。该组合物还可包括降低谷氨酰胺浓度的化合物,比如氨基转移酶抑制剂(例如,氨基氧乙酸盐)。
通过以下对优选实施方式连同附图的详细描述,本发明主题的各种目的、特征、方面和优点将变得更加显而易见,在附图中,相同的附图标记表示相同的组分。
附图说明
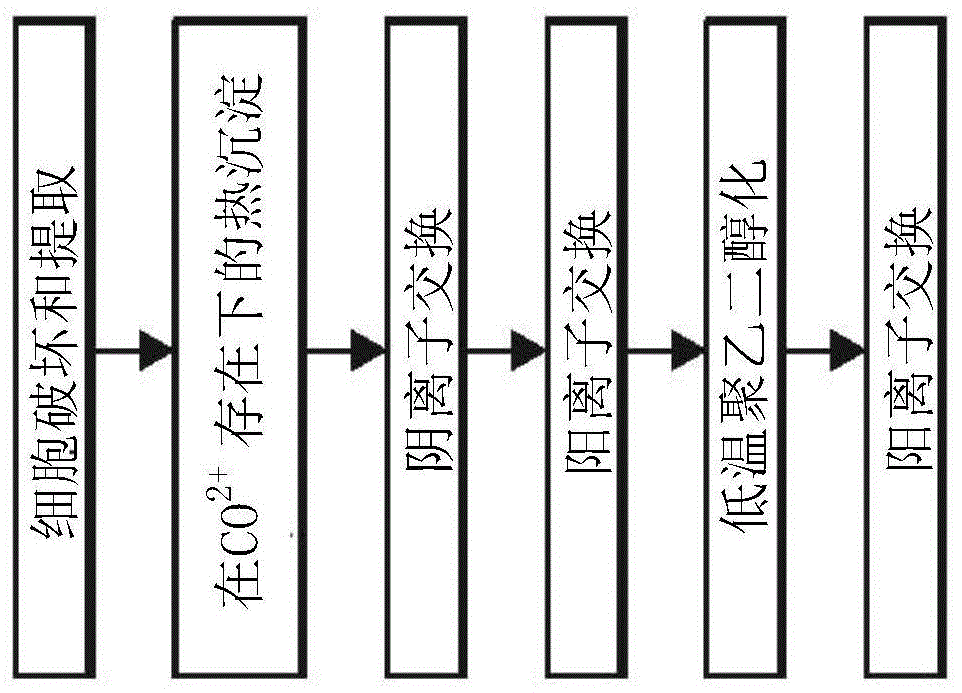
图1:本发明构思的示例性方法的流程图。
图2:电泳凝胶的照片,显示了在匀浆和热沉淀产物中,在8-16%的梯度凝胶上还原sds-page的结果。
图3:在captoqtm上进行色谱期间的uv吸收曲线图。
图4:电泳凝胶的照片,其显示了在典型的captoqtm色谱步骤中,在8-16%的梯度凝胶上还原sds-page的结果。
图5:在captostm上进行色谱期间的uv吸收图。
图6:电泳凝胶的照片,其显示了在典型的captoqtm色谱步骤中,在8-16%的梯度凝胶上还原sds-page的结果。
图7:在不同摩尔过量的peg-马来酰亚胺下在2-8℃下人激酶1的聚乙二醇化动力学的图。
图8:在第0天给予单次静脉内剂量的peg修饰的人精氨酸酶1后健康大鼠中血浆精氨酸浓度的图。
图9:在第0天用单次静脉内剂量的peg修饰的人精氨酸酶1治疗的健康大鼠中血浆精氨酸浓度的图。
图10:在第0天用单次静脉内剂量的peg修饰的人精氨酸酶1治疗的健康大鼠的体重图。
图11:在第0天用单次静脉内剂量的直链和支化peg修饰的人精氨酸酶1治疗的健康大鼠中血浆精氨酸浓度的图。
图12:在第0天用单次静脉内剂量的直链或支化peg修饰的人精氨酸酶1治疗的健康大鼠的体重图。
图13:通过lc/q-tofms的分子量测定。聚乙二醇化精氨酸酶的去卷积质量为34,572.3da。
图14:突变型人精氨酸酶1的肽图。
图15:在2mg/kg的单次静脉内剂量之后,精氨酸酶在大鼠血浆中随时间变化的酶促活性图。
图16:在2mg/kg的单次静脉内剂量之后,免疫反应性peg修饰的人精氨酸酶1在大鼠血浆中随时间变化的血浆浓度图。
图17:单独的asnase在(i)低asns表达细胞系(mda-mb-231、zr-75-1和mcf7)和(ii)高asns表达细胞系(hela、hepg2和mia-paca2)中的功效图。每个实验进行三组独立试验。误差栏代表一个标准偏差(sd)。
图18:单独的rharg和rharg-asnase组合在(i)低asns表达细胞系(mda-mb-231、zr-75-1和mcf7)和(ii)高asns表达细胞系(hela、hepg2和mia-paca2)中的功效图。每个实验进行三组独立试验。误差栏代表一个标准偏差(sd)。
具体实施方式
以下描述包括可能有助于理解本发明的信息。并不是承认本文提供的任何信息是现有技术或与当前要求保护的发明有关,或明确或隐含引用的任何出版物均为现有技术。
本发明的主题提供了提供人精氨酸酶的可分级纯化的装置、组合物和方法。在本发明构思的组合物和方法中,将含有重组人精氨酸酶的制剂在高温下温育,这导致沉淀的形成。除去该沉淀,收集上清液并在阴离子交换剂上进行离子交换。收集来自该阴离子交换过程的流过级分,并在阳离子交换剂上进行进一步的抛光步骤,在该步骤中,使用盐梯度洗脱人精氨酸酶。可以例如通过聚乙二醇化修饰所得的人精氨酸酶。可以在降低的温度下使用相对较小摩尔过量的反应性peg类似物进行这种聚乙二醇化,以便产生高纯度的聚乙二醇化的人精氨酸酶。本发明的主题提供了装置、系统和方法,其中使用还原精氨酸和天冬酰胺的化合物来抑制癌细胞的生长。这种化合物可以是催化地降低精氨酸和天冬酰胺浓度的酶,比如精氨酸酶和/或天冬酰胺酶。在优选的实施方式中,这种酶是人酶,比如重组人精氨酸酶(rharg)。
这种氨基酸消耗酶可以作为从天然来源纯化的酶或作为重组细菌、真菌、植物细胞或动物细胞的产物提供。在这种疗法中使用的酶可以具有超过80%、85%、90%、95%、98%、99%或更高的纯度,并且可以在翻译后进行修饰。这种修饰可包括改善吸收和/或半衰期的修饰(比如,聚乙二醇化)。含酶的药物制剂可以静脉内施用,例如,通过注射或输注。这种制剂可以包括用于癌症治疗的化学治疗剂、免疫治疗剂和/或放射疗法或与其共同施用。
通过以下对优选实施方式以及附图的详细描述,本发明主题的各种目的、特征、方面和优点将变得更加显而易见,在附图中,相同的附图标记表示相同的组分。
应当领会,所公开的技术提供了许多有利的技术效果,其包括可规模生产具有来自重组来源的天然序列的高度纯化的人精氨酸酶。
在一些实施方式中,用于描述和要求保护本发明的某些实施方式的表示成分的数量、性质比如浓度、反应条件等的数字应理解为在某些情况下由术语“约”修饰。因此,在一些实施方式中,在书面描述和所附权利要求书中阐述的数字参数是近似值,其可以根据特定实施方式试图获得的期望性质而变化。在一些实施方式中,应当根据报告的有效数字的数目并通过应用普通的舍入技术来解释数字参数。尽管阐述本发明的一些实施方式的广泛范围的数值范围和参数是近似值,但是在具体实例中阐述的数值被尽可能精确地报告。在本发明的一些实施方式中呈现的数值可能含有某些误差,这些误差必然是由它们各自的测试测量中发现的标准偏差引起的。
如本文的描述和遍及随后的权利要求书中所使用,除非上下文另外明确指出,否则“一(a,an)”和“所述(the)”的含义包括复数形式。而且,除非上下文另外明确指出,如本文的描述中所使用,“在...中(in)”的含义包括“在...中(in)”和“在...上(on)”。
本文中数值范围的列举仅旨在用作分别指代落入该范围内的每个单独的值的速记方法。除非本文另外指出,否则每个单独的值都被并入说明书中,就好像它在本文中被单独引用一样。除非本文另外指出或与上下文明显矛盾,否则本文描述的所有方法可以以任何合适的顺序进行。相对于本文的某些实施方式提供的任何和所有实施例或示例性语言(例如,“比如”)的使用仅旨在更好地阐明本发明,并且不对以其他方式要求保护的本发明的范围构成限制。说明书中的任何语言都不应解释为表示对实施本发明必不可少的任何未要求保护的要素。
本文公开的本发明的可选要素或实施方式的分组不应解释为限制。每个组成员可以单独引用或要求保护,也可以与该组的其他成员或本文找到的其他要素组合使用。出于方便和/或可专利性的原因,一个组中的一个或多个成员可以包括在一个组中或从该组中删除。当发生任何这种包括或删除时,说明书在本文中被认为包含经修改的组,从而满足所附权利要求中使用的所有马库什组的书面描述。
以下讨论提供了本发明主题的许多实例实施方式。虽然每个实例代表发明要素的单个组合,但是发明主题被认为包括所公开要素的所有可能的组合。因而,如果一个实施方式包括要素a、b和c,而第二实施方式包括要素b和d,则即使没有明确地公开,本发明主题也被认为包括a、b、c或d的其他剩余组合。
在本发明构思的实施方式中,氨基酸消耗酶的一种是精氨酸酶,比如哺乳动物、鸟类、爬行动物、植物、真菌和/或细菌精氨酸酶。在一些这种实施方式中,精氨酸酶可以是作为基因工程产物提供的人精氨酸酶,例如,培养物中的细菌、酵母、真菌、昆虫、植物或哺乳动物细胞。这种精氨酸酶可包括一种或多种序列修饰,其用于改善随后的缀合反应的特异性,例如,去除或替换含有潜在修饰的侧链的一种或多种氨基酸。在优选的实施方式中,可以在大肠杆菌克隆中产生重组人精氨酸酶,例如,含有卡那霉素抗性的菌株bl21(来自newenglandbiolabs的t7express),其中插入了编码人精氨酸酶1的cdna的表达载体pet-30a。可以在合适的培养基中以任何合适的规模,例如0.1l、1l、5l、10l或更大的规模进行这种转化的大肠杆菌的培养。可以监测这种细菌培养物的光密度,以便确定何时达到用于收集重组人精氨酸酶1的最佳密度。可选地,在收集细菌和进一步处理之前,可以允许培养持续预定的时间段。
图1提供了概述本发明构思的方法的实例的流程图。如所显示,收集、破坏和提取表达人精氨酸酶1的细菌或其他细胞,以便释放所需的酶。细菌可以通过任何合适的方式收集,包括过滤、沉降和/或离心。任选地,如此收集的细菌可以在随后的处理之前被冲洗或洗涤。
细菌或其他细胞的破坏可以通过任何合适的方法进行。这些包括但不限于酶消化、渗压震扰、突然的压力变化(例如,通过压力的表达和/或超声处理)。在一些实施方式中,这些方法可以在温度受控的条件下进行。例如,可以控制进行超声处理的细菌或其他细胞的温度,以确保其温度不超过与人精氨酸酶的后续活性相容的温度。在其他实施方式中,可以在破坏细菌或其他细胞之前、期间或之后加入一种或多种蛋白酶抑制剂。在仍其他实施方式中,可以在破坏细菌或其他细胞之前、期间或之后加入一种或多种稳定剂(例如,抗氧化剂)。
在破坏细菌或其他细胞之后,可以去除残留的碎片(例如,通过沉降、过滤和/或离心),以留下包括人精氨酸酶的溶液。发明人发现精氨酸酶在升高的温度(即,高于37℃、40℃、45℃、50℃、60℃和/或70℃)下令人惊讶地稳定,这可能导致不期望的污染蛋白质(contaminatingprotein)的变性和随后的沉淀。例如,发明人发现人精氨酸酶i在74℃是稳定的,该温度导致许多污染蛋白质沉淀。不受限于理论,认为该稳定性由与二价离子的络合物形成提供。这样可以在存在二价离子(比如mn2+或co2+)的高温(即,超过37℃的温度)下提取精氨酸酶,以便产生沉淀(其包括污染蛋白质)和上清液(其包括人精氨酸酶)。此外,由于钴螯合的精氨酸酶表现出大大增强的催化活性(kcat/km),因此在提取期间可以利用cocl2来不仅提供高的催化潜力,而且可以用co2+替换精氨酸酶的mn2+。可以选择温度和温育时间以提供足够的人精氨酸酶的最佳回收、纯度和活性。
温育温度的范围可以是从约40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃或超过约90℃。温育时间范围可以是从1分钟、2分钟、3分钟、5分钟、10分钟、15分钟、30分钟、45分钟、1小时、2小时、3小时、4小时、8小时、12小时或超过12小时。在一些实施方式中,温度可以在温育期间变化。在优选的实施方式中,温育温度为65℃,并且温育期间为15分钟。发明人发现,这种方法可以有利地除去大部分不需要的热敏蛋白质,同时在精氨酸酶中用co2+替换mn2+。
在该沉淀步骤之后,收集含有精氨酸酶的上清液用于进一步处理。上清液可以通过任何合适的方法从沉淀中分离,其包括沉降、过滤和/或离心。然后将收集的上清液转移(例如,通过透析、凝胶过滤和/或渗滤)到与阴离子交换相容的水性缓冲液中。这种缓冲液的组成至少部分取决于所用阴离子交换介质的性质,但是通常可以具有相对较低的摩尔浓度(例如,小于100mm)和升高的ph(例如,大于7)。这种阴离子交换剂可以是对阴离子具有相对低亲和力的弱阴离子交换剂,比如,包括铵基团的阴离子交换剂。可选地,这种阴离子交换剂可以是对阴离子具有相对高亲和力的强阴离子交换剂(比如,包括季胺基的阴离子交换剂)。在优选的实施方式中,采用强阴离子交换剂。例如,如果使用强阴离子交换剂,比如captoqtm,则合适的缓冲液可以是ph8.05的20mmtris。可以调节上清液的最终蛋白质浓度以提供足够的精氨酸酶与至少一部分存在的污染物质的最佳分离。
在转移至合适的阴离子交换缓冲液后,用阴离子交换介质处理上清液。如上所述,这种阴离子交换介质可以是强阴离子交换介质,例如,包括固定的季胺的阴离子交换介质。阴离子交换介质可以以任何合适的形式提供,例如,作为过滤器、不混溶的液体、多孔颗粒和/或无孔颗粒。这种强阴离子交换介质的实例是captoqtm介质(gehealthcare),它作为多孔颗粒提供,并包括季胺基侧基(pendantquaternaryaminegroup)。可以将这种阴离子交换介质作为本体固相来应用,将其混合和/或悬浮在上清液中,然后除去(例如,通过沉降、离心和/或过滤)。在优选的实施方式中,阴离子交换介质在色谱柱中作为色谱床提供。
可以将上清液施加到阴离子交换介质的床上,导致至少一些污染物与介质结合,同时允许含有部分纯化的精氨酸酶的流过级分通过。可以优化这种柱的体积和配置,以及在应用期间的流速,以提供足以从上清液中最佳捕获污染物的能力。在通过并收集部分纯化的人精氨酸酶后,可以(例如,使用含高盐浓度的缓冲液)冲洗和再生阴离子交换介质以供再次使用。在这种实施方式中,可以选择阴离子交换介质以耐受灭菌和/或减少热原的处理。
所收集的部分纯化的精氨酸酶可以原样使用(取决于应用),或者经受进一步的抛光(polishing)步骤。药物用途可能需要这种进一步的处理。如果需要抛光步骤,则可以将部分纯化的精氨酸酶转移至适用于阳离子交换色谱的水性缓冲液中。该转移可以通过任何合适的方式来完成,包括透析、凝胶过滤和/或渗滤。在一些实施方式中,可以通过在提供合适的阳离子交换缓冲液组合物的稀释缓冲液中稀释部分纯化的人精氨酸酶来有效地完成该转移。在仍其他实施方式中,可以(例如,通过控制ph和/或离子强度)调节在先前的阴离子交换步骤中使用的缓冲液以适合于阳离子交换。
当部分纯化的精氨酸酶在合适的阳离子交换缓冲液中时,可以将其应用于阳离子交换介质。合适的缓冲剂通常具有低至中等的离子强度(例如,小于200mm)和中性ph(例如,ph7)。合适的阳离子交换缓冲液的实例是50mmtris,ph7。这种阳离子交换剂可以是对阳离子具有相对低亲和力的弱阳离子交换剂,比如,包括羧基的阳离子交换剂。可选地,这种阳离子交换剂可以是对阳离子具有相对高亲和力的强阳离子交换剂(比如,包括磺酸根基团的阳离子交换剂)。在优选的实施方式中,阳离子交换介质可以是强阳离子交换介质,比如captostm(gehealthcare),其包括磺酸根侧基。由于来自部分纯化的精氨酸酶制剂的精氨酸酶与阳离子交换介质结合并选择性地从阳离子交换介质洗脱,因此优选将阳离子交换介质提供为固定在适当位置以便支持梯度洗脱的固体(例如,颗粒)。在优选的实施方式中,阳离子交换介质在色谱柱中作为色谱床提供。可以优化这种柱的体积和配置,以及在应用期间的流速,以提供足以最佳捕获和随后从阳离子交换介质释放人精氨酸酶的能力。
当使用这种阳离子交换柱时,已经转移到阳离子交换缓冲液中的部分纯化的精氨酸酶以允许在阳离子交换介质上捕获精氨酸酶的流速施加于该柱。在施加部分纯化的精氨酸酶后,可以用另外体积的阳离子交换缓冲液(例如,1至10个柱体积)冲洗阳离子交换柱,以便除去未结合的物质。任选地,在该方法期间监测uv吸收率,以便确定何时完成洗涤。在一些实施方式中,可以使用另外的洗涤步骤,其中将更严格的阳离子交换缓冲液(例如,具有比阳离子交换缓冲液更高的ph和/或离子强度的洗涤缓冲液)施加至阳离子交换柱以置换松散结合的物质。这种洗涤缓冲液的实例是小于0.5m的50mmtris+氯化钠(nacl),其ph为7。在一些实施方式中,可以使用一系列不同严格程度的这种洗涤缓冲液。
在施加部分纯化的精氨酸酶和任何随后的洗涤步骤之后,通过施加洗脱缓冲液从阳离子交换介质上洗脱纯化的精氨酸酶。可以通过施加固定组成的洗脱缓冲液作为单次推注以进行逐步洗脱来提供这种洗脱。在其他实施方式中,洗脱缓冲液可以作为与阳离子交换缓冲液的混合物施加,其中洗脱缓冲液与阳离子交换缓冲液的比率随时间增大。在这种梯度洗脱途径中,该比率变化的速率可以随时间呈线性,或非线性。在优选的实施方式中,使用线性梯度完成洗脱,其随时间以恒定的速率将柱缓冲液的组成从阳离子交换缓冲液过渡到洗脱缓冲液。洗脱缓冲液在ph值、离子强度或两者方面都可以与阳离子交换缓冲液不同。在优选的实施方式中,洗脱缓冲液基本上复制了阳离子交换缓冲液的组成和ph,但是另外包括高浓度(例如,大于0.2m)的nacl。这种洗脱缓冲液的实例是50mmtris+0.5mnacl,ph为7。
在这种梯度洗脱期间中,可以监测离开柱的物质的uv吸收率,以确定应收集的级分。可以基于精氨酸酶含量和/或污染物的存在来选择级分,以提供所需的产率和纯度。可以收集、合并这种级分并将其转移至适于稳定性的缓冲液中。在一些实施方式中,随后可以将这种纯化的精氨酸酶冷冻和/或冻干。在仍其他实施方式中,可以将以这种方式获得的纯化的精氨酸酶衍生化,例如,通过聚乙二醇化,以用于药物用途。本发明构思的方法和组合物的典型结果可以以约30%的产率提供高纯度(>90%)的人精氨酸酶。在通过并收集纯化的人精氨酸酶后,可以(例如,使用含高盐浓度的缓冲液)漂洗和再生阳离子交换介质以供再次使用。在这种实施方式中,可以选择阳离子交换介质以耐受灭菌和/或减少热原的处理。
在一些实施方式中,随后可以对如上所述纯化的精氨酸酶进行化学修饰。合适的化学修饰包括生物素化、电荷修饰、交联和缀合(比如,亲水聚合物,例如,葡聚糖、peg等的接枝)。可以通过使用聚合物的反应性形式,例如,通过使纯化的精氨酸酶与带有胺反应性和/或硫醇反应性基团的聚合物接触,将这种聚合物接枝到纯化的精氨酸酶上。合适的反应性基团包括n-羟基琥珀酰亚胺(nhs)酯、磺基nhs酯、环氧化物、卤代三嗪、醛、肼、碘乙酰胺、马来酰亚胺和本领域已知的其他交联基团。在一些实施方式中,可以对这种方法中使用的人精氨酸酶进行遗传修饰,例如,以便限制或减少人精氨酸酶上存在的可修饰氨基酸侧链的数量和/或位置。例如,可以通过用另一种氨基酸替换人精氨酸酶序列中的一个或多个赖氨酸来减少反应性胺的数量。类似地,可以通过用另一种氨基酸替换人精氨酸酶序列中的一个或多个半胱氨酸来减少反应性硫醇的数量。
应当领会,在本发明构思的组合物或方法中不需要添加通常用于产生对镍具有亲和力的融合蛋白的聚组氨酸序列(例如,在氨基和/或羧基末端)。在seqidno.1中提供了合适的重组精氨酸酶的实例。包括这种聚组氨酸序列可能会使人精氨酸酶具有抗原性,因此不适合重复用作治疗剂。另外,包括聚组氨酸序列会干扰在初始纯化期间以及在上述修饰反应之后使用阳离子交换对精氨酸酶的分离。
聚乙二醇化经常用于延长具有治疗价值的蛋白质的血清半衰期。通常使用大摩尔过量(例如,10倍摩尔过量或更大)的peg的反应性形式进行这种方法,以便确保很大一部分的目标蛋白质被聚乙二醇化。在存在降低偶联效率的空间问题的蛋白质(比如,人精氨酸酶1)中,尤其如此。peg的典型反应性形式包括peg-nhs或peg-磺基nhs(当需要通过胺偶联时使用)或peg-马来酰亚胺(当需要通过硫醇偶联时使用)。由于许多原因,不希望使用大摩尔过量的这种活化的peg,这些原因包括在大摩尔过量时以降低选择性的偶联的可能性,随后难以从反应的蛋白中分离大过量的未反应的peg,以及费用。
令人惊讶地,发明人已经发现可以使用非常低(例如,相对于蛋白含量为3倍至4倍)摩尔过量的peg-马来酰亚胺有效地对人精氨酸酶(比如,如上所述纯化的人精氨酸酶1)进行聚乙二醇化。甚至更令人惊讶的是,可以在低温(其二者均会降低反应性)和延长(即,大于1小时和/或长达72小时)的反应时间下在选择性条件下(例如,弱酸性ph,通过质子化作用阻断潜在的反应性胺)高效进行这种聚乙二醇化。发明人已经发现,这种方法可以提供基本上全部(即,大于90%)的所提供的人精氨酸酶1的聚乙二醇化,并且通过凝胶过滤和/或离子交换可以容易地实现与剩余的相对少量的未反应或水解的peg的分离。在一些实施方式中,可以对如此修饰的人精氨酸酶进行遗传修饰以提供相对于天然序列减少的潜在反应性半胱氨酸数。在优选的实施方式中,人精氨酸酶可以是修饰的人精氨酸酶1,其提供单个半胱氨酸并且不包括聚组氨酸序列。在一些实施方式中,人精氨酸酶可包括非天然(即,非锰)金属辅因子,比如钴或镍。
实施例
细胞破裂、提取和澄清
用编码人精氨酸酶-1的cdna转化含有氨苄青霉素抗性、瞬时和组成型表达载体pet-3a的大肠杆菌克隆(菌株:bl21startm,invitrogen),并在培养物中建立。用230ml的裂解缓冲液(50mmtrisph7.9,1mmmgso4)洗涤湿重为42.2g的由这种培养物产生的细胞糊,然后离心以收集细胞糊。在用210ml裂解缓冲液再悬浮细胞糊后,抽出35ml以进行进一步处理。
通过使用q700超声发生器(qsonica)以及以下工作循环进行超声处理将人精氨酸酶从35ml的细胞再悬浮液中释放:开启10秒,关闭30秒,开启3.5分钟)以产生匀浆。在离心(10,000rpm,15分钟)之后,收集所得的上清液,并在水浴中在cocl2存在下进行热沉淀(65℃下15分钟)。通过离心除去沉淀,并使上清液进行另外的纯化步骤。图2显示了匀浆的sds-page结果以及在各种量的cocl2存在下的热沉淀结果,表明在至少20mm的cocl2存在下在65℃的温度下持续约15min观察到精氨酸酶的最佳回收率。该方法步骤不仅除去了热敏杂质,而且用钴替换了螯合离子。
通过阴离子交换色谱法的部分纯化
通过热沉淀产生的上清液(26.5ml)通过0.45μm过滤器(agilent,captivatmeconofilterpes膜,25mm,0.45μm)过滤,并用100mlmilliqtm水和110ml20mmtris缓冲液(ph8.1)稀释以产生加载样品(ph7.95,电导率:1.213ms/cm)。
在aktatmprimeplus(gehealthcarelifesciences)上的fplc进行纯化,该aktatmprimeplus配有装有captoqtm(1×6.8cm,gehealthcarelifesciences)的色谱柱,该色谱柱先前已用20mmtris缓冲液ph8.1平衡过。收集流速为3.5ml/min的流出物(flowthrough),以进行进一步纯化。在该过程期间监测uv吸收;结果在图3中显示。在captoqtm色谱期间中收集的级分的sds-page分析结果在图4中显示。显而易见的是,人精氨酸酶1连同一些少量污染物保留在流过级分中。
通过阳离子交换色谱的另外纯化
将15ml的50mmmes(mes一水合物)缓冲液(ph6.7)添加到从captoqtm柱获得的流过级分中,并在以3.9ml/min的流速加载到captostm柱(1×10cm,gehealthcarelifesciences)之前通过添加6n盐酸将ph调节至6.2。captostm柱先前已用50mmmes缓冲液(ph6.7)进行平衡。在平衡缓冲液中以0至0.5mnacl的线性梯度洗脱人精氨酸酶1。监测uv吸收率;典型的结果如图5所显示。图6中显示了在captostm色谱法期间收集的级分的sds-page分析结果。显而易见的是,使用简单的nacl梯度以高纯度洗脱人精氨酸酶1,只有很少的注意到的污染物明显,sds-page凝胶超载。
即使在使sds-page凝胶超载的蛋白浓度下也没有明显的污染物,表明该人精氨酸酶1制剂的纯度至少为90%、95%、98%、99%或更高。应当领会,无需聚组氨酸或其他亲和力“标签”序列即可实现该纯度,并且代表了天然蛋白序列的纯化。发明人设想,本发明构思的方法和组合物可用于纯化序列修饰和/或衍生的(例如,聚乙二醇化的)人精氨酸酶,以及在衍生化反应的反应产物中分离未反应的人精氨酸酶的衍生产物。
方法产率和表达水平评估
表1提供了纯化方法中各个点的方法产率的评估。除了captos库的蛋白浓度是使用uv分光光度计(multiskantmgo,thermoscientifictm)通过280nm处的uv吸光度测量之外,使用imagestudiolitetmversion5.2(li-corbiosciences)通过光密度法测量蛋白质浓度。1mg/ml时在280nm处的消光系数为0.703。
表1
在该实施例中,总产率估计为28.5%。
具有各种peg部分的缀合人精氨酸酶1的制备
获得纯化的具有300~450u/mg的催化活性的经序列修饰的钴螯合的人精氨酸酶-1(seqidno1),并如上所述纯化,用于随后用不同的马来酰亚胺衍生的peg进行聚乙二醇化。使用四种peg-马来酰亚胺进行选择性缀合,即,20l(20-kd直链peg-马来酰亚胺,购自jenkemtechnologyusa,目录号为m-mal-20k)、20vsinopeg#06020101912(20-kd“v”构型的peg-马来酰亚胺,购自nofcorp.,目录号gl2-200ma)、20y(20-kd“y”构型的peg-马来酰亚胺,购自sinopeg#06020501954)和40y(40-kd“y”构型的peg-马来酰亚胺,购自jenkemtechnologyusa,目录号为y-mal-40k)。为了缀合,使5mg/ml的上述人精氨酸酶1与不同摩尔比的各自peg试剂在4-10℃,ph6.7下反应。将反应混合物在该降低的温度下温育至少48小时。然后用尺寸排阻色谱或阳离子交换色谱(可能更适合大规模制备)分离单聚乙二醇化产物。对于阳离子交换色谱,使用含有0.1mnacl的20mmmesph6.3缓冲液作为洗脱缓冲液,使用macrocaptmsp柱纯化聚乙二醇化产物。
将通过sds-page所确定的含有单聚乙二醇化产物的级分合并、浓缩并用pbsph7.4缓冲液透析。使用消光系数为0.703的0.1%(1mg/ml)溶液在280nm下通过紫外光谱直接确定最终蛋白浓度。
马来酰亚胺衍生的peg对于巯基的蛋白缀合有效,以在ph6.5至7.5下以有效地形成稳定的硫醚键。当ph值大于7.5时,可能会发生朝向伯胺的反应,而马来酰亚胺基团的稳定性会随着ph值增加而降低。已知人精氨酸酶使用这种衍生的亲水性聚合物相对抵抗缀合。人精氨酸酶是同源三聚体。发明人相信(不希望受理论束缚),即使巯基缀合反应是选择性的(例如,由于位阻),第一peg分子的结合也可能会阻碍同源三聚体上的第二结合。结果,通常使用大过量摩尔比的peg试剂以确保完全反应。例如,在常规反应条件下,在室温下温育35小时后,添加6倍摩尔的peg可以产生71.1%的单聚乙二醇化产物;在室温下温育46小时后,8倍摩尔过量添加产生86.3%的单聚乙二醇化产物。
令人惊讶地,发明人发现,即使在使用严格的缀合条件下(比如,弱酸性ph),当缀合反应在降低的温度(例如,小于10℃)下进行时,使用最少的peg试剂也可以实现高缀合产率。不希望受到理论的束缚,发明人相信降低的温度延长了马来酰亚胺偶联基团的半衰期,使得增加了第二和第三缀合的可能性。反应的ph可以为约ph6.7,以便有利于巯基的选择性缀合。
用不同摩尔比(例如,2倍、4倍、6倍)的peg-马来酰亚胺试剂研究了聚乙二醇化动力学。在添加peg-马来酰亚胺并在约4℃下温育后,将粗反应混合物用4×体积的20mmmesph6.3缓冲液稀释,然后通过阳离子交换剂(macrocaptmsp)纯化。将稀释的反应混合物加载到柱上后,通过用20mmmesph6.3缓冲液洗涤除去过量的peg。然后用含有0.1mnacl的相同缓冲液洗脱单聚乙二醇化的精氨酸酶。经过针对pbs缓冲液和浓度的广泛透析后,最终产品的比活为425u/mg。
通过反相超高效液相色谱法(rp-uplc)确定随时间在降低的温度下的聚乙二醇化产率(单聚乙二醇化产物)。结果在图7中显示,表明相对于人激酶1的4倍摩尔过量的peg-马来酰亚胺足以在48小时内达到95%的产率。发明人认为,在降低的温度下给予延长的温育(例如,48小时或更长时间),3倍摩尔过量足以达到相似的产率。
聚乙二醇化的人精氨酸酶1在健康大鼠中的药效学研究
动物:为每个测试组选择三只健康的幼年雄性sd大鼠。通过指示剂量的iv递送向每组大鼠施用人精氨酸酶缀合物。对于每只动物,使用1-ml注射器使用含有抗凝剂(肝素钠)的样品管在适当的时间点从颈静脉收集约0.8ml的全血的样品。通过将血液样品以3,000rpm立即离心10分钟来制备血浆样品。获得上清液(0.3-0.4ml)并将其分成2个样品,每个样品都存储在-80℃。
精氨酸定量:使用以下以及表2所示出的条件,使用agilent6460液相色谱和电喷雾电离三重四极杆ms系统通过与已知浓度的精氨酸进行比较,确定了精氨酸的血浆浓度。
柱:agilentzorbaxrrhdhilic
流动相a:5mmnh4coo-/0.1%甲酸;b:在乙腈中的0.1%甲酸。
流速:0.2ml/min;注射体积1μl。
运行时间(包括平衡):15min。
检测:极性+
表2
对照制备:制备30mm的精氨酸储备溶液。在1%bsa/pbs缓冲液中制备4、10、25、75、100、150、200和250μm精氨酸的工作标准液。制备约60μg/ml的辛弗林储备液。辛弗林用作内标,以标准化如下所述的样品预处理步骤的回收率。
样品预处理:向50μl的血浆样品中添加10μl的辛弗林储备液,然后添加540μlmeoh,以沉淀样品中的蛋白质。涡旋以确保完全混合。高速离心以使沉淀自旋向下,将上清液进行uplc/ms分析。精氨酸标准液
分析和计算:针对对照标准样品计算的选定产物离子的面积用于确定精氨酸的浓度。定量限为约5μm。
通过单次静脉内(iv)递送确定了健康大鼠中精氨酸消耗的潜力。由于计算误差,三种缀合物,即,a20cl(与20kd直链peg缀合的精氨酸),a20cv(与20kd“v形”支化的peg缀合的精氨酸)和a40cy(与40kd“y形”支化的peg缀合的精氨酸)分别给出为2.4mg/kg、3.3mg/kg和2.8mg/kg。血浆精氨酸后处理在图8中显示,表明成功的精氨酸消耗为持续5天健康的雄性大鼠中95%血浆精氨酸(相对于给药前水平)。
使用通过静脉内递送以1.2和0.4mg/kg接受a20cl的大鼠进行了剂量发现研究,随后监测血浆精氨酸浓度。结果在图9中显示。用1.2mg/ml的a20cl进行处理会导致持续约5天低水平的血浆精氨酸(<10μm)。如图10中所显示,在治疗期间,没有发现明显的体重减轻。这表明peg修饰的精氨酸酶具有良好的耐受性。
将直链和支化peg在修饰人精氨酸酶1以便进行精氨酸消耗的潜力方面进行了面对面的比较。在第0天分别向三只雄性健康大鼠以2mg/kg给予a20cl和a20cy。相对血浆精氨酸浓度的结果在图11中显示。如所显示,直链和y型缀合物连续至少5天成功消耗90%的血浆精氨酸。
如图12所显示,在用直链或支化peg修饰的精氨酸酶治疗期间未观察到明显的体重减轻。这表明直链和支化的peg修饰的精氨酸酶均具有良好的耐受性。
人精氨酸酶1的分子量
采用与agilent6540uhd精确质量q-toflc/ms系统联用的uplc系统,通过反相(rp)色谱法分析了突变型人精氨酸酶1的分子量。
纯化的精氨酸酶的质谱m/z在图13中显示,其表明去卷积的质量为34,572.3da。这与衍生自突变型人激酶(即,没有n-末端met)的氨基酸序列的平均质量34,571.6da非常一致。
肽作图和缀合位点的确定
在4m尿素的存在下,在含有2mg/ml蛋白质和2%(w/w)测序级lys-c的50mmtrisph8缓冲液中制备蛋白水解溶液。在室温下温育6小时后,添加tfa或甲酸以获得0.1%的最终浓度以便淬灭反应。注射之前,可通过离心或通过0.2或0.4μm膜过滤除去沉淀。
使用lc/ms系统,特别是与agilent6540uhd精确质量q-toflc/ms系统联用的agilent1290infinityuplc系统进行肽鉴定。
使用以下和表3中列出的条件进行色谱分析步骤:
柱:与用于分子量确定的色谱柱相同(参见上文)
流动相和梯度:
流动相a:水中的0.1%(v/v)tfa
流动相b:100%(v/v)乙腈中的0.1%(v/v)tfa
流速:0.4ml/min
注射量:10μg
表3
通过与lc-ms联用的肽作图鉴定了聚乙二醇化人激酶1的聚乙二醇化位点。蛋白质被内蛋白酶lys-c消化,该内蛋白酶lys-c在4m尿素存在下选择性地水解赖氨酸残基c端上的肽键。如图14所显示,所有蛋白水解肽均被成功指定,其中赖氨酰肽总结在表4中。聚乙二醇化人精氨酸酶1的肽图表明在k6肽处的缀合,其中cys-44是唯一易被巯基修饰的位点。
表4
酶活性和动力学
通过在强酸、硫代氨基脲和fe3+的存在下检测尿素的二乙酰一肟(damo)衍生化,同时加热以产生在540nm处具有最大吸光度的生色团来确定催化活性。测定显示尿素在0至15mm之间呈线性,其具有1.25mm的较低检测限。通常,通过在预先设定为37℃的加热块上温热30μl血浆样品和阳性对照3分钟来启动反应。加入30μl精氨酸底物后,将混合物在37℃下温育5分钟,然后通过添加30μl的25%三氯乙酸(tca)淬灭。离心后,将10μl工作尿素标准品、样品/阳性对照或空白对照与300μl显色试剂(含有damo和硫代氨基脲)混合,并将混合物在预设为100℃的加热块上温育10分钟。测量所得样品在540nm的吸光度以确定尿素浓度。精氨酸酶活性的单位定义为每分钟1微摩尔的尿素产量。
血浆中的精氨酸酶活性随时间变化显示在图15中。计算出的a20cl和a20cy的半衰期(t1/2)分别为17.0小时和17.6小时。第5天后采集的血浆样品中未检测到活性。
酶联免疫吸附测定(elisa)
使用夹心elisa确定聚乙二醇化人精氨酸酶1的血浆浓度。该测定利用针对人精氨酸酶1的兔多克隆抗体(sinobiologicals#11558-rp01)作为捕获抗体,并利用羊多克隆抗精氨酸酶抗体(r&dsystems#af5868)与hrp连接的抗山羊igg抗体(r&dsystems#haf017)作为检测抗体。
图16显示了2mg/kg的单次iv剂量的peg修饰的人精氨酸酶1之后免疫反应性peg修饰的人精氨酸酶1的血浆浓度的elisa研究结果。给药后24小时,a20cl(与20lpeg缀合)和a20cy(与20ypeg缀合)的血浆浓度分别为1013±119ng/ml和2239±257ng/ml。给药前和给药后120小时收集的所有样品的浓度均低于检测限(160ng/ml)。因而,计算出a20cl和a20cy的半衰期分别为22.6小时和20.3小时,这与提到的酶活性的半衰期一致。
为了增强序列修饰的重组人精氨酸酶(rharg)的抑制作用,发明人使用rharg和天冬酰胺酶(asnase)同时剥夺了癌细胞的精氨酸和天冬酰胺。发明人认为,由于天冬酰胺作为氨基酸交换因子,天冬酰胺的剥夺至少可以与精氨酸剥夺产生互补作用。认为天冬酰胺可以调节精氨酸向细胞的导入,从而影响精氨酸介导的mtorc1活化。发明人推测,天冬酰胺的剥夺会损害精氨酸向细胞内mtorc1的转运。
癌细胞中天冬酰胺的剥夺的影响可能取决于细胞中存在的产生天冬酰胺的酶——天冬酰胺合成酶(asns)的量(richardsandkilberg2006;balasubramanian,butterworthetal.2013;liu,dongetal.2013)。为了评估其可能具有的影响,发明人利用rharg和asnase来治疗(i)相对较低的asns表达乳腺细胞系mda-mb-231、mcf7和zr-75-1(yang,heetal.2014)和(ii)高asns表达细胞系hela(guerrini,gongetal.1993)、mia-paca-2(liu,dongetal.2013)和hepg2(gjymishka,suetal.2009)。比较了每种药物(rharg,asnase)单独以及组合的功效。
实施例
以上详述了重组人精氨酸酶(rharg)的表达、纯化和聚乙二醇化的示例性步骤。精氨酸酶的一个单位定义为在30℃,ph8.5下每分钟产生1μmol尿素的酶的量。天冬酰胺酶(asnase)购自sigma(a3809)。
mtt测定:低asns表达乳腺癌细胞系(mcf-7、zr-75-1和mda-mb-231)和高asns表达癌细胞系(hela、hepg2和mia-paca-2)购自atcc。将细胞以5×103个细胞/孔的密度接种在96孔板中。温育1天后,将培养基替换为含有各种浓度的rharg的培养基。对于组合测定(即,利用精氨酸酶和天冬酰胺酶二者),将培养基替换为含有恒定摩尔比(例如,5rharg:1asnase)的不同浓度的rharg和asnase的培养基(chou2010)。在第3天(药物治疗后3天)进行mtt测定。用mtt溶液(1mg/ml)(invitrogen)替换培养基,并在37℃下温育4小时。温育4小时后,用二甲基亚砜(dmso)替换mtt溶液,并以650nm为参照测量570nm处的吸光度。通过将处理细胞的吸光度除以未处理细胞的平均吸光度来确定细胞活力。对每个细胞系进行三组独立的实验(n=3)。使用prismtm6.01版本分析数据。
组合指数(ci)的计算:使用calcusyntm2.1版本计算rharg和asnase处理的组合指数。ci为药物的组合作用提供了一个值,比如,大于叠加作用(ci<1,协同作用),小于叠加作用(ci>1,拮抗作用)或类似于叠加作用(ci=1)。
发明人发现单独的asnase不能对大多数低和高asns表达细胞系提供令人满意的抑制作用。图17显示了(i)低asns表达和(ii)高asns表达癌细胞中asnase的剂量响应曲线。asnase表现出较低的抑制作用(<20%细胞抑制),范围为0.016至0.4u/ml。在mda-mb-231、zr-75-1、mcf7、hela和hepg2处可检测到60-70%的细胞活力。在mia-paca-2处检测到约40%的细胞活力。
令人惊讶的是,在低asns表达细胞系中,与单独的rharg相比,rharg和asnase的组合提供了显著改善的抑制作用。图18显示了在(i)低asns表达和(ii)高asns表达的癌细胞中单独的rharg(实线)以及rharg和asnase的组合(虚线)的剂量-响应曲线。在低asns表达细胞系中,rharg和asnase组合处理可在各种浓度下显著改善细胞抑制作用。组合的rharg-asnase处理对mda-mb-231的抑制作用显示出令人满意的改善。在高asns表达细胞系中,组合疗法平均会略微改善(<5%)抑制作用。发明人发现,rharg-asnase组合疗法在低asns表达细胞系中而不是在高asns表达的细胞系中提供了预料不到的强协同作用。
具有不同浓度的rharg和asnase组合的组合指数(ci)在表5中显示。令人惊讶地,对于低asns表达细胞系mda-mb-231、zr-75-1和mcf7,所有组合均表现出抑制癌细胞生长的协同作用(ci<1)。对于高asns表达细胞系hela、hepg2和mia-paca2,大多数rharg和asnase组合均显示出抑制细胞生长的拮抗作用(ci>1)。
表5
发明人发现,仅天冬酰胺的剥夺对癌细胞几乎没有抑制作用。除急性淋巴细胞白血病(all)外,这种仅剥夺天冬酰胺似乎不是治疗癌症的有效方法。发明人通过在这些白血病细胞中天冬酰胺合成酶(asns)的低表达来推测asnase对all的有效性(su,panetal.2008)。
发明人推测,在如上所述的组合疗法中,精氨酸剥夺可以使mtorc1失活,而天冬酰胺剥夺可以损害精氨酸在细胞内导入mtorc1蛋白。组合疗法的功效会受到癌细胞中asns表达水平的影响,因为高asns表达水平会从谷氨酰胺中产生天冬酰胺(horowitzandmeister1972)。表现出高asns表达水平的hela、hepg2和mia-paca2,相对于表现出低asns水平的癌细胞,在组合疗法中显示出降低的改善。ci计算显示,低asns表达细胞系(比如mda-mb-231、zr-75-1和mcf7)在大多数组合浓度下均表现出明显的rharg-asnase协同作用。然而,在高asns表达细胞系(比如hela、hepg2和mia-paca2)中观察到了较差的协同作用。结果与细胞活力测定一致。发明人推测,高asns表达细胞系能够产生足够的天冬酰胺以减轻组合疗法的功效。发明人认为,asns的表达水平可用于预测rharg-asnase组合疗法的有效性,并可用于开发定制的药物疗法。
基于在各种癌细胞系上用精氨酸酶和天冬酰胺酶组合疗法的结果,发明人认为,在体外,谷氨酰胺还可以与精氨酸和天冬酰胺同时被剥夺用于癌症治疗。谷氨酰胺剥夺疗法的功效在很大程度上取决于c-myc表达的表达水平(wiseandthompson2010)。发明人认为,用化合物组合疗法以减少精氨酸(比如,精氨酸酶)、天冬酰胺(比如,天冬酰胺酶)和谷氨酰胺(比如,氨基转移酶抑制剂氨基氧乙酸盐或aoa、6-重氮-5-氧代-l-正亮氨酸、重氮丝氨酸和/或阿西维汀)可以高度有效地抑制癌细胞的生长。不希望受到理论的束缚,发明人假设精氨酸、天冬酰胺和谷氨酰胺剥夺可以通过精氨酸去除(例如,通过rharg)来使mtorc1失活,并且细胞内精氨酸的浓度可以通过减少天冬酰胺和谷氨酰胺(例如,通过asnase和aoa)而保持在较低水平。
使用上述方法,可以高效地将精氨酸酶聚乙二醇化,并以高纯度、比活性和产率分离。这种聚乙二醇化的精氨酸酶在体外表现出延长的半衰期,可有效降低精氨酸浓度,并且具有良好的耐受性。因此,发明人认为如上所述分离和缀合的精氨酸酶特别适用于癌症治疗的治疗用途,特别是当这种癌症显示出低的天冬酰胺酶活性时。基于当与天冬酰胺酶组合使用时针对不同癌细胞系的预料不到且显著的协同作用的证据,发明人认为,如上所述制备并与天冬酰胺酶组合使用的聚乙二醇化精氨酸酶可以在癌症的治疗中提供类似的协同作用。在这种治疗方法中使用的天冬酰胺酶也可以被聚乙二醇化或者与类似的亲水性聚合物缀合以延长血清半衰期。
在优选的实施方式中,提供了呈现类似药代动力学的精氨酸酶和天冬酰胺酶,从而允许同时施用。这种酶可以通过任何合适的方法来提供,包括注射、输注和/或跨粘膜吸附(例如,通过吸入)。合适的治疗方案可以通过所用酶的药代动力学来确定,并且可以适应于不同的肿瘤类型和/或表型。例如,与具有表达较低水平的天冬酰胺酶的个体相比,具有表达相对高水平的天冬酰胺酶的肿瘤的个体可以更频繁地和/或用更高剂量的精氨酸酶和/或天冬酰胺酶治疗。合适的治疗方案可包括每12小时、24小时、36小时、48小时、3天、4天、5天、7天、10天、14天21天、28天或超过28天施用精氨酸酶、天冬酰胺酶和/或精氨酸酶和天冬酰胺酶的混合物。在一些实施方式中,施用频率可以在整个治疗过程中变化,并且可以包括延伸超过初始治疗时间的维持剂量。在优选的实施方式中,精氨酸酶以如上所述制备的聚乙二醇化精氨酸酶的形式提供。天冬酰胺酶也可以以聚乙二醇化的形式提供。如上所述,发明人还认为,通过使用氨基转移酶抑制剂来减少谷氨酰胺可用于减少癌细胞的生长。这样,如上所述的精氨酸酶/天冬酰胺酶治疗方案可以包括使用有效降低谷氨酰胺的血液浓度的氨基转移酶抑制剂(比如氨基氧乙酸盐或aoa、6-重氮基5-氧代-l-正亮氨酸、重氮丝氨酸和/或阿西维汀)。
参考文献
balasubramanian,m.n.,e.a.butterworth,etal.(2013)."asparaginesynthetase:regulationbycellstressandinvolvementintumorbiology."amjphysiolendocrinolmetab304(8):e789-799.
bar-peled,l.,l.d.schweitzer,etal.(2012)."ragulatorisageffortheraggtpasesthatsignalaminoacidlevelstomtorc1."cell150(6):1196-1208.
carroll,b.,d.maetzel,etal.(2016)."controloftsc2-rhebsignalingaxisbyarginineregulatesmtorc1activity."elife5.
chantranupong,l.,s.m.scaria,etal.(2016)."thecastorproteinsareargininesensorsforthemtorc1pathway."cell165(1):153-164.
cheng,p.n.,t.l.lam,etal.(2007)."pegylatedrecombinanthumanarginase(rharg-peg5,000mw)inhibitstheinvitroandinvivoproliferationofhumanhepatocellularcarcinomathroughargininedepletion."cancerres67(1):309-317.
chou,t.c.(2010)."drugcombinationstudiesandtheirsynergyquantificationusingthechou-talalaymethod."cancerres70(2):440-446.
feun,l.,m.you,etal.(2008)."argininedeprivationasatargetedtherapyforcancer."currpharmdes14(11):1049-1057.
gjymishka,a.,n.su,etal.(2009)."transcriptionalinductionofthehumanasparaginesynthetasegeneduringtheunfoldedproteinresponsedoesnotrequiretheatf6andire1/xbp1armsofthepathway."biochemj417(3):695-703.
guerrini,l.,s.s.gong,etal.(1993)."cis-andtrans-actingelementsinvolvedinaminoacidregulationofasparaginesynthetasegeneexpression."molcellbiol13(6):3202-3212.
hensley,c.t.,a.t.wasti,etal.(2013)."glutamineandcancer:cellbiology,physiology,andclinicalopportunities."jclininvest123(9):3678-3684.
horowitz,b.anda.meister(1972)."glutamine-dependentasparaginesynthetasefromleukemiacells.chloridedependence,mechanismofaction,andinhibition."jbiolchem247(20):6708-6719.
korangath,p.,w.w.teo,etal.(2015)."targetingglutaminemetabolisminbreastcancerwithaminooxyacetate."clincancerres21(14):3263-3273.
krall,a.s.,s.xu,etal.(2016)."asparaginepromotescancercellproliferationthroughuseasanaminoacidexchangefactor."natcommun7:11457.
lam,t.l.,g.k.wong,etal.(2009)."recombinanthumanarginaseinhibitsproliferationofhumanhepatocellularcarcinomabyinducingcellcyclearrest."cancerlett277(1):91-100.
liu,r.y.,z.dong,etal.(2013)."overexpressionofasparaginesynthetaseandmatrixmetalloproteinase19conferscisplatinsensitivityinnasopharyngealcarcinomacells."molcancerther12(10):2157-2166.
richards,n.g.andm.s.kilberg(2006)."asparaginesynthetasechemotherapy."annurevbiochem75:629-654.
saxton,r.a.,l.chantranupong,etal.(2016)."mechanismofargininesensingbycastor1upstreamofmtorc1."nature536(7615):229-233.
su,n.,y.x.pan,etal.(2008)."correlationbetweenasparaginasesensitivityandasparaginesynthetaseproteincontent,butnotmrna,inacutelymphoblasticleukemiacelllines."pediatrbloodcancer50(2):274-279.
tsui,s.m.,w.m.lam,etal.(2009)."pegylatedderivativesofrecombinanthumanarginase(rharg1)forsustainedinvivoactivityincancertherapy:preparation,characterizationandanalysisoftheirpharmacodynamicsinvivoandinvitroandactionuponhepatocellularcarcinomacell(hcc)."cancercellint9:9.
wang,s.,z.y.tsun,etal.(2015)."metabolism.lysosomalaminoacidtransporterslc38a9signalsargininesufficiencytomtorc1."science347(6218):188-194.
wise,d.r.andc.b.thompson(2010)."glutamineaddiction:anewtherapeutictargetincancer."trendsbiochemsci35(8):427-433.
yang,h.,x.he,etal.(2014)."down-regulationofasparaginesynthetaseinducescellcyclearrestandinhibitscellproliferationofbreastcancer."chembioldrugdes84(5):578-584.
zheng,l.,w.zhang,etal.(2016)."recentadvancesinunderstandingaminoacidsensingmechanismsthatregulatemtorc1."intjmolsci17(10).
对于本领域的技术人员显而易见的是,除了已经描述的那些之外,在不脱离本文的发明构思的情况下,可以进行更多的修改。因此,除了所附权利要求的精神之外,本发明的主题不受限制。此外,在解释说明书和权利要求书时,应以与上下文一致的尽可能广泛的方式解释所有术语。特别地,术语“包括(comprise,comprising)”应被解释为以非排他性的方式指代元素、组分或步骤,指示所引用的元素、组分或步骤可以存在,被利用或与其他未明确引用的元素、组分或步骤组合。在说明书权利要求书中引用选自a、b、c…和n中的至少一种时,则该文本应解释为仅需要组中的一个要素,而不是a加n或b加n等。
序列表
<110>阿瓦隆博利通(香港)有限公司
<120>用于氨基酸消耗疗法的组合物和方法
<130>103228.0001pct
<150>us62/546489
<151>2017-08-16
<150>us62/591102
<151>2017-11-27
<160>1
<170>patentinversion3.5
<210>1
<211>321
<212>prt
<213>人工序列
<220>
<223>人精氨酸酶1的突变,n-末端甲硫氨酸缺失。
<400>1
seralalysserargthrileglyileileglyalapropheserlys
151015
glyglnproargglyglyvalglugluglyprothrvalleuarglys
202530
alaglyleuleuglulysleulysgluglnglucysaspvallysasp
354045
tyrglyaspleuprophealaaspileproasnaspserprophegln
505560
ilevallysasnproargservalglylysalasergluglnleuala
65707580
glylysvalalagluvallyslysasnglyargileserleuvalleu
859095
glyglyasphisserleualaileglyserileserglyhisalaarg
100105110
valhisproaspleuglyvaliletrpvalaspalahisthraspile
115120125
asnthrproleuthrthrthrserglyasnleuhisglyglnproval
130135140
serpheleuleulysgluleulysglylysileproaspvalprogly
145150155160
phesertrpvalthrproserileseralalysaspilevaltyrile
165170175
glyleuargaspvalaspproglygluhistyrileleulysthrleu
180185190
glyilelystyrphesermetthrgluvalaspargleuglyilegly
195200205
lysvalmetglugluthrleusertyrleuleuglyarglyslysarg
210215220
proilehisleuserpheaspvalaspglyleuaspproserphethr
225230235240
proalathrglythrprovalvalglyglyleuthrtyrargglugly
245250255
leutyrilethrglugluiletyrlysthrglyleuleuserglyleu
260265270
aspilemetgluvalasnproserleuglylysthrproglugluval
275280285
thrargthrvalasnthralavalalailethrleualaserphegly
290295300
leualaarggluglyasnhislysproileasptyrleuasnpropro
305310315320
lys
- 还没有人留言评论。精彩留言会获得点赞!