作为毒蕈碱M1受体正向别构调节剂的多环酰胺的制作方法
本发明涉及作为毒蕈碱m1受体正向别构调节剂(muscarinicm1receptorpositiveallostericmodulator,m1pam)的式(i)化合物或其同位素形式、立体异构体或可药用盐。本发明还描述了制备这样的化合物的方法、包含这样的化合物的药物组合物及其用途。
背景技术:
毒蕈碱乙酰胆碱受体(muscarinicacetylcholinereceptor,machr)属于g蛋白偶联受体(gprotein-coupledreceptor,gpcr)的a类家族,其在全身广泛表达。迄今为止,已经鉴定出响应内源性神经递质乙酰胆碱(ach)的五种亚型,称为m1至m5。它们在调节中枢和外周神经系统的许多重要功能(包括认知功能)的活性中发挥关键作用。m1、m3和m5与gq偶联,而m2和m4通过gi/o与下游信号传导途径和相关效应物系统偶联(criticalreviewsinneurobiology,1996,10,69-99;pharmacology&therapeutics,2008,117,232-243)。m2和m3在外周高度表达,并且已知其参与胃肠道(gi)运动和副交感神经应答(例如分泌唾液)(lifesciences,1993,52,441-448)。m1毒蕈碱受体主要在参与认知的脑区域(例如皮质、海马和杏仁核)中表达,并因此预期m1受体的选择性活化会促进认知能力(annalsofneurology,2003,54,144-146)。
占诺美林(xanomeline)是对m1和m4亚型具有合理选择性的毒蕈碱乙酰胆碱受体激动剂,其在临床阿尔茨海默病(alzheimer'sdisease,ad)试验中对认知产生显著作用(alzheimerdiseaseandassociateddisorders,1998,12(4),304-312),尽管胃肠副作用导致临床试验中的高脱试率(dropoutrate)。毒蕈碱受体亚型在其正构乙酰胆碱配体结合位点之间存在高度保守性,这使得难以鉴定m1选择性激动剂。
为了规避该选择性和安全性问题,替代方法由开发在较不保守的别构结合位点发挥作用的m1pam组成。merck报道了m1pam,pqca(1-{[4-氰基-4-(吡啶-2-基)哌啶-1-基]甲基}-4-氧代-4h-喹嗪-3-羧酸)的开发。相对于其他毒蕈碱受体亚型,该化合物对m1具有高选择性,并发现其在数种临床前认知模型中有效(psychopharmacology,2013,225(1),21-30),在等于或小于与改善认知所需的最小有效剂量相差五倍的剂量下没有胃肠副作用。在临床前研究中,证明m1活化提高了脑中神经递质乙酰胆碱的浓度。此外,通过将app加工转变为非促淀粉样(non-amyloidogenic)α-分泌酶途径以及通过降低tau过度磷酸化二者,m1活化具有作为对ad的疾病改善治疗的潜力。已证明m1受体的正向别构调节剂在体外提高sappα的产生(thejournalofneuroscience,2009,29,14271-14286)。因此,m1pam提供了靶向ad和精神分裂症中认知缺陷的对症治疗和疾病修饰治疗二者的方法。
pct专利申请公开wo2017155050、wo2017143041、wo2017123482和wo2011149801已经公开了一些m1pam化合物。尽管迄今为止在文献中已经公开了数种m1pam,但市场上还没有推出用作m1pam的药物。
尽管现有技术公开了可用于治疗cns相关疾病的m1pam化合物,但存在差的脑渗透性和胆碱能副作用如唾液分泌过多、腹泻和呕吐的问题。因此,发现和开发具有良好的脑渗透性且没有胆碱能副作用的新m1pam用于治疗cns相关病症的需求和范围尚未得到满足。
发明概述
在第一方面,本发明涉及式(i)化合物的m1pam或者其同位素形式、立体异构体、互变异构体或可药用盐,
其中:
r1为-(c6-10)-芳基或-(c5-10)-杂芳基;其各自任选地被选自卤素、-oh、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-n(ch3)2、-(c1-6)-烷基、-(c3-6)-环烷基、卤代(c1-6)-烷基、-nh2、-cn和r1a的一个或更多个取代基取代;
r1a是-(c6-10)-芳基或-(c5-10)-杂芳基;其各自任选地被选自卤素、-oh、-nh2、-cn、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-(c1-6)-烷基和-(c3-6)-环烷基的一个或更多个取代基取代;
a1是ch2或chf;
环a选自:
r2是氢、-(c1-6)-烷基或-(c3-6)-环烷基;
r3是氢、卤素、-oh、-(c1-6)-烷基、-o-(c1-6)-烷基或卤代(c1-6)-烷基;
r4是氢、-(c1-6)-烷基或卤代(c1-6)-烷基;
r5是氢、-(c1-6)-烷基或卤代(c1-6)-烷基;
x1独立地选自o、s、nh或nch3;
y1独立地选自n或ch;
x独立地选自ch2、o、nh或nch3;并且
y独立地选自ch2、o、nh或nch3。
在另一方面,本发明涉及用于制备式(i)化合物或者其立体异构体或可药用盐的方法。
在另一方面,本发明涉及药物组合物,其包含治疗有效量的至少一种式(i)化合物或者其立体异构体或可药用盐,以及可药用赋形剂或载体。
在另一方面,本发明涉及式(i)化合物或者其立体异构体或可药用盐,其与选自乙酰胆碱酯酶抑制剂和nmda受体拮抗剂的一种或更多种其他治疗剂组合。
在另一方面,本发明涉及式(i)化合物或者其立体异构体或可药用盐,其用作毒蕈碱m1受体正向别构调节剂。
在另一方面,本发明涉及式(i)化合物或者其立体异构体或可药用盐,其用于治疗选自认知、疼痛或睡眠障碍的疾病或病症。
在另一方面,本发明涉及式(i)化合物或者其立体异构体或可药用盐,其用于治疗选自阿尔茨海默病、精神分裂症、帕金森病性痴呆(parkinson'sdiseasedementia)、路易体引起的痴呆(dementiaduetolewybody)、疼痛或睡眠障碍的疾病或病症。
在另一方面,本发明涉及用于治疗与毒蕈碱m1受体相关的疾病或病症的方法,该方法包括向有此需要的患者施用治疗有效量的式(i)化合物或者其立体异构体或可药用盐。
在另一方面,本发明涉及式(i)化合物或者其立体异构体或可药用盐在制备用于治疗与毒蕈碱m1受体相关的疾病或病症的药物中的用途。
在另一方面,本发明涉及式(i)化合物或者其立体异构体或可药用盐,其用于毒蕈碱m1受体的正向别构调节。
附图简述
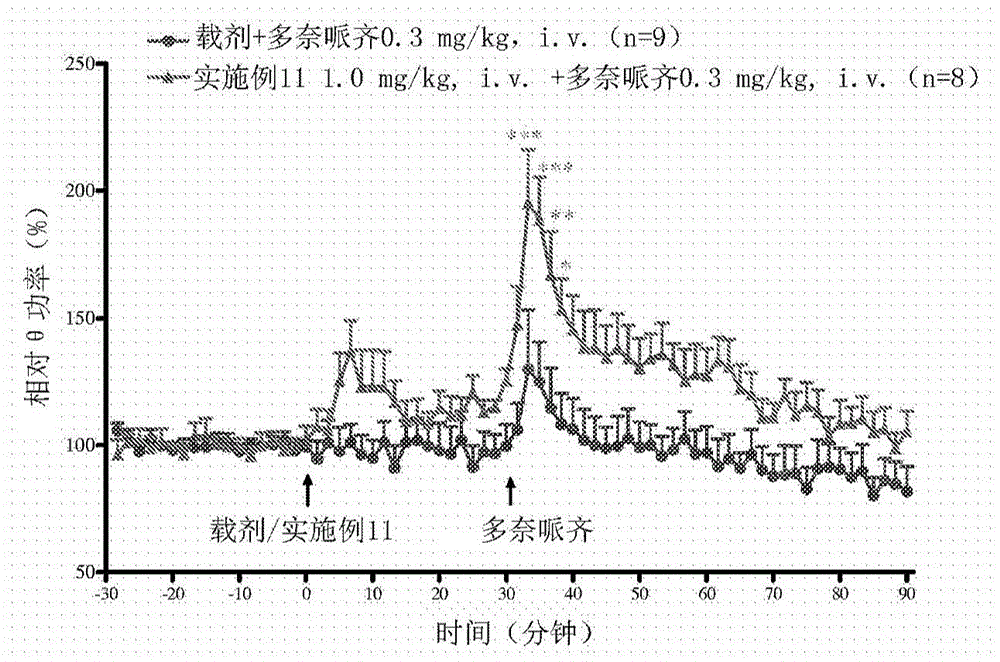
图1:与多奈哌齐组合的受试化合物(实施例11)对海马θ振荡的作用。
发明详述
除非另有说明,否则说明书和权利要求书中使用的以下术语具有以下给出的含义:
本文中使用的术语“(c1-6)-烷基”是指含有1至6个碳原子的支链或直链脂族烃。(c1-6)-烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。优选的(c1-6)-烷基是甲基、乙基或异丙基。
本文中使用的术语“卤素”或“卤代”是指氟、氯、溴或碘。优选地,卤素是氟、氯或溴。更优选地,卤素是氟或氯。
本文中使用的术语“卤代(c1-6)-烷基”是指其中相同或不同碳原子的一个或更多个氢被相同或不同卤素取代的如上定义的(c1-6)-烷基。卤代(c1-6)-烷基的实例包括氟甲基、氯甲基、氟乙基、二氟甲基、二氯甲基、三氟甲基、二氟乙基等。
本文中使用的术语“(c3-6)-环烷基”是指含有3至6个碳原子的饱和单环烃环。(c3-6)-环烷基的实例包括环丙基、环丁基、环戊基和环己基。
本文中使用的术语“(c6-10)-芳基”是指含有六至十个碳原子的芳族烃环。(c6-10)-芳基的实例包括苯基或萘基。
本文中使用的术语“(c5-10)-杂芳基”是指包含五至十个原子的芳族单环或芳族双环杂环环系统。(c5-10)-杂芳基的实例包括1,2,4-
短语“治疗有效量”定义为以下的本发明化合物的量:其(i)治疗特定疾病、病症或障碍(ii)消除特定疾病、病症或障碍的一种或更多种症状(iii)延迟本文中所述的特定疾病、病症或障碍的一种或更多种症状的发作。
本文中使用的术语“同位素形式”是指其中式(i)化合物的一个或更多个原子被其各自的同位素取代的式(i)化合物。例如,氢的同位素包括2h(氘)和3h(氚)。
本文中使用的术语“立体异构体”是指其原子空间排列不同的式(i)化合物的异构体。本文中公开的化合物可以作为单一的立体异构体、外消旋体,和/或对映体和/或非对映体的混合物存在。所有这样的单一立体异构体、外消旋体及其混合物都旨在本发明的范围内。
本文中使用的术语“可药用盐”是指活性化合物(即式(i)化合物)的盐,并且通过与适当的酸或酸衍生物(其取决于本文中所述的化合物上存在的特定取代基)反应来制备。
本文中使用的术语“认知障碍”是指一组主要影响学习、记忆、感知和解决问题的精神健康障碍,包括健忘症、痴呆和谵妄。认知障碍可由疾病、病症、疾患或毒性引起。优选地,认知障碍是痴呆。痴呆的实例包括但不限于阿尔茨海默病性痴呆(dementiainalzheimer′sdisease)、帕金森病性痴呆(dementiainparkinson′sdisease)、亨廷顿病性痴呆(dementiainhuntington′sdisease)、与唐氏综合征相关的痴呆(dementiaassociatedwithdownsyndrome)、与图雷特综合征相关的痴呆(dementiaassociatedwithtourette′ssyndrome)、与绝经后期相关的痴呆(dementiaassociatedwithpostmenopause)、额颞痴呆(frontotemporaldementia)、路易体痴呆(lewybodydementia)、血管性痴呆(vasculardementia)、hiv性痴呆(dementiainhiv)、克罗伊茨费尔特-雅各布病性痴呆(dementiaincreutzfeldt-jakobdisease)、物质诱发的持续性痴呆(substance-inducedpersistingdementia)、皮克病性痴呆(dementiainpick′sdisease)、精神分裂症性痴呆(dementiainschizophrenia)、老年性痴呆(seniledementia)和一般医学病症性痴呆(dementiaingeneralmedicalconditions)。
本文中使用的术语“患者”是指动物。优选地,术语“患者”是指哺乳动物。术语哺乳动物包括例如小鼠、大鼠、狗、兔、猪、猴、马、鸽子、非洲爪蟾(xenopuslaevis)、斑马鱼、豚鼠和人的动物。更优选地,患者是人。
实施方案
本发明涵盖由式(i)化合物(但不限于此)所描述的所有化合物,然而,本发明的一些优选方面和要素在本文中以下面的实施方案的形式讨论。
在一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:环a选自:
其中r2、r4、r5和
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中环a选自:
其中r2、r5和
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中环a选自:
其中x1、y1、r2和r3如第一方面所定义。
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中环a选自:
其中x1、y1、r2、r3和
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:环a选自:
其中r2和
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:环a是
其中r2和
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:r1是-(c6-10)-芳基或-(c5-10)-杂芳基;其各自任选地被选自卤素、-oh、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-n(ch3)2、-(c1-6)-烷基、-(c3-6)-环烷基、卤代(c1-6)-烷基、-nh2和-cn的一个或更多个取代基取代。
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:r1是-(c6-10)-芳基或-(c5-10)-杂芳基;其各自被选自r1a、卤素、-oh、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-n(ch3)2、-(c1-6)-烷基、-(c3-6)-环烷基、卤代(c1-6)-烷基、-nh2和-cn的一个或更多个取代基取代;其中r1a如第一方面所定义。
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:r1是任选地被选自卤素、-oh、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-n(ch3)2、-(c1-6)-烷基、-(c3-6)-环烷基、卤代(c1-6)-烷基、-nh2和-cn的一个或更多个取代基取代的-(c6-10)-芳基。
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:r1是任选地被选自卤素、-oh、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-n(ch3)2、-(c1-6)-烷基、-(c3-6)-环烷基、卤代(c1-6)-烷基、-nh2和-cn的一个或更多个取代基取代的-(c5-10)-杂芳基。
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:r1是被选自r1a、卤素、-oh、-o-(c1-6)-烷基、-s-(c1-6)-烷基、-n(ch3)2、-(c1-6)-烷基、-(c3-6)-环烷基、卤代(c1-6)-烷基、-nh2、-conh2和-cn的一个或更多个取代基取代的-(c6-10)-芳基;其中r1a如第一方面所定义。
在另一个实施方案中,本发明涉及式(i)化合物或者其同位素形式、立体异构体或可药用盐,其中:r1是被一个或更多个r1a取代的-(c5-10)-杂芳基;其中r1a如第一方面所定义。
在另一个实施方案中,本发明的一些优选化合物选自以下或其可药用盐:
n-(顺式-1s,2s-2-羟基环己基)-6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(2,3-二氟苄基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-3s,4s-3-羟基四氢吡喃-4-基)-6-(2-氯吡啶-5-基甲基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(2-氟吡啶-4-基甲基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(2-氟苄基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(2-氯吡啶-5-基甲基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[2-(1-甲基-1h-吡唑-4-基)-吡啶-5-基甲基]-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[2,3-二氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[3-氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(4-吡唑-1-基-苄基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[2-氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(4-噻唑-4-基-苄基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-3s,4s-3-羟基四氢吡喃-4-基)-6-(4-噻唑-4-基-苄基)-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-苄基-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-5-甲基喹啉-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-5-甲基-3,4-二氢-2h-苯并[1,4]
n-(顺式-1s,2s-2-羟基环己基)-6-(4-吡唑-1-基-苄基)-5-甲基-3,4-二氢-2h-苯并[1,4]
n-(顺式-1s,2s-2-羟基环己基)-5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-5-甲基-6-(4-吡唑-1-基-苄基)-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-5-甲基-6-[2-氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[2,3-二氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(2,3-二氟苄基)-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(4-噻唑-4-基-苄基)-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-(4-苯基-苄基)-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[2-氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[2-氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[2-氯吡啶-3-基甲基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[4-(噻唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[2,3-二氟苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[3,4-二氟苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[6-(1-甲基-1h-吡唑-4-基)-吡啶-3-基甲基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-[2,3-二氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-6-[2,3-二氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-2,7-二甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-2,7-二甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-2,7-二甲基-6-(4-噻唑-4-基-苄基)-1h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-3,7-二甲基-6-[2-氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-3h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-3,7-二甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-3h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-3,7-二甲基-6-[2,3-二氟-4-(1-甲基-1h-吡唑-4-基)-苄基]-3h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-3,7-二甲基-6-[6-(1-甲基-1h-吡唑-4-基)-吡啶-3-基甲基]-3h-苯并咪唑-4-甲酰胺;
n-(顺式-1s,2s-2-羟基环己基)-3,7-二甲基-6-[4-(噻唑-4-基)-苄基]-3h-苯并咪唑-4-甲酰胺;以及
n-(顺式-1s,2s-2-羟基环己基)-2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-甲酰胺。
实验程序:
方案-1描述了用于制备式(i)化合物的一般方法,其中:t是-(c1-6)-烷基,a1是ch2;环a、r1、x和y如上所定义。
方案-1
步骤-1:制备式2化合物
在存在[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)以及选自碳酸钾、碳酸铯和碳酸钠的碱的情况下,使式1化合物与式a化合物
r1-a1-cl
a
在溶剂例如水、thf和1,4-二氧六环的混合物中在回流下反应3至7小时以获得式2化合物。
步骤-2:制备式3化合物
使用氢氧化钠在回流下,使式2化合物在溶剂例如水、thf和甲醇的混合物中水解2至17小时得到式3化合物。
步骤-1a:制备式2a化合物
在存在[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)以及选自碳酸钾和碳酸钠的碱的情况下,使式1a化合物与式a化合物
r1-a1-cl
a
在溶剂例如水和1,4-二氧六环的混合物中在回流下反应3至5小时以获得式2a化合物。
步骤-1b:制备式2b化合物
使用氢氧化钾在回流下,使式2a化合物在溶剂例如水和乙醇的混合物中水解2至4小时得到式2b化合物。
步骤-2a:制备式3化合物
使用hcl水溶液,使式2b化合物在95℃至105℃的温度下水解5至7小时得到式3化合物。
步骤-3:制备式(i)化合物
在存在偶联试剂(hatu、dcc或edc)和碱(在选自dmf、thf、二氯甲烷或1,4-二氧六环的溶剂中的dipea)的情况下,使式3化合物与胺
在rt下偶联过夜以获得式(i)化合物。
制备式(i)化合物的可药用盐
通过与适当的酸或酸衍生物反应,可任选地将式(i)化合物转化为其可药用盐。合适的可药用盐对本领域技术人员而言是明显的。所述盐是用无机酸(例如盐酸、氢溴酸、硫酸、硝酸或磷酸)或有机酸(例如草酸、琥珀酸、马来酸、乙酸、富马酸、柠檬酸、苹果酸、酒石酸、苯甲酸、对甲苯甲酸、对甲苯磺酸、苯磺酸、甲磺酸或萘磺酸)形成的。
制备式(i)化合物的立体异构体
式(i)化合物的立体异构体可以通过以下示出的一种或更多种常规方式制备:
a.一种或更多种试剂可以其光学活性形式使用。
b.在还原过程中可以使用光学纯的催化剂或手性配体以及金属催化剂。金属催化剂可以是铑、钌、铟等。手性配体可以优选是手性膦。
c.可通过常规方法(例如与手性酸或手性胺或手性氨基醇或手性氨基酸形成非对映体盐)拆分立体异构体的混合物。然后可通过例如分级结晶、色谱等方法对所得的非对映体混合物进行分离,随后进行另外的步骤,即从拆分的物质/盐中分离出光学活性产物。
d.可通过常规方法拆分(例如微生物拆分,对与手性酸或手性碱形成的非对映体盐进行拆分)立体异构体的混合物。可使用的手性酸可以是酒石酸、扁桃酸、乳酸、樟脑磺酸、氨基酸等。可使用的手性碱可以是金鸡纳生物碱类(cinchonaalkaloid)、马钱子碱或碱性氨基酸(例如赖氨酸、精氨酸等)。
在另一个实施方案中,合适的可药用盐包括盐酸盐、氢溴酸盐、草酸盐、富马酸盐、酒石酸盐、马来酸盐和琥珀酸盐。
在本发明的另一方面,式(i)化合物是毒蕈碱m1正向别构调节剂。
在另一方面,本发明涉及治疗选自认知障碍、精神分裂症、疼痛或睡眠障碍的疾病或病症的方法,其包括向有需要的患者施用治疗有效量的式(i)化合物或其可药用盐。
在另一方面,本发明涉及治疗阿尔茨海默病的方法,其包括向有此需要的患者施用治疗有效量的式(i)化合物或其可药用盐。
在另一方面,本发明涉及治疗阿尔茨海默病的方法,所述阿尔茨海默病包括轻度阿尔茨海默病、中度阿尔茨海默病、重度阿尔茨海默病、轻度至中度阿尔茨海默病或中度至重度阿尔茨海默病,所述方法包括向有此需要的患者施用治疗有效量的式(i)化合物或其可药用盐。
在另一方面,本发明涉及式(i)化合物,其用于治疗选自认知障碍、精神分裂症、疼痛或睡眠障碍的疾病或病症。
在另一方面,本发明涉及式(i)化合物在制备用于治疗选自认知障碍、精神分裂症、疼痛或睡眠障碍的疾病或病症的药物中的用途。
在另一方面,本发明涉及式(i)化合物在制备用于治疗选自认知障碍的疾病或病症的药物中的用途。
在另一方面,本发明涉及式(i)化合物在制备用于治疗阿尔茨海默病的药物中的用途。
在另一个实施方案中,本发明涉及式(i)化合物与一种或更多种其他治疗剂例如乙酰胆碱酯酶抑制剂和nmda受体拮抗剂的组合。
在另一个实施方案中,本发明的式(i)化合物可以与一种或更多种其他治疗剂组合用于治疗本发明的式(i)化合物对其具有效用的疾病或病症。本发明化合物的组合的实例包括与用于治疗阿尔茨海默病的治疗剂(例如乙酰胆碱酯酶抑制剂例如加兰他敏、卡巴拉汀(rivastigmine)、多奈哌齐和他克林;和nmda受体拮抗剂例如美金刚(memantine))的组合。
在另一个实施方案中,本发明涉及式(i)化合物与选自加兰他敏、卡巴拉汀、多奈哌齐、他克林和美金刚的至少一种治疗剂的组合。
在另一个实施方案中,本发明涉及式(i)化合物与一种或更多种其他治疗剂例如乙酰胆碱酯酶抑制剂和nmda受体拮抗剂的组合,其用于治疗认知障碍、精神分裂症、疼痛和睡眠障碍。
在另一个实施方案中,本发明涉及式(i)化合物与一种或更多种其他治疗剂乙酰胆碱酯酶抑制剂和nmda受体拮抗剂的组合,其用于治疗阿尔茨海默病。
在另一方面,本发明涉及式(i)化合物的药物组合物。为了在治疗中使用式(i)化合物或其立体异构体及其可药用盐,通常将根据标准药学实践将其配制成药物组合物。
可使用一种或更多种可药用赋形剂以常规方式配制本发明的药物组合物。可药用赋形剂是稀释剂、崩解剂、黏合剂、润滑剂、助流剂、聚合物、包衣剂、溶剂、共溶剂、防腐剂、润湿剂、增稠剂、消泡剂、甜味剂、调味剂、抗氧化剂、着色剂、增溶剂、增塑剂、分散剂等。赋形剂选自微晶纤维素、甘露醇、乳糖、预胶化淀粉、乙醇酸淀粉钠、玉米淀粉或其衍生物、聚维酮、交聚维酮、硬脂酸钙、单硬脂酸甘油酯、棕榈酸硬脂酸甘油酯、滑石、胶体二氧化硅、硬脂酸镁、十二烷基硫酸钠、硬脂酰富马酸钠、硬脂酸锌、硬脂酸或氢化植物油、阿拉伯树胶、镁砂(magnesia)、葡萄糖、脂肪、蜡、天然或硬化油、水、生理氯化钠溶液或醇类(例如乙醇、丙醇或甘油)、糖溶液(例如葡萄糖溶液或甘露醇溶液等)、或多种赋形剂的混合物。
在另一方面,本发明的活性化合物可以以丸剂、片剂、包衣片剂、胶囊剂、散剂、颗粒剂、丸粒剂、贴剂、植入剂、膜剂、液体剂、半固体剂、凝胶剂、气雾剂、乳剂、酏剂等的形式配制。这样的药物组合物及其制备方法是本领域中公知的。
在另一方面,本发明的药物组合物包含按重量计1%至90%、5%至75%和10%至60%的本发明化合物或其可药用盐。药物组合物中的活性化合物或其可药用盐的量可以是约1mg至约500mg、或约5mg至约400mg、或约5mg至约250mg、或约7mg至约150mg、或在1mg至500mg的更宽范围内的任何范围。
活性化合物的剂量可以根据多种因素例如患者的年龄和体重、待治疗的疾病的性质和严重程度以及这样的其他因素而变化。因此,关于药理学有效量的通式(i)化合物、其立体异构体和可药用盐的任何提及是指上述因素。
本文中使用以下缩写词:
amp:腺苷一磷酸
auc:曲线下面积
cmax:最大浓度
cdcl3:氘代氯仿
cs2co3:碳酸铯
dcm:二氯甲烷
dcc:n,n′-二环己基碳二亚胺
dipea:n,n-二异丙基乙胺
dmf:n,n-二甲基甲酰胺
dmso:二甲基亚砜
ec50:半最大有效浓度
edc:二氯化乙烯
etoac:乙酸乙酯
etoh乙醇
h:小时
hatu:2-(7-氮杂-1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐
hcl:盐酸
h2o水
h2so4:硫酸
k2co3:碳酸钾
kno3:硝酸钾
lc-ms/ms:液相色谱-质谱/质谱
mmol:毫摩尔
nahco3:碳酸氢钠
naoh:氢氧化钠
na2so4:硫酸钠
nh4cl:氯化铵
rt:室温(25℃至30℃)
roa:施用途径
p.o经口
thf:四氢呋喃
t1/2半衰期
x-phos:2-二环己基膦基-2′,4′,6′-三异丙基联苯
实施例
使用适当的材料和条件,根据以下实验程序制备本发明化合物。仅通过举例说明而不是限制本发明的范围来提供以下实施例。
中间体的制备:
中间体1:6-溴-5-甲基喹啉-8-羧酸(i-1)
向在rt下的2-氨基-5-溴-4-甲基-苯甲酸(15.9g,69.1mmol)在硝基苯(22.8ml)中的搅拌溶液添加甘油(24.8g,269.6mmol),随后添加浓h2so4(22.28g,222.8mmol)。将反应混合物逐渐加热至125℃并在该温度下搅拌16小时。将其冷却至rt之后,将反应混合物用冰淬灭,并用水和etoac稀释。将两层分离,并将水层用etoac萃取。将水层用10%氨化甲醇dcm溶剂体系进一步萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:9.65g(52%);1h-nmr(400mhz,cdcl3):δ16.49(bs,1h),8.94(s,1h),8.93(d,j=6.2hz,1h),7.69(dd,j=4.3,8.6hz,1h),2.87(s,3h);质量(m/z):265.8,267.8(m+h)+.
中间体2:6-溴-5-甲基喹啉-8-羧酸甲酯(i-2)
向在0℃下冷却的6-溴-5-甲基-喹啉-8-羧酸(i-1)(9.65g,36.2mmol)在甲醇(145.1ml)中的搅拌溶液缓慢添加亚硫酰氯(15.7ml,145.1mmol)。将反应混合物逐渐加热至回流温度并在该温度下搅拌16小时。将其冷却至rt之后,在减压下除去挥发物,并将粗产物溶解在10%nahco3水溶液和etoac中。将两层分离,并将水层用etoac萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:9.7g;1h-nmr(400mhz,cdcl3):δ9.05(d,j=3.8hz,1h),8.42(d,j=8.5hz,1h),8.18(s,1h),7.52(dd,j=4.0hz,8.5hz1h),4.04(s,3h),2.81(s,3h);质量(m/z):280.1,282.1(m+h)+.
中间体3:(3-氰基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(i-3)
向在0℃下冷却的2-氯-6-甲基烟腈(0.4g,2.62mmol)在干thf(10.4ml)中的搅拌溶液依次添加氨基甲酸叔丁酯(1.5g,13.1mmol)、cs2co3(3.25g,9.99mmol)、x-phos(0.025g,0.052mmol)和三(二亚苄基丙酮)二钯[0](tris(dibenzilidineacetone)dipalladium[0])(0.12g,0.13mmol)。将反应混合物逐渐加热至65℃并在该温度下搅拌7小时。将其冷却至rt之后,添加另外量的cs2co3(3.25g,9.99mmol)。将反应混合物逐渐加热至65℃并在该温度下搅拌另外的7小时。将反应混合物冷却至rt,并通过硅藻土(celite)床过滤。将硅藻土床用etoac洗涤。将滤液用10%nahco3水溶液洗涤。将有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:0.55g(87%);1h-nmr(400mhz,cdcl3):δ7.82(d,j=5.6hz,1h),7.29(bs,1h),7.00(d,j=7.80hz,1h),2.56(s,1h),1.47(s,9h);质量(m/z):234.1(m+h)+.
中间体4:2-氨基-6-甲基烟腈(i-4)
向在0℃下冷却的(3-氰基-6-甲基-吡啶-2-基)-氨基甲酸叔丁酯(i-3)(0.55g,2.36mmol)在dcm(9.4ml)中的搅拌溶液添加tfa(0.22ml,10.7mmol)。将反应混合物逐渐温热至rt并在该温度下搅拌16小时。在减压下除去挥发物,并将粗物质用10%nahco3水溶液和etoac稀释。将两层分离。将有机层用盐水溶液洗涤,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:0.31g(100%);1h-nmr(400mhz,dmso):δ7.73(d,j=7.60hz,1h),6.78(bs,2h),6.53(d,j=8hz,1h),2.34(s,3h);质量(m/z):134.0(m+h)+.
中间体5:2-氨基-5-溴-6-甲基烟腈(i-5)
向在rt下的2-氨基-6-甲基-烟腈(i-4)(0.31g,2.3mmol)在1,2-二氯乙烷(9.4ml)中的搅拌溶液添加新鲜重结晶的nbs(0.46g,2.6mmol)。将反应混合物逐渐加热至85℃并在该温度下搅拌3小时。将反应混合物冷却至rt,并用水和chcl3稀释。将两层分离。将有机层用盐水溶液洗涤,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:0.38g(87%);1h-nmr(400mhz,cdcl3):δ7.74(s,1h),5.12(bs,2h),2.52(s,3h);质量(m/z):212.0,214.0(m+h)+.
中间体6:6-溴-5-甲基咪唑并[1,2-a]吡啶-8-腈(i-6)
向在rt下的2-氨基-5-溴-6-甲基-烟腈(i-5)(0.38g,1.8mmol)在乙醇(7.1ml)中的搅拌溶液添加氯乙醛(49%水溶液,0.23ml,3.56mmol)。将反应混合物逐渐加热至85℃并在该温度下搅拌6小时。将反应混合物冷却至rt,在减压下除去挥发物,并将粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:0.1g(23%);1h-nmr(400mhz,cdcl3):δ7.87(s,1h),7.83(s,1h),7.66(s,1h),2.86(s,3h);质量(m/z):235.9,238.0(m+h)+.
中间体7:2-乙酰氨基-5-溴-4-甲基苯甲酸甲酯(i-7)
向在0℃下冷却的2-氨基-5-溴-4-甲基-苯甲酸甲酯(2.0g,8.19mmol)在干dcm(32.7ml)中的搅拌溶液依次添加三乙胺(1.7ml,8.2mmol)乙酰氯(0.65g,8.19mmol)。使反应逐渐进行至rt,并搅拌2小时,然后用dcm和水稀释。将两层分离,并将有机层用盐水溶液洗涤,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:2.3g(95%);1h-nmr(400mhz,dmso):δ10.46(bs,1h),8.22(s,1h),7.99(s,1h),3.85(s,3h),2.37(s,3h),2.12(s,3h);质量(m/z):286.0,288.2(m+h)+.
中间体8:2-乙酰氨基-5-溴-4-甲基-3-硝基苯甲酸甲酯(i-8)
向在0℃下冷却的发烟硝酸(98%,3.5ml)经过15分钟的时间添加2-乙酰氨基-5-溴-4-甲基-苯甲酸甲酯(i-7)(1.0g,3.49mmol)。在搅拌另外的15分钟之后,通过添加冰水和etoac将反应混合物淬灭。将两层分离,并将水层用etoac进一步萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂,以95%的产率获得为褐色固体的标题化合物(1.0g)。
1h-nmr(400mhz,dmso):δ10.49(s,1h),8.17(s,1h),3.79(s,3h),2.34(s,3h),1.97(s,3h);质量(m/z):330.9,332.9(m+h)+.
中间体9:6-溴-2,7-二甲基-1h-苯并咪唑-4-羧酸乙酯(i-9)
向在rt下的2-乙酰氨基-5-溴-4-甲基-3-硝基苯甲酸甲酯(i-8)(1.0g,3.02mmol)在h2o∶thf∶etoh的1∶2∶4混合物(12.0ml)中的搅拌溶液添加铁粉(0.85g,15.1mm01)和nh4cl(0.82g,15.1mmol)。将反应逐渐加热至回流并搅拌2小时。将反应物料冷却至rt之后,将其通过硅藻土床过滤。将硅藻土床用乙醇洗涤。将滤液在减压下蒸发,并将如此获得的粗物质用etoac和水稀释。将两层分离,并将有机层用盐水溶液洗涤,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得上述标题化合物。
产量:0.47g(50%);1h-nmr(400mhz,dmso):δ12.40(s,1h),7.84(s,1h),4.44(q,2h),2.61(s,3h),2.56(s,3h),1.37(t,j=7.0hz,3h);质量(m/z):297.0,299.0(m+h)+.
中间体10:2-甲酰基氨基-5-溴-4-甲基苯甲酸甲酯(i-10)
将2-氨基-5-溴-4-甲基苯甲酸甲酯(2.0g,8.19mmol)在甲酸(32.7ml)中的搅拌溶液加热至100℃,并在该温度下搅拌16小时。将反应逐渐冷却至rt,并用etoac和水稀释。将两层分离,并将有机层用盐水溶液洗涤,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:2.0g(90%);1h-nmr(400mhz,cdcl3):δ10.91(bs,1h),8.65(s,1h),8.50(s,1h),8.19(s,1h),3.91(s,3h),2.45(s,3h);质量(m/z):272.2,274.0(m+h)+.
中间体11:2-甲酰基氨基-5-溴-4-甲基-3-硝基苯甲酸甲酯(i-11)
向在0℃下冷却的发烟硝酸(98%,9.2ml)经过15分钟的时间添加2-甲酰基氨基-5-溴-4-甲基-苯甲酸甲酯(i-10)(2.5g,9.19mmol)。在搅拌另外的15分钟之后,通过添加冰水和etoac将反应混合物淬灭。将两层分离,并将水层用etoac进一步萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:2.0g(70%);1h-nmr(400mhz,cdcl3):δ9.47(bs,1h),8.33(s,1h),8.31(s,1h),3.98(s,3h),2.50(s,3h);质量(m/z):315.2,317,0(m+h)+.
中间体12:6-溴-7-甲基-1h-苯并咪唑-4-羧酸乙酯(i-12)
向在rt下的2-甲酰基氨基-5-溴-4-甲基-3-硝基苯甲酸甲酯(i-11)(2.0g,6.31mmol)在h2o∶thf∶etoh的1∶2∶4混合物(25.0ml)中的搅拌溶液添加铁粉(1.76g,31.55mmol)和nh4cl(1.7g,31.55mmol)。将反应逐渐加热至回流并搅拌6小时。将反应物料冷却至rt之后,将其通过硅藻土床过滤。将硅藻土床用乙醇洗涤。将滤液在减压下蒸发,并将如此获得的粗物质用etoac和水稀释。将两层分离,并将有机层用盐水溶液洗涤,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得上述标题化合物。
产量:0.72g(40%);1h-nmr(400mhz,cdcl3):δ10.51(bs,1h),8.10(s,2h),4.47(q,2h),2.79(s,3h),1.44(t,j=6.8hz,3h);质量(m/z):282.9,285.0(m+h)+.
中间体13:2-羟基-4-甲基苯甲酸甲酯(i-13)
在0℃下,向2-羟基-4-甲基-苯甲酸(10g,0.065mol)在甲醇(50ml)中的溶液添加亚硫酰氯(15ml,摩尔)。将反应混合物在80℃下加热12小时,冷却至rt,在真空下浓缩以获得粗物质。向该粗物质添加200ml水,并用氨水碱化,并用二氯甲烷(200ml×3)萃取。将有机层用盐水溶液(50ml)洗涤并经na2so4干燥。将有机层在真空下浓缩以得到标题化合物。
产量:10.7g(98.1%);1h-nmr(cdcl3,400mhz)δppm:2.34(s,3h),3.92(s,3h),6.68-6.70(d,j=8hz,1h),6.79(s,1h),7.69-7.71(d,j=8.12hz,1h),10.71(s,1h);质量(m/z):167.1(m+h)+.
中间体14:5-溴-2-羟基-4-甲基苯甲酸甲酯(i-14)
在0℃下,向2-羟基-4-甲基-苯甲酸甲酯(10.6g,0.06mol)在氯仿(20ml)中的溶液逐滴添加溴(3.27ml,0.06mol),并将混合物在室温下搅拌3小时。将反应混合物在减压下浓缩,将残余物在冰冷却下在ph8下用亚硫酸钠溶液中和,并将混合物用二氯甲烷(100ml×3)萃取。将有机层用盐水溶液(50ml)洗涤,并经na2so4干燥,并且将溶剂在真空下浓缩以获得粗化合物,将该粗化合物通过快速色谱使用正己烷:乙酸乙酯(97:3)进一步纯化以得到标题化合物。
产量:15g(98.1%);1h-nmr(cdcl3,400mhz)δppm:2.38(s,3h),3.94(s,3h),6.88(s,1h),7.96(s,1h),10.58(s,1h);质量(m/z):244.8(m+h)+.
中间体15:5-溴-2-羟基-4-甲基-3-硝基苯甲酸甲酯(i-15)
在0℃下,向5-溴-2-羟基-4-甲基-苯甲酸甲酯(13.3g,0.05mol)在h2so4(60ml)中的混合物添加kno3(8.2g,0.08mol),并将混合物在室温下搅拌3小时。将反应混合物倒入1000ml冷水中,在此期间固体沉淀。将这些固体过滤并溶解在ch2cl2(500ml)中。将有机层用盐水(250ml)洗涤,经无水na2so4干燥,过滤并在旋转蒸发仪上浓缩以获得标题化合物的粗物质。
产量:13.9g;1h-nmr(cdcl3,400mhz)δppm:2.39(s,3h),3.98(s,3h),8.12(s,1h),11.14(s,1h);质量(m/z):290.0(m+h)+.
中间体16:2-羟基-4-甲基-3-硝基-5-(4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷-2-基)-苯甲酸甲酯(i-16)
向在25℃,n2下在密封管中的5-溴-2-羟基-4-甲基-3-硝基-苯甲酸甲酯(0.1g,0.0003mol)在1,4-二氧六环(10ml)中的溶液添加乙酸钾(0.101g,0.001mol)、双(频哪醇)二硼(0.131g,0.0005mol)和1,1-双(二苯基膦基)二茂铁二氯化钯(ii)二氯甲烷络合物(0.028g,0.00003mol)。将反应混合物在100℃下加热16小时,冷却至rt,通过硅藻土垫过滤并用乙酸乙酯(20ml×2)洗涤。将滤液在真空下浓缩以获得粗标题化合物。
产量:1.4g;质量(m/z):336.2(m+h)-.
中间体17:2-羟基-4-甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-3-硝基苯甲酸甲酯(i-17)
向在n2下的2-羟基-4-甲基-3-硝基-5-(4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷-2-基)-苯甲酸甲酯(1.5g,0.004mol)在100mlthf与10ml水的混合物中的溶液添加2-羟基-4-甲基-3-硝基-5-(4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷-2-基)-苯甲酸甲酯(1.11g,0.004mol)、碳酸铯(2.90g,0.008mol)以及与二氯甲烷(0.369g,0.0004mol)以1∶1络合的[1,1’-双(二苯基膦基)二茂铁]二氯钯(ii)。将混合物回流7小时,冷却至rt,通过硅藻土过滤,并用乙酸乙酯(100ml×2)洗涤。将滤液在真空下浓缩以获得粗化合物,将该粗化合物通过快速色谱使用乙酸乙酯:正己烷(60∶40)进一步纯化以获得标题化合物。
产量:0.196g;1h-nmr(cdcl3,400mhz)δppm:2.19(s,3h),2.37(s,3h),3.91-3.97(m,5h),7.14-7.25(d,j=8.1hz,1h),7.44(s,1h),7.46-7.50(m,2h),7.59(s,1h),7.73-7.77(m,2h),11.14(s,1h);质量(m/z):382.1(m+h)+.
中间体18:3-氨基-2-羟基-4-甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯甲酸甲酯(i-18)
向2-羟基-4-甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-3-硝基-苯甲酸甲酯(0.196g,0.0005mol)在甲醇(20ml)中的溶液添加10%钯碳(0.109g,0.001mol),并在氢气氛下搅拌5小时,并通过硅藻土过滤该物质并用甲醇(50ml)洗涤。将滤液在真空下浓缩以获得粗化合物,将该粗化合物通过快速色谱使用乙酸乙酯∶己烷(60∶40)进一步纯化以获得标题化合物。
产量:0.93g;1h-nmr(cdcl3,400mhz)δppm:2.04(s,3h),3.84(bs,2h),3.92(s,3h),3.93(s,3h),3.94(s,2h),7.06-7.08(d,j=7.9hz,2h),7.15(s,1h),7.34-7.36(d,j=8.04hz,2h);7.56(s,1h),7.72(s,1h);10.83(s,1h);质量(m/z):352.2(m+h)+.
中间体19:5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-3,4-二氢-2h-苯并[1,4]
向3-氨基-2-羟基-4-甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯甲酸甲酯(0.93g,0.0026mol),1-溴-2-氯乙烷(0.06ml,0.007mol)在dmf(2ml)中的搅拌溶液添加cs2co3(0.430g,0.001摩尔)。将反应混合物在室温下搅拌30小时,冷却,倒在水(50ml)上并用乙酸乙酯(50ml×3)萃取。将有机萃取物合并,经无水na2so4干燥,过滤并在旋转蒸发仪上浓缩以获得粗物质,将该粗物质通过柱色谱使用甲醇∶二氯甲烷(2∶98)进行纯化以获得标题化合物。
产量:0.99g;质量(m/z):378.1(m+h)+.
中间体20:5-溴-4-甲基-2-丙-2-炔氧基苯甲酸甲酯(i-20)
向在rt下的5-溴-2-羟基-4-甲基苯甲酸甲酯(0.75g,3.06mmol)在乙腈(12.2ml)中的搅拌溶液添加k2co3(0.633g,4.60mmol)和炔丙基溴(0.2ml,3.36mmol)。将反应混合物在回流温度下搅拌16小时,冷却至rt,用etoac和水稀释。将两层分离,并将水层用乙酸乙酯萃取。将有机萃取物合并,用盐水溶液洗涤,经无水na2so4干燥,过滤并在减压下浓缩以获得标题化合物。
产量:0.85g(98%);1h-nmr(400mhz,dmso):δ7.82(s,1h),7.26(s,1h),4.89(s,2h),3.78(s,3h),3.62(s,1h),2.38(s,3h);质量(m/z):283.0,285.0(m+h)+.
中间体21:5-溴-2,4-二甲基苯并呋喃-7-羧酸甲酯(i-21)
将在n-甲基吡咯烷酮(1.49ml)中的5-溴-4-甲基-2-丙-2-炔氧基苯甲酸甲酯(0.85g,3.0mmol)在202℃至205℃加热18小时。将反应混合物冷却至0℃,并通过添加冰水混合物来淬灭。将反应混合物用etoac稀释,并将两层分离,并且将水层用乙酸乙酯萃取。将有机萃取物合并,用盐水溶液洗涤,经无水na2so4干燥,过滤并在减压下浓缩以获得为灰白色固体的标题化合物。
产量:0.3g(35%);1h-nmr(400mhz,cdcl3):δ8.02(s,1h),6.43(s,1h),3.98(s,3h),2.53(s,6h);质量(m/z):282.6,284.9(m+h)+.
实施例1:
n-(顺式-1s,2s-2-羟基环己基)-6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-甲酰胺
步骤1:合成6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-羧酸甲酯
向在rt下冷却的6-溴-5-甲基喹啉-8-羧酸甲酯(i-2)(0.25g,0.89mmol)在1,4-二氧六环(5.9ml)中的搅拌溶液添加乙酸钾(0.27g,3.1mmol)和双(频哪醇)二硼(0.34g,1.33mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(72.8mg,0.08mmol)。将反应混合物逐渐加热至100℃并在该温度下搅拌10小时。将其冷却至rt之后,在减压下除去挥发物。将所获得的粗产物溶解在1,4-二氧六环与水的4:1混合物(5.9ml)中。添加固体k2co3(0.16g,1.14mmol)和2-氯-4-氯甲基-吡啶(0.19g,1.15mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(62.3mg,0.07mmol)。将反应混合物逐渐加热至100℃并在该温度下搅拌8小时。将其冷却至rt之后,在减压下除去挥发物,并将粗硼酸酯溶解在水和etoac中。将反应物料通过硅藻土床过滤,并将两层分离。用etoac萃取水层。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:111mg(40%);1h-nmr(400mhz,cdcl3):δ9..07(d,j=4.0hz,1h),8.44(d,j=8.6hz,1h),8.28(d,j=5.0hz,1h),7.86(s,1h),7.53(dd,j=4.0,8.6hz,1h),7.06(s,1h),6.97(d,j=4.9hz,1h),4.23(s,2h),4.04(s,3h),2.58(s,3h);质量(m/z):327.2,328.9(m+h)+.
步骤2:合成6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-羧酸
向在0℃下冷却的在步骤1中获得的6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-羧酸甲酯(0.11g,0.34mmol)在h2o与甲醇的1∶1混合物(2.0ml)中的搅拌溶液添加固体naoh(0.04g,1.01mmol)。在回流温度下搅拌2小时之后,将反应混合物冷却至rt,用2nhcl酸化并用dcm萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:0.11g(100%);1h-nmr(400mhz,cdcl3):δ16.65(bs,1h),8.94(d,j=3.2hz,1h),8.68(s,1h),8.65(d,j=8.7hz,1h),8.29(d,j=5.1hz,1h),7.68(dd,j=4.3,8.6hz,1h),7.04(s,1h),6.99(d,j=4.9hz,1h)4.29(s,2h),2.65(s,3h);质量(m/z):312.9,314.9(m+h)+.
步骤3:合成n-(顺式-1s,2s-2-羟基环己基)-6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-甲酰胺
向在0℃下冷却的6-(2-氯吡啶-4-基甲基)-5-甲基喹啉-8-羧酸(114mg,0.34mmol)在dcm(3.4ml)中的搅拌溶液,依次添加dipea(0.18ml,1.1mmol)、顺式2-氨基环己醇盐酸盐(50.6mg,0.43mmol)和tbtu(151.6mg,0.40mmol)。在rt下搅拌16小时之后,将反应混合物用水和dcm稀释。将两层分离,并将水层用dcm萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:90.0mg(64%);1h-nmr(400mhz,cdcl3):δ11.52(bs,1h),8.92(d,j=4.1hz,1h),8.7(s,1h),8.53(d,j=8.6hz,1h),8.26(d,j=5.12hz,1h),7.56(dd,j=4.1hz,8.6hz,1h),7.03(s,1h),6.98(sj=5.08hz,1h),4.39(bs,1h),4.28(s,2h),4.00-3.94(m,1h),3.64-3.50(m,1h),2.58(s,3h),2.17-2.13(m,2h),1.81-1.78(m,2h),1.48-1.45(m,4h);
质量(m/z):410.1,412.1(m+h)+.
通过使用合适的中间体i-2,按照如实施例1的制备中所述的实验程序,通过一些非关键的改变来合成以下实施例。
通过使用适当的中间体i-19,按照如实施例1的制备中所述的实验程序,通过一些非关键的改变来制备实施例16和17。
实施例18:n-(顺式-1s,2s-2-羟基环己基)-5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺
步骤1:合成5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-腈
向在rt下的6-溴-5-甲基-咪唑并[1,2-a]吡啶-8-腈(i-6)(0.1g,0.42mmol)在甲苯(5.9ml)中的搅拌溶液添加乙酸钾(0.14g,1.43mmol)和双(频哪醇)二硼(0.16g,0.63mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(17.0mg,0.02mmol)。将反应混合物逐渐加热至100℃并在该温度下搅拌20小时。将其冷却至rt之后,将甲苯中的粗产物用1,4-二氧六环与水的9∶1混合物(3.7ml)稀释。添加固体k2co3(0.07g,0.5mmol)和4-(4-氯甲基-苯基)-1-甲基-1h-吡唑(0.07g,0.35mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(28.0mg,0.04mmol)。将反应混合物逐渐加热至100℃并在该温度下搅拌6小时。将其冷却至rt之后,在减压下除去挥发物,并将粗产物溶解在水和etoac中。将反应物料通过硅藻土床过滤,并将两层分离。用etoac萃取水层。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:40mg(35%);1h-nmr(400mhz,cdcl3):δ7.82(s,1h),7.73(s,1h),7.61(s,1h),7.59(s,1h),7.54(s,1h),7.42(d,j=8.04hz,2h),7.10(d,j=8.00hz,2h),4.07(s,2h),3.94(s,3h),2.66(s,3h);质量(m/z):328.1(m+h)+.
步骤2:合成5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺
向在rt下的在步骤1中获得的5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-腈(0.02g,0.06mmol)在水与乙醇的1:1混合物(1.0ml)中的搅拌溶液添加固体koh(0.009g,0.15mmol)。在85℃下搅拌3小时之后,将反应混合物冷却至rt,在减压下除去挥发物以获得标题化合物。
产量:0.02g(95%);1h-nmr(400mhz,dmso):δ8.05(s,1h),7.77(s,1h),7.70(d,j=8.2hz,1h),7.51(d,j=5.9hz,1h),7.45(d,j=8.1hz,2h),7.21(d,j=8.1hz,2h),6.88(s,1h),4.96(s,2h),3.98(s,3h),2.86(s,3h);质量(m/z):346.1(m+h)+.
步骤3:合成5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-羧酸
向在步骤2中获得的5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺(0.02g,0.06mmol)的搅拌溶液添加hcl水溶液(5n,1.0ml)。在100℃下搅拌6小时之后,将反应混合物冷却至rt,将反应混合物用氨水溶液碱化。粗产物用dcm与甲醇的9:1混合物萃取以获得标题化合物。
产量:0.02g(100%);1h-nmr(400mhz,dmso):δ8.49(s,1h),8.40(s,1h),8.24(s,1h)8.09(d,j=4.5hz,1h),7.82(d,j=4.5hz,1h),7.50(d,j=7.6hz,2h),7.24(d,j=7.6hz,2h),6.86(s,1h),4.19(s,2h),3.99(s,3h),2.84(s,3h);质量(m/z):347.1(m+h)+.
步骤4:合成n-(顺式-1s,2s-2-羟基环己基)-5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-甲酰胺
向在0℃下冷却的在步骤3中获得的5-甲基-6-[4-(1-甲基-1h-吡唑-4-基)-苄基]-咪唑并[1,2-a]吡啶-8-羧酸(20.0mg,0.06mmol)在dcm(1.0ml)中的搅拌溶液依次添加dipea(0.02ml,0.15mmol)、顺式2-氨基环己醇盐酸盐(8.7mg,0.06mmol)和hatu(24.1mg,0.063mmol)。在rt下搅拌1小时之后,将反应混合物用水和dcm稀释。将两层分离,并将水层用dcm萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:18.0mg(72%);1h-nmr(400mhz,cdcl3):δ10.44(d,j=6.2hz,1h),8.05(s,1h),7.44(s,1h),7.70(d,j=8.2hz,1h),7.51(d,j=5.96hz,2h),7.45(d,j=8.16hz,2h),7.21(d,j=6.6hz,2h),4.96(s,2h),3.98(s,3h);3.97-3.90(m,1h),3.62-3.56(m,1h),2.86(s,3h);2.18-2.08(m,2h),1.77-1.75(m,2h),1.41-1.43(m,4h);质量(m/z):444.1(m+h)+.
通过使用适当的中间体i-6,按照如实施例18的制备中所述的实验程序,通过一些非关键的改变来合成以下实施例19至实施例26。
实施例27:n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-甲酰胺
步骤1:合成7-甲基-6-(4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷-2-基)-1h-苯并咪唑-4-羧酸乙酯
向在rt下的6-溴-7-甲基-1h-苯并咪唑-4-羧酸乙酯(i-12)(0.3g,1.06mmol)在甲苯(5.0ml)中的搅拌溶液添加乙酸钾(0.35g,3.6mmol)和双(频哪醇)二硼(0.4g,1.6mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(86.6mg,0.11mmol)。将反应混合物逐渐加热至110℃并在该温度下搅拌12小时。将其冷却至rt之后,将反应物料在硅藻土上过滤,并将滤液在减压下蒸发。将由此获得的粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:0.24g(70%);1h-nmr(400mhz,cdcl3):δ10.50(bs,1h),8.35(s,1h),8.11(s,1h),4.49(q,2h),2.98(s,3h),1.44(t,j=3.2hz,3h),1.39(s,12h);质量(m/z):331.1(m+h)+.
步骤2:合成7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-羧酸乙酯
将在步骤1中获得的7-甲基-6-(4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷-2-基)-1h-苯并咪唑-4-羧酸乙酯(0.1g,0.3mmol)溶解在1,4-二氧六环与水的5∶1混合物(3.6ml)中。添加固体k2co3(0.06g,0.42mmol)和1-(4-氯甲基-苯基)-1h-吡唑(0.06g,0.31mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(24.7mg,0.03mmol)。将反应混合物逐渐加热至回流温度并在该温度下搅拌12小时。将其冷却至rt之后,将反应物料通过硅藻土床过滤,并将滤液在减压下蒸发以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:87.0mg(80%);1h-nmr(400mhz,cdcl3):δ10.45(bs,1h),8.12(s,1h),7.89-7.88(d,j=2.2hz,2h),7.87(s,1h),7.61-7.59(d,j=6.9hz,2h),7.24(d,j=6.5hz,2h),6.44(s,1h),4.47(q,2h),4.21(s,2h),2.65(s,3h),1.44(t,j=7.1hz,3h);(质量(m/z):361.1(m+h)+.
步骤3:合成7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-羧酸
向在0℃下冷却的在步骤2中获得的7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-羧酸乙酯(0.1g,0.28mmol)在水与甲醇的1∶1混合物(3.0ml)中的搅拌溶液添加固体naoh(0.022g,0.55mmol)。在回流温度下搅拌2小时之后,将反应混合物在减压下蒸发至其体积的一半,冷却至rt,用1nhcl酸化并用dcm与甲醇的9∶1混合物萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得标题化合物。
产量:0.083g(90%);1h-nmr(400mhz,dmso:δ15.59(bs,1h),9.45(bs,1h),8.45(s,1h),7.91(s,1h),7.91(s,ih),7.77(d,j=8.4hz,2h),7.70(s,1h),7.29-7.27(d,j=8.4hz,2h),6.51(s,1h),4.24(s,2h),2.66(s,3h);质量(m/z):333.1(m+h)+.
步骤4:合成n-(顺式-1s,2s-2-羟基环己基)-7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-甲酰胺
向在0℃下冷却的在步骤3中获得的7-甲基-6-(4-吡唑-1-基-苄基)-1h-苯并咪唑-4-羧酸(100.0mg,0.3mmol)在dcm(3.0ml)中的搅拌溶液依次添加dipea(0.075ml,0.45mmol)、顺式2-氨基环己醇盐酸盐(45.5mg,0.17mmol)和hatu(114.0mg,0.3mmol)。在rt下搅拌2小时之后,将反应混合物用水和dcm稀释。将两层分离,并将水层用dcm萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:83.9mg(65%);1h-nmr(400mhz,cdcl3):δ10.3(bs,1h),9.89(bs,1h),8.01(s,1h),7.88(s,1h),7.70(s,1h),7.50-7.52(d,j=5.36hz,2h),7.13-7.11(d,j=6.48hz,2h),6.44(s,1h),4.24(s,2h),4.15(bs,1h),4.03.90(m,1h),3.65-3.55(m,1h),3.49(s,3h),2.60(s,3h),2.20-2.10(m,2h),1.86-1.77(m,2h),1.43-1.39(m,4h);质量(m/z):430.5(m+h)+.
通过使用适当的中间体i-9和i-12,按照如实施例27的制备中所述的实验程序,通过一些非关键的改变来合成以下实施例28至实施例45。
实施例46:n-(顺式-1s,2s-2-羟基环己基)-2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-甲酰胺
步骤1:2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-羧酸甲酯
向在rt下的5-溴-2,4-二甲基-苯并呋喃-7-羧酸甲酯(i-21)(0.1g,0.35mmol)在甲苯(3.5ml)中的搅拌溶液添加乙酸钾(0.106g,1.43mmol)和双(频哪醇)二硼(0.13g,0.53mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(43.0mg,0.053mmol)。将反应混合物逐渐加热至100℃并在该温度下搅拌20小时。将其冷却至rt之后,将甲苯中的粗产物用1,4-二氧六环与水的9∶1混合物(3.7ml)稀释。添加固体k2co3(0.06g,0.42mmol)和4-(4-氯甲基-苯基)-1-甲基-1h-吡唑(0.06g,0.30mmol)。将反应混合物用氮脱气15分钟,并添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)(25.0mg,0.03mmol)。将反应混合物逐渐加热至100℃并在该温度下搅拌6小时。将其冷却至rt之后,在减压下除去挥发物,并将粗产物溶解在水和etoac中。将反应物料通过硅藻土床过滤,并将两层分离。用etoac萃取水层。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:0.59mg(52%);1h-nmr(400mhz,cdcl3):δ7.72(d,j=7.6hz,2h),7.55(s,1h),7.36(d,j=8.1hz,2h),7.10(d,j=8.0hz,2h),6.41(s,1h),4.11(s,2h),3.97(s,3h),3.92(s,3h),2.52(s,3h),2.37(s,3h);质量(m/z):375.0(m+h)+.
步骤2:2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-羧酸
向在0℃下冷却的2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-羧酸甲酯(0.06g,0.16mmol)在h2o与甲醇的1∶1混合物(0.6ml)中的搅拌溶液添加固体naoh(0.013g,0.31mmol)。在回流温度下搅拌2小时之后,将反应混合物冷却至rt,用2nhcl酸化并用dcm萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得为灰白色固体的标题化合物。
产量:0.045g(80%);1h-nmr(400mhz,dmso):δ13.8(bs,1h),8.06(s,1h),7.81(s,1h),7.56(s,1h),7.46(d,j=8.04hz,2h),7.11(d,j=8.0hz,2h),6.71(s,1h),4.05(s,2h),3.85(s,3h),2.46(s,3h),2.39(s,3h);质量(m/z):360.9(m+h)+.
步骤3:n-(顺式-1s,2s-2-羟基环己基)-2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-甲酰胺
向在0℃下冷却的2,4-二甲基-5-[4-(1-甲基-1h-吡唑-4-基)-苄基]-苯并呋喃-7-羧酸(45.0mg,0.12mmol)在dcm(0.5ml)中的搅拌溶液依次添加dipea(0.05ml,0.31mmol)、顺式2-氨基环己醇盐酸盐(19.0mg,0.12mmol)和hatu(52.3mg,0.14mmol)。在rt下搅拌2小时之后,将反应混合物用水和dcm稀释。将两层分离,并将水层用dcm萃取。将合并的有机层用盐水溶液洗涤一次,经无水na2so4干燥,并在减压下除去溶剂以获得粗产物,将该粗产物通过硅胶柱色谱进行纯化以获得标题化合物。
产量:21.1mg(36%);1h-nmr(400mhz,cdcl3):δ7.8(s,1h),7.70(s,1h),7.52(s,1h),7.39(d,j=8.16hz,2h),7.10(d,j=7.96hz,2h),6.46(s,1h),4.15(s,2h),3.97(m,3h),3.92(s,3h),3.56-3.49(m,1h),2.51(s,3h),2.35(s,3h),2.16-2.12(m,2h),1.80-1.77(m,2h),1.49-1.38(m,4h);质量(m/z):458.0(m+h)+.
实施例47:
毒蕈碱m1受体的别构效力ec50值的确定:
使用表达重组人毒蕈碱m1受体和pcre-luc报道系统的稳定cho细胞系用于基于细胞的测定。该测定提供了基于非放射性的方法来确定化合物与gpcr的结合。在该特定测定中,测量了通过受体的活化或抑制来调节的胞内环amp的水平。重组细胞在camp响应元件的控制下具有萤光素酶报道基因。
将以上细胞在含有10%胎牛血清(fetalbovineserum,fbs)的hamsf12培养基中的96孔透明底白板中培养。在添加化合物或标准激动剂之前,将细胞血清饥饿过夜。将递增浓度的受试化合物与optimem培养基中的ec20的乙酰胆碱一起添加至细胞。在co2培养箱中在37℃下继续孵育4小时。去除培养基并用磷酸盐缓冲盐水洗涤细胞。将细胞裂解,并在发光计(luminometer)中测量萤光素酶活性。将每个浓度的测试项目中的发光计数相对于乙酰胆碱诱导的最大响应归一化,并使用graphpad软件对数据进行分析。化合物的ec50值定义为在存在ec20的乙酰胆碱的情况下刺激萤光素酶活性50%所需的浓度。
实施例48:
啮齿动物药代动力学研究
将雄性wistar大鼠(260±50克)用作实验动物。将动物单独饲养在聚丙烯笼中。在研究之前的两天,将雄性wistar大鼠用异氟烷麻醉以进行颈静脉导管的手术放置。将大鼠随机分为经口(3mg/kg)和静脉内(i.v.)(1mg/kg)给药(n=3/组),并在经口给药前(p.o.)之前禁食过夜。然而,不限量地提供给分配为静脉内(i.v.)给药的大鼠食物和水。
在预定点,通过颈静脉收集血液并补充等体积的生理盐水。将收集的血液转移至含有作为抗凝剂的10μl肝素的标记的eppendorf管中。通常在以下时间点收集血液样品:给药之后0.08、0.25、0.5、1、2、4、6、8和24小时。将血液以4000rpm离心10分钟。分离血浆并在-80℃下冷冻储存直至分析。使用合适的提取技术,通过合格的lc-ms/ms方法在血浆中对受试化合物的浓度进行定量。在血浆中在约1至1000ng/ml的校准范围内对受试化合物进行定量。使用批次中的校准样品和分布在该批次中的质量控制样品对研究样品进行分析。
通过使用phoenixwinnonlin6.0.2或6.0.3版软件包,使用标准非房室模型,通过非房室模型计算药代动力学参数cmax、tmax(h)、auct、t1/2、清除率和生物利用度(f)。
实施例49:
啮齿动物脑渗透研究
将雄性wistar大鼠(260±40克)用作实验动物。在每个笼中饲养三只动物。在整个实验过程中不限量地给予动物水和食物并维持12小时光/暗循环。
在大鼠中以离散方式确定脑渗透。在给药日之前的一天,使雄性wistar大鼠适应并根据其体重随机分组。在每个时间点(0.5、1和2小时),使用n=3只动物。
将受试化合物适当地预先配制并以(游离碱当量)3mg/kg经口施用。通过使用异氟烷麻醉通过心脏穿刺取出血液样品。处死动物以收集脑组织。分离血浆并将脑样品进行匀浆,并在-20℃下冷冻储存直至分析。使用lc-ms/ms方法确定血浆和脑中受试化合物的浓度。
使用合格的提取技术,通过合格的lc-ms/ms方法在血浆和脑匀浆中对受试化合物进行定量。在血浆和脑匀浆中,在1至500ng/ml的校准范围内量化受试化合物。使用批次中的校准样品和分布在该批次中的质量控制样品对研究样品进行分析。计算脑-血浆比例(cb/cp)的程度,并将结果列于下表。
实施例50:
物体识别任务模型
通过使用该模型来估计本发明化合物的认知增强特性。
将雄性wistar大鼠(8至10周龄)用作实验动物。每个笼中饲养四只动物。从实验之前的一天开始,使动物保持20%的食物剥夺。在整个实验过程中不限量提供水。在温度和湿度受控的室内将动物维持12小时光/暗循环。实验在由丙烯酸制成的圆形场地中进行。在第1天,在没有任何物体的情况下,使大鼠适应单独场地达45分钟。
在熟悉(t1)和选择(t2)试验之前,一组12只大鼠接受载剂,并且另一组动物接受式(i)化合物。在熟悉阶段(t1)期间,将大鼠单独放置在场地中3分钟,其中两个相同的物体(a1和a2)位于离墙10cm处。t1之后24小时,进行长期记忆测试的试验。将相同的大鼠放置在与它们在t1试验中所放置的同一场地中。在选择阶段(t2)期间,允许大鼠在存在熟悉物体的复制品(a3)和一个新物体(b)的情况下探索场地3分钟。在t1和t2试验期间,使用秒表记录对每个物体的探索(定义为嗅、舔、咀嚼或将鼻子朝向距离小于1cm的物体时移动触须)。
t1是探索熟悉物体(a1+a2)所花费的总时间。
t2是探索熟悉物体和新物体(a3+b)所花费的总时间。
如ennaceur,a.,delacour,j.,1988,anewone-trialtestforneurobiologicalstudiesofmemoryinrats-behaviouraldata,behav.brainres.,31,47-59所述进行物体识别测试。
实施例51:
与乙酰胆碱酯酶抑制剂多奈哌齐组合的麻醉的雄性wistar大鼠背侧海马中的θ调节的评价。
评价与多奈哌齐组合的实施例11对作为药效学终点的脑活动的作用。
通过腹膜内施用氨基甲酸乙酯(1.2至1.5g/kg)麻醉雄性wistar大鼠(240至320g),用于在左股静脉中植入导管。将动物放置在立体定位框架中,用于将电极(不锈钢丝,plasticsone)植入背侧海马中(ap:-3.8mm;ml:+2.2mm;dv:-2.5mm;paxinos和watson,2004)。将双极刺激电极(无捻不锈钢丝,其尖端间隔0.75至1.0mm,plasticsone)植入nucleuspontisoralis中(npo;ap:-7.8mm;ml:1.8mm;dv:-6.0mm;paxinos和watson,2004)。另外,将一个电极植入小脑中作为参照。通过使用grasss88刺激器和psiu6刺激隔离单元(grassmedicalinstruments,quincy,ma)以0.01序列/秒的速率递送至npo的6秒电刺激序列(20至160μa,0.3-ms脉冲持续时间,250hz)诱发海马θ节律。使用ponemah(版本5.2)软件以1000hz的速率记录eeg,并存储用于使用neuroscore(版本3.0)进行离线分析。通过使用在控制条件下将θ节律引导至最大幅度的50%所需的电流来实现基线幅度水平。在1小时的稳定期之后,进行基线记录30分钟,然后用载剂或实施例11(1mg/kg,i.v.)处理。在实施例11处理之后30分钟施用多奈哌齐(0.3mg/kg,i.v.)并继续记录另外的1小时。
统计分析:
计算在30分钟基线期间的刺激期中的θ节律频率的功率,并计算处理之后这些测量的%变化。使用双因素方差分析(时间和处理),然后进行bonferroni事后检验,将实施例11与多奈哌齐组合后相对θ功率的百分比变化与多奈哌齐进行比较。在p值小于0.05时认为是统计学显著的。
参考文献:
1.paxinosg.和watsonc.(2004)ratbraininstereotaxiccoordinates.academicpress,newyork.
结果:
用多奈哌齐处理产生海马θ功率适度提高。与多奈哌齐组合的实施例11产生θ功率水平的显著提高。观察到组合治疗中的效果显著高于单独的多奈哌齐(图1)。
与多奈哌齐单独处理相比,在实施例11和多奈哌齐的处理之后计算的平均曲线下面积值(auc)显著更高(图1)。
- 还没有人留言评论。精彩留言会获得点赞!