功能性核酸分子及其用途的制作方法
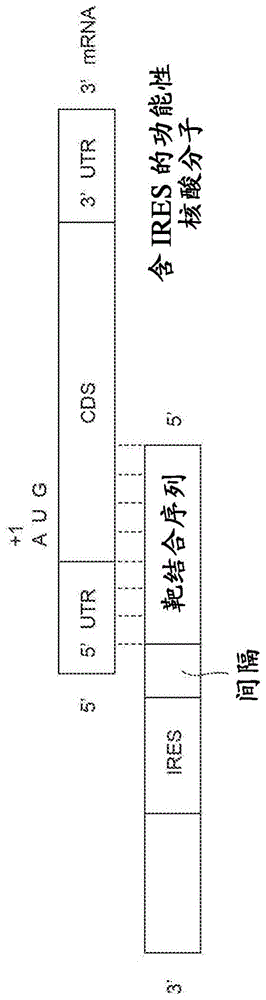
相关申请的交叉引用本申请要求于2017年9月20日提交的意大利专利申请号10201700015372的优先权,其公开内容通过引用并入本文。本发明涉及具有增强真核生物中特定靶mrna的蛋白质翻译功能的反式作用的功能性核酸分子、编码此类分子的dna分子、此类分子的用途以及增强蛋白质翻译的方法。现有技术在真核生物中,mrna主要通过帽依赖性机制进行翻译,根据所述帽依赖性机制,起始因子将40s核糖体亚基募集到mrna的5'端的帽结构。但是,一些病毒和细胞信息在没有帽的情况下启动蛋白质合成(thompsonsr,trendsmicrobiol2012;jacksonrj,coldspringharbperspectbiol.2013)。在这些情况下,称为内部核糖体进入位点(ires)的结构化rna元件募集40s核糖体亚基。ires是20多年前在小核糖核酸病毒中发现的。在细胞中,ires序列促进非帽依赖性的编码蛋白质的mrna亚基的翻译,从而克服了在应激条件下发生的帽依赖性翻译的普遍抑制。ires序列通常存在于编码应激反应基因的细胞mrna的5'非翻译区,从而刺激其顺式翻译。最近的高通量筛选系统已经扩大了细胞mrna内验证的ires序列的列表(weingarten-gabbays等人,science,2016)。可通过修饰编码蛋白质的mrna,以包括包含内部核糖体进入(ires)序列或翻译增强子序列的修饰的5'序列,来实现基因特异性翻译的上调。在这样的系统中,ires或翻译增强子序列被顺式放置在编码感兴趣的特定基因的cdna的5'端。该方法已用于构建表达两个顺反子的载体,并用于增强过表达基因的翻译。但是,当目标是诱导内源表达的mrna的翻译上调时,不能使用翻译增强的顺式调节。因此,需要鉴定促进基因特异性翻译上调并作用于内源性mrna的反式调节元件。还需要作为非依赖性rna结构域发挥作用的翻译上调反式调节元件。近年来,由于在临床上的潜在应用,使用核酸分子在体内操纵基因表达引起了极大的兴趣。迄今为止,大多数努力都集中在使用sirna、mirna和反义寡核苷酸来下调毒性蛋白的能力上。然而,许多疾病是由基因剂量减少引起的,因此需要增加蛋白产物。尽管许多研究已经在转录水平上解决了该问题,但是仅存在一个使用功能性反义rna分子(sineup)来增加翻译的例子(carrieric.等人,nature,2012)。sineup是反义、长的非编码rna,其能够促进部分重叠的编码蛋白质的mrna的翻译,而对mrna水平没有影响。sineup活性取决于两个功能结构域:重叠区域(或“结合结构域”),其决定了sineup的特异性,而嵌入的反向sineb2元件则作为“效应子结构域”发挥作用,其控制mrna翻译的增强(zucchellis.等人,frontcellneurosci2015;zucchellis.等人,rnabiol,2015)。通过利用其模块结构,可以设计合成的sineup来特异性增强几乎任何感兴趣靶基因的翻译(zucchellis.等人,frontcellneurosci2015;zucchellis.等人,rnabiol,2015;indrieria.等人,scientificreports,2016;gustincichs.等人,progneurobiol,2016;zucchellis.等人,computstructbiotechnolj,2016)。ep2691522公开了包括sineup的功能性核酸分子。尽管sineup具有潜力,但其仍依赖于嵌入的sine元件的翻译增强子的活性,sine元件是源自小鼠基因组的序列,具有在受体细胞中逆转座(从一个基因组位置移动到另一个基因组位置)的潜力。这对于涉及翻译上调以校正基因剂量不足的任何治疗用途都是不利的。因此,需要反式调节元件,其促进基因特异性翻译上调并作用于不是源自小鼠序列的内源性mrna。还需要反式调节元件,其促进基因特异性翻译上调并且不是源自转座元件。ep2691522的大多数功能性核酸分子具有相当长的长度。需要鉴定较短的反式调节元件,其促进基因特异性翻译上调并作用于内源性mrna,以使rna分子向受体细胞更有效地递送。ep2691522的功能性核酸分子的翻译增强作用通常为1.5-2.0倍,这取决于细胞类型。如果目的是在人中诱导翻译上调以校正不足的基因剂量,则这种蛋白增加的水平可能不足。因此,需要鉴定促进更高水平的基因特异性翻译上调并作用于内源性mrna的反式调节元件。技术实现要素:因此,本发明的目的是提供一种克服上述问题并且可能还具有增强功能的功能性核酸分子。该目的通过权利要求1中所定义的反式作用功能性核酸分子来实现。本发明的其他目的是提供权利要求10所定义的dna分子、权利要求11所定义的表达载体、权利要求12所定义的用于增强蛋白质翻译的方法、权利要求13所定义的组合物以及权利要求14和15所定义的反式作用功能性核酸分子的用途。附图说明图1显示了根据本发明的反式作用功能性核酸分子的示意图。图2a显示了根据现有技术(sineup)的功能性核酸分子的示意图。图2b显示了在分别用空对照质粒(-)、全长sineup-dj-1(fl)及其缺失突变体(δed=缺失效应子结构域的突变体,δbd=缺失结合结构域的突变体)转染的人胚胎肾293t/17细胞(以下也称为hek293t/17细胞)的裂解物上进行的蛋白质印迹的结果。图2c显示了qrt-pcr的结果,其定量了在如图2b所示样品上进行的内源性dj-1mrna(上图)和sineuprna(下图)的表达。图2d显示了hek293t/17细胞(n=5)中全长sineup-dj-1、δed和δbd对内源性dj-1mrna的翻译增强活性的图示。p<0.05图3显示了靶向dj-1mrna的根据本发明的通用反式作用功能性核酸分子(irup)的示意图。图4显示了用于测试含有ires的功能性反义核酸分子的翻译上调活性的实验程序的示意图。图5a显示了靶向dj-1基因并包括hcvires的根据本发明的功能性核酸分子(irup)的示意图。图5b显示了在分别用空对照质粒、sineup-dj-1和在正向(direct)(hcv(d))和反向方向(hcv(i))上包括hcvires的irup转染的hek293t/17细胞的裂解物上进行蛋白质印迹的结果。图5c显示了qrt-pcr的结果,其定量了在如图5b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图6a显示了靶向dj-1基因并包括脊髓灰质炎病毒ires的根据本发明的功能性核酸分子(irup)的示意图。图6b显示了在分别用空对照质粒、sineup-dj-1和在正向(polio(d))和反向方向(polio(i))上包括脊髓灰质炎ires的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图6c显示了qrt-pcr的结果,其定量了如图6b所示在样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图7a显示了靶向dj-1基因并包括脑心肌炎病毒(emcv)ires和蟋蟀麻痹病毒(cricketparalysisvirus,crpv)ires的根据本发明的功能性核酸分子(irup)的示意图。图7b显示了在分别用空对照质粒、sineup-dj-1和在正向方向(emcv(d))和反向方向(emcv(i))上包括emcvires的irup,和在正向方向(crpv(d))和反向方向(crpv(i))上包括crpvires的irup分别转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图7c显示了qrt-pcr的结果,其定量了在如图7b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图8a和8b显示了一组图,其总结了转染了本发明的hcv(d)和hcv(i)irup、polio(d)和polio(i)irup和emcv(d)、emcv(i)、crpv(d)和crpv(i)irup的hek293t/17细胞与转染空载体的293t/17细胞相比,dj-1蛋白数量的增加。图9a显示了靶向dj-1基因并包括人凋亡肽酶激活因子1(apaf-1)mrnaires的根据本发明的功能性核酸分子(irup)的示意图。图9b显示了分别用空对照质粒、sineup-dj-1和在正向方向(apaf-1(d))和反向方向(apaf-1(i))上包括apaf-1ires的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图9c显示了qrt-pcr的结果,其定量了在如图9b所示样品上进行内源性dj-1mrna(上图)和iruprna(下图)的表达。图10a显示了靶向dj-1基因并包括人增强水平的基因组不稳定性1(elg-1)mrnaires的根据本发明的功能性核酸分子(irup)的示意图。图10b显示了分别用空对照质粒、sineup-dj-1和在正向方向(elg-1(d))和反向方向(elg-1(i))上包括elg-1ires的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图10c显示了qrt-pcr的结果,其定量了在如图10b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图11a显示了靶向dj-1基因并包括人v-myc禽骨髓细胞瘤病毒癌基因同源物(cmyc)mrnaires的根据本发明的功能性核酸分子(irup)的示意图。图11b显示了在分别用空对照质粒、sineup-dj-1和在正向方向(cmyc(d))和反向方向(cmyc(i))上包括cmycires的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图11c显示了qrt-pcr的结果,其定量了在如图11b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图12a显示了靶向dj-1基因的根据本发明的功能性核酸分子(irup)的示意图,其包括图11a至11c的人v-myc禽骨髓细胞瘤病毒癌基因同源物(cmyc)mrnaires的较短版本。图12b显示了分别用空对照质粒、sineup-dj-1和在正向方向(cmyc(d))和反向方向(cmyc(i))上包括cmycires(短变体)的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图12c显示了qrt-pcr的结果,其定量了在如图12b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图13a显示了靶向dj-1基因并包括人肌营养不良蛋白(dmd)mrnaires的根据本发明的功能性核酸分子(irup)的示意图。图13b显示了分别用空对照质粒、sineup-dj-1和在正向方向(dmd(d))和反向方向(dmd(i))上包括dmdires的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图13c显示了qrt-pcr的结果,其定量了在如图13b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图14a和14b显示了一组图,其总结了用本发明的apaf-1(d)和apaf-1(i)irup、elg-1(d)和elg-1(i)irup、cmyc(d)短版本和cmyc(i)短版本irup、dmd(d)和dmd(i)irup、以及cmyc(d)长版本和cmyc(i)长版本irup转染的hek293t/17细胞,相对于空载体转染的293t/17细胞中,dj-1蛋白数量的增加。图15a-15d显示了分别用空对照质粒、sineup-dj-1、包括正向(d)或反向(i)方向的hcvires序列、正向(d)或反向(i)方向的polio和cmycires序列、正向(d)或反向(i)方向的apaf-1和elg-1ires序列、和正向(d)或反向(i)方向的dmdires序列的irup转染的人肝细胞癌(hepg2)细胞的裂解物上进行的蛋白质印迹的结果。图16a和图16b显示了一组图,其总结了用本发明的hcv(d)和hcv(i)irup、polio(d)和polio(i)irup、cmyc(d)短版本和cmyc(i)短版本irup、apaf-1(d)和apaf-1(i)irup、elg-1(d)和elg-1(i)irup、和dmd(d)和dmd(i)irup转染的hepg2细胞,相对于空载体转染的hepg2细胞中,dj-1蛋白数量的增加。图17a显示了靶向dj-1基因的根据本发明的功能性核酸分子的微型化版本(miniirup)的示意图。图17b显示了分别用空对照质粒、sineup-dj-1和包括正向方向的hcvires(hcv(d))、正向方向(polio(d))和反向方向(polio(i))的脊髓灰质炎病毒ires、和正向方向ires(cmycshort(d))的cmyc短版本ires的miniirup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图17c显示了qrt-pcr的结果,其定量了在如图17b所示样品上进行的内源dj-1mrna(上图)和iruprna(下图)的表达。图17d显示了sineup-dj-1和mini-irup对hek293t/17细胞中内源性dj-1mrna的翻译增强活性的图示(n=6)。图18a显示了靶向dj-1基因的根据本发明的功能性核酸分子的微型化版本(miniirup)的示意图。关于图17a-17d的miniirup,在不同启动子的控制下克隆了含有ires的功能性核酸序列。图18b显示了分别用空对照质粒、sineup-dj-1和包括正向方向的hcvires(hcv(d))、正向方向(polio(d))和反向方向(polio(i))的脊髓灰质炎病毒ires、和正向方向的cmyc短版本ires的miniirup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图18c显示了qrt-pcr结果,其定量了在如图18b所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图18d显示了sineup-dj-1和mini-irup对hek293t/17细胞中内源性dj-1mrna的翻译增强活性的图示(n=6)。图19a显示了用于在哺乳动物细胞中共同表达功能性核酸分子和感兴趣基因的pdual-gfp质粒的示意图。图19b显示了分别用如图19a所示空对照质粒、含sine(sine)或含ires(ires)的微型功能性核酸分子转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图19c显示了qrt-pcr的结果,其定量了用图19a的构建体转染的hek293t/17细胞中过表达的gfpmrna的表达。图19d显示了qrt-pcr的结果,其定量了功能性核酸sine或iresrna的表达。图20a显示了具有gfp靶向功能性核酸分子的pdual-gfp质粒的示意图,其中效应子结构域由sine或hcvires序列表示。图20b显示了分别用在图20a所示的空对照质粒、含sine(sine)或含ires(ires)的微型功能性核酸分子转染的人神经母细胞瘤neuro2a细胞的裂解物上进行的蛋白质印迹的结果。图21显示了hcviresrna二级结构的示意图。图22a显示了分别用空对照质粒、sineup-dj-1和包括wthcvires和m2和m5突变的hcvires的irup转染的hek293t/17细胞的裂解物上进行的蛋白质印迹的结果。图22b显示了qrt-pcr的结果,其定量了在如图22a所示样品上进行的内源性dj-1mrna(上图)和iruprna(下图)的表达。图22c显示了sineup-dj-1和irup对hek293t/17细胞中内源性dj-1mrna的翻译增强活性的图示(n=7)。图23a显示了如何将ires序列5'端和含ires的细胞mrna内的序列视为结合结构域的示意图。图23b显示了cmycmrna参考序列(nm_002467)内的功能性核酸序列元件。显示了结合结构域(黑色)、ires序列(深灰色)、编码序列或cds(浅灰色)和3'非翻译区(白色)。图23c显示了使用c-mycmrna作为查询序列在反义方向鉴定部分重叠的靶mrna蛋白编码序列的生物信息学分析(blast)的结果。图24a显示了编码myc的全长mrna(cmyc-fl)的哺乳动物表达质粒的示意图。图24b显示了用抗jag2、抗dyrk2、抗lys、抗ube3a、抗nrf1抗体在哺乳动物saos细胞的裂解物上进行的蛋白质印迹。图24c和24d显示了qrt-pcr的结果,其定量了内源性jag2、dyrk2、lis1、ube3a、nrf1和cmycmrna的表达。图24e显示了平均cmyc全长mrna水平。图25a显示了编码myc的全长mrna(cmyc-fl)或缺少cmycdna结合结构域(deltac)并且仅由5'utr(5'utr)或仅由ires(ires)结构域组成的变体的哺乳动物表达质粒的示意图。图25b显示了用抗jag2、抗dyrk2、抗lys、抗ube3a、抗nrf1抗体在哺乳动物saos细胞的裂解物上进行的蛋白质印迹。图25c显示了qrt-pcr的结果,其定量了内源性jag2、dyrk2、lis1、ube3a、nrf1和cmycmrna的表达。定义除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。以下描述了优选的方法和材料,尽管可以在实践或测试本发明中使用许多与本文描述的方法或材料相似或等同的方法和材料。除非另有说明,否则本文描述的用于本发明的技术是本领域普通技术人员众所周知的标准方法。术语“内部核糖体进入位点(ires)衍生的序列”是指与内部核糖体进入位点(ires)序列具有同源性的核酸序列,从而保留其功能活性,即翻译增强活性。特别地,内部核糖体进入位点(ires)衍生的序列可以通过基因工程或化学修饰从天然存在的ires序列获得,例如通过分离保留功能的ires序列的特定序列、或通过突变/缺失/引入ires序列中的一个或多个核苷酸、或用结构修饰的核苷酸或类似物替换ires序列中的一个或多个核苷酸。更特别地,本领域技术人员将知道内部核糖体进入位点(ires)衍生的序列是能够促进双顺反子构建体中第二顺反子翻译的核苷酸序列。通常,编码双重荧光素酶(萤火虫荧光素酶、海肾荧光素酶)的质粒用于实验测试。最近已经使用基于双重报告基因或双顺反子质粒的大规模筛选调查来自人基因组的序列作为ires发挥作用的能力(weingarten-gabbays等人,science.2016,351:6270)。存在主要数据库,即iresite,其用于注释已被使用双重报告基因或双顺反子测定法实验验证为ires的核苷酸序列(http://iresite.org/iresite_web.php)。在iresite中,可以使用基于web的工具来搜索感兴趣的查询序列与数据库中所有经注释和实验验证的ires序列之间的基于序列和基于结构的相似性(http://iresite.org/iresite_web.php?page=search)。该程序的输出是在使用双顺反子构建体的验证实验中能够作为ires发挥作用的任何核苷酸序列的概率得分。可以使用其他基于序列和基于结构的基于web的浏览工具来建议任何给定核苷酸序列的ires活性潜能的数字预测值(http://rna.informatik.uni-freiburg.de/;http://regrna.mbc.nctu.edu.tw/index1.php)。发明详述参考图1,本发明的反式作用功能性核酸分子(以下也称为“irup”)包含靶结合序列(也称为“结合结构域”)和调节序列(也称为“效应子结构域”)。靶结合序列包含与待增强蛋白质翻译的真核靶mrna序列反向互补的序列。真核靶mrna序列优选是动物或人靶mrna序列,更优选人靶mrna序列。调节序列包含内部核糖体进入位点(ires)序列或内部核糖体进入位点(ires)衍生的序列,其增强靶mrna序列的翻译。调节序列位于靶结合序列的3'。反式作用功能性核酸分子通过靶结合序列与靶mrna序列杂交,并且ires或ires衍生的序列增强靶mrna序列的翻译。本发明的功能性核酸分子允许利用ires序列作为反式调节元件,用于基因特异性地增加几乎任何细胞内源性或过表达的编码蛋白质的mrna的翻译。优选地,靶结合序列由从3'至5'与靶mrna序列的5'非翻译区(5'utr)的1至50个核苷酸和靶mrna序列的编码序列(cds)的1至40个核苷酸反向互补的序列组成。具体的非限制性实例包括由以下组成的靶结合序列:-与靶mrna序列的5'非翻译区(5'utr)的40个核苷酸和编码序列(cds)的4个核苷酸(提及起始甲硫氨酸密码子或内部符合读码框甲硫氨酸密码子)反向互补的序列;-与靶mrna序列的5'非翻译区(5'utr)的40个核苷酸和编码序列(cds)的32个核苷酸反向互补的序列;-与靶mrna序列的5'非翻译区(5'utr)的14个核苷酸和编码序列(cds)的4个核苷酸(提及起始甲硫氨酸密码子)反向互补的序列。调节序列包含内部核糖体进入位点(ires)序列,其优选衍生自人病毒或人蛋白编码基因。已经成功地测试了具有48至576个核苷酸的序列的一些ires,例如人丙型肝炎病毒(hcv)ires(seqidno:36和seqidno:37)、人脊髓灰质炎病毒ires(seqidno:38和seqidno:39)、人脑心肌炎(emcv)病毒(seqidno:40和seqidno:41)、人蟋蟀麻痹病毒(crpv)(seqidno:42和seqidno:43)、人apaf-1(seqidno:44和seqidno:45)、人elg-1(seqidno:46和seqidno:47)、人c-myc(seqidno:48、seqidno:49、seqidno:50和seqidno:51)、人肌营养不良蛋白(dmd)(seqidno:52和seqidno:53)。可以在实施例部分中找到更多详细信息。已经鉴定、分离了编码ires的结构元件的序列,其是翻译增强活性的基础,并用作反式作用功能性核酸分子的调节序列。如定义中已经提到的,内部核糖体进入位点(ires)衍生的序列可以包括基因工程或化学修饰的ires。化学修饰包括但不限于以下:碱基修饰:假尿苷;5'-溴尿苷;5'-甲基胞苷。糖修饰(2'修饰):2'-o-甲基-(2'-o-me);2'-o-甲氧基乙基(2'-moe);锁核酸(lna)。骨架修饰(磷酸骨架修饰):硫代磷酸酯(ps);磷酸三酯。其他(细胞类型特异性靶向结构域):galnac连接(肝细胞)。相对于功能性核酸分子的5'至3'方向无论是以正向方向或反向方向插入反式作用功能性核酸分子,ires序列或ires衍生的序列均是功能性的,但是,优选地的方向为正向方向。换句话说,“正向”是指将ires序列以与功能性核酸分子相同的5'至3'方向嵌入(插入)的情况。相反,“反向”是指将ires序列的反向互补序列插入核酸分子中的情况(ires序列相对于功能性核酸分子为3'至5'方向)。优选地,ires序列或ires衍生的序列是与选自seqidno:36至seqidno:65的序列具有75%同源性的序列,更优选地与选自seqidno:36至seqidno:65的序列具有90%同源性的序列,甚至更优选为选自seqidno:36至seqidno:65的序列。反式作用功能性核酸分子优选是rna分子或修饰的rna分子。修饰的示例如下:碱基修饰:假尿苷;5'-溴尿苷;5'-甲基胞苷。糖修饰(2'修饰):2'-o-甲基-(2'-o-me);2'-o-甲氧基乙基(2'-moe);锁核酸(lna)。骨架修饰(磷酸骨架修饰):硫代磷酸酯(ps);磷酸三酯。其他(细胞类型特异性靶向结构域):galnac连接(肝细胞)。反式作用功能性核酸分子优选进一步包含靶结合序列和调节序列之间的间隔序列。另外,反式作用功能性核酸分子任选地包含非编码的3'尾序列,例如包括用于将分子克隆到合适的质粒中的限制性位点。根据本发明已经生成了几种反式作用功能性核酸分子。下面总结了其中一些分子的特征。(bd=结合结构域;括号中的编号是相对于aug三联体a=+1)seqidno:1定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv,383个核苷酸,正向方向特征:bd=dj-ls(-40/+4)ed=ireshcv(383ntd)(seqidno:36)骨架=delta5'asuchllires方向:正向方向seqidno:2定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv,383个核苷酸,反向方向特征:bd=dj-ls(-40/+4)ed=ireshcv(383ntd)(seqidno:37)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:3定义:irup功能性核酸分子ires:病毒ires,人脊髓灰质炎病毒,312个核苷酸,正向方向特征:bd=dj-ls(-40/+4)ed=ires脊髓灰质炎病毒(312ntd)(seqidno:38)骨架=delta5'asuchllires方向:直接seqidno:4定义:irup功能性核酸分子ires:病毒ires,人脊髓灰质炎病毒,312个核苷酸,反向方向特征:bd=dj-ls(-40/+4)ed=ires脊髓灰质炎病毒(312ntd)(seqidno:39)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:5定义:irup功能性核酸分子ires:病毒ires,人脑心肌炎病毒,emcv-r,576个核苷酸,正向方向特征:bd=dj-ls(-40/+4)ed=iresemcv-r(576ntd)(seqidno:40)骨架=delta5'asuchllires方向:直接seqidno:6定义:irup功能性核酸分子ires:病毒ires,人脑心肌炎病毒,emcv-r,576个核苷酸,反向方向特征:bd=dj-ls(-40/+4)ed=iresemcv-r(576ntd)(seqidno:41)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:7定义:irup功能性核酸分子ires:病毒ires,人蟋蟀麻痹病毒,crpv,192个核苷酸,正向方向特征:bd=dj-ls(-40/+4)ed=irescrpv(192ntd)(seqidno:42)骨架=delta5'asuchllires方向:直接seqidno:8定义:irup功能性核酸分子ires:病毒ires,人蟋蟀麻痹病毒,crpv,192个核苷酸,反向方向特征:bd=dj-ls(-40/+4)ed=irescrpv(192ntd)(seqidno:43)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:9定义:irup功能性核酸分子ires:细胞ires,人apaf-1,231个核苷酸,正向方向(ensembl:ensg00000120868;mim:602233)特征:bd=dj-ls(-40/+4)ed=iresapaf-1(231ntd)(seqidno:44)骨架=delta5'asuchllires方向:直接seqidno:10定义:irup功能性核酸分子ires:细胞ires,人apaf-1,231个核苷酸,反向方向(ensembl:ensg00000120868;mim:602233)特征:bd=dj-ls(-40/+4)ed=iresapaf-1(231ntd)(seqidno:45)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:11定义:irup功能性核酸分子ires:细胞ires,人elg-1,460个核苷酸,正向方向(ensembl:ensg00000176208;mim:609534)特征:bd=dj-ls(-40/+4)ed=ireselg-1(460ntd)(seqidno:46)骨架=delta5'asuchllires方向:直接seqidno:12定义:irup功能性核酸分子ires:细胞ires,人elg-1,460个核苷酸,反向方向(ensembl:ensg00000176208;mim:609534)特征:bd=dj-ls(-40/+4)ed=ireselg-1(460ntd)(seqidno:47)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:13定义:irup功能性核酸分子ires:细胞ires,人c-myc,395个核苷酸,正向方向(ensembl:ensg00000136997;mim:190080)特征:bd=dj-ls(-40/+4)ed=iresc-myc全长(395ntd)(seqidno:48)骨架=delta5'asuchllires方向:直接其他:包括seqidno:15中包含的48nt最小序列(seqidno:50)。seqidno:14定义:irup功能性核酸分子ires:细胞ires,人c-myc,395个核苷酸,反向方向(ensembl:ensg00000136997;mim:190080)特征:bd=dj-1s(-40/+4)ed=iresc-myc全长(395ntd)(seqidno:49)骨架=delta5'asuchllires方向:反向(反向互补)其他:包括seqidno:16中包含的48nt最小序列(seqidno:51)。seqidno:15定义:irup功能性核酸分子ires:细胞ires,人c-myc,48个核苷酸,正向方向(ensembl:ensg00000136997;mim:190080)特征:bd=dj-ls(-40/+4)ed=iresc-myc(48ntd)(seqidno:50)骨架=delta5'asuchllires方向:直接seqidno:16定义:irup功能性核酸分子ires:细胞ires,人c-myc,48个核苷酸,反向方向(ensembl:ensg00000136997;mim:190080)功能:bd=dj-1s(-40/+4)ed=iresc-myc(48ntd)(seqidno:51)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:17定义:irup功能性核酸分子ires:细胞ires,人肌营养不良蛋白(dmd),71个核苷酸,正向方向(ensembl:ensg00000198947;mim:300377)特征:bd=dj-1s(-40/+4)ed=iresdmd(71ntd)(seqidno:52)骨架=delta5'asuchllires方向:直接seqidno:18定义:irup功能性核酸分子ires:细胞ires,人肌营养不良蛋白(dmd),71个核苷酸,反向方向(ensembl:ensg00000198947;mim:300377)特征:bd=dj-ls(-40/+4)ed=iresdmd(71ntd)(seqidno:53)骨架=delta5'asuchllires方向:反向(反向互补)seqidno:19定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#1,303个核苷酸,deltaii(40-119),与核糖体蛋白相互作用特征:bd=dj-ls(-40/+4)ed=hcvires正向,deltaii(seqidno:54)骨架=delta5'asuchll突变体#1:deltaii(40-119),与核糖体蛋白相互作用seqidno:20定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#2,367个核苷酸,deltaiii(156-171),eif3结合位点特征:bd=dj-ls(-40/+4)ed=hcvires正向,deltaiiia(seqidno:55)骨架=delta5'asuchll突变体#2:deltailia(156-171),eif3结合位点seqidno:21定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#3,356个核苷酸,deltaiiid(253-279),18srrna结合区特征:bd=dj-1s(-40/+4)ed=hcvires正向,deltallld(seqidno:56)骨架=delta5'asuchll突变体#3:deltaiiid(253-279),18srrna结合区seqidno:22定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#4,330个核苷酸,deltaiv(331-383),含aug的末端序列特征:bd=dj-ls(-40/+4)ed=hcvires正向,deltaiv(seqidno:57)骨架=delta5'asuchll突变体#4:deltaiv(331-383),包含aug的末端序列seqidno:23定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#5,383个核苷酸,g266->c;单个点突变,与18srrna接触特征:bd=dj-ls(-40/+4)ed=hcvires正向,g266->c(seqidno:58)骨架=delta5'asuchll突变体#5:g266->c;单个点突变,与18srrna接触seqidno:24定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#6,383个核苷酸,u228→c;在hcvires另一个位点的对照单个点突变,降低ires活性而不会破坏前起始复合物的形成特征:bd=dj-ls(-40/+4)ed=hcvires正向,u228->c(seqidno:59)骨架=delta5'asuchll突变体#6:u228->c;在hcvires另一个位点的对照单个点突变,降低ires活性,而不会破坏前起始复合物的形成。突变版本降低了对eif3的亲和力。seqidno:25定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#7,383个核苷酸,g267->c;iiid环,单个点突变,与18srrna接触特征:bd=dj-ls(-40/+4)ed=hcvires正向,g267->c(seqidno:60)骨架=delta5'asuchll突变体#7:g267->c;iiid环,单个点突变,与18srrna接触seqidno:26定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#8,383个核苷酸,g268->c;iiid环,单个点突变,与18srrna接触特征:bd=dj-ls(-40/+4)ed=hcvires正向,g268->c(seqidno:61)骨架=delta5'asuchll突变体#8:g268->c;iiid环,单个点突变,与18srrna接触seqidno:27定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#9,383个核苷酸,g266g267g268->c266c267c268;iiid环,三个点突变,与18srrna接触特征:bd=dj-ls(-40/+4)ed=hcvires正向,g266g267g268->c266c267c268(seqidno:62)骨架=delta5'asuchll突变体#9:g266g267g268->c266c267c268;iiid环,三个点突变,与18srrna接触seqidno:28定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#10,383个核苷酸,g266->a/g268->t;双点突变突变体;hcv5a分离株,感染力较弱特征:bd=dj-ls(-40/+4)ed=hcvires正向,g266->a/g268->t(seqidno:63)骨架=delta5'asuchll突变体#10:g266->a/g268->t;双点突变突变体;hcv5a分离株,感染力较弱seqidno:29定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#11,383个核苷酸,iiia->iiia-comp;agta->tcat特征:bd=dj-ls(-40/+4)ed=hcvires正向,iiia->iiia-comp;agta->tcat(seqidno:64)骨架=delta5'asuchl1突变体#11:hcvires正向,iiia->iiia-comp;agta->tcat)seqidno:30定义:irup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv突变体#12,383个核苷酸,iie->iiie-comp;tgatag->actatc特征:bd=dj-ls(-40/+4)ed=hcvires正向,iiie->iiie-comp;tgatag->actatc(seqidno:65)骨架=delta5'asuchll突变体#12:hcvires正向,iiie->iiie-comp;tgatag->actatcseqidno:31定义:miniirup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv,383个核苷酸,正向方向特征:bd=dj-ls(-40/+4)ed=ireshcv(383ntd)(seqidno:36)ires方向:正向seqidno:32定义:miniirup功能性核酸分子ires:病毒ires,人脊髓灰质炎病毒,312个核苷酸,正向方向特征:bd=dj-ls(-40/+4)ed=ires脊髓灰质炎病毒(312ntd)(seqidno:38)ires方向:正向seqidno:33定义:miniirup功能性核酸分子ires:病毒ires,人脊髓灰质炎病毒,312个核苷酸,反向方向特征:bd=dj-ls(-40/+4)ed=ires脊髓灰质炎病毒(312ntd)(seqidno:39)ires方向:反向(反向互补)seqidno:34定义:miniirup功能性核酸分子ires:细胞ires,人c-myc,48个核苷酸,正向方向(ensembl:ensg00000136997;mim:190080)特征:bd=dj-ls(-40/+4)ed=iresc-myc(48ntd)(seqidno:50)ires方向:正向seqidno:35定义:miniirup功能性核酸分子ires:病毒ires,人丙型肝炎病毒,hcv,383个核苷酸,正向方向特点:bd=gfp(-40/+32)ed=ireshcv(383ntd)(seqidno:36)ires方向:正向根据本发明的dna分子编码任何以上公开的反式作用功能性核酸分子。根据本发明的表达载体包含上述dna分子。特别地,以下质粒已用于有效表达功能性核酸分子。哺乳动物表达质粒:质粒名称:pcs2+表达:cmvie92启动子sv40polya终止子质粒名称:pcdn3.1(-)表达:cmv启动子bgh终止子质粒名称:pdual-egfpδ(由修饰pegfp-cl而得)表达:h1启动子;cmv启动子bgh终止子;sv40终止子病毒载体:载体名称:paav病毒:腺相关病毒表达:cag启动子/cmv增强子sv40polya终止子载体名称:plvx-tetone-puro病毒:慢病毒表达:tre3g启动子(诱导型表达)sv40polya终止子应当指出,进行的实验突出了反式作用功能性核酸分子的功能不受所用质粒的影响。根据本发明的用于增强蛋白质翻译的方法包括将上述公开的反式作用功能性核酸分子或dna分子或表达载体转染到细胞中。根据本发明的组合物包含上述公开的反式作用功能性核酸分子或dna分子或表达载体。反式作用功能性核酸分子可以作为裸rna递送,rna任选地包括适于增加rna稳定性的修饰。作为替代,反式作用功能性核酸分子可以是封装在基于脂质的纳米颗粒的阵列中的体外转录的rna或封装在基于外来体(exosome-based)的颗粒中的体外转录的rna。以上公开的反式作用功能性核酸分子或dna分子或表达载体可用于增强靶mrna序列的翻译。实施例显示了两种不同的靶mrna序列,park7/dj-1(也称为dj-1)和gfp的翻译增强,但是可以成功靶向任何其他mrna序列而不影响mrna水平。应该注意的是,irup可以增强感兴趣基因的翻译,而不影响其自身的mrna量。因此,上述公开的反式作用功能性核酸分子或dna分子或表达载体可以成功地用作分子工具,以验证细胞中的基因功能以及实现重组蛋白生产的程序。以上公开的反式作用功能性核酸分子或dna分子或表达载体可用于治疗由编码蛋白质的mrna的下调引起的遗传疾病,或用于治疗某些编码蛋白质的mrna的水平降低是不利的散发性疾病。以下是此类疾病的示例。当正常表型需要两个等位基因的蛋白质产物,并且基因功能降低到50%或更低会导致异常表型时,就会出现单倍体不足(haploinsufficiency)的病症。这是导致多种疾病的原因,包括特定类型的癌症、共济失调以及由于发育过程衰竭而导致的疾病。大量罕见病是由导致基因剂量减少的突变或微缺失而引起的。转录因子、突触蛋白和染色质重塑酶似乎对基因剂量特别敏感。在衰老过程中还可以观察到基因表达的降低。实施例实施例1图2显示,嵌入的效应子结构域(ed)是靶向内源性人dj-1mrna的反义、长的非编码rna(lncrna)的翻译上调功能所必需的。图2a显示了上调靶标特异性mrna翻译的功能性反义lncrna分子的示意图。指出了使用sineb2家族的嵌入式鼠转座元件的原始分子(sineup)。突出显示了sineup功能结构域:sineup结合结构域(bd):其为在反义方向与正义蛋白质编码mrna重叠的sineup序列;sineup效应子结构域(ed):其为sineup的非重叠部分中的反向sineb2元件(sine),可激活蛋白质合成。指出了正义和反义rna分子的5'至3'方向。靶标特异性mrna包括5'非翻译区(5'utr)、编码序列(cds)和3'非翻译区(3'utr)。还显示了翻译起始aug密码子。设计合成的sineup以靶向内源性人dj-1mrna(sineup-dj-1)。产生缺少结合结构域(δbd)或效应子结构域(δed)的sineup-dj-1突变体。用编码sineup-dj-1全长(fl)或其缺失突变体(δed=具有缺失的效应子结构域的突变体,δbd=具有缺失的结合结构域的突变体)的质粒转染人胚肾(hek)293t/17细胞。用空对照质粒(-)转染对照细胞。转染后48小时,将细胞裂解并处理以用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图2b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和sineuprna的表达(图2c)。数据表示平均值±标准偏差。数据代表n=5个独立重复。图2d显示了sineup-dj-1fl、δbd和δed对hek293t/17细胞中的内源性dj-1mrna的翻译增强活性(n=5)。p<0.05。实施例2合成的irup设计为靶向内源性人dj-1mrna。如图3所示,通过用衍生自具有ires活性的人病毒或人mrna的ires序列交换原始sineb2序列生成含ires的功能性核酸分子。表1包括在根据本发明的反式作用功能性核酸分子中使用的一些ires序列的列表。指出了ires名称、ires起源、克隆方向和ires长度。表1ires起源方向长度(nt)hcv人病毒正向383hcv人病毒反向383polio人病毒正向312polio人病毒反向312emcv人病毒正向576emcv人病毒反向576crpv人病毒正向192crpv人病毒反向192apaf-1人mrna正向231apaf-1人mrna反向231elg-1人mrna正向460elg-1人mrna反向460cmyc(长)人mrna正向395cmyc(长)人mrna反向395cmyc(短)人mrna正向48cmyc(短)人mrna反向48dmd人mrna正向71dmd人mrna反向71图4显示了用于测试含ires的功能性反义核酸分子的翻译上调活性的实验步骤的示意图。用人dj-1重叠序列(结合结构域)和ires序列(效应子结构域)产生了用于翻译激活的反义功能性核酸分子。将含ires的功能性核酸分子克隆到哺乳动物表达载体中,以在体外培养的哺乳动物细胞中表达。使用表达内源量的人dj-1mrna的细胞。显示了细胞接种、细胞转染和收获的时间。收获细胞以纯化rna(用于定量实时pcr,qrt-pcr)和蛋白质(用于蛋白质印记,wb)。图5a显示了反式作用功能性核酸分子的示意图,其中效应子结构域是来自人丙型肝炎病毒(hcv)的ires序列。相对于功能性核酸分子的5'到3'方向,通过将hcvires序列以正向(hcv(d)-seqidno:1)或反向(hcv(i)-seqidno:2)方向克隆而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中hcvires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图5b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。相对于含sine的功能性核酸分子,含ires的功能性核酸分子的效力更高或相似。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图5c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例3图6a显示反式作用功能性核酸分子的示意图,其中效应子结构域是来自人脊髓灰质炎病毒的ires序列。相对于功能性核酸分子的5'到3'方向,通过以正向(polio(d)-seqidno:3)或反向(polio(i)-seqidno:4)方向克隆polioires序列而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中polioires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图6b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图6c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例4图7a显示反式作用功能性核酸分子的示意图,其中效应子结构域分别是来自人脑心肌炎病毒(emcv)的ires序列和来自蟋蟀麻痹病毒(crpv)的ires序列。相对于功能性核酸分子的5'到3'方向,通过以正向(emcv(d)-seqidno:5)或反向(emcv(i)-seqidno:6)方向克隆emcvires序列,以及相对于功能性核酸分子的5'到3'方向,通过以正向(crpv(d)-seqidno:7)或反向(crpv(i)-seqidno:8)方向克隆crpvires序列而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中emcv和crpvires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图7b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图7c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例5通过蛋白质印记测量相对于空载体转染的hek293t/17细胞,实施例2的hcv(d)和hcv(i)irup、实施例3的polio(d)和polio(i)irup、实施例4的emcv(d)、emcv(i)、crpv(d)和crpv(i)irup转染的hek293t/17细胞中内源性dj-1蛋白的数量增加。结果总结在图8a和8b中。显然,含ires的功能性核酸分子反式激活了翻译,并且比含sine的分子更具活性。数据代表n>5个生物重复的平均值和标准偏差。单个星号(*)表示相对于空对照细胞,ires序列具有统计上显著的反式翻译增强活性;双星号(**)表示相对于含sine的功能性核酸分子,ires序列显示统计学上显著增强的效能。实施例6图9a显示反式作用功能性核酸分子的示意图,其中效应子结构域是来自人凋亡肽酶激活因子(apaf-1)mrna的ires序列。相对于功能性核酸分子的5'到3'方向,通过以正向(apaf-1(d)-seqidno:9)或反向(apaf-1(i)-seqidno:10)方向克隆apaf-1ires序列而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中apaf-1ires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图9b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力相对于含sine的功能性核酸分子的效力更高或类似。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图9c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例7图10a显示反式作用功能性核酸分子的示意图,其中效应子结构域是来自人增强水平的基因组不稳定性1(elg-1)mrna的ires序列。相对于功能性核酸分子的5'到3'方向,通过以正向(elg-1(d)-seqidno:11)或反向(elg-1(i)-seqidno:12)方向克隆elg-1ires序列而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中elg-1ires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图10b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图10c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例8图11a显示反式作用功能性核酸分子的示意图,其中效应子结构域是来自人v-myc禽骨髓细胞瘤病毒癌基因同源物(cmyc)mrna的ires序列。相对于功能性核酸分子的5'到3'方向,通过以正向(cmyc全长(d)-seqidno:13)或反向(cmyc全长(i)-seqidno:14)方向克隆cmycires序列(长变体)而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中cmycires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图11b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力相对于含sine的功能性核酸分子的效力更高或类似。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图11c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例9图12a显示反式作用功能性核酸分子的示意图,其中效应子结构域是实施例8的来自人v-myc禽骨髓细胞瘤病毒癌基因同源物(cmyc)mrna的ires序列的较短版本。相对于功能性核酸分子的5'到3'方向,通过以正向(cmyc短变体(d)-seqidno:15)或反向(cmyc短变体(i)-seqidno:16)方向克隆cmycires序列而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中cmycires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图11b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力相对于含sine的功能性核酸分子的效力更高或类似。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图12c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例10图13a显示反式作用功能性核酸分子的示意图,其中效应子结构域是来自人肌营养不良蛋白(dmd)mrna的ires序列。相对于功能性核酸分子的5'到3'方向,通过以正向(dmd(d)-seqidno:17)或反向(dmd(i)-seqidno:18)方向克隆dmdires序列而产生含ires的功能性核酸分子。如所示,用编码含ires的功能性核酸分子的质粒(其中dmdires序列为正向(d)或反向(i)方向)转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图13b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和iruprna的表达(图13c)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。数据代表n>5个独立重复。实施例11通过蛋白质印记测量相对于空载体转染的hek293t/17细胞,实施例6的apaf-1(d)和apaf-1(i)irup、实施例7的elg-1(d)和elg-1(i)irup、实施例8的cmyc全长(d)和cmyc全长(i)irup、实施例9的cmyc短变体(d)和cmyc短变体(i)irup、和实施例10的dmd(d)和dmd(i)irup转染的hek293t/17细胞中内源性dj-1蛋白的数量增加。结果总结在图14a和14b中。显然,含ires的功能性核酸分子反式激活翻译,并且比含sine的分子更具活性。数据代表n>5个生物重复的平均值和标准偏差。单个星号(*)表示相对于空对照细胞,ires序列具有统计上显著的反式翻译增强活性;双星号(**)表示相对于含sine的功能性核酸分子,ires序列显示统计学上显著增强的效能。实施例12如所示,用编码含ires功能性核酸分子的质粒(其中hcv(图15a)ires序列为正向(d)或反向(i)方向(seqidno:1或seqidno:2)、polio和cmyc(图15b)ires序列为正向(d)或反向(i)方向(seqidno:3、seqidno:4、seqidno:13或seqidno:14)、apaf-1和elg-1(图15c)ires序列为正向(d)或反向(i)方向(seqidno:9、seqidno:10、seqidno:11或seqidno:12、以及dmd(图15d)ires序列为正向(d)或反向(i)方向(seqidno:17或seqidno:18))转染人肝细胞癌(hepg2)细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含ires的功能性核酸分子的效力几乎总是比含sine的功能性核酸分子的效力更高。实施例13通过蛋白质印记测量相对于空载体转染的hepg2细胞,用hcv(d)和hcv(i)irup、polio(d)和polio(i)irup和cmyc短变体(d)和cmyc短变体(i)irup、apaf-1(d)和apaf-1(i)irup、elg-1(d)和elg-1(i)irup、dmd(d)和dmd(i)irup转染的hepg2细胞中内源性dj-1蛋白的数量增加。结果总结在图16a和16b中。含ires的功能性核酸分子反式激活翻译,并且比含sine的分子更具活性。数据代表n>2个生物重复的平均值和标准偏差。实施例14图17a显示了反式作用功能性核酸分子的微型化版本(minilrup)的示意图,其中效应子结构域是来自hcv、脊髓灰质炎病毒或cmyc短版本的ires序列。通过将hcvires序列以正向(hcv(d)-seqidno:31)方向克隆、将polioires序列以正向(polio(d)-seqidno:32)和反向(polio(i)-seqidno:33)方向克隆、以及将cmyc短ires序列以正向(cmyc短变体(d)-seqidno:34)方向克隆,在哺乳动物细胞中用于通过rna聚合酶ii表达的基于sv40的启动子控制下,生成含ires的功能性核酸分子。如所示,用编码以上所述含微型ires的功能性核酸分子的质粒转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图17b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含微型ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和微型iruprna的表达(图17c)。图17d显示了sineup-dj-1和微型irup对hek293t/17细胞中内源性dj-1mrna的翻译增强活性的示意图(n=6)。实施例15图18a显示了反式作用功能性核酸分子的微型化版本(miniirup)的示意图,其中效应子结构域是来自hcv、脊髓灰质炎病毒或cmyc短版本的ires序列。通过将hcvires序列以正向(hcv(d)-seqidno:31)方向克隆、将polioires序列以正向(polio(d)-seqidno:32)和反向(polio(i)-seqidno:33)方向克隆、以及将cmyc短ires序列以正向(cmyc短版本(d)-seqidno:34)方向克隆,在哺乳动物细胞中用于通过rna聚合酶iii表达的基于h1的启动子控制下,生成含ires的功能性核酸分子。如所示,用编码以上所述含微型ires的功能性核酸分子的质粒转染hek293t/17细胞。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图18b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含微型ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高(在一种情况下类似)。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和微型iruprna的表达(图18c)。图18d显示了sineup-dj-1和微型irup对hek293t/17细胞中内源性dj-1mrna的翻译增强活性的示意图(n=6)。实施例16图19a显示了用于在哺乳动物细胞中共同表达两个感兴趣基因的pdual-gfp质粒的示意图。pdual-gfp质粒包含一个用于通过rna聚合酶ii表达gfpmrna的cmv启动子元件;和一个用于表达gfp靶向的功能性核酸分子微型化版本的h1启动子(方向相反),以使gfp翻译增强。所产生的对照质粒缺乏翻译增强子功能性核酸分子,且表达基础水平的gfp蛋白。如所示,创建了pdual-gfp/minigfp质粒,其中效应子结构域由sineb2序列或hcvires表示。用单独编码gfp或编码gfp与含sine(sine)或含ires(ires)的微型功能性核酸分子组合的pdual质粒转染hek293t/17细胞。仅用pdual-gfp转染的细胞用作测试含ires分子效率的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗gfp抗体进行蛋白质印迹(图19b)。将β-肌动蛋白用作上样对照。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测过表达gfpmrna(图19c)和功能性核酸sine或iresrna(图19d)的表达。结果表明,当gfp在hek293t/17细胞中过表达时,带有与gfpmrna反义的结合结构域的含ires功能性核酸分子增强gfpmrna的翻译。实施例17图20a显示了具有gfp靶向功能性核酸分子的pdual-gfp质粒的示意图,其中效应子结构域由sine或hcvires序列表示。用图20a所示的pdual-gfp质粒转染人神经母细胞瘤neuro2a细胞。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗gfp抗体进行蛋白质印迹(图20b)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。含微型ires的功能性核酸分子的效力比含sine的功能性核酸分子的效力更高。实施例18设计了包含dj-1靶向结合结构域和hcvires效应子结构域的功能性核酸分子,其在对hcvires顺式活性重要的结构区中具有特定突变。图21显示了hcviresrna二级结构的示意图。hcvires结构域(iia,iib,iiia,iiib,iiic,iiid,iiie和iiif)在不同的方块表示中。还显示了每个结构域对于序列的内部核糖体进入活性的功能,并与核糖体rna和/或核糖体蛋白接触。功能性核酸分子用作诱变的模板,所述功能性核酸分子中的效应子结构域由衍生自hcv并含有dj-1靶向结合结构域的ires序列表示。通过缺失iiia茎环(hcvires序列-ires的氨基酸156-171=seqidno:55;irup=seqidno:20)产生m2突变体,iiia茎环参与与真核翻译起始因子eif3和核糖体蛋白es27的接触。通过核苷酸g266的定点核苷酸取代(g266->c-ires=seqidno:58;irup=seqidno:23)产生m5突变体,核苷酸g266对18srrna的碱基配对和hcvires的顺式活性很重要。实施例19如所示,用编码含ires的功能性核酸分子的哺乳动物表达质粒转染hek293t/17细胞,该含ires的功能性核酸分子具有正向方向的hcvires序列(wt)或hcviresdiiia(m2)或g266->c(m5)突变体。用空对照质粒(-)转染对照细胞。用sineup-dj-1转染的细胞用作测试含ires分子效力的参考。转染后48小时,将细胞裂解并处理用于蛋白质定量。用抗dj-1抗体进行蛋白质印迹(图22a)。将β-肌动蛋白用作上样对照。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。相对于含sine的功能性核酸分子,wt和含突变的ires的功能性核酸分子的效力更高或类似。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性dj-1mrna和功能性核酸rna的表达(图22b)。为了比较含sine和含ires的功能性核酸分子间的rna数量,将引物定位于效应子结构域的3'端。数据表示平均值±标准偏差。图22c显示了具有sine或hcvires嵌入序列的功能性核酸分子对hek293t/17细胞中内源性dj-1mrna的翻译增强活性的示意图(n=7)。双星号(**)表示突变的ires序列相对于含wthcvires的功能性核酸分子,显示在统计上显著降低的翻译增强。该实施例表明,顺式hcvires活性所需的结构元件有助于作为包含dj-1靶向结合结构域的功能性核酸分子中嵌入的效应子结构域(ed)的反式hcvires的翻译增强活性的增加。实施例20该实施例表明,靶mrna中的任何核酸序列均可被包含ires衍生序列的功能性核酸分子的结合结构域识别。图23a显示了如何将ires序列的5'的序列和含ires的细胞mrna内的序列视为结合结构域的示意图,图23b显示了cmycmrna参考序列(nm_002467)中的功能性核酸序列元件。图23c显示了使用c-mycmrna作为查询序列在反义方向鉴定部分重叠的靶mrna蛋白编码序列的生物信息学分析(blast)的结果。在表中,标出了注释的基因ensembl命名法、基因名称和基因配对区。ires衍生的结合结构域可以在反义方向与靶mrna在5'utr、第一外显子、内部外显子中重叠,并具有18至198的不同配对长度。用编码myc的全长mrna(cmyc-fl)的哺乳动物表达质粒转染哺乳动物的saos细胞(图24a)。用空载体质粒转染对照细胞(对照)。转染后48小时,将细胞裂解并处理用于蛋白质定量。如所示,用抗jag2、抗dyrk2、抗lys、抗ube3a、抗nrf1抗体进行蛋白质印迹(图24b)。将β-肌动蛋白用作上样对照。抗cmyc抗体被用作另外的对照,以验证转染后cmyc蛋白的表达。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品(c),计算诱导倍数。含cmycires的功能性核酸分子对于所有测试的靶mrna均具有明显的效力,其中结合结构域的长度范围为144(jag2)至20(ube3a,nrf1)个核苷酸。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性jag2、dyrk2、lis1、ube3a、nrf1和cmycmrna的表达(图24c和图24d)。该实施例表明,含ires的功能性核酸分子的结合结构域和编码靶蛋白的mrna之间的配对区域可以在位置和长度上变化,而保持其全部翻译增强活性。实施例21该实施例表明,含ires的功能性核酸分子不需要cmyc的编码蛋白质的cds部分和dna结合结构域来增加部分重叠的编码蛋白质的mrna的翻译。用编码myc全长mrna(cmyc-fl)或缺少cmycdna结合结构域(deltac)的和仅包含5'utr(5'utr)、或仅包含ires(ires)结构域的变体的哺乳动物表达质粒转染哺乳动物saos细胞(图25a)。用空载体质粒转染对照细胞(对照)。转染后48小时,将细胞裂解并处理用于蛋白质定量。如所示,用抗jag2、抗dyrk2、抗lys、抗ube3a、抗nrf1抗体进行蛋白质印迹(图25b)。将β-肌动蛋白用作上样对照。抗cmyc抗体被用作另外的对照,以验证转染后cmyc蛋白的表达。蛋白质印迹图像针对β-肌动蛋白归一化和相对于空对照样品,计算诱导倍数。相对于对照细胞的蛋白质量的倍数变化显示在蛋白质印迹相图像的底部。从转染的细胞中纯化rna。使用特异性引物通过qrt-pcr监测内源性jag2、dyrk2、lis1、ube3a、nrf1和cmycmrna的表达(图25c),证明了含ires的功能性核酸分子的转录后机制。优点本发明的反式作用功能性核酸分子允许在不影响靶mrna水平的情况下增强几乎任何靶mrna序列的翻译。相对于ep2691522中公开的功能性核酸分子,本发明的那些核酸分子避免了由于小鼠sine序列引起的逆转座的风险,并促进了更高水平的蛋白质翻译增强,如实施例2至11的hek293t/17中所示,以及实施例12中的hepg2细胞所示。特别地,在图5(hcvires,正向)、图6(polioires,正向和反向)、图7(ecmvires,正向和反向;crpvires,正向和反向)、图9(apaf1ires,正向)、图10(elg-1ires,正向和反向)、图11(cmycires,正向)、图12(短cmycires,正向)、图12(dmdires,正向和反向)中给出了在hek细胞中更有效的ires序列的实例。此外,在hepg2细胞中也给出了更有效的ires序列的实例(图15)。一些ires序列短至40至50个核苷酸。这允许工程化非常短的反式作用功能性核酸分子。另外,特别是与ep2691522中公开的功能性核酸分子相比,本发明的反式作用功能性核酸分子可以包括特别短的靶结合序列。调节序列和靶结合序列的有限长度均有助于保持短的分子长度,同时允许最佳靶向和蛋白质合成增强。具有短分子的主要优点之一是克服了合成长度超过100个核苷酸的rna的困难。本发明的反式作用功能性核酸分子的另一个优点是它们具有模块结构,即具有独立的靶结合结构域和独立的效应子结构域。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1