建立将iPSC衍生的细胞分化为器官等效物的新型多器官芯片的制作方法
本公开涉及在微流体装置上建立将诱导多能干细胞(ipsc)衍生的细胞分化成器官等效物的新型多器官芯片,以及产生器官等效物的相应方法。本公开还涉及模拟用ipsc衍生的内皮细胞产生的器官屏障和/或在水凝胶中生物印刷和/或其上接种的细胞器的新型生物工程化组织构建体。本公开进一步涉及生物工程化器官构建体的方法,其包括共培养ipsc衍生的器官前体细胞和ipsc衍生的成纤维细胞和内皮细胞。本公开具体地提供微流体装置,其包括:(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞自从单一类型的体细胞重编程的单一供体ipsc分化。
背景技术:
微流体装置能够以最小的生物学可接受规模在体外模仿人类生物学。与传统的(静态)细胞和组织培养物相比,微生理系统将动态流体流应用于组织的生理营养,作为模拟器官功能的因素,其中对人体细胞和组织的使用最少。就药物开发和毒性测试而言,多器官芯片技术是制药行业特别感兴趣的。芯片上多器官模型可以增强对复杂生物过程的基本了解,并被认为可以带来更快速、更准确、更具成本效益以及与药物和化妆品的临床相关测试。因此,在本领域中,越来越认识到,使用在微流体装置上实施的微生理系统进行的体外测试比体内测试更有效,也更可靠。
干细胞具有连续分裂的能力,并能够分化成各种细胞。近年来,已经出现了用于功能器官产生的基于干细胞的方法,特别是为了解决用于移植的器官的短缺,并且本领域中已经报道了在芯片上器官装置上培养干细胞。具体地,giobbe等人(nat.methods,2015,12(7),637-640)描述了在芯片上将多能干细胞功能分化为心肌细胞和肝细胞,以及zhang等人(futuresci.oa,2017,3(2),fso197)描述了充质干细胞培养物及其在微流体装置中向芯片上器官的分化。然而,尚无关于将不同干细胞衍生的器官前体细胞共培养以建立具有众多模仿器官功能的模型的多器官芯片的报道,特别是没有关于在微流体装置上共培养不同的诱导多能干细胞(ipsc)衍生的细胞用于产生器官等效物的报道。
本领域中存在对将诱导多能干细胞(ipsc)衍生的细胞分化成器官等效物的多器官微流体装置以及产生器官等效物的相应方法的需要。本公开解决了该需要,具体地通过提供新型微流体装置以及通过提供生物工程化器官构建体的新型方法,该微流体装置包括:(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞由从单一类型的体细胞重编程的单一供体ipsc分化;以及该方法包括共培养ipsc衍生的器官前体细胞和ipsc衍生的成纤维细胞和内皮细胞。
技术实现要素:
本公开尤其提供了建立将诱导多能干细胞(ipsc)衍生的细胞分化成器官等效物的新型多器官芯片。具体地,本公开提供了用于共培养不同的ipsc衍生的器官前体细胞以产生具有众多模仿器官功能的模型的多器官芯片的新型微流体装置。本公开进一步提供了生物工程化器官构建体的方法,该方法包括共培养ipsc衍生的器官前体细胞和ipsc衍生的成纤维细胞和内皮细胞。本公开还提供了新型生物工程化组织构建体,其模拟了由ipsc衍生的原代内皮细胞(包括如hdmec)产生的器官屏障和/或水凝胶中或上的细胞器。
本公开进一步提供了在微流体芯片中实现血液回路(circuit)和尿液回路,并建立了支持生理条件的微生理系统,该生理条件用于在模拟模仿器官功能的众多模型的相互作用和串扰(cross-talk)的系统中维持稳定的微环境。令人惊讶的是,已发现具有微型化人肠、肝、脑和肾等效物的四器官芯片,它们均由同一供体的ipsc预先分化,显示了在缺乏生长因子的培养基中在14天培养期内不同的ipsc衍生的器官模型的进一步分化。该进一步分化归因于器官等效物之间的串扰。此外,可以观察到不同组织随时间的高级成熟。有意义的是,已经表明,不同的ipsc衍生的器官模型在adme-n(=adme芯片加神经元等效物)的共培养期间是稳定的,即保持其表型,并显示出随时间对定向的组织的确定的和一致的标记基因表达(实验7和图21)。本公开提供了新型微流体装置,其适合在adme(t)序型分析的背景下用于药代动力学-药物动力学分析的测定建立。具体地,本公开建立了在生理基础上药代动力学(pbpk)顺应性微生理系统(mps)中培养的来自单一供体的四个不同的自体ipsc衍生的器官模型的成功的系统性长期共培养,而没有添加额外的生长因子。
具体地,本公开提供了:
[1]微流体装置,其包括:(i)诱导多能干细胞(ipsc)衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中从单一类型的体细胞获得的ipsc的单一供体获得根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞。因此,如本文所描述,ipsc衍生的前体细胞可以被认为是自体细胞。
[2]微流体装置,其包括:(i)诱导多能干细胞(ipsc)衍生的肝细胞细胞器;(ii)ipsc衍生的肠细胞器;和(iii)ipsc衍生的肾小管细胞器;其中从单一类型的体细胞获得的ipsc的单一供体获得根据(i)、(ii)、(iii)和(iv)的ipsc衍生的细胞器。
[3]根据[1]或[2]的微流体装置,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞或根据(i)、(ii)和(iii)的ipsc衍生的细胞器分别沉积在单独的细胞培养隔室中。
[4]根据[1]-[3]中任一项的微流体装置,其中微流体装置包括第一回路和第二回路,和其中含有根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞或根据(i)、(ii)和(iii)的ipsc衍生的细胞器的细胞培养隔室分别形成第一回路的部分,和其中第二回路包括过滤单元和重吸收单元,其中两个回路经由过滤单元和重吸收单元彼此连接。
[5]根据[4]的微流体装置,其中过滤单元包括基于分子大小和电荷选择性允许分子从第一回路穿过至第二回路的过滤屏障。
[6]产生肝细胞细胞器、肠细胞器和肾脏肾小管细胞器的方法,该方法包括在单独的细胞培养隔室中共培养(i)诱导多能干细胞(ipsc)衍生的肝细胞前体细胞、(ii)ipsc衍生的肠前体细胞和(iii)ipsc衍生的肾前体细胞,这些单独的细胞培养隔室彼此之间处于微流体连接。
[7]根据[6]的方法,其进一步包括共培养ipsc衍生的内皮细胞,其中ipsc衍生的内皮细胞获得自与根据(i)、(ii)和(iii)的ipsc衍生的前体细胞/球状体相同的ipsc的单一供体,和其中ipsc衍生的内皮细胞沉积在连接细胞培养隔室的微流体通道中。
[8]根据[6]或[7]的方法,其中含有ipsc衍生的肝细胞前体细胞的细胞培养隔室进一步包含ipsc衍生的成纤维细胞,其获得自与ipsc衍生的肝细胞前体细胞相同的ipsc的单一供体。
[9]根据[1]-[5]中任一项的微流体装置在分析测试、诊断、研究、靶标验证、毒性研究、组织工程化、组织制造、药物筛选和/或药代动力学-药物动力学分析中的用途。
[10]利用根据[1]-[5]中任一项的微流体装置检测微生理系统中分析物的方法。
[11]模拟哺乳动物器官屏障的生物工程化结缔组织构建体,其包括:(i)诱导多能干细胞(ipsc)衍生的细胞器;(ii)ipsc衍生的成纤维细胞;和(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)和(iii)的ipsc衍生的细胞器和细胞获得自ipsc的单一供体,该ipsc获得自单一类型的哺乳动物体细胞。
[12]生物工程化模拟哺乳动物器官屏障的结缔组织构建体的方法,该方法包括在水凝胶中生物印刷和/或在其上接种:(i)诱导多能干细胞(ipsc)衍生的细胞器,(ii)ipsc衍生的成纤维细胞,和(iii)ipsc衍生的内皮细,其中根据(i)、(ii)和(iii)的ipsc衍生的细胞器和细胞获得自ipsc的单一供体,该ipsc获得自单一类型的哺乳动物体细胞。
[13]根据[11]的结缔组织构建体,其用于组织修复、组织工程化和/或组织制造中任一种。
[14]模拟哺乳动物血脑屏障的生物工程化组织构建体,其包括:(i)诱导多能干细胞(ipsc)衍生的神经球;和(ii)ipsc衍生的内皮细胞,其中根据(i)和(ii)的ipsc衍生的神经球和内皮细胞获得自ipsc的单一供体,该ipsc获得自单一类型的哺乳动物体细胞。
[15]生物工程化模拟哺乳动物血脑屏障的组织构建体的方法,方法包括在水凝胶中生物印刷和/或在其上接种:(i)诱导多能干细胞(ipsc)衍生的神经球;(ii)ipsc衍生的内皮细胞;和(iii)ipsc衍生的成纤维细胞,其中根据(i)、(ii)和(iii)的ipsc衍生的神经球、内皮细胞和成纤维细胞获得自ipsc的单一供体,该ipsc获得自单一类型的哺乳动物体细胞。
[16]微流体系统,其包括[11]的结缔组织构建体或[14]的组织构建体。
[17]生物工程化成年器官构建体的方法,其包括在单个细胞培养隔室中共培养(i)诱导多能干细胞(ipsc)衍生的器官前体细胞,(ii)ipsc衍生的成纤维细胞,和(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)和(iii)的ipsc衍生的器官前体细胞和ipsc衍生的成纤维细胞和内皮细胞获得自ipsc的单一供体,该ipsc获得自单一类型的哺乳动物体细胞。
[18]生物工程化成年内皮细胞的方法,其包括将诱导多能干细胞(ipsc)衍生的内皮前体细胞暴露至剪切应力,优选地其中方法包括在微流体系统的微流体通道中培养ipsc衍生的内皮前体细胞。
[19]生物工程化成年肝器官构建体的方法,其包括在单一细胞培养隔室中共培养(i)诱导多能干细胞(ipsc)衍生的肝细胞前体细胞;(ii)ipsc衍生的成纤维细胞;和/或(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)和(iii)ipsc衍生的肝细胞前体细胞、ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞获得自ipsc的单一供体,该ipsc获得自单一类型的哺乳动物体细胞。
在本公开的各种实施方式中,包括本文公开的任何微流体装置、组织构建体、方法和用途,将ipsc衍生的前体细胞和/或ipsc衍生的细胞器与不含ipsc衍生的前体细胞和/或ipsc衍生的细胞器的额外生长因子的培养基/营养液一起培养。例如,如果培养基包含人类成年血清,则其不含对个体ipsc衍生的前体细胞和/或ipsc衍生的细胞器特异性的额外生长因子,即不含例如肝细胞的肝细胞生长因子。因此,在各种实施方式中,培养基/营养液不包含对本文公开的任何ipsc衍生的前体细胞和/或ipsc衍生的细胞器具有特异性的生长因子。本公开包括ipsc衍生的前体细胞和/或ipsc衍生的细胞器在本文公开的任何微流体装置、组织构建体、方法和用途中的用途,其中ipsc衍生的前体细胞和/或ipsc衍生的细胞器共培养至少两个星期的期间。优选地,这样的共培养包括四种不同的细胞器/器官等效物的共培育。在优选的实施方式中,四种不同的细胞器/器官等效物是肝细胞器/等效物、肾脏(或肾)细胞器/等效物、脑细胞器/等效物和肠细胞器/等效物。在这样的共培养中,培养基/营养液优选不包含ipsc衍生的前体细胞和/或ipsc衍生的细胞器的生长因子。
在各种优选的实施方式中,本文所述的任何ipsc衍生的细胞器由ipsc衍生的成纤维细胞和/或ipsc衍生的内皮细胞组装/组装在一起,其中ipsc衍生的成纤维细胞和/或ipsc衍生的内皮细胞获得自与ipsc衍生的细胞器相同的ipsc的单一供体(其从单一类型的体细胞获得)。更具体地,在各种优选的实施方式中,肠细胞器由ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞组装/组装在一起,即,在各种实施方式中,肠细胞器与ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞共培养。此外,在各种优选的实施方式中,肝细胞器由ipsc衍生的肝细胞以及ipsc衍生的成纤维细胞组装/组装在一起。同样,在各种优选的实施方式中,肾细胞器可以由(ipsc衍生的)成纤维细胞和ipsc衍生的内皮细胞组装/组装在一起。同样,在各种优选的实施方式中,脑细胞器可以由ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞组装/组装在一起。根据以上所述,在这些优选的实施方式中,ipsc衍生的成纤维细胞和/或ipsc衍生的内皮细胞获得自与ipsc衍生的细胞器相同的ipsc的单一供体(其从单一类型的体细胞获得)。
本公开的进一步方面和实施方式包括:
[1]微流体装置,其包括具有一个或多个细胞培养隔室的第一回路和包括过滤单元和重吸收单元的第二回路,其中两个回路经由过滤单元和重吸收单元彼此连接。
[2]根据[1]的微流体装置,其中过滤单元包括基于分子的大小和电荷选择性允许分子从第一回路穿过至第二回路的过滤屏障。
[3]根据[2]的微流体装置,其中过滤屏障是机械的或生物屏障,优选地包括足细胞的生物屏障。
[4]根据[1]-[3]中任一项的微流体装置,其中重吸收单元包括允许来自第二回路的流体至第一回路的重吸收的屏障。
[5]根据[4]的微流体装置,其中重吸收屏障是生物屏障,优选地其中生物屏障包括肾小管细胞。
[6]根据[1]-[5]中任一项的微流体装置,其中第一回路的细胞培养隔室中至少一个包括模拟肝功能的器官等效物,和第一回路的细胞培养隔室中至少一个包括模拟肠功能的器官等效物。
[7]根据[1]-[6]中任一项的微流体装置在分析测试、诊断、研究、靶标验证、毒性研究、组织工程化、组织制造、药物筛选、和/或药代动力学-药物动力学分析中的用途。
[8]利用根据[1]-[6]中任一项的微流体装置操作微生理系统的方法。
[9]根据[8]的方法,进一步包括经由细胞培养隔室向微生理系统选择性添加营养液,细胞培养隔室包括包含胃肠道的内皮细胞并模拟肠功能的器官等效物或组织。在本公开的各种实施方式中,营养液不含有根据本文其他地方描述的实施方式的ipsc衍生的前体细胞和/或ipsc衍生的细胞器的额外生长因子。例如,如果培养基包含人类成年血清,则其不含对个体ipsc衍生的前体细胞和/或ipsc衍生的细胞器特异性的额外生长因子,即不含例如肝细胞的肝细胞生长因子。因此,在各种实施方式中,营养液不包含对本文公开的任何ipsc衍生的前体细胞和/或ipsc衍生的细胞器具有特异性的生长因子。
[10]利用根据[1]-[6]中任一项的微流体装置检测微生理系统中分析物的方法,其中方法包括将测试样品添加到第一回路的细胞培养隔室,优选地其中细胞培养隔室包括包含胃肠道、皮肤或呼吸道的内皮细胞的组织。
[11]模拟体内稳态的方法,其包括操作微生理系统,该微生理系统包括具有一个或多个细胞培养隔室的第一回路和包括过滤单元和重吸收单元的第二回路,其中两个回路经由过滤单元和重吸收单元彼此连接。
[12]根据[11]的方法,其包括经由细胞培养隔室向微生理系统选择性添加营养液,细胞培养隔室包括胃肠道、皮肤或呼吸道的内皮细胞,优选地其中内皮细胞是胃肠道,优选地小肠的内皮细胞。
[13]培养和/或保持细胞的方法,其包括向根据权利要求[1]-[6]中任一项的微流体装置接种细胞。
[14]操作微生理系统的套件,其包括根据权利要求[1]-[6]中任一项的微流体装置和使用说明书。
[15]adme(吸收、分配、代谢、排泄)测定或admet(吸收、分配、代谢、排泄、毒性)测定,其包括根据权利要求[1]-[6]中任一项的微流体装置。
附图说明
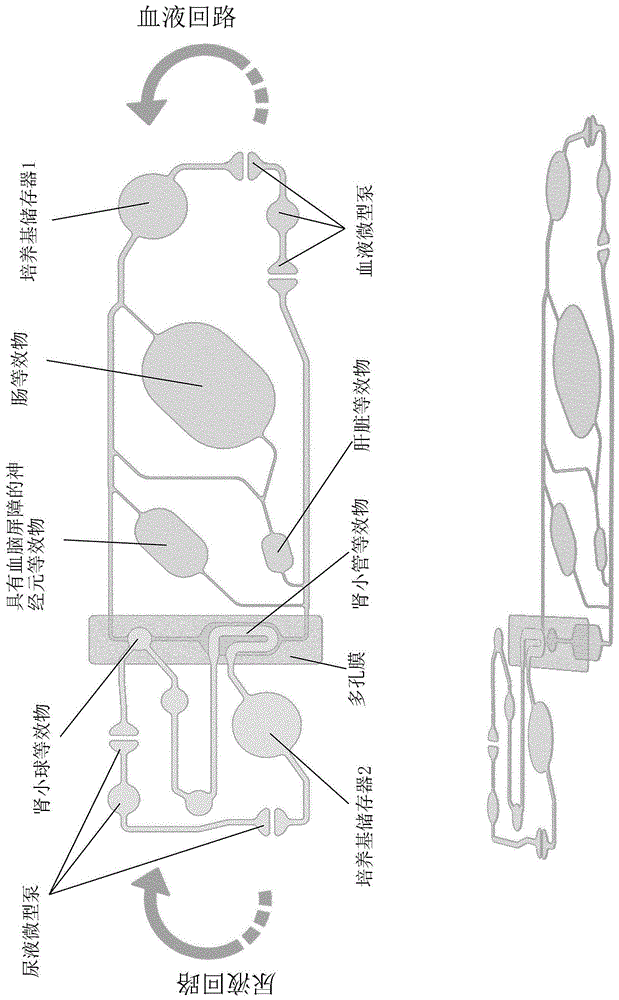
图1:显示了示例性adme-n芯片覆盖区(footprint)(上图)和单独层上的等长视图(下图)。等长视图举例说明两个回路(血液回路和尿液回路)之间的膜的定位。adme-n=adme芯片加神经元等效物。
图2:显示了ipsc芯片和初生组织芯片的实验设计。rptec=肾近端小管上皮细胞系。ipsc=诱导多能干细胞。2a:实验1.1和1.2的设计,2b:实验2的设计。
图3:显示了葡萄糖浓度和ldh活性的测量。3a:实验1.1(ipsc芯片)的葡萄糖浓度和ldh活性的测量;3b:实验1.2(初生组织芯片)的葡萄糖浓度和ldh活性的测量。在“血液”培养基储存器(用于血液回路)和在“尿液”培养基储存器(用于尿液回路)中,在肠等效物的顶端隔室中每日进行测量。
图4:显示了完全接种人rptec的adme-n芯片的肾小管等效物(实验1.1,第7天)。a:培养的第7天的明场(bf)图像。b-d:在第14天rptec的免疫组织学染色(实验1.2)b:用dapi(4’,6-联脒-2-苯吲哚)染色的核;c:nak-atp酶染色的细胞膜;d:细胞角蛋白8/18染色的细胞骨架(cytoskeleton)。rptec=肾近端小管内皮细胞。
图5:显示了在培养基储存器1中“血液”回路中和培养基储存器2中“尿液”回路中的天冬酰胺转氨酶(ast)浓度的测量。
图6:显示了在adme-n芯片培养的第7天时具有原代内皮细胞的ipsc衍生的肠等效物的示例性免疫组织学检查(实验1.1)。a:用dapi染色的核;b:针对cd31染色的原代内皮细胞;c:针对nak-atp酶进行染色的ipsc衍生的肠细胞器。d:用dapi染色的核;e:针对cyp3a进行染色的ipsc衍生的肠细胞器;f:针对波形蛋白进行染色的ipsc衍生的成纤维细胞。
图7:显示了在adme-n芯片中进行2周培育的初生肝脏等效物(来自insphero)的示例性免疫组织学检查(实验1.2)。a:用dapi染色的核;b:白蛋白;c:cyp3a4。
图8:显示了在adme-n芯片中进行3周培育的ipsc衍生的肝脏等效物的示例性免疫组织学检查(实验2)。所有细胞衍生自同一供体。a:用dapi染色的核;b:针对波形蛋白进行染色的ipsc衍生的成纤维细胞;c:用细胞角蛋白8/18染色的肝细胞的细胞骨架,d:用dapi染色的核;e:用zo-1染色的紧密连接;f:白蛋白。
图9:显示了在adme-n芯片中进行2周培育的ipsc衍生的神经元等效物的示例性免疫组织学检查(实验1.2)。a:用dapi染色的核;b:用b微管蛋白iii染色的神经元细胞;c:用vwf(von-willebrand-faktor)染色的原代内皮细胞;d:位于包括原代内皮细胞的印刷的水凝胶上的神经元球状体的明场图像。
图10:显示了在培养基储存器1中血液回路中和培养基储存器2中尿液回路中的肠等效物的顶端隔室中ldh浓度的测量(实验2)。肠等效物和肾等效物的屏障功能通过所有三个隔室中不同浓度的ldh显示。
图11:显示了多器官芯片的通道中ipsc衍生的内皮细胞的延伸。在芯片培养第8天时内皮标记物dc31高表达。
图12:显示了本公开的adme-芯片的横截面示意图。a=施用,d=分配,m=代谢,e=排泄。
图13:显示了ipsc衍生的肝细胞的分化和具有ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞(肝脏等效物)的3d球状体形成后的免疫荧光图像。波形蛋白:ipsc衍生的肝细胞与ipsc衍生的成纤维细胞(波形蛋白染色)。cd31:ipsc衍生的肝细胞与ipsc衍生的内皮细胞(cd31染色)。所有细胞衍生于同一ipsc供体。比例尺=100μm。
图14:显示了ipsc衍生的肝脏等效物(ipsc衍生的肝细胞)中选定的肝标记物基因的转录水平。通过qpcr分析的转录水平。培育ipsc衍生的肝脏等效物2天以产生包括ipsc衍生的肝细胞、成纤维细胞和内皮细胞的3d肝脏球状体。归一化数据至持家tbp。
图15:显示了在芯片上的单一培养物中,ipsc衍生的3d肝脏等效物将普萘洛尔(propranolol)代谢为普萘洛尔葡糖苷酸和α-萘氧乳酸的代谢能力。
图16:显示了肠插入物模型发展。所有细胞衍生自同一ipsc供体。a):肠模型设置的示意图;b)和c):静止培育2周后ipsc衍生的肠细胞器和ipsc衍生的成纤维细胞的共培养;d):插入物膜下面,插入物塑料边缘下面可见的ipsc衍生的内皮细胞层;e)和f):具有ipsc衍生的细胞器、成纤维细胞和内皮细胞的肠模型的另外3周静止培育;g):静止培育3周周,塑料插入物边缘下面的ipsc衍生的内皮细胞层。比例尺:500μm。
图17:显示了具有ipsc衍生的肠细胞器、ipsc衍生的成纤维细胞和原代内皮细胞的生物印刷的水凝胶屏障。
图18:显示了由神经球和内皮细胞制造的ipsc衍生的血脑屏障。所有细胞衍生自同一ipsc供体。
图19:显示了ipsc分化为肾细胞器、肝脏球状体、神经球和肠细胞器,在adme-n芯片中转移和共培养的设置和时间表。所有细胞衍生自同一供体。de:确定性内胚层;tw:transwell。
图20:显示了在adme-n芯片中共培育14天的肝脏、肠、肾和神经元模型的免疫染色表征(参见,实验2)。所有细胞衍生自同一ipsc供体。a)–c):肝脏模型:a:白蛋白、zo-1,b:hnf4α、slc10a1,和c:ki67、tunel;d)–f):肠模型;d:cdx2、na+/k+-atp酶,e:细胞角蛋白8/18、波形蛋白,和f:ki67、tunel;g)–i):肾模型:g:细胞角蛋白8/18、波形蛋白,h:水通道蛋白1、na+/k+-atp酶,和i:ki67、tunel;j)–l):神经元模型:j:tubb3、pax6,k:神经上皮干细胞蛋白,和l:ki67、tunel。比例尺=50μm。虚线图解了可渗透插入物膜。
图21:显示了在ipsc衍生的肠、肝脏、肾和脑模型的adme-n芯片中共培养的qpcr结果。所有细胞衍生自同一ipsc供体。将数据归一化至持家ef1(a、c)或tbp(b、d)。对于第0、7和14天,n=3-6;对于ipsc,n=1-3,和对于代表的阳性对照,n=1。nd:没有检测到信号。使用普通单向anova与tukey多重比较检验进行统计分析。在a)至d)的每个中:从左至右的条为“ipsc”、“第0天”、“第7天”、“第14天”、和各自的“阳性对照”。
具体实施方式
本公开建立了微流体装置中不同诱导多能干细胞(ipsc)衍生的器官前体细胞和/或ipsc衍生的器官等效组织的共培养。本公开提供的新型微流体装置实现了具有众多器官等效物的多器官芯片,其特异性地基于衍生自单一供体ipsc的细胞的分化,而该单一供体ipsc又由单一类型的体细胞进行重编程。因此,在本公开中用于分化成器官等同物的ipsc衍生的细胞包括器官前体细胞,和更具体地器官特异性成年细胞的前体细胞。这样的ipsc衍生的细胞包括如ipsc衍生的肝细胞前体细胞。
在各个方面中,本公开涵盖了ipsc衍生的细胞器的使用,包括如ipsc衍生的肝细胞细胞器。在仍其他方面,本公开具体地涵盖了ipsc衍生的神经球的使用。
本公开的实验2(参见,图2,用于实验1.1、1.2和2的实验设置)举例说明了在微流体芯片上不同ipsc衍生的细胞或细胞器的共培养。实施例2中使用的细胞类型反映了描述要求保护的“ipsc多器官芯片”的器官类型:肝细胞(肝脏)、肠细胞(肠)、肾小管细胞(肾脏)、和神经元细胞(脑)。培育芯片组7、14和21天。在端点处,对细胞样品进行免疫组织学检查、qpcr和rna测序。分析上清液中葡萄糖、乳酸酯、ldh(乳酸酯脱氢酶)、白蛋白、尿素、alt(丙氨酸转氨酶)和ast(天冬酰胺转氨酶)含量。在第0、7和14天时取来自给定器官等效物的静态培育的对照。
本公开提供了微流体装置,其包括(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞获得自从单一类型的体细胞获得的ipsc的单一供体。
如本文所描述,前体细胞衍生自ipsc,即,已经由ipsc分化。ipsc又衍生自体细胞,即,已经由体细胞重编程。例如,肝细胞前体细胞衍生自ipsc,即,已经由ipsc分化,其又衍生自如体细胞皮肤细胞,即,已经由体细胞皮肤细胞重编程。
如本文所描述,细胞可以衍生(即,分化)自单一(即,一个且同一个)供体ipsc,其又获得(即,重编程)自单一类型的体细胞。例如,细胞可以衍生(即,分化)自单一(即,一个且同一个)ipsc,其又获得(即,重编程)自如体细胞皮肤细胞、白细胞、肾细胞、脂肪细胞等。
如本文所描述,衍生自ipsc的前体细胞或更具体地器官特异性前体细胞通过定义不再是ipsc,但是仍然可以显示一种或多种ipsc-特异性标记物的表达,如,一种或多种重编程因子,比如oct4、klf4、sox2和任选地c-myc的表达。具体地,如本文所描述的前体细胞是已经由ipsc分化的器官前体细胞。甚至更具体地,如本文所描述的器官特异性前体细胞是已经由ipsc分化的器官特异性前体细胞。因此,如本文所描述的前体细胞可以被认为是预先分化的器官细胞,或者预先分化的未成熟器官细胞。更具体地,如本文所描述的器官特异性前体细胞可以被认为是预先分化的器官特异性细胞,或者预先分化的未成熟器官特异性细胞。
在各种实施方式中,由ipsc分化的前体细胞可以被认为是(ipsc-衍生的)诱导器官特异性前体细胞。
优选地,如本文所描述的前体细胞或更具体地器官特异性前体细胞产生成熟功能器官细胞。例如,如本文所描述的肝细胞前体细胞(即,ipsc衍生的肝细胞前体细胞)优选产生成熟功能肝细胞,但是也产生其他肝的细胞。因此,如本文所描述的前体细胞或更具体地器官特异性前体细胞产生显示或保留器官细胞特异性功能的成熟细胞。例如,如本文所描述的肝细胞前体细胞优选地产生显示或保留肝细胞特异性功能的成熟细胞。在各种实施方式中,如本文所描述的肝细胞前体细胞产生显示或保留除了肝细胞以外的肝的细胞的特异性功能。
因此,如本文所描述,由ipsc衍生的肝细胞前体细胞获得的成熟肝细胞能够重现在人群中观察到的代谢表型,以与原代人肝细胞相同的水平表达药物代谢酶,和/或在体外维持稳定的功能,等等。
在各种实施方式中,鉴于这样的前体细胞产生成熟功能器官细胞,从ipsc分化的前体细胞可以被认为是成熟器官细胞诱导细胞。例如,如本文所描述的ipsc衍生的肝细胞前体细胞可被认为是肝细胞诱导细胞。
在各种其他实施方式中,鉴于其能够发育为成年型细胞器的能力,从ipsc分化的前体细胞可以被认为是细胞器诱导细胞。例如,如本文所描述的ipsc衍生的肝细胞前体细胞可被认为是肝细胞细胞器诱导细胞。
在各种实施方式中,如本文所描述的前体细胞或更具体地器官特异性前体细胞可以表达一种或多种成熟器官细胞特异性标记物或标记蛋白。例如,在本公开的各种实施方式中,肝细胞前体细胞可以表达一种或多种成熟肝细胞特异性标记物或标记蛋白。在各种实施方式中,肝细胞前体细胞可以表达包括cd45和cd109的细胞标记物。在各种实施方式中,肝细胞前体细胞可以表达包括白蛋白、hnf4a、α-1-抗胰蛋白酶(aat)和α-胎蛋白(afp)、优选地白蛋白和/或afp的细胞标记物。
同样地,在各种实施方式中,如本文所描述的成熟器官细胞表达一种或多种成熟器官细胞特异性标记物或标记蛋白。例如,在本公开的各种实施方式中,肝细胞表达一种或多种肝细胞特异性标记蛋白。在各种实施方式中,成熟肝细胞标记物包括白蛋白、pxr、h4抗原、α-1-抗胰蛋白酶(aat)、细胞角蛋白7(ck7)、细胞角蛋白8(ck8)、肝细胞核转录因子(hnf-3)、caat增强子结合蛋白(cebp)-α、caat增强子-结合蛋白(cebp)-β、slc10a1(钠/胆汁酸共转运蛋白-肝胆汁酸转运蛋白)、hnf4a(肝细胞核因子4α)、细胞角蛋白8/18、cyp2a6、cyp2e1、和cyp3a4(细胞色素p450)。优选的成熟肝细胞标记物包括白蛋白、slc10a1、hnf4a、细胞角蛋白8/18、cyp2a6、cyp2e1、和/或cyp3a4。
药物代谢是主要肝细胞功能。末端肝细胞分化可以通过细胞色素p450(cyp)家族中药物代谢酶的表达和活性进行评估。因此,在各种实施方式中,成熟肝细胞标记物包括以下任一种:cyp1a1、cyp1a2、cyp1b1、cyp2a6、cyp2a7、cyp2a13、cyp2b6、cyp2c8、cyp2c9、cyp2c18、cyp2c19、cyp2d6、cyp2e1、cyp2f1、cyp2j2、cyp2r1、cyp2s1、cyp2u1、cyp2w1、cyp3a4、cyp3a5、cyp3a7、cyp3a43、cyp4a11、cyp4a22、cyp4b1、cyp4f2、cyp4f3、cyp4f8、cyp4f11、cyp4f12、cyp4f22、cyp4v2、cyp4x1、cyp4z2、cyp5a1、cyp7a1、cyp7b1、cyp8a1、cyp8b1、cyp11a1、cyp11b1、cyp11b2、cyp17a1、cyp19a1、cyp20a1、cyp21a1、cyp21a2、cyp24a1、cyp26a1、cyp26b1、cyp26c1、cyp27a1、cyp27b1、cyp27c1、cyp39a1、cyp46a1、和/或cyp51a1。在各种实施方式中,成熟肝细胞标记物包括以下任一种:cyp1a2、cyp2c9、cyp3a4、细胞角蛋白8/18、cyp2a6、和/或cyp2e1。优选的成熟肝细胞标记物包括细胞角蛋白8/18、cyp2a6、cyp2e1、和/或cyp3a4。
如本文进一步描述,ipsc衍生的肠前体细胞优选地产生成熟功能肠细胞。因此,ipsc衍生的肠前体细胞优选地产生显示或保留肠细胞特异性功能的成熟肠细胞。在各种实施方式中,如本文所描述的ipsc衍生的肠前体细胞可以表达一种或多种(成熟肠细胞特异性和/或肠前体细胞特异性)标记蛋白。在各种实施方式中,这类成熟肠细胞特异性和/或肠前体细胞特异性标记蛋白包括abcb1、cdh1、chga、dpp4、kl5、lgr5、lyz、slc2a1、slc2a3、sox9、和/或cxcr4。
在各种实施方式中,如本文所描述的成熟肠细胞是小肠的成熟细胞。在各种其他实施方式中,如本文所描述的成熟肠细胞是肠的成熟上皮细胞。在仍其他实施方式中,如本文所描述的成熟肠细胞包括小肠的成熟上皮细胞。
在各种实施方式中,如本文所描述的成熟肠细胞可以表达一种或多种成熟肠细胞特异性标记物或标记蛋白。在各种实施方式中,成熟肠细胞标记物包括cd326、cdx2、细胞角蛋白8/18、和/或nak-atp酶(上皮细胞)。
如本文进一步描述,ipsc衍生的肾小管前体细胞优选地产生成熟功能肾小管细胞,但是也可以产生其他肾细胞。因此,ipsc衍生的肾小管前体细胞优选地产生显示或保留肾小管细胞特异性功能的成熟肾小管细胞。在各种实施方式中,如本文所描述的肾小管前体细胞产生显示或保留除肾小管细胞以外的肾细胞的特异性功能的成熟细胞。在各种实施方式中,如本文所描述的ipsc衍生的肾小管前体细胞可表达一种或多种(成熟的肾小管前体细胞特异性和/或肾小管前体细胞特异性)标记蛋白。在各种实施方式中,这种成熟的肾小管前体特异性和/或肾小管前体细胞特异性标记蛋白包括水通道蛋白1、mrp2、细胞角蛋白8/18,和/或nak-atp酶。
在各种实施方式中,如本文所描述的成熟肾小管细胞是成熟肾小管上皮细胞。在各种其他实施方式中,如本文所描述的成熟肾小管细胞是成熟近端肾小管细胞,优选成熟近端肾小管上皮细胞。在本公开的进一步实施方式中,如本文所描述的成熟肾小管细胞包括成熟上皮肾小管细胞,优选成熟上皮近端肾小管细胞。
在各种实施方式中,如本文所描述的成熟肾小管细胞可以表达一种或多种成熟肾小管细胞特异性标记物或标记蛋白。在各种实施方式中,成熟的肾小管细胞标记物包括巨蛋白(近端肾小管细胞)、水通道蛋白1、mrp2、细胞角蛋白8/18,和/或nak-atp酶。
如本文进一步描述,ipsc衍生的神经元前体细胞优选产生成熟功能神经元细胞,但也可产生脑中其他细胞。因此,ipsc衍生的神经元前体细胞优选产生显示或保留神经元细胞特异性功能的成熟神经元细胞。在各种实施方式中,如本文所描述的ipsc衍生的神经元前体细胞可表达一种或多种(成熟神经元细胞特异性和/或神经元前体细胞特异性)标记蛋白。在各种实施方式中,此类成熟神经元细胞特异性和/或神经元前体细胞特异性标记蛋白包括神经上皮干细胞蛋白(神经外胚层干细胞标记物)、tubb3(微管蛋白β-3链,神经细胞分化的早期生物标记物)、和/或pax6(配对盒蛋白pax-6,转录因子、眼睛和脑发育的关键调控基因)。在各种其他实施方式中,此类成熟神经元细胞特异性和/或神经元前体细胞特异性标记蛋白可以包括gfap、突触泡蛋白,neun和/或map2。
在各种实施方式中,如本文所描述的成熟神经元细胞可表达一种或多种成熟神经元细胞特异性标记物或标记蛋白。在各种实施方式中,成熟神经元细胞标记物包括nse(γ-烯醇化酶或烯醇化酶-2;由成熟神经元和神经元起源的细胞表达的胞质蛋白)。在各种实施方式中,成熟神经元细胞标记物还包括神经上皮干细胞蛋白、tubb3、和/或pax6。在各种其他实施方式中,成熟神经元细胞标记物包括gfap、突触泡蛋白、neun,和/或map2。
已经通过yamanaka和takahashi在2006年的工作建立了对体细胞的重编程。如本文所描述,用于生成ipsc的体细胞可以是可重编程为ipsc的任何类型的体细胞,更多的是任何类型的原代体细胞。在各种实施方式中,成纤维细胞是用于产生ipsc的原代体细胞类型,优选皮肤衍生的成纤维细胞。在各种其他实施方式中,(头发衍生的)角质形成细胞是用于产生ipsc的原代体细胞类型。在各种实施方式中,成纤维细胞包括皮肤细胞、白细胞、肾细胞、脂肪细胞等。
如本文所描述,ipsc的特征在于重编程因子的表达,包括例如,主要重编程因子oct4、klf4、sox2和任选地c-myc。在各种(优选)实施方式中,鉴定为表达的重编程因子包括sox2、nanog、oct3/4、ssea5、和/或tra-1-60。
在本公开中,通过本领域普通技术人员可获得的和已知的任何重编程方法从单一类型的体细胞获得ipsc。menon等,2016(int.j.mol.sci.,vol.17,141)可提供ipsc重编程方法的概述,该方法可用于将体细胞重编程为ipsc。在文献中报道了用于将体细胞重编程为ipsc的试剂盒和方案,并且可商购获得。
在本公开的各种实施方式中,从单一类型的体细胞获得的ipsc可从合同制造商获得。然而,在各种实施方式中,在与本文描述的方法有关的特定实施方式中,本公开包括将(单一类型的)体细胞重编程为ipsc的步骤。
在各种实施方式中,术语“从(单一类型的)体细胞获得的ipsc”是指从体细胞对ipsc进行重编程,而该体细胞又先前可能或可能没有通过ipsc的分化获得。
在各种实施方式中,根据本公开的ipsc获自成年体细胞。
在各种实施方式中,术语“体细胞”和/或“成年体细胞”可以或可以不包括“体干细胞”和/或“成年体干细胞”和/或“成年干细胞”。优选地,术语“体细胞”或“成年体细胞”不包括“体干细胞”和/或“成年体干细胞”和/或“成年干细胞”。
在本公开中,可以使用本领域普通技术人员可获得和已知的用于ipsc分化的手段和方法通过ipsc的分化从ipsc获得ipsc衍生的器官前体细胞。分化试剂盒和方案已在文献中报道并可商购。表1列出了ipsc衍生的细胞的列表。分化方案改编自列出的论文。
表1列出的科学论文中描述的分化方案通过引用具体地并入本文。
在本公开的各种实施方式中,ipsc衍生的器官前体细胞可从合同制造商处获得。然而,在各种实施方式中,在与本文描述的方法有关的特定实施方式中,本公开包括将如本文所描述的ipsc分化成器官(特异性)前体细胞的步骤。如本文其他地方所描述,从ipsc分化的这种器官(特异性)前体细胞可以被认为是预分化的器官(特异性)细胞或预分化的未成熟器官(特异性)细胞。
在各种实施方式中,微流体装置包括:(i)ipsc衍生的肝细胞;(ii)ipsc衍生的肠细胞;(iii)ipsc衍生的肾小管细胞;和(iv)ipsc衍生的神经元细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的细胞获得自从单一类型的体细胞获得的ipsc的单一供体。
在各种实施方式中,微流体装置包括:(i)ipsc衍生的肝细胞细胞器;(ii)ipsc衍生的肠细胞器;和(iii)ipsc衍生的肾小管细胞器;其中根据(i)、(ii)、和(iii)的ipsc衍生的细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。在各种实施方式中,微流体装置进一步包括(iv)另外器官或细胞类型的ipsc衍生的细胞器,其不同于根据(i)、(ii)、和(iii)的细胞器,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。在优选实施方式中,根据(iv)的另外的ipsc衍生的细胞器是ipsc衍生的神经元细胞器,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。
类似于关于ipsc衍生的器官前体细胞的公开,ipsc衍生的细胞器是指通过分化ipsc可获得的或获得的细胞器。如本文其他地方所描述,“细胞器”可被认为是指或代表最小的功能器官或组织单元。因此,通过分化ipsc可获得的或获得的细胞器具体是指单一供体ipsc(其从单一类型的体细胞获得的)的分化,并使用分化的细胞作为细胞器的来源。更具体地,所述分化的细胞发展成包含具有器官特异性性质的细胞的细胞器。在各种实施方式中,所述分化的细胞形成球形细胞器,其发展成包含具有器官特异性(功能)性质的细胞的成年型细胞器。
优选地,所述器官特异性性质是器官特异性功能性质。
在各种实施方式中,微流体装置包括:(i)ipsc衍生的球形细胞器,其发展为成年型肝细胞细胞器;(ii)ipsc衍生的球形细胞器,其发展为成年型肠细胞器;和(iii)ipsc衍生的球形细胞器,其发展为成年型肾小管细胞器,其中根据(i)、(ii)、和(iii)的ipsc衍生的球形细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。在各种实施方式中,微流体装置进一步包括(iv)ipsc衍生的球形细胞器,其发展为与根据(i)、(ii)、和(iii)的成年型细胞器不同的成年型细胞器,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的球形细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。在优选实施方式中,根据(iv)的另外的ipsc衍生的球形细胞器是ipsc衍生的球形细胞器,其发展为成年型神经元细胞器,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的球形细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。
如本文所描述,比如本文公开的器官特异性前体细胞,由ipsc分化并用作以上描述的细胞器的来源的细胞(分化的细胞发展为含有具有器官特异性性质的细胞的细胞器),通过定义不再是ipsc,但是仍然可以显示一种或多种ipsc特异性标记物的表达,如,一种或多种重编程因子(比如oct4、klf4、sox2、和任选地c-myc)的表达。在各种(优选)实施方式中,鉴定表达的重编程因子包括sox2、nanog、oct3/4、ssea5、和/或tra-1-60。具体地,此类分化的细胞可以被认为是已经从ipsc分化的(器官特异性)细胞器前体细胞。因此,从ipsc分化并用作上面描述的细胞器的来源的细胞可以被认为是预分化的细胞,或预分化的未成熟细胞,其发展为含有具有器官特异性性质的细胞的细胞器,或形成发展为含有具有器官特异性(功能)性质细胞的成年型细胞器的球形细胞器。
在各种实施方式中,从ipsc分化并用作上面描述的细胞器的来源的细胞可以被认为是(ipsc衍生的)诱导器官特异性细胞。
在各种实施方式中,鉴于其发展为成年型细胞器或形成发展为成年型细胞器的球形细胞器的能力,从ipsc分化并用作上面描述的细胞器的来源的细胞(分化的细胞发展为含有具有器官特异性性质的细胞的细胞器)可以被认为是(ipsc衍生的)细胞器诱导细胞,或球形细胞器诱导细胞。
如本文所描述,根据本公开的ipsc衍生的细胞器可能够重现在人群中观察到的代谢表型,以与原代人肝细胞相同的水平表达药物代谢酶,和/或在体外维持稳定的功能,等等。
在各种实施方式中,细胞器细胞(即,构成细胞器的细胞)可以表达一种或多种成熟器官细胞特异性标记物或标记蛋白。例如,在本公开的各种实施方式中,(ipsc衍生的)肝细胞细胞器细胞(即,构成肝细胞细胞器的细胞)可以表达一种或多种成熟肝细胞特异性标记蛋白。在各种实施方式中,肝细胞细胞器细胞可以表达细胞标记物,包括cd45和cd109。在各种进一步实施方式中,肝细胞细胞器细胞可以包括细胞标记物,包括白蛋白、hnf4a、α-1-抗胰蛋白酶(aat)、和α-胎蛋白(afp),优选地白蛋白和/或afp。
在仍进一步实施方式中,肝细胞细胞器细胞可以表达细胞标记物,包括白蛋白、pxr、h4抗原、aat、ck7、ck8、hnf-3、cebp-α、cebp-β、slc10a1、hnf4a、细胞角蛋白8/18、cyp2a6、cyp2e1、和/或cyp3a4。优选的标记物包括白蛋白、slc10a1、hnf4a、细胞角蛋白8/18、cyp2a6、cyp2e1、和cyp3a4。
如本文进一步描述,如本文所描述的(ipsc-衍生的)肠细胞器细胞(即,构成肠细胞器的细胞)可以表达一种或多种(成熟肠细胞特异性和/或肠前体细胞特异性)标记蛋白。在各种实施方式中,此类成熟肠细胞特异性和/或肠前体细胞特异性标记蛋白包括abcb1、cdh1、chga、dpp4、kl5、lgr5、lyz、slc2a1、slc2a3、sox0、和/或cxcr4。在各种其他实施方式中,如本文所描述的肠细胞器细胞可以表达成熟肠细胞标记物,包括cd326、cdx2、细胞角蛋白8/18、和/或nak-atp酶。
如本文进一步描述,如本文所描述的(ipsc衍生的)肾小管细胞器细胞(即,构成肾小管细胞器的细胞)可以表达一种或多种(成熟肾小管细胞特异性和/或肾小管前体细胞特异性)标记蛋白。在各种实施方式中,此类成熟肾小管细胞特异性和/或肾小管前体细胞特异性标记蛋白包括水通道蛋白1、mrp2、细胞角蛋白8/18、和/或nak-atp酶。
如本文进一步描述,如本文所描述的(ipsc衍生的)神经元细胞器细胞(即,构成神经元细胞器的细胞)可以表达一种或多种(成熟神经元细胞特异性和/或神经元前体细胞特异性)标记物或标记蛋白。在各种实施方式中,此类成熟神经元细胞特异性和/或神经元前体细胞特异性标记蛋白包括神经上皮干细胞蛋白、tubb3、和/或pax6。在各种其他实施方式中,此类成熟神经元细胞特异性和/或神经元前体细胞特异性标记蛋白可以包括gfap、突触泡蛋白、neun、和/或map2。在各种实施方式中,如本文所描述的神经元细胞器细胞可以表达一种或多种成熟神经元细胞特异性标记蛋白。在各种实施方式中,成熟神经元细胞标记物包括nse。在各种实施方式中,成熟神经元细胞标记物进一步包括神经上皮干细胞蛋白、tubb3、和/或pax6。在各种其他实施方式中,成熟神经元细胞标记物包括gfap、突触泡蛋白、neun、和/或map2。
在本公开中,用作上述的细胞器的来源的ipsc衍生的细胞(发展为含有具有器官特异性性质的细胞的细胞器的分化的细胞)可以使用本领域普通技术人员可获得和已知的用于ipsc分化的手段和方法通过ipsc的分化从ipsc获得。在本公开的各种实施方式中,ipsc衍生的细胞器诱导细胞(或ipsc衍生的细胞器前体细胞)可从合同制造商处获得。然而,在各种实施方式中,在涉及本文描述的方法的具体实施方式中,本公开涵盖将如本文所描述的ipsc分化为此类细胞器诱导细胞或ipsc衍生的细胞器前体细胞(即,用作细胞器的来源的细胞)的步骤。
在本公开的各种实施方式中,细胞器嵌入细胞外基质内,优选地细胞外凝胶基质内,更优选地基底膜样细胞外基质提取物(通常类似组织细胞外环境)内。在各种实施方式中,基底膜样细胞外(凝胶)基质提取物包括胶状蛋白混合物。优选地,胶状蛋白质混合物是由engelbreth-holm-swarm(ehs)小鼠肉瘤细胞分泌。更优选地,基底膜样细胞外(凝胶)基质是
在本公开的各种实施方式中,用作细胞器来源的ipsc衍生的前体细胞、或ipsc衍生的细胞器、或ipsc衍生的细胞在微流体装置中沉积在单独的细胞培养隔室中。
在各种实施方式中,微流体装置可以包括ipsc衍生的细胞和ipsc衍生的细胞器或球状体的混合物。例如,微流体装置可以包括(i)ipsc衍生的肝细胞的球状体;(ii)ipsc衍生的肠细胞器;(iii)ipsc衍生的肾小管细胞或ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元球状体;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的球状体、细胞器和细胞获得自从单一类型的体细胞获得的ipsc的单一供体。优选地,根据(i)、(ii)、(iii)、和(iv)的ipsc衍生的球状体、细胞器和细胞沉积或存在于微流体芯片的单独的细胞培养隔室中。优选地,包括ipsc衍生的肝细胞的球状体的细胞培养隔室进一步包括成纤维细胞,优选地ipsc衍生的成纤维细胞。因此,ipsc衍生的肝脏等效物通过将具有(ipsc衍生的)成纤维细胞的ipsc衍生的肝细胞的球状体放置在各自的细胞培养隔室中实现。
在进一步优选实施方式中,ipsc衍生的肠细胞器嵌入本文其他地方的细胞外基质或水凝胶。在其他优选实施方式中,包含ipsc衍生的肠细胞器的细胞培养隔室另外包括成纤维细胞和内皮细胞,优选地ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞,或ipsc衍生的成纤维细胞和原代微血管内皮细胞。原代微血管内皮细胞或ipsc衍生的内皮细胞优选接种在细胞培养隔室的基底外侧上。
此外,包括ipsc衍生的神经元球状体的细胞培养隔室优选地进一步包括生物印刷的血脑屏障。更具体地,包括ipsc衍生的神经元球状体的细胞培养隔室富含有内皮细胞,优选地ipsc衍生的内皮细胞,其接种在细胞培养隔室的基底外侧上。
在各种实施方式中,包括含有用作细胞器来源的ipsc衍生的前体细胞、或ipsc衍生的细胞器、或ipsc衍生的细胞的微细胞培养隔室的微流体装置包括第一回路和第二回路,其中含有用作细胞器来源的ipsc衍生的前体细胞、或ipsc衍生的细胞器、或ipsc衍生的细胞的细胞培养隔室形成第一回路的部分,和其中第二回路包括过滤单元和重吸收单元,其中两个回路经由过滤单元和重吸收单元彼此连接。优选地,过滤单元包括基于分子的大小和电荷选择性允许分子从第一回路穿过至第二回路。更具体地,过滤屏障是生物屏障,甚至更优选地生物屏障包括足细胞。在进一步优选实施方式中,重吸收单元包括允许从第二回路重吸收流体至第一回路的屏障。更优选地,重吸收屏障是生物屏障,甚至更优选地生物屏障包括肾小管细胞。
在优选实施方式中,微流体装置包括第一回路中的含有肝脏等效物或组织模拟肝脏功能的至少一个细胞培养隔室,和第一回路中的含有肠等效物或组织模拟肠功能的至少一个细胞培养隔室。
在各种实施方式中,第二回路的过滤单元和重吸收单元可以被认为是肾脏或肾等效物。优选地,肾脏或肾等效物意思是肾脏或肾细胞器。如本文所描述,肾脏或肾细胞器优选意思是足细胞和肾小管细胞的细胞器,更优选地ipsc衍生的足细胞和ipsc衍生的肾小管细胞的细胞器。同样地,肝脏细胞器优选意思是肝细胞的细胞器,更优选地ipsc衍生的肝细胞的细胞器。同样地,(小)肠细胞器优选地意思是(小)肠细胞的细胞器,更优选地ipsc衍生的(小)肠细胞的细胞器。同样地,神经元细胞器优选地意思是神经元细胞的细胞器,更优选地ipsc衍生的神经元细胞的细胞器。同样地,呼吸道(优选地肺)细胞器优选地意思是呼吸道的细胞(优选地肺细胞,更优选地肺上皮细胞)的细胞器。优选地,呼吸道的细胞或肺细胞分别是ipsc衍生的呼吸道的细胞或ipsc衍生的肺细胞。
在本公开的各种实施方式中,新型微流体装置具有如此细胞培养隔室的布置,使得包括“肝脏等效物”的细胞培养隔室位于包括“肠等效物”的细胞培养隔室的下游(根据图1中描绘的“血液回路”的布局,然而并不限于此)。优选地,包括“肝脏等效物”和“肠等效物”的细胞培养隔室排布在单独的微通道中,其是主微通道结构的分支(根据图1中描绘的“血液回路”的布局,然而并不限于此)。优选地,在肠等效物和肝脏等效物的细胞培养隔室之间没有其他细胞培养隔室。在各种实施方式中,微流体装置可以包括分支的微流体网路(或微流体通道的分支网络)。在进一步优选实施方式中,新型微流体装置具有如此细胞培养隔室的布置,使得包括“神经元等效物”的细胞培养隔室与包括“肝脏等效物”和“肠等效物”的细胞培养隔室平行布置。更优选地,“神经元等效物”布置在单独的微通道分支中,该单独的微通道分支与包括含有“肝脏等效物”和“肠等效物”的细胞培养隔室的微通道分支平行布置(根据图1中描绘的“血液回路”的布局,然而并不限于此)。
在微流体装置包含单独的培养基储存器或取样储存器的情况中,优选地布置在主微通道结构中,即,不布置在分支微通道结构中(根据图1中描绘的“血液回路”的布局,然而并不限于此)。
此外,在微流体装置含有微型泵的情况中,微型泵优选地布置在主微通道结构中,即,不布置在分支微通道结构中(根据图1中描绘的“血液回路”的布局,然而并不限于此)。
在各种优选实施方式中,第二回路不显示分支微流体网络,而是非分支回路或循环系统。术语“回路”和“循环系统”本文中可以相互交换地使用。
在本公开的各种实施方式中,新型微流体装置包括:(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞获得自从单一类型的体细胞获得的ipsc的单一供体,其具有根据图1所示布局的细胞培养隔室的布置,然而不限于此。对于根据本公开的其中微流体装置包括用作细胞器的来源的ipsc衍生的细胞器、或ipsc衍生的细胞的实施方式也是如此。
在本公开的各种其他实施方式中,新型微流体装置包括:(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞获得自从单一类型的体细胞获得的ipsc的单一供体,其具有根据图1所示布局的细胞培养隔室的布置,然而不限于此。此类实施方式可以或可以不具有一个或多个隔室,其与图1示出的尿液回路的肾小管和/肾小球等效物匹配,从而提供两个回路的交叠。对于根据本公开的其中微流体装置包括用作细胞器的来源的ipsc衍生的细胞器、或ipsc衍生的细胞的实施方式也是如此。
如本文所描述,新型微流体装置的新型微生理系统包括:(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞获得自从单一类型的体细胞获得的ipsc的单一供体,优选地,是闭合的通道系统。对于根据本公开的其中微流体装置包括用作细胞器的来源的ipsc衍生的细胞器、或ipsc衍生的细胞的实施方式也是如此。
因此,新型微流体装置的血液和/或尿液回路形成闭合回路,更具体地微流体通道的闭合回路。更具体地,新型微生理系统可以被认为是自支撑或自包含微生理系统。包括两个肾功能单元(过滤单元和重吸收单元)的闭合的通道系统能够具体地测定测试药物的肾脏毒性。在优选实施方式中,微生理系统或微流体装置以第一回路中血液模拟液体溶液和/或第二回路中尿液模拟液体溶液操作。
新型微流体装置包括:(i)ipsc衍生的肝细胞前体细胞;(ii)ipsc衍生的肠前体细胞;(iii)ipsc衍生的肾小管前体细胞;和(iv)ipsc衍生的神经元前体细胞;其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞获得自从单一类型的体细胞获得的ipsc的单一供体,对于根据(i)、(ii)、(iii)和(iv)的ipsc衍生的前体细胞的每个,可以包括一个或多个细胞培养隔室。
同样,新型微流体装置包括:(i)ipsc衍生的肝细胞细胞器;(ii)ipsc衍生的肠细胞器;和(iii)ipsc衍生的肾小管细胞器,其中根据(i)、(ii)、和(iii)的ipsc衍生的前体细胞获得自从单一类型的体细胞获得的ipsc的单一供体,对于根据(i)、(ii)、和(iii)的ipsc衍生的前体细胞的每个,可以包括一个或多个细胞培养隔室。在各种实施方式中,微流体装置进一步包括(iv)另外的器官或细胞类型的ipsc衍生的细胞器,其与根据(i)、(ii)、和(iii)的细胞器不同,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。在优选实施方式中,根据(iv)的另外ipsc衍生的细胞器是ipsc衍生的神经元细胞器,其中根据(i)、(ii)、(iii)和(iv)的ipsc衍生的细胞器获得自从单一类型的体细胞获得的ipsc的单一供体。
在优选实施方式中,新型微流体装置仅一次包括每个器官等效物,遵循原则一个个体器官等效物/微流体装置(或/微生理系统)。换句话说,例如,如果新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏等脏等效物,这意思是可能至少两个细胞培养隔室每个包括肝脏等效物。
在各种实施方式中,每个细胞培养隔室(或单一细胞培养隔室)包括仅一个器官等效物,遵循原则一个个体器官等效物/细胞培养隔室。
此外,在各种实施方式中,细胞培养隔室可以包括一个或多个器官等效物,如,神经元等效物单独或与肠等效物组合。在各种其他实施方式中,每个细胞培养隔室(或单一细胞培养隔室)包括仅一个器官等效物,即,涉及一个单一器官的等效物,遵循原则一个个体器官等效物/细胞培养隔室。
本公开提供了产生肝细胞细胞器、肠细胞器和肾小管细胞器的方法,方法包括在(经由微流体通道)彼此微流体连接的单独的细胞培养隔室中,共培养(i)ipsc衍生的肝细胞前体细胞,(ii)ipsc衍生的肠前体细胞,和(iii)ipsc衍生的肾前体细胞。
本公开还提供了产生成年型肝细胞细胞器、成年型肠细胞器、和成年型肾小管细胞器的方法,方法包括在(经由微流体通道)彼此微流体连接的单独的细胞培养隔室中共培养(i)ipsc衍生的球形细胞器,其发展为成年型肝细胞细胞器,(ii)ipsc衍生的球形细胞器,其发展为成年型肠细胞器,和(iii)ipsc衍生的球形细胞器,其发展为成年型肾细胞器。
在各种实施方式中,方法使用包括(经由微流体通道)彼此微流体连接的单独的细胞培养隔室的微流体装置进行。
在各种实施方式中,方法优选地还包括共培养ipsc衍生的内皮细胞,其中ipsc衍生的内皮细胞获得自与根据(i)、(ii)、和(iii)的ipsc衍生的前体细胞相同的ipsc的单一供体,和其中ipsc衍生的内皮细胞沉积在连接细胞培养隔室的微流体通道中。
优选地,包含ipsc衍生的肝细胞前体细胞的细胞培养隔室进一步包括ipsc衍生的成纤维细胞,其获得自与ipsc衍生的肝细胞前体细胞相同的ipsc的单一供体。
本公开提供的新型微流体装置可以使用ipsc衍生的器官特异性前体细胞、或ipsc衍生的器官特异性细胞器提供具有体外微生理系统的细胞器或组织工程化。本公开进一步提供通过在水凝胶中印刷(生物印刷)和/或其上接种ipsc衍生的细胞器产生的模拟器官屏障的新型生物工程化的组织构建体。具体地,本公开具体地提供了包括ipsc衍生的细胞器、ipsc衍生的成纤维细胞、和ipsc衍生的内皮细胞的模拟哺乳动物器官屏障的生物工程化结缔组织构建体,和包括ipsc衍生的神经球和ipsc衍生的内皮细胞的模拟血脑屏障的生物工程化结缔组织构建体。
本公开的实验1.1和实验1.2的ipsc芯片举例说明了模拟肠屏障的生物工程化组织构建体。具体地,所述两个实验的ipsc芯片的肠等效物含有ipsc衍生的肠细胞的细胞器,其嵌入也含有ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞的matrigel水凝胶。在ipsc衍生的肠等效物模型上,原代微血管内皮细胞或ipsc衍生的内皮细胞接种在细胞培养插入物的基底外侧。
此外,实验1.2的ipsc芯片含有具有血脑屏障的神经元等效物,其中含有ipsc衍生的神经元球状体的细胞培养插入物富含在神经元球状体下印刷(生物印刷)的ipsc衍生的内皮细胞。在具有实验2的ipsc芯片的血脑屏障的神经元等效物中,含有ipsc衍生的神经元球状体的细胞培养插入物富含在细胞培养插入物的基底外侧上接种的ipsc衍生的内皮细胞。
具体地,本公开提供了模拟哺乳动物器官屏障的结缔组织,包括:(i)ipsc衍生的细胞器;(ii)ipsc衍生的成纤维细胞;和(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的细胞器和细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。在各种实施方式中,结缔组织构建体是生物工程化结缔组织构建体。此外,哺乳动物器官屏障可以是皮肤屏障、肠屏障、呼吸道屏障(优选地肺屏障)、眼屏障、口腔粘膜组织屏障、和生殖器粘膜组织屏障的任一种,不限于此。因此,ipsc衍生的细胞器可以是呼吸道(优选地肺)的ipsc衍生的皮肤细胞器、ipsc衍生的肠细胞器、ipsc衍生的细胞器,ipsc衍生的眼睛细胞器,ipsc衍生的口腔粘膜组织细胞器,和ipsc衍生的生殖器粘膜组织细胞器的任一种。
在各种优选实施方式中,模拟哺乳动物器官屏障意思是模拟哺乳动物器官屏障功能。
在各种实施方式中,模拟哺乳动物器官屏障的结缔组织构建体可以被认为是屏障器官等效物。
在各种实施方式中,结缔组织构建体模拟哺乳动物肠屏障。因此,本文提供了模拟哺乳动物肠屏障的结缔组织构建体,其包括:(i)ipsc衍生的肠细胞器;(ii)ipsc衍生的成纤维细胞,优选地ipsc衍生的肠成纤维细胞;和(iii)ipsc衍生的内皮细胞,优选地ipsc衍生的肠内皮细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的肠细胞器和细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。
同样地,如本所描述,模拟另一哺乳动物器官屏障的结缔组织构建体优选地包括ipsc衍生的器官特异性细胞器;(ii)ipsc衍生的成纤维细胞,更优选地ipsc衍生的器官特异性成纤维细胞;和(iii)ipsc衍生的内皮细胞,更优选地ipsc衍生的器官特异性内皮细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的器官特异性细胞器和(ipsc衍生的)成纤维细胞和内皮细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。
在各种实施方式中,模拟哺乳动物器官屏障的(生物工程化)结缔组织构建体包括在水凝胶中印刷(生物印刷)或在其上接种的(i)ipsc衍生的细胞器;(ii)ipsc衍生的成纤维细胞;和(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的细胞器和细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。
在各种实施方式中,水凝胶是细胞外基质,优选地细胞外凝胶基质,更优选地基底膜样细胞外基质提取物(通常类似组织细胞外环境)。在各种实施方式中,基底膜样细胞外(凝胶)基质提取物包括胶状蛋白混合物。优选地,胶状蛋白质混合物是由engelbreth-holm-swarm(ehs)小鼠肉瘤细胞分泌的胶状蛋白质混合物。更优选地,基底膜样细胞外(凝胶)基质是
本公开进一步提供了生物工程化或产生模拟哺乳动物器官屏障的结缔组织构建体的方法,方法包括在水凝胶中印刷(生物印刷)和/或在其上接种以下:(i)ipsc衍生的细胞器,(ii)ipsc衍生的成纤维细胞,和(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的细胞器和细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。水凝胶可以是如上所描述的任意水凝胶。
本公开提供了通过如本文所描述的生物工程化或产生模拟哺乳动物器官屏障的结缔组织构建体的方法可获得的或获得的模拟哺乳动物器官屏障的结缔组织构建体。
本公开提供了本文描述的模拟哺乳动物器官屏障的结缔组织构建体,其用于组织修复、组织工程化、和/或组织制造中任一个。
本公开进一步提供了模拟哺乳动物血脑屏障的组织构建体,其包括:(i)ipsc衍生的神经球或ipsc衍生的神经元细胞器;和(ii)ipsc衍生的内皮细胞,其中根据(i)和(ii)的ipsc衍生的神经球或ipsc衍生的神经元细胞器和ipsc衍生的内皮细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。在各种实施方式中,模拟哺乳动物血脑屏障的组织构建体可以被认为是生物工程化的模拟哺乳动物血脑屏障的组织构建体。在各种进一步实施方式中,模拟哺乳动物血脑屏障的组织构建体进一步包括(iii)ipsc衍生的成纤维细胞;其中根据(i)、(ii)和(iii)的ipsc衍生的神经球或ipsc衍生的神经元细胞器、ipsc衍生的内皮细胞和ipsc衍生的成纤维细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。
本公开还提供了生物工程化或产生模拟哺乳动物血脑屏障的组织构建体的方法,该方法包括在水凝胶中印刷(生物印刷)和/或在其上接种以下:(i)ipsc衍生的神经球或ipsc衍生的神经元细胞器;(ii)ipsc衍生的内皮细胞;和(iii)ipsc衍生的成纤维细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的神经球或ipsc衍生的神经元细胞器、ipsc衍生的内皮细胞、和ipsc衍生的成纤维细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。水凝胶可以是结合模拟哺乳动物器官屏障的组织构建体如上所描述的任意水凝胶。
在各种优选实施方式中,模拟哺乳动物血脑屏障意思是模拟哺乳动物血脑屏障功能。
在各种实施方式中,模拟哺乳动物血脑屏障的结缔组织构建体可以被认为是屏障器官等效物。
本公开提供了通过如本文所描述的生物工程化或产生模拟哺乳动物血脑屏障的组织构建体的方法可获得的或获得的模拟哺乳动物血脑屏障的组织构建体。
本公开提供了微流体系统,其包括本文描述的模拟哺乳动物器官屏障或哺乳动物血脑屏障的结缔组织构建体。
本公开进一步提供了生物工程化或产生成年器官构建体的方法,其包括在单一细胞培养隔室中共培养:(i)ipsc衍生的器官前体细胞,(ii)ipsc衍生的成纤维细胞,和(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)、和(iii)的ipsc衍生的器官前体细胞和ipsc衍生的成纤维细胞和内皮细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。
在各种实施方式中,方法是生物工程化或产生成年肝脏器官构建体的方法,其包括在单一细胞培养隔室中共培养(i)ipsc衍生的肝细胞前体细胞,(ii)ipsc衍生的成纤维细胞,和/或(iii)ipsc衍生的内皮细胞,其中根据(i)、(ii)、和/或(iii)的ipsc衍生的肝细胞前体细胞和ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞获得自从单一类型的哺乳动物体细胞获得的ipsc的单一供体。在各种优选实施方式中,ipsc衍生的成纤维细胞是ipsc衍生的肝的成纤维细胞。在各种其他优选实施方式中,ipsc衍生的内皮细胞是ipsc衍生的肝的内皮细胞。
在各种实施方式中,生物工程化或产生成年器官构建体的方法可以使用包括细胞培养隔室的微流体装置共培养(i)ipsc衍生的器官前体细胞,(ii)ipsc衍生的成纤维细胞,和(iii)ipsc衍生的内皮细胞进行。
在各种实施方式中,成年器官构建体可以被认为是模拟成年器官功能的成年器官等效物。
如本文所描述,成年器官构建体可以特征在于指示成年器官或模拟成年器官功能的成年器官等效物的标记物或标记蛋白的表达。在各种实施方式中,成年器官或模拟成年器官功能的成年器官等效物可以被认为是成熟器官或模拟成年器官功能的成熟器官等效物。指示成熟器官或模拟成年器官功能的成熟器官等效物并由其表达的标记蛋白在本文其他地方进行描述。
本公开提供了通过如本文所描述的生物工程化或产生成年器官构建体的方法可获得的或获得的成年器官构建体。本公开具体地提供了如本文所描述的生物工程化或产生成年肝脏(器官)构建体的方法可获得的或获得的成年肝脏(器官)构建体。
本公开进一步提供了生物工程化成年内皮细胞的新型方法,其包括将ipsc衍生的内皮前体细胞暴露至剪切应力。方法优选包括在微流体系统的微流体通道中培养ipsc衍生的内皮前体细胞。本公开的图11证明了剪切应力促进多器官芯片的通道中ipsc衍生的内皮细胞的延伸。
本公开提供了生物工程化或产生成年内皮细胞的方法,其包括将ipsc衍生的内皮前体细胞暴露至剪切应力。在各种实施方式中,方法包括在微流体系统的微流体通道中培养ipsc衍生的内皮前体细胞。
本公开提供了通过如本文所描述的生物工程化或产生成年内皮细胞的方法可获得的或获得的成年内皮细胞。
本公开进一步提供了在微流体芯片中实施血液回路和尿液回路,以及建立支持微生理条件的微生理系统,从而保持在模拟模仿器官功能的多种模型的交互和串扰的系统中的稳定的微环境。本公开提供了适合在adme(t)序型的背景下进行药代动力学-药物动力学分析的测定建立的新型微流体装置。本公开的图1显示了示例性adme-n(adme+神经元等效物)芯片覆盖区(上图)和在单独的层上的等长视图(下图)。该等长视图举例说明了两个回路(血液回路和尿液回路)之间膜的定位。图12显示了本公开的adme芯片的部分横截面示意图。
已经显示了实施如本文所描述的血液回路和尿液回路的新型微流体装置建立和保持微生理系统的体内稳态稳定性,如通过图3和10中描绘的葡萄糖和ldh测量所证明。
可以利用聚碳酸酯膜和肾细胞的紧密层的组合实现肾小球和小管隔室(过滤单元和重吸收单元)(图4)。前者实施技术屏障以过滤较大分子量介质成分并减缓其扩散。后者重吸收物质并引起跨越“血液”和“尿液”回路的浓度梯度的积累。该梯度不仅对于ldh可见,而且对于天冬酰胺转氨酶也可见(ast,图5)。它们两者明显不同的浓度都证明了由本公开提供的新型微流体adme芯片的肾膜功能。ast起源自肝脏等效物,因为其是肝细胞中发现的细胞内酶。
对所有器官等效物在免疫组织化学上进行评估以确定同一性、功能和生存力(viability)(图6-9)。
代谢分析揭示了所有器官等效物之间可重现的体内稳态的建立。本公开能够证明体内观察到的细胞极化、重组织、屏障功能和运输。在组合具有一个或多个细胞培养隔室的第一回路和包括过滤和重吸收单元的第二回路(与肾单元中的第一回路重叠)的新型微流体装置中实现稳定微环境开启重复剂量测试(如在药物研发中)的可能性。
本公开提供了包括具有一个或多个细胞培养隔室的第一回路和包括过滤和重吸收单元的第二回路的新型微流体装置,其中两个回路经由过滤单元和重吸收单元彼此连接。图1显示了包括两个回路(称为为“血液回路”和“尿液回路”)的新型微流体装置的示例性布局,两个回路包含用于掺入以下器官等效物的腔室:肠、肝脏、肾脏(分成肾小球和小管)、和神经元组织。前面三个组织被用于实现所谓的adme序型(profile)(吸收、分配、代谢、排泄)。后者是补充该序型的另外的组织。因此,芯片称为adme-n芯片(adme+神经元等效物/组织)。在每个回路中一个储存器隔室允许上清液的采样(“培养基储存器1和2”)。培养基由两个内置的气动微型泵通过微流体网络灌注,每个回路一个。回路在两个肾单元隔室中重叠,并由聚碳酸酯制成的多孔膜隔开。
与单器官系统/芯片相比,鉴于微流体装置包括两个回路,并且因此包括至少两个细胞培养隔室,其中一个位于第一回路中,并且另一个位于模拟肾功能的第二回路的一个单元中,特别是重吸收单元,本公开的微生理系统/微流体芯片可以被认为是多器官系统/芯片。
在各种实施方式中,新型微流体装置可以被认为包括具有一个或多个细胞培养隔室的第一回路,和包括过滤单元和重吸收单元的第二回路,其中两个回路在过滤单元和重新收单元中重叠。在各种优选实施方式中,两个回路的重叠部分(或连接彼此两个回路的部分)由多孔膜分隔。这些重叠/连接部分具体地意思是过滤单元和重吸收单元。
在各种实施方式中,分隔两个回路的重叠/连接部分的所述多孔膜是合成的或生物多孔膜。在各种实施方式中,所述多孔膜可以由胶原、纤维蛋白、或细胞外基质(包括去细胞化器官基质)的任一种制成,而不限于此。在各种实施方式中,多孔膜展示与
过滤单元和重吸收单元是单独的细胞培养隔室,用于并入肾脏细胞,特别是肾小球等效物(过滤单元)和肾小管等效物(重吸收单元)。
如本文所描述,术语“细胞培养隔室”和“细胞培养室”或“细胞培养腔室”本文中可互换地使用。根据本公开的细胞培养隔室是特别适合培养在本公开的背景下使用和描述的细胞和组织的隔室、室或腔室。在各种实施方式中,细胞培养隔室包括6-、12-、24-、48-、96-、和384-孔格式的任一种的孔板隔室,特别是(微)孔细胞培养板(或多孔)。多孔可以由多种材料制成,同时最常见的材料是聚苯乙烯和聚丙烯,其可以用于本公开的各种实施方式中。在各种其他实施方式中,细胞培养隔室是
如本文所描述,多孔膜具体地意思是具有可以不仅用于过滤、计量、和/或分离化学和/或生物分子而且作为细胞或组织培养和生长的多孔结构的膜,并且不限于此。在本公开的背景中使用的细胞培养隔室的多孔膜具体地用于建立细胞培养隔室包括的器官等效物和微流体网络之间的流体连接。因此,在各种实施方式中,如本文所描述的细胞培养隔室的多孔膜布置成使得在多孔膜的表面上定位的器官等效物(细胞/组织)与微流体装置的微流体通道流体连接。在各种实施方式中,多孔膜可以在膜的两侧上接种细胞。优选地,内皮细胞接种在多孔膜的底部侧面。
一般地,通过制造过程,可以调控孔大小从数纳米至微米,由此能够实现过滤、计量和分离靶向的化学和生物分子,以及细胞培养隔室中器官等效物和微流体通道网络之间的流体流。在各种实施方式中,多孔膜是如上所描述的多孔膜。因此,多孔膜可以是合成或生物多孔膜。在各种实施方式中,所述多孔膜可以由胶原、纤维蛋白或细胞外基质(包括去细胞化器官基质)的任一种制成,而不限于此。在各种实施方式中,多孔膜展示与
如本文所描述,术语“第一回路”具体地意思是模拟哺乳动物血液循环系统,更具体地模拟人血液循环系统的循环系统。如本文进一步描述,术语“第一回路”和“血液回路等效物”或“生物模拟血液回路”本文中可以互换地使用。同样地,如本文所描述,术语“第二回路”具体地意思是模拟哺乳动物泌尿系统,更具体地模拟人泌尿系统的循环系统。如本文进一步描述,术语“第二回路”和“尿液回路等效物”或“生物模拟尿液回路”本文中可以互换地使用。
肾过滤包括被动和主动过滤,其中肾小球起到被动过滤屏障作用,阻止大分子量血清蛋白进入肾单位(nephron)。因此,这类大分子量血清蛋白在血液流中继续循环。如本文所描述,本文描述的新型微流体装置的过滤单元包括基于分子的大小和电荷选择性允许分子从第一回路(“血液回路”)穿过至第二回路(“尿液回路”)的过滤屏障,从而模拟选择性肾小球过滤屏障。
在本公开的各种实施方式中,过滤单元包括的过滤屏障由分开过滤单元(和重吸收单元)与血液回路(分开两个回路的重叠部分)的多孔膜建立。因此,根据此类实施方式,过滤屏障可以被认为是(多孔)机械过滤屏障。具体地,(多孔)机械过滤屏障模拟肾小球过滤屏障。因此,在各种实施方式中,过滤屏障甚至可以由具有多孔膜的细胞培养隔室建立。在优选实施方式中,机械过滤屏障具有大约8nm的孔径,但是可以具有小于8nm的孔径。根据其他优选实施方式,机械过滤屏障具有如此孔径,其上限设置为约69kda,以允许血清蛋白进入第二(尿液)回路。在各种实施方式中,机械过滤屏障具有如此孔径,其限度为允许白蛋白,优选地血清白蛋白(或血液白蛋白)进入第二(尿液)回路。
在本公开的各种其他实施方式中,过滤单元包括的过滤屏障是生物过滤屏障。优选地,生物过滤屏障是具有过滤狭缝的屏障,其上限设置为约69kda,以允许血清蛋白进入第二(尿液)回路。在各种实施方式中,生物过滤屏障包括足细胞(也称为内脏上皮细胞)。更具体地,生物过滤屏障是足细胞(过滤)屏障,阻止血浆蛋白进入第二(尿液)回路。足细胞过滤屏障优选具有过滤狭缝,其上限设置为约69kda,允许血清蛋白进入第二(尿液)回路。在各种实施方式中,生物或足细胞过滤屏障的孔径极限设置为允许白蛋白,优选地血清白蛋白(或血液白蛋白)进入第二(尿液)回路。
在肾生理学中,重吸收(或肾小管重吸收)是肾单位从肾小管液(前尿液(pre-urine))中除去水和溶质并将其返回循环血液的过程。肾小球滤液变得更浓缩,这是形成尿液的步骤之一。重吸收使许多有用的溶质(主要是葡萄糖和氨基酸)、盐和水返回血液循环。如本文所描述的,本文公开的新型微流体装置的重吸收单元包括屏障,该屏障允许流体从第二回路(尿液回路)到第一回路(血液回路)的重吸收。在本公开的各种实施方式中,重吸收单元包括的重吸收屏障可以是模拟该重吸收屏障的(多孔)机械屏障。优选地,重吸收屏障是生物屏障,更优选地,生物重吸收屏障包括肾小管细胞(或肾小管的细胞)。更具体地,生物重吸收屏障是肾小管的细胞(重吸收)屏障,其将水、盐和溶质(后者包括蛋白质)返回到第一回路(血液回路)中。如本文所述,重吸收可被视为肾小球滤液从重吸收屏障(特别是从肾小管细胞)到第一回路(血液回路)的流动,从而允许某些物质(尤其是水、盐和溶质)选择性回到第一回路(血液回路)。在各种实施方式中,肾小管细胞可视为肾近端小管细胞。
本文公开的新型微流体装置的第二回路可以包括隔室,该隔室不用作细胞培养隔室,而是用作(培养基)储存器隔室。优选地,这样的(培养基)储存室隔室可以专门用作“采样储存器”或“采样室/隔室”,用于从第二个回路中采集样品,和/或专门用作“样品储存室”或“样品室/隔室”,用于将测试样品添加到微流体系统的第二回路中。因此,在优选实施方式中,第二回路除了构成过滤单元和重吸收单元的两个隔室/单元之外,不包括细胞培养隔室,而包括单独的(进一步的)储存器隔室,用于从第二个回路中采集样品(采样隔室)和/或用作“样品储存室”或“样品室/隔室”,用于将测试样品添加到微流体系统的第二回路中。
储存器隔室可用于向系统中添加营养液,这就是为什么它也被称为培养基储存器隔室的原因。因此,储存器隔室可以起到三种功能:取样、进料和添加测试样品,但是,不能用作携带器官等效物的细胞培养隔室。
本文公开的新型微流体装置的第一回路同样可以包括隔室,该隔室不用作细胞培养隔室,而用作(培养基)储存器隔室。优选地,这样的(培养基)储存器隔室可以专门用来从第一回路中取样。而且,这种储存器隔室可以用于向系统中添加营养液,这就是为什么它可以被称为培养基储存器隔室的原因。因此,第一回路的储存器隔室可以起到采样和进料这两种功能,但是,不能用作携带器官等效物的细胞培养隔室。因此,在优选实施方式中,第一回路除了一个或多个细胞培养隔室之外还可以包括储存器隔室,其用于从第一回路采集样品(采样隔室)和/或向系统添加培养基(营养液)。
在本公开的优选实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包括模拟肝脏功能的组织(“肝脏等效物”)。
在本公开的其他优选实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏等效物,并且第一回路的至少一个细胞培养隔室包括肠等效物。这样的实施方式对于完成adme序型分析特别有用,因为这样微流体芯片包括肠和肝脏(第一回路)和肾脏(第二回路)的器官等效物。如本文所述,肠、肝和肾的器官等效物可被视为“adme”器官等效物。在各种实施方式中,新型微流体装置可包括一种或多种另外的“非adme”器官等效物,其不同于肠、肝脏和肾脏的“adme”器官等效物。在各种实施方式中,这种另外的“非adme”器官等效物包括但不限于神经元等效物、皮肤等效物或呼吸道等效物(优选地肺等效物)。
在本公开的仍其他优选实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏等效物,和第一回路的至少一个细胞培养隔室包括肠等效物,和第一回路的至少一个细胞培养隔室包含神经元等效物,从而建立adme-n芯片。
在本公开的其他优选实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏等效物,和第一回路的至少一个细胞培养隔室包括皮肤等效物。这样的实施方式对于完成adme序型分析也是有用的,因为这样微流体芯片包括皮肤和肝脏(第一回路)和肾脏(第二回路)的器官等效物。然后通过皮肤等效物进行测试样品(测试药物)的施用。这样的实施方式对于测试化妆品和/或消费产品(包括乳霜)特别有用。
在本公开的其他优选实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏等效物,和第一回路的至少一个细胞培养隔室包括呼吸道等效物,具体地肺等效物。这样的实施方式对于完成adme序型分析也是有用的,因为这样微流体芯片包括呼吸道/肺和肝脏(第一回路)和肾脏(第二回路)的器官等效物。然后通过呼吸道/肺等效物进行测试样品(测试药物)的施用。这样的实施方式对于测试旨在经由呼吸道/肺施加的物质(包括药物)特别有用。
在本公开的各种其他实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包含肝脏等效物,和第一回路的至少一个细胞培养隔室包含肠等效物,和第一回路的至少一个细胞培养隔室包括皮肤等效物。
在本公开的各种进一步实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包含肝脏等效物,和第一回路的至少一个细胞培养隔室包含肠等效物,和第一回路的至少一个细胞培养隔室包括呼吸道(优选地肺)等效物。
在本公开的仍其他实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包含肝脏等效物,和第一回路的至少一个细胞培养隔室包含肠等效物,和第一回路的至少一个细胞培养隔室包括皮肤等效物,和第一回路的至少一个细胞培养隔室包括呼吸道(优选地肺)等效物。
在本公开的仍进一步实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包含肝脏等效物,和第一回路的至少一个细胞培养隔室包含肠等效物,和第一回路的至少一个细胞培养隔室包括皮肤等效物,和第一回路的至少一个细胞培养隔室包括呼吸道(优选地肺)等效物,和第一回路的至少一个细胞培养隔室包括神经元等效物。
在本公开的各种实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包含肝脏等效物,和第一回路的至少一个细胞培养隔室包含肠等效物,第一回路的至少一个细胞培养隔室包括神经元等效物,和第一回路的至少一个细胞培养隔室包括皮肤等效物。
在本公开的各种实施方式中,新型微流体装置的第一回路的至少一个细胞培养隔室包含肝脏等效物,和第一回路的至少一个细胞培养隔室包含肠等效物,第一回路的至少一个细胞培养隔室包括神经元等效物,和第一回路的至少一个细胞培养隔室包括呼吸道(优选地肺)等效物。
优选的器官等效物包括肾脏等效物、肝脏等效物、肠等效物(优选地小肠等效物)、神经元(脑)等效物、呼吸道/肺等效物、和皮肤等效物。在肾脏(或肾)等效物的情况下,等效物具体地意思是肾小球和肾小管的等效物。更具体地,肾小球和肾小管的这类等效物布置在本文提供的新型微流体装置的第二回路的单独的单元(分别为过滤单元和重吸收单元)中。
如本文所描述,。“细胞培养隔室”包括或含有器官等效物,其涵盖模拟器官功能的细胞和组织。因此,在各种实施方式中,术语“器官等效物”和模拟器官功能的“细胞/组织”本文中可以互换地使用。
在各种实施方式中,器官等效物或模拟器官功能的组织是初生肝脏组织或初生肠组织。优选地,初生器官组织包括各自器官的上皮细胞,即,如,胃肠道、皮肤或呼吸道的上皮细胞。
在各种实施方式中,模拟器官功能的组织可以是包括各自器官的上皮细胞(即胃肠道、皮肤或呼吸道的上皮细胞)的组织。在各种其他实施方式中,模拟器官功能的组织可以是包括细胞系的细胞,包括从市售细胞系可获得的细胞。
在各种其他实施方式中,模拟器官功能的组织是包括衍生自多能干细胞(ipsc)的细胞的组织。具体地,细胞可以衍生(即,分化)自单一(即,一个且同一个)供体ipsc,其又已经从单一类型的体细胞获得(即,重编程)。例如,细胞可以衍生(即,分化)自单一(即,一个且同一个)ipsc,其又已经从如体细胞皮肤细胞、白细胞、肾细胞、脂肪细胞等获得(即,重编程)。
如本文其他地方所描述,模拟器官功能的细胞或组织包括细胞器和球状体。因此,在各种实施方式中,器官等效物具体地意思是模拟器官功能的细胞器或球状体,如肠细胞或肝细胞的细胞器,或肠细胞或肝细胞的球状体。
本公开提供的微流体装置的细胞、组织和/或器官可以在二维(2d)、三维(3d)或器官型复杂性下建模。2d意思是单层细胞培养物的悬浮液,而3d例如包括不同几何结构的多层培养物,包括如细胞器和球状体。器官型通过捕捉体内器官构造的进一步特征而不同于3d。
在各种实施方式中,包括器官等效物的细胞培养隔室是包括细胞器的细胞培养隔室。如本文所描述。术语“细胞器”可以被认为是意思是或代表最小功能器官或组织单元。marx等人针对15种主要人体器官发表了一系列细胞器组织学选择,其全部具有相关功能和高度可变的密集几何形状(marxetal.2012,alternlabanim40,235-257)。其公开内容通过引用明确并入本文。如本文进一步描述,根据本公开的细胞器具体地意思是ipsc衍生的细胞的细胞器,然而不限于此。如本文进一步描述,细胞器可以被认为是细胞/组织培养物,其模拟器官功能。如本文进一步描述,细胞器可以通常特征在于任意以下特性,而不限于此:(i)(至少)三维多细胞构建体或结构;(ii)器官特异性细胞类型的集合;(iii)如果从干细胞(优选地ipsc)产生,其通常概括发育器官发生程序;(iv)自组织(细胞自组装或/和自组织为组织的能力)。
在各种实施方式中,包括器官等效物的细胞培养隔室是包括模拟器官功能的球状体的细胞培养隔室。如本文所描述,根据本公开的球状体具体地意思是ipsc衍生的细胞的球状体,然而不限于此。如本文进一步描述,球状体可以被认为是非常近似体内器官组织的细胞的(球形簇的)聚集体或自组装。球状体具有三维结构构造,比如细胞器。与细胞器相比较,认为与球状体培养物相反,在细胞器中存在更高级的自组装。在各种实施方式中,细胞器可以认为是模拟器官功能的细胞/组织培养物。
优选的细胞器包括肾脏细胞器、肝脏细胞器、肠细胞器(优选地小肠细胞器)、神经元(脑)细胞器、呼吸道/肺细胞器、和皮肤细胞器。在肾脏(或肾)细胞器的情况下,细胞器具体地意思是肾小球和肾小管的细胞器。更具体地,肾小球和肾小管的这类细胞器布置在本文提供的新型微流体装置的第二回路的单独的单元(分别为过滤单元和重吸收单元)中。
在本公开的各种方面中,新型微流体装置的第一回路的至少一个细胞培养隔室包括ipsc衍生的肝脏等效物,和第一回路的至少一个细胞培养隔室包括ipsc衍生的肠等效物,和第一回路的至少一个细胞培养隔室包括ipsc衍生的神经元等效物,和新型微流体装置的第二回路包括肾近端小管上皮细胞(rptec),更具体地,接种在重吸收单元中的rptec。优选地,包括ipsc衍生的肠等效物的至少一个细胞培养隔室包括ipsc衍生的肠细胞的细胞器。更优选地,ipsc衍生的肠细胞的细胞器嵌入至细胞外基质中,优选地细胞外凝胶基质中,更优选地基底膜样细胞外(凝胶)基质提取物中(通常类似组织细胞外环境)。在各种实施方式中,基底膜样细胞外(凝胶)基质提取物包括胶状蛋白混合物。优选地,基底膜样细胞外基质是
在进一步优选实施方式中,包括ipsc衍生的肠等效物(具体地ipsc衍生的肠细胞的细胞器)的至少一个细胞培养隔室此外包括ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞,或ipsc衍生的成纤维细胞和原代微血管内皮细胞。原代微血管内皮细胞或ipsc衍生的内皮细胞优选地接种在细胞培养隔室的基底外侧。
此外,包括ipsc衍生的神经元等效物的至少一个细胞培养隔室优选地包括ipsc衍生的神经元球状体。更优选地,包括ipsc衍生的神经元等效物(具体地ipsc衍生的神经元球状体)的至少一个细胞培养隔室包括印刷的(生物印刷的)血脑屏障。更具体地,包括ipsc衍生的神经元等效物(具体地ipsc衍生的神经元球状体)的至少一个细胞培养隔室富含有内皮细胞,优选地印刷(生物印刷)在神经元球状体下的ipsc衍生的内皮细胞。
此外,包括ipsc衍生的肝脏等效物的至少一个细胞培养隔室优选地包括ipsc衍生的肝细胞的球状体。更优选地,包括ipsc衍生的肝脏等效物(具体地ipsc衍生的肝细胞的球状体)的细胞培养隔室进一步包括成纤维细胞,优选地ipsc衍生的成纤维细胞。在优选实施方式中,ipsc衍生的肝脏等效物通过将ipsc衍生的肝细胞的球状体连同ipsc衍生的成纤维细胞放置在各自细胞培养隔室中实现。
在各种实施方式中,rptec包括肾近端小管上皮细胞系。
在本公开的各种方面中,新型微流体装置的第一回路的至少一个细胞培养隔室包括初生肝脏组织,和第一回路的至少一个细胞培养隔室包括初生肠组织,优选地初生小肠组织,和第一回路的至少一个细胞培养隔室包括ipsc衍生的神经元等效物,和新型微流体装置的第二回路包括肾近端小管上皮细胞(rptec),更具体地接种在重吸收单元和/或过滤单元中的rptec。在各种实施方式中,初生肝脏组织包括原代(人)肝细胞。初生肝脏组织可以是市售的肝脏模型,如,3dinsighttm人肝脏微组织xl,insphero。在各种实施方式中,初生肝脏组织或肝脏模型可以包括50个球状体,每个含有3,000个原代肝细胞。此外,在优选实施方式中,初生肠组织包括原代(人)细胞衍生的肠上皮和内皮细胞,和更优选地进一步包括(人)成纤维细胞。初生肠组织可以是市售的肠模型,如3d
此外,包括ipsc衍生的神经元等效物的至少一个细胞培养隔室优选地包括ipsc衍生的神经元球状体。更优选地,包含ipsc衍生的神经元等效物(具体地ipsc衍生的神经元球状体)的至少一个细胞培养隔室包括印刷(生物印刷)的血脑屏障。更具体地,包含ipsc衍生的神经元等效物(具体地ipsc衍生的神经元球状体)的至少一个细胞培养隔室富含有内皮细胞,优选地印刷(生物印刷)在神经元球状体下的ipsc衍生的内皮细胞。
在各种实施方式中,rptec包括肾近端小管上皮细胞系。
在本公开的各种方面中,新型微流体装置的第一回路的至少一个细胞培养隔室包括ipsc衍生的肝脏等效物,和第一回路的至少一个细胞培养隔室包括ipsc衍生的肠等效物,和第一回路的至少一个细胞培养隔室包括ipsc衍生的神经元等效物,和新型微流体装置的第二回路包括ipsc衍生的肾等效物。优选地,包括ipsc衍生的肠等效物的至少一个细胞培养隔室包括ipsc衍生的肠细胞的细胞器。更优选地,ipsc衍生的肠细胞的细胞器嵌入至细胞外基质中,优选地细胞外凝胶基质中,更优选地基底膜样细胞外(凝胶)基质提取物中(通常类似组织细胞外环境)。在各种实施方式中,基底膜样细胞外(凝胶)基质提取物包括胶状蛋白混合物。优选地,基底膜样细胞外基质是
在进一步优选实施方式中,包括ipsc衍生的肠等效物(具体地ipsc衍生的肠细胞的细胞器)的至少一个细胞培养隔室包括ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞,或ipsc衍生的成纤维细胞和原代微血管内皮细胞。原代微血管内皮细胞或ipsc衍生的内皮细胞接种在细胞培养隔室的基底外侧。
此外,包括ipsc衍生的神经元等效物的至少一个细胞培养隔室优选地包括ipsc衍生的神经元球状体。更优选地,包括ipsc衍生的神经元等效物(具体地ipsc衍生的神经元球状体)的至少一个细胞培养隔室包括印刷的(生物印刷的)血脑屏障。更具体地,包括ipsc衍生的神经元等效物(具体地ipsc衍生的神经元球状体)的至少一个细胞培养隔室富含有内皮细胞,优选地接种在细胞培养隔室的基底外侧的ipsc衍生的内皮细胞。
此外,包括ipsc衍生的肝脏等效物的至少一个细胞培养隔室优选地包括ipsc衍生的肝细胞的球状体。更优选地,包括ipsc衍生的肝脏等效物(具体地ipsc衍生的肝细胞的球状体)的细胞培养隔室进一步包括成纤维细胞,优选地ipsc衍生的成纤维细胞。在优选实施方式中,ipsc衍生的肝脏等效物通过将ipsc衍生的肝细胞的球状体连同ipsc衍生的成纤维细胞放置在各自细胞培养隔室中实现。
在本公开的各种方面中,新型微流体装置的第一回路的至少一个细胞培养隔室包括初生肝脏组织,和第一回路的至少一个细胞培养隔室包括初生肠组织,优选地初生小肠组织,和第一回路的至少一个细胞培养隔室包括初生神经元等效物,和新型微流体装置的第二回路包括初生肾组织,优选地重吸收单元中的初生肾组织,更优选地重吸收单元中初生肾小管(上皮细胞)组织,和过滤单元中的初生肾小球组织。优选地,初生肾组织包括肾上皮细胞,更具体地肾近端小管上皮细胞(rptec),其中肾上皮细胞或rptec可以接种在重吸收单元中,和初生肾小球组织包括足细胞,其可以接种在过滤单元中。在各种实施方式中,初生肝脏组织包括原代(人)肝细胞。初生肝脏组织可以是市售的肝脏模型,如,3dinsighttm人肝脏微组织xl,insphero。此外,在优选实施方式中,初生肠组织包括原代(人)细胞衍生的肠上皮和内皮细胞,和更优选地进一步包括(人)成纤维细胞。初生肠组织可以是市售的肠模型,如3d
此外,初生神经元组织优选地包括原代神经元细胞。在仍进一步优选实施方式中,包含初生神经元组织(具体地原代神经元细胞)的至少一个细胞培养隔室进一步包括印刷的(生物印刷的)血脑屏障。更具体地,包括初生神经元组织(具体地原代神经元细胞)的至少一个细胞培养隔室富含有内皮细胞,其可以接种在细胞培养隔室的基底外侧或印刷(生物印刷)在神经元球状体下。
在本公开的各种方面中,新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏细胞器,和第一回路的至少一个细胞培养隔室包括肠细胞器,优选地小肠细胞器,和新型微流体装置的第二回路包括重吸收单元和/或过滤单元中的肾细胞器。在各种实施方式中,第一回路的至少一个另外的细胞培养隔室包括与肝脏细胞器、肠细胞器(包括小肠细胞器)和肾细胞器不同的另外的细胞器。此类另外的细胞器可以被认为是“非-adme”细胞器,而肝脏细胞器、肠细胞器(包括小肠细胞器)和肾细胞器可以被认为是“adme”细胞器。在各种实施方式中,此类另外的(非-adme)细胞器可以是神经元细胞器、皮肤细胞器、或呼吸道(优选地肺)细胞器中的任一种。在各种实施方式中,第一回路的至少两个另外的细胞培养隔室进一步包括与肝脏细胞器、肠细胞器(包括小肠细胞器)和肾细胞器不同的两个另外的“非-adme”细胞器(一个细胞器/另外的细胞培养隔室)。在各种实施方式中,两个另外的(非-adme)细胞器可以选自神经元细胞器、皮肤细胞器、或呼吸道(优选地肺)细胞器中的任一种。在仍其他实施方式中,第一回路的至少三个另外的细胞培养隔室进一步包括三个另外的“非-adme”细胞器(一个细胞器/另外的细胞培养隔室)。在各种实施方式中,三个另外的(非-adme)细胞器是神经元细胞器、皮肤细胞器、或呼吸道(优选地肺)细胞器。优选地,细胞器是ipsc衍生的器官细胞的细胞器。具体地,肝脏细胞器优选地是ipsc衍生的肝细胞的细胞器,和肠细胞器优选地是ipsc衍生的肠细胞的细胞器,更优选地ipsc衍生的小肠的细胞的细胞器,和神经元细胞器优选地是ipsc衍生的神经元细胞的细胞器,和肾细胞器优选地是ipsc衍生的肾细胞的细胞器。
在本公开的各种方面中,新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏球状体,和第一回路的至少一个细胞培养隔室包括肠球状体,优选地小肠细胞器,和新型微流体装置的第二回路包括重吸收单元和/或过滤单元中的肾球状体。在各种实施方式中,第一回路的至少一个另外的细胞培养隔室包括与肝脏球状体、肠球状体(包括小肠球状体)和肾球状体不同的另外的球状体。此类另外的球状体可以被认为是“非-adme”球状体,而肝脏球状体、肠球状体(包括小肠球状体)和肾球状体可以被认为是“adme”球状体。在各种实施方式中,此类另外的(非-adme)球状体可以是神经元球状体、皮肤球状体、或呼吸道(优选地肺)球状体中的任一种。在各种实施方式中,第一回路的至少两个另外的细胞培养隔室进一步包括与肝脏球状体、肠球状体(包括小肠球状体)和肾球状体不同的两个另外的“非-adme”球状体(一个球状体/另外的细胞培养隔室)。在各种实施方式中,两个另外的(非-adme)球状体可以选自神经元球状体、皮肤球状体、或呼吸道(优选地肺)球状体中任一种。在仍其他实施方式中,第一回路的至少三个另外的细胞培养隔室进一步包括三个另外的“非-adme”球状体(一个球状体/另外的细胞培养隔室)。在各种实施方式中,三个另外的(非-adme)球状体是神经元球状体、皮肤球状体、或呼吸道(优选地肺)球状体。优选地,球状体是ipsc衍生的器官细胞的球状体。具体地,肝脏球状体优选地是ipsc衍生的肝细胞的球状体,和肠球状体优选地是ipsc衍生的肠细胞的球状体,更优选地ipsc衍生的小肠的细胞的球状体,和神经元球状体优选地是ipsc衍生的神经元细胞的球状体,和肾球状体优选地是ipsc衍生的肾细胞的球状体。
在各种实施方式中,细胞培养隔室可以包括一种或多种器官等效物,如神经元等效物单独或与肠等效物组合。在各种其他实施方式中,每个细胞培养隔室(或单一细胞培养隔室)可以仅包括一种器官等效物,遵循原则一个个体器官等效物/细胞培养隔室。换句话说,如果例如新型微流体装置的第一回路的至少一个细胞培养隔室包括肝脏等效物,这意味着可能存在第一回路的两个细胞培养隔室,每个包括肝脏等效物。然而,在优选实施方式中,新型微流体装置每个包括仅一个器官等效物,遵循原则一个个体器官等效物/细胞培养隔室(或/微生理系统)。
本公开提供了本文描述的新型微流体装置在分析测试、诊断、研究、靶标验证、毒性研究、组织工程化、组织制造、药物筛选、和/或药代动力学-药物动力学分析,具体地adme(t)序型分析中的用途。
本公开使得能够操作微生理系统并基于本文提供的新型微流体装置建立所谓的adme序型分析。因此,本公开提供了利用本文所述的新型微流体装置来操作微生理系统的方法,并且进一步提供了包括本公开提供的新型微流体装置的adme(吸收、分配、代谢、排泄)测定。本文进一步公开了包含本文所述的新型微流体装置的admet(吸收、分配、代谢、排泄、毒性)测定。
具体地,在药物发现过程中,体外adme序型分析(或筛选)为选择具有理想药物代谢、药代动力学或安全性性质的新分子实体和先导化合物提供了基础,这些性质对于候选药物的选择和后期临床前和临床开发是必不可少的。药物(测试物质)的adme(t)序型(或性质)使药物开发人员可以了解监管批准所需的安全性和有效性数据。
在操作微生理系统的方法中,培养时间可持续数周或甚至数月,从而能够实现疾病建模和重复剂量物质暴露。
本公开提供了利用本公开提供的新型微流体装置来执行adme(吸收、分配、代谢、排泄)序型分析的方法。本公开还提供了利用本文所述的新型微流体装置进行admet(吸收、分配、代谢、排泄、毒性)序型分析的方法。本文进一步公开了产生(测试)药物的adme序型或admet序型的方法,其包括使用本公开提供的新型微流体装置分别进行adme筛选或admet筛选。
如本文所公开的操作微生理系统的方法优选地包括经由包括胃肠道等效物,优选地肠等效物,更优选地小肠等效物的细胞培养隔室选择性地将营养溶液添加到微生理系统。器官等效物优选地包括组织,该组织包括胃肠道,优选地肠,甚至更优选地小肠的上皮细胞。为了反映生理学的体内状况,本公开优选地以如下方式操作微生理系统:通过细胞培养隔室选择性地将营养液添加到微生理系统中,该细胞培养隔室包括胃肠道等效物,优选地肠等效物,更优选地小肠等效物。
在各种实施方式中,通过包含皮肤等效物,和/或呼吸道等效物,更具体地肺等效物的细胞培养隔室,将营养液选择性地添加到微生理系统中。
如本文所描述,营养溶液具体地包含对细胞或身体生长或恢复至关重要的物质(营养物质)(包括氨基酸、盐(电解质)和葡萄糖)以及碳水化合物形式的卡路里。具体地,如本文所描述的营养液是用于细胞增殖的营养液。如本文所描述,术语“营养液”和“细胞培养基”在本文中可以互换使用。
令人惊讶地发现,本文提供的新型微流体芯片可以在微生理系统中建立体内稳态。葡萄糖和ldh的恒定水平表明了这一点(图3)。恒定的葡萄糖浓度表明恒定的消耗和对可用葡萄糖的主动调节。在所有隔室中,葡萄糖水平已达到相等的水平。此外出乎意料地发现,通过肠等效物(从顶端通过肠等效物)的选择性进料足以供应“血液”回路和“尿液”回路二者。而且,在整个实验中,ldh活性已显示相当恒定。与葡萄糖相比,每个隔室的ldh水平不同。在所有三个“隔室”(即,血液回路->培养基储存器1;尿液回路->培养基储存器2;和肠隔室)中,不同浓度的ldh可以显示出肠等效物和肾等效物的屏障功能。因此,屏障在交叉物质之间分化。葡萄糖的主动或被动渗透,同时保留了其他物质,表明了芯片系统子集之间的实际相互作用。
因此,本公开提供了模拟体内稳态的方法,该方法包括操作微生理系统,该微生理系统包括具有一个或多个细胞培养隔室的第一回路和包括过滤单元和重吸收单元的第二回路,其中两个回路通过过滤单元和重吸收单元彼此连接。根据本文其他地方关于新型微流体装置所描述的(优选的)实施方式,由微生理系统的第二回路包括的过滤单元优选地包括过滤屏障,该过滤屏障基于分子的大小和电荷选择性地允许分子从第一回路穿过到第二回路。更优选地,过滤屏障是生物屏障,甚至更优选地,其中生物屏障包括足细胞。
同样根据本文其他地方关于新型微流体装置描述的(优选的)实施方式,微生理系统的第二回路包括的重吸收单元优选地包括屏障,该屏障允许流体从第二回路重吸收到第一回路。更优选地,重吸收屏障是生物屏障,甚至更优选地,其中生物屏障包括肾小管细胞。
在模拟体内稳态的新方法的各种实施方式中,通过(第一回路的)细胞培养隔室将营养溶液选择性地添加到微生理系统中,所述细胞培养隔室包含胃肠道等效物,更具体地肠等效物,甚至更具体地小肠等效物。在各种实施方式中,器官等效物包括上皮细胞,或包括胃肠道,优选地肠,甚至更优选地小肠的上皮细胞的组织。
本文关于新型微流体装置描述的(优选)实施方式同样适用于模拟体内稳态的新方法,该方法包括操作如本文所描述的微生理系统。因此,本文其他地方关于新型微流体装置描述的(优选)实施方式也是关于模拟体内稳态的新方法的优选实施方式,所述新方法包括操作微生理系统。更具体地,本文中其他地方关于新型微流体装置的(优选)实施方式也是由模拟体内稳态的新方法所包括的微生理系统的优选实施方式。
本公开还提供了利用如本文所描述的微流体装置在微生理系统中检测分析物的方法。在各种实施方式中,该方法包括将测试样品添加到第一回路的细胞培养隔室中,优选地,其中所述细胞培养隔室包含选自胃肠道等效物(更具体地肠等效物)、皮肤等效物、和/或呼吸道等效物(更具体地肺等效物)中任一种的器官等效物。器官等效物优选地包括组织,该组织包括胃肠道、皮肤或呼吸道的上皮细胞。在优选实施方式中,将测试样品添加到包含胃肠道等效物(更具体地肠等效物)的细胞培养隔室中。更优选地,将测试样品选择性地添加到包含胃肠道等效物(具体地肠等效物,更具体地小肠等效物)的细胞培养隔室中。
在各种实施方式中,经由包括皮肤等效物和/或呼吸道等效物(更具体地肺等效物)的细胞培养隔室将测试样品选择性地添加到微生理系统。
在各种其他实施方式中,通过不同于包含器官等效物的细胞培养隔室的腔室,将测试样品选择性地添加到微生理系统。这样的腔室可以是血液回路和/或尿液回路的“培养基储存器”。如本文其他地方所述,这样的“培养基储存器”旨在是“采样储存器”或“采样室/隔室”,其专门用于从微流体系统中取样或培养上清液,和/或旨在是“样品储存器”或“样品室/隔室”,其专门用于将测试样品添加到微流体系统中。
在各种实施方式中,测试样品是液体测试样品,其优选地通过包括胃肠道等效物,具体地肠等效物,更具体地小肠等效物的细胞培养隔室添加到微生理系统中。在各种实施方式中,测试样品是化妆品或消费产品,包括乳膏,其优选地通过包含皮肤等效物的细胞培养隔室添加到微生理系统中。
根据本公开的检测分析物的方法可以包括从血液回路和/或尿液回路的“培养基储存器”中取样。如本文其他地方所描述的,这样的“培养基储存器”可以旨在是“采样储存器”或“采样室/隔室”,其用于从微流体系统中取样品或培养上清液,和/或可旨在是“样品储存器”或“样品室/隔室”,其用于将测试样品添加到微流体系统中,但不充当器官等效物的细胞培养隔室。
根据本公开的检测分析物的方法可以进一步包括分析经由采样室从微流体系统取的样品中代谢物,优选有毒代谢物的存在。根据本公开的检测分析物的方法具体地允许检测作为测试样品添加到微生理系统的药物的代谢物。
根据本公开的检测分析物的方法可以进一步包括检测第一回路和/或第二回路的流体流中的分析物。
在检测分析物的方法的优选实施方式中,将测试样品添加到或沉积在第一回路的细胞培养隔室中,该细胞培养隔室与添加营养液的细胞培养隔室相同或不同。
本文进一步公开了培养和/或维持细胞的方法,所述方法包括用细胞接种本文所述的新型微流体装置。
本文还进一步公开了用于操作微生理系统的套件,该套件包括所描述的新型微流体装置和使用说明书。
本公开提供的微流体装置可以是平板或芯片的形式。平板通常基于微量滴定板的尺寸,并使用基于重力的被动式微流体流或主动式机载泵送。显微镜载玻片大小和其他格式的芯片可以通过主动或被动微流体流进行操作,从而以生理毛细血管内或间隙速率模拟切应力。在主动微流体流的情况下,可以使用外部或芯片上微型泵。优选地,本发明提供的微流体装置为芯片形式。
在本文公开的新型微流体装置或新型微生理系统的各种实施方式中,第一回路包括一个或多个微流体通道,所述微流体通道内衬有内皮细胞。如本文其他地方所描述,本公开证明剪切应力促进多器官芯片的通道中ipsc衍生的内皮细胞的延伸(图11)。
在各种实施方式中,新型微流体装置或新型微生理系统包括微型泵,优选地蠕动微型泵。在各种实施方式中,两个回路(第一回路和第二回路)中的一个可以具有微型泵(即“血液回路微型泵”或“尿液回路微型泵”)。在优选实施方式中,两个回路(第一回路和第二回路)中每个均具有其自己的微型泵(即“血液回路微型泵”和“尿液回路微型泵”)。根据优选的实施方式,微型泵优选为“芯片上”微型泵,其中,新型微流体装置或新型微生理系统是封闭的通道系统。
如本文所描述,本文提供的新方法可包括在第一回路的细胞培养隔室中沉积和/或培养器官等效物,优选地包括各自器官的(上皮)细胞或ipsc衍生的(上皮)细胞的组织。
在各种实施方式中,肠等效物可以(进一步)包括成纤维细胞,具体地ipsc衍生的成纤维细胞。优选地,肠等效物是进一步包括成纤维细胞(具体地ipsc衍生的成纤维细胞)的ipsc衍生的肠等效物。更优选地,肠等效物是由细胞外基质层形成的ipsc衍生的等效物,其被成纤维细胞(具体地ipsc衍生的成纤维细胞)覆盖。细胞外基质层优选地是基于凝胶的细胞外基质层。甚至更优选地,肠等效物是ipsc衍生的肠细胞的细胞器。优选地,肠等效物是通过基底膜样细胞外基质提取物(通常类似组织细胞外环境)层形成的ipsc衍生的等效物,优选地ipsc衍生的肠细胞的细胞器,其中该层被成纤维细胞(具体地ipsc衍生的成纤维细胞)覆盖。在各种实施方式中,基底膜样细胞外基质提取物包括胶状蛋白混合物。优选地,基底膜样细胞外基质是
在各种实施方式中,肠等效物(其优选是ipsc衍生的肠细胞的细胞器)掺入或嵌入前述细胞外基质。
在各种实施方式中,肠等效物(其优选是ipsc衍生的肠细胞的细胞器)包括细胞培养隔室的基底外侧上的内皮细胞(封闭)层,其包括原代微血管或ipsc衍生的内皮细胞(后者是优选的)。在各种实施方式中,肠等效物(其优选是ipsc衍生的肠细胞的细胞器)包括细胞培养隔室的基底外侧上的ipsc衍生的内皮细胞的(封闭的)层。
在各种实施方式中,肠等效物可以(进一步)包括成纤维细胞和内皮细胞,具体地ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞,如上所描述。因此,在各种实施方式中,肠等效物是由细胞外基质层形成的ipsc衍生的肠等效物,其被成纤维细胞(具体地ipsc衍生的成纤维细胞)覆盖,和其中肠等效物进一步包括细胞培养隔室的基底外侧上的另一内皮细胞(优选地原代微血管内皮细胞)层。可选地,在各种实施方式中,肠等效物是由细胞外基质层形成的ipsc衍生的肠等效物,其被成纤维细胞(具体地ipsc衍生的成纤维细胞)覆盖,和其中肠等效物进一步包括细胞培养隔室的基底外侧上的另一ipsc衍生的内皮细胞层。
在各种实施方式中,肠等效物掺入或嵌入前述细胞外基质。
此外,如上所描述,ipsc衍生的肠等效物优选地是ipsc衍生的肠细胞的细胞器。同样,细胞外基质层优选是基于凝胶的细胞外基质层,更优选地基底膜样细胞外基质提取物(通常类似组织细胞外环境)。基底膜样细胞外提取物可以包括胶状蛋白混合物。优选地,基底膜样细胞外基质是
在各种实施方式中,神经元等效物可以(进一步)包括内皮细胞,具体地ipsc衍生的内皮细胞。优选地,神经元等效物是进一步包括内皮细胞(具体地ipsc衍生的内皮细胞)的ipsc衍生的等效物。更优选地,内皮细胞(具体地ipsc衍生的内皮细胞)存在于包括神经元等效物的细胞培养隔室的神经元等效物的基底外侧上。可选地,神经元等效物是进一步包括在神经元等效物下印刷(生物印刷)(并因此存在)的ipsc衍生的内皮细胞的ipsc衍生的神经元等效物。优选地,ipsc衍生的神经元等效物包括ipsc衍生的神经元细胞的球状体或细胞器,和ipsc衍生的内皮细胞在ipsc衍生的神经元细胞的神经元球状体或细胞器下印刷(生物印刷)(并因此存在)。优选地,ipsc衍生的神经元等效物包括ipsc衍生的神经元细胞的球状体或细胞器,其掺入或嵌入细胞外基质的层。优选地,ipsc衍生的内皮细胞印刷(生物印刷)(并因此存在)于ipsc衍生的神经元细胞的神经元球状体或细胞器下(基底外侧)的细胞外基质中。如上所描述,细胞外基质层优选是细胞外凝胶基质层,更优选地基底膜样细胞外基质提取物(通常类似组织细胞外环境)。基底膜样细胞外提取物可以包括胶状蛋白混合物。优选地,基底膜样细胞外基质是
在神经元球状体或细胞器下印刷(生物印刷)的或在神经元等效物的基底外侧上(具体地在包括神经元等效物的细胞培养隔室的基底外侧上)接种的内皮细胞类似血脑屏障,并且已经在2周芯片培育后通过20-78ωxcm2的teer显示其紧密性(tightness)。经上皮/经内皮电阻(teer)是广泛接受的测量内皮和上皮细胞层的细胞培养模型中紧密连接动力学(tightjunctiondynamics)的完整性的定量技术。teer是在评估细胞屏障,如输送药物或化学品之前,细胞屏障的完整性的强指示剂。teer测量可以实时进行而没有细胞损坏并一般地基于测量欧姆电阻或测量宽谱频率的阻抗。已经用商业上可获得的测量系统以及定制的微流体实现方式报道了各种细胞类型的测量。使用teer广泛表征的一些屏障模型包括血脑屏障(bbb)、胃肠(gi)道和肺部模型。
在本公开的各种实施方式中,在神经元球状体或细胞器下印刷(生物印刷)的或在神经元等效物的基底外侧上(具体地在包括神经元等效物的细胞培养隔室的基底外侧上)接种的内皮细胞显示20-78ωxcm2的teer,具体地在2周芯片培育后。
在本公开的各种实施方式中,肠等效物的细胞的特征在于肠上皮细胞的特异性标记物的表达,包括蔗糖异麦芽糖酶、肠寡肽转运体slc15a1/肽转运体1(pept1)、和主要代谢酶cyp3a4。
在本公开的各种实施方式中,肠等效物和/或肝脏等效物的细胞特征在于特异性标记物的表达,包括主要代谢酶cyp3a4。
在本公开的各种实施方式中,肝脏等效物的细胞特征在于特异性标记物的表达,包括细胞角蛋白8/18。
在本公开的各种实施方式中,肝脏等效物特征在于紧密连接zo-1蛋白的表达。
在本公开的各种实施方式中,神经元等效物的细胞特征在于特异性标记物的表达,包括β-微管蛋白iii。
在本公开的各种实施方式中,(原代)内皮细胞特征在于cd31和/或von-willebrand-faktor(vwf)的表达。
在本公开的各种实施方式中,(ipsc衍生的)成纤维细胞特征在于波形蛋白的表达。
如本文所描述,本公开中使用和描述的任何类型的细胞可以衍生自诱导多能干细胞(ipsc)。具体地,细胞可以衍生(即,分化)自单一(即,一个且同一个)供体ipsc,其又获得(即,重编程)自单一类型的体细胞。例如,细胞可以衍生(即,分化)自单一(即,一个且同一个)ipsc,其已经获得(即,重编程)自如体细胞皮肤细胞、白细胞、肾细胞、脂肪细胞等。因此,在细胞还未被鉴定为ipsc衍生的细胞的程度上,在本公开中使用和描述的细胞可以是根据各种实施方式的ipsc衍生的细胞,优选地是从单一(即,一个且同一个)供体ipsc分化的ipsc衍生的细胞,其已经获得(即,重编程)自单一类型的体细胞。
如本文所描述,提及“肠”意思是根据优选的实施方式提及“小肠”。例如,提及“肠等效物”或“肠的细胞”意思是根据优选的实施方式分别提及“小肠等效物”或“小肠的细胞”。
如本文所描述,提及“细胞”涵盖提及“哺乳动物细胞”,同时提及“人细胞”是优选的。例如,提及“内皮细胞”涵盖提及“哺乳动物内皮细胞”,同时提及“人内皮细胞”是优选的。
如本文进一步描述,提及“组织”涵盖提及“哺乳动物组织”,同时提及“人组织”是优选的。例如,提及“肝脏组织”涵盖提及“哺乳动物肝脏组织”,同时提及“人肝脏组织”是优选的。
如本文进一步描述,在各种实施方式中,术语“组织”可以被认为是“组织培养物”。
此外,如本文所描述,“培养细胞”优选地意思是“细胞的流体培养”。
在各种实施方式中,本公开涵盖流体的(或流体)剪切应力,具体地生理上相关的流体的(或流体)剪切应力。
实施例
adme-n芯片的芯片设计
实现了具有从人类生理学按比例缩小的约束的芯片设计。考虑尺寸数据以及流动特性。布局包括两个回路(称为“血液”和“尿液”),其包含用于掺入以下器官等效物的腔室:肠、肝、肾脏(分为肾小球和肾小管)和神经元组织(图1)。前三个组织用于完成所谓的adme序型(吸收、分配、代谢、排泄)。后者是补充该序型的另外的组织。因此,该芯片称为adme-n芯片。每个回路的一个储存器隔室允许对上清液(培养基储存器1和2)进行取样。培养基由两个内置的气动微型泵(每个回路一个)通过微流体网络灌注。回路在两个肾脏隔室中重叠,并由聚碳酸酯制成的多孔膜分隔开。
肠隔室
通过将24孔直立(standing)细胞培养插入物放入各自的腔室(细胞培养隔室)中来实现肠等效物。插入物包含市售的肠模型(
神经元隔室
具有血脑屏障的神经元等效物由96孔悬挂细胞培养插入物组成,该插入物含有ipsc衍生的神经元球状体,其富含ipsc衍生的内皮细胞,接种在96孔悬挂细胞培养插入物的基底外侧或在神经元球状体下进行生物印刷。插入物的顶端侧含有75μl的体积。
肝脏隔室
可以通过将市售的肝脏模型(3dinsighttm人类肝脏微组织xl,insphero)或ipsc衍生的肝细胞与ipsc衍生的成纤维细胞的球状体放入各自的腔室中来完成肝脏等效物。在前者中,将50个球状体置于一个芯片中,每个芯片包含3,000个原代肝细胞。在后者中,将20个球状体放入一个芯片中,每个芯片包含50,000个细胞。
肾脏(肾)隔室
肾脏隔室接种有肾近端小管上皮细胞系(rptec)或ipsc衍生的肾细胞。
ipsc衍生的细胞使用的分化方案改编自表1列出的不同论文。
表1:ipsc衍生的细胞的列表。分化方案改编自列举的论文。
“血液”回路的总体积为大约1.37ml(不包括顶端体积)。“尿液”回路的总体积为大约0.58ml。最初,芯片包含含有葡萄糖和血清的培养基。每天从培养基储存器和肠等效物的顶端侧采集样品。对于“血液”培养基储存器,所采集的体积替换为无葡萄糖培养基,对于“尿液”培养基储存器,所采集的体积替换为无葡萄糖和血清的培养基。向肠隔室提供富含葡萄糖的
培育芯片组7、14和21天(图2)。在终点,采集细胞样品进行免疫组织学检查、qpcr和rna测序。分析上清液的葡萄糖、乳酸盐、ldh、白蛋白、尿素、alt和ast含量。在第0、7和14天采集给定器官等效物的静态培养的对照。
实验1.1:ipsc芯片–3个芯片
·ipsc肝脏等效物
·ipsc肠等效物
·具有印刷的血脑屏障的ipsc神经元等效物
·rptec肾脏
肠隔室
肠等效物的插入物包含嵌入到matrigel中的ipsc衍生的肠细胞的细胞器,其中matrigel还包含ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞。在ipsc衍生的肠等效物模型上,将原代微血管内皮细胞或ipsc衍生的内皮细胞接种在24孔直立细胞培养插入物的基底外侧。
神经元隔室
具有血脑屏障的神经元等效物由含有ipsc衍生的神经元球状体的细胞培养插入物组成,该插入物含有ipsc衍生的神经元球状体,其富含ipsc衍生的内皮细胞,在神经元球状体下进行生物印刷。
肝脏隔室
肝脏等效物是通过将ipsc衍生的肝细胞与ipsc衍生的成纤维细胞的球状体放入各自的腔室中来实现。将20个球状体放在一个芯片上,每个芯片上包含50,000个细胞(肝细胞与成纤维细胞的比例为24:1)。
肾脏(肾)隔室
肾脏隔室接种有肾近端小管上皮细胞系(rptec)。
实验1.2:初生组织芯片–10个芯片
·初生肝脏组织
·初生小肠
·具有印刷的血脑屏障的ipsc神经元等效物
·rptec肾脏
肠隔室
肠等效物的插入物含有市售的肠模型
神经元隔室
具有血脑屏障的神经元等效物由含有ipsc衍生的神经元球状体的细胞培养插入物组成,该插入物含有ipsc衍生的神经元球状体,其富含ipsc衍生的内皮细胞,在神经元球状体下进行生物印刷。
肝脏隔室
可以通过将市售的肝脏模型(3dinsighttm人肝脏微组织xl,insphero)放入各自的腔室中来完成肝脏等效物。将50个球状体放入一个芯片上,每个芯片包含3,000个原代肝细胞。
肾脏(肾)隔室
肾脏隔室接种有肾近端小管上皮细胞系(rptec)。
实验2:ipsc芯片–21个芯片
·ipsc肝脏等效物
·ipsc肠等效物
·具有血脑屏障的ipsc神经元等效物
·ipsc肾等效物
肠隔室
肠等效物的插入物包含嵌入到matrigel中的ipsc衍生的肠细胞的细胞器,其中matrigel还包含ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞。在ipsc衍生的肠等效物模型上,将原代微血管内皮细胞或ipsc衍生的内皮细胞接种在24孔直立细胞培养插入物的基底外侧。
神经元隔室
具有血脑屏障的神经元等效物由含有ipsc衍生的神经元球状体的细胞培养插入物组成,该插入物含有ipsc衍生的神经元球状体,其富含ipsc衍生的内皮细胞,接种在细胞培养插入物的基底外侧上。
肝脏隔室
肝脏等效物是通过将ipsc衍生的肝细胞与ipsc衍生的成纤维细胞的球状体放入各自的腔室中来实现。将20个球状体放在一个芯片上,每个芯片上包含50,000个细胞(肝细胞与成纤维细胞的比例为24:1)。
肾脏(肾)隔室
肾脏隔室接种有ipsc衍生的肾细胞。
结果
芯片是体内稳态的。葡萄糖和ldh的恒定水平表明了这一点(图3)。恒定的葡萄糖浓度表明恒定的消耗和对可用葡萄糖的主动调节。在所有隔室中,葡萄糖水平已达到相等的水平。仅从顶端通过肠等效物的进料足以供应“血液”回路和“尿液”回路。而且,在整个实验中,ldh活性已显示相当恒定。与葡萄糖相比,每个隔室的ldh水平不同。在所有三个隔室(即,血液回路->培养基储存器1;尿液回路->培养基储存器2;和肠隔室)中,不同浓度的ldh可以显示出肠等效物和肾等效物的屏障功能。因此,屏障在交叉物质之间分化。葡萄糖的主动或被动渗透,同时保留了其他物质,表明了芯片系统子集之间的实际相互作用。
利用聚碳酸酯膜和肾细胞的紧密层的组合实现肾小球和小管隔室(图4)。前者实施技术屏障以过滤大培养基成分并减缓其扩散。后者重吸收物质并引起跨越“血液”和“尿液”回路的浓度梯度的积累。该梯度不仅对于ldh可见,而且对于天冬酰胺转氨酶也可见(ast,图5)。它们两者明显不同的浓度都证明了adme-n芯片的肾膜功能。ast可以仅起源自肝脏等效物,因为其是在肝细胞和肌肉细胞中发现的细胞内酶。
所有器官等效物进行免疫组织化学评估以确定同一性、功能和生存力(图6-9)。ipsc衍生的肠等效物由ipsc衍生的成纤维细胞覆盖的matrigel层形成。将封闭管腔的肠细胞器掺入凝胶中(图6)。ipsc衍生的肠细胞表达nak-atp酶和cyp3a4。在实验1.2中,原代微血管内皮细胞的闭合层进一步在细胞培养插入物的基底外侧形成另一层。
初生肝脏等效物显示了其两周培育期终点时的功能标记物(图7)。同样,在adme-n芯片中培育三周后,确认了ipsc衍生的肝脏等效物功能标记物(图8)。
在其两周培育期的终点时,ipsc衍生的神经元等效物表达β-微管蛋白iii的功能标记物(图9)。在水凝胶中印刷的内皮细胞显示了芯片培育两周后的vwf表达(实验1.2)。在2周芯片培育后由20-78ωxcm2的teer显示了血液屏障的紧密性(实验2)。
实验3:具有ipsc衍生的肝细胞、内皮细胞和成纤维细胞的肝脏3d等效物。
利用根据szkolnicka等人(szkolnicka等人,2014)的修饰进行肝细胞细胞分化。利用根据zou等人,2013)的修饰进行成纤维细胞分化。在harding等人(harding等人,2017)后,进行内皮分化。通过使用超低附着平板形成球状体。图13显示了在ipsc衍生的肝细胞分化和3d球状体形成后的免疫荧光图像。图14显示了在ipsc衍生的肝脏等效物(ipsc衍生的肝细胞)中选择的肝的标记物基因的转录水平。通过qpcr分析转录水平。在两天内培育ipsc衍生的肝脏等效物以产生3d肝脏球状体,其包括ipsc衍生的肝细胞、成纤维细胞和内皮细胞。将数据标准化至持家tbp。图15显示了在芯片上的单一培养物中3d肝脏等效物将普萘洛尔(propranolol)代谢为普萘洛尔葡糖苷酸和α-萘氧乳酸的代谢能力。
实验4:由ipsc衍生的肠细胞器、ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞构成的肠等效物。
仅由来自stemuse101ipsc的ipsc衍生的细胞(ipsc衍生的肠细胞器、ipsc衍生的成纤维细胞和ipsc衍生的内皮细胞)建立肠模型。在共培育ipsc衍生的成纤维细胞和细胞器两周后已经可见高密度的细胞器。在静止培养三周后,细胞器融合在一起并且其大小生长。在插入物边缘下ipsc衍生的内皮细胞的可视化是可能的。但静止培育3周后,仍然可见单层ipsc衍生的内皮细胞。图16显示了该结果。
实验5:具有ipsc衍生的肠细胞器、成纤维细胞和内皮细胞的水凝胶屏障。
用成纤维细胞生物印刷水凝胶并在其上接种原代内皮细胞和肠细胞器。图17显示了该结果。
实验6:芯片中的ipsc衍生的血脑屏障。
在
实验7:adme-n共培养实验。(adme-n=adme芯片+神经元等效物)
在概念验证实验中,在adme-n芯片中培育来自stemuse101ipsc系的四种不同的ipsc衍生的器官模型的组合两周。adme-n芯片因此也成为4-器官芯片。adme-n芯片被设计为以模仿人生理的布置主持肠直立24-孔插入物模型、肝脏等效物、肾细胞器和神经球。在24孔插入物上建立肠屏障。肠细胞器与成纤维细胞共培养,和在插入物膜下面接种单层的ipsc衍生的内皮细胞。由ipsc衍生的肝细胞与ipsc衍生的成纤维细胞组装肝脏模型。在adme-n共培育开始前六天,肾细胞器的单一细胞溶液被用于接种两个肾脏隔室中的膜。神经元组织在生物反应器系统中分化并作为球状体被放入96孔transwell中。选择该器官的组合以允许评估化合物adme序型的研究(=基于生理上的药代动力学(pbpk)符合的芯片/序型)。在图19中显示了该实验的复合设置(参见实验2和图2的对应部分)。图20显示了在adme-n芯片中共培育14天的肝脏、肾和神经元模型的免疫染色特性。图21显示了在ipsc衍生的肠、肝脏、肾和脑模型的adme-n芯片中共培养的qpcr结果。
四种不同的ipsc衍生的器官模型不仅显示在adme-n芯片中共培育两周后稳定,即保持了它们的表型。令人惊讶的是,发现具有微型人肠、肝脏、脑和肾等效物(它们均从来自同一供体的ipsc中预分化)的四器官芯片显示了在缺乏生长因子的培养基中在14天的培育期内,不同的ipsc衍生的器官模型的进一步分化。这种进一步的分化归因于器官等效物之间的串扰。此外,随着时间的推移,可以观察到不同组织的高级成熟。值得注意的是,已经显示了不同的ipsc衍生的器官模型在adme-n(=adme芯片+神经元等效物)共培育期内是稳定的,即,保持其表型,并显示出随时间朝向定向组织的限定和一致的标记物基因表达(实验7和图21)。
肠模型(图21a):nakatp酶-钠钾腺苷三磷酸酶(小肠中的营养运输);cdx2-尾型同源盒2(对肠上皮的转录调控很重要)。
肝脏模型(图21b):显著的上调基因是alb-白蛋白(仅在肝脏中产生);mpr2-多药耐药性相关蛋白2(mrp2)(在肝细胞的小管部分表达,在胆汁运输过程中起作用),和afp-α-胎蛋白–胎肝脏蛋白(肝细胞的成熟)。
脑模型(图21d):显著的上调基因是tbr1-t-box,脑1(对脑发展重要的转录因子),和mapr2-微管相关蛋白2(对神经发生关键)。
本公开建立了来自在基于生理上的药代动力学(pbpk)符合的微生理系统(mps)中培养的单一供体的四种不同自体ipsc衍生的器官模型的成功系统性长期共培育,而不需要添加额外的生长因子。
参考文献列表(在表1中引用的,等等):
1.szkolnicka,d.,farnworth,s.l.,lucendo-villarin,b.&hay,d.c.derivingfunctionalhepatocytesfrompluripotentstemcells.1–12(2014).doi:10.1002/9780470151808.sc01g05s30
2.zou,l.等人asimplemethodforderivingfunctionalmscsandappliedforosteogenesisin3dscaffolds.sci.rep.3,2243(2013).
3.kauffman,a.l.等人,directeddifferentiationprotocolsforsuccessfulhumanintestinalorganoidsderivedfrommultipleinducedpluripotentstemcelllines.2,1–10(2015).
4.morizane,r.&bonventre,j.v.generationofnephronprogenitorcellsandkidneyorganoidsfromhumanpluripotentstemcells.nat.protoc.12,195–207(2016).
5.rigamonti,a.等人stemcellreports.stemcellreports6,993–1008(2016).
6.lippmannethans.等人humanblood-brainbarrierendothelialcellsderivedfrompluripotentstemcells.nat.biotechnol.30,783–791(2012).
7.harding,a.等人highlyefficientdifferentiationofendothelialcellsfrompluripotentstemcellsrequiresthemapkandthepi3kpathways.stemcells35,909–919(2017).
- 还没有人留言评论。精彩留言会获得点赞!