环介导恒温扩增结合纳米生物传感检测肺炎支原体的方法与流程
本发明公开了一种基因扩增方法,属于分子生物学技术领域。
背景技术:
肺炎支原体(mycoplasmapneumoniae,mp),属柔膜体纲,支原体目,支原体科,支原体属,它是介于细菌和病毒之间的能在无生命培养基中生长繁殖的最小的原核生物。mp是社区获得性肺炎的重要病原体之一,约占社区获得性肺炎的10%-40%,在流行高峰年或者在半封闭的空间mp感染率甚至可高达50%-80%,在某些地区mp甚至已经超过肺炎链球菌成为最常见的社区获得性肺炎的病原菌。mp感染在人群中呈现常年散发和周期性流行的特点,一般每3-7年会有区域性的mp流行高峰出现。同时,mp可在人群中暴发流行,易发生在封闭或半封闭的环境中,特别是学校、军营和养老院是暴发流行的好发地点。mp在各年龄均可发病,尤其是儿童和青少年。mp感染后临床症状呈现多样性,轻者可无任何症状,重者除了可引起常见的呼吸系统疾病,如发热、咳嗽、咳痰、全身不适、支气管炎、细支气管炎、肺不张、呼吸窘迫等,还可以引起全身多系统肺外并发症,涉及到血液系统、心血管系统、消化系统、泌尿系统等。mp引起的临床症状很难与其他呼吸道病原菌引起的疾病进行鉴别。因此,研发一个简单、快速、灵敏性和特异性较高的mp的检测方法,对于及时诊断和治疗mp感染患者尤为重要。
mp的诊断方法有培养法、血清学检测和分子生物学检测方法。虽然培养法是mp诊断的金标准,但是mp对培养条件要求苛刻,生长缓慢,一般为7-10天,做出判断需要3-4周,无早期诊断价值,并且检出率比较低。血清学检测因它的便利性和快捷性仍是目前国内外最常用的mp感染诊断方法,在mp感染的诊断中起到非常重要的作用,但是血清学抗体检测存在窗口期和抗体持续存在的问题以及不同检测试剂盒之间敏感性和特异性存在较大的差异,因此限制了它的临床使用。随着核酸诊断技术的快速发展,一些以pcr为基础的诊断技术(如普通pcr技术,荧光pcr技术)被用于mp的快速诊断,然而这些方法依赖于昂贵的仪器设备,需要后续的电泳操作,昂贵的探针合成,以及熟练的操作人员。对于一些落后的实验室无法进行,限制了这些技术的运用。目前运用这些检测技术诊断mp的pcr方法和real-timepcr方法,检测灵敏度差,检测过程耗时较长,不利于快速检测和应急检测。
为了克服pcr扩增技术的劣势,近年来发展了许多恒温扩增技术。恒温扩增技术较pcr技术而言,不依赖于热循环扩增设备,反应速度快,敏感性好。因此,恒温扩增技术有利于实现快速扩增,便捷检测及现场诊断。
环介导恒温扩增技术(loop-mediatedisothermalamplification,lamp)是由notomi等发明的一种新型核酸特异性扩增技术。该技术灵敏高、操作简单、产物易检测等优点,已被广泛用于分子生物研究和诊断领域。为了使该技术在生物、医药及卫生领域应用更广泛、更经济。近期,研究人员将lamp技术与纳米生物检测技术相结合,开发了依赖lamp技术、实现快速,敏感检测的纳米生物传感技术,该技术被命名为环介导恒温扩增结合纳米生物传感的核酸诊断技术(loop-mediatedisothermalamplificationlabel-basednanoparticleslateralflowbiosensor,lamp-lfb)。本发明将lamp-lfb技术用于肺炎支原体的检测,针对肺炎支原体的特异基因p1设计一套lamp扩增引物,旨在验证、评价lamp-lfb技术及建立针对肺炎支原体的快速、敏感和特异的lamp-lfb检测体系。
技术实现要素:
基于上述发明目的,本发明首先提供了一种环介导恒温扩增结合高分子纳米生物传感检测目的基因的方法,所述方法包括以下步骤:
(1)提取待检测样品的基因组;
(2)提供如seqidno:1所示的外引物f3,seqidno:2所示的外引物b3,seqidno:3所示的内引物fip,seqidno:4所示的内引物bip,seqidno:5所示的环引物lf,seqidno:6所示的环引物lb,其中,选择以上任一引物的5’端标记半抗原,选择任意另一种引物的5’端标记生物素(biotin);
(3)在链移位型聚合酶、解链温度调节剂、引物以及脱氧核糖核苷三磷酸(dntp)存在下,使用待检测样品的基因组核酸作为模板恒温扩增dna;
(4)使用高分子纳米生物传感器检测步骤(3)的扩增产物。
在一个优选的实施方案中,,在5’端标记有半抗原的引物为fip,在5’端标记有生物素的引物为lf。
在一个更为优选的实施方案中,在引物fip的5’端标记的半抗原为荧光素(fitc)。
更为优选地,所述高分子纳米生物传感器包括一背板,在所述背板上依次设置装有样品垫、结合垫、硝酸纤维素膜及吸水垫,在所述硝酸纤维素膜上依次设置检测线及控制线,在结合垫、检测线、及控制线区域依次包被有色基团修饰的亲和素化的高分子纳米粒子、羊抗fitc抗体及生物素偶联的牛血清蛋白。
在一个优选的实施方案中,所述恒温扩增是在60-67℃的环境中进行的。
在一个更为优选的实施方案中,所述恒温扩增是在65℃的环境中进行的。
其次,本发明还提供了一组用于恒温扩增肺炎支原体特异基因p1的引物序列,所述序列包括:如seqidno:1所示的引物f3,seqidno:2所示的引物b3,seqidno:3所示的引物fip,seqidno:4所示的引物bip,seqidno:5所示的引物lf,seqidno:6所示的引物lb,其中,选择以上任一引物的5’端标记半抗原,选择任意另一种引物的5’端标记生物素。
在一个优选的实施方案中,在5’端标记有半抗原的修饰引物为fip,在5’端标记有生物素的修饰引物为lf。
在一个更为优选的实施方案中,在引物fip的5’端标记的半抗原为荧光素(fitc)。
所述方法针对肺炎支原体特异基因p1的扩增产物能被纳米生物传感器可视化检测。该方法具有优异的检测灵敏度,其检测范围为60ng~600fg,而且也具有较快的检测速度,仅需60分钟,即可获得能供可视化lfb检测的扩增产物。
以常见的致病菌及条件致病菌dna(肺炎克雷伯杆菌、铜绿假单胞杆菌、肺炎链球菌、单增李斯特菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、蜡样芽胞杆菌、阪崎肠杆菌、空肠弯曲菌、大肠杆菌、嗜水气单胞菌、类志贺单胞菌、沙门氏菌、福氏志贺菌、鲍氏志贺菌、副溶血性弧菌、创伤弧菌、稀氏肠球菌、粪肠球菌、屎肠球菌)为模板评价mp-lamp-lfb技术的特异性。mp-lamp-lfb技术能准确地鉴别肺炎支原体,具有优异的特异性。
附图说明
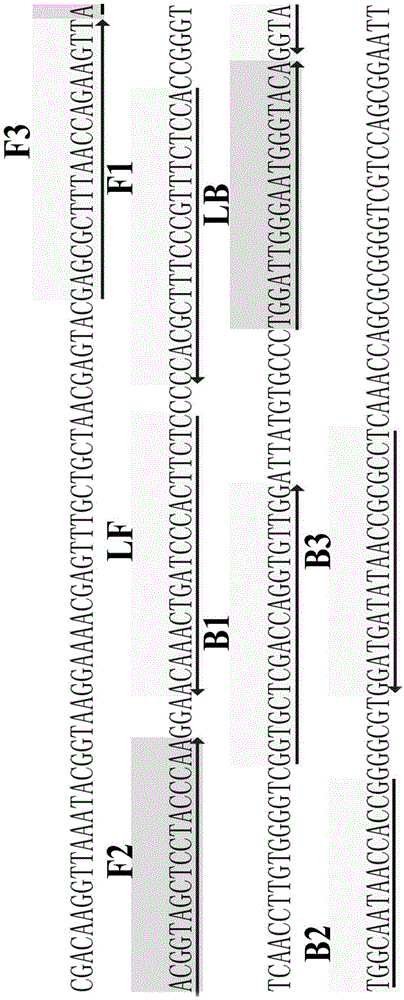
图1.lamp-lfb引物设计的位置和方向示意图;
图2.lamp引物验证及lamp-lfb检测结果图谱;
图3.标准lamp-lfb最佳反应温度测试结果图谱;
图4.lamp-lfb检测mp的灵敏度结果图谱;
图5.lamp-lfb技术的特异性检测评价图谱。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的保护范围构成任何限制。
本发明中所涉及的试剂:
抗荧光素抗体(anti-fitc)及生物素偶联的牛血清蛋白(b-bsa)购于abcam公司。高分子纳米粒子偶联的链霉素亲和素(sa-np)购于北京海泰正元科技有限公司。背板,样品垫,金标垫,纤维膜及吸水垫购于上海杰一公司。恒温扩增试剂盒(
本发明实验中使用的主要仪器:恒温实时浊度仪la-320c(eikenchemicalco.,ltd,japan)购于日本荣研公司。pcr仪为东胜龙edc-810,北京东胜创新生物科技有限公司。电泳设备为美国bio-rad产品;凝胶成像系统为bio-radgeldoxxr,美国bio-rad产品。
实施例1.lamp-lfb检测mp的特异基因p1的方法的建立
1.引物设计
为了验证、评价lamp-lfb技术及建立针对mp的快速、敏感和特异的lamp-lfb检测体系。本发明针对mp的特异基因p1设计一套lamp扩增引物,旨在验证lamp-lfb技术的可行性,敏感性,特异性及可靠性。
p1基因存在于所有的mp中,其保守性和特异性良好,可以将mp与其他密切相近的菌种区分开。利用引物设计软件primerexplorerv4(eikenchemical)(http://primerexplorer.jp/e/)和引物设计软件primerpremier5.0设计lamp引物,并将获得的特异性引物在ncbi数据库(http://blast.ncbi.nlm.nih.gov/blast.cgi)中进行序列比对分析,以排除引物与其他物种序列可能存在的非特异性匹配,最终获得优化后的lamp扩增引物。引物设计的位置和方向见图1,序列及修饰见表1。
表1.引物序列及修饰
fitc:荧光素。fip*:5’端标记fitc(该引物用于lamp-lfb检测体系)。
biotin:生物素。lf*:5’-端标记biotin(该引物用于lamp-lfb检测体系)。
2.基因组提取:细菌基因组的提取使用qiagen公司的dna提取试剂盒(qiaampdnaminikits;qiagen,hilden,germany),按照说明书进行操作。提取的基因组dna均少量分装,-20℃保存备用。
3.lamp扩增
lamp的反应体系:总体积为25μl,包含1.6mm内引物fip*和bip,0.2mm外引物f3和b3,0.4mm环引物lf*和lb,20mmtris-hcl(ph8.8),10mmkcl,8mmmgso4,10mm(nh4)2so4,0.1%tween20,0.8mbetaine,1.4mmdntps,1μlofbst2.0dna聚合酶(8u/ml),1μlvr染料,1μldna模板。lamp的反应条件都为恒温65℃,反应时间为60min。
4.lamp扩增结果判别
lamp扩增之后,三种检测方法用于lamp扩增判别。
(1)可视法:在反应混合物中加入可视染料(vr),阳性反应管的颜色为绿色(图2a1),阴性反应为无色(图2a2-4)。
(2)电泳法:lamp产物可以通过琼脂糖电泳后检测扩增子,由于产物中包含了不同大小的扩增片段,因此阳性扩增产物的电泳图呈特异性阶梯状(图2c1),阴性反应不出现任何条带(图2c2-4)。
(3)生物传检测器(lfb):通过lfb对产物进行检测(图2b)。
生物传检测器(lfb)的原理及结果读取
lfb的检测原理:将mp-lamp产物直接滴加到lfb的样品垫区域,然后将80ul的检测缓冲液加到样品垫区域,lamp产物在虹吸作用下,从下往上运动(从样品垫向吸水垫方向运动)。当lamp产物达到结合垫后,双标产物的一端(即生物素标记端)与sa-np(纳米粒子偶联的链霉素亲和素)反应。当产物继续运动,双标产物的另一端(即荧光素标记端)与检测线区域的抗体结合,将双标产物固定在检测线区域。随着产物在检测线区域的积累,通过另一端的sa-np(纳米粒子偶联的链霉素亲和素)进行显色反应,从而对lamp产物进行可视化检测。此外,过剩的sa-np(纳米粒子偶联的链霉素亲和素)可与cl(质控线)区域的b-bsa(生物素偶联的牛血清蛋白),进行直接显色反应,判断lfb的功能是否正常。
lfb结果的判读(图2b):仅仅cl区域出现红色条带,表示阴性对照,没有阳性产物(图2b2,2b3,2b4);cl及检测线区域出现红色条带,表示针对靶标的检测为阳性结果(图2b1);当lfb不出现红线条带时,表示lfb失效;仅当测试线出现红色条带时,cl无红色条带,代表结果不可行,需要重新检测。
实施例2.lamp技术最佳反应温度的测定
在标准反应体系条件下,加入针对mpdna模板及所设计的对应的lamp引物,其模板浓度为60ng/ul。反应在恒温条件下进行(60-67℃),结果运用实时浊度仪进行检测,在不同的温度下得到不同的动态曲线图,见图3。65℃被推荐作为mcda引物的的最佳反应温度。本发明中的后续验证选择65℃作为恒温条件进行lamp扩增。图3表示针对p1基因序列设计的检测mp的lamp引物温度动态曲线图。
实施例3.lamp-lfb检测mp的灵敏度评价
运用连续稀释好的mp基因组dna进行标准的lamp扩增反应后,运用lfb检测显示:lamp-lfb的检测范围为60ng~600fg,lfb在tl和cl区域出现红色线,当反应体系中基因组模板量降低至600fg以下时,lfb仅在cl区域出现红色线,表示阴性结果(图4c)。为了进一步验证lamp-lfb检测mp的敏感性,另外2种检测方法用于lamp扩增结果判别,进一步确认lamp-lfb的检测灵敏度。首先,lamp产物可以通过琼脂糖电泳后检测扩增子,由于产物中包含了不同大小的扩增片段,因此阳性扩增产物的电泳图呈特异性阶梯状,阴性反应不出现任何条带。检测显示:mp-lamp的检测范围为60ng~600fg,阳性反应出现阶梯条带,当反应体系中基因组模板量降低至600fg以下时,不出现特异的阶梯条带,表示阴性结果(图4b)。其次,在反应混合物中预先加入可视染料(如te染料),阳性反应管的颜色为绿色,阴性反应管由绿色变为无色。检测显示:mp-lamp的检测范围为60ng~600fg,阳性扩增管为绿色,当反应体系中基因组模板量降低至600fg以下时,反应管的颜色由绿色变为无色,表示阴性结果(4a)。
实施例4.lamp-lfb检测mp的的特异性评价
以常见的致病菌及条件致病菌dna(肺炎克雷伯杆菌、铜绿假单胞杆菌、肺炎链球菌、单增李斯特菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、蜡样芽胞杆菌、阪崎肠杆菌、空肠弯曲菌、大肠杆菌、嗜水气单胞菌、类志贺单胞菌、沙门氏菌、福氏志贺菌、鲍氏志贺菌、副溶血性弧菌、创伤弧菌、稀氏肠球菌、粪肠球菌、屎肠球菌)为模板评价mp-lamp-lfb技术的特异性(菌株信息详见表2)。mp-lamp-lfb技术能准确地鉴别mp,说明lamp-lfb方法的特异性良好,见图5。图5,lfb1-6:mp模板;lfb7-27,非mp模板;lfb28,空白对照。结果表明,lamp-lfb能够正确的检测靶序列。
表2菌株及特异性检测结果
bch,beijingchildren’shospital(北京儿童医院);cp-cdc,changpingdistrictcenterfordiseasecontrolandprevention(昌平区疾病预防控制中心)。
p,positive(mp-lamp-lfb检测阳性);n,negative(mp-lamp-lfb检测阴性).表2中检测结果说明,只有属于m.pneumoniae的成员,经mp-lamp-lfb检测产生阳性结果,说明所建立的方法准确的鉴定m.pneumonia,无假阳性及假阴性结果产生。
序列表
<110>首都医科大学附属北京儿童医院
<120>环介导恒温扩增结合纳米生物传感检测肺炎支原体的方法
<160>6
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>mycoplasmapneumoniae
<400>1
gagcgctttaaccagaagtt20
<210>2
<211>19
<212>dna
<213>mycoplasmapneumoniae
<400>2
aggcgcggttatatcatcc19
<210>3
<211>40
<212>dna
<213>mycoplasmapneumoniae
<400>3
tggagaaacgggaaagcgtggaacggtagctcctacccaa40
<210>4
<211>39
<212>dna
<213>mycoplasmapneumoniae
<400>4
ggtgctcgaccaggtgttggcggtggttattgccatacc39
<210>5
<211>20
<212>dna
<213>mycoplasmapneumoniae
<400>5
gagaagtgggatcagtttgt20
<210>6
<211>19
<212>dna
<213>mycoplasmapneumoniae
<400>6
tggattgggaatgggtaca19
- 还没有人留言评论。精彩留言会获得点赞!