一种提取漆树漆酶的方法与流程
本发明涉及一种提取具有高纯度、高浓度及高活性的漆树漆酶的方法,属于生物酶领域。
背景技术:
漆树漆酶是来自漆树的一种天然的酶,它是生漆催化漆酚聚合的催化剂。漆酶作为一种四铜糖蛋白的氧化还原酶,它通过氧气氧化底物,并且能够催化氧化多种底物。但是由于漆树漆酶的活力偏低且制备成本较高,极大地限制了漆树漆酶在各个领域的应用实施。文献中提取漆树漆酶采用硫酸铵沉淀—阳离子交换层析—阴离子交换层析—冷冻干燥等方法,此提取方法易失去漆酶中的铜原子,影响其结构和活性且提取成本较高,分离时间长,难以大批量生产。专利cn102559621a报道了采用超滤机和喷雾干燥机来制备真菌漆酶的方法,但此方法中的高温会严重影响漆树漆酶的活性。reinhammar报道的方法中虽然可以避免硫酸铵沉淀来获得漆酶,但是由于溶液中含有大量的多糖和其他小分子杂质,在过cm-sephadexc50柱时会有如下问题:(1))凝胶塌陷,使分离效果变差,柱子也不利于重复使用;(2)一些杂质会挂在柱上堵塞凝胶,使流速越来越慢;这些杂质在柱中呈白色颗粒状,很难除去而影响凝胶的再次使用;此方法凝胶损耗太大,因而会大大提升分离纯化成本;(3)多糖结合的一些阳离子会将漆酶交换下来,这也不利于分离纯化;(4)采用阳离子交换柱与阴离子交换柱相结合的方式来提取漆酶,该方法会对阳离子树脂造成很大的伤害,以至于造成树脂只能使用一次,不能再生重复使用,并且此方法成本较高、提取时间较长。
技术实现要素:
针对上述漆树漆酶制备方法中的不足,本发明先利用交联葡聚糖凝胶g-100的分子筛作用进行分级,再采用cm-葡聚糖凝胶c-25(cmsephadexc-25)或cm-葡聚糖凝胶c-50(cmsephadexc-50)进行阳离子交换层析,从而制备出高纯度和高活性的漆酶。
实现本发明目的的技术手段如下:
本发明的提取漆树漆酶的方法,是将天然生漆液用丙酮制得丙酮粉末,粉末用浸提液溶解后抽滤,滤液采用凝胶柱层析和阳离子柱层析进行分离后透析脱盐,最后冷冻干燥得漆树漆酶纯品。
所述的浸提液为磷酸盐缓冲溶液,ph值为5.5-6.5。该浸提液在整个提取过程中不影响漆酶的活性。
所述的柱层析指凝胶柱层析和阳离子柱层析,凝胶柱层析所用凝胶为葡聚糖凝胶g-100,阳离子柱层析所用填料为cm-葡聚糖凝胶c-25或cm-葡聚糖凝胶c-50。
选用葡聚糖凝胶g-100可以优先分去大部分多糖组分和几乎全部的有机小分子级分,使收集到的含漆酶级分中仅剩小部分多糖,大大减小了后续分离的压力;
从葡聚糖凝胶g-100层析柱流出的溶液再进入cm-葡聚糖凝胶c-25或cm-葡聚糖凝胶c-50层析柱,漆酶被支载在柱上而多糖则流出,从而实现二者的完全分离;此后只要用较浓的磷酸盐缓冲溶液洗脱漆酶,就可得到仅含漆酶的磷酸盐缓冲溶液了。
进一步地,漆酶的磷酸盐缓冲溶液采用葡聚糖凝胶g-25层析柱层析脱盐,或者采用透析袋对去离子水透析脱盐,或者采用超滤膜超滤脱盐,最后经冷冻干燥可以得到高纯的漆酶粉末。所得产品铜的质量百分含量为2.28‰~2.32‰,280nm与614nm处吸光度比值(a280nm/a614nm)为18.45~20.43。
与现有技术相比,本发明的有益效果为:
(1)本发明采用sephadexg-100和cmsephadexc-50(或c-25)组合的柱层析分离,较其它搭配相比,sephadexg-100可以优先分离掉大部分的糖组分和几乎全部的有机小分子级分,剩余小部分的多糖和漆酶组分在过c-50时,不仅分离时间缩短,分离效率显著提高,并且大大减小了对cmsephadexc-50的损害,可重复使用,降低了实验成本。
(2)本发明提取过程简单,方便快捷,成本低,得率高(高达0.3%-0.4%),并且采用本发明方法提取的漆酶纯度高,活性高,可广泛应用于有机污染物处理、纸浆漂白、生物传感器、纺织物染整、食品改良等领域。
附图说明
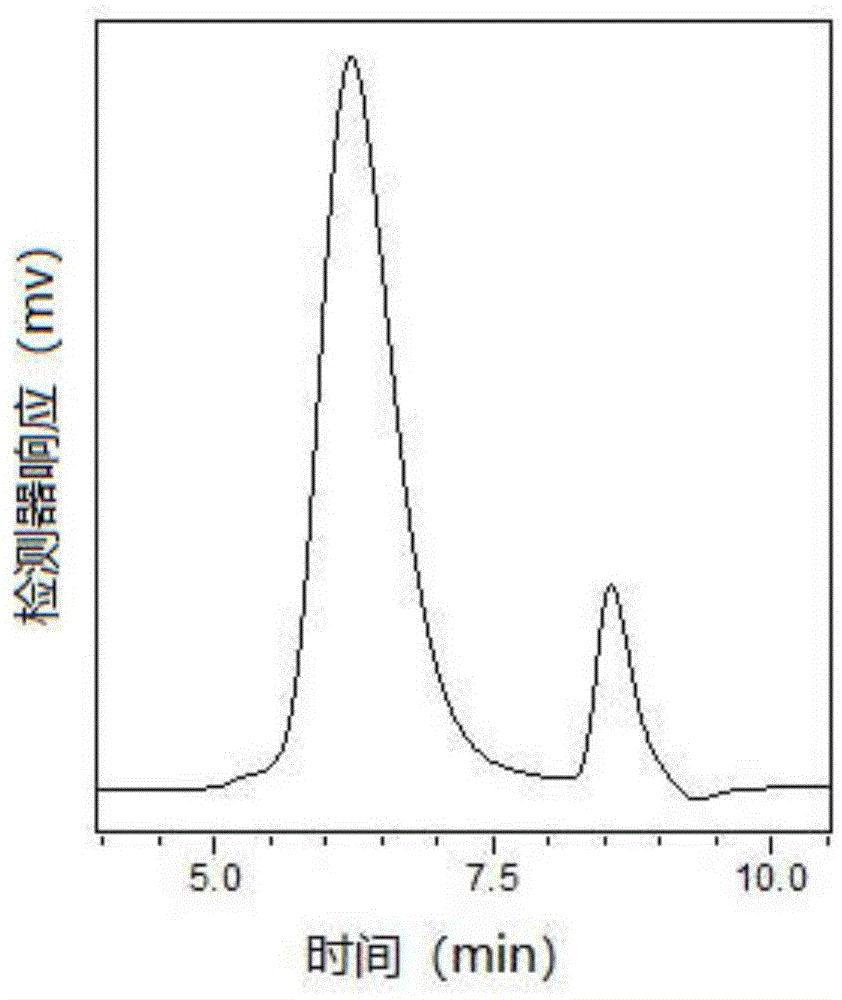
图1为本发明实施例4制得的漆树漆酶的gpc谱图。
具体实施方式
下面结合具体实施例对本发明作进一步说明,但本发明的保护范围并不限于此。
实施例1
取1kg生漆液加入5倍量丙酮浸泡并充分搅拌,静置过夜,离心、用丙酮洗涤沉淀物直至沉淀接近灰白色,阴干沉淀后得丙酮粉末。将丙酮粉末加入2.0l0.01ml/l的磷酸盐缓冲溶液(ph5.8)中搅拌4h后过滤得到墨绿色的漆酶提取液。漆酶提取液加载到sephadexg-100凝胶柱,以0.01mol/l的磷酸盐缓冲溶液(ph5.8)洗脱,收集蓝色层析带漆酶溶液。
将经sephadexg-100分离的蓝色漆酶溶液加载到cmsephadexc-50阳离子交换柱,然后用1.0l的0.05mol/l的磷酸盐缓冲溶液(ph5.8)洗柱,随后再用0.1mol/l的磷酸盐缓冲溶液(ph5.8)洗脱柱上的蓝带,即得漆酶溶液。将该漆酶溶液装入透析袋(切割分子量10000da)中,对0.01mol/lph=5.8的磷酸盐缓冲溶液透析24h,继续对蒸馏水透析48h,最后冷冻干燥即得固体漆酶纯品,得率0.31%。该纯漆酶中铜的质量百分含量为2.31‰,280nm与614nm处吸光度比值(a280nm/a614nm)为20.12。所有步骤都是在温度4-5℃左右的环境温度下进行的。
实施例2
将上述丙酮粉末加2.0l0.01mol/lph=5.5的磷酸盐缓冲溶液,搅拌过夜后离心并抽滤。滤液加载到sephadexg-100凝胶柱,以0.01mol/lph=5.5的磷酸盐缓冲溶液洗脱,恒流泵流速控制在20-26ml/h,收集蓝色层析带漆酶溶液。酶溶液加载到cmsephadexc-50阳离子交换柱上,用1.0l0.01mol/lph=5.5的磷酸盐缓冲溶液洗脱,然后将缓冲液的浓度提高至0.15mol/l继续洗脱,收集蓝色流出液,该流出液采用葡聚糖凝胶g-25层析柱脱盐后冷冻干燥得漆酶纯品,得率0.35%。该纯漆酶中铜的质量百分含量为2.28‰,280nm与614nm处吸光度比值(a280nm/a614nm)为18.58。所有步骤都是在温度4-5℃左右的环境温度下进行的。
实施例3
将上述丙酮粉末加2.0l0.01mol/lph=6.0的磷酸盐缓冲溶液,搅拌过夜后离心并抽滤。滤液加载到sephadexg-100凝胶柱,以0.01mol/lph=6.0的磷酸盐缓冲溶液洗脱,恒流泵流速控制在20-26ml/h,收集蓝色层析带漆酶溶液。酶溶液加载到cmsephadexc-25阳离子交换柱上,恒流泵流速控制在300-350ml/h,用1.0l0.01mol/lph=6.0的磷酸盐缓冲溶液洗脱,然后将缓冲液的浓度提高至0.10mol/l继续洗脱,收集蓝色流出液,将该漆酶溶液装入透析袋(切割分子量10000da)中,对0.01mol/lph=6.0的磷酸盐缓冲溶液透析24h,继续对蒸馏水透析48h,最后冷冻干燥即得固体漆酶纯品,得率0.30%。该纯漆酶中铜的质量百分含量为2.31‰,280nm与614nm处吸光度比值(a280nm/a614nm)为18.99。所有步骤都是在温度4-5℃左右的环境温度下进行的。
实施例4
将上述丙酮粉末加入到2.0l0.01mol/lph=6.5的磷酸盐缓冲溶液,搅拌过夜后离心并抽滤。滤液加载到sephadexg-100凝胶柱,用0.01mol/lph=6.5的磷酸盐缓冲溶液洗脱,恒流泵流速控制在20-26ml/h收集蓝色层析带漆酶溶液。酶溶液加载到cmsephadexc-50阳离子层析柱,用1.0l0.05mol/lph=6.5的磷酸盐缓冲溶液洗脱,恒流泵流速控制在240-300ml/h,然后将缓冲液的浓度提高至1.0mol/l继续洗脱,收集蓝色流出液,该流出液采用pall-gelman超滤仪超滤(膜包mw10000da)脱盐后冷冻干燥得漆酶纯品,得率0.34%。该纯漆酶中铜的质量百分含量为2.30‰,280nm与614nm处吸光度比值(a280nm/a614nm)为19.51。所有步骤都是在温度4-5℃左右的环境温度下进行的。
所得的漆酶纯品gpc谱图可见图1,控制流速为1ml/min,漆酶进样后洗脱6.5min时出现了漆酶纯品的单峰。以0.6mm的对苯二胺为底物,在500nm处用分光光度法测定酶活性,活性可达28700u/g。
对比例1
将上述适量丙酮粉末加入2.0l0.01ml/l的磷酸盐缓冲溶液(ph5.8)中搅拌4h后过滤得到墨绿色的漆酶提取液。漆酶提取液上sephadexg-75凝胶柱,以0.01mol/l的磷酸盐缓冲溶液(ph5.8)洗脱,收集蓝色层析带漆酶溶液。
将经sephadexg-75分离的蓝色漆酶溶液加载到cmsephadexc-50阳离子交换柱,然后用1.0l的0.05mol/l的磷酸盐缓冲溶液(ph5.8)洗柱,随后用0.1mol/l的磷酸盐缓冲溶液(ph5.8)洗脱柱上的蓝带,即得漆酶溶液。将该漆酶溶液装入透析袋(切割分子量10000da)中,对0.01mol/lph=5.8的磷酸盐缓冲溶液透析24h,继续对蒸馏水透析48h,最后冷冻干燥即得固体漆酶纯品,得率0.21%。该纯漆酶中铜的质量百分含量为1.99‰,280nm与614nm处吸光度比值(a280nm/a614nm)为18.17。所有步骤都是在温度4-5℃左右的环境温度下进行的。
对比例1与实施例1相比,区别在于,将葡聚糖凝胶g-100换成葡聚糖凝胶g-75,结果会发现葡聚糖凝胶g-75分离时会残留较多的多糖级分,直接造成在过c-50时凝胶塌陷,分离效率大大降低,所分离出的漆酶样品得率减少且纯度降低。
对比例2
将上述适量丙酮粉末加入到2.0l0.01mol/lph=6.5的磷酸盐缓冲溶液,搅拌过夜后离心并抽滤。滤液加载到cmsephadexc-50阳离子层析柱,用1.0l0.05mol/lph=6.5的磷酸盐缓冲溶液洗脱,恒流泵流速控制在240-300ml/h,然后将缓冲液的浓度提高至1.0mol/l继续洗脱,收集蓝色流出液。酶液加载到sephadexg-100凝胶柱,用0.01mol/lph=6.5的磷酸盐缓冲溶液洗脱,恒流泵流速控制在20-26ml/h收集蓝色层析带漆酶溶液。该流出液采用pall-gelman超滤仪超滤(膜包mw10000da)脱盐后冷冻干燥得漆酶,得率0.24%。该漆酶中铜的质量百分含量为2.00‰,280nm与614nm处吸光度比值(a280nm/a614nm)为18.92。所有步骤都是在温度4-5℃左右的环境温度下进行的。
对比例2与实施例4相比,区别在于,先进行cmsephadexc-50阳离子交换柱分离、后经过sephadexg-100凝胶柱分离。结果会发现直接进行cmsephadexc-50阳离子交换柱,酶液中的多糖会对树脂产生很大的损害,直接导致凝胶不可再次使用,而且多糖组分对凝胶产生较大的压力以至于酶液中的部分大分子杂质随着漆酶组分同时洗脱出来,所以漆酶不纯。此时再过sephadexg-100凝胶柱,由于不纯物的分子量和漆酶差不多,所以过sephadexg-100凝胶柱并不能很好分去大分子杂质,导致过sephadexg-100凝胶柱后获得的漆酶依然不纯。这就需要再次过cmsephadexc-50阳离子交换柱才能将多糖组分分离。这样提高了实验成本且所得漆酶得率低、纯度低。
所述的实施例为本发明的优选的实施方式,但本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员能够做出的任何显而易见的改进、替换或变型,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!