一种适用于胰腺导管腺癌诊断及预后判断的血浆外泌体miRNA标志物及应用的制作方法
本发明涉及医学生物检测技术领域,具体地说,是一种适用于胰腺导管腺癌的诊断及预后判断的血浆外泌体mirnas标志物及检测应用。
背景技术:
胰腺导管腺癌(pancreaticductaladenocarcinoma,pdac)是美国第四大癌症相关死亡原因,预计到2020年将上升至第2位(siegelrl,millerkd,jemala.cancerstatistics,2018[j].cacancerjclin,2018,68(1):7-30.)。延误诊断丧失手术机会是影响pdac生存率的一个重要原因。pdac转移患者的中位生存期在6到12个月,而pdac患者总体的5年生存率为8%(siegelrl,millerkd,jemala.cancerstatistics,2018[j].cacancerjclin,2018,68(1):7-30)。
在临床上,pdac与慢性胰腺炎(chronicpancreatitis,cp)鉴别诊断较为困难,这也是pdac误诊的重要原因。pdac组织周围可发生炎症改变,而复发性cp也可进展为pdac。高分辨率ct、核磁共振成像(mri)、正电子发射断层扫描(pet)等影像学检查是诊断pdac的良好工具。但是影像学检查也难以完全将pdac于cp区分开,尤其是肿块性慢性胰腺炎。超声内镜引导下细针穿刺活检(eus-fna)也是诊断pdac的重要方法,但是作为一种侵入性检查,它存在诱发感染、出血和肿瘤播散的风险。重要的是,eus-fna对胰腺癌的诊断存在一定的假阴性率。在一项研究中,用eus-fna对317名患者穿刺后进行病理检查,其中13%诊断为良性病变的患者最终被证实为恶性(layfieldlj,doddl,factorr,etal.malignancyriskassociatedwithdiagnosticcategoriesdefinedbythepapanicolaousocietyofcytopathologypancreaticobiliaryguidelines[j].cancercytopathol,2014,122(6):420-427)。作为临床最常用用于胰腺癌诊断的血液学标志物,ca19-9的高低会受患者胆红素水平的影响,另外,人群中10%lewis抗原阴性的个体ca19-9也不会出现升高,这限制了ca19-9在pdac诊断中的应用。因此,我们需要新的敏感性和特异性高的生物标志物来辅助pdac的准确诊断。
但是目前还没有pdac诊断及预后试剂盒的报道,若能够开发相关试剂盒,并用于临床,必将对pdac的临床诊断及治疗产生重要的指导作用。
技术实现要素:
外泌体是30-100纳米的细胞外囊泡,存在于各种体液中。几乎所有的细胞都可以分泌外泌体,而不同来源的外泌体组成成分(主要为蛋白质及核酸)是有区别的。mirna参与细胞的发育和分化,其在外泌体中较为丰富,且可以被外泌体的脂质双分子层结构保护而避免被分解。既往的研究已经证实,在pdac组织与正常组织中,mirna表达是不同的。bloomston等人发现,相对于正常胰腺组织,在pdac组织中有21个mirna是过表达的,4个mirna是低表达的(bloomstonm,frankelwl,petroccaf,etal.micrornaexpressionpatternstodifferentiatepancreaticadenocarcinomafromnormalpancreasandchronicpancreatitis[j].jama,2007,297(17):1901-1908)。因此,本发明认为,可以通过检测释外周血中的pdac组织细胞分泌的外泌体mirna,来将pdac患者与cp患者区分开来。通过外周血检测,可以避免对病人造成更大的创伤;同时相对于pet-ct等影像学检查,外周血检测的费用相对较低。通过检测外泌体中的mirna,而不是直接检测血浆中的mirna,保证了检测结果的稳定性和特异性。
本发明的目的在于针对上述技术问题,提供一种与胰腺导管腺癌的诊断及预后判断相关的血浆外泌体mirnas标志物,及其在制备pdac诊断及预后判断相关试剂或试剂盒中的应用。
为了实现上述目的,本发明的第一方面,提供用于胰腺导管腺癌的诊断及预后判断的血浆外泌体mirnas标志物:包括mirna-95-3p、mirna-26b-5p、mirna-335-5p。
所述的mirna-95-3p,accessionnumber:mimat0000094,具体序列如下:
uucaacggguauuuauugagca(seqidno:1)。
所述的mirna-26b-5p,accessionnumber:mimat0000083,具体序列如下:
uucaaguaauucaggauaggu(seqidno:2)。
所述的mirna-335-5p,accessionnumber:mimat0000765,具体序列如下:
ucaagagcaauaacgaaaaaugu(seqidno:3)。
mirna-95-3p在pdac患者血浆外泌体中的表达水平高于正常人和慢性胰腺炎患者;mirna-26b-5p在pdac患者血浆外泌体中的表达水平低于正常人和慢性胰腺炎患者;mirna-335-5p表达水平与pdac患者生存期正相关。因此,通过检测血浆中mirna-95-3p、mirna-26b-5p、mirna-335-5p的表达水平,可以辅助pdac的诊断及鉴别诊断,并评估pdac患者的预后。
本发明的第二方面,提供上述血浆外泌体mirna标志物在制备胰腺导管腺癌诊断及预后判断的试剂或试剂盒中的应用。
进一步的,所述的试剂或试剂盒为血浆学检测试剂或检测试剂盒。
进一步的,所述的试剂或试剂盒检测血浆外泌体中mirna-95-3p、mirna-26b-5p、mirna-335-5p中的一种或两种以上的mirna的表达量。
进一步的,所述的诊断试剂或试剂盒为采用二代测序(next-generationsequencing)方法检测mirna表达量的试剂或试剂盒。
更进一步的,所述的试剂或试剂盒检测血浆外泌体中mirna-95-3p和mirna-26b-5p的表达量。为了使所有样本的表达标准化,我们选择了一组至少在所有样本中有一个片段表达的mirna作为管家mirna。将每个样本中第75百分位的管家mirna表达量作为衡量其它mirna表达量的“度量因子”。我们对每个mirna的标准化:标准化表达量=mirna的片段数目/度量因子。当mirna-95-3p/mirna-26b-5p的标准化表达量比值高于0.06时,诊断胰腺导管腺癌风险较大;如果mirna-95-3p/mirna-26b-5p的标准化表达量比值低于0.06时,诊断胰腺导管腺癌风险小。
更进一步的,所述的试剂或试剂盒检测血浆外泌体中mir-335-5p的表达量。当mir-335-5p的标准化表达量高于1.37时,诊断胰腺导管腺癌发生转移可能性大,预后较差,患者生存期相对较短;当mir-335-5p的标准化表达量低于1.37时,诊断胰腺导管腺癌未发生转移可能性大,预后较好,患者生存期相对较长。
进一步的,所述的试剂或试剂盒包括:对mirna-95-3p、mirna-26b-5p、mirna-335-5p中的一种或两种以上具有检测特异性的探针、基因芯片,或pcr引物。
进一步的,所述的试剂或试剂盒为采用real-timert-pcr(qpcr)方法检测血浆外泌体中mirna表达量的试剂或试剂盒。
本发明的第三方面,提供一种针对胰腺导管腺癌的诊断及预后判断的试剂盒,所述的试剂盒中包括用于检测血浆外泌体中mirna表达量的试剂,所述的mirna选自mirna-95-3p、mirna-26b-5p、mirna-335-5p中的一种或两种以上。
进一步的,所述的用于检测mirna表达量的试剂为采用real-timert-pcr(qpcr)方法检测mirna表达量的试剂。
本发明的第四方面,提供检测mirna-95-3p、mirna-26b-5p、mirna-335-5p表达水平的试剂在制备诊断及预后判断胰腺导管腺癌的试剂盒的用途。
本发明的试剂盒通过检测血浆外泌体中mirna-95-3p、mirna-26b-5p、mirna-335-5p的表达水平,可以辅助胰腺导管腺癌的诊断,并判断其预后:如果mirna-95-3p/mirna-26b-5p高于0.06,则胰腺导管腺癌风险较大;如果mirna-95-3p/mirna-26b-5p低于0.06,则胰腺导管腺癌风险小;如果mirna-335-5p高于1.37,则该胰腺导管腺癌患者生存期相对较长;如果mirna-335-5p低于1.37,则该胰腺导管腺癌患者生存期相对较短。
本发明的技术方案包括:(1)建立统一标准的标本采集及处理程序,即标准化操作程序(sop);(2)建立系统的待测者临床信息取样流程及资料保管储存程序;(3)血浆外泌体mirna筛查试剂盒的研制:根据胰腺导管腺癌和慢性胰腺炎及健康人对照的特异血浆外泌体mirna,开发mirna对于胰腺导管腺癌的诊断及预后判断试剂盒。
本发明可用于对胰腺导管腺癌高危人群进行诊断及预后判断,本发明通过检测上述外泌体mirna的血浆含量,同时将mirna-95-3p含量比上mirna-26b-5p的含量,得到新的比值,比值大于0.06,则胰腺导管腺癌风险较大;比值小于0.06,则胰腺导管腺癌风险小;而mirna-335-5p的含量高,则该胰腺导管腺癌患者生存期长,预后好。此应用可辅助胰腺癌的临床诊断及预后判断,提高胰腺导管腺癌的诊断准确性,减少误诊、漏诊造成的患者治疗的延误,以期提高患者的手术率和生存率。
本发明的有益效果在于:本发明首次发现了对胰腺导管腺癌有诊断及预后判断价值的血浆外泌体生物标记物,包括mirna-95-3p、mirna-26b-5p、mirna-335-5p;通过血浆外泌体mirna标志物和诊断试剂盒的研制和应用,可以使胰腺导管腺癌的诊断更加方便易行,为临床医生快速并准确掌握患者病情及提高临床治疗效果奠定基础,同时对上述mirna在胰腺导管腺癌发生发展机制的研究可能会为其治疗提供新的方式。
附图说明
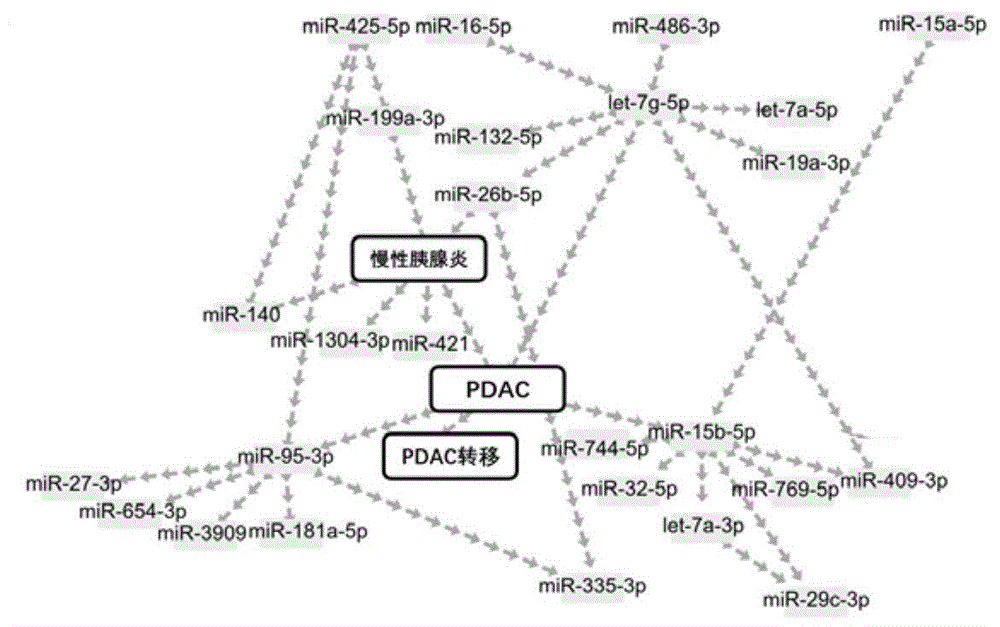
图1.用贝叶斯网络分析“癌”(是否有pdac)、“胰腺炎”(是否有胰腺炎)、“转移”(是否有转移性pdac)的上下游因子。整个贝叶斯网络由337个节点和713条边组成。从整个网络中提取出包括“pdac”节点在内的子网络,以及“pdac”节点的原因和后果。“pdac”的上游有let-7g-5p和“慢性胰腺炎”,提示pdac与let-7g-5p和慢性胰腺炎2个因素有关。“pdac”的下游有3个因子:“pdac转移”、mir-95-3p和mir-15b-5p。
图2.mir-95-3p/mir-26-5p的比值可以作为pdac与慢性胰腺炎的鉴别诊断的指标。为了发现pdac的潜在生物标志物,我们用训练组建立了模型,并在验证组进行了验证。每个mirna的预测准确性用roc分析中曲线下面积(auc)表示。两组中auc高且稳定的标志物为候选标志物(图2a),其中mir-95-3p在pdac患者中高表达(图2d)。由于血浆外泌体mirna可能有不同的来源,对所有mirna使用相同的度量因子进行标准化可能并不适用。与定量pcr(quantitativepcr,qpcr)的标准化类似,可以选择一对mirna,其中一个mirna被认为是目标基因,另一个被认为是参考基因。将目标基因表达量除以参考基因表达量所得的值可视为生物标志物。我们选择那些高表达的mirna(平均表达量≥50),并计算所有可能的成对mirna在两个组中的预测精度(图2b)。肿瘤的下游因子之一的mir-95-3p和胰腺炎的上游因子之一的mir-26b-5p,平均auc为0.92,在所有组合中排名第二。mir-26b-5p和mir-95-3p的失调趋势相反(图2c和2d)。两个mirna的比值(mir-95-3p/mir-26-5p)为两个队列提供了更准确、稳定的预测(图2e)。将其界值设为0.06,其训练组的敏感性和特异性为81.5%、93.3%,试验组为86.7%、100%。
图3.mir-335-5p可用于对pdac预后的判断。在两个队列中,5对mirna的平均auc均大于0.8(图3a)。所有5对mirna都含有mir-335-5p。实验验证的mir-335-5p的靶点主要富集于类固醇生物合成和ecm受体相互作用(图3b)。tcga数据库中对胰腺癌肿瘤组织mirna测序显示,mir-335-5p表达>第80百分位的患者,相对于其表达<20%的患者,中位生存期明显延长(图3c)。在5对mirna中,“癌”下游节点之一的mir-95-3p的auc不是最高的,但在两组队列中显示出最稳定诊断效果(图3d)。以1.37为界值,区分转移患者与非转移患者,训练组的敏感性为72.7%,验证组为83.3%,特异性为81.3%,72.2%。此外,mir-95-3p/mir-335-5p也可检测到医学影像学无法发现的转移(图3e)。一般来说,影像学转移患者的mir-95-3p/mir-335-5p水平略低于手术转移患者。手术转移患者的敏感性为78.6%,略低于影像学转移患者的敏感性(88.9%)。在这两个队列中,49名患者接受了手术,这些患者中mir-335-5p低于1.37的患者os(中位os,243天)较高于1.37的患者os(中位os,408天)更差,p值为0.027(图3f)。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等《分子克隆:实验室指南》(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照常规条件,或按照制造厂商所建议的条件。
实施例1
一、研究对象:研究pdac与慢性胰腺炎血浆外泌体mirna表达谱的不同
本发明于2017年6月至2018年6月共纳入训练组和验证组141例(图1),剔除非pdac、样本严重溶血(5级以上或5级以上)的标本后,纳入患者共90例。90例pdac或cp患者血样取自长海医院临床血样库。
二、研究方法
1.在患者入院后药物及手术治疗前,进行血样采集;每个病人抽5ml外周静脉血,用真空抗凝管储存(ref367863;bectondickinson,franklinlakes,nj,usa)。血样在1小时内放入4℃储存。
2.血浆的纯化:样品在4℃、1600×g离心10分钟,记录溶血情况,本研究采用溶血水平低于4级的样品。收集到的上层清液在4℃、16000×g离心15分钟,然后取1毫升上层清液储存在1.5毫升,保存在-80℃冰箱。
3.外泌体的纯化:血浆样本在4℃、12000×g离心10分钟后。然后,上层清液被转移到一个0.45-μm管过滤器(cls8163-100ea;costar,corning,ny,usa),接着转移到一个0.22-μm管过滤器(cls8161-100ea;costar),在4℃、12000×g离心5分钟。接下来,在1.5ml试管中将四分之一的外泌体纯化剂(l3525;3dmed,shanghai,china)加入上清液中。混合物在4℃放置30分钟,然后在4℃、4700×g离心30分钟。去除上清液,将含有外泌体的颗粒重新悬浮在0.2ml磷酸盐缓冲盐水(pbs)中。
4.从外泌体中提取mirna:根据制造商的方案,使用mirneasy血清/血浆试剂盒(217184;qiagen,shanghai,china)从血浆纯化的外泌体中提取mirna。mirna的质量、产量和分布采用agilent2100小型rna芯片生物分析仪进行分析(5067-1548;agilent,savage,md,usa)。
5.mirna测序:按照制造商的方案使用nebnext,multiplexsmallrnalibraryprepsetforillumina(e7300l;newenglandbiolabs,ipswich,ma,usa)建立mirna文库。dna的质量、产量和分布使用
6.数据分析:为了使所有样本的表达标准化,我们选择了一组至少在所有样本中有一个片段表达的mirna作为管家mirna。将每个样本中第75百分位的管家mirna表达量作为衡量其它mirna表达量的“度量因子”。我们对每个mirna的标准化:标准化表达量=mirna的片段数目/度量因子。在主成分分析(principalcomponentanalysis,pca)中,为了避免高表达mirna的偏倚,我们对每个mirna的标准化表达进行了缩放。对每个mirna,找出其表达的最大标准值,对每个表达值除以这个最大标准值,完成其缩放。利用r3.3.3中的prcomp函数对缩放后的数据进行主成分分析。根据mirna的中位数离散每个mirna的标准值,从而构建贝叶斯网络。大于或等于中位数的值被归类为高,否则被归类为低。然后,用离散化后的值对贝叶斯网络进行训练,使用r语言中的bnlearnv4.2包中的中的“bn.fit”函数中的“tabu”算法。
三、研究结果
如图2所示:为了发现pdac的潜在生物标志物,我们用训练组建立了模型,并在验证组进行了验证。每个mirna的预测准确性用roc分析中曲线下面积(auc)表示。两组中auc高且稳定的标志物为候选标志物(图2a),其中mir-95-3p在pdac患者中高表达(图2d)。由于血浆外泌体mirna可能有不同的来源,对所有mirna使用相同的方法进行标准化可能并不适用。与定量pcr(quantitativepcr,qpcr)的标准化概念类似,可以选择一对mirna,其中一个mirna被认为是目标基因,另一个被认为是参考基因。将目标基因表达量除以参考基因表达量所得的值可视为生物标志物。我们选择那些高表达的mirna(平均表达量≥50),并计算所有可能的成对mirna在两个组中的预测准确度(图2b)。肿瘤的下游因子之一的mir-95-3p和胰腺炎的上游因子之一的mir-26b-5p的组合,平均auc为0.92,在所有组合中排名第2。mir-26b-5p和mir-95-3p的失调趋势相反(图2c和2d)。两个mirna的比值(mir-95-3p/mir-26-5p)为两个队列提供了更准确、稳定的预测(图2e)。将其界值设为0.06,其训练组的敏感性和特异性为81.5%、93.3%,试验组为86.7%、100%。
上述结果显示血浆外泌体mir-95-3p/mir-26-5p比值对pdac的诊断及鉴别诊断有重要意义。
实施例2:找出可以诊断pdac转移与否的mirna标志物并与预后关联
一、研究对象
本研究于2017年6月至2018年6月共纳入训练组和验证组141例(图1),剔除非pdac、样本严重溶血(5级以上或5级以上)的标本后,余下患者共90例,其中pdac患者65例,未转移34例,转移21例。患者血样取自长海医院临床血样库。
二、研究方法
同实施例1。
分析转移与未转移pdac之间血浆外泌体mirna表达的异同,对找出的mirna进行通路富集分析;在tcga数据中分析,分析组织同mirna不同表达的个体之间预后的差异。
三、研究结果
如图3所示:在两个队列中,5对mirna的平均auc均大于0.8(图3a)。所有5对mirna都含有mir-335-5p。实验验证的mir-335-5p的靶点主要富集于类固醇生物合成和ecm受体相互作用(图3b)。tcga数据库中对胰腺癌肿瘤组织mirna测序显示,mir-335-5p表达>第80百分位的患者相对于其表达<20%的患者,中位生存期明显延长(图3c)。在5对mirna中,“癌”下游节点之一的mir-95-3p的auc不是最高的,但在两组队列中显示出最稳定诊断效果(图3d)。以1.37为界值,区分转移患者与非转移患者,训练组的敏感性为72.7%,试验组为83.3%,特异性为81.3%,72.2%。此外,mir-95-3p/mir-335-5p也可检测到医学影像学无法发现的转移(图3e)。一般来说,影像学转移患者的mir-95-3p/mir-335-5p水平略低于手术转移患者。手术转移患者的敏感性为78.6%,略低于影像学转移患者的敏感性(88.9%)。在这两个队列中,49名患者接受了手术,这些患者中mir-335-5p低于1.37的患者os(中位os,243天)较高于1.37的患者os(中位os,408天)更差,p值为0.027(图3f)。
上述结果显示,mir-335-5p可用于识别pdac是否发生转移,并对pdac预后进行判断。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
序列表
<110>上海长海医院
<120>一种适用于胰腺导管腺癌诊断及预后判断的血浆外泌体mirna标志物及应用
<130>/
<160>3
<170>siposequencelisting1.0
<210>1
<211>22
<212>rna
<213>智人(homosapiens)
<400>1
uucaacggguauuuauugagca22
<210>2
<211>21
<212>rna
<213>智人(homosapiens)
<400>2
uucaaguaauucaggauaggu21
<210>3
<211>23
<212>rna
<213>智人(homosapiens)
<400>3
ucaagagcaauaacgaaaaaugu23
- 还没有人留言评论。精彩留言会获得点赞!