一株微小杆菌及其作为益生菌在水产上的应用的制作方法
本发明涉及一种微小杆菌及其作为益生菌在水产上的应用,属于菌种技术领域。
背景技术:
微小杆菌(exiguobacteriumspp.)是由collins等于1983年首次鉴定并命名的。该属微小杆菌具有广阔的生境,其生长环境温度范围为-12~55℃(vishnivetskaya等,2009)。国内外已有从多种不同环境分离该属不同种菌的报道,如土壤、养殖环境、大气气溶胶等(selvakumar等,2009;胡晓娟等,2014;夏晓敏等,2010),也包括多种极端环境中,如美国黄石公园热泉、格陵兰岛冰核、西伯利亚永久冻土等(knudston等,2001;miteva等,2004;rodriguez等2006)。目前发现的e.spp.绝大多数为革兰氏阳性菌,通常呈杆状,也有一些菌种在对数生长期及稳定生长期呈球杆状,不形成芽孢,是一类兼性厌氧菌。在营养培养基上形成的菌落多为规则圆形,有氧条件下表现为浅黄色、橘黄色等,且色素不扩散(fruhling等,2002;chaturvedi等,2008)。目前e.spp.已经分离鉴定出14个菌种,e.aurantiacum(collinsetal.1983),e.mexicanum和e.artemiae(lopez-cortesetal.2006),e.aestuarii和e.marinum(kimetal.2005),e.profundum(crapartetal.2007),e.indicum(chaturvediandshivaji2006),e.sibiricum(rodriguesetal.2006),e.oxidotolerans(yumotoetal.2004),e.undae和e.antarcticum(fruhlingetal.2002),e.acetylicum(farrowetal.1994),e.soli(chaturvedietal.2008)和e.aquaticum(raichandetal.2012)。
微小杆菌可分泌具有多种功能作用的酶类,其在降解有机污染物、重金属污染修复、食品加工等领域已得到应用。胡江等(2004)在除草剂污染的土壤中分离得到1株能够以阿特拉津为唯一碳源氮源生长的exiguobacteriumsp.btah1株,该菌株能够在126h内完全降解1000mg/l的阿特拉津;okeke等(2008)和张莹等(2014)分别报道了exiguobacteriumsp.gs1和exiguobacteriumsp.mh3具有很好去除cr6+的能力,具有重金属污染的修复能力;sorokulova等(2009)报道了e.acetylicum可以在发酵时对虾壳废料进行高效的脱蛋白和去矿化的作用,实现从几丁质丰富的废料中提取几丁质的目的;时胜男等(2010)利用青霉菌qq与exiguobacteriumsp.tl协同脱色偶氮染料活性深蓝k-r,两者在优化条件下,脱色率均可达到90%以上;谭靓等(2011)报道了1株耐盐偶氮还原菌exiguobacteriumsp.tl株,利用该菌与作为氧化还原介体的蒽醌联合强化活性污泥,可以有效提高含有高盐活性鲜红x-3b染料废水的脱色效率,所建立强化工艺启动时间可约有3d缩短,而脱色效率最高可达约1000mg/(g·d);乔宇等(2012)从自然界中筛选的exiguobacteriumsp.h4株可产能分解支链淀粉的普鲁兰酶,可用于淀粉为原料的食品加工等行业,能大规模提高淀粉的利用率和生产效率。微小杆菌还具有植物根际促生菌(plantgrowthpromotingrhizobacteria,pgpr)的作用,bharti等(2013)从盐碱土中植物根际分离到的e.oxidotoleransstr36株,可分泌丰富的胞外多糖,具有显著的缓解高盐对植物体的胁迫的作用。str36菌接种的原生盐碱土、次生盐碱土中的印度草药婆罗米(bacopamonnieri)植株生物量比未接菌分别高出109%和138%,而且该植物体中的活性物质三萜皂甙bacoside-a含量也分别有36%和76%的提高。微小杆菌在水产养殖上应用报道较少,胡晓娟等(2014)从罗非鱼(tilapianilotica×t.aurea)养殖系统中分离的2株微小杆菌属d45和d51株,具有降解养殖池塘有机物,改善水质的作用。
近年来,水产病害已对水产养殖的健康可持续发展构成严重威胁,开发针对水产病原的有效防控方法的应用研究,是水产业健康可持续发展的迫切要求。以虾类养殖业为例,已知的虾类疫病多达10种,且近年呈现多病原感染的趋势。其中上个世纪90年代报道的白斑综合症(whitespotsyndrome,wss),以及近些年来相继发现的肝胰腺微孢子虫病(hepatopancreaticmicrosporidiosis,hpm)和急性肝胰腺坏死病(acutehepatopancreaticnecrosisdisease,ahpnd)的3种疫病,分别是当前虾类产业中重要的病毒病、寄生虫病和细菌病,其病原分别是由白斑综合症病毒(whitespotsyndromevirus,wssv)、虾肝肠胞虫(enterocytozoonhepatopenaei,ehp)和携带着编码毒力蛋白pirvp的质粒的部分弧菌所引起的。该3种病原也是当前我国虾类疫病中有着很高阳性检出率及危害的重要病原,据《2016年中国水生动物卫生状况报告》报道,2016年我国开展的白斑综合症的主动监测范围包括天津等12个省(自治区、直辖市),661个监测养殖场点的平均阳性养殖场点检出率为16.2%,997批次样品的平均阳性样品检出率为12.9%。而被动监测中,507批次样品中的虾肝肠胞虫阳性率为30.9%,501批次的急性肝胰腺坏死性病的阳性率为22.5%。
益生菌(probiotics)作为活体微生物制剂,具有促进营养物质的消化吸收而促生长,其本身也可作为营养物质而被机体吸收;分泌拮抗物质或争夺生态位抑制有害微生物而优化菌群结构;激发机体的非特异性免疫提高抗病力,其在水产养殖中的应用也为水产病害的防控提供了一种方法。我们在2014年11月从对虾养殖池塘的底泥中分离到一株微小杆菌20141109005株,其保藏编号为:cgmccno.16066,人工感染实验结果表明,该菌株对凡纳滨对虾(litopenaeusvannamei)没有致病作用;该菌株具有胞外蛋白酶活性。该菌株添加到对虾饲料中,投喂携带有致急性肝胰腺坏死病副溶血弧菌、白斑综合症病毒、虾肝肠胞虫的凡纳滨对虾幼虾60天后,可不同程度提高实验对虾血清蛋白浓度,以及超氧化物歧化酶活力、过氧化物酶活力、溶菌酶和酸性磷酸酶活力等免疫酶活性,成活率、生长率和单位水体产量也较对照组有显著提高,并可有效降低饲料系数。上述结果说明本发明日微小杆菌20141109005株可提高水生动物的抗病力和生长性能,具有水产益生菌的开发应用前景。
技术实现要素:
本发明的目的是提供一株微小杆菌及其作为益生菌在水产上的应用。
一株微小杆菌(exiguobacteriumsp.),菌株的分类命名为:微小杆菌(exiguobacteriumsp.)20141109005株;于2018年7月6号在中国微生物菌种保藏管理委员会普通微生物中心保藏;保藏编号为:cgmccno.16066;保藏单位地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
所述微小杆菌20141109005株于2014年11月从一个对虾养殖池塘的底泥中分离得到,该菌株不具有致病性,凡纳滨对虾在1.0×108cfu/ml的浓度的该菌株中浸浴浸泡72h后也是安全的。
所述微小杆菌20141109005株,可培养于2216e海水培养基,培养方法如下:从-80℃保存的菌种中挑取少量接种于液体培养基或固体平板,培养温度范围可以为20—37℃。其中液体培养中,180r/min摇瓶培养至od600为0.5—0.6,即可获得该菌株的新鲜菌液。
所述微小杆菌20141109005株的16srrna和23srrna的碱基序列如seqidno:1和seqidno:2所示,这些基因具有该菌株的特征性。
所述微小杆菌20141109005株,可产生胞外蛋白活性物质,具有胞外蛋白酶活性。
所述微小杆菌20141109005株,以及该菌株的各类产物和/或其产物的改造物,对对虾类不具有致病性。
所述的微小杆菌20141109005株,以及该菌株的各类产物和/或其产物的改造物,对水生动物的病毒和细菌疾病具有抗病作用。所述水生动物的病毒和细菌疾病可以为白斑综合征病毒(wssv)、虾血细胞虹彩病毒(shrimphemocyteiridescentvirus,shiv)、传染性皮下及造血组织坏死病毒(infectioushypodermalandhematopoieticnecrosisvirus,ihhnv)、偷死野田村病毒病(covertmortalitynodavirus,cmnv)、黄头病毒(yellowheadvirus,yhv)、桃拉综合征病毒(taurasyndromevirus,tsv)等虾类病毒、神经坏死病毒(nervousnecrosisvirus)、传染性脾肾坏死病毒(infectiousspleenandkidneynecrosisvirus,isknv)等鱼类病毒等所引起的病毒病,哈维氏弧菌(vibrioharveyi)、副溶血弧菌(v.parahaemolyticus)、坎贝氏弧菌(v.campbellii)、发光杆菌、爱德华氏菌(edwardsiella)、鳗弧菌(v.anguillarum)、溶藻弧菌(v.alginolyticus)和嗜水气单胞菌(aeromonashydrophila)等引起的细菌病。所述的水生动物的细菌疾病,其特征在于也可以为携带具有编码pira和/或pirb毒素基因的质粒的弧菌引起的急性肝胰腺坏死病,该类弧菌可以为v.parahaemolyticus,v.campbellii和v.owensii等,也可以是其他尚未发现和报道的携带具有编码pira和/或pirb毒素的基因的细菌。
该菌株应用中,添加饲料后中投喂对虾,可不同程度的提高携带多病原感染对虾的血清蛋白浓度、免疫酶活性和成活率,所述的携带病原可以是白斑综合征病毒、虾肝肠胞虫,以及可引起对虾急性肝胰腺坏死病的细菌,所述的免疫酶可以为氧化物歧化酶活力、过氧化物酶活力、溶菌酶和酸性磷酸酶活力等,所述的对虾携带的病原也可以是虾类的其他病原的一种或多种;该菌株添加饲料中投喂对虾,可显著提高对虾的成活率、生长率和单位水体产量,并可有效降低饲料系数。
一种如上述所述的微小杆菌cgmccno.16066株作为水生动物益生菌的应用,所述菌株具有促进水生动物生长的作用。
所述微小杆菌20141109005株,在应用中可影响水生对物的肠道内定植的优势菌群种类,这种影响与提高对虾免疫力和生长性能相关。
所述微小杆菌20141109005株,作为水生动物益生菌的应用,可采用注射、口服和浸泡的方式。注射可采用腹腔或肌肉注射两种方式,该方式下菌株使用的剂量为104—108cfu/g(菌落形成单位/鱼体体重),注射1次后的14—30天也可进行2次注射;口服方式中,该菌株在配合饲料中的添加剂量为104-1011cfu/g(菌落形成单位/饲料重量),连续投喂14天及以上;浸泡方式中,该菌株在养殖水体中的浓度为104-109cfu/ml(菌落形成单位/浸泡水体体积)的浓度,浸泡时间60min及以上。
所述微小杆菌20141109005株,作为水生动物益生菌的应用,所述的水生动物可以甲壳类、鱼类、两栖类和爬行类动物。不同的水生动物及其应用方式的不同,该菌株的应用剂量也有所不同,对于特定水生动物的在使用中的具体剂量,应该进行单独测试。
本发明的积极效果在于:本发明找到了1株水生动物的益生菌株,即微小杆菌20141109005株。以携带有3种病原的对虾为对象,进行了该株菌的益生菌的应用效果评估,3种病原包括有2种致病原,即白斑综合征病毒和可引起对虾急性肝胰腺坏死病原细菌,以及1种可引起感染对虾生长停滞的虾肝肠胞虫,结果发现本发明菌株添加饲料投喂对虾后,可显著提高对虾的成活率,并可提高生长率和单位水体产量,同时有降低饲料系数的效果。这一结果,为包括虾类在内的水生动物的疫病防控提供了一种有效的保护途径,其使用可减少或消除由于水生动物病原发生所致的消毒剂、抗生素等化学药物的滥用,显著提高水产养殖动物及其产品的安全,以及病原菌抗药性增加所带来的生物安全风险。
附图说明
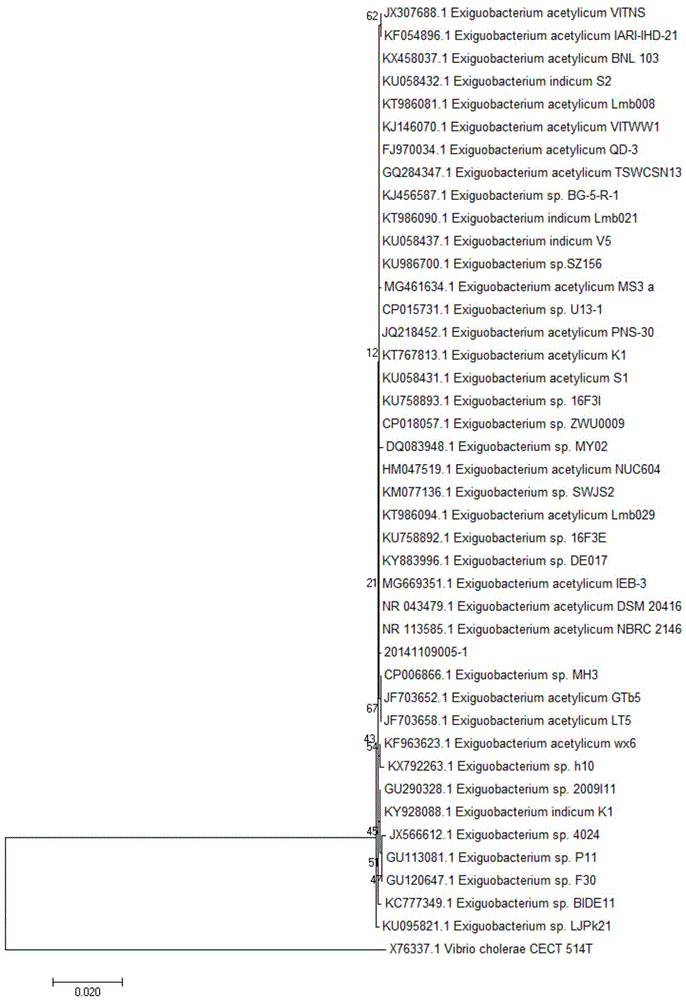
图1为微小杆菌20141109005株的16srrna基因序列系统发育树。
图2为微小杆菌20141109005株的23srrna基因序列系统发育树。
图3为微小杆菌20141109005株的蛋白酶效果图。
具体实施方式
为了使本发明目的、技术方案更加清楚明白,下面通过实施例,对本发明作进一步详细说明。所述保藏编号为cgmccno.16066的微小杆菌缩写为20141109005,下同。
实施例1:20141109005株的分离、培养及保藏
菌株分离及培养:20141109005株是2014年11月从一个对虾养殖池塘的底泥中分离得到。该菌株可用在以下培养进行培养。
2216e液体培养基:每100ml过滤后的海水加入0.5g蛋白胨,0.1g酵母膏,0.001g四水合磷酸铁,调节ph至7.6-7.8,121℃,20min灭菌后。
干酪素琼脂培养基:配制盐度约为16%的海水,每100ml该过滤海水中加入1.0g干酪素,0.3g牛肉浸膏,0.2g磷酸二氢钾,1.5g琼脂,调节ph至10.0,121℃,20min灭菌。
上述的液体培养基,加入2%的琼脂即可作为固体培养基。
菌株保藏:将离心去上清的20141109005株重悬于含有8—20%甘油的新鲜液体培养基中,并置于-80℃冰箱保存。
实施例2:基于20141109005株的16srrna基因的pcr扩增及其序列分析
(1)细菌dna的制备:细菌样品dna的制备采用天根生化科技(北京)有限公司的细菌基因组dna提取试剂盒(tianampbacteriadnakit)进行dna提取。
(2)pcr扩增:采用细菌16srrna基因的通用引物(27f/1492r)进行pcr扩增,pcr扩增反应体系如下:
上述的反应体系中的premixex
(3)系统发育学分析:考虑测序中,荧光染料的干扰可导致引物3'端后面的几十个碱基不一定能够准确判读的因素,实际序列比对中,对所获得的测序序列(1454bp)起始和末尾的约10—20bp碱基进行了去除,对剩下的1425bp碱基的序列(seqidno:1)在ncbi上进行同源性检索,并对其相关序列采用了clustalx(1.83)软件进行多序列比对,进一步采用mega7软件的邻接法(neighbor-joining,nj)构建系统发生树,并进行1000次的bootstraps重复检验,所获的系统进化树见图1。
结果表明20141109005株与微小杆菌属细菌exiguobacteriumsp聚类,其与exiguobacteriumsp.mh3株(cp006866.1)和exiguobacteriumacetylicumdsm20416株(nr_043479.1)等菌株的相似度达到99%,根据上述信息学的分析结果,20141109005株可确定为微小杆菌属细菌。
实施例3:基于微小杆菌20141109005株的23srrna基因的pcr扩增及其序列分析
(1)细菌dna的制备:同实施例2。
(2)pcr扩增:根据微小杆菌exiguobacteriumnio-1109株(genbank:lnql01000011.1)的序列,设计用于扩增其23srrna基因的引物,产物大小应为527bp,所设计引物序列如下:
ex-e-f:5'ctccgaatgccagcaactt3'
ex-e-r:5'ctatcctcctgcgtccccc3'
pcr扩增反应体系参见实施例2。pcr方法反应程序:94℃预变性4min,1个循环;94℃变性20s,55℃退火20s,72℃延伸30s,35个循环;72℃延伸5min,1个循环。所获pcr产物由生工生物工程(上海)有限公司进行dna测序。
(3)系统发育学分析:序列比对中,对所获得的522bp碱基的序列(seqidno:2)在ncbi上进行同源性检索,并对其相关序列采用了clustalx(1.83)软件进行多序列比对,进一步采用mega7软件的邻接法(neighbor-joining,nj)构建系统发生树,并进行1000次的bootstraps重复检验,所获的系统进化树见图2。
由图2可见,基于23srrna基因系统进化分析的结果中20141109005株与exiguobacteriumsp.zwu0009株(cp018057.1)和exiguobacteriumsp.u13-1株(cp015731.1)等菌株的相似度均达到99%,该结果也进一步确定了20141109005株确为微小杆菌属细菌。
实施例4:微小杆菌20141109005株蛋白酶活性检测
干酪素琼脂培养基配制:参考dang等(2009)方法配制酪蛋白平板(成分见实施例1),115℃,灭菌30min。
用无菌镊子夹取3片φ6mm无菌滤纸片在平板上等距离放置,取8μl微小杆菌20141109005株的新鲜菌液滴于滤纸片上,28℃培养24h后观察透明圈。另选用1株芽孢杆菌kl-y2013株和1株酵母菌kl-52016株作为对照菌株,操作方法同上。
如图3所示,实验结果发现,对照菌株中芽孢杆菌2016kl没有观察到透明圈,但酵母菌2017kl观察到透明圈。微小杆菌20141109005株可在酪蛋白平板上形成透明圈,该结果表明20141109005株具有胞外的蛋白酶活性。
实施例5:微小杆菌20141109005株生物安全性实验
评估菌株对水生动物的安全性,所选的水生动物为凡纳滨对虾。
微小杆菌20141109005以1.0×108cfu/ml的浓度,浸浴凡纳滨对虾,另设对照组。每组设3个平行,每个平行30尾虾,浸泡72h,记录对虾的活动及存活状况。实验结果中20141109005株并未引起任何对虾死亡和异常表征,该结果显示该株菌对凡纳滨对虾无致病性。
实施例6:饲料中添加微小杆菌20141109005株对对虾生长性能的影响
本实施例用于微小杆菌20141109005株对水生动物的生长性能的评估,所选的水生动物以凡纳滨对虾为例。
1.1菌液制备
微小杆菌20141109005保种菌株,在2216e平板上划线活化,挑取单菌落接种于2216e海水液体培养基,于28℃摇床振荡培养过夜,采用涂布平板计数法确定菌浓度约为1011cfuml-1。
1.2实验饲料制备
饲料选用正大集团有限公司所售2种不同规格的饲料,饲料粒径分别为0.5—1.0mm和1.2mm,饲料蛋白含量均为35%,分别记为1号和2号料。
实验饲料制备:2种规格饲料分别以料液比1:0.5(w/g:v/ml)添加假交替单胞菌20101015001菌液。室温放置10h,使菌液充分浸润,使饲料中最终含菌量为1011cfu/g左右。
对照组饲料:按照料液比1:0.5与无菌2216e培养基混合,操作方法同上。
1.3实验分组及养殖管理
实验虾病原检测:随机取实验对虾30尾,分为2个样品进行合并检测,使用无菌手术刀片切取对虾肝胰腺、鳃丝和肌肉组织,放入3倍体积的95%乙醇中保存。组织的总dna和总rna,使用海洋动物组织基因组dna提取试剂盒(天根)和rnaisoplus(takara)分别进行提取,检测方法分别按oie(2016)、tourtip等(2009)和zhang等(2014)的方法对对虾白斑综合征病毒(wssv)、传染性皮下及造血组织坏死病毒(ihhnv)、虾肝肠胞虫(ehp)、致急性肝胰腺坏死副溶血弧菌(vpahpnd)、桃拉综合征病毒(tsv)、黄头病毒(yhv)、传染性肌坏死病毒(imnv)和偷死野田村病毒(cmnv)进行pcr检测。检测结果表明,实验虾的ihhnv、tsv、yhv、imnv和cmnv均为阴性,但vpahpnd、wssv和ehp的3种病原在第2轮pcr扩增结果显示为阳性,其中,wssv和vpahpnd在2个合并样品中均只有1个出现阳性。
实验分组情况:实验组和对照组各3个平行/组,140尾/平行。实验对虾每天早上、中午和晚上共投喂3次,日投喂量为对虾体重的3~5%。养殖实验进行60d,前30d投喂1号实验饲料,后30d投喂2号实验饲料。实验组投喂中,以6d为周期,前3d投喂实验组饲料,后3d投喂对照组饲料。正式实验前凡纳滨对虾暂养15天。
养殖管理:凡纳滨对虾各平行组,置于φ80cm×150cm的圆形水泥池中,水体为0.5m3。实验期间每隔2d换水1次,换水量约为水体的1/3,水温为(26±2)℃,盐度为15±1,ph8.1±0.1,连续充气,每天检查对虾摄食及存活情况,对发现的死亡对虾及时捞出。
1.4实验指标及数据处理
每隔15d每组每个重复取20尾,快速称重后再放回原池,计算特定生长率;养殖结束时,记录各组对虾存活数量,测量各组对虾初始和实验结束时的体重,计算各组对虾的存活率和生长率;统计各组对虾饲料投喂量,计算饲料系数。
存活率(survivalrate,sr)(%)=存活尾数/总尾数×100
特定生长率(specificgrowthrate,sgr)(%/d)=[t(i+15)平均体重–ti平均体重]/(ti平均体重×15)×100
平均生长率(averagegrowthrate,agr)(%/d)=(终末平均体重–初始平均体重)/(初始平均体重×60)×100
饲料系数(feedconversionratio,fcr)=摄食饲料量/(终末体重–初始体重)
以上的实验数据分析,均采用spss18.0软件进行单因素方差分析。单因素实验结果方差分析(one-wayanova),p<0.05作为差异显著水平,若差异达显著,则进行duncan多重比较,显著性水平为p<0.05。
2.1生长率
特定生长率统计结果表明,投喂16~30d各组对虾的特定生长率较0~15d均有所提升,但前30d内实验组对虾的特定生长率与对照组相比没有显著差异(p>0.05);在第31~60天,实验组对虾的生长速度显著高于对照组(p<0.05)。各组对虾养殖60d体重统计结果显示:投喂添加微小杆菌20141109005组和对照组的平均生长率分别是(15.78±1.76)%d-1和(7.69±0.30)%d-1,实验组较对照组提高了(105.5±28.1)%,且两数值间有显著性差异(p﹤0.05)。
2.2成活率
各组对虾养殖60d存活率结果显示:由于实验对虾携带有wssv、vpahpnd和ehp,对照组存活率仅为(25.5±1.8)%,而投喂添加微小杆菌20141109005组对虾存活率达(37.9±2.9)%,较对照组提高了48.6%,且两数值间有着显著差异(p<0.05)。
2.3饲料效率
实验组的饲料系数和对照组的饲料系数分别为0.94和1.38,实验组是对照组的(68.6±9.2)%,较对照组有着显著差异性下降(p<0.05)。
2.4对虾产量
实验组和对照组对虾养殖60d的单位水体产量分别为(422.7±67.6)gm-3和(138.2±10.8)gm-3,实验组是对照组的(308±63)%,实验组较对照组有显著差异(p<0.05)。
表1投喂添加不同饲料的凡纳滨对虾生长、存活和生产特性
注:标注相同小写字母表示无显著差异(p>0.05),标注不同小写字母表示有显著差异(p<0.05),标注两个相同的字母表示极显著差异(p<0.01)。
实施例7:饲料中添加微小杆菌20141109005株对对对虾肠道菌群的影响评估
实验用虾分组及管理同实施例5。
实验中第40、50和60d,测定对虾肠道细菌优势菌群的变化,以评估假交替单胞菌20101015001株对对对虾肠道菌群的影响。
肠道组织dna的提取及测序:参考李继秋等(2006)的方法,提前2d从每组随机取8尾虾,置于3l新鲜海水中暂养,不投喂饲料,待排空肠道内容物后,无菌操作取对虾肠道,置于灭菌海水中清洗后匀浆,将肠道匀浆液梯度稀释,将各稀释度的肠道匀浆液涂布2216e平板,于28℃培养箱中培养24h后,挑取各组平板中的优势菌落,进行分离纯化培养。按水煮法提取dna作为模板,用细菌16srdna通用引物进行pcr扩增,pcr扩增产物寄送生工生物工程(上海)股份有限公司测序。
肠道菌群分析:测序分析结果表明,益生菌添加的颗粒饲料长期投喂改变了肠道内定植的优势菌组成和数量。在养殖实验40d,对照组对虾的肠道中定植菌量最少,无明显优势单一的菌群,而实验组在50d时实验组组的优势菌则为施罗氏弧菌,次优势菌为美人鱼发光杆菌;在60d对照组肠道定植有美人鱼发光杆菌和副球菌2种优势菌,实验组的对虾肠道中定植的优势菌是欧文斯弧菌,且优势菌的密度要比对照组优势菌高两个数量级。
上述结果表明,微小杆菌20141109005株在应用中,可影响水生对物的肠道内定植的优势菌群种类,这种影响与提高对虾免疫力和生长性能相关。
表2各实验组对虾中肠定植的优势菌
注:实验组投喂对照商品饲料,实验组投喂添加微小杆菌20141109005饲料;nd:未测试
实施例8:饲料中添加微小杆菌20141109005株对对虾免疫性能的影响
实验用虾分组及管理同实施例5。
对虾血清制备:实验60天后,对虾进行饥饿24h再抽取血液。每池取10尾对虾,用1ml无菌注射器自对虾围心腔中抽取血淋巴,每组血淋巴液混合置于无菌离心管中,于4℃冰箱中静置过夜,3000r/min离心10min,取上层血清,置于–80℃超低温冰箱保存。
血清酶活测定:酸性磷酸酶(acp)、超氧化物歧化酶(sod)、过氧化物酶(pod)、溶菌酶活力,以及总蛋白的浓度测定均采用测试盒(南京建成生物工程研究所)按说明书方法操作。
acp活力定义:100ml血清在37℃与基质作用30min产生1mg酚为1个活力单位(u/100ml);sod总活力定义:lml反应液中sod抑制率达50%时所对应的酶量为一个sod活力单位(u/ml);pod活力定义:在37℃条件下,每毫升血清每分钟催化产生1μg的底物酶量定义为一个酶活力单位(u/ml);溶菌酶测定采用以南京建成生物工程研究所提供的测试盒中的溶壁微球菌的冻干粉(sigma)为底物。用0.1mol/l、ph=6.4的磷酸钾盐缓冲液配底物悬液(od≈0.3-0.5)。取3m1该悬液于试管内做水浴处理,并加入50μl血清振荡混匀,测其a0值。然后37℃水浴加热30min,结束后立即冰浴10min以终止反应,于570nm处的测其a值。溶菌酶活力ul按下式计算:ul=(a0-a)/a;总蛋白浓度测定原理:碱性条件下,蛋白将cu2+还原为cu+,cu+与bca试剂形成紫色的络合物,562nm处有最大吸收峰,依据吸光度与浓度成正比,通过测吸光度即可计算待测蛋白的浓度。
蛋白浓度分析:实验组总蛋白浓度极显著高于对照组(p<0.01)。
免疫酶活结果分析:结果显示,实验组凡纳滨对虾血清acp、sod、pod、溶菌酶活性和总蛋白浓度较对照组分别提高12.4%、30.1%、6.3%、14.3%和20.1%,其中pod较对照组有着极显著差异(p<0.05),总蛋白浓度较对照组有着极显著差异(p<0.01)。
表3不同添加饲料对凡纳滨对虾免疫的影响
注:标注相同小写字母表示无显著差异(p>0.05),标注不同小写字母表示有显著差异(p<0.05),标注两个相同的字母表示极显著差异(p<0.01)。
上述结果表明,饲料添加该菌株,可提高携带白斑综合征病毒(wssv)、虾肝肠胞虫(ehp)和致急性肝胰腺坏死副溶血弧菌(vpahpnd)病原对虾血清总蛋白浓度和免疫酶活性。
实施例9:微小杆菌20141109005株在水产养殖中的应用效果评估方式
通过注射、口服或浸泡的方式,评估微小杆菌20141109005株对水生动物抗病效果评估。
水生动物可以为甲壳类、鱼类和爬行类等。
注射可采用腹腔或肌肉注射两种方式,该方式下菌株使用的剂量为104—108cfu/g(菌落形成单位/水生动物体重),注射1次后的14—30天也可进行2次加强接种;
口服方式中,该菌株在配合饲料中的添加剂量为104-1011cfu/g(菌落形成单位/饲料重量),连续投喂14—60d;
浸泡方式中,该菌株在养殖水体中的浓度为104-109cfu/ml(菌落形成单位/浸泡水体体积)的浓度,浸泡时间60min—24h。
上述微小杆菌20141109005株在对虾养殖中抗病原的应用效果评估所用的病原,可以是下列病原中的1种或多种。所述的病原可以为白斑综合征病毒(wssv)、传染性皮下及造血组织坏死病毒(ihhnv)、致急性肝胰腺坏死病细菌(ahpnd)、虾血细胞虹彩病毒(shiv)、黄头病毒(yhv)、传染性肌坏死病毒(imnv)、偷死野田村病毒(cmnv)和桃拉综合征病毒(tsv)等已知或未知的虾类病原、神经坏死病毒(nnv)、传染性脾肾坏死病毒(isknv)等鱼类病毒,也可以是如哈维氏弧菌(v.harveyi)、副溶血弧菌(v.parahaemolyticus)、坎贝氏弧菌(v.campbellii)、发光杆菌、以及可引起对虾肝胰腺坏死综合征(ahpnd)或其他细菌病的虾类病原细菌、爱德华氏菌(edwardsiella)、鳗弧菌(v.anguillarum)、溶藻弧菌(v.alginolyticus)和嗜水气单胞菌(a.hydrophila)等鱼类病原菌。其中,可引起对虾肝胰腺坏死综合征(ahpnd)的细菌为携带具有编码pira和/或pirb毒素基因的质粒的弧菌引起的急性肝胰腺坏死病,该类弧菌可以为v.parahaemolyticus,v.campbellii和v.owensii等,也可以是其他尚未发现和报道的携带具有编码pira和/或pirb毒素的基因的细菌。
应用30—60天后,通过投喂前后的水生动物的生长性能、免疫因子及成活率等的检测,进行微小杆菌20141109005株抗病原的应用效果评估,较对照组实验组的成活率和平均生长率提高10—30%及以上,视为有效。
实施例10:微小杆菌20141109005株与其他益生菌混合在水产养殖中的应用效果评估方式
将微小杆菌20141109005株与水生动物益生菌混合,进行混合益生菌制剂在水产养殖上应用效果评估。
微小杆菌20141109005株与其不具有拮抗作用的益生菌,按1:0.25、1:0.5、1:1、1:1.5、1:2.0的比例混合添加于水生动物饲料中,添加菌在饲料中的浓度可以104、105、106、107、108、109、1010、1011cfu/g(菌落形成单位/饲料重量),连续投喂14—60d后,用合适剂量的实验水生动物的病原进行人工感染,根据感染后的成活率,确定两种益生菌的合适比例及在饲料中适宜添加量,并参考实施例7、8和9的方法进行混合益生菌对水生动物抗病及生长性能的影响评估。
上述应用试也可采用浸泡的方式加以评估,所述的益生菌可以为枯草芽孢杆菌(bacillussubtili)等,水生动物可以为甲壳类、鱼类、爬行类等水生动物。
应用30—60天后,通过投喂前后的水生动物的生长性能、免疫因子及成活率等的检测,进行微小杆菌20141109005株抗病原的应用效果评估,较对照组实验组的成活率和平均生长率提高10—30%及以上,视为有效。
以上所述仅为本发明的较佳实施例而己,并不以本发明为限制,凡在本发明的精神和原则之内所作的均等修改、等同替换和改进等,均应包含在本发明的专利涵盖范围内。
序列表
<110>中国水产科学研究院黄海水产研究所
连云港市启明水产有限公司
<120>一株微小杆菌及其作为益生菌在水产上的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>1425
<212>dna
<213>微小杆菌(exiguobacteriumsp.)
<400>1
tgcaagtcgagcgcaggaagctgacggaactcttcggagggaaggcggtggaatgagcgg60
cggacgggtgagtaacacgtaaggaacctgcctcaaggattgggataactccgagaaatc120
ggagctaataccggatagttcaacggaccgcatggtccgctgatgaaaggcgcttcggcg180
tcaccttgagatggccttgcggtgcattagctagttggtggggtaacggcccaccaaggc240
gacgatgcatagccgacctgagagggtgatcggccacactgggactgagacacggcccag300
actcctacgggaggcagcagtagggaatcttccacaatggacgaaagtctgatggagcaa360
cgccgcgtgagtgatgaaggttttcggatcgtaaaactctgttgtaagggaagaacacgt420
acgagaggaaatgctcgtaccttgacggtaccttacgagaaagccacggctaactacgtg480
ccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggcgtaaagcg540
cgcgcaggcggccttttaagtctgatgtgaaagcccccggctcaaccggggagggccatt600
ggaaactggaaggcttgagtacagaagagaagagtggaattccacgtgtagcggtgaaat660
gcgtagagatgtggaggaacaccagtggcgaaggcgactctttggtctgtaactgacgct720
gaggcgcgaaagcgtggggagcaaacaggattagataccctggtagtccacgccgtaaac780
gatgagtgctaggtgttggggggtttccgcccctcagtgctgaagctaacgcattaagca840
ctccgcctggggagtacggccgcaaggctgaaactcaaaggaattgacggggacccgcac900
aagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaactcttgaca960
tcccattgaccgcttgagagatcaagttttcccttcggggacaatggtgacaggtggtgc1020
atggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaaccc1080
ctatccttagttgccagcattcagttgggcactctagggagactgccggtgacaaaccgg1140
aggaaggtggggatgacgtcaaatcatcatgccccttatgagttgggctacacacgtgct1200
acaatggacggtacaaagggcagcgagaccgcgaggtggagccaatcccataaagccgtt1260
cccagttcggattgcaggctgcaactcgcctgcatgaagtcggaatcgctagtaatcgca1320
ggtcagcatactgcggtgaatacgttcccgggtcttgtacacaccgcccgtcacaccacg1380
agagtttgcaacacccgaagccggtgaggtaaccgcaaggagcca1425
<210>2
<211>522
<212>dna
<213>微小杆菌(exiguobacteriumsp.)
<400>2
tctccgaattgccagcaacttatactcgggagtcagactgcgagtgataagatccgtagt60
caagagggaaacagcccagaccgccagctaaggtccccaagtgtatgttaagtggaaaag120
gatgtggcgctgcctagacagctaggatgttggcttagaagcagccaccattcaaagagt180
gcgtaatagctcactagtcgagtggcgccgcgccgaaaatgtaacggggctaaacatacc240
accgaagctgcggattccgtaaggaatggtaggggagcgttccaaaccgctgtgaagctg300
taccggaaggagcagtggagcgtttggaagtgagaatgccggtgtgagtagcgaaaagag360
gggtgagaatcccctccgtcgaaagcccaaggtttcctgaggaaggctcgtccgctcagg420
gttagtctggacctaagccgaggccgaaaggcgtaggcgatggataacaggttgatattc480
ctgtaccccgatccaccgtttgaacaatggggggacgcggga522
- 还没有人留言评论。精彩留言会获得点赞!