一种体外人睾丸精子发生模型的制备方法与流程
本发明属于生物医学领域,具体涉及一种在体外构建人睾丸完整生精上皮完成减数分裂获得精子细胞的方法。
背景技术:
精子发生是指从精原细胞发育成为成熟精子的一个连续而复杂的生物学过程,包括了精原细胞的自我更新、精母细胞的减数分裂和精子细胞的变形三个阶段。睾丸精子发生容易存在遗传突变、内分泌紊乱的风险以及受到环境内分泌干扰物的影响。已有的数据显示,儿童肿瘤发病率为每1000名儿童中有1.0至2.5例,经过治疗后约三分之一的男性面临无精症的风险。体外人睾丸精子发生建立了研究生殖细胞和睾丸体细胞形成发育的遗传、表观遗传和环境因素,以及对研究各种精子发生障碍的病理机制提供研究模型,为青春期前男性肿瘤患者生育能力的建立提供技术储备。
在体外,完成减数分裂以产生单倍体配子是建立体外人睾丸精子发生模型的终极目标。为了避免对体外减数分裂的误解,生殖生物学家制定了一套“减数分裂金标准”,用于评价在体外衍生出反映减数分裂关键事件的配子。为了证明体外减数分裂的发生,需获得正确的细胞核dna含量、正常的染色体数量、染色体同源重组和正常后代。虽然经过多次尝试,但人类仍未达到符合“金标准”的体外减数分裂。
技术实现要素:
解决的技术问题:本发明提供一种体外人睾丸精子发生模型的制备方法。该模型既支持精原干细胞(ssc)自我更新,精母细胞的减数分裂及单倍体精子细胞成熟的功能性生精管腔的形成,是生殖医学研究的重大突破。据我们所知,这是关于人类性腺生殖细胞减数分裂的第一次报告,形成了能够通过单精子卵细胞胞浆注射使体外成熟的卵细胞受精的功能性精子,并通过符合“减数分裂金标准”进行体外减数分裂,包括获得正确的细胞核dna含量、正常的染色体数量等。
技术方案:一种体外人睾丸精子发生模型的制备方法,包括以下步骤:将人睾丸组织离体后分离为小块,置于提前至少8小时进行完全睾丸培养基置换过的0.25%-1.5%的琼脂块上,加入完全睾丸培养基到达琼脂块高度的三分之一到三分之二,于32-37℃,5%二氧化碳环境中进行培养10-100天。
优选的,上述人睾丸组织包括各种年龄阶段人睾丸。
优选的,上述琼脂块浓度为0.25%。
优选的,上述培养温度为34℃。
优选的,上述完全睾丸培养基的成分包含:90%(v/v)αmem,10%(v/v)血清替代物(kosr),10-50ng/ml胶质细胞源性神经营养因子(gdnf)、10-50ng/ml碱性成纤维细胞生长因子(bfgf)、10-50ng/ml表皮生长因子(egf)、50-100ng/ml转化生长因子β家族激活素a(activina)、10-50ng/ml干细胞生长因子(scf)、10-50ng/ml骨形态发生蛋白(bmp4/7)、10-50mm睾酮(testosterone)、100-200ng/ml促卵泡激素(fsh)和50-100mg/ml垂体提取物(bpe)。
我们以前报道过将胚胎干细胞(esc)分化的原始生殖细胞(pgc)样细胞与新生的睾丸体细胞共同培养在小鼠体内的成功应用。然而,精子发生是短暂的,没有ssc自我更新的证据。在人睾丸器官发生过程中,采用标准的气液交换法,我们将直径约为3毫米的性腺组织碎片培养在半淹没在培养基中的小琼脂糖凝胶上。阴囊的温度大约比人体温度低2-3度,培养的温度保持在34℃,过程中加入胶质细胞源性神经营养因子(gdnf)、碱性成纤维细胞生长因子(bfgf)和表皮生长因子(egf),以支持ssc体外自我更新。在本模型中,血睾屏障(btb)在体外培养过程中形成,通过支持细胞间紧密连接将曲细精管分为近腔小室和基底小室,基底小室提供ssc自我更新的微环境,近腔小室提供了减数分裂的微环境。经过100多天的培养,我们通过流式细胞术获得了一定比例的单倍体细胞。体外的培养能够让未成熟的组织细胞进一步成熟,支持细胞和生殖细胞建立一个相互作用的微环境,这正是持续的精子发生所必须的。
有益效果:该模型为体外研究人类睾丸精子发生提供了平台,旨在了解睾丸器官发生复杂性的研究,并为开发男性不育治疗提供一个研究平台。
附图说明
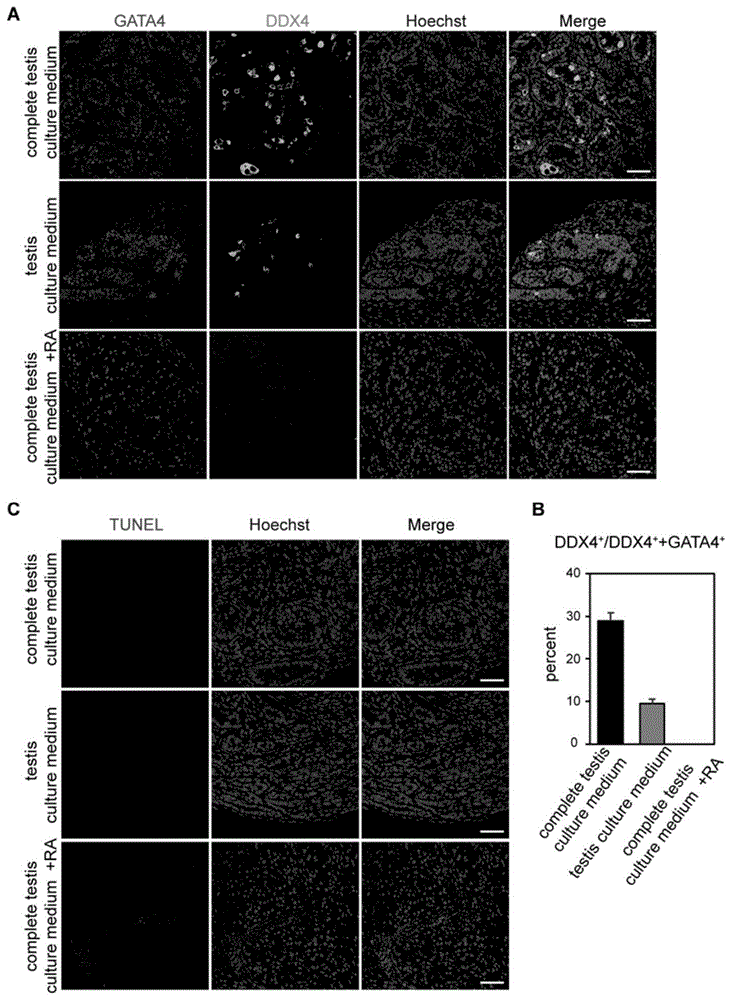
图1不同培养基进行组织培养30天结果,其中a.完全睾丸培养基和空白睾丸培养基以及添加ra的完全睾丸培养基培养组织30daygata4、ddx4和dna(hoechst33342)荧光染色图,标尺为100μm;b.对不同培养基培养30天后组织进行生殖细胞统计结果;c.完全睾丸培养基和空白培养基以及添加ra的完全睾丸培养基培养组织30day的组织切片tunel染色图,标尺为100μm;
图2为培养不同时间点组织plzf和ki67的免疫荧光图,标尺为100μm;
图3为完全睾丸培养基培养下,0、10day的ddx4、plzf、sycp3、prm1、sox9、cyp17a1的组织免疫染色图,标尺为100μm,dna用hoechst33342染色;
图4为通过免疫荧光和电镜检测培养过程中体外减数分裂,组织免疫荧光检测sycp3、γh2ax、mlh1、sycp1和prm1图,标尺为10μm,dna用hoechst33342染色;透射电镜显示带有联会复合体的初级精母细胞:星号;标尺为2µm;
图5为完全睾丸培养基培养下,30day的ddx4、plzf、sycp3、prm1、sox9、cyp17a1的组织免疫染色图,标尺为100μm,dna用hoechst33342染色;
图6为透射电镜显示带顶体小泡的精子细胞图:左图三角形;早期尾巴结构:右图三角形,标尺为2µm;1µm;
图7为完全睾丸培养基培养下,50day的ddx4、plzf、sycp3、prm1、sox9、cyp17a1的组织免疫染色图,标尺为100μm,dna用hoechst33342染色;
图8为体外诱导的精子细胞的遗传和表观遗传特征进行鉴定图,其中a.流式分选得到的单倍体顶体素acrosin染色,标尺为10μm,dna用hoechst33342染色;b.13和21号染色体特有的体细胞探针或x和y染色体特有性染色体探针对二倍体和诱导精子细胞的fish探针染色,标尺为10μm,dna为hoechst33342染色;c.二倍体细胞、体内精子细胞和体外来源的单精子细胞的基因组cnv测序,箭头显示12号染色体拷贝数异常;d.流产胎儿皮肤细胞和诱导精子细胞str位点的检测(左),减数分裂后染色体str位点和染色体分离的示意图(右);e.人圆形精子细胞和诱导精子细胞的h19和snrpn亚硫酸氢盐测序测序,空心和实心圆圈分别表示未甲基化和甲基化cpgs;
图9为体外诱导的精子细胞功能验证图,其中a.体外成熟人卵细胞胞浆注射(rosi)注入诱导的精子细胞,原核期,8细胞期和囊胚期,b.获得的胚胎与rosi所用的体外诱导精子细胞来源的胚胎皮肤和所用卵子颗粒细胞str位点检测,c.培养获得的胚胎cnv结果。
具体实施方式
在整个诱导体外睾丸器官发生的过程中,利用人类12w~19w胚胎睾丸进行特定培养基的分化培养,诱导生殖细胞在体外一定时间内持续完成减数分裂形成功能性的配子,包括精原干细胞的自我更新,精母细胞的减数分裂和精子变形过程,并且在精子发生的同时能够观察到支持细胞和间质细胞逐渐成熟,紧密连接结构建立。对于培养不同时间点的组织采用免疫荧光、电镜等技术方法进行形态上的鉴定,并配合流式分选对于体外诱导睾丸器官发生过程中精母和精子细胞产生的时间和比例进行进一步地分析;将通过流式分选获得的单倍体细胞利用荧光染色、cnv测序、str检测、甲基化等方法鉴定其遗传和表观遗传的正常建立;利用rosi技术、胚胎与亲本间的str鉴定、胚胎cnv测序验证体外诱导睾丸器官发生完成减数分裂获得单倍体细胞的功能性。
实施例1胚胎12周的睾丸培养100天仍有精原干细胞增殖
(1)组织培养方法:用低熔点的琼脂和灭菌水配制0.25%的琼脂块,将琼脂块切割成8mm×8mm大小的方块,置于完全睾丸培养基中置换至少8小时;将12w的人胚胎睾丸去除中肾,剪碎至3mm大小的组织块,将其置于提前准备好的浸泡于培养集中的0.25%的琼脂块上,培养液加到琼脂块三分之二的位置,于34℃,5%co2培养;
(2)培养体系确立:在本实验培养过程中,为了摸索出人体外睾丸器官发生的最适培养基,实验中采用了三种培养方案,具体培养基成分如下:
完全睾丸培养基(completetestisculturemedium):90%(v/v)αmem,10%(v/v)ksr,bmp4/7(20ng/ml,r&dsystems),scf(20ng/ml,r&dsystems),bfgf(20ng/ml,r&dsystems),egf(20ng/ml,r&dsystems),gdnf(20ng/ml,r&dsystems),activina(100ng/ml,r&dsystems),testosterone(10mm,acrosorganics),fsh(200ng/ml,sigma),以及bpe(50mg/ml,corninglifesciences);
睾丸培养基(testisculturemedium):90%(v/v)αmem,10%(v/v)ksr;
完全睾丸培养基(completetestisculturemedium)加入视磺酸ra(10-6m)。
(3)三种培养基下的组织皆在培养至30day后取材,置于4%的pfa固定,免疫荧光染色包括ddx4/gata4和tunel(图1),结果显示在完全睾丸培养基中培养30day的组织仍然有大量ddx4的表达,而在睾丸培养基中培养的组织只残留了少量的ddx4阳性的细胞,在完全睾丸培养基加入ra中的组织完全没有ddx4的阳性信号,tunel染色也反应出在完全睾丸培养基和睾丸培养基中培养30day的组织出现少量细胞的凋亡,完全睾丸培养基加入ra中的组织则出现了大量的凋亡信号,由此表明完全睾丸培养基能够支持人胚胎期睾丸存活,因此后续实验中利用该培养基进行组织培养。
(4)利用摸索的培养基进行人器官模型的持续培养,在10天,30天,50天,70天,100天免疫荧光染色可以观察到精原干细胞的增殖,即plzf和ki67同时阳性的细胞(图2)。
实施例2胚胎12周的睾丸培养10天出现精母细胞
(1)组织培养方法:用低熔点的琼脂和灭菌水配制0.25%的琼脂块,将琼脂块切割成8mm×8mm大小的方块,置于完全睾丸培养基中置换至少8小时;将12w的人胚胎睾丸去除中肾,剪碎至3mm大小的组织块,将其置于提前准备好的浸泡于培养集中的0.25%的琼脂块上,培养液加到琼脂块三分之二的位置,于34℃,5%co2培养;
(2)利用完全睾丸培养基对12周人睾丸培养10天,将培养前0day,与培养10day的组织切片染色,对精子发生关键作用的细胞类型,包括生殖细胞、精原、精母、精子细胞、支持细胞、间质细胞的细胞marker(ddx4、plzf、sycp3、prm1、sox9、cyp17a1)进行荧光染色(图3)。染色结果显示,组织未培养前曲细精管内有ddx4的表达,并有少量plzf的表达,sox9和cyp17a1皆有表达;组织培养到10day时可见大部分曲细精管中plzf的表达增加,并出现了大量的sycp3的信号,提示组织在培养10day时已经开始了减数分裂,出现精母细胞。
实施例3胚胎12周的睾丸培养30天出现圆形精子
(1)组织培养方法:用低熔点的琼脂和灭菌水配制0.25%的琼脂块,将琼脂块切割成8mm×8mm大小的方块,置于完全睾丸培养基中置换至少8小时;将12w的人胚胎睾丸去除中肾,剪碎至3mm大小的组织块,将其置于提前准备好的浸泡于培养集中的0.25%的琼脂块上,培养液加到琼脂块三分之二的位置,于34℃,5%co2培养;
(2)利用完全睾丸培养基对12周人睾丸培养30天,将培养过程中30day的组织切片染色,对生殖细胞、精原、精母、精子细胞、支持细胞、间质细胞的marker(ddx4、plzf、sycp3、prm1、sox9、cyp17a1)进行荧光染色(图4),结果显示,在组织培养30day后曲细精管内有prm1的阳性信号,并且这些阳性信号的细胞核都是圆形的,提示着圆形精子的出现;
(3)为了符合“减数分裂金标准”的要求,对培养的组织进行荧光染色检测减数分裂markersycp3/γh2ax、sycp3/mlh1、sycp1的表达(图5),表明该阶段正在高度有序地发生同源重组与同源染色体联会等重要的生物学事件,以确保减数分裂的正确发生,电镜下观察精母细胞同源重组的结构进一步验证了上述结果。
(4)电镜对圆形精子的鉴定:在透射电镜观察下,可见带顶体颗粒的圆形精子细胞,同时观察到了中心粒刚产生变形形成尾部鞭毛的精子尾部结构,此时的线粒体正在向鞭毛移动并有序排列(图6),进一步验证了体外培养过程中圆形精子的产生。
实施例4胚胎12周的睾丸培养50天出现变形精子并具有一定受精能力
(1)组织培养方法:用低熔点的琼脂和灭菌水配制0.25%的琼脂块,将琼脂块切割成8mm×8mm大小的方块,置于完全睾丸培养基中置换至少8小时;将12w~19w的人胚胎睾丸去除中肾,剪碎至3mm大小的组织块,将其置于提前准备好的浸泡于培养集中的0.25%的琼脂块上,培养液加到琼脂块三分之二的位置,进行标准气液界面法于34℃,5%co2培养;
(2)利用完全睾丸培养基对12周人睾丸培养50天,将培养过程中50day的组织切片染色,对生殖细胞、精原、精母、精子细胞、支持细胞、间质细胞的细胞marker(ddx4、plzf、sycp3、prm1、sox9、cyp17a1)进行荧光染色(图7),结果显示,培养50day的组织曲细精管中存在prm1的阳性信号,此时有的细胞细胞核已浓缩并且呈长形精子细胞的形态,提示人性腺组织体外培养50day时检测到了变形精子;
(3)体外获得精子细胞遗传和表观遗传特性鉴定:利用流式分选获得的单倍体细胞进行单倍体特异性蛋白(acrosin)和fish鉴定,采用cnv测序验证获得的单倍体细胞染色体完整性。利用mda(multipleannealingandlooping-basedamplificationcycles)扩增单细胞进行str位点检测,进一步解释了体外诱导获得的单倍体细胞在减数分裂中发生了同源重组。亚硫酸氢盐测序显示诱导的精子细胞在亲本印记的h19和母系印记的snrpn位点上存在特异性差异甲基化,与体内来源的人类精子相似(图8),这些数据表明,体外来源的精子细胞建立了正常的印迹基因甲基化状态,即父系印记的高甲基化和母体印记的低甲基化。
(4)体外获得精子细胞功能验证:用圆形精子细胞注射(rosi)评价体外来源精子细胞的功能,共注射16枚体外成熟的人卵母细胞,最终形成1枚8细胞期胚胎和1枚囊胚。为了排除孤雌激活,确认诱导的精子细胞对获得的胚胎的贡献,对8个胚胎进行str13个codis位点和性别位点分析。str分析显示,所有的胚胎等位基因均与单个父系和母系等位基因相匹配。全基因组cnv分析显示,胚胎具有完整的整倍体基因组(图9)。以上结果表明,我们建立了体外人精子发生模型的方法,获得的精子细胞可以使卵母细胞受精,并支持早期胚胎的体外发育。
尽管本发明已进行了一定程度的描述,明显地,在不脱离本发明的精神和范围的条件下,可进行各个条件的适当变化。可以理解,本发明不限于所述实施方案,而归于权利要求的范围,其包括所述每个因素的等同替换。
- 还没有人留言评论。精彩留言会获得点赞!