茶多肽在制备改善、缓解或治疗痛风药物中的应用的制作方法
本发明涉及药物领域,特别是茶多肽的制药用途,尤其是茶多肽在制备改善、缓解或治疗痛风药物中的应用。
背景技术:
痛风是嘌呤代谢长期紊乱,血尿酸水平长期维持在高水平状态,从而引发组织损伤或异变的一系列临床综合征。其现实生活中的表现为尿酸形成晶体结构后,在组织、器官和关节内部逐渐积累,导致痛风是沉积、急性或慢性关节炎间断性发作,甚至引起关节畸变,而且往往伴有肾脏损伤,如慢性小管间质性肾炎和尿酸肾结石等症状。痛风之所以发病,是由于尿酸的产生过度和尿酸在肾脏排泄的障碍。随着我国经济的持续健康发展,人的生活质量得到很大提升,饮食结构也随之发生变化,富含嘌呤的食物摄入量增加,导致高尿酸血症患者明显增多,而且痛风的患病人群逐渐呈现年轻化的趋势,严重影响人们的正常生活和工作,不得不引起人们的高度重视。但是痛风发病的主要原因是尿酸排泄障碍引起的排泄减少。因为人体内没有尿酸酶,而尿酸保持原有结构经过肾小球过滤,在尿液中排出体外之前,还要按照程序经历肾小管重吸收和再分泌两个阶段。
尿酸的重吸收由位于肾小管近曲端的尿酸盐转运蛋白urat1介导进入小管腔,abcg2为最新发现的huat转运体,介导尿酸进入小管腔的同时还会消耗一定的atp,但是有研究指出abcg2的q141k突变可使尿酸转运率下降53%(pnas,第106卷第25期,第10338-10342页,2009年6月23日)。所以恢复abcg2q141k的突变表达是一种有效的降低尿酸,治疗痛风的方法。
临床上使用的抑制尿酸生成的药物有别嘌醇、奥昔嘌醇、非布索坦等;促进尿酸排泄的药物有丙磺舒、碱性药物氯沙坦、苯溴马隆等。这类合成药物疗效好,但是也会造成一系列的副作用,例如:皮肤过敏、肝脏肾脏毒性、骨髓毒性、腹泻、头痛、易引发心脑血管疾病等。目前很多研究已经致力于用天然药物代替化学药物,试图从食物中寻找有效的可以降低尿酸,治疗痛风的有效活性成分。目前的研究有有从千屈菜科植物美艳秋水仙叶中分离纯化的化合物、槲皮素、木犀草素、菊花中提取的菊花油等都可以有效降低尿酸水平。
茶叶作为中国传统的健康饮品,富含茶多酚、咖啡碱、茶氨酸、茶多糖等功能性成分。茶叶根据工艺可以分为不发酵的绿茶、半发酵的乌龙茶、轻微发酵的黄茶和白茶、全发酵的红茶以及后发酵的普洱茶六大类。茶叶的揉捻、发酵等加工工艺可能促进蛋白质分解,产生天然的多肽,因此这是很好的研究原料。目前,茶叶多肽在抑制ace,降血压从而预防心血管疾病、缓解糖尿病肾病等方面有涉及,但是在茶叶多肽恢复abcg2q141k突变表达降低尿酸治疗痛风方面的应用尚未发现。
现有的治疗痛风的天然植物来源的药物副作用虽然比化学药物小,但是只能简单的降低尿酸的含量,并没有针对由abcg2q141k基因突变引起痛风的病人体现出良好的治疗效果。由于天然植物中活性成分的作用靶点多,即使有可以恢复突变的靶点,其药效也不明显。
本发明旨在提出针对由于ancg2q141k基因突变引起尿酸排泄障碍从而患有痛风疾病的患者提出精准治疗方案。
技术实现要素:
本申请克服了现有技术的缺陷,提供一种缓解由于遗传造成的痛风及高尿酸血症的精准治疗方法。
从用药安全角度来看,茶多肽是从茶叶中提取出来的功能活性成分,不会造成肝肾细胞毒性,也不会引发心脑血管疾病,因此与现有的中西药相比,毒副作用性更小,更加安全从治疗效果上来看,如图中结果所示,一方面,茶多肽可以明显增加abcg2野生型蛋白表达水平,即可以增加尿酸的排泄,缓解一般的痛风疾病;另一方面,茶多肽还可以增加abcg2q141k大分子蛋白的表达量,使其恢复成abcg2野生型,即可以缓解由q141k突变造成的尿酸排泄障碍,恢复abcg2野生型蛋白转运尿酸的能力,在一定程度上缓解由基因突变造成的痛风症状。因此相比于现有治疗药物的需长期服用,治标不治本,又容易产生耐药性等诸多问题,茶多肽不仅可以治疗由生活习惯引起的一般痛风,而且可以靶向的治疗由abcg2q141k这类由基因突变造成的痛风疾病,治疗范围更广,治疗效果更好。
本发明提供了一种茶多肽在制备改善、缓解或治疗痛风药物中的用途。
上述通风是由基因突变造成的痛风。
上述基因突变是abcg2q141k突变。
本发明还提供一种茶多肽在制备增加abcg2野生型蛋白表达水平药物中的用途。
本发明还提供一种茶多肽在制备缓解由q141k突变造成的尿酸排泄障碍药物中的用途。
本发明还提供一种茶多肽在制备恢复abcg2野生型蛋白转运尿酸药物中的用途。
本发明还提供一种茶多肽在制备恢复abcg2q141k突变表达药物中的用途。
上述的药物也可以为检测试剂。
如上所述用途,其治疗对象是人或其它动物。
其中茶多肽为绿茶蛋白多肽。
其中所述药物为口服制剂、局部制剂、注射制剂、缓释制剂、控释制剂、或速释制剂。
其中所述药物为片剂、胶囊剂、固体分散体、口服液体制剂、纳米制剂、注射液、注射粉针剂、栓剂、膏剂、凝胶剂、贴剂。
其中所述药物还包含其它治疗痛风的治疗剂。
其中所述药物中茶多肽的含量为0.1-99.9%。
本发明还提供一种改善、缓解或治疗痛风药物,其特征在于以茶多肽为活性成分,任选地包含药学上可接受的辅料。
尤其是,一种改善、缓解或治疗痛风药物,其特征在于活性成分为:茶多肽,和其它的改善、缓解或治疗痛风的药物,任选地包含药学上可接受的辅料。
如上所述的药物,茶多肽的含量为0.1-99.9%。
本申请还提供了一种可以改善、缓解或治疗痛风的茶多肽。
具体的茶多肽可以为绿茶多肽。
茶多肽的制备方法如下:
s1.破壁:采用酶解技术对茶渣进行酶解破壁处理;
s2.碱提:步骤s1酶解后的茶渣继续采用碱法提取茶蛋白,得到茶蛋白提取液;
s3.酸沉:对s2所得茶蛋白提取液进行酸沉,得沉淀物;
s4.脱盐:对s3所得沉淀物进行脱盐;
s5.脱色:取s4脱盐后的茶蛋白,利用75%丙酮进行脱色,冷冻干燥得到茶蛋白;
s6.酶解:取s5所得的茶蛋白加入食物蛋白酶进行酶解,得到茶蛋白多肽(即茶多肽)。
优选的,上述茶蛋白为绿茶蛋白,茶蛋白多肽为绿茶蛋白多肽,即绿茶多肽。
其中,所述茶渣可以为绿茶茶渣,优选的,绿茶茶渣可以为浸提后的废弃绿茶茶渣。
另外,优选地,步骤s6所述食物蛋白酶为酸性蛋白酶、胰蛋白酶、胃蛋白酶或碱性蛋白酶。
更优选地,步骤s6所述食物蛋白酶为酸性蛋白酶。
更优选地,所述酸性蛋白酶为和氏璧酸性蛋白酶(acidprotease)。
优选地,步骤s6所述酶解的参数为:酶浓度为2.0~4.0%,酶解ph为1.8~8.0,酶解温度为37~60℃,酶解时间为2~4h。
更优选地,步骤s6所述酶解的参数为:酶浓度为2.0~4.0%,酶解ph为2.5~4.0,酶解温度为40~50℃,酶解时间为2~4h。
更优选地,步骤s6所述酶解的参数为:酶浓度为2.0%,酶解ph为4.0,酶解温度为40℃,酶解时间为2h。
优选地,步骤s1所述酶解破壁所使用的酶为复合植物水解酶。
更优选地,所述复合植物水解酶为诺维信复合植物水解酶viscozymel。
优选地,步骤s1所述酶解的参数为:酶浓度为1.5~3.5%,固液比为1∶20~1∶30,酶解ph为2.5~4.0,酶解温度为37~45℃,酶解时间为2~4h。
优选地,步骤s2所述碱提的参数为:碱液浓度为0.10~0.15mol/l,固液比为1∶30~1∶50,提取温度为80~90℃,提取时间为90~150min;离心得到绿茶蛋白提取液。
优选地,步骤s3所述酸沉是取绿茶蛋白提取液,用稀盐酸调节ph为2.5~3.5,静置30~60min后离心,得到沉淀物。
优选地,步骤s4所述脱盐是在沉淀物中加入水混匀,注入透析袋中,置于纯水中透析36~48h,期间更换纯水4~6次,直至透析袋外水无色且电导率接近纯水,然后3500~4000r/min离心15~20min得到脱盐后的绿茶蛋白。
优选地,步骤s5所述脱盐后的绿茶蛋白和75%丙酮的用量比为:固液比1∶5~1∶8。
优选地,步骤s5所述脱色的方法是:取s4脱盐后的绿茶蛋白,加入75%丙酮,震荡15~20min,离心弃上清,重复数次,用纯水洗涤并离心,重复数次以洗净丙酮,得到绿茶蛋白。
附图说明
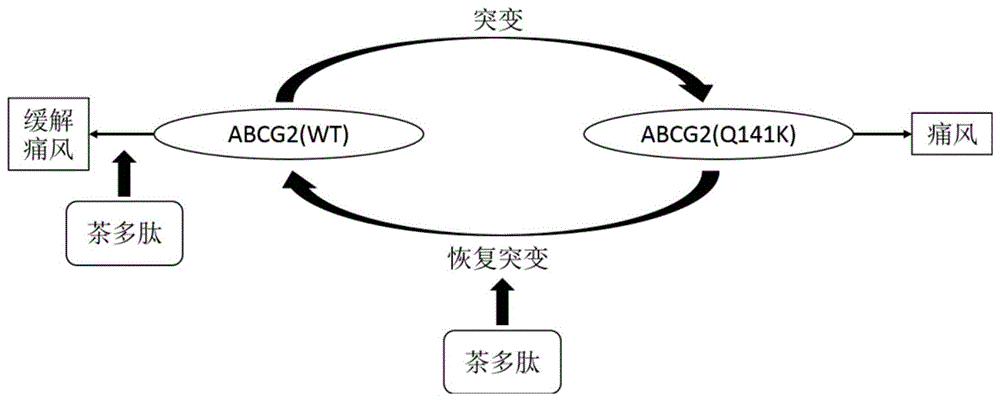
图1;研究茶多肽恢复abcg2q141k突变表达改善痛风原理图。如图所示,茶多肽一方面可以缓解由生活习惯造成的痛风,另一方面可以恢复abcg2q141k突变表达改善痛风及高尿酸血症。
图2;阳性克隆的鉴定图。a:marker;wt:abcg2野生型;1:abcg2q141k突变型。abcg2wt是野生型abcg2蛋白,如图中所示,pdonr-abcg2wt质粒用bsrgi酶切后得到分子约量为2000bp的abcg2片段,pdnor-abcg2q141k酶切后同样得到分子量约2000bp小片段,初步认为abcg2q141k连接到pdonr载体上,得到abcg2q141k阳性克隆突变。
图3;阳性克隆测序结果。图3中基因测序结果与设计的q141k基因完全吻合,即q141k突变成功,获得abcg2q141k阳性克隆。
图4;阳性克隆蛋白表达水平验证。图4中abcg2q141k的大分子蛋白表达水平明显低于野生型abcg2,即获得可以正确表达abcg2q141k蛋白的阳性克隆。
图5;茶多肽调控abcg2及abcg2q141k蛋白表达水平检测。a:abcg2野生型及突变型蛋白表达水平;b:abcg2大分子蛋白表达水平定量分析结果;c:abcg2总蛋白分子表达水平定量分析结果。其中abcg2q141k蛋白上样量是wt的4倍。从蛋白表达水平来看,无论是abcg2总蛋白表达量还是大分子蛋白表达量,茶多肽都上调了其表达水平,且abcg2q141k的表达量与野生型abcg2表达水平相当,即茶多肽可以部分恢复abcg2q141k突变表达改善痛风。
具体实施方式
以下结合实施例,对本发明作进一步说明。
实施例一、茶多肽样品的制备
1.茶蛋白的制备:
s1.破壁:采用酶解技术对绿茶茶渣进行酶解破壁处理;
s2.碱提:步骤s1酶解后的绿茶茶渣继续采用碱法提取绿茶蛋白,得到绿茶蛋白提取液;
s3.酸沉:对s2所得绿茶蛋白提取液进行酸沉,得沉淀物;
s4.脱盐:对s3所得沉淀物进行脱盐;
s5.脱色:取s4脱盐后的绿茶蛋白,利用75%丙酮进行脱色,冷冻干燥得到绿茶蛋白;
s6.酶解:取s5所得的绿茶蛋白加入食物蛋白酶进行酶解,得到具有降血压活性的绿茶蛋白多肽。
其中,所述绿茶茶渣为浸提后的废弃绿茶茶渣。
步骤s6所述酶解的参数为:酶浓度为2.0~4.0%,酶解ph为2.5~4.0,酶解温度为40~50℃,酶解时间为2~4h。
步骤s1所述酶解破壁所使用的酶为诺维信复合植物水解酶viscozymel。
步骤s1所述酶解的参数为:酶浓度为1.5~3.5%,固液比为1∶20~1∶30,酶解ph为2.5~4.0,酶解温度为37~45℃,酶解时间为2~4h。
步骤s2所述碱提的参数为:碱液浓度为0.10~0.15mol/l,固液比为1∶30~1∶50,提取温度为80~90℃,提取时间为90~150min;离心得到绿茶蛋白提取液。
步骤s3所述酸沉是取绿茶蛋白提取液,用稀盐酸调节ph为2.5~3.5,静置30~60min后离心,得到沉淀物。
步骤s4所述脱盐是在沉淀物中加入水混匀,注入透析袋中,置于纯水中透析36~48h,期间更换纯水4~6次,直至透析袋外水无色且电导率接近纯水,然后3500~4000r/min离心15~20min得到脱盐后的绿茶蛋白。
步骤s5所述脱盐后的绿茶蛋白和75%丙酮的用量比为:固液比1∶5~1∶8。
步骤s5所述脱色的方法是:取s4脱盐后的绿茶蛋白,加入75%丙酮,震荡15~20min,离心弃上清,重复数次,用纯水洗涤并离心,重复数次以洗净丙酮,得到绿茶蛋白。
2.本申请所用的茶多肽样品的制备
取步骤s5所得的茶蛋白1g,加50ml酶液(酸性蛋白酶,浓度为0.96mg/ml,即96mg/100ml),调节ph值至4.0,40℃下水浴酶解2h,期间不断调ph到最适。酶解后4200r/min离心15min,取得上清液置于90℃下灭酶10min。取上述所得提取液置于旋转蒸发仪中浓缩,最后将所得浓缩液进行超滤,获得小于3kd的酶解片段的浓缩液。超滤浓缩液样品置于冻干机中冷冻干燥,冻干后即为本申请使用的绿茶多肽材料,将冻干粉置于-20℃冰箱中保存。
使用时,准确称量绿茶多肽粉末100mg溶于1ml超纯水中。用于细胞的溶液均用0.22μm的滤膜过滤除菌备用。
实施例二、abcg2q141k的制备与细胞转染
1定点突变
1.1引物设计
定点突变要遵循的设计原则是:尽量少的改变位点,减少突变频率,易于验证。在突变位点处,设计一对反向互补的引物。
1)引物合成脱盐要完全,最好选择较纯的纯化方案;2)引物一般要25-35bp左右,引物末端以g或者c结尾;3)参考密码子对照表,尽量减少碱基改变;4)突变的位点两端有至少5-9个与模板匹配的位点;5)引物设计时,可以考虑突变引物序列上的酶切位点,该酶切位点最好是载体和基因片段上其他位置没有的酶切位点。同时,该酶切位点可以用来酶切验证以分辨突变型和野生型;6)本技术中所使用的定点突变引物如下:
q141k突变引物(forward):gtgagagaaaacttaaagttctcagcagctc
1.2pcr
定点突变过程中的pcr步骤必须使用高保真酶。本实验的酶切体系为:
pcr反应条件是95℃预变性5min,95℃变性40s,55-70℃退火50s,72℃延伸8min,循环30次。最后72℃15min,保存在12℃。
1.3dpni酶切
在pcr产物中直接加入dpni酶进行酶切,无须经过纯化。尽量将模板完全切除干净,一般反应时间大于4h。反应体系为:
该体系于37℃反应4h。
1.4转化及单克隆验证
1)取出制备好的感受态细胞,放在冰上融化;
2)每100μl感受态细胞中加入10ng质粒dna或者10μl连接体系,用移液枪轻轻吹打均匀,在冰上静置30min;
3)将离心管放置42℃水浴90s,此过程切勿摇动离心管;
4)迅速将离心管转移至冰中,放置2min;
5)每管中加入400μllb培养液,于37℃温和孵育1h,使菌种复苏;
6)用涂布棒将菌液均匀铺到lb平板上,与37℃培养16-20h;
7)挑取单菌落于含有抗生素的lb液体培养基中培养16-20h;
8)抽提质粒(操作方法参照生工小提质粒试剂盒说明书),进行酶切和测序验证。
2gateway基因克隆
1)lr反应
该体系在25℃反应4h。
2)将lr反应产物直接转化到大肠杆菌克隆菌株感受态中,培养,挑取单克隆,抽提质粒,酶切测序验证。
3细胞培养
3.1细胞复苏
将细胞从液氮中取出,快速于37℃水浴锅中溶解,用酒精对其表面灭菌后转移到超净工作台中,将细胞移到事先加有预热好的新鲜培养液的离心管中,800g离心4min,倒掉上清加入2ml培养液轻轻吹打均匀,移入10cm培养皿中,再加入8ml培养液。37℃,5%co2培养箱中培养。
3.2细胞传代与冻存
当细胞融合度达到90%以上时,对细胞进行传代。吸去细胞上清,pbs清洗1-2遍,加入适量胰酶消化,胰酶的体积以盖住培养皿底部为宜,待消化完全后加入等量新鲜培养液终止消化,轻轻将细胞吹打下来形成细胞悬液,收集悬液于800g离心4min,弃去上清,加入新鲜培养液重悬细胞,根据细胞数量选择适当的比例进行传代。
细胞冻存时所使用的细胞冻存液为90%fbs+10%dmso,冻存时调整细胞浓度为5×106/ml,轻轻吹打均匀后移入冻存管中,然后将冻存管移入冻存盒中于-80℃超低温冰箱中程序降温,24-72h后转移到液氮罐中长期保存。
4细胞转染
1)转染前一天将细胞接种于细胞培养板或培养皿,根据细胞生长速度调整细胞浓度以保证第二天细胞融合度为60-80%;
2)准备复合物,不同数量的细胞需要转染的dna量不一样,以6孔板为例:将1μgdna稀释于150μlopi-memreducedserummedium中轻轻混匀温室孵育5min;将3μllipofectamine2000稀释于150μlopi-memreducedserummedium中,轻轻混匀,温室孵育5min;将dna稀释液缓缓加入lipofectamine2000稀释液中,轻轻混匀,室温孵育15-20min。
3)弃去培养板上清液,每孔加2ml新鲜培养液;将2)中的复合物逐滴加入培养孔,轻轻晃动培养板使其分布均匀;
4)将细胞放在培养箱孵育24h后即可观察基因表达情况,一般48-72h表达水平最高;
5)瞬时转染的细胞样品则是在转染48-72h收集细胞样品。
实施例三、westernblot检测蛋白表达水平
1细胞总蛋白的提取
(1)细胞的预处理:由37℃co2培养箱中取出于细胞培养板中培养的293t细胞,吸弃原培养液,用4℃预冷的1×pbs洗细胞表面3-4次,以去除培养基中的血清及死细胞,并尽量吸弃细胞培养皿中残余的pbs。将洗涤后细胞直接冻存于-80℃冰箱,待提取蛋白质。此方法可保存细胞至少两周。(注:如果需要,当用pbs洗涤细胞后,不必-80℃冰箱冻存,可直接进行步骤2)
(2)加入含pmsf的裂解液:由-80℃冰箱中取出细胞培养皿,将其置于冰上,向上述各培养皿中加入含pmsf的细胞裂解液,轻轻晃动,使裂解液均匀铺于细胞表面。
(3)冰浴10min(通常冰浴时间为30-60min),期间晃动培养皿,使其作用均匀。
(4)用tip头集中蛋白提取液,将其收集入冰上预冷的1.5mlep管中,4℃离心,13200rmp×20min。
(5)将上清液小心移入预冷的0.5ml离心管中(为避免反复冻融导致蛋白降解,可按需要将其分装使用),-80℃保存备用。
2细胞总蛋白含量的测定(bca法)
(1)需96孔板,测蛋白浓度的a液,b液,标准蛋白,要测的样品蛋白。
(2)按要测的样品蛋白的数量来配ab液,每孔需ab混合液200μl(a∶b=50∶1)。有6个样品,加上6个标准蛋白和空白对照,3个复孔。共有36个孔。则a液取10ml,b液取200μl两液混匀,加入96孔板,每孔200μl。然后加入标准蛋白25μl及样品蛋白(蛋白样品5μl+20μl去离子水,即稀释5倍)。(标准蛋白先配好浓度0,0.125,0.25,0.5,1.0,2.0mg/ml)。
(3)将孔板放入37℃温箱孵育30min。
(4)用酶标仪562nm处测od值,用标准曲线法计算蛋白浓度。
(5)调整蛋白浓度后(用裂解液和4×上样缓冲液调整蛋白浓度),98℃5min加热变性,插入冰中冷却后,于-20℃保存。
3制备sds-page凝胶
(1)准备sds-page凝胶用玻璃槽:清洗玻璃板,将两块玻璃板(一个长板一个短板,其中一块为凹形)组合并放置于制胶架夹紧,于玻璃槽中加入去离子水验漏,确定灌制分离胶液面标志线(距样品梳子底部约0.5-1.0cm处);
(2)配制5%浓缩胶(制2块):去离子水4.05ml;30%丙烯酰胺1.005ml;1.0mtris-clph6.80.75ml;10%aps0.06ml;10%sds0.06ml;temde(临灌胶前再加)0.006ml;
(3)配制10%sds-page分离胶:去离子水7.08ml;30%丙烯酰胺6.0ml;1.5mtris-clph8.84.56ml;10%aps0.18ml;10%sds0.18ml;振动仪震动数秒;
(4)灌制分离胶:在通风橱加temed0.012ml,立即灌胶,灌至分离胶液面标志线,立即加入无水乙醇与顶部平齐,分离胶凝固后倒掉无水乙醇;
(5)灌制浓缩胶与插样品梳:用吸水纸尽可能吸干玻璃槽中的无水乙醇,轻轻加入5%浓缩胶液(注意避免产生气泡),插入样品梳,使液面至样品梳上标志线位置,室温凝胶约40min;
(6)取下有sds-page凝胶的玻璃板,置于密封袋中,并加入去离子水适量保持凝胶湿润,封口,于4℃冰箱中保存,备用。
4样品变性及电泳(恒压,浓缩胶80v10-30min,分离胶110v60-90min)
(1)由-20℃冰箱取出调整浓度后的组织蛋白样品,37℃水浴融化,立即插入冰中(减少蛋白降解)。
(2)吸取组织蛋白样品80μl加入1.5mlep管中,每样品管中分别加入20μl4×蛋白质凝胶电泳上样缓冲液,旋涡数秒,短暂离心,98℃变性5min,立即插入冰中,快速冷却至室温,旋涡数秒,短暂离心。
(3)移液枪吸取变性蛋白液20μl,贴紧加样孔上方,将样品轻轻加至凝胶孔中,样品蛋白两端分别加入5μlmarker。
(4)将电泳仪设置成稳压状态,接通电源,将电压调至80v使样品通过浓缩胶(电压约8v/cm)。当染料进入分离胶后,将电压调高到110v(约11v/cm),继续电泳约60min,使染料至分离胶底部位置,结束电泳。
5转膜
(1)pvdf膜的预处理:剪裁与胶大小一致(8.3×6.0cm)的pvdf膜,将其浸入甲醇平衡5min以上,备用。(注意:必须保证pvdf膜完全浸于甲醇中);
(2)转移缓冲液制备:取一瓶配制转移缓冲液的固体粉末,溶于800ml去离子水+200ml甲醇,置于4℃冰箱,备用;
(3)取与胶同样大小的滤纸与海绵,用转移缓冲液浸泡后待用;
(4)取下电泳板,将其平置(使“凹”面玻璃板在下),小心去掉上层玻璃板,切除多余凝胶,将含样品胶用1×转膜液漂洗一次。
(5)转膜:将样品胶与膜装入标有正、负极的转膜夹板中:由阴极侧开始,依次为黑色海绵→1层白色海绵垫片→样品胶→pvdf膜→1层滤纸→1层白色海绵垫片(注意:排除气泡)→黑色海绵,扣紧转膜夹板,放入含有转膜缓冲液的转移电泳槽中(黑对黑),并放入冰盒,周围用冰或冰袋冰盒包裹(使转移缓冲液保持在4℃左右);正确连接转移电泳连线,保证电荷由负极向正极流动(膜侧对红色侧)。接通电源,恒流275-300ma60-90min,中间换一次转移电泳槽中的冰盒;小心取出转移膜,膜剪角或标记膜,在1×tbst液中漂洗两次后放入封闭液中封闭。
6封闭、抗体孵育及曝光
(1)封闭:将转移后的膜放入封闭液中,室温、摇床上缓慢摇动状态下封闭90min(或4℃过夜);
(2)一抗反应
①将一抗用抗体稀释液稀释1000倍,配制为一抗工作液;
②封闭结束后,回收封闭液,将膜用1×tbst漂洗2-3次至干净,剪膜,放入一抗工作液中,4℃反应过夜;
(3)洗膜
回收一抗工作液,将膜用1×tbst洗涤三次(室温下缓慢摇动洗涤),每次5min,洗净未结合的一抗;
(4)二抗反应
①将对应的二抗用1×tbst稀释16000倍,配制为二抗工作液;
②将洗涤后的一抗反应膜放入二抗工作液中(室温、避光缓慢摇动)作用50min(不超过60min);
(5)洗膜:用1×tbst洗膜,方法同“3”,洗去游离二抗;
(6)曝光及洗片:
①按1∶1(v/v)混合ecl试剂盒中两种液体;
②将上述混合液均匀铺在pvdf膜表面,室温作用2min。抖掉膜上液体,将其放入铺有保鲜膜的曝光盒中,再将保鲜膜折叠,以包裹住pvdf膜(避免在膜的上面出现气泡);
③在暗室中(红光下)将x光胶片直接压于包裹后的膜上,曝光盒中曝光适当时间;
④将曝光后x光片放入显影液中显影、清水中漂洗、定影液中定影1min(具体曝光时间及显影时间需根据显影结果作出调整);
曝光可根据实验条件选择适宜方法。
实施例四、实验结果
如图2中所示,pdonr-abcg2wt质粒用bsrgi酶切后得到分子约量为2000bp的abcg2片段,pdnor-abcg2q141k酶切后同样得到分子量约2000bp小片段,初步认为abcg2q141k连接到pdonr载体上,得到abcg2q141k阳性克隆突变。
图3中基因测序结果与设计的q141k基因完全吻合,即q141k突变成功,获得abcg2q141k阳性克隆。
图4中abcg2q141k的大分子蛋白表达水平明显低于野生型abcg2,即获得可以正确表达abcg2q141k蛋白的阳性克隆。
如图5所示,其中abcg2q141k蛋白上样量是wt的4倍。从蛋白表达水平来看,无论是abcg2总蛋白表达量还是大分子蛋白表达量,茶多肽都上调了其表达水平,且abcg2q141k的表达量与野生型abcg2表达水平相当,即茶多肽可以恢复abcg2q141k突变表达改善痛风。
综合以上结果可以看出,一方面,茶多肽可以明显增加abcg2野生型蛋白表达水平,即可以增加尿酸的排泄,缓解一般的痛风疾病;另一方面,茶多肽还可以增加abcg2q141k大分子蛋白的表达量,使其恢复成abcg2野生型,即可以缓解由q141k突变造成的尿酸排泄障碍,恢复abcg2野生型蛋白转运尿酸的能力,在一定程度上缓解由基因突变造成的痛风症状。因此相比于现有治疗药物的需长期服用,治标不治本,又容易产生耐药性等诸多问题,茶多肽不仅可以治疗由生活习惯引起的一般痛风,而且可以靶向的治疗由abcg2q141k这类由基因突变造成的痛风疾病,治疗范围更广,治疗效果更好。
以上描述是本发明的一般性描述。根据情况或实际需要,可进行形式的变化和等值的替代,虽然本文采用特定的术语,但这些术语意在描述,而不是为了限制的目的。本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!