一种高粱14-3-3蛋白GF14c基因及其重组载体和表达方法与流程
本发明涉及一种高粱14-3-3蛋白gf14c基因及其重组载体和表达方法,属于生物技术领域。
背景技术:
高粱(sorghumbicolor(l.)moench),又名芦黍、芦栗,是一种重要的禾谷类作物,具有较强的抗逆境能力,也是饲料、酿酒、生产生物燃料、造纸以及工业淀粉的重要原料,同时也是近年来广泛使用的的一种畜牧饲用作物。高粱在我国的栽培历史悠久,在建国之前并未规模化栽培,直到上世纪70年代,随着经济和社会的发展,我国才逐渐重视并规模化栽培高粱。高粱属于短日照c4植物,相比其它的能源作物,高粱具有更加明显的光合作用效率以及更高的产量优势,因此,被誉为“高能作物”。近年来,随着全球性的环境问题和能源危机的日益严重,人们不断的再寻求一种安全、无污染、高效的生物质能源。其中高粱作为一种优质的能源植物引起科学界的重视和研究。为了更加深入研究高粱,美国能源部生物和环境研究中心于2009年顺利对高粱基因组进行测序并组装,这标志着对高粱的研究工作进入基因水平,同时也为高粱重要基因的克隆和功能分析提供了便利。
14-3-3蛋白最早发现于脑组织中,被认为与神经元组织独特相关,其命名来自对淀粉凝胶迁移率和脑总蛋白分离得到的组分编号。目前,研究发现,14-3-3蛋白普遍存在于所有类型的真核细胞中,是高度保守的真核蛋白,能够与靶蛋白结合,在大多数情况下,这种结合需要发生磷酸化修饰,进而调节它们的活性、稳定性、亚细胞定位以及参与形成蛋白复合物。在植物生长发育过程中,14-3-3蛋白通过与其它蛋白的相互作用参与多种植物激素信号转导、各种代谢调控、物质运输和光信号应答等调控过程。在拟南芥、烟草和大麦等许多植物中都发现14-3-3蛋白基因。但迄今为止,国内外尚未见14-3-3蛋白基因在高粱中研究报道。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种高粱14-3-3蛋白gf14c基因及其重组载体和表达方法。
本发明的技术方案是:一种高粱14-3-3蛋白gf14c基因,其核苷酸序列如seqidno.1所示。
本发明还提供所述高粱14-3-3蛋白gf14c基因编码的蛋白质,其氨基酸序列如seqidno.2所示。
相应的,本发明提供包含上述高粱14-3-3蛋白gf14c基因的重组载体和表达方法。
具体地,所述重组载体的制备方法如下:提取高粱rna,并反转录出cdna;以cdna为模板扩增gf14c基因;将gf14c扩增产物经bamhi和xhoi双酶切后,通过dna连接酶插入到经同样双酶切的pet-28a表达载体中,得到重组质粒pet-28a-gf14c。
优选地,以cdna为模板,利用以下引物扩增gf14c基因,引物序列如下:
上游引物:gf14c-f:gcgaattcatggcatcagcagagcttt下划线为bamhi酶切位点;
下游引物:gf14c-r:cgctcgagttactgcccctcgctcga下划线为xhoi酶切位点;
上下游引物分别如seqidno.3、4所示。
具体地,表达高粱14-3-3蛋白gf14c基因的方法,包括以下步骤:
(1)用权利要求3或4所述的重组载体转化大肠杆菌细胞,得到表达gf14c的重组原核表达菌株;
(2)将重组原核表达菌株接种到卡那霉素或卡那霉素+氯霉素液体培养基中,过夜培养活化菌株;
(3)将活化的重组原核表达菌株转接到卡那霉素或卡那霉素+氯霉素液体培养基中,震荡培养后加入iptg诱导重组gf14c的表达;
(4)诱导完成后,回收并纯化所表达的gf14c重组蛋白。
优选地,步骤(3)中在震荡培养至od600=0.5时,加入终浓度为1.2mm的iptg,在30℃诱导培养。
所述卡那霉素液体培养基中卡那霉素为50ug/ml。
所述卡那霉素+氯霉素液体培养基中卡那霉素为50ug/ml,氯霉素为50ug/ml
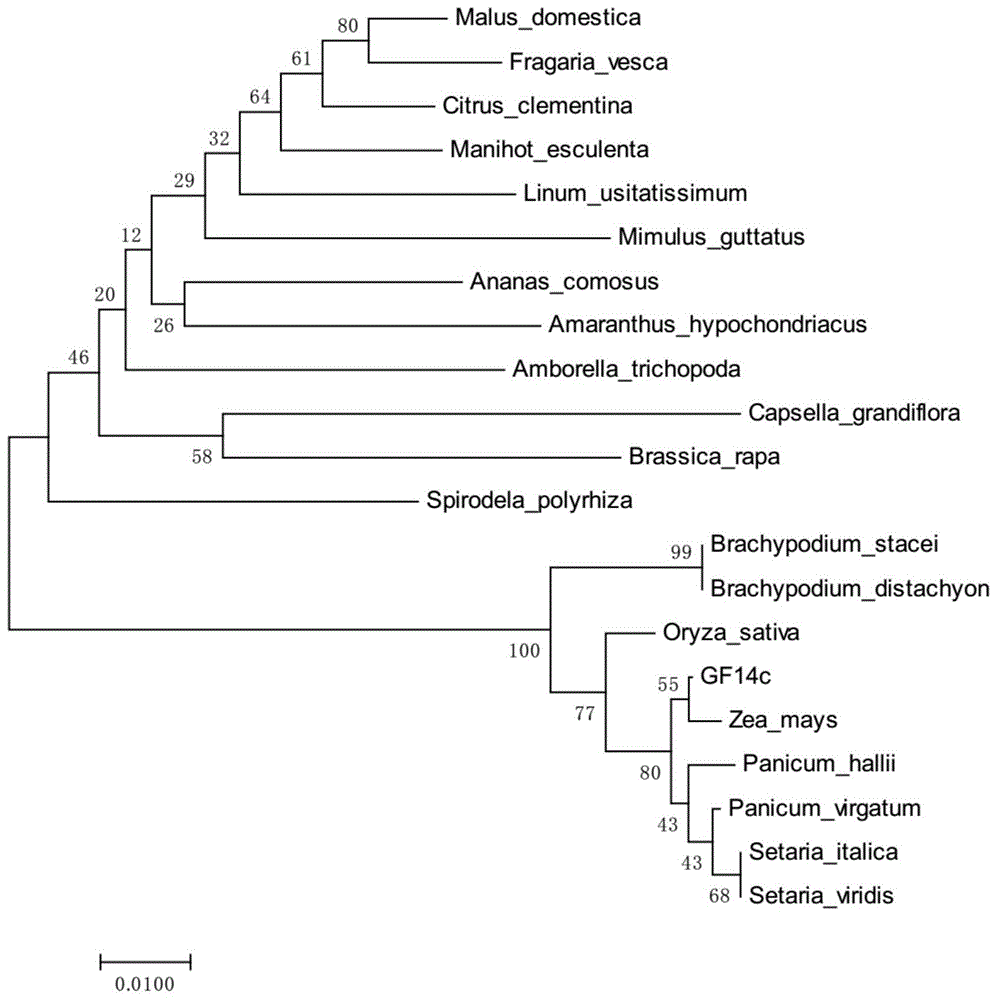
本发明的有益效果是:针对目前对高粱中的基因研究比较少,尤其14-3-3蛋白gf14c基因没有相关报道,本发明通过玉米gf14c基因的蛋白序列,从高粱基因组数据库中获得高粱同源基因gf14c,该基因cds全长771bp,根据该基因推导出的氨基酸序列,在ncbi数据库中下载其它物种中的gf14c基因,以邻接法构建无根进化树,结果表明其氨基酸序列与玉米gf14c聚为一支,亲缘关系较近,说明gf14c基因是高粱14-3-3蛋白基因。
基因的原核表达是研究基因功能的常用技术之一,但在原核表达中,蛋白通常以包涵体的形式存在于沉淀中,如何让蛋白在细胞上清中以可溶性形式表达是原核表达中面临的技术难题。另外,本发明为得到gf14c可溶性蛋白,构建了高粱14-3-3蛋白gf14c基因的原核表达载体,并且针对蛋白表达条件进行一系列的优化,发现gf14c可以在bl21(de3)plyss,jm109(de3),rosetta(de3),bl21(de3),tuner(de3),这5个菌株中表达,其中在bl21(de3)中表达量最多;当诱导温度为30℃时,其表达量最佳;随着iptg浓度的增加,蛋白表达量逐渐增加,最佳诱导浓度为1.2mm。经sds-page电泳检测,得到分子量约为36kda的目的条带,为gf14c蛋白预期大小,最终得到gf14c可溶性蛋白。同时,本发明用蛋白纯化系统对其进行纯化,其结果为进一步研究蛋白晶体结构和生物学特性奠定基础,进而为通过基因编辑方法提高高粱的抗逆性提供依据。
附图说明
图1为高粱gf14c基因的系统进化树;
图2为酶切结果示意图,1为酶切的质粒dna,2为bamhi和xhoi内切酶切结果,3为dnamarker;
图3为gf14c蛋白通过akta蛋白纯化系统纯化和脱盐得到的蛋白峰图;
图4为gf14c蛋白纯化后的电泳结果图;
图5为sds-page电泳测试最佳表达菌株的结果图;
图6为sds-page电泳测试最佳iptg诱导浓度的结果图;
图7为sds-page电泳测试最佳诱导温度的结果图;
图8为westernblot检测图。
具体实施方式
下面结合附图及具体的实施例对发明进行进一步介绍:
实施例1:高粱14-3-3蛋白gf14c基因的获取与分析
根据已报道的玉米gf14c基因的蛋白序列,blastp搜索高粱基因组数据库(https://phytozome)找到高粱同源基因gf14c(基因号为sb03g028430)。以gf14c蛋白搜索ncbi数据库,下载其它物种中的14-3-3基因,用mega7.0软件,以邻接法(neighbor-joining,nj)(bootstrap=1000)构建无根进化树,由图1可以看出,gf14c与玉米gf14c聚为一支,亲缘关系最近。
实施例2:高粱14-3-3蛋白gf14c基因重组载体的构建与鉴定
1、提取高粱rna,并反转录出cdna
取高粱btx623材料,利用rna提取试剂盒(天根生化科技(北京)有限公司)提取苗期总rna,用反转录试剂盒(promega)反转录得cdna。
2、以cdna为模板扩增gf14c基因;
设计引物,以cdna为模板对gf14c基因进行扩增。
引物如下:
上游引物:gf14c-f:gcgaattcatggcatcagcagagcttt下划线为bamhi酶切位点;
下游引物:gf14c-r:cgctcgagttactgcccctcgctcga下划线为xhoi酶切位点;
上下游引物分别如seqidno.3、4所示。
用于载体构建的基因扩增所用的pcr扩增体系如下:5×buffer10μl,fastpfuflydnapolymerase1μl(全式金),2.5mmoldntps4μl,cdna模板0.5μl,10μmol上下游引物各1μl,ddh2o32.5μl。
以下为pcr扩增条件:95℃2min,35个循环(95℃20s,58℃20s,72℃30s-1min(根据dna片段长度确定),72℃5min。
3、构建gf14c基因重组载体
pcr产物经纯化后,连接到pet-28a载体。采用1%琼脂糖对pcr产物进行检测。pcr产物参考南京诺唯赞生物科技有限公司琼脂糖凝胶回收试剂盒说明书进行回收。回收后的产物经bamhi和xhoi双酶切后通过dna连接酶插入到经同样双酶切的pet-28a表达载体中,16℃连接16小时,构建pet-28a-gf14c重组质粒。
将重组质粒转化到大肠杆菌菌株dh5a,在50ug/ml卡那霉素固体平板上于37℃培养,挑选单菌落经酶切鉴定正确后(酶切结果如图2所示),再通过北京擎科生物科技有限公司测序验证其序列正确性。测序结果表明,所获得的gf14c基因编码区序列与预计相符,说明重组质粒构建成功并将其命名为pet-28a-gf14c,即重组载体。
实施例3:gf14c蛋白的诱导表达
1、获得gf14c的重组原核表达菌株
挑测序成功的单克隆接种到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养,按照南京诺唯赞生物科技有限公司质粒小量提取试剂盒将pet-28a-gf14c重组表达载体提取出来,取重组表达载体转化大肠杆菌分别转化大肠杆菌bl21(de3),jm109(de3),rosetta(de3),bl21(de3)plyss,tuner(de3),novablue(de3)检测gf14c蛋白的表达。
2、过夜培养活化菌株
过夜培养活化上述的重组原核表达菌株。例如,将bl21(de3)、jm109(de3)、tuner(de3)、novablue(de3)菌株转接到50ug/ml卡那霉素液体培养基中,将rosetta(de3)、bl21(de3)plyss菌株转接到50ug/ml卡那霉素+50ug/ml氯霉素液体培养基中,37℃、200rpm过夜培养活化菌株。
3、诱导表达
将活化的重组原核表达菌株转接到含相应抗生素的液体培养基中,例如,将活化的bl21(de3)、jm109(de3)、tuner(de3)、novablue(de3)菌株转接到50ug/ml卡那霉素液体培养基中,将rosetta(de3)、bl21(de3)plyss菌株转接到50ug/ml卡那霉素+50ug/ml氯霉素液体培养基中,37℃震荡培养至od600=0.5时,加入终浓度为1.2mm的iptg,在30℃诱导培养10小时,获得gf14c的重组蛋白。
4、gf14c重组蛋白的纯化
诱导完成后,回收并纯化所表达的gf14c重组蛋白,采用akta蛋白纯化系统进行纯化和脱盐,优选地,采用aktapurifier10快速蛋白纯化系统进行蛋白纯化,步骤如下:
由于pet28a在终止子前具有6个his编码序列,所以pet28a-gf14c重组表达载体获取的蛋白可以利用ni-nta进行亲和层析纯化。亲和层析是以蛋白质或生物大分子和结合在介质上配基间的特异亲和力为基础,因为his-tags所用层析凝胶的基质上连接了一个nta[(nitrilotriaceticacid)氮基三乙酸],可以与ni离子结合,而ni离子与融合蛋白的6×his氨基酸之间产生吸引力,从而将带有his-tags组氨酸标签的融合蛋白与其它蛋白区分开来,组氨酸残基的五元咪唑环是蛋白与ni离子作用的关键,因此当我们用高浓度的咪唑(imidazole)溶液洗脱的时侯(如400mm),咪唑便于蛋白质his-tags的咪唑环竞争结合,最终将融合蛋白从凝胶上洗脱下来。
具体操作:取出-80℃保存的菌体,加入lysisbuffer重悬,重悬后的菌液于冰浴中进行超声波破碎,其功率为350w,占空比50%,每个循环30s,总时间35min。破碎后的匀浆,4℃,1,2000rpm离心30min。用蠕动泵将上清液吸附到ni-nta吸附柱上,5ml/min,重复一次,保留20μl通过吸附柱的样品进行蛋白胶电泳;将ni-nta吸附柱连接到快速蛋白纯化系统上,进行洗脱;根据uv吸收曲线收集蛋白,并取样进行蛋白胶电泳检测。
图3为akta蛋白纯化系统纯化蛋白峰图。gf14c蛋白通过akta蛋白纯化系统纯化得到的蛋白峰图。gf14c纯化图为纯化gf14c蛋白时紫外(uv)吸收值。
图4为gf14c蛋白纯化后的电泳图。其为在30℃,iptg浓度1.2mm时表达纯化gf14c蛋白结果。1为经过ni柱亲和后纯化后的蛋白;2为ni柱亲和后蛋白流出液;m为蛋白marker;箭头所指示为gf14c蛋白。图5显示,此条件下gf14c蛋白多出现在了上清液中,通过akta蛋白纯化系统纯化后得到的gf14c蛋白纯度达到要求,可用于后续实验。
实施例4:gf14c蛋白诱导表达条件的验证
1、获得gf14c的重组表达菌株
挑选实施例2中测序成功的单克隆接种到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养,按照南京诺唯赞生物科技有限公司质粒小量提取试剂盒将pet-28a-gf14c重组表达载体提取出来,取重组表达载体分别转化大肠杆菌bl21(de3),jm109(de3),rosetta(de3),bl21(de3)plyss,tuner(de3),novablue(de3)菌株,涂布于含50ug/ml卡那霉素(rosetta(de3),bl21(de3)plyss需补加50ug/ml氯霉素)平板上于37℃进行过夜培养,挑取单菌落接种到50ug/ml卡那霉素(rosetta(de3),bl21(de3)plyss需补加50ug/ml氯霉素)液体培养基中,37℃、200rpm过夜培养,在菌液中加入灭菌50%甘油,混匀后冻存于-80℃冰箱,得到表达gf14c的原核表达菌株。
2、gf14c基因诱导表达最佳菌株的确定
分别接种上述的重组原核表达菌株bl21(de3)、jm109(de3)、tuner(de3)、novablue(de3)菌株到50ug/ml卡那霉素液体培养基中,接种rosetta(de3)、bl21(de3)plyss到50ug/ml卡那霉素+50ug/ml氯霉素液体培养基中,37℃、200rpm过夜培养活化菌株。
将活化的bl21(de3)、jm109(de3)、tuner(de3)、novablue(de3)菌株转接到50ug/ml卡那霉素液体培养基中,将rosetta(de3)、bl21(de3)plyss菌株转接到50ug/ml卡那霉素+50ug/ml氯霉素液体培养基中,37℃震荡培养至od600=0.5时,加入终浓度为1mm的iptg,在25℃诱导培养12小时(取pet-28a菌作阴性对照)。诱导完成后4℃,1,2000rpm离心2min,收集菌体,细菌沉淀与阴性对照用2ml预冷pbsbuffer(用前加入1mmpmsf)悬浮,用超声破碎仪进行细胞破碎,每次10sec,共10次,每次间隔30sec;1,2000rpm离心10min,取上清,sds-page电泳检测,测试最佳表达菌株,结果如图5所示,gf14c可以在bl21(de3)plyss,jm109(de3),rosetta(de3),bl21(de3),tuner(de3),这5个菌株中表达,其中在bl21(de3)中表达量最多。
3、gf14c基因诱导表达最佳iptg浓度的确定
接种上述的重组原核表达菌株tuner(de3)到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养活化菌株。将活化的重组原核表达菌株转接到50ug/ml卡那霉素液体培养基中,37℃震荡培养至od600=0.5时,分别加入终浓度为0.4、0.6、0.8、1.0、1.2mm的iptg,在25℃诱导培养10小时(取未诱导的菌作阴性对照)。诱导完成后4℃,1,2000rpm离心2min,收集菌体,细菌沉淀与阴性对照用2ml预冷pbsbuffer(用前加入1mmpmsf)悬浮,用超声破碎仪进行细胞破碎,每次10sec,共10次,每次间隔30sec;1,2000rpm离心10min,取上清,sds-page电泳检测,测试最佳iptg诱导浓度,结果如图6所示,当iptg浓度为1.2mm时,gf14c表达最多。
4、gf14c基因诱导表达最佳温度的确定
接种上述的重组原核表达菌株bl21(de3)到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养活化菌株。将活化的重组原核表达菌株再转接到50ug/ml卡那霉素液体培养基中,37℃震荡培养至od600=0.5时,加入终浓度为0.8mm的iptg,分别在16、20、25、30、和37℃诱导培养8-16小时(取pet-28a菌作阴性对照)。诱导完成后4℃,1,2000rpm离心2min,收集菌体,细菌沉淀与阴性对照用2ml预冷pbsbuffer(用前加入1mmpmsf)悬浮,用超声破碎仪进行细胞破碎,每次10sec,共10次,每次间隔30sec;1,2000rpm离心10min,取上清,sds-page电泳检测,测试最佳诱导温度,结果见图7,在30℃诱导培养时,gf14c表达量最多。
实施例5:gf14c重组蛋白的westernblot检测
(一)提取经过纯化后的gf14c蛋白:
1.培养含有pet-28a-gf14c质粒的大肠杆菌表达菌株,iptg诱导表达;
2.加入蛋白裂解液(50mmtrisph8.0,120mmnacl,1mmdtt,0.5%np-40,用前加入1mmpmsf,1mmdtt),用超声波破碎细胞后,离心收集上清,冰上放置20min;
3.15,000g,4℃离心5min,弃沉淀;
4.取200μl上清加入5×loadingbuffer,震荡混匀,剩余样品-80℃冻存;
5.沸水煮5min,冰浴,12,000rpm离心5min,吸取上清15μl进行蛋白电泳,剩余样品-20℃冻存;
6.制备sds-page胶,先用90v进行电泳20min,待样品进入分离胶时,用150v电压进行电泳,至溴酚蓝跑出分离胶时停止电泳。
(二)转膜
用裁纸刀裁出比胶稍大一些的pvdf膜(对于pvdf膜,先用甲醇浸泡30秒,再在ddh2o中浸泡3-5min,然后放入转膜buffer中)将胶板夹放入转移电泳槽。倒入转膜缓冲液,4℃,100v90min。
(三)封闭
转膜完成后,取出pvdf膜,放于用5%脱脂奶粉的pbst溶液中,摇床上封闭2h。
(四)一抗孵育
弃去封闭液,加入antihis抗体(1:5000),摇床孵育12h。
(五)二抗孵育
倒掉一抗,用1×pbst洗涤pvdf膜3次,每次5min;加入对应的二抗(羊抗小鼠),摇床孵育1h。
(六)ecl曝光
弃二抗,用1×pbst洗涤pvdf膜3次,每次5min;在pvdf膜上加入hrp化学发光底物液,在天能5200化学发光检测仪上检测蛋白表达信号(如图8所示),从结果可以看出成功表达出gf14c蛋白。
核苷酸系列表:
sequencelisting
序列表
<110>贵州大学
<120>一种高粱14-3-3蛋白gf14c基因及其重组载体和表达方法
<160>4
<210>1
<211>771
<212>dna
<213>高粱14-3-3蛋白gf14c
<400>1
atgtcgagggaggagaatgtttacatggccaagctggctgagcaggctgaaaggtatgag60
gagatggttgagtatatggagaaggtggccaagactgtagatgttgaagagctcactgtt120
gaggagcggaacctcctgtctgtcgcatacaagaatgtcattggggctcgccgtgcttca180
tggcgcattgtctcttccattgaacagaaggaggagtctcgtaagaacgaagagcatgtg240
aaccttatcaaggaataccgtgggaagattgaggctgaactgagcaacatctgtgatggt300
atcctgaagctacttgactcccacctagtgccttcttctactgctgccgaatcaaaggtc360
ttctacctcaagatgaagggtgactatcacaggtatcttgcggaatttaagactggtgct420
gagaggaaggaatctgctgagagcacgatggtagcctacaaggctgctcaggacattgct480
ctggctgagctggcaccaacccatccgataaggcttgggcttgctcttaacttctcggtg540
ttctattatgagattctgaactccccagacaaagcttgcaaccttgcaaagcaggcgttt600
gatgaagccatctctgagttggatacccttggggaggagtcatacaaagatagcactctg660
atcatgcagctcctgagggacaacttgaccctttggacctctgacctcacggaggacggt720
gctgatgagtgcaaagaagcctcgaaaggcgatgctggcgagggacagtaa771
<210>2
<211>256
<212>prt
<213>高粱14-3-3蛋白gf14c
<400>2
msreenvymaklaeqaeryeemveymekvaktvdveeltveernllsvayknvigarras60
wrivssieqkeesrkneehvnlikeyrgkieaelsnicdgilklldshlvpsstaaeskv120
fylkmkgdyhrylaefktgaerkesaestmvaykaaqdialaelapthpirlglalnfsv180
fyyeilnspdkacnlakqafdeaiseldtlgeesykdstlimqllrdnltlwtsdltedg240
adeckeaskgdagegq256
<210>3
<211>27
<212>dna
<213>人工序列
<400>3
gcgaattcatggcatcagcagagcttt27
<210>4
<211>26
<212>dna
<213>人工序列
<400>4
cgctcgagttactgcccctcgctcga26
- 还没有人留言评论。精彩留言会获得点赞!