单层或多层的3D脑胶质瘤细胞培养模型及其构建方法和应用与流程
本发明涉及细胞培养模型,尤其涉及单层或多层的3D脑胶质瘤细胞培养模型及其构建方法,本发明还涉及该脑胶质瘤细胞模型在脑胶质瘤实验研究或者抗肿瘤药物筛选中的应用,属于脑胶质瘤细胞培养模型构建及应用领域。
背景技术:
脑胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,年发病率在4/10~5/10万。随着细胞生物学和分子病理学的发展,已经确定脑胶质瘤是一类异质性极高的肿瘤,同一患者同一部位的脑胶质瘤细胞之间分子表型差异很大,而分子表型与治疗反应息息相关。在目前的实验研究中往往利用脑胶质瘤细胞系(例如U87、LN229、U251等)或者病人来源的脑胶质瘤原代细胞进行2维培养平面上的实验,这种培养方式形成的培养物,其分子表型结构单一或者随着传代次数的增加越来越单一,难以再代表脑胶质瘤的生物学特征,急需构建具有代表性的肿瘤模型以及构建方式。
随着脑胶质瘤的生长,肿瘤内部往往存在着缺氧坏死核心,尤其是高度恶性的脑胶质瘤类型,从肿瘤表面到核心往往存在氧气和营养梯度,研究表明这种氧气和营养梯度与体内肿瘤干细胞特性的维持息息相关,而肿瘤干细胞是治疗抵抗、肿瘤复发的主要来源之一。脑胶质瘤2维随着组织工程和生物材料科学的发展,其与肿瘤学的交叉也越来越多,尤其在肿瘤3D模型的实验方面。其使用的构建支架多为高分子合成的多孔材料,少数也使用脱细胞基质。这些材料能为细胞提供3维的空间生长环境,研究结果表明这种3维的生长环境更能模拟肿瘤细胞在体内的生物学行为,且在加入其他肿瘤相关细胞共培养时,更能模拟体内环境,表现出与体内相似的形态、迁移方式、细胞表型、代谢形式、药物反应、基因表达谱等。尤其在用脱细胞基质做支架时,还能提供细胞与细胞外基质互相作用环境。有研究结果表明,细胞外基质谱也能影响肿瘤的形态、迁移方式、细胞表型、代谢形式、药物反应、基因表达谱。但由于脑组织本身脆弱,脱细胞后更是弱不禁风,难以成型,难以进行细胞接种实验,且由于脱细胞组织块大,接种细胞后难以迁入脱细胞组织内部,且在脱细胞组织内分布不均匀。
脑胶质瘤不像其他恶性肿瘤一样容易形成远隔器官的转移,脑胶质瘤细胞很少发生颅外转移,但大都沿着脑内血管壁、脑白质间隙、髓鞘形成脑内的广泛播散。这一特性决定了其复发率高的特点。从目前的研究来看,这种生物学行为被认为除了与脑胶质瘤的分子表型有关外,主要与脑组织的细胞外基质(例如透明质酸、胶原、组织结构等)以及肿瘤相关细胞(例如巨噬细胞、血管内皮细胞等),也即是肿瘤微环境有关。肿瘤细胞通过直接接触、旁分泌等方式与这些因素互相作用形成相应的生物学行为,然而现有的2维平面培养也很难模拟出这些因素,平面培养也很难模拟出这些因素,急需更具有代表性的肿瘤模型。
技术实现要素:
本发明的目的之一是提供一种能模拟体内脑胶质瘤生物学特性的单层或多层的3D脑胶质瘤细胞培养模型;
本发明的目的之二是提供一种构建所述单层或多层的3D脑胶质瘤细胞培养模型的方法;
本发明的目的之三是将所构建的3D脑胶质瘤细胞培养模型应用于脑胶质瘤的实验研究或抗脑胶质瘤的药物筛选。
本发明的上述目的是通过以下技术方案来实现的:
本发明提供了一种单层或多层的3D脑胶质瘤细胞培养模型,其构建方法包括:
(Ⅰ)将实验动物或人的大脑组织脱去细胞得到脱细胞的大脑组织;
(Ⅱ)将脱细胞的大脑组织进行冰冻处理;
(Ⅲ)冰冻处理后的脱细胞大脑组织用冰冻切片机切片;
(Ⅳ)切片预冷后进行冷冻干燥后灭菌得到支架;
(Ⅴ)将脑胶质瘤细胞接种到单片的支架上培养得到单层的脑胶质瘤细胞3D培养模型;或者将脑胶质瘤细胞接种到多片叠加的多层支架上培养得到多层的脑胶质瘤细胞3D培养模型;
本发明中所述的实验动物可以是大鼠、小鼠或猪等,优选为大鼠。
所述的脱细胞的大脑组织脱除了全部细胞,部分保存原有脑基质的基质结构和生物成分,譬如透明质酸、糖胺聚糖、蛋白聚糖、各种生长因子等,采用这种脱细胞的大脑组织的切片能作为脑胶质瘤细胞单独培养或者与其他相关细胞共培养的支架;其中,将大脑组织中的细胞脱除的方法可以采用任何一种常规的从组织中脱除细胞的方法;只要能够去除大脑中的细胞成分,尽可能的保存其原有机械性能、ECM成分、各种细胞因子等,这样的脱细胞处理方式均能适用于本发明。
作为一种优选的实施方式,本发明提供了一种将动物或人的大脑组织脱去细胞得到脱细胞的大脑组织的方法,包括:
(1)将实验动物或人的去除小脑后的大脑组织在-80℃和常温下进行交替冻融;
(2)在摇床上,将冻融处理后的大脑组织用去离子水处理;
(3)在摇床上,将去离子水处理后的的大脑组织用1%Triton-X100处理得到初步脱细胞的脑组织;
(4)在摇床上,将初步脱细胞的大脑组织再用去离子水处理;
(5)在摇床上,将用去离子水处理后的大脑组织用4%的脱氧胆酸钠处理得到脱细胞的大脑组织。
其中,步骤(1)中物或人的去除小脑后的大脑组织用1×PBS冲洗一遍后再于-80℃和常温进行冻融交替;所述的冻融交替是在-80℃放置20-45min再于常温放置20-45min,如此交替冻融4次;所述的常温可以是18-27℃的温度。
优选的,步骤(2)中,将冻融处理后的大脑组织以30-120rpm的转速,室温下用去离子水处理1-8h;更优选的,将冻融处理后的大脑组织以60rpm的转速,室温下用去离子水处理4h。
优选的,步骤(3)中将去离子水处理后的的大脑组织以30-120rpm的转速,4℃下用0.5-3%Triton-X100处理4-24h,得到初步脱细胞的脑组织;更优选的,步骤(3)中将去离子水处理后的大脑组织以60rpm,4℃下用1%Triton-X100处理12h,得到初步脱细胞的脑组织。
优选的,步骤(4)中将初步脱细胞的大脑组织以30-120rpm,室温下用去离子水洗2-5遍,5-15min/遍;更优选的,将初步脱细胞的大脑组织以60rpm,室温下用去离子水洗3遍,10min/遍。
优选的,步骤(5)中将用去离子水冲洗处理后得到的大脑组织在30-120rpm的转速条件下,室温下用2-6%的脱氧胆酸钠处理8-24h,得到脱细胞的大脑组织;更优选的,步骤(5)中将用去离子水洗后得到的大脑组织在60rpm的转速条件下,室温下用4%的脱氧胆酸钠处理12h,得到脱细胞的大脑组织。
为了充分的将残留的细胞液以及细胞成分从大脑组织中脱除,本发明进一步将所得到的脱细胞的大脑组织进行下述处理:
(1)在摇床上,将得到的脱细胞的大脑组织以60rpm的转速,室温下用去离子水洗3遍,10min/遍。
(2)在摇床上,将步骤(2)用去离子水处理后的脱细胞的大脑组织以60rpm的转速,室温下用1M蔗糖溶液处理15min;
通过上述处理步骤,可以将大脑组织中残留的细胞液以及细胞成分彻底的从大脑组织中脱除。
优选的,步骤(Ⅱ)中将脱细胞的大脑组织于-80℃温度下进行冰冻处理;
步骤(Ⅲ)中所述的切片的切片方向可为任意方向,譬如冠状面、矢状面等,切片温度可以为-9℃至-15℃,切片厚度可以为30um-100um;
步骤(Ⅳ)中所述的冷冻干燥温度优选为-45℃,所述冷冻干燥时间优选为12h;所述的灭菌优选采用Co60照射灭菌。
优选的,步骤(Ⅴ)中将脑胶质瘤细胞接种到单片的支架上得到的单层的脑胶质瘤细胞3D培养模型的方法包括:将含有脑胶质瘤细胞的细胞培养液浓缩至1-20ul,滴在培养皿中央,在液滴上加上一片灭菌后的脱细胞脑切片,再在该切片上滴加一滴脑胶质瘤细胞浓缩悬液得到单层的脑胶质瘤细胞3D培养模型;
步骤(Ⅴ)中将脑胶质瘤细胞接种到多片叠加的的多层支架上得到多层的脑胶质瘤细胞3D培养模型的方法包括:在已接种有脑胶质瘤细胞的单片脑切片上再叠加上一片灭菌后的脱细胞脑切片,再于该切片上滴加一滴脑胶质瘤细胞浓缩悬液后再叠加上一片灭菌后的脱细胞脑切片;以此类推,以“三明治”样叠加方式构建得到多层的脑胶质瘤细胞3D培养模型。
将脑胶质瘤细胞接种到单片支架得到单层的脑胶质瘤细胞3D培养模型或接种到多层的支架构建得到多层的脑胶质瘤细胞3D培养模型后还需要向支架中加入适量的细胞培养液进行培养并根据情况进行换液,所述换液次数优选为接种第二天换液一次,接下来2-4天换液一次,具体换液方案,本领域人员可根据具体3D脑胶质瘤模型的生长代谢情况而定。
本发明中所述的脑胶质瘤细胞可以是LN229或U87等脑胶质瘤细胞。
本发明将所构建的单层3D脑胶质瘤模型以及多层3D脑胶质瘤模型进行培养观察,发现其培养液变黄速度明显低于同量细胞的2D培养体系,这说明其细胞代谢率下降,符合体内肿瘤细胞代谢低于体外培养肿瘤细胞代谢的情况。对单层的3D脑胶质瘤模型培养1天后进行钙黄绿素和碘化丙啶染色,观察细胞生存与死亡情况,结果发现:单层的3D肿瘤模型,可见细胞分布均匀,大多呈球分布于脱细胞支架上,有聚集成团分布的趋势,少数可见凸起伪足,未见死细胞存在。将构建的多层的3D脑胶质瘤模型进行多层共聚焦扫描3D重建(扫描厚度为250um),可见细胞均匀的生长于3D培养的脑胶质瘤模型内,不同层次的细胞之间互相交错,细胞呈球状、多突起分布,未见死细胞存在。多层3D培养的脑胶质瘤模型培养5天和培养15天后作对比可见细胞密度增加,这些观察表现说明,细胞能很好的立体分布于支架内,存活并且增殖,证明3D脑胶质瘤模型内的胶质瘤细胞的形态以及代谢水平均接近于体内脑胶质瘤。
本发明能在不添加其他支撑材料或者应用交联剂的基础上,使脱细胞的脑组织成型,将其进行切片,而且能使脑胶质瘤细胞通过“三明治”叠加的构建方式均匀分布于脱细胞脑组织内。在这个3D脑胶质瘤模型中的脑胶质瘤细胞生长模式与在体的脑胶质瘤细胞生长模式非常相似。所构建的大脑脱细胞切片3D培养脑胶质瘤细胞模型,能用于脑胶质瘤细胞与ECM以及肿瘤相关细胞互相作用机制研究,也能应用于临床抗胶质瘤药物的筛选。同一动物的脑组织可以切除上百张脱细胞脑切片,能保证材料的均一性;其中单层3D脑胶质瘤模型更方便于实验效果的观察,而多层3D脑胶质瘤模型更能模拟体内乏氧、营养梯度环境,二者互相补充。
本发明的有益效果
(1)本发明所用构建3D脑胶质瘤模型的脱细胞脑切片支架,脱除细胞完全,核酸残留少,能部分保存原有脑基质的立体网状结构和生物成分(如透明质酸、糖胺聚糖、蛋白聚糖、各种生长因子等),因此能模拟体内脑胶质瘤细胞生长的微环境,使培养的脑胶质瘤细胞的生物学特性更接近在体生长的脑胶质瘤细胞,适用于抗肿瘤药物的筛选、脑胶质瘤细胞与ECM作用机制的研究。
(2)本发明所用构建3D脑胶质瘤模型的脑脱细胞切片支架,提供了一个细胞接种平面,细胞能较均匀分散于其中,通过“三明治”叠加的构建方式,能保证多片3D模型中的脑胶质瘤细胞均匀分布。
(3)本发明所用构建3D脑胶质瘤模型的脑脱细胞切片支架,为厚度30um-100um的薄片,面积可根据实验目的裁定。单层的3D脑胶质瘤模型能很方便的用于各种显微镜、组织学、免疫组织或细胞化学的观察。多层“三明治”叠加构建的3D脑胶质瘤模型能通过增加层数、选用大面积的切片来叠加,从而构建大体积(厘米级)的3D脑胶质瘤模型,模拟体内脑胶质瘤的乏氧和营养梯度梯度。
(4)本发明所用构建3D脑胶质瘤模型的脑脱细胞切片支架,为一个细胞兼容性的天然生物材料,不仅适合脑胶质瘤细胞的生长,还能适合其他脑胶质瘤相关细胞的生长,将这些细胞与脑胶质瘤细胞共培养将更加模拟体内的肿瘤微环境,不仅可以用于抗脑胶质瘤药物的筛选,而且可以用于脑胶质瘤细胞与其肿瘤相关细胞作用机制的研究。
(4)本发明的取材易得,脱细胞试剂常见便宜,所需设备要求不高,且同一动物的脑组织能切除成百上千的脑脱细胞切片,既来源充足,又能保证均一性,所以构建成本低,实用性强,适合推广。
附图说明
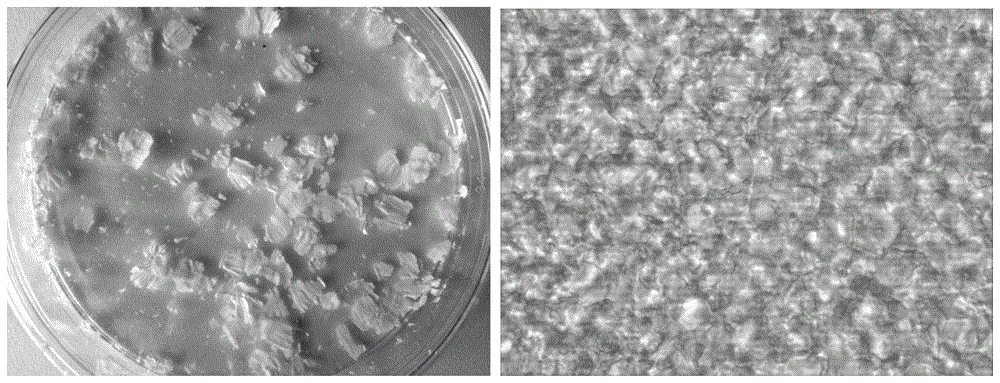
图1为本发明SD大鼠脑脱细胞切片肉眼观(左)以及显微观(右);
图2为本发明SD大鼠脑脱细胞前(左)后(右)的HE染色图;
图3为本发明SD大鼠脑脱细胞前(左)后(右)的DAPI染色图;
图4为本发明单层脱细胞脑切片构建出3D脑胶质瘤模型的肉眼观;
图5为本发明10层脱细胞脑切片构建出3D脑胶质瘤模型的肉眼观;
图6为本发明单层脱细胞脑切片构建出3D脑胶质瘤模型的钙黄绿素染色和碘化丙啶双染共聚焦物镜4倍图;
图7为本发明多层脱细胞脑切片构建出3D脑胶质瘤模型的钙黄绿素染色和碘化丙啶双染共聚焦多层扫描(250um)后重建图;
图8为本发明多层脱细胞脑切片构建出3D脑胶质瘤模型培养第5天(左)、15天(右)的钙黄绿素染色和碘化丙啶双染共聚焦对比图。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
实施例1单层以及多层的3D脑胶质瘤细胞模型的构建
(1)SD大鼠脱细胞大脑的无菌切片的制备
将32周雌性SD大鼠进行腹主动脉灌流生理盐水200ml,共灌注了5min至脑组织变白,然后进行开颅取脑;将所得的SD大鼠脑去除小脑后,放于-80℃,30min,然后室温放置30min,如此反复4次交替冻融;将交替冻融后的脑以60rpm,室温下用100ml去离子水处理4h。再以60rpm,4℃下用50ml 1%的Triton-X100处理12h,得到初步脱细胞的脑组织。再以60rpm,室温下去离子水洗3遍,10min/遍。再以60rpm,室温下用50ml,4%的脱氧胆酸钠处理12h,得到脱细胞的脑组织。又用60rpm,室温下用去离子水洗3遍,10min/遍。再以60rpm,室温下用50ml,1M蔗糖溶液处理15min,脱出残留的脱细胞液以及细胞成分。再以60rpm,室温下用去离子水洗3遍,10min/遍。然后将脱细胞后的脑放于-80℃冰冻30min后,放入冰冻切片机中-10℃复温预冷1h,同时放入直径10cm培养皿作为切片容器预冷,然后以水平面进行切片,切片厚度为100um。将切好的切片小心转移到皿内,尽量不要重叠,迅速将盛脱细胞脑切片的皿放于-80℃,预冷1h后放入冻干机冻干。在冻干前冻干机预冷30min,冻干温度为-45℃,冻干6h后将脱细胞切片连同皿放于装有变色硅胶的封口袋中(图1,左)。然后进行Co60的照射灭菌,剂量为25Gy。最后在4℃,干燥保存,显微镜40倍物镜最大光圈下可见脱细胞切片的结构,呈网格状交叉分布(图1,右)。
(2)SD大鼠大脑脱细胞情况的HE染色、DAPI检测
将38周,雄性SD大鼠进行腹主动脉灌流生理盐水300ml共灌注了10min至脑组织变白,然后进行开颅取脑。将所得的SD大鼠脑去除小脑后的一半,放于-80℃,30min,然后室温放置30min,如此反复4次,另一半于4%的多聚甲醛固定。将冻融后的脑以60rpm,室温下用100ml去离子水处理4h,再以60rpm,4℃下用50ml 1%的Triton-X100处理12h,得到初步脱细胞的脑组织。再以60rpm,室温下去离子水洗3遍,10min/遍。再以60rpm,室温下用50ml,4%的脱氧胆酸钠处理12h,得到脱细胞的脑组织。又用60rpm,室温下用去离子水洗3遍,10min/遍,得到脱细胞的脑组织。
将上述脱细胞的脑组织以及未脱细胞4%多聚甲醛固定的脑组织在4℃用50ml,30%蔗糖溶液处理12h,切取约3mm*3mm*2mm大小的脑组织进行OCT包埋,-25℃冰冻切片,厚度6um,作HE染色(图2)以及DAPI染核(图3)。HE染色可见脱细胞完全,组织结构呈网状,保留着脱去细胞后的脑基质结构。DAPI染色也证实脱细胞完全。
(3)脑胶质瘤细胞种于单片脑脱细胞切片构建3D脑胶质瘤模型
在超净工作台内将步骤(1)所制备的Co60灭菌后的脑脱细胞切片用PBS浸泡24h,将其转移入一个新的12孔板中的一个孔中,在其上接种6ul含有10-5个脑胶质瘤细胞(LN229和U87)的完全培养液(DMEM高糖,10%的FBS,1%的双抗),LN229和U87分别接种于一片脱细胞脑片(图4),小心放入37℃细胞培养箱孵育4h后加入1ml的培养液,培养1天后换液1次,以后每3天换液一次。
(4)脑胶质瘤细胞种于多片脑脱细胞切片构建3D脑胶质瘤模型
在超净工作台内,将步骤(1)所制备的Co60灭菌后的脑脱细胞切片用脑胶质瘤完全培养液浸泡24h,将其转移入一个新的6孔板中的一个孔中,在其上接种5ul含有5×104个U87或者LN229细胞的完全培养液(DMEM高糖,10%的FBS,1%的双抗)。再在其上加一片浸泡后的脱细胞脑切片,然后再接种5ul含有5×104个U87或者LN229细胞,如此反复,共叠加10层,分别形成LN229和U87细胞的3D培养模型(图5)。培养箱孵育2h后,补加2ml脑胶质瘤完全培养液,培养1天后换液1次,以后每3天换液一次。
试验例1 3D脑胶质瘤模型细胞生长情况观测试验
将实施例1中所制备的单片3D脑胶质瘤模型以及10层的3D脑胶质瘤模型分别进行培养观察,结果发现其培养液变黄速度明显低于同量细胞的2D培养体系,这说明其细胞代谢率下降,符合体内肿瘤细胞代谢低于体外培养肿瘤细胞代谢的情况。对实施例1中的3D脑胶质瘤模型培养1天后进行钙黄绿素和碘化丙啶染色,观察脑胶质瘤细胞生存与死亡情况(图6):单层的3D肿瘤模型,可见脑胶质瘤细胞分布均匀,大多呈球分布于脱细胞支架上,有聚集成团分布的趋势,少数可见凸起伪足,未见死细胞存在。10层的3D脑胶质瘤模型对其进行多层共聚焦扫描3D重建(扫描了250um厚度)(图7),可见脑胶质瘤细胞均匀的生长于3D培养的脑胶质瘤模型内,不同层次的细胞之间互相交错,细胞呈球状、多突起分布,未见死细胞存在。10层3D培养的脑胶质瘤模型培养5天和培养15天后作对比(图8),可见脑胶质瘤细胞密度增加。这些表现说明,脑胶质瘤细胞能很好的立体分布于支架内,存活并且增殖,支架中的脑胶质瘤细胞的形态以及代谢水平均接近于体内脑胶质瘤。
- 还没有人留言评论。精彩留言会获得点赞!