肿瘤细胞凋亡小体及其制备方法和应用与流程
本发明涉及抗肿瘤疫苗领域,特别是涉及一种肿瘤细胞凋亡小体及其制备方法和应用。
背景技术:
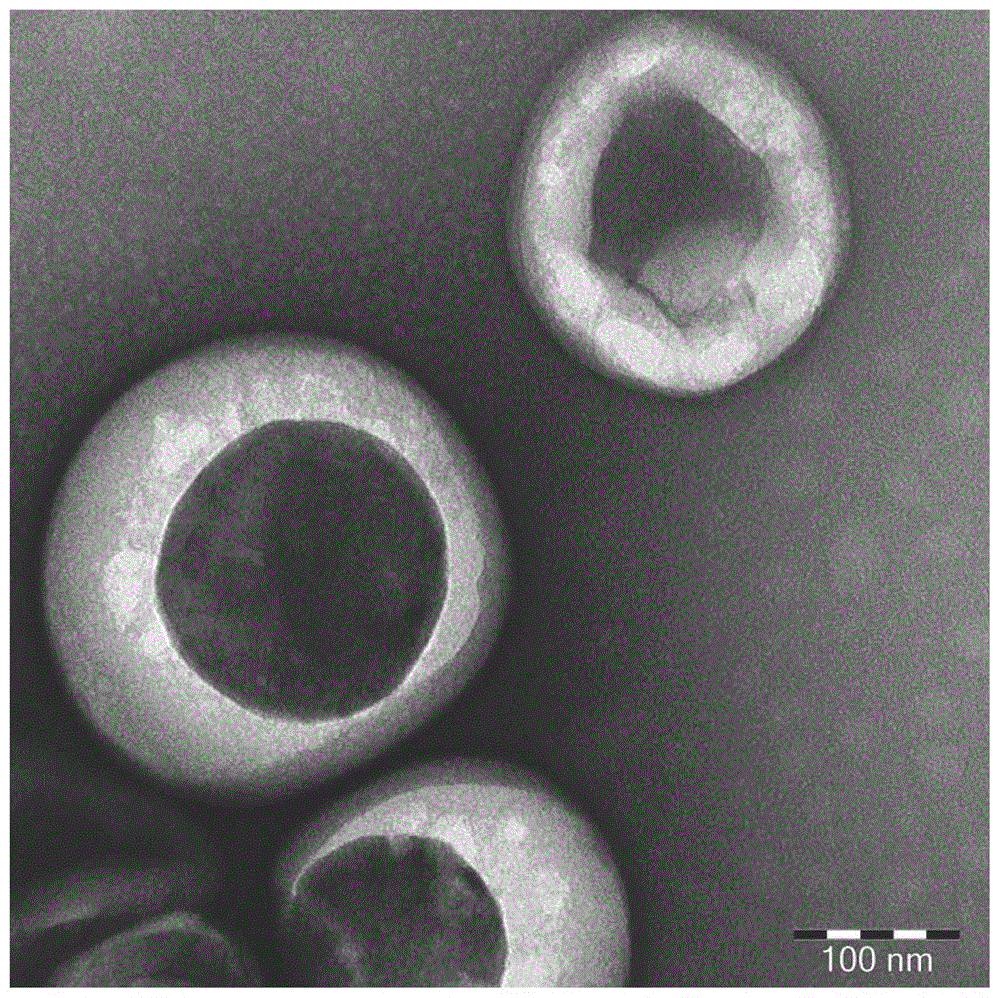
:近年来,恶性肿瘤的发病率逐年提高。尽管科学家们一直在探索以各种方式来攻克肿瘤,但临床上对肿瘤的治愈率仍未显示出明显的提高。癌症的治疗手段主要有手术治疗,放射治疗和药物治疗等,然而这些传统的癌症治疗手段由于靶向性较差,毒性较强,在杀伤肿瘤细胞的同时也会损伤正常细胞,产生不良反应,因此具有一定的局限性。随着肿瘤学、免疫学以及分子生物学等相关学科的迅速发展和交叉渗透,肿瘤免疫治疗的研究突飞猛进。美国fda近期已批准若干个免疫治疗项目进入临床研究,此治疗技术为全世界成千上万的肿瘤患者带来了新的希望。技术实现要素:基于此,本发明提供了一种肿瘤细胞凋亡小体的制备方法,该制备方法获得的肿瘤细胞凋亡小体活性高,具有优良的抗肿瘤效果,并且毒性低,可作为肿瘤疫苗用于治疗癌症。具体技术方案如下:一种肿瘤细胞凋亡小体的制备方法,包括如下步骤:在缺氧的环境下培养肿瘤细胞,以诱导肿瘤细胞发生凋亡,产生凋亡小体。在其中一些实施例中,所述缺氧是指氧浓度为0-6%。在其中一些实施例中,所述缺氧是指氧浓度为1%-6%。在其中一些实施例中,所述缺氧的环境通过以下方法形成:在培养肿瘤细胞的培养基中添加能够诱导细胞缺氧的化合物,以上调肿瘤细胞中低氧诱导因子1α。在其中一些实施例中,所述能够诱导细胞缺氧的化合物选自氯化钴、去胺铁和亚硫酸钠中的至少一种。在其中一些实施例中,所述肿瘤细胞凋亡小体的制备方法包括如下步骤:(1)在缺氧的环境下培养肿瘤细胞,以诱导肿瘤细胞发生凋亡,产生凋亡小体,取细胞上清液;(2)将步骤(1)所得细胞上清液离心,取上清液;(3)将步骤(2)所得上清液离心,取沉淀,即得。在其中一些实施例中,所述肿瘤细胞凋亡小体的制备方法包括如下步骤:(1)在缺氧的环境下培养肿瘤细胞,以诱导肿瘤细胞发生凋亡,产生凋亡小体,取细胞上清液;(2)将步骤(1)所得细胞上清液离心,取上清液;(3)将步骤(2)所得上清液离心,取沉淀;(4)将步骤(3)所得沉淀用无菌生理盐水重悬,离心,取沉淀,即得。在其中一些实施例中,步骤(2)中所述离心的条件包括:离心力为300-700g,离心时间为30-100min。在其中一些实施例中,步骤(2)中所述离心的条件包括:离心力为400-600g,离心时间为30-100min。在其中一些实施例中,步骤(2)中所述离心的条件包括:离心力为400-600g,离心时间为40-90min。在其中一些实施例中,步骤(2)中所述离心的条件包括:离心力为450-550g,离心时间为50-70min。在其中一些实施例中,步骤(3)中所述离心的条件包括:离心力为2000-5000g,离心时间为30-100min。在其中一些实施例中,步骤(3)中所述离心的条件包括:离心力为2000-3000g,离心时间为30-100min。在其中一些实施例中,步骤(3)中所述离心的条件包括:2000-3000g,离心时间为40-90min。在其中一些实施例中,步骤(3)中所述离心的条件包括:离心力为2400-2600g,离心时间为50-70min。在其中一些实施例中,步骤(4)中所述离心的条件包括:离心力为2000-5000g,离心时间为30-100min。在其中一些实施例中,步骤(4)中所述离心的条件包括:离心力为2000-3000g,离心时间为30-100min。在其中一些实施例中,步骤(4)中所述离心的条件包括:离心力为2000-3000g,离心时间为40-90min。在其中一些实施例中,步骤(4)中所述离心的条件包括:离心力为2400-2600g,离心时间为50-70min。在其中一些实施例中,所述培养的时间为12-72小时。在其中一些实施例中,所述培养的时间为40-56小时。本发明还提供了一种肿瘤细胞凋亡小体。该凋亡小体具有优良的抗肿瘤效果,可作为肿瘤疫苗用于预防或者治疗癌症,并且治疗靶向性精准,毒副作用低,治疗效果好。具体技术方案如下:一种肿瘤细胞凋亡小体,由上述制备方法制备得到。本发明提供了上述肿瘤细胞凋亡小体的应用。具体技术方案如下:上述的肿瘤细胞凋亡小体在制备预防和/或治疗肿瘤的疫苗或者药物中的应用。本发明还提供了一种预防和/或治疗肿瘤的疫苗。具体技术方案如下:一种预防和/或治疗肿瘤的疫苗,包含上述的肿瘤细胞凋亡小体。本发明还提供了一种预防和/或治疗肿瘤的药物。具体技术方案如下:一种预防和/或治疗肿瘤的药物,由活性成分和药物中可接受的辅料制备而成,所述活性成分包含上述的肿瘤细胞凋亡小体。本发明的肿瘤细胞凋亡小体及其制备方法和应用具有如下有益效果:本发明的方法通过在缺氧的环境下培养肿瘤细胞,以诱导肿瘤细胞的凋亡,从而产生凋亡小体,该凋亡小体活性高,能够有效激发肿瘤携带者体内的免疫活性,从而具有优良的预防和治疗肿瘤的效果,可作为肿瘤疫苗用于预防或者治疗癌症,并且治疗靶向性精准,毒副作用低,治疗效果好。进一步地,通过差速离心法并且合理控制差速离心的条件(离心力和时间),可以获得粒径更均一、活性更好的凋亡小体,可以进一步提高所得凋亡小体的抗肿瘤效果。并且进一步优选的离心条件,无需高速离心,制备成本低。本发明的制备方法操作简单、生产成本低,所得凋亡小体产品纯度高、活性好、保存方便、毒副作用低,基于免疫疗法,将其作为肿瘤疫苗,能够实现癌症的精准靶向治疗,改善治疗效果,降低毒副作用,减少治疗成本,可推进肿瘤疫苗的发展。附图说明图1为实施例1制备的肿瘤细胞凋亡小体的形态鉴定图;图2为肿瘤细胞凋亡小体的粒径检测图;图3为凋亡小体对非小细胞肺癌细胞a549的抑制生长的结果图;图4为凋亡小体在卵巢癌皮下瘤动物模型中的治疗效果图;图5为凋亡小体在乳腺癌皮下瘤动物模型中的治疗效果图;图6为凋亡小体在肺部转移瘤动物模型中的治疗效果图;图7为凋亡小体在肿瘤术后复发模型中的治疗效果图;图8为凋亡小体预防肺癌肿瘤生长的效果图;图9为实施例9中血生化肝功能指标的检测结果图。具体实施方式为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。本发明一实施方案中提供了一种肿瘤细胞凋亡小体的制备方法,包括如下步骤:在缺氧的环境下培养肿瘤细胞,以诱导肿瘤细胞发生凋亡,产生凋亡小体。其中所述缺氧的环境是指细胞无法正常获得氧气的状态,优选氧浓度不高于6%,更优选为1%-6%。所述缺氧的环境还可以通过以下方法形成:在培养肿瘤细胞的培养基中添加氯化钴、去胺铁和/或亚硫酸钠等诱导细胞缺氧的化合物,添加量为添加至可以上调肿瘤细胞中的低氧诱导因子1α(hif-1α)。通过上述制备方法可以获得活性较高的肿瘤细胞凋亡小体,该凋亡小体能够有效激发肿瘤携带者体内的免疫活性,从而具有优良的抗肿瘤效果,并且毒性低,可作为肿瘤疫苗用于治疗癌症。通过上述方法产生的凋亡小体可以用现有的常规方法进行提取,以获得纯度较高的凋亡小体。本发明中优选地提取方法如下:将上述方法所得细胞上清液离心以去除细胞及细胞碎片,弃去沉淀,取上清液;再将所得上清液离心,以沉淀凋亡小体,弃去上清,取沉淀,即得凋亡小体。该提取方法进一步优选地离心条件为差速离心法,即第一次离心的离心力小于第二次离心的离心力。第一次离心的离心条件进一步优选为:离心力为300-700g,离心时间为30-100min;更优选为:离心力为400-600g,离心时间为40-90min;最优选为:离心力为450-550g,离心时间为50-70min;第二次离心的离心条件进一步优选为:离心力为2000-5000g,离心时间为30-100min;更优选为:离心力为2000-3000g,离心时间为40-90min;最优选为:离心力为2400-2600g,离心时间为50-70min。在该离心条件下提取的凋亡小体具有更均一的粒径、更高的纯度和更好的活性,进而具有更好的抗肿瘤效果。通过上述方法提取的凋亡小体可以用现有的常规方法进行纯化,以获得纯度更高的凋亡小体。本发明中优选地纯化方法如下:将上述方法所得沉淀用无菌生理盐水重悬,离心,弃去上清,取沉淀,即得。其中,离心的条件优选为:离心力为2000-5000g,离心时间为30-100min;更优选为:离心力为2000-3000g,离心时间为40-90min;最优选为:离心力为2400-2600g,离心时间为50-70min。在该离心条件下纯化的凋亡小体具有更高的纯度,进而具有更好的抗肿瘤效果。本发明的制备方法中,培养时间优选为12-72小时,更优选为40-56小时。在该时间范围内,肿瘤细胞的凋亡率较高,因而,可以获得较高产率的凋亡小体。本发明的制备方法中,培养肿瘤细胞的其它条件可以是在常规条件下进行,比如:无菌无毒环境,温度为35℃-37℃。本发明的制备方法中,培养肿瘤细胞的培养基可以是现有的常规培养基,比如:含10%血清的完全培养基。本发明的制备方法,用于产生凋亡小体的肿瘤细胞是指任何肿瘤细胞,其产生的凋亡小体用于抑制自身的生长,来源于母体肿瘤细胞的凋亡小体,因为拥有与母体肿瘤细胞相似的肿瘤抗原,因此回输体内发挥激活体内免疫系统,进而抗肿瘤的效果,即母体的肿瘤细胞自身产生的凋亡小体可激活免疫系统抑制自身生长。本发明还提供了由上述制备方法制备得到的肿瘤细胞凋亡小体。该凋亡小体具有较高的活性,具有优良的抗肿瘤效果,可作为肿瘤疫苗用于预防或者治疗癌症;或者将其与药物中可接受的辅料制备成药物用于预防或者治疗癌症,所得疫苗和药物均具有治疗靶向性精准,毒副作用低,治疗效果好的优点。本发明的制备方法操作简单、生产成本低,所得凋亡小体产品纯度高、活性好、保存方便、毒副作用低,基于免疫疗法,将其作为肿瘤疫苗,能够实现癌症的精准靶向治疗,改善治疗效果,降低毒副作用,减少治疗成本,可推进肿瘤疫苗的发展。以下结合具体实施例对本发明作进一步详细的说明。实施例1缺氧环境下肿瘤细胞凋亡小体的制备一、诱导肿瘤细胞发生凋亡在缺氧的环境中(o2浓度为1%-6%),于细胞培养箱中持续培养乳腺癌细胞(mda-mb-231)2天,诱导细胞发生凋亡,产生凋亡小体,收取细胞上清液,记为细胞上清液a;其中培养箱无菌无毒,温度为35℃-37℃,培养基为含10%血清的完全培养基。缺氧环境也可以通过以下方法形成:在培养基中添加氯化钴、去胺铁和/或亚硫酸钠等诱导细胞缺氧的化合物,添加量为添加至可以上调肿瘤细胞中的低氧诱导因子1α(hif-1α)。二、凋亡小体的提取与纯化(1)去除细胞及细胞碎片:将所述细胞上清液a在离心力为500g的条件下,离心1h,弃去沉淀,取上清液,记为上清液b;(2)沉淀凋亡小体:将所述上清液b在离心力为2500g的条件下,离心1h,弃去上清,获取沉淀;(3)纯化凋亡小体:将步骤(2)中所得沉淀用无菌生理盐水重悬,在离心力为2500g的条件下,离心1h,获取沉淀,即得所述凋亡小体。获得的沉淀再用无菌生理盐水重悬,得凋亡小体悬液,保存于-80℃冰箱中,以备后续实验使用。实施例2一、诱导肿瘤细胞发生凋亡在缺氧的环境中(o2浓度为1%-6%),于细胞培养箱中持续培养乳腺癌细胞(mda-mb-231)2天,诱导细胞发生凋亡,产生凋亡小体,收取细胞上清液,记为细胞上清液a;其中培养箱无菌无毒,温度为35℃-37℃,培养基为含10%血清的完全培养基。二、凋亡小体的提取与纯化(1)去除细胞及细胞碎片:将所述细胞上清液a在离心力为500g的条件下,离心30min,弃去沉淀,取上清液,记为上清液b;(2)沉淀凋亡小体:将所述上清液b在离心力为2500g的条件下,离心1h,弃去上清,获取沉淀;(3)纯化凋亡小体:将步骤(2)中所得沉淀用无菌生理盐水重悬,在离心力为2500g的条件下,离心1h,获取沉淀,即得所述凋亡小体。获得的沉淀再用无菌生理盐水重悬,得凋亡小体悬液,保存于-80℃冰箱中,以备后续实验使用。实施例3一、诱导肿瘤细胞发生凋亡在缺氧的环境中(o2浓度为1%-6%),于细胞培养箱中持续培养乳腺癌细胞(mda-mb-231)2天,诱导细胞发生凋亡,产生凋亡小体,收取细胞上清液,记为细胞上清液a;其中培养箱无菌无毒,温度为35℃-37℃,培养基为含10%血清的完全培养基。二、凋亡小体的提取与纯化(1)去除细胞及细胞碎片:将所述细胞上清液a在离心力为500g的条件下,离心1.5h,弃去沉淀,取上清液,记为上清液b;(2)沉淀凋亡小体:将所述上清液b在离心力为2500g的条件下,离心1h,弃去上清,获取沉淀;(3)纯化凋亡小体:将步骤(2)中所得沉淀用无菌生理盐水重悬,在离心力为2500g的条件下,离心1h,获取沉淀,即得所述凋亡小体。获得的沉淀再用无菌生理盐水重悬,得凋亡小体悬液,保存于-80℃冰箱中,以备后续实验使用。对比例1一、诱导肿瘤细胞发生凋亡在缺氧的环境中(o2浓度为1%-6%),于细胞培养箱中持续培养乳腺癌细胞(mda-mb-231)2天,诱导细胞发生凋亡,产生凋亡小体,收取细胞上清液,记为细胞上清液a;其中培养箱无菌无毒,温度为35℃-37℃,培养基为含10%血清的完全培养基。二、凋亡小体的提取与纯化(1)去除细胞及细胞碎片:将所述细胞上清液a在离心力为500g的条件下,离心10min,弃去沉淀,取上清液,记为上清液b;(2)沉淀凋亡小体:将所述上清液b在离心力为2500g的条件下,离心1h,弃去上清,获取沉淀;(3)纯化凋亡小体:将步骤(2)中所得沉淀用无菌生理盐水重悬,在离心力为2500g的条件下,离心1h,获取沉淀,即得所述凋亡小体。获得的沉淀再用无菌生理盐水重悬,得凋亡小体悬液,保存于-80℃冰箱中,以备后续实验使用。对比例2将乳腺癌细胞(mda-mb-231)分别在缺乏氮源、缺乏碳源、缺乏生长因子的培养基中培养48h,诱导细胞发生凋亡,产生凋亡小体。将发生凋亡的肿瘤细胞的培养基收集在50ml离心管中。在900g下离心10min,以除去死细胞和细胞碎片。将上清转移至1.5mlep管中,在12000g下离心30分钟,得到的沉淀即为凋亡小体。获得的沉淀再用无菌生理盐水重悬,得凋亡小体悬液,保存于-80℃冰箱中,以备后续实验使用。对比例3在缺氧的环境中(o2浓度为1%-6%),于细胞培养箱中持续培养乳腺癌细胞(mda-mb-231)2天,诱导细胞发生凋亡,产生凋亡小体,收取细胞上清液,记为细胞上清液a;其中培养箱无菌无毒,温度为35℃-37℃,培养基为含10%血清的完全培养基。将发生凋亡的肿瘤细胞的培养基收集在50ml离心管中。在900g下离心10min,以除去死细胞和细胞碎片。将上清转移至1.5mlep管中,在12000g下离心30分钟,得到的沉淀即为凋亡小体。获得的沉淀再用无菌生理盐水重悬,得凋亡小体悬液,保存于-80℃冰箱中,以备后续实验使用。实施例4凋亡小体形态的鉴定本实施例鉴定了实施例1制备的凋亡小体的形态,方法如下:(1)将5μl实施例1所得凋亡小体悬液加到formvar-carbon载样铜网上。每份样品准备2-3个铜网。盖上盖子,在干燥环境中让formvar膜吸收20min;(2)将100μlpbs加到封口膜上。用镊子将铜网(formvar膜面朝下)放在pbs液滴上清洗;(3)将铜网放在50μl1%戊二醛液滴上5min;(4)将铜网放在100μl超纯水中洗涤2min;(5)将铜网放在50μl草酸双氧铀液滴上5min;(6)将铜网放在50μl甲基纤维素-ua液滴上10min;(7)用不锈钢环移开铜网,在滤纸上轻轻吸去多余液体,留下一薄层甲基纤维素膜;(8)铜网仍在不锈钢环上,空气中干燥5到10min后再置于透射电镜下观察形态。结果如图1所示:凋亡小体在透射电镜下呈杯状结构,为典型囊泡形态。实施例5凋亡小体粒径大小的鉴定将实施例1所得凋亡小体悬液注入纳米颗粒跟踪分析仪(马尔文)中,观察颗粒在溶液中的布朗运动,测定粒径大小。结果如图2所示:凋亡小体的粒径较为均一,大小为148.3±2.3nm。用同样的方法检测实施例2-3,对比例1-3的凋亡小体的粒径,其结果如表1所示:从粒径结果上我们可以看出,实施例1-3的平均粒径和粒径分散度低于对比例1、对比例2和对比例3。免疫系统对不同大小的颗粒具有不同的反应,拥有更均一的粒径有助于获取效果更专的免疫激活反应。因此,实施例1-3的免疫激活效果优于对比例1-3。其中,实施例1和实施例3的平均粒径和粒径分散度比实施例2更好;而实施例1和实施例3相比,虽然粒径大小和分散度相近,但实施例3中在去除细胞及细胞碎片时需要多离心30min,因此实施例1在拥有相同效果时,制备效率更高,制备成本更低,因此,实施例1的制备方法为更优选的方法。表1样品粒径(nm)实施例1148.3±2.3实施例2247.4±3.4实施例3144.3±2.1对比例1351.3±5.2对比例2308.6±6.1对比例3315.7±6.9实施例6凋亡小体的体外抗肿瘤效果本实施例考察了依照实施例1、对比例2和对比例3制备方法制备的肺癌(a549)凋亡小体在体外的抗肿瘤效果。方法如下:(1)收集对数期非小细胞肺癌细胞a549,调整细胞悬液浓度,种植到96孔板,每孔加入100μl,铺板使待测细胞的密度为5000个每孔;(2)将96孔板置于细胞培养箱中培养24h后,加入各组药物,放回培养箱接着培养24h;(3)24h后,每孔加入20μlmtt溶液(5mg/ml,即0.5%mtt),继续培养4h;(4)4小时后,每孔加入150μl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。(5)在酶联免疫检测仪od值490nm处测量各孔的吸光值。结果如图3所示:实施例1制备的凋亡小体能够更有效抑制非小细胞肺癌细胞a549的生长。实施例7凋亡小体在卵巢癌皮下瘤动物模型中的治疗效果本实施例考察了依照实施例1制备方法制备的卵巢癌(skov3)凋亡小体在卵巢癌皮下瘤动物模型中的治疗效果。方法如下:(1)采集处于对数生长期的卵巢癌细胞skov3细胞,在裸鼠(购自中山大学动物中心)腋下处经皮下注射skov3卵巢癌细胞2×106/只,建立荷瘤鼠模型。(2)造模一周后,腋下形成实体肿瘤块,随后,瘤旁注射凋亡小体一次。(3)从给药时起,每两天量一次肿瘤体积,21天后解剖。空白组裸鼠的处理过程和方法与上述相同,只是步骤(2)中不给药。结果如图4所示:相对空白组,凋亡小体能够显著抑制卵巢癌皮下瘤的生长。实施例8凋亡小体在乳腺癌皮下瘤动物模型中的治疗效果本实施例考察了实施例1制备的凋亡小体在乳腺癌皮下瘤动物模型中的治疗效果。方法如下:(1)采集处于对数生长期的乳腺癌细胞mda-mb-231细胞,经裸鼠(购自中山大学动物中心)皮下注射mda-mb-231乳腺癌细胞2×106/只,建立荷瘤鼠模型。(2)造模一周后,腋下形成实体肿瘤块。随后,瘤旁给药凋亡小体一次。(3)从给药时起,每两天量一次肿瘤体积,21天后解剖。空白组裸鼠的处理过程和方法与上述相同,只是步骤(2)中不给药。结果如图5所示:相对空白组,凋亡小体能够显著抑制乳腺癌皮下瘤的生长。实施例9凋亡小体在肺部转移瘤动物模型中的治疗效果本实施例依照实施例1制备方法制备的肺癌(a549)凋亡小体在肺部转移瘤动物模型中的治疗效果。方法如下:(1)收集处于对数生长期的标记gfp荧光的非小细胞肺癌细胞a549/gfp细胞,经裸鼠(购自中山大学动物中心)尾静脉注射a549/gfp非小细胞肺癌细胞2×106/只,建立荷瘤鼠模型。(2)造模一周后,尾静脉给药凋亡小体一次。(3)21天后解剖荷瘤鼠,取出肺部在小动物活体成像仪(购自德国nightowl公司)拍照成像,并对其肿瘤荧光进行定量分析。空白组裸鼠的处理过程和方法与上述相同,只是步骤(2)中不给药。结果如图6所示:相对空白组,凋亡小体能够显著抑制肺部转移瘤的形成。实施例10凋亡小体在肿瘤术后复发模型中的治疗效果本实施例考察了依照实施例1制备方法制备的肺癌(a549)凋亡小体在肿瘤术后复发模型中的治疗效果。方法如下:(1)收集处于对数生长期的标记gfp荧光的非小细胞肺癌细胞a549/gfp细胞,经裸鼠(购自中山大学动物中心)皮下注射a549/gfp非小细胞肺癌细胞5×106/只,建立荷瘤鼠模型。(2)造模一周后,腋下形成实体肿瘤块,手术切除后,当天尾静脉给药凋亡小体一次。(3)从给药时起,每周对肿瘤成像一次,21天后解剖,取出肿瘤在小动物活体成像仪(购自德国nightowl公司)拍照成像,并对其肿瘤荧光和大小进行定量分析。空白组裸鼠的处理过程和方法与上述相同,只是步骤(2)中不给药。结果如图7所示:相对空白组,凋亡小体能够显著抑制肺癌肿瘤的术后复发。实施例11凋亡小体预防肿瘤发生的效果本实施例考察了依照实施例1制备方法制备的肺癌(a549)凋亡小体预防肿瘤发生的效果。方法如下:(1)对裸鼠(购自中山大学动物中心)以尾静脉方式连续给药(凋亡小体)三次,三天给一次。(2)三天后,收集处于对数生长期的标记gfp荧光的非小细胞肺癌细胞a549/gfp细胞,经裸鼠(购自中山大学动物中心)尾静脉注射a549/gfp非小细胞肺癌细胞2×106/只,构建肿瘤模型。(3)21天后解剖裸鼠,取出肝、肺部在小动物活体成像仪(购自德国nightowl公司)拍照成像,并对其肿瘤荧光进行定量分析。(4)取各组裸鼠的血液样本,检测血生化肝功能指标。空白组裸鼠的处理过程和方法与上述相同,只是步骤(1)中不给药。肿瘤荧光定量分析的结果如图8所示:相对空白组,凋亡小体能够预防肺癌肿瘤的生长。血生化肝功能指标的检测结果如图9所示:空白组和凋亡小体组之间的肝功能指标没有明显差异。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1