SYT8基因表达变异在胃癌预后及诊断中的应用的制作方法
本发明涉及医药生物
技术领域:
,尤其是一种syt8基因表达变异在胃癌预后及诊断中的应用。
背景技术:
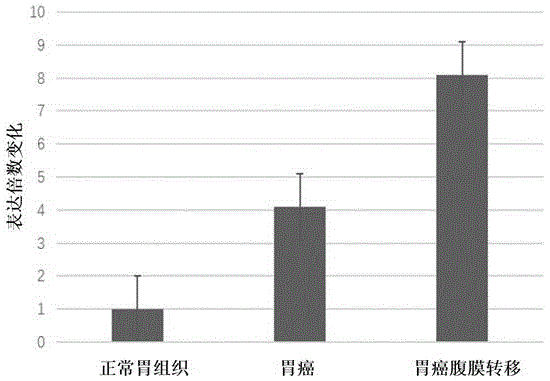
:胃癌是全球最常见的恶性肿瘤之一,其发病率和死亡率在世界范围内分别居第四和第二位。我国是胃癌的高发地区,其发病率和死亡率均居第二位,每年约有45万人死于胃癌。导致胃癌死亡率居高不下的重要原因是肿瘤的复发、转移和耐药。在早期胃癌患者中进行内镜或手术切除,可获得良好的预后,目前传统的治疗方式,如手术、放化疗等治疗手段对胃癌转移的治疗疗效较差,胃癌的5年生存率近30年一直徘徊在20%~30%。因此,要提高胃癌5年生存率必须寻找研究新的更有效的治疗策略。腹膜是一个常见的恶性肿瘤复发和远处转移部位,腹膜转移是晚期胃癌患者的主要死因。虽然本质上是一种无法治愈的疾病,在影像学研究中,发现会改变整个治疗策略的小腹膜沉积物通常很困难,需要分期腹腔镜检查和活检进行确认。因此,临床迫切需要一种能准确预测胃癌腹膜转移风险的生物标志物,帮助临床做出适当的策略。syt8基因是一种与生长因子和抗癌药物转运相关的跨膜蛋白,在胃癌组织中的高表达具有最大的风险比,对胃癌腹膜转移具有高特异性,被确定为腹膜无复发生存率的独立预后因素。胃癌中与syt8表达相关的公开数据未见报道,特别是在胃癌腹膜转移预后诊断中的应用还没有涉及。技术实现要素:本发明的目的在于提供一种syt8基因表达变异在胃癌预后及诊断中的应用,通过研究证实syt8可应用于诊断胃癌腹膜转移治疗效果的指标预测预后;syt8可作为胃癌腹膜转移治疗新药和生物免疫治疗的新靶点。本发明的技术方案为:一种syt8基因表达变异在胃癌预后及诊断中的应用,该应用为运用syt8基因制备胃癌诊断和/或预后试剂盒,所述试剂盒中包含用于qrt-pcr的引物对以及相应的试剂。所述试剂盒中含有如下的引物序列:syt8检测引物对:上游引物:5’-gcttctctctccggtacgtg-3’;下游引物:5’-aggaaggtgaaggcctcatt-3’;内参引物对:gapdh上游引物:5’-cagctgagagggaaatcgtg-3’、下游引物:5’-cgttgccaatagtgatgacc-3’。syt8基因表达阻断剂制备治疗胃癌药物,syt8基因表达阻断剂为syt8基因干扰rna。干扰rna为sirna,shrna,rnai或者化学干扰抑制剂。干扰rna包含正义rna片段和反义rna片段,所述正义rna片段和所述反义rna片段互补。所述正义rna片段和反义rna片段的长度均为15-27个核苷酸;较佳的,长度均为19-23个核苷酸;最佳的,长度均为19、20或者21个核苷酸。所述小分子干扰rna为发夹型单链rna,包括正义rna片段、茎环片段和反义rna片段,正义rna片段和反义rna片段中间由茎环片段分隔;其中,正义rna片段和反义rna片段互补。将干扰rna序列构建成为基因干扰慢病毒载体,所述载体为将编码特异性抑制syt8基因表达的干扰小分子rna的基因片段克隆入慢病毒载体后获得,能产生人syt8基因小分子干扰rna。所述慢病毒载体可以选自:plko.1-puro、plko.1-cmv-tgfp、plko.1-puro-cmv-tgfp、plko.1-cmv-neo、plko.1-neo、plko.1-neo-cmv-tgfp、plko.1-puro-cmv-tagcfp、plko.1-puro-cmv-tagyfp、plko.1-puro-cmv-tagrfp、plko.1-puro-cmv-tagfp635、plko.1-puro-ubc-turbogfp、plko.1-puro-ubc-tagfp635、plko-puro-iptg-1xlaco、plko-puro-iptg-3xlaco、plp1、plp2、plp/vsv-g、pentr/u6、plenti6/block-it-dest、plenti6-gw/u6-laminshrna、pcdna1.2/v5-gw/lacz、plenti6.2/n-lumio/v5-dest、pgcsil-gfp或plenti6.2/n-lumio/v5-gw/lacz中的任一。所述胃癌为原发性胃癌。本发明的优点在于:通过检测syt8基因的表达情况针对胃癌治疗患者进行预后,具有较好的预测效果,为后期进一步的治疗提供初步的指导。同时本发明提供了一种阻断syt8基因表达的sirna,具有较好的抑制syt8基因表达的效果。本发明具有较好的抑制效果以及应用前景。附图说明图1为qrt-pcr对比正常胃组织,胃癌组织,胃癌腹膜转移瘤细胞中syt8的表达水平变化对比图;图2为胃癌病人的syt8表达水平及预后关系图;图3为sirna干扰syt8基因表达效果图。具体实施方式syt8基因表达水平预测胃癌腹膜转移患者预后的标志物用途,基于syt8基因表达水平可以预测胃癌腹膜转移患者的预后,syt8表达水平低的患者预后好,表达水平高的患者预后差。基于syt8基因表达水平预测胃癌腹膜转移患者预后的检测及应用方法,a.提取肿瘤患者原发癌组织标本的细胞总rna;以rna为模板逆转录合成cdna;以cdna为模板,用syt8基因和管家基因的特异性引物和荧光标记探针进行实时定量pcr扩增,计算syt8基因mrna的相对表达量;b.根据胃癌腹膜转移患者复发转移阳性病例和复发转移阴性病例的syt8mrna表达量,确定预后判断的临界值。syt8mrna表达量低于临界值的患者预后好,而高于临界值的患者预后差。所述的检测方法,以原发癌组织中syt8mrna表达量对肿瘤患者预后判断,表达量低的患者则判断为预后好,表达量高的则判断为预后差。本发明通过研究证实syt8可应用于诊断胃癌腹膜转移治疗效果的指标预测预后;syt8可作为胃癌腹膜转移治疗新药和生物免疫治疗的新靶点。阻断syt8表达可抑制胃癌肿瘤生长,抑制胃癌肿瘤细胞,可作为胃癌治疗新药和生物免疫治疗的新靶点。另外,本发明提供一种特异性抑制syt8基因表达的sirna,其序列如seqidno:1和2所示。另外,本发明提供一种基因干扰慢病毒载体,为将编码特异性抑制syt8基因表达的干扰小分子rna的基因片段克隆入慢病毒载体后获得,能产生人syt8基因小分子干扰rna。所述慢病毒载体可以选自:plko.1-puro、plko.1-cmv-tgfp、plko.1-puro-cmv-tgfp、plko.1-cmv-neo、plko.1-neo、plko.1-neo-cmv-tgfp、plko.1-puro-cmv-tagcfp、plko.1-puro-cmv-tagyfp、plko.1-puro-cmv-tagrfp、plko.1-puro-cmv-tagfp635、plko.1-puro-ubc-turbogfp、plko.1-puro-ubc-tagfp635、plko-puro-iptg-1xlaco、plko-puro-iptg-3xlaco、plp1、plp2、plp/vsv-g、pentr/u6、plenti6/block-it-dest、plenti6-gw/u6-laminshrna、pcdna1.2/v5-gw/lacz、plenti6.2/n-lumio/v5-dest、pgcsil-gfp或plenti6.2/n-lumio/v5-gw/lacz中的任一。实施检测syt8在胃癌细胞,胃癌腹膜转移瘤细胞和正常胃细胞中表达水平(图1)。临床标本入选标准:接受外科手术切除病例,术后病理诊断为胃癌;穿刺活检术获得完整组织学标本,病理诊断为胃癌。参与本研宄的患者手术或活检前均未接受化、放疗以及免疫治疗,患者签署了知情同意书,并经过伦理委员会审核。方法:获取术后和活检正常胃组织,胃癌组织。抽提rna后进行qrt-pcr,qrt-pcr操作步骤为本领域常规的操作方法,所需的引物分别为:syt8上游引物:5’-gcttctctctccggtacgtg-3’、下游引物:5’-aggaaggtgaaggcctcatt-3’;gapdh上游引物:5’-cagctgagagggaaatcgtg-3’、下游引物:5’-cgttgccaatagtgatgacc-3’。qrt-pcr对比正常胃组织、胃癌肿瘤组织和胃癌腹膜转移瘤细胞中syt8的表达水平变化。结果:如图1所示,定量pcr数据发现syt8的表达水平在正常胃组织中较低,相对正常组织,胃癌组织中升高约4.1倍,在胃癌腹膜转移组织中升高近8.1倍。定量pcr每组分析10例标本,gapdh作为内参指示检测准确,符合要求。免疫组织化学染色采用美国dako公司envisiontm二步法检测系统检测syt8蛋白表达。根据本领域常用的irs进行标本的阳性细胞百分率统计。应用irs可兼顾染色强度和阳性细胞百分率。如表1所示,免疫组化检查发现正常胃组织只有3.2%为syt8阳性,胃癌组织为86.9%,胃癌腹膜转移组织为91.6%(表1)。免疫组化检查每组为10例标本。为了避免主观性,将样本随机分配,在分析前由2名不了解样本性质的独立观察员进行编码。在给定的时间间隔内,每个观察者至少评估两次所有标本(syt8阳性或阴性)。表1正常胃细胞胃癌组织胃癌腹膜转移组织3.2%86.9%91.6%从以上结果可以看出,syt8定量pcr和免疫组化检查可用来诊断胃癌腹膜转移,有助于预测腹膜复发。实施检测胃癌细胞syt8阳性水平和预后的关系(图2)。选择具有完整随访记录36例胃癌病人,获取病理切片进行syt8免疫组化检查(操作步骤同上)。36例胃癌病人的syt8免疫组化检查分为三组(弱阳性为1.0,阳性为3.0,强阳性为5.0),每组12例,进行预后跟踪,获得病人的生存时间。结果:如图2所示,预后数据表明胃肿瘤细胞阳性水平和预后生存时间呈反比关系,强阳性患者预后差,生存期短,而弱阳性患者预后较好,生存期较长。结论,检测syt8免疫组化水平可用来预测胃癌患者预后,并可作为预测治疗效果的指标。实施syt8干扰肿瘤的影响(图3)。1、人syt8基因rnai慢病毒的制备(1)筛选针对人syt8基因的有效的sirna靶点从genbank调取人syt8基因信息;利用dnaman设计针对syt8基因的有效的sirna靶点。在syt8基因的编码序列(cds)区域内,设计了2条针对syt8基因的有效sirna靶点序列。分别为:syt8-1:cccagaagcccctgaggagctg;syt8-2:tactgcaagcgggaggcggagg。针对sirna靶点合成两端含agei和ecori酶切位点粘端的双链dnaoligo序列;以agei和ecori限制性内切酶作用于pgcsil-gfp载体,使其线性化,琼脂糖凝胶电泳鉴定酶切片段。并构建含有syt8的rnai载体,命名为pgcsil-gfp-syt8-1-shrna以及pgcsil-gfp-syt8-2-shrna,同时还按照本领域常规的试验方法构建pgcsil-gfp-control阴性对照质粒。同时将所述载体导入到慢病毒中备用。2、实时荧光定量rt-pcr法检测syt8基因的沉默效率使用对数生长期的人胃癌mkn45细胞和正常人口腔上皮细胞进行胰酶消化,制成细胞悬液(细胞数约为5.0×104/ml),在24孔板中培养培养72小时,培养至细胞融合度达到约40%。根据侵染复数(mkn45的moi为20)值,加入适宜量的的病毒,培养24h后更换培养基,待侵染时间达到3天后,收集细胞。根据invitrogen公司的trizol操作说明书,抽提总rna。根据promega公司的m-mlv操作说明书,将rna逆转录获得cdna(逆转录反应体系2℃反应1h,然后在70℃水浴锅中水浴10min使逆转录酶失活)。采用abi7500型realtimepcr仪(life)进行实时定量检测。基因的引物如上述实施例所述。实验结果显示,实验组中人胃癌mkn45细胞的syt8mrna表达水平分别下降了98.5%和99.2%,具有较好的抑制表达效果。3:检测侵染syt8-shrna慢病毒的肿瘤细胞的增殖能力将上述实验2制备的细胞,待侵染时间达到3天后,收集处于对数生长期的各实验组细胞。完全培养基重悬成细胞悬液(5.0×104/ml),以细胞密度约为2000个/孔,接种96孔板。每组5个复孔,每孔200μl。铺好板后,置37℃、5%co2培养箱培养。从铺板后第二天开始,用cellomics仪器(thermofisher)第1、3和5天测量读板一次。通过调整cellomicsarrayscan的输入参数,准确地计算出每次扫描孔板中的带绿色荧光的细胞的数量,对数据进行统计绘图,绘出细胞增殖曲线。结果发现,二个syt8shrna慢病毒侵染的人胃癌mkn45细胞在体外培养5天后,活力细胞数目分别下降了81.9%和82.8%,表明syt8基因沉默导致肿瘤细胞增殖能力被抑制。本发明通过以上具体实施详细加以说明。本领域技术人员应清楚,本发明并不限于此处所列出的实施方式,其保护范围由所附权利要求书限定,下面的实施例仅仅是以示例的方式说明本发明,以使本发明更易于理解。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1