一种递送UL128复合体和预防CMV感染的MVA疫苗的制作方法
政府权益声明
本发明是由(美国)国家过敏症和传染病研究所授予的批准号ai063356和(美国)国立癌症研究所授予的批准号ca030206在(美国)政府支持下完成的。美国政府享有本发明的一定权利。
优先权声明
本申请要求享有2012年7月27日提交的美国专利临时申请号61/676846的优先权益,在此通过引用引入其全文。
背景技术:
巨细胞病毒(cmv)基因组很大(大于200kbp),人类巨细胞(hcmv)编码大于等于165个开放阅读框架(orf),其编码的蛋白质使它能够感染多种细胞类型、建立潜伏期和从潜伏期重激活,并在免疫感受态宿主维持终生的持久性(murphy等2003;barry&chang2007;hansen等2003;jarvis&nelson2007;rivailler等2006;schleiss等2008;oxford等2008)。60%以上的orf对于纤维原细胞中的hcmv复制是非必要的(dunn等2003;yu等2003),这表明大部分hcmvorf的功能只能在非纤维原细胞的细胞中和/或在体内观察到。对hcmv的更广泛的理解应包括涉及orf及其相关的非纤维原细胞的细胞类型、这些细胞在hcmv传播中起到的作用以及适当的动物模型的使用的研究。
内皮细胞和上皮细胞(合称,“epi/ec”)是对于hcmv感染和传播重要的细胞类型。在从主要感染部位血原性传播之后,hcmv感染对于水平传播重要的组织的epi/ec细胞,如肾、唾液和乳腺(sinzger等2008)。多项研究已经报道,在原发性感染消退之后病毒仍可分泌于唾液和尿液中,并能分泌于连续的怀孕和哺乳期间的母乳中(schleiss2006a;britt2008;wang等2008;mansat等1997;stagno等1975)。在垂直传播期间,hcmv从子宫血管传播到细胞滋养层祖细胞,胎盘绒毛的epi/ec是hcmv感染的第一类胚胎细胞(maidji等2006;maidji等2002)。因为epi/ec同时在水平和垂直传播中起到重要作用,hcmv疫苗的保护效力很可能取决于成功生成对抗预防感染该种细胞类型的抗原性hcmv蛋白的高效价中和抗体(nab)。
在没有起作用的免疫系统的个体中,如移植接受者、同时感染hiv的个体、或先天感染的胎儿/新生儿中,hcmv是发病率和死亡率的重要来源。目前,还没有已获得批准的疫苗来预防hcmv感染和/或疾病,然而,(美国)国家科学院医学研究所在2000年发布了一项报告,由于这种疫苗将带来的对人类健康的改善而将hcmv疫苗的研发放在了最高优先级类别中。因此,研发一种针对介导epi/ec和纤维原细胞感染的病毒抗原(ags)的疫苗将大有益处。
技术实现要素:
在一个实施方案中,本文提供了一种用于表达ul128复合体(ul128c;其包括ul128、ul130、ul131a、糖蛋白h、糖蛋白l)的表达系统。该表达系统可以包括一种细菌人工染色体(bac)构建体,其中该bac构建体包括一种插入了一组编码ul128c的dna序列的病毒载体。
在另一个实施方案中,提供了一种用于预防hcmv感染的疫苗组合物。该疫苗组合物可以包括一种能够表达ul128c的病毒载体,和一种药学可接受的载体、辅剂、添加剂或其组合。
在另一个实施方案中,提供了一种预防hcmv侵入细胞的方法,该方法可包括使细胞与有效量的病毒载体接触,所述病毒载体包括一组编码ul128c的dna序列。
在另一个实施方案中,提供了一种在某一对象中治疗hcmv感染的方法。该方法可以包括给对象施用治疗有效量的hcmv疫苗,其中所述hcmv疫苗包括一种能够表达ul128c的病毒载体和一种药学可接受的载体、辅剂、添加剂(例如,cd40l)或其组合。
根据以上所述的一些实施方案,该病毒载体是一种经过改良的痘苗病毒安卡拉(mva),该ul128c包括一组5种hcmv蛋白或其抗原片段:ul128、ul130、ul131a、糖蛋白l(gl)和糖蛋白h(gh)。在一些实施方案中,该病毒载体进一步插入一种或多种额外的dna序列,该序列编码一种或多种额外的hcmv蛋白或其抗原片段,例如pp65、gb。这些额外的蛋白既可以是细胞介导免疫的主要目标,例如pp65和ie1,也可以是其他重要的刺激nab的侵入介质,例如糖蛋白gb、gm、gn或go。
附图说明
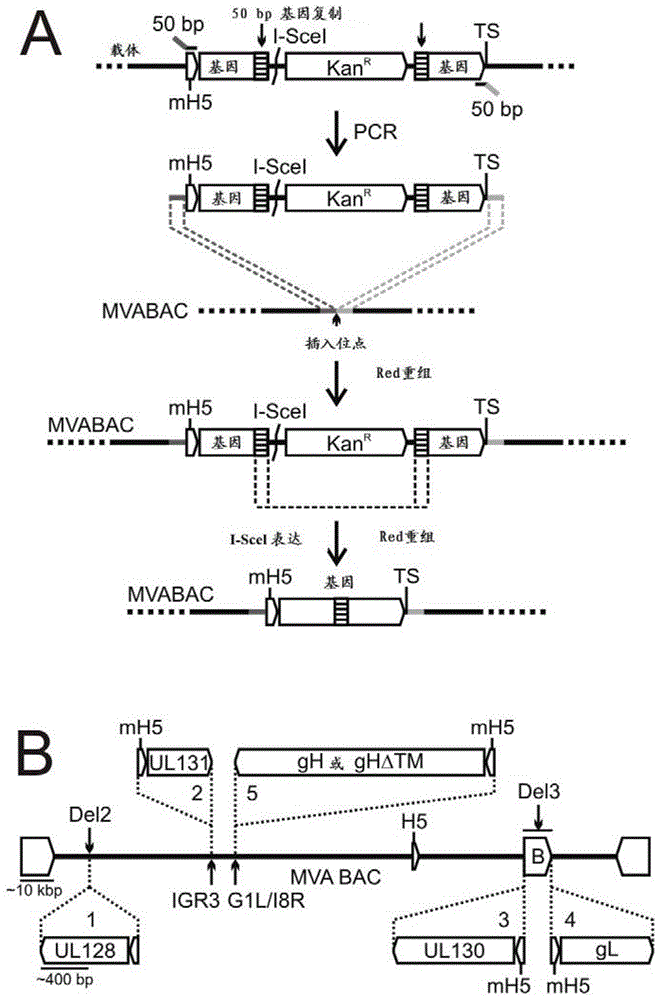
图1是一对示意图,阐明根据一些实施方案的基因表达盒的插入(图1a)和rhcmv基因在mva-bac中的插入位点(图1b)。图1a显示了一种通过enpassant诱变将痘病毒基因表达盒插入mva-bca的方案。首先,产生了一种转移构建体,其包括带有上游牛痘病毒mh5启动子、下游转录终端信号(ts)以及一个基因i-scel限制性内切位点和卡那霉素抗性(kanr)标记的基因序列,后两者均侧接于50bp基因复制(点画框)。该构建体随后通过pcr扩增并利用同源的50bp引物延伸,通过red重组插入mva-bac。接着,通过在i-scel位点i-scel表达介导的双链断裂的引入和随后的50bp基因复制的第二次red重组,将kanr筛选标记无缝移除。图1b显示了插入位点(del2、igr3、g1l/18r,bac(b)载体结束于del3)和在mva-bac中的rhcmv基因ul128、ul130、ul131a、gl和gh或ghδtm的方向。插入顺序由数字1-5表示。
图2显示蛋白质印迹法(wbs)用兔多克隆抗血清检测从mva表达的rhul128c亚基的共表达。图2a显示感染了mva-rhul128c或mva-rhul128cδ的bhk细胞的总细胞裂解物的wb分析。图2b显示cef细胞总细胞裂解物的wb分析,该cef细胞感染了表达不同的rhul128-ul131a亚基组合的mva或感染了mva-rhul128c或mva-rhul128cδ。未受感染的或mva-感染的细胞被用作阴性对照。作为上样对照,裂解物用对于牛痘病毒br5蛋白有特异性的单克隆抗体19c2进行分析。标记物蛋白大小以千道尔顿(kd)给出。
图3显示wbs检测mva-rhul128c在bhk细胞上繁殖期间(5次病毒传代)的rhul128、rhul130、rhul131a、rhgl和rhgh的表达。用对应于每个rhcmv基因的肽特异性兔多克隆抗血清分析5代不同的病毒传代(p1-p5)的总细胞裂解物。作为上样对照,裂解物用对于牛痘病毒br5蛋白有特异性的单克隆抗体19c2进行分析。用感染mva的和未感染的bhk细胞作为对照。
图4显示wbs检测在由mva-rhul128δ表达的rhghδtm的免疫沉淀之后的rhghδtm与rhul128c亚基的免疫共沉淀。感染了mva-rhul128cδ的bhk细胞的裂解物用于与蛋白质a/g琼脂糖和小鼠单克隆抗c-myc标记的抗体或无关的igg对照抗体的免疫沉淀。该免疫沉淀样本之后用特异于每个独立亚基的兔多克隆抗血清通过wb进行分析。感染mva的bhk细胞作为对照进行分析。
图5说明根据由mva表达的ruul128c亚基表达的rhghδtm的分泌物。细胞的或根据单表达、与rhgl的共表达或与rhgl和rhul128-ul131a的共表达分泌的rhghδtm和rhgh的wbs。cef细胞在moi为0.1时被感染,并在无血清培养基(vp-sfm)中生长36-48小时,细胞裂解物和浓缩培养基用多克隆抗血清分析。分析了非重组mva作为对照。分析了牛痘病毒br5蛋白作为上样对照。相对条带强度由每个泳道下的数字给出。
图6显示在rhcmv攻击前的接种疫苗的rm中的nab的体外测量。所示a和b是,对指出的疫苗组疫苗接种(vx)2周(a)和6周(b)后在猴子的肾脏上皮细胞(mke)上测量的nt50效价。所示c和d是疫苗接种2周(c)和6周(d)后在纤维原细胞(telo-rf)上测量的nt50效价。给出的在telo-rf上测量的接种mva-rhgb-或mva-venus的rm的数值之前已经公开(1)(星号)。中位值由柱状图给出。在自然受感染的猴子的mke或telo-rf上测量的标准nt50范围由虚线表示。箭头标出了化验的检测极限。将mva-rhul128c疫苗组和mva-rhul128cδ疫苗组或其它某一个疫苗组(rhul128、rhul130、rhul128/ul130/ul131、rhgb、venus)对比的p值,通过单侧秩和检验计算得到。c图中将mva-rhul128c或mva-rhul128cδ疫苗组与mva-rhgb疫苗组对比的p值,通过双侧秩和检验计算得到。
图7显示接种了疫苗的rm的血浆中的rhcmv攻击病毒的病毒载量。所示的是攻击16周后在接种了mva-rhul128cδ、mva-rhul128c的rm和未接种一秒的对照动物的血浆中可检测到的基因组拷贝数的曲线下的面积。每组的auc中位值由实线标出。疫苗组和非疫苗对照组之间的p值通过单侧秩和检验计算得到。
图8显示来自mva的人ul128c(u-ul128c)亚基的表达。所示的是在表达mva的hcmvul128c亚基抗原的独立泳道中的全细胞提取物的结果。利用ucmv特异性mab(gh、ul128、ul130)和来自h-ul128c特异性肽的在兔子中制得的多克隆血清(ul131a,gl)完成在sds-page后对pvdf膜上蛋白的检测。cef=小鸡胚胎纤维原细胞,br5=mab对抗mva内源性蛋白质作为上样对照。
图9显示由mva表达的hcmvul128c亚基的免疫共沉淀。感染了mva-ul128c的bhk细胞的裂解物被用于gh和小鼠单克隆抗体抗hcmv-gh14-4b或偶联到蛋白质a/g琼脂糖的不相关的对照抗体的免疫沉淀。然后,通过wb用抗hcmv-gh(克隆ap86)、ul128或ul130的小鼠单克隆抗体和抗hcmv的gl或ul131的兔多克隆抗血清(如所示)分析免疫沉淀的蛋白。
图10是一张生成自剪切的mva-bac的示意图。首先,包括氯霉素抗性标记(cmr)、mini-f复制子和由牛痘病毒p11启动子驱动的gfp表达盒的bac载体,通过在cef中的重组被插入mva胸苷激酶(tk)位点。其后,重组基因组克隆在大肠杆菌中拯救(rescue),并且逆基因组复制通过2步基于enpassant诱变的red重组插入到bac载体中。在bac转染入mva受纳细胞后,bac载体序列通过基因组复制的切除重组去除。
图11说明来自mva的hcmv插入片段的表达,该mva由1974-mva-bac重新构建。在图11a中,红色荧光蛋白(rfp)的表达通过bhk-21细胞的单一病毒斑块荧光显微显示,该细胞感染了在del2、igr或g1l插入位点包含mrfp表达盒的mva。由于bac载体构建,mva也表达gfp(图右侧)。在图11b中,蛋白质印迹法分析cef,其感染了表达由del2表达的人ul128、由igr3表达的人ul131a或由g1l表达的人全长gh的mva。感染了非重组mva的cef作为非特异性的对照被分析。通过兔多克隆抗体(ul131a)或小鼠单克隆抗体(ul128,gh)检测蛋白。
图12显示接种了疫苗的balb/c小鼠中的nab效价。a和b显示了在接种了所示mva疫苗之后不同时间点的balb/c小鼠的nab效价(nt50)。balb/c小鼠被接种2次、间隔4周,在每次接种3周后即第3周和第7周、并额外地在第一次接种后的第20周测量血清nab效价。利用hcmv菌株vhl-1用于感染,在人arpe-19上皮细胞(a)和人体包皮纤维原细胞(hff-1)(b)上确定nab效价。c显示在apre-19细胞上第一次疫苗接种对抗hcmv菌株vhl-1、tb40/e和tr20周后的中和活性。a、b和c中邻近y轴的箭头说明了该化验的检测极限。a和c中上方的虚线说明在arpe-19细胞上测量的在来自hcmv阳性个体的混合血清中抗hcmv菌株vhl-1的中和活性。b中上方的虚线显示在纤维原细胞上测定的hcmv阳性供体的血清中抗实验株ad169的中和活性。
具体实施方式
本文提供了用于预防或治疗hcmv感染的表达系统和疫苗。下文详细描述的表达系统和疫苗,产生对抗hcmv抗原蛋白或片段的中和抗体(nab)以阻断病毒侵入宿主细胞,从而预防水平的和垂直的病毒传播。
尽管努力了几十年,hcmv疫苗研发仍然是未解决的公共卫生重点(arvin等2004;stratton等2001)。在基于糖蛋白b(gb)的亚基疫苗上已经取得一些进展(zhang等2006;zhang和pass2004)。在初次感染期间产生高抗体亲抗原性抗gbnab的孕妇比起不产生高抗体抗原性gb抗体的女性有先天感染的孩子的可能性更低(boppana和britt1995)。尽管该结果强调了gb-nab在限制先天感染的重要性,仍有与经胎盘传播相关的未确定的因素。一些产生高抗体亲抗原性gb抗体的女性怀有先天感染的胎儿,而具有低抗体亲抗原性抗体的女性中却没有先天传播(boppana和britt1995)。
被动免疫治疗已被证明可保护胎儿免于宫内感染的灾难性后果。这表明超免疫球蛋白可以降低先天感染的发生率、减少胎盘增厚并解决中枢神经系统疾病的病症。(adler和nigro2006;alder等2007;latorre等2006;nigro等2005;nigro等2008)。近期的发现已经证明大部分cmv超免疫球蛋白nab是针对ul128c的(fouts等2012)。
减毒的hcmvtowne疫苗(下称“towne”),通过在人纤维原细胞上反复传代而衍生(plotkin等1975),引发nab预防hcmv纤维原细胞进入和对病毒抗原的细胞免疫应答(gonczol和plotkin2001)。接种towne疫苗防止低剂量hcmv(plotkin等1989)攻击并部分保护hcmv阴性的肾移植受体免于严重的移植后hcmv疾病(plotkin等1991)。虽然towne刺激与暴露于野生型病毒相差无几的淋巴增殖应答,但是nab效价比在纤维原细胞中测量的自然感染之后观察到的低10到20倍。towne株在人纤维原细胞上繁殖期间经历了基因组改变,包括破坏ul128c细胞膜表达稳定性的ul130蛋白的突变(patrone等2005)(见下文)。与gb疫苗的潜在限制(sinzger等2008;cui等2008)类似的,缺乏特异于epi/ec的对cmv抗原的nab可能限制towne的保护效力。因此,由于最小体内复制和缺乏潜伏期的持久性或迹象,有可能towne被减弱了太多而不能刺激强健的免疫力。因此,在towne和自然隔离之间的嵌合疫苗株(toledo)被用于i期研究中,以加速复制,同时保留毒性(heineman等2006)。
基于hcmv的疫苗也可以被免疫逃避限制,导致被不相关的hcmv菌株重叠感染hcmv阳性的女性,导致先天感染,(boppana等2001)。一种由pp65和gb抗原组成的dna疫苗策略已经在移植情况中测试,然而gb特异性抗体水平被最小刺激并且该水平被认为不够高来防止恶化的感染(wilck等2010;wloch等2008;kharfan-dabaja等2012)。
评估重组gb与辅剂mf59混合(gb/mf59)的ii期试验表明预防血清反应阴性的在前一年内生过孩子的女性的初次hcmv感染有50%的有效性(pass等1999;pass等2009)。与此相反,减毒活hcmvtowne株(“towne”)在早前的试验中未能保护血清反应阴性的有至少一个hcmv泄出的孩子母亲免受初次hcmv感染(adler等1995)。这些结果提供了鼓励,针对中和表位的疫苗可以显著地降低hcmv阴性女性的初次感染率。然而,在两期试验中均缺乏彻底的预防,表明额外的非gb编码的中和表位应当被作为消除婴儿在母体中的初次感染和先天感染的风险的目标。尤其是,如下文所述,cmv疫苗中应当包括可能诱导nab来阻断epi/ec细胞谱系的hcmv感染的表位。
在细胞或细胞群在粘膜表面的初次感染之后,hcmv通过血液扩散到多种身体器官。hcmv感染具有广泛的细胞向性,包括epi/ec、纤维原细胞、巨噬细胞(sinzger等2007;plachter等1996)和细胞滋养层(maidji等2006;maidji等2002)。病毒侵入不同的细胞类型需要不同的gh和gl包被糖蛋白复合物(gh/gl)(sinzger和jahn2008;vanarsdall和johnson2012)。然而,由于它们的易用性,通常利用纤维原细胞研究hcmv的培养和nab效价的定量。
利用适应组织培养的hcmv株(例如,ad169或towne)的基于纤维原细胞感染的中和作用的研究已经确定糖蛋白b(gb)、糖蛋白h(gh)和糖蛋白m(gm)与糖蛋白n(gn)复合体(nm/gn)作为主要nab靶点(adler等1998;britt等1990;marshall等1994;rasmussen等1991;shimamura等2006)。gb引发了多数的抗体,这些抗体发现于免疫个体中,通过在病毒体和细胞膜之间阻断gb介导的融合体中和纤维原细胞感染(kinzler和compton2005;navarro等1993;britt1984;britt等1988;gonczol等1990;liu等1991)。然而,如上所述的疫苗研究,基于纤维原细胞的中和作用对nab对hcmv感染的响应的界定不完全。这可能是由于预防epi/ec感染的失败,因为中和作用研究没有检测阻断epi/ec感染的nab。
人cmv(hcmv)和恒河猴cmv(rhcmv)基因组是基本上共线的(hansen等2003;rivailler等2006),并且和hcmv相似,rhcmv的ul/b’毒性区域已经被证明经历培养传代之后的重排,导致多个开放阅读框(orfs)的缺失(oxford等2008)。尽管hcmv入侵纤维原细胞取决于bb、gm/gn和由糖蛋白h、糖蛋白l和糖蛋白o形成的复合体(gh/gl/go),但需要3个在ul/b区域的orfs,ul128、ul130和ul131a以侵入epi/ec。ul128、ul130和ul131a形成一个带有gh/gl的五聚体病毒体蛋白复合体,称为ul128c,其介导依赖低ph的内吞噬侵入epi/ec,这与上文所述的与纤维原细胞的病毒融合是截然不同的(hahn等2004;isaacson和compton2009;ryckman等2010;ryckman等2008a,b;vanarsdall等2008;wang和shenk2005b;wille等2010)。
由于在ul128-ul131a位点的突变,ad169和townecmv株已经失去了感染epi/ec的能力(murphy等2003;wang和shenk2005a)。因此,它们受限制的细胞向性使得这些病毒不适合于量化抑制epi/ec感染的nab。使用带有完整细胞向性的hcmv临床株表明,感染hcmv的个体产生抗ul128c的nab有效地阻断了epi/ec感染(genini等2011;macagno等2010)。另外,用ul128、ul130和ul131a修复的ad169的研究已经表明gb/mf59和towne未能诱导epi/ec特异性的与在自然感染期间观察到的相当的nab效价(cui等2008)。这些结果提供了有力的证据表明ul128c是重要的特异于epi/ec的nab活性决定因素(cui等2008;gema等2008)。因此,一种最小化越过粘膜表面攻击病毒的传播的方法,是通过疫苗接种来以这些蛋白为目标,以预防初次感染的扩散(参见wussow等,2013,示出了通过ul128c疫苗接种的nab阻断epi/ec和纤维原细胞感染)。
cmv疫苗的临床应用通过在恒河猴(rm)中的研究变得更为方便,恒河猴被认为是与人类最直接相关的模型。以前已证明将表达rhgb的mva接种于rhcmv阴性的rm会诱导纤维原细胞特异性nab并减少血浆中的rhcmv攻击病毒(abel等2011;yue等2008;yue等2003)。另外,一种由rhgb和两种细胞介导免疫的主要靶向物,磷蛋白65(rhpp65)和立即早期1(rhie1)组成的三价mva疫苗,在50%的接种疫苗的动物中降低了泄出(abel等2011)。在hcmvul128c五聚体在epi/ec侵入中被需要并且是一种重要的nab靶向物的研究基础之上,在下面描述的实施例中的研究表明将表达mva的rhcmvul128c(rhul128c)疫苗接种于rm会引发nab抑制rhcmv感染恒河猴epi/ec和恒河猴纤维原细胞。该方法由一个研究支持,该研究表明在缺乏orfs的rhcmv变异体中ul128、ul130和ul131a的恢复会恢复上皮向性(lilja和shenk2008)。另外,与用亲代的ad169免疫相比,用带有修复的ul130基因及恢复的ul128c五聚体结构的ad169接种于rm或兔,会导致显著增加的抑制hcmv感染arpe-19上皮细胞的中和活性,(fu等2012)。下文所述的在rhcmv阴性的rm中的研究,利用rhcmvul128c作为预防性疫苗来引发nab,该研究证明了可以预防多种cmv感染侵入路线的一个hcmv当量的构建的合理性。类似的hcmvul128c和基于gb的疫苗也可以被构建并被评价以引发nab,该nab预防被致命的临床hcmv分离物体外感染。这种疫苗可以在中和内吞噬和纤维原细胞感染途径的hcmv感染中更有效。
如本文所述,并至少在段落[0005]、[0010]、[0017]和[0018]中所述,在mva中表达hcmvul128c五聚体的组装形式和表示独立组分的亚种。这些抗原的组合包括gh和gl;ul128、ul130和ul131;带有全长gh的ul128c;以及带有跨膜缺失的gh的ul128cδ和。另外,gb和venus被分别插入mva并在balb/c小鼠中与ul128c亚基类似地被评估。简言之,这些实验包括了2轮免疫,相隔4周,并且在基线第3、7和20周抽血。值得注意的是,在用ul128c免疫的小鼠中,在arpe-19上皮细胞上测量的nt50nab对抗hcmv菌株vhl-1的效价,在一次免疫接种之后激增到4096,在第二次免疫接种之后增长了约3倍,同时在第20周的时间点保持了仅仅稍低于最高水平的活性(图12a)。使用ul128cδ株在第二次免疫接种后得到一组平行的但更低的量,但是使用gh/gl-mva只得到很短暂的并相对低水平的nab,在使用gb-mva或venus-mva时只有背景识别(图12a)。感染途径为腹膜内,这可能已经影响了nab水平,因为已经描述了mva皮下注射或肌肉注射可以导致nab效价的增加。然而,关于降低在balb/c小鼠中的中和活性,在所有其他构建体和具有全长gh的ul128c之间有明显的区别。
令人惊讶的是,测量于血清中的hff-1纤维原细胞上的nab效价,该细胞衍生自接种了mva-ul128c疫苗的小鼠,也显著地高于其它组确定的nab效价(图12b)。这些结果是出乎意料的,因为ul128c之前从未被作为预防纤维原细胞的hcmv感染的nab靶点描述于文献中。虽然在第一次免疫接种后在mva-ul128c疫苗组中没有可检测到的中和活性,但是在第二次免疫接种后nab效价增加到387,并且甚至在第20周有小幅增长。在第二次免疫接种后,在接种了mva-ul128cδ或表达gh/gl的mva疫苗的小鼠中也确定了低nab效价,尽管在第20周,两种疫苗的nab效价下都跌到化验检测极限以下。另外,接种了共表达ul128-ul131、mva-gb680或venus的mva疫苗的小鼠中中引发的中和活性,在20周中自始至终无法检测到。同样,对于诱导nab来说,疫苗接种途径可能已经是次优的。然而这些结果提供了有力的证据证明对于降低同时抑制epi/ec和纤维原细胞感染的中和活性,ul128c五聚体优于gb或任何少于所有5种ul128c的亚基的组合。
另外,在来自接种了mva-ul128c疫苗第20周的balb/c血清中的arpe-19细胞上测量的有效中和活性,不仅对抗vhl-1病毒有效,它对抗hcmv株tb40/e和tr也是同等有效的(图12c)。对独立病毒的确定的效价彼此相当。在来自接种了mva-ul128cδ疫苗的小鼠血清中测定的对arpe-19细胞中3种不同的病毒的nab效价也彼此相当,但是明显低于在接种了mva-ul128c疫苗的小鼠血清中测量的nab效价。在接种了表达ghh/gl、ul128-ul131a、gb或venus的mva疫苗的小鼠中,没有中和活性被确认。这些数据提供了有力的证据证明接种ul128c五聚体疫苗引起了广泛的中和活性。
在上述研究基础上,本文已经研究和描述了用于抑制hcmv入侵epi/ec、纤维原细胞或两者均可的表达系统、病毒载体和疫苗。
cmv抗原的表达系统和疫苗
根据本文描述的实施方案,本文提供了hcmv抗原蛋白表达系统(或“抗原表达系统”)。在一个实施方案中,抗原表达系统可以包括一种克隆载体来克隆一种表达载体,该表达载体能够表达一种或多种hcmv抗原蛋白或其抗原片段。
在一个实施方案中,该克隆载体是一种bac,它是一种可以被用于通过在细菌(如,大肠杆菌)中转化来克隆一种或多种靶向hcmv基因的dna构建体。将bac作为一种克隆载体的使用允许了非常大的dna序列的稳定的克隆,并且能利用为大肠杆菌建立的基因技术轻易控制。在一些实施方案中,bac克隆载体被用于克隆一种表达载体。该表达载体可能是一个质粒、bac、病毒载体(如,腺病毒载体、腺相关病毒载体、rna病毒载体、慢病毒载体或逆转录病毒载体)、构造成bac的病毒载体或任何其他能够表达重组蛋白、病毒载体或两者均有的适合的载体。
在一些实施方案中,该表达载体(如,病毒载体)能够表达一种或多种免疫原性的或抗原的hcmv蛋白或其功能化的片段。一种免疫原性的蛋白是指一种蛋白,当它被引入一个对象时,它被对象的免疫细胞识别,从而刺激免疫反应。该免疫反应可以导致抗体产生(如,中和抗体产生)对抗该蛋白。一个免疫原性的蛋白的有功能的或抗原的片段是该蛋白的任何部分,其包含一种该蛋白的抗原部分或即为该蛋白的包含至少一个抗原决定位的抗原部分。在一些实施方案中,该一种或多种免疫原性的蛋白或其有功能的片段可能是一种免疫原性的蛋白复合体,其包括一组免疫原性的蛋白质亚基或其有功能的片段。
在一个实施方案中,该bac克隆载体被用于克隆一种病毒表达载体。在这样的实施方案中,该病毒表达载体的基因组被插入到一种bac构建体中以生成一种病毒bac构建体或质粒。随后用病毒bac质粒转染一种细菌宿主(如,大肠杆菌)来克隆病毒载体。病毒bac的转染克隆到易受病毒载体感染的真核细胞导致了重组病毒的重建。其产生的重建的病毒载体然后可以被用于感染一个宿主内的靶向、组织或细胞。
在一些实施方案中,病毒载体可以衍生自任何合适的痘病毒,包括但不仅限于:禽痘病毒(如,金丝雀病毒及相关的菌株,如金丝雀痘病毒、鸡痘病毒),正痘病毒(如,牛痘病毒菌株如westernreserve或lister菌株、哥本哈根菌株(nyvac)、dryvax菌株、经过改良的痘苗病毒安卡拉(mva)菌株、acam1000和acam2000菌株),副痘病毒(如,orf病毒)。在某个实施方案中,该病毒载体是一种经过改良的痘苗病毒安卡拉,它被克隆到bac克隆载体(“mva-bac”)中并且能够表达一种或多种免疫原性的hcmv蛋白或其抗原片段。根据本文描述的实施方案,任何适合的mva菌株可以通过bac克隆,包括但不仅限于1974-mva菌株、vr菌株或acam3000菌株。
在一个实施方案中,一种或多种免疫原性的hcmv蛋白或其抗原片段是一组免疫原性的蛋白质亚基或其有功能的片段,它们是ul128复合体(ul128c)的部分。该ul128复合体是一种hcmv蛋白复合体,其包括下列5种免疫原性蛋白质亚基或其有功能的片段:ul128、ul130、ul131a、gl和gh。需要在单个细胞中ul128c的全部5种亚基的共表达来获得有功能的表达(patrone等2005;macagno等2009)。因此,需要一种单一递送载体(如,mva见下文),因为没有现有的普遍可接受的方法来引导>1独立的dmv或病毒载体通过ul128c全部5种组分的共表达在体内组装一种蛋白质复合体。
通过本文所述的表达系统和病毒载体,包括ul128、ul130、ul131a、gl和gh蛋白或其抗原片段的ul128复合体的表达导致了通过宿主的免疫系统的中和抗体(nab)的刺激,该刺激阻断了在易感细胞如上皮细胞和内皮细胞中的hcmv感染。
在其它的实施方案中,表达载体可以包括额外的hcmv蛋白,包括但不仅限于pp65、gb、ie1gm、gn、go和其他本领域已知的合适的抗原hcmv蛋白。这些额外的基因可以与ul128c亚基被插入到第一表达载体,或可选择地,可以被插入到第二表达载体以与第一表达载体的组合来被施用。
根据本文所述的实施方案,提供了一种免疫疗法。该免疫疗法可以包括施用一种或多种预注载体或疫苗,然后施用一种或多种增效载体或疫苗。预注载体可以是任何合适的表达载体,其包括在上述mva载体中描述的hcmv或rhcmvul128c亚基。在一个实施方案中,预注载体可以是一种包括裸质粒dna的载体,其结合和本文所述的mva载体相同的hcmv或rhcmvul128c亚基。额外的预注载体或疫苗可以包括病毒载体、细菌载体或其它递送载体,既可以是活的也可以是人造的,在mva免疫前施用。该预注疫苗接种可以施用一次或可以作为多剂量给药(如,一次、两次、三次、四次或更多)施用预注免疫方案,其可以包括一系列预注免疫接种,施用的时间表可以在接种之间从1至4周变化。例如,预注疫苗接种可以在一个方案或可以在接种之间从1至4周变化中的时间表中施用一次、两次,或者三次。
在其他实施方案中,上述mva载体可以是预注免疫。在这种情况下,上述的预注也可以在一次或更多次(如,一次、两次、三次、四次或更多)连续的mva免疫后被用作增效载体。亦或,预注和增效载体可以交替,从而异源性免疫将包括一种mva或替代的载体作为预备,随后mva或替代的载体作为增效,以从1-4倍为例。本领域内已知的其它合适的免疫时间表或方案可以由本领域内技术人员根据本文所述的实施方案施用。
根据一些实施方案,替代的载体,例如上述的裸质粒dna,可被组装从而所有的ul128c亚基被组装于一个单体载体中。亦或,该ul128c亚基可被组装于基础表达载体的几个不同的拷贝中,该基础表达载体可以是质粒、病毒或细菌载体。另外,ul128c亚基可以被插入到分散的位置或通过被称为内部核糖连接体进入位点(ires)的连接肽连接,ires从许多不同的本领域内公知的rna病毒衍生,将所有或一部分的亚基连接在一个插入位点或多个插入位点。一个这样的连接肽被称为2a或相似的来自一个相关病毒的连接肽被称为t2a,可以被用于将ul128c亚基连接在一起成为一个多顺反子信使rna,其可被翻译和加工为多种不同的蛋白。
一个重组载体,如上述mva病毒载体,或任何其他合适的替代的载体,包括上述合适的预注或增效载体,可以是可用于治疗或预防hcmv感染的方法中的hcmv疫苗组合物的部分。本文所述的hcmv疫苗组合物可包括治疗有效剂量的本文所述的重组病毒载体,并进一步包括根据标准方法药学可接受的载体。可接受的载体的实施例包括生理上可接受的溶液,如无菌生理盐水和无菌缓冲盐水。
在一些实施方案中,疫苗或药物组合物可结合药学有效剂量的佐剂来使用以增强抗cmv效果。任何可以刺激免疫系统并增强对疫苗的应答,并且自身没有任何特定抗原作用的免疫佐剂都可被用作佐剂。许多免疫佐剂模仿被称为病原体相关的分子模式(pamps)并且被一组被称为toll样受体(tlrs)的疫苗受体识别的进化上保守的分子。根据本文所述的实施方案,可被使用的佐剂的例在包括弗氏完全佐剂、弗氏不完全佐剂、双链rna(一种tlr3配体)、lps、lps类似物如单磷酰基脂质a(mpl)(一种tlr4配体)、鞭毛蛋白(一种tlr5配体)、脂蛋白、脂肽、单链rna、单链dna、咪唑并喹啉类似物(tlr7和tlr8配体)、cpgdna(一种tlr9配体)、ribi佐剂(单磷酰基脂质a/海藻糖双棒状霉菌酸酯)、糖脂(α-galcer类似物)、未甲基化的cpg岛、油乳剂、脂质体、病毒体、皂苷(皂苷的活性部分,如qs21)、胞壁酰二肽、明矾、氢氧化铝、角鲨烯、bcg、细胞因子如gm-csf和il-12,趋化因子如mip1-α和rantes、活化的细胞表面配体如cd40l、n-乙酰胞壁胺基-l-丙氨酰基-d-异谷氨酰胺(mdp)和胸腺素α1。根据症状的程度,使用佐剂的量可被适当地选择,如软化皮肤、疼痛、红斑、发热、头痛和肌肉痛的程度,这可能是人或动物在施用了这种类型的疫苗后的作为免疫应答一部分的表现。
在进一步的实施方案中,如上文所讨论的,和本发明的疫苗一起使用其它各种佐剂、药物或添加剂,可以增强通过施用该种疫苗或药学可接受的组合物来获得的治疗效果。该药学可接受的载体可以包括微量的添加剂,如增强等张性和化学稳定性的物质。这种添加剂应当是在使用的剂量和浓度范围内对人类或其它哺乳动物对象无毒性的,其实施例包括缓冲剂如磷酸、柠檬酸、丁二酸、醋酸和其他有机酸及其盐;抗氧化剂如抗坏血酸;低分子量(如,小于约10个残基)多肽(如,多聚精氨酸和三肽)蛋白(如,血清白蛋白、明胶和免疫球蛋白);氨基酸(如,甘氨酸、谷氨酸、天门冬氨酸和精氨酸);单糖、二糖和其他碳水化合物(如,纤维素及其衍生物、葡萄糖、甘露糖和葡聚糖)、螯合剂(如,edta);糖醇(例如,甘露醇和山梨醇);平衡离子(如,钠);非离子型表面活性剂(如,聚山梨醇酯和泊洛沙姆);抗生素和peg。
该疫苗或药学组合物包括本文所述的重组病毒载体,可作为水溶液或冻干制品被贮存于单剂量或多剂量的容器中,如密封的安瓿瓶或小瓶中。
预防hcmv侵入细胞、治疗hcmv以及预防hcmv感染
上述抗原表达系统可用于预防hcmv入侵单个细胞或细胞群的体外、体内或间接体内方法。在一些实施方案中,预防hcmv侵入单个细胞或细胞群的方法包括以下步骤,用有效量的能够表达ul128复合体或其抗原片段的病毒载体接触细胞或细胞群。
在其他实施方案中,提供了在对象中治疗或预防hcmv感染的方法。这些方法可以包括向对象施用药学有效剂量的hcmv疫苗。该hcmv疫苗可以包括至少一种活性成分,其中该至少一种活性成分包括一种能够表达ul128复合体或其抗原片段的病毒载体,例如本文所述的那些。
本文所述的表达系统和疫苗可用于治疗或预防任何感染上皮细胞、内皮细胞、纤维原细胞或其组合的hcmv感染。用本文所述的方法可被治疗或预防的hcmv感染的例子包括但不仅限于,先天的hcmv感染、在免疫系统受损的对象(如,器官和骨髓移植接受者、癌症患者和化疗接受者、接受抑制免疫力的药物的患者和hiv感染者)中机遇性hcmv感染以及在其他健康对象中隐性hcmv感染。
本文中使用的术语“有效量”是指产生了预期的效果的化合物的量。例如,一个细胞群可以被有效量的一种化合物接触来研究其在体外的效果(如,细胞培养)或产生预期的在间接体内的或体内的疗效。有效量的化合物可被用于在对象中产生疗效,如预防或治疗目标病情,缓解与病情相关的症状,或产生预期的生理作用。在该种情况下,化合物的有效量是“治疗有效的量”,“治疗有效的浓度”或“治疗有效的剂量”。精确的有效量或治疗有效的量是,根据在一个给药对象或细胞群中的治疗功效,组合物产生最有效的结果的量。取决于许多因素,这个量将变化,包括但不限于化合物的特性(包括活性、药动学、药效学和生物有效性)、对象的生理状况(包括年龄、性别、疾病类型和阶段、一般身体状况、对给定剂量的响应和用药类型)或细胞、药学上可接受的载体在剂型中的性质和给药途径。进一步的,取决于该化合物是否是单独施用或与其他的化合物、药物、疗法或其它治疗方法或用药模式结合施用,有效的或治疗有效的量可以变化。临床和药理学领域的技术人员通过常规实验将能够确定有效的量或治疗有效的量,即通过检测一个细胞或对象对施用化合物和相应地调整剂量的响应。更多的指导参见remingto:thescienceandpracticeofpharmacy,第21版,univ.ofsciencesinphiladelphia(usip),lippincottwilliams&wilkins,philadelphia,pa,2005,其通过援引如同在本文中完全详述一般并入。
病情的“治疗”(treating)或“治疗”(treatment)可以指预防该病情、减缓病情的发作或发展率、降低病情发展的风险、预防或延迟与病症相关症状的发展、减缓或终止与病情相关的症状、产生彻底的或部分的病情的复原或其组合。治疗(treatment)也可以表示病情的预防或防止的治疗。
在一些实施方案中,本文所述的疫苗或药学组合物可结合其他已知的药品来使用,如免疫反应促进肽和抗菌剂(合成抗菌剂)。该疫苗或药物组合物可进一步包含其它药物和添加剂。本文所述的可与疫苗或药物组合共同使用的药物或添加剂的例子,包括援助本发明的重组病毒或mva或重组转基因蛋白、脂质体的细胞内吸收的药物和其它促进转染的药物和/或添加剂以(如,碳氟化合物乳化剂、脂质卷(cochleates)、小管、金颗粒、可生物降解性微球,和阳离子聚合物)。
在一些实施方案中,包含在本文所述的疫苗或药物组合的活性成分的量可选自广泛的浓度范围,病毒粒子单元(vpu)、噬斑形成单位(pfu)、重量体积百分比(w/v%)或其它活性成分量的定量测定,只要它是一个治疗的或药学有效的量。根据预期的治疗效果、施用方法(给药途径)、患者的年龄、性别和其他情况等,疫苗或药物组合的剂量可适当地选自广泛的范围。
在一些方面,当重组病毒载体作为疫苗或药物组合的活性成分被施用于人类对象时,重组病毒或mva的剂量可以是大约相当于102到1014的pfu的量,优选为105到1012的pfu,并且更优选为106到1010的pfu,作为重组病毒的pfu测算。
在进一步的方面中,当重组病毒载体作为疫苗或药物组合的活性成分被施用于对象时,根据被引入疫苗宿主的可表达的dna的量或转录的rna的量,该剂量可以选自一个广泛的范围。该剂量也取决于所使用的任何载体中使用的转录和翻译的启动子的强度。
在一些实施方案中,本文所述的疫苗组合物或药物组合物可通过直接注射通过将重组病毒或mva悬浮于pbs(磷酸盐缓冲盐水)制得的重组病毒载体的悬浮或盐水到局部位置来施用(如,进入肺组织、肝脏、肌肉或脑),通过鼻或呼吸道吸入,或通过血管内注射(i.v.)(如,动脉内、静脉内和门静脉),皮下(s.c.),皮内(i.c.),皮内(i.d.)或腹腔内(i.p.)施用。本发明的疫苗或药物组合物可被施用超过一次。更具体的,在初次施用后,一次或多次的疫苗可被作为增效剂给药。一次或多次增效给药可以增强预期效果。在疫苗或药物组合物的施用后,用本文所述包含重组病毒或mva药物组合物的增强免疫可被执行。
本文所述的对hcmv疫苗的试验、体外研究及rhcmv模型中的工作的评价集中于,蛋白的ul128复合体(ul128、ul130、ul131a、gh和gl)必须被包含于疫苗制剂来干扰一种重要的hcmv感染的入口——内皮细胞和上皮细胞的前提下。这种蛋白复合体的功能通过免疫被中和来同时阻断从传染位点到末端位点的播散和来自受感染的宿主的受感染的病毒的传播。单独的ul128c或与其他疫苗候选抗原,这样的战略提供了合理地基础来显著地抑制hcmv的垂直和水平传播。hcmv的小动物模型(即,小鼠、豚鼠[gp]和大鼠)将持续在建模疫苗方式中起关键的转化作用。在啮齿动物模型中,只有豚鼠cmv(gpcmv)编码了ul128和ul130的序列同源物(schleiss等,2008;yamada等,2009),而ul128c蛋白对细胞向性的功能的重要性局限于灵长类cmv(hansen等,2003;rivailler等,2006;oxford等,2008)。下列实施例1所述的数据证明了hcmv疫苗方法在高度相关的灵长类动物宿主中的适用范围和可翻译性。
下列的实施例证明了通过操纵bac衍生出mva,每种组成ul128c的5种亚基蛋白已经被连续地克隆在不同的保留为bac质粒的mva(mac-mva)的插入位点中。将ul128c-mva疫苗接种于rhcmv阴性的恒河猴(rm)后ul128c的功能,并证明了抑制剧毒的rhcmv自然隔离感染epi/ec细胞和纤维原细胞的高效价nab的生成。基于这些在rm中的结果,对应于恒河猴ul128c的hcmv很可能可以被组装在mva-bac中并被用来接种疫苗于rm来引起防止体外hcmv感染多种容许细胞类型的nab。
在实施例2中所述的一个实施方案中,ul128复合体可利用mva-bac分子技术构建。使用由目前被用在临床试验的1974-mva菌株制得的病毒dna,用本文所述的方法生成一种自剪切的mva-bac。随后,五种人ul128c亚基(ul131a、ul130、ul128、gl和gh)可被连续地克隆到mva-bac中。在一些实施方案中,通过在fda可接受的人类疫苗细胞基质、小鸡胚胎纤维原细胞中连续传代,在一个单体rmva中的全部五种亚基的等同表达可被分析其稳定性。鼠免疫进一步证实hcmvul128c-mva疫苗的引起nab抑制剧毒的hcmv自然隔离感染易感染的huepi/ec细胞的功能能力。使用免疫腹膜内(i.p.)途径的免疫接种,每组四只balb/c小鼠分别接种包括ul128c、ul128cδ、ul128-ul130-131、gh/gl、gb和venus的mva菌株。被用于体外中和的细胞是本领域标准的人arpe-19(视网膜色素上皮细胞)。给予了vhl-1、tr和tb40/ehcmv菌株优越的中和作用的构建体是ul128c-mva构建体,其具有全长的gh作为插入物之一。
在另一个实施例2所述的实施方案中,可以评价将1974-mva-ul128c接种于未感染rhcmv的rm的接种和nab响应的特性。该实施例中生成的rmva可被用于皮内接种rm。给六只rm每只两剂量的ul128c-mva,间隔六周,随后额外六周后为体外研究收集血清和唾液。由已经免疫的rm获得的血清和唾液将被用于阻断包含ulb’病毒性区域并表达ul128c五聚体的hcmv隔离的感染。评估在对照的和已经免疫的rm中产生的nab的干扰hcmv感染arpe-19(视网膜色素上皮)细胞和初级人类纤维原细胞的功能。hcmv实验室和毒性菌株将被用作与来自已经免疫的rm和对照的血清或唾液共培养的arpe-19细胞的感染攻击。
在另一个实施例3所述的方案中,hcmv蛋白、pp65和gb可被插入mva-bac,并且以类似于ul128c-mva的方式研究该构建体的表达、稳定性和免疫原性。pp65-gb-mva和ul128c可以每6周以混合物或分开地给到rm。可利用arpe-19细胞或者成纤维细胞,使用体外方法测量hcmv特异的nab。出于探寻epi/ec和纤维原细胞的被疫苗刺激的nab抑制hcmv感染的路线的目的,可以测量预防hcmv感染的效价。可评价所有ul128c亚基和pp65/gb被插入一个单个mva-bac中的一种替代的疫苗的亚基表达和遗传稳定性。该疫苗将被给到rm,并且在arpe-19细胞和初级人类纤维原细胞进行hcmv的体外中和。
以下的实施例旨在阐明本发明的各种实施方案。因此,所讨论的具体实施例不应成为对本发明范围的限制。在不脱离本发明范围内的各种等同物、变化和调整对本领域的技术人员是显而易见的,并且应当理解,这些等效的实施方案应包括于本发明。此外,所引用的所有参考文献通过援引如同在本文中完全详述一般并入。
实施例
下列实施例阐明了hcmvul128c的全部五种成分可被持续地在一个bac衍生的临床相关的mva载体的版本中表达,来刺激nab以预防epi/ec细胞感染。这些实施例至少包括以下检测:(1)bac技术可应用于快速建造mva以在单细胞中有效地表达rhcmvul128c;(2)由mva-rhcmv-ul128c的rm免疫引发生物相关的nab效价,其中和了rhcmv噬上皮菌株;(3)bac技术对于在单细胞中表达有功能的、五种成分的hcmvul128c是有效的;(4)临床批准的1974-mva菌株可被克隆到bac中;以及(5)利用rhcmv阴性的rm来分析阻断带有hcmv的人类epi/ec细胞感染的nab的发展,(6)在rm中的攻击结果。(7)在mva中的hcmvul128c引起了小鼠中的nab,其中和了arpe细胞上的不同hcmvepi/ec嗜菌菌株(tb40/e、vhl-1、tr、其他)。
mva-bac优于过去的方案,因为它的使用消除了在真核细胞中的逐步修饰的病毒和斑块纯化的5-10次传代的连续衍生,其需要几个月甚至数年来稳定表达多种基因。与此相反,该bac系统允许大基因组在一个易于应用的细菌系统中修饰,其中几个月的工作可被合并到几周。这种方法可能是唯一可做到的方法来共表达5种或更多个来自单个载体的基因,其中每种基因都在相同或不同的启动子序列(mh5)下。如近期被证明的那样(wang等2004,abel等2010),hcmv亚基gb也可以被插入到mva中以诱导nab阻断纤维原细胞侵入。无论最终的载体是否仅包含ul128c的成员或也包含pp65和gb,这种在bac系统中mva遗传操纵的方法呈现了传统方法的一个显著变化,和将mva的适用范围扩展到适用于生产nab所需的多组分复合体,该nab可识别例如ul128c的构象表位。因为已经证明rm能够生成响应于rhcmvpp65和gb(abel等2010)以及rhul128c(wussow等2013)的有功能的nab,生成响应于hcmvul128c+gb-mva疫苗的在体外分析系统中能中和hcmv隔离种群的nab也应当是成功的。
实施例1:一种在cmv初生恒河猴中引入广泛中和抗体的疫苗,其抑制恒河猴cmv感染的主要入口
病毒和细胞。在幼仓鼠肾(bhk)细胞中的mva传播,和病毒原液的制备和存储根据之前报道的方案(wang等2010)执行。用于mva传播的小鸡胚胎纤维原细胞(cef)保留在病毒生产的无血清培养基(vp-sfm;invitrogen)中。
通过如下所述的bac技术产生表达全长的5个亚基rhul128、rhul130、rhul131、rhgl和rhgh的五聚体的mva(mva-rhul128c),用一种交替的跨膜(tm)位点缺失版本的gh表达该5亚基五聚体的mva(mva-rhul128cδ),或表达rhul128、rhul130和ul131a亚基的mva。通过之前描述的在真核细胞中的常规操作方案(wang等2007)产生单独表达rhul128或rhul130的mva。具有一个缺失的tm位点的mva-rhgb的构建已经在之前描述(yue等2008)。rhcmv的噬上皮细胞ucd59菌株,其包括一个全长的ul/b′区域,包括完整的rhul128-ul131a基因座(genbank登录号为eu130540:原本注释为菌株22659)(oxford等2008),为了这些研究被连续传代4次在mke细胞上。rhcmv菌株68.1(atcc)在调聚恒河猴纤维原细胞(telo-rf)上传播(oxford等2011)。mke细胞保留在dulbecco的修饰的eagle的培养基f12(dmem:f12;invitrogen),由上皮细胞生长因子(sciencell)补充,1mm丙酮酸酯,25mmhepes,100u/ml青霉素,100μg/ml链霉素,2mml-谷氨酰胺(invitrogen)以及2%牛胎儿血清/superserum(geminibio-products)。telo-rf细胞如前所述的贮存(abel等2011)。所有细胞在37℃、5%co2和95%的湿度下培养。
转移质粒。通过如下描述生成转移质粒以通过enpassant诱变为单个的rhcmv基因在mva-bac中插入基因表达盒。首先,rhul128、rhul130或rhul131a的合成无内含子编码序列(genscript),以及rhcmv菌株ucd59的rhgl和rhgh的已pcr扩增的编码序列(genbank登录号eu130540.1,hq667932.1和hq667933.1)通过pmll和ascl限制性位点被单独插入在质粒pzero2-mh5的牛痘病毒修饰的h5(mh5)启动子和poly-t(5tat)转录终止标志之间(wang等2010)。rhul130的编码序列相较于已公开的序列合成为在orf的位点99和102上有两种c至t的核苷酸变化。对于rhghδtm的生成,rhgh的第一批690个密码子为myc标记表位eqkliseedl(seqidno:2)通过带有提供3’末端编码序列的反向引物的pcr扩增(gagcagaaactgatatctgaagaggacctctga;seqidno:1)。
与此相反,rhul128、rhul130、rhul131a、rhgl和rhghorf与5’末端的kozak序列(gccaccacc(rhul130和rhul131a;seqidno:3)、gccgccgcc(gl;seqidno:4)或gccgccacc(gh;seqidno:5))被插入到atg起始密码子之前。在接下去的克隆步骤中,卡那霉素抗性(kanr)标记物aphai和质粒pepkan-s2的归位内切酶限制位点i-scei(tishcer等2006),用提供50bp复制基因作用的引物进行pcr扩增,并且被插入到克隆基因特有的的限制位点中。用于扩增aphai-i-scei基因盒的引物序列和用于克隆pcr产物的限制位点在下列表1中给出。在所得的构建体中,在基因内部的aphai-i-scei基因盒两侧有50bp的复制基因(图1a)。所有的克隆插入通过测序证实。所有转移质粒的完整序列可根据要求提供。
表1:克隆引物。
为了克隆aphai-i-scei和复制基因讲入rhcmv基因的引物
a克隆到pzero2-mh5的靶基因。
b从pepkans2扩增aphai-i-scei的引物。下划线的序列提供了50bp的复制基因。
c用于把aphai-i-scei基因盒插入到各自rhcmv基因的限制位点。
enpdssant诱变。根据已公开的方案,通过在大肠杆菌菌株gs1783中的两步的基于red重组的enpassant诱变,将已克隆的rhcmv基因插入到mva-bac中(tischer等2010)。简而言之,具有上游mh5启动子、下游牛痘病毒中断信号和已引入的两侧是50bp复制基因的aphai-i-scei基因盒的基因序列,从pzero2-mh5转移质粒用带有包含50bp同源重组扩展的引物被pcr扩增,和通过初次red重组被引入病毒基因组(图1a)。随后,kanr筛选标记被无缝地从插入的基因中切离,其通过归位内切酶的表达在i-scei位点引入dna双链断裂,和随后的50bp复制基因的二次red重组(图1a)。通过连续的应用这些反应,这五种rhcmv基因被依次插入四种传统的mva插入位点中,如图1b所示。用于扩增表达基因盒和基因插入位点的引物序列在下面的表2中给出。
表2.red重组的引物
rhcmv基因表达盒red重组至mva-rac中的引物
a被克隆到pzero-mh5中的rhcmv基因,且包含内部的两侧是50bp复制基因的aphai-i-scei基因盒。
b扩增已pzero2克隆的基因表达盒的引物。下划线的序列介导重组。
c在mva-bac中的表达盒的mva插入位点。
病毒重组。根据类似于前文描述的(cottingham等2008;domi和moss2002)制造商说明(roche)利用fugenehd转染试剂在bhk细胞中进行来自mva-bac的病毒重组。首先,用plasmidmaxikit(qiagen)从gs1783大肠杆菌细胞纯化bacdna。大约1×105bhk细胞被接种于一个六孔板并在16-20小时之后通过fugenehd脂质复合体用2μg经过纯化的bacnda转染。4小时后细胞用鸡痘病毒hp1.441以0.1的感染多重性(moi)感染(mayr和malicki1996)(由bernardmoss友好提供,niaid)。在2天的培育之后,细胞被稀释到1∶2的比率,并且病毒重组由gfp表达和噬斑形成来监测。该稀释步骤可被重复直至大于90%的单层细胞被感染。
多克隆抗血清。rhcmv蛋白兔多克隆抗血清通过用来自genscript的表达完整抗原肽多克隆抗体包对抗下列肽序列生成:用于rhul128抗血清的cidsdsypyeedidg(seqidno:26);用于rhul130的抗血清ctprsapakqvapkp(seqidno:27);用于rhul131的抗血清cvrpgeideclyrqq(seqidno:28);用于rhgl抗血清的cftgetfspeddsw(seqidno:29);以及用于rhgh抗血清生产的hnstkcnnngtrrnc(seqidno:30)。
蛋白质印迹(wb)。用类似于公开的标准方案完成wb(wang等2004)。简而言之,用mva在moi为0.1时感染80-90%的接种于六孔板的融合(confluent)bhk细胞。在36-40小时后,细胞被收集并在300xg下用离心机分离,总的细胞裂解物在200μlsds样品缓冲液(2%sds,100mm二硫苏糖醇(dtt)或10%β-巯基乙醇,和125mmtris-hcl/ph8.8)中配备。为检测培养基中分泌的蛋白,在六孔板上的融合单细胞层的cef细胞在moi为0.1时被感染并在2ml病毒生产无血清培养基(vp-sfm;gibco)中培养36-40小时。收集培养基,在300xg下用离心机澄清,并用
共免疫沉淀反应(co-ip)。用mva-rhul128cδ在moi为5时被感染在100cm2组织培养皿中的bhk细胞(80-90%融合),并培养16-22小时。细胞被收集在冰冷的pbs中并在1ml含有1%(w/v)tritonx-100、50mmtris-hcl(ph7.4)、300mmnacl、4mm乙二胺四乙酸(edta)、0.02%(w/v)叠氮化钠、1mm苯甲基磺酰氟(pmsf)和completemini蛋白酶抑制剂混合物片剂(罗氏)的冰冷的细胞裂解抽提试剂中重新悬浮。在冰上放置30分钟后,通过在~10000xg下在4℃离心分离10分钟去除细胞碎片。用蛋白a/gplu-琼脂糖珠和鼠1gg(圣克鲁斯生物技术公司)在4℃预澄清细胞裂解物30分钟。与此同时,蛋白a/gplu-琼脂糖珠和1-2μg鼠抗c-myc标志抗体克隆4a6(millipore)或鼠1gg非相关的对照抗体在冰冷的pbs中培育2小时,在pbs中洗涤2次,然后与500μl预澄清的细胞裂解物混合。该混合物在4℃培育2小时或过夜。接着,该琼脂糖微球在pbs中洗涤3次,并在50μl的sds样品缓冲液中煮沸。该样品(10-20μl)如前所述进行wb分析。
动物。基因上远系繁殖的恒河猴短尾猿(macacamulatta)来自加利福尼亚国家灵长类动物研究中心(cnprc),反复证实为rhcmv阴性,被用于这些研究。它们在接种rhcmv时的年龄是约1到2岁。这些动物在疫苗接种前至少两周被成对放在一笼,并且保持直至在病毒攻击后的7周研究结束。加州大学戴维斯分校(ucdavis)的动物保护与使用委员会,其被实验动物保护评估和许可委员会全权授权,在任何流程以前批准了所有动物方案。
免疫和攻击。4种rm小组(3种mva-rhul130的rm)通过相隔6周的肌肉注射约5×108噬斑形成单位(pfu)纯化的mva被赋予免疫性,如之前所述(yue等2008)。根据之前公开的方案,在二次免疫八周后,动物通过皮下注射1×103pfu的rhcmvucd59被病毒攻击(yue等2008)。检测nab效价和病毒载量用的血液、口腔试样和尿样如之前所述准备(yue等2008)。
实时pcr。根据制造商的说明和已公开的方案从血浆和口腔试样中用qiasymphony自动化dna处理器(qiagen)提取dna(huff等2003)。最终的洗脱体积是300μl。提取的dna在零下80℃贮存至执行实时pcr分析时。rhcmvucd59dna在血浆和口腔试样中的拷贝数通过前述的实时pcr试验检测(sequar等2002)。
中和试验。(edta抗凝的)猴血浆对于纤维原细胞的nab效价通过使用telo-rf细胞和rhcmv菌株68.1感染进行试验,如前文所述(abel等2011,abel等2008)。mke细胞上的nab检测如下所述。简而言之,25pfu的ucd59,与用连续半对数稀释(1∶31到1∶100)热灭活(56℃,30分钟)的血浆,在一个最终体积为500μl的带有10%牛胎儿血清的dmem:f12中培育。来自八个未感染rhcmv的恒河猴的血浆的汇集混合物作为阴性对照被列入。该病毒/血浆混合物在37℃培育2小时并且随后被一式三份地加入在24孔板上的单层mke细胞中(500μl/孔),其已在之前一天以6×104细胞/孔的密度接种。三个孔中的细胞只在生长培养基中培育。在4小时的培育之后,该病毒/血浆混合物被去除,并且该细胞用dmem:f12洗涤两次,然后覆盖0.5%琼脂糖和2ml的生长培养基。10-12天后,计算噬菌斑。每种稀释的中和效价(nt)百分数如下测算:nt=(1-(免疫血浆的噬菌斑数/阴性对照血浆的噬菌斑数))×100。提供50%噬菌斑减少的效价(nt50效价)通过测定nt对血浆稀释绘图的直线斜率来测算。
数据分析。对每种动物的病毒载量拷贝数被归纳为病毒攻击后16周的总的曲线下面积(auc)。两个连续的时间点之间的auc(t1和t2,在几周内)被测算为两个时间点病毒载量(vl)形成的梯形面积,根据如下公式:auc(t1和t2之间)=1/2(vlt1+vlt2)×(t2-t1)。各个auc测量的总数代表了每种动物的总体auc。
统计分析。根据wilcoxon测算单侧和双侧秩和检验对组与组之间统计学的差异。
在单个mva载体中的rhgh/gl/ul128-ul131a的组装。为了在单个mva基因组中组装所有的五种rhcmv基因的基因表达盒,一种mva-bac与通过enpassant诱变插入的无标记的序列结合使用(cottingham等2008;tischer等2010;tischer等2006)。该mva-bac通过将pbelobac11载体序列和gfp表达盒插入到mva缺失3(del3)位点被构建(cottingham等2008)。使用相应的转移构建体,包含上游牛痘病毒mh5启动子和下游转录终止信号的五种rhcmv基因被连续引入4种已知的mva插入位点,通过在没有细菌选择标记的大肠杆菌菌株gs1783中的enpassant诱变(图1a)。rhul128、rhul131a或rhgh的表达盒,无论作为全长(fl)或tm缺失形式(rhghδtm),被分别插入缺失ii号位点(del2)、基因间隔区3(igr3)(manuel等2010)以及在必不可少的orfg1l和i8r中的插入位点(wyatt等2009)(图1b)。此外,rhul130和rhgl的表达盒被引入del3位点在bac载体的两端(图1b)。该tm缺失的构建体生成的理由是可溶的rhul128c表达能增强致免疫性(endresz等2001,wang等200415,61)。为了帮助rhul128c的分析,rhgh的缺失的c-末端被一种适合于c-myc表位标记物的框内编码序列替代。所有其他亚基包括全长rhgh未经改良以防止rhul128c的形成中断(lilja和shenk2008)。在相反的转录方向,与单独的mh5启动子基因盒的并置的单独的基因被插入不同的插入位点,以允许可比较的转基因表达的同时降低启动子元件之间在分子间和分子内同源重组的风险(图1b)。该rhgh序列被插入到g1l/i8r位点,因为该位点已被描述支持大的或有毒的序列的稳定传播,如包含跨膜的蛋白或糖蛋白(wyatt等2009)。克隆mva基因组和rhcmv基因的无标记插入的完整性,通过限制性片段分析、pcr和测序证实(数据未列出)。这些结果证明enpassant诱变允许快速的和精确地将全部五种rhul128c亚基插入进入一个克隆为bac的单体mva基因组。
表达rhgg/gl/ul128-ul131a的mva的复原。复原共表达rhgl/gh/ul128-ul131a的mva病毒体,带有或不带有gh的tm,被称为mva-rhul128c和mva-rhul128cδ,该mva-bacdna被转染到bhk细胞中来在鸡痘(fpv)辅助病毒存在条件下重新构成病毒(cottingham等2008;domi和moss2002)。需要用fvp来从″裸露″mvadna引发转路机制,但既不用和mva基因组经历重组也不用在bhk细胞中建立有效感染(cottingham等2008;domi和moss2002)。mva的复原在细胞培养4-5天后通过观察致细胞病变效应(cpe)和源自于bac构建体的表达gfp基因的细胞噬斑形成(数据未列出)来证实(cottingham等2008)。感染了重组病毒的bhk细胞随后通过蛋白质印迹(wb)分析。使用对抗单个rhul128c亚基的肽序列的兔多克隆抗血清,对两种mva载体证实了全部5种插入的rhcmv基因的表达(图2a)。检测到的蛋白质尺寸是:rhul128约55kd、rhul130约43kd、rhul131约23kd、rhgl约32kd以及rhgh约95kd。所有的蛋白质尺寸比依据氨基酸组成理论测算的蛋白质尺寸大,表明了在bhk细胞中所有的rhcmvul128c亚基被翻译后修饰(lilja和shenk2008)。两种更快的rhgl的迁移形式可以通过需要o糖基化作为晚期转移后的成熟过程的未加工的蛋白来解释,如已为hsv所示的(图2a)(johnson和spear1983)。正如预期的那样,tm的缺失导致了rhgh表达与全长rhgh相比带有更小的分子量(图2)。仅表达1个、2个或全部3个rhul128-131a亚基蛋白的mva也在bac技术的协助下生成(图2b)。全部的rhul128c蛋白亚基的共表达导致了ul128-ul131a细胞质数量的增加,其可以通过增加的稳定性或表达解释(图2b)。有单个基因插入的mva在2-3周内生成,且mva-rhul128c和mva-rhul128cδ在4-5个月内生成。总之,bac技术被顺利地用于快速生成仅表达几种或全部5种rhul128c基因的mva疫苗。
rhgh/gl/ul128-ul131a在mva中稳定的共表达。作为下一步,研究了mva-rhul128c的基因和蛋白表达在病毒传播中在病毒传播中的稳定性。mva-rhul128c在bhk细胞上被传代了5次并且在每次病毒传代后通过wb测定全部5种插入的rhcmv基因的相关表达水平。在mva-rhul128c的5次病毒传代期间证实了全部5种rhcmv蛋白的稳定数量(图3)。插入的rhcmv基因的稳定表达也在mva共表达rhul128、rhul130和rhul131a的5次病毒传代期间被证实(数据未列出)。另外,来自通过bac技术生成的疫苗载体或来自由常规mva转染/感染策略衍生的疫苗载体的单发的rhul128基因表达在超过10次病毒传代有可比的表达水平(数据未列出)(earl等2011)。这些结果证明mva-rhul128c在连续的病毒传代期间稳定共表达了全部的rhcmv基因,并证明了bac衍生的mva提供的插入稳定性比得上常规衍生重组体。因此,五聚体和其他rhcmv亚基mva重组体被判定适合于大规模扩展来为免疫研究准备原种。
rhul128c亚基的相互作用。为了显示rhul128c五聚体的形成,通过免疫共沉淀(co-ip)分析了由mva表达的rhgh/gl/ul128-ul131a蛋白的蛋白相互作用。感染了mva-rhul128cδ的bhk细胞被收集并被加工为用抗-c-myc标记物单克隆抗体检测rhghδtm的ip。该免疫共沉淀蛋白通过wb进行分析,使用多克隆抗血清检测该单独的rhul128c亚基。rhghδtm的ip导致了所有其他的rhul128c亚基的co-ip(rhgl、rhul128、ul130和ul131a)(图4)。(参见wussow等2013)这些结果证明了当共表达自mva-rhul128cδ时rhghδtm与rhgl和rhul128相互作用,这也为导致五聚体的rhul128c的形成的关键作用提供了证据。
在rhgl和rhul128-ul131a共表达下rhghδtm的分泌增强。ryckman等利用基于腺病毒的表达载体证明了tm缺失的gh(ghδtm)的分泌通过全部的ul128c五聚体亚基表达被提高(ryckman等2008b)。形成rhcmv的rhul128c五聚体复合体的亚基的相互作用被同理表征,通过比较表达自单独的mva的,或与rhgl,或与rhgl和ul128-ul131a(mva-rhul128ca)结合的mva表达的rhghδtm分泌效率。该方法通过使用多克隆抗gh抗血清的wb分析浓缩的无血清培养基和感染mva构建体的cef的细胞裂解产物。正如预期的那样,全部的rhul128c亚基的共表达(mva-rhul128cδ)与其单独的表达或与gl结合的表达相比,导致了rhghδtm的最高分泌水平(图5)。另外,单独表达的、或与rhgl结合、或与其它全部的rhul28c亚基结合的rhghδtm分泌的数量比那些与其它全部的rhul128c亚基(mva-rhul128c)一起共表达的全长rhgh更高(图5),表明tn或rhgh存在的条件下拴住了在细胞表面的复合体。有趣的是,培养基中可检测的rhghδtm或rhgh的尺寸比在细胞裂解产物中观察到的稍大一些(相对于95kd尺寸标记物),表明rhgh的分泌形式(有或没有tm)相比于细胞对应物被不同地转移后修饰。再加上先前的co-ip数据,这些结果进一步证实rhghδtm与rhgl和rhul128-ul131a的共表达导致了五聚体复合物促进rhghδtm的分泌增强,其与一种hcmvgh的可溶形式的研究一致(ryckman等2008b)。
在接种了mva-rhul128c的rm中的epi/ec特异性nab诱导。为了获得防疫过程的中心目标,研究mva-rhul128c或mva-rhul128cδ在rm中产生nab的能力。两组四只rhcmv阴性的猴子各用mva-rhul128c或mva-rhul128cδ(n=4rm/疫苗)免疫2次,间隔6周。单独表达rhul128或rhul130(n=3rm)的mva,或共表达rhul128-ul131a的mva也被用于免疫。在猴肾上皮(mke)细胞上用rhcmv菌株ucd59感染检测提供50%中和的nab效价(nt50)。来自先前的研究的被rhgb或细菌标记gus在dna初期/双倍mva增效过程免疫的猴血浆样品,作为额外的对照进行分析(abel等2011)。mva-rhul128c-或mva-rhul128cδ-接种的rm的nt50效价在疫苗接种2周后相当于自然感染rm的标准nt50范围,分别为从108到402(中位数146)或88至513(中位数209)(图6a)。在mke细胞上测量3-4岁圈养猴对ucd59的nt50的标准范围是67-1060(中位数662)(yue等,未发表)。与此相反,接种了只表达rhul128c亚基或rhgb的mva的rm的nt50效价在试验中保持在可检测限以下(图6a)。mva-rhgb组中只有一种动物具有72的nt50效价(图6a)。因此,对rm不论是接种了mva-rhul128c或者mva-rhul128ca的mke细胞nab效价的测量,均显著高于mva-venus对照组和其他全部的疫苗组(图6a)。第二次接种6周后,nt50效价下降,对于mva-rhul128c免疫的猴其范围介于70至101(中位数79),对于mva-rhul128cδ接种的动物其范围介于36至94(中位数56)。这些nab效价仍然在较低端的或稍低于在mke细胞上测得的nt50标准范围。对mva-rhul128c和mva-rhul128cδ疫苗组测得的nab效价没有显著差异(在2周时p=0.69,在6周时p=0.2)(图5b)。这些结果表明,全部5种rhul128c亚基的共表达,或用横跨膜负载的或可溶形式的gh表达的,全都是引发上皮细胞特异性的nab所需的。
在接种了mva-rhul128c中的rm纤维原维胞特异性nab的生成。对于来自用mva-rhul128c或mva-rhul128ca疫苗免疫的rm的血浆,分析其抑制调聚恒河猴纤维原细胞(telo-rf)感染rhcmv菌株68-1的能力。令人惊讶的是,两种疫苗构建体均诱发了猛烈的nab活性防止rhcmv感染telo-rf细胞(图6c)。在第二次疫苗接种后的两周时,接种了mva-rhul128c的rm血浆显示nt50效价介于590到785(中位数608),接种了mva-rhul128cδ的动物血清具有更高的nt50效价,介于450到864(中位数732)。这些nt50效价在测试于telo-rf的自然受感染的rm的nt50标准范围之内,对于长期受感染的动物该范围介于231到3348(abel等2011)。值得注意的是,测试于telo-rf在疫苗接种2周后接种mva-rhul128c或mva-rhul128cδ的rm的nab显著高于在先前的研究中那些接种了mva-rhgb的rm(3倍,p=0.01)或对照接种疫苗的动物(p=0.005)(图6c)。第二次疫苗接种六周后,nab效价下降了,但对接种mva-rhul128c的rm仍然介于160到383(中位数216),对mva-rhul128cδ疫苗组的动物仍然介于148到350(中位数226)。六周时的nab仍然保持在较低端或稍低于测定于纤维原细胞的nt50值的标准范围(图6d)。正如测定于mke细胞上的nab效价,在telo-rm上,从mva-rhul128c和mva-rhul128cδ的疫苗组检测的nab效价没有显著的区别(p=0.49和0.89)(图6)。相比于具有全长gh的rhul128c,用于生成可溶复合体的缺失tm的gh没有增加mke细胞和恒河猴纤维原细胞的nab效价。这些意料之外的结果证明了表达rhcmvgh/gl/ul128-ul131a的mva诱发nab活性,其不仅抑制了入侵epi/ec,也出人意料地阻断了rhcmv感染纤维原细胞。
在rhcmv病毒攻击后接种rm的mva-rhul128c中降低的病毒载量。评价这2组mva疫苗组表达促进了nab活性的rhul128c的不同的形式对rhcmv攻击的预防效率。免疫了mva-rhul128cδ或mva-rhul128c的rm在用上皮趋向的rhcmv菌株ucd59增效免疫(在第六周)2周后被皮下接种(oxford等2011)。作为对照,未接种疫苗的动物也受病毒攻击。rhcmv基因组拷贝数随后通过在每1到2周收集的血浆和口腔式样中用qpcr测定。图7呈现了累积的ucd59病毒攻击的血浆病毒载量,通过计算在间隔病毒攻击开始的16周之后的曲线下面积(auc)测定。然而动物免疫mva-rhul128c的血浆病毒载量(基因组拷贝数的auc中位数=584)比对照rm(基因组拷贝数的auc中位数=12,652)低21倍,接种疫苗mva-rhul128cδ的动物的病毒载量(基因组拷贝数的auc中位数=5247)仅比对照的未接种疫苗的动物低2-4倍。大部分接种mva-rhul128c的rm病毒载量比没有接种疫苗的rm(p=0.03)低。四个接种了mva-rhul128c的动物中的三个在血浆中没有或只有很少的可检测的rhcmv拷贝数(图7)。与此相反,mva-rhul128ca疫苗组的两种rm表现出无病毒载量,但其他两个具有高病毒载量(图7)。因此,相对于对照组,我们不能在mva-rhul128ca接种的rm的病毒载量中推断任何的改进(p=0.33),也不能推断对mva-rhul128c组的任何的区别(p=0.64)。然而,合并两个疫苗组并比较病毒负荷以控制未接种疫苗的动物产生显著性概率p=0.07,非常接近明确的统计学意义。这些数据表明,接种疫苗rhcmv初生rm与mva-rhul128c在大多数被提供病毒攻击的rm中降低血浆的病毒载量。对于猴子及更重要的对于人类而言,该nab和病毒攻击结果是强烈的指示指明ul128c五聚体将成为一种成功的预防疫苗的所需部分。
epi/ec对hcmv的入侵、传播、持久性以及宿主与宿主之间的传递起到了关键作用(sinzger等2008)。一种有效预防hcmv感染的疫苗策略将可能取决于诱发强有力的nab的能力抑制病毒入侵这些细胞类型(revello和gema2010;schleiss2010)。基于重组的gb或towne的以前的疫苗策略未能引起高效价nab抑制以epi/ec的hcmv感染(cui等2008)。由于ul128-ul131a蛋白与gh/gl形成的一种五聚体的病毒粒子复合体对于入侵epi/ec是所需的并且在hcmv-血清反应阳性的个体中充当强有力的nab的目标,这些蛋白已被提议作为主要的疫苗目标(gema等2008;hahn等2004;macagno等2010;wang和shenk2005b)。上述研究表明mva共表达全部五种hcmvul128c的rhcmv对应物强有力地诱发了nab阻断病毒感染mke细胞及恒河猴纤维原细胞。一种表达这些蛋白的疫苗可以是一种抑制多种hcmv的入侵途径的有效候选物。
通过结合bac技术与通过enpassant诱变的无标记序列插入(cottingham等2008;tischer等2010),五种rhcmv基因表达盒能被快速插入单个mva基因组不同的插入位点(图1)。一种普遍使用的方法,其基于在真核细胞中的同源重组的、随后使用费力的筛选程序,可能会花费更多的时间来生成这些重组体(earl等2001)。这是第一种在5个不同的插入位点带有基因表达盒的mva的描述,推进mva进入一个多抗原性疫苗设计的新种类。mva-rhul128c经5次病毒传代保留全部五种rhcmv基因稳定的表达(图3),这表明该载体构建体对于疫苗研发是一种可行的候选物。虽然每一种单体ul128c亚基可被表达自不同的载体,但同时被传输到一个细胞中以组装有功能的五聚体将在体内比体外的实验设置中更难实现。对于五聚体组装以及其作为一种hcmv疫苗的构件发挥意义深远的翻译效果的功能确定了一个较佳方法。
hcmv疫苗在动物模型中的评估可能由于cmv严格的物种特异性被限制,但是啮齿动物的cmv以及它们各自的宿主仍然充当重要的动物模型来研发hcmv疫苗的候选。由于豚鼠cmv(gpcmv)经胎盘感染胎儿,gpcmv/豚鼠模型对设计先天性感染的疫苗策略尤其有用(schleiss2010)。另外,在rm中的rhcmv疫苗评估代表了一种非人类灵长类模型以研发类似于那些以hcmv为目标的疫苗策略(barry等2006;yue等2003)。从进化的观点,rm是最接近于人的可以被实验研究的动物(barry等2006)。另外,rhcmv的基因组信息、病毒持久性模式以及主体发病机理与hcmv的这些情况极其相似,虽然rhcmv的经胎盘的传输还未被证实(barry等2006;schleiss2010)。然而,与啮齿类cmv相反,rhcmv编码了一整套hcmvul128、ul130和ul131a直系同源物(hansen等2003;lilja和shenk2008;oxford等2008;rivailler等2006;schleiss等2008;yamada等2009)。
一些研究者已经证明在鼠或兔内ul128、ul130或ul131a标记的融合蛋白或衍生肽诱发对于hcmv的epi/ec特异性nab(adler等2006;saccoccio等2011;wang和shenk2005b),表明这些ul128c亚基可能足以产生在人体内的nab活性。然而,在小动物内产生免疫对抗外来抗原可能仅只表明一种免疫属性而不是对抗宿主受限的cmv的定向免疫。该结论基于被用于在兔子中生成nab的ul130和ul131a多肽序列不与来自hcmv-血清反应阳性的的血清抗体结合(saccoccio等2011),有力地暗示了这些单个线性表位不会是在人体内致免疫的。另外,除了一种已表征的抗ul128的抗体,其余所有已表征的专门抑制hcmv入侵epi/ec的人单克隆nab,瞄准由两种或更多ul128c亚基形成的构象表位(genini等2011;macagno等2010)。此处所述的结果与前文所述的依靠多种ul128c亚基共表达来产生有功能的nab以诱发在rm中epi/ec特异性rhcmv中和活性是一致的,其比得上接着的自然感染诱发(图6)。添加rhgh/gl对于拴住剩下的rhul128c亚基来稳定构象表位的形成可能是重要的(ryckman等2008a;ryckman等2008b)。因此,在rhcmv系统中的观察与hcmv研究是类似的,并且有力地暗示了两个物种的ul128c的功能的相似性和形成五聚体以产生有效nab的要求。上面所讨论的数据支持ul128c五聚体应当是综合性预防疾病的hcmv疫苗的一部分,其可被单独使用或与一种或多种其他中和因素(如,rhgb、rhgm/gn、rhgo)一起使用,和/或一种或多种主要的细胞介导免疫目标(如,rhpp65或rhie1)。另外,一种综合性预防疾病的hcmv疫苗可结合额外的辅助因子、b细胞刺激的分子(如,cd40l)被施用。
rhul128c接种的cmv初生的rm应该引起nab来抑制rhcmv感染mke细胞,因为rhul128c五聚体是相似于ul128c的人类版本的。然而,一个额外的和意料之外的发现是可以在接种了rhul128c的rm中获得nab来抑制rhcmv感染恒河猴纤维原细胞。这些结果表明本文所述的疫苗构建体是能够持续刺激nab同时对抗ul128c和gh/gl复合体的。同样值得注意的是,在mke或纤维原细胞上测定的nab效价比得上在rhcmv-血清反应阳性的猴子中所观察到的(fouts等2012;macagno等2010;urban等1996)。值得注意的是,在接种mva-rhul128c的rm中得到的nab抑制rhcmv感染恒河猴纤维原细胞比接种mva-rhgb的动物中得到的nab具有3倍更高的效价,如先前所述(abel等2011)(图6c)。同样被证实的是,接种mva-rhgb的rm只提供最低水平nab来抑制rhcmv感染mke细胞(图6a),其有力地支持了对于诱发nab抑制rhcmv同时入侵纤维原细胞和epi/ec而言,mva-rhul128c优于mva-rhgb。这些结果扩大了最近的cmv超免疫球蛋白的分析,该分析显示nab抑制入侵epi/ec或纤维原细胞主要以ul128c或gh/gl复合体的表位为目标,并显示了在抑制hcmv入侵两种细胞类型中nab对gb只起到了次要的作用(fouts等2012)。该数据支持基于ul128c和/或gh/gl的hcmv疫苗策略比单独依靠gb产生nab阻断多种细胞类型的感染更加有效。然而,两种方法的组合比只是基于这些重要的中和决定因素中的一种甚至可以提供更高、更广的nab活性。
综上所述,mva-bac技术与通过enpassant诱变的无标记序列插入一起被试验以生成稳定共表达hcmvul128c的全部五种rhcmv对应物的mva,其被需要用于病毒入侵epi/ec。结果发现,用这些疫苗免疫的rhcmv阴性rm不仅显示了强的中和活性以预防rhcmv感染上皮细胞,而且也显示了强的nab活性来抑制感染纤维原细胞。另外,在两种细胞类型上测定的nab效价均比得上那些自然感染的猴子。而且,该免疫的rm显示了在血浆中降低的病毒载量。至少由于下列理由,该研究是有价值的:(1)已经证实所有5种ul128c亚基足够诱发nab以抑制rhcmv在epi/ec和纤维原细胞上的感染,尽管单体ul128、ul130或ul131a亚基或其组合不足够。(2)不论感染底物是epi/ec或纤维原细胞nab效价是同等强度的,表明由ul128c亚基组成的单个的疫苗可以不需gb亚基疫苗;(3)可以确定的是,目前进行临床评估的hcmv疫苗应当包含ul128c成分来防止水平传输,不然它们将有不充分预防cmv感染两种主要感染入口(portal)的风险,从而降低它们的有效性(bernstein等2009;griffiths等2011;kharfan-dabaja等2012;pass等2009)。
实施例2:表达自mva的hcmvul128c五聚体的构建和表达
人类ul128c亚基的mva表达。表达全长人类ul128、ul130、ul131、gl和gh(h-ul128c-mva)的5种亚基五聚体的mva通过与实施例1相似的bac技术生成。
如图8所示,人类ul128c(h-ul128c)的全部5种亚基被成功表达,通过或者mab(gh、ul128、ul130)或者多克隆抗血清(ul131a、gl)检测单独的亚基。单独的亚基的mw与公开的数据一致,提供了强有力的证据表明基于mva的表达对表达自hcmv的这些亚基的结构是准确可靠的。图8显示了含有交替的gh结构(如,缺失横跨膜区域的gh、ghδtm)与其他4种h-ul128c亚基共表达的组合物(一种带有交替的ghδtm的组合物通过ul128cδ表示,以及全长gh(gh-fl)通过ul128c表示)。可在体外研究评价该五聚体复合体的功能特性,利用一种抑制hcmv感染上皮细胞系的方法(ryckman等2008a)。该实验可通过使用arpe-19和mrc5细胞系、使用两种不同的mva病毒、h-ul128c-mva和gb-mva进行。该体外研究应当证实表达自mva的h-ul128c的功能活性,并应当是对于本文所述的nab研究的一种有效模型。
h-ul128c亚基的互相作用。为了显示h-ul128c五聚体的形成,通过免疫共沉淀(co-ip)分析了表达自mva的人类gh、gl和ul128-ul131a蛋白的蛋白相互作用(图9)。感染了mva-h-ul128c的bhk细胞被收集,并且为用鼠单克隆抗体抗gh14-4b或不相关的与蛋白a/g琼脂糖偶联的对照抗体对gh的ip进行处理。该免疫沉淀法形成的蛋白用检测各rhul128c亚基的多克隆抗血清通过wb来分析。图9中的结果显示在gh蛋白的ip之后全部5种ul128c亚基的免疫共沉淀。这表明h-ul128c的各亚基之间互相发生作用,当由mva共表达时形成了一个功能化的五聚体。
实施例3:构建和评价临床可接受的人体使用的mva-bac
通过先前构建的mva-bac载体促进使用rhcmv进行的临床前的研究(cottingham2008)。所有使用rhcmv化合物的的疫苗用该mva-bac组合。然而,因为mva的起源是未知的,一种不同的疫苗载体将被用于人体使用。该mvamba也将在某种程度上被构建,使载体序列在病毒重组后可以被删除来避免任何不需要的有功能的细菌序列的滞留,该性质可能是fda批准所必须的。该载体成分将被插入tk位点来重组用于转基因表达的插入位点。用于人体的mva-bac的构建通过使用由niaid的bernardmoss博士提供的1974-mva来追踪。mva的临床使用允许多种疫苗的研发,其中许多现在进入临床试验。因此,1974-mva在用于人体是应该是安全的。构建一种基于1974-mva的自剪切的mva-bac的方案如图10所示。一种限制酶图谱被研发用于预测由6bp限制性内切酶(re)在已知侧形的全序列1974-mva基因组生成的片段的尺寸(数据未列出)。该re侧形与mva全长基因组的克隆的拯救(rescue)是兼容的。为了证明在bac克隆之后的1974-mva的功能,mrfp表达盒被插入三种已知的mva插入位点,并且形成的1974-mva-bac被用于转染bhk-21细胞。图11a显示了在cef单层上的病毒噬斑显示红色(插入的表达盒)和绿色的蛋白表达(gfp表达盒包含在bac在体内),显示了在cef转染和病毒产生后来自bac克隆的有效的表达和病毒产生。另外,新的mvabac已经被用于生成mva重组表达cd40l,其将被以不同的剂量使用来提高在鼠免疫后对ul128c五聚体的抗体响应。
使用3种不同的人类cmv蛋白测试抗原评估1974-mva-bac的三个插入位点。所有的三个插入位点将插入的hcmv基因表达入蛋白(图11b),证明了1974-mva-bac功能的完整性、及其被hcmvul128c亚基改进的能力和它在疫苗研究中的应用。
用mva-bac技术来组装有功能的rhcmv-ul128c以诱发nab抑制上皮细胞感染,通过一种天然的rhcmv(ucd59)与功能化的ul/b’毒性区域的隔离。对应物人类ul128c五聚体复合体的类似的mva-bac构建体也可以被研发,并且此构建体可被在rhcmv-阴性rm中评价。尽管hcmv的宿主范围限制阻碍了rm病毒攻击研究,血清可从接种疫苗的rm被收集,并且其抑制hcmv感染病毒受纳(viruspermissive)的arpe-19细胞的容量可以被评价作为临床评价的替代。一个全长的防护的疫苗可能需要同时抑制内吞噬的和纤维原细胞途径的病毒感染,这可以通过研发另外的单独表达gb或也表达ul128c的mva构建体来解决。感染rm和评价血清nab体外抑制感染纤维原细胞和arpe-19细胞可被研究。最终,通过临床试验的研究可能最好地确立hcmv构建体预防或限制感染或病毒血症的能力。为免疫候选人个体,可以包括但不仅限于:生育年龄的妇女、摆脱hcmv或初生的会通过阻断携带感染回家的可能性而受益于免疫的青少年、以及潜在感染有生育可能的未受感染的母亲。所有上述的个体是用本发明所述的实施方案的载体接受免疫的候选人。
在1974-mva-bac中组装hu-ul128c,体外表达和功能分析
上述数据利用同源的rhcmv阴性rm模型证明rhcmvul128c在mva中的表达是有效的,其中证明了rhcmv特异性nab是在接受ul128c-mva免疫后形成的(实施例1)。这提供了有力的证据证明用hcmv基因和在mva中的表达的ul128c的有指导的研发,如图8所示(实施例2)。另外,gh的免疫沉淀反应与随后的用单克隆抗体检测gh、ul128和ul130的wb分析,证明了表达自mva的ul128c亚基的组装(图9)(实施例2)。为了获得生产人类使用的疫苗附带的翻译相关性,该载体应当与已经通过fda关于其在临床评价研究中的安全性批准的mva相关。因此,1974-mva被插入到自剪切的bac载体中(图10),并且它的功能性在体外被证明(图11)。随后,hcmvul128c的全部五种亚基可被插入到1974-mva-bac中,并且测定亚基的表达、功能和稳定性。成功响应疫苗和安全分析应当为fda批准进行临床研究提供了强有力的支持,该临床研究用与rm的研究相同的hcmv-mva疫苗。
hcmv1974-mva-bac的构建与组装。如图10构建的1974-mva-bac可被用于插入如图1a中所示的为mva-bac所描述的五种ul128c抗原。其他的缺失位点或基因键的区域也可被用于组装ul128c五聚体或另外的转基因如gb、pp65或ie。mva-bac通常需要辅助病毒来启动复制,其最易通过使用在mva复制允许的cef中的cgmp级无复制的鸡痘病毒(fpv,从bernardmoss博士处获得,lvd,niaid)解决。该组装载体随后在与附图2到5相似的方式被评价,每个亚基被成功插入,然后从mva表达。可以对所有共表达的亚基做表达谱(expressionprofiling)wb。亚基ul128、ul130、ul131a、gl和gh按照顺序被插入1974-mva-bac。gh的最终插入可使用两种糖蛋白形式完成,或者δtm或者fl形式。五聚体构建体表达分析的最终阶段可以是全部5种亚基的同时表达。目标是每个亚基的表达达到大致相等的水平,因为起作用的假设表明在最终的五聚体复合体中亚基比重相等。所有的亚基表达水平对照br5抗原被归一化,其在表达水平中应当没有区别,无论mva疫苗的抗原组合物是什么(图2)。两种五聚体构建体(ul128c-1974-mva和ul128cδ-1974-mva)可被单独测试体外和体内功能,以确定哪种产生更好的hcmv隔离种群(isolate)的中和。
ul128c-1974-mva-bac可以在cef中制造,这是一种为fda所接受的细胞基质。该操作可能需要获得具有可追踪的起源且未暴露于疯牛病(bse)介质的fpv隔离种群。由于cef细胞对fpv是受纳的,可如之前描述的通过结合的补骨脂素和紫外光使病毒失活(lubaki等1994)。或者,可以使用bhk-21细胞,该细胞不受纳fpv感染,尽管需要一个fda注册的主细胞库。
通过ul128c表达有功能的抑制hcmv感染受纳的arpe-19细胞。已经证明了h-ul128c-mva预防hcmvtb40/e促内皮趋向病毒(或其他具有完整的epi/ec趋性的病毒菌株,如tr、vhl-1等)感染受纳的epi/ec如arpe-19细胞或huvec。该功能性实验对于建立诱发nab的成功标准是重要的,因为它可以检测干扰hcmv感染arpe-19细胞的五聚体复合体的合适的组装。该研究可在适当的对照下进行,如gb和表达自mva的个体的h-ul128c亚基,紧接着纤维细胞(mrc-5)感染来建立抑制hcmvtb40/e感染的特异性。这建立了一些条件,其中在研究抑制hcmv感染之前单层的arpe-19或mrc-5细胞一致的地表达来自h-ul128c-mva(1974)或对照mva(变化moi1-5)的gfp。或者,如果h-ul128c亚基的共表达抑制了mcherry版的tb40/e感染arpe-19细胞其moi范围介于1-100pfu/细胞,具有统一的gfp表达的arpe-19细胞单层可被使用。这些试验可以在96孔板进行来保存病毒,在每种条件下,斑块可以在6个完全相同的孔板中通过红外线和/或hcmv-iemab计数。下列条件可被使用:h-ul128c-mva、gh/gl-mva、ul128/130/131-mva、gb-mva或gfp-mva。tb40/e感染的显著抑制应当只能用ul128c-mva观察,并且在arpe-19细胞中使用其他任何的mva时只观察到极低的或没有感染。与此相反,通过hu-iemab染色评估,在gh/gl-mva有适度的(约40%)抑制时mrc-5细胞可能受纳tb40/e感染。
如果预防tb40/e感染是成功的,利用其它异源的天然hcmv隔离种群(tr或toledo)的感染的抑制也可被试验,以评价预防来自异型菌株的感染的能力。
通过wb和qpcr评估ul128c-mva的稳定性分析。基于ul128c-mva传代的稳定性可以通过先前描述的方法测定(wang等2010)。稳定性分析很重要,因为需要传代扩增足够的病毒以供rm或将来的人体使用。ul128c-mva被进行连续10次的传代,每次传代伴随病毒群体效价测定、表达分析和基因分析。稳定性是基于五种hcmv插入的每种的表达水平以及基于每次传代的mva-br5抗原相比于指定为p0的初始病毒的评估。每种插入的抗原的表达水平可以在每次传代进行比较,并为了稳定性范围的评估与br5抗原作比较。因为稳定性中可以发生小的变化反映了mva的常见现象(wyatt等2009),从在p0的初始病毒的小于等于20%的信号下降被定义为是可接受的。任何在传代后积累的基因变异也可以被测定。利用与上述的病毒传代相同的程序,在每次传代中进行每种抗原和作为组装ul128c-mva的一部分的内因性tk抗原的基于qpcr的分析。qpcr信号在p10相比于p0下降了小于等于20%可以被接受。插入定量的qpcr方法的详情可以在先前的研究中找到。5种插入和mva-tk基因的每种引物可以源自于自序列信息,并且通过最初的包含全部五种插入和mva-tk基因的mva-bacdna被确认。这个阳性对照也可以用来绘制一条标准曲线来估计每次ul128c-mva传代的拷贝数。
另外,整个ul128c-mva可以被测序来证明其在传代后其未变的情况,通过mva-bac媒介步骤建立其作为候选人体疫苗的适当性。
hcmvul128c五聚体在balb/c小鼠中的免疫学功能。
动物和免疫方案。总量200只雌性balb/c小鼠(年龄大于2个月)可被用来确认在此实施例及下列实施例中所述的候选抗原的表达和体液免疫原性。该方法可评估来自免疫的小鼠的血清中抑制体外hcmv感染易受感染的人体细胞系的nab。小鼠可被接种疫苗rmva,预期的抽血可被用来评价nab产物。
有至少两个原因使得在rm疫苗研究之前执行该鼠疫苗研究是重要的。第一个原因是,在恒河猴研究之前具有候选抗原的mva载体需要被证实为编码区域的真实表达。这些研究不能在组织培养中进行,因为nab形成的测试需要一套完整的免疫系统。据估计,10rmva载体(表达hcmv基因)可被构建并被用于感染小鼠(n=10小鼠/rmva构建体)。每组的小鼠数量基于以往的经验来获得最低限度一致的结果,其符合统计学评价。每只小鼠通过腹膜内、皮下或肌肉内途径用rmva隔开最少3周间隔被免疫,并在无痛处死之前在180天期限内定期抽血。每只小鼠的抽血可隔开至少2周。血液可从尾静脉被收集,且可以一次收集的最大量为0.25ml/小鼠(小于体重的1%)。目的是为了测试哪种rmva引发nab对抗hcmv感染,如下文所述。
balb/c小鼠通过腹膜内的或肌肉内的途径免疫两次,用具有全长的gh或横跨膜缺失的gh的hcmvul128c-mva或ul128cδ-mva免疫来检测诱发nab的要求。一种免疫方案被使用,其中4只小鼠/每组被施用了1-5千万pfu的ul128c-mva、ul128cδ-mva、ul128-ul130-ul131a-mva、gl/gh-mva、gb-mva或对照venus-mva(wang等2004a)。小鼠隔开3周接受2次免疫,在每次免疫后的一周和第一次免疫后的20周,获得血清用于用arpe-19上皮细胞系或hff-1纤维原细胞评价nab容量。大约100pfu的hcmv菌株vhl-1、tb40/e或tr是用连续半对数稀释的来自被免疫的小鼠的血清培育的,起始稀释为1∶100。该混合物被培育1小时在37℃,并被一式三份地加入到arpe-19上皮细胞或hff-1纤维原细胞的80-90%融合单层,这些单层在一天前已经接种在96孔平板上。22小时的培育后,这些细胞为ie1表达染色并且阳性细胞在显微镜下被计数。分析来自3只未免疫的小鼠血清作为基线水平,以测定每种稀释液的中和效价(nt):nt=(1-(免疫血浆的ie1阳性细胞数)/(阴性对照血浆的ie1阳性细胞数))×100。通过测定nt对血浆稀释绘图的直线斜率来测算提供50%中和的效价(nt50效价)(wussow等2013)。
鉴于为接种mva-rhul128c的rm所做的观察,来自接受任何一种五聚体疫苗免疫的小鼠血清可能包含nab,该nab抑制hcmv菌株(如tb40/e、tr或toledo)感染arpe-19和mrc-5纤维原细胞,然而在ul/b’区域中有缺陷的(ad169和towne)将对arpe-19细胞没有传染性。相比之下,对于这两种细胞类型上,使用相同的血清制剂,感染gb-mva的小鼠均应当有更低的中和活性。没有接种小于5种ul128c亚基的动物应该产生nab。另外,表达gh-δtm或者gh-fl的ul128c-mva可被比较以确定哪种刺激了更大量的nab。二次免疫的小鼠可以被第三次免疫,3-6个月后用来研究增效现有的nab,如在之前的研究中使用gb-mva完成的那样(wang等2004a)。最终,使用商业试剂盒来研究由免疫引起的抗体特异性的进化,来表征absigg子集。当有成功的nab刺激时igg2a应当是主要的(wang等2004a)。
可以增加免疫之间的时间和第二次免疫之后的期间来得到血清,如果中和太低。另外,在提议的3-6个月之前的第三次的免疫可以被添加,并且血清可以在中和评价之后获得。
使用ul128c-mva(1974)的rm免疫和nab表征
动物和免疫方案。动物可以源自加利福尼亚国家灵长类动物研究中心(cnprc)室外畜栏内未感染rhcmv的育种群体。在下述研究中使用的动物对于本项目的每个单独的组成部分均放在一起。这是一个微创过程的非终极研究,并且在研究完成后动物可以归还cnprc群体。会使用大约相同数量的雄性和雌性,尽管动物的性别不是其包含或排除在这些研究中的一个决定性因素。
在此实施例中,30个未感染rhcmv的恒河猴可用重组mva载体免疫(n=6每个载体),其中每一个各自表达三种不同的ul128c亚基mva疫苗(ul128c、gl/gh、ul128/130/131a)的一种,或一个对照mva。也可以使用表达其他ul128c亚基的组合的mva。另外,第五组(n=6)的免疫可接受至多200μg福尔马林灭活的hcmvtb40/evisions(fi-hcmv)与montanideisa720佐剂,一种水包油辅剂,通过肌肉(im)注射传输。
本研究的目的是研究每种载体引发有功能的nab的潜能。动物可以被肌内(im)免疫三次,在第0、6和26周,用5×108pfu/剂的在pbs中的重组mva。预期的静脉血样品和口腔试样可以从麻醉的(克他命)动物中获得,使用cnprc标准流程。在28周期间(相对于第0周的初次免疫)每1-4周收集血样。抽血不会超过cnprc指南(12/月/kg体重)。血液可以通过标准流程被处理成血浆和pbmc,并被等分用来检测全血计数(cbc)和血液化学(chem20)。简而言之,口腔试样用2根放置在口腔颊囊中的涤纶棉签收集。每根棉签用0.2ml唾液使之饱和,并且每根棉签被放置到装有1.8mlpbs的试管中,这代表唾液的1次1∶10稀释。这个容量为多次试验留下了足够的材料。唾液以初始收集的1∶10稀释液的连续半对数稀释被分析。唾液可以被处理,用于类似于coh血清样本的nab效价评价。疫苗接种的动物可以共同放在谷仓内。
关于ul128c的体外表达和小动物免疫研究确认本文所述的ul128c五聚体引发nab的功能和能力通过。然而,评价引发关于人类疾病的nab的能力的最佳实验模型是灵长类动物研究。因此,在研究中使用rhcmv阴性rm可以排除预先存在的nab对于rhcmv而导致的对hcmv交叉反应的可能性。其目的是进行如先前进行的传统的肌肉内(i.m.)疫苗接种(abel等2010)并用体外hcmv中和测定nab水平(参见-图6和12)。在可用于人体的rm中的血清和粘膜(唾液)nab的持久性、最佳疫苗接种数量、剂量水平、gh抗原结构在nab频率上的影响、亲和性和安全性均被研究。不仅是在这些研究中评估疫苗的功能性质,而且其关于未来fda申请的安全性也可通过与gmp方法制造的相同的病毒来研究。另外的研究也可以追求最佳疫苗方案,该方案利用在同时包括ul128c和gb/pp65rhcmv亚基的rhcmv阴性的rm中同源的rhcmv疫苗在体内抑制病毒攻击。总之,来自rhcmv和人体研究的结果将使影响先天hcmv感染的hcmv疫苗能够转译。
rhcmv阴性的rm的mva免疫的方案。研究四种不同的ul128c亚基mva疫苗(ul128c或ul128cδ、gl/gh、ul128/130/131a)或gb-mva或一个对照mva-venus疫苗在接种疫苗的rm中引发有功能的血清和粘膜的nab的性质。其他的表达自mva的ul128c亚基组合也可以作为疫苗载体被包括。使用在1-2岁大的rhcmv阴性的rm的疫苗可以被使用。为了获得统计显著性,每组疫苗组包括6个动物,每个动物施用5.0×108pfu/剂两次,间隔6周(wussow等2013)。在每个动物第二次疫苗接种后第2周、第6周、第3个月和第6个月获得抽血和唾液取样(参见vertebrateanimalsforcollectiontechnique)。在第6个月,可以实施第三次疫苗接种,并且在之后的2周获得血清和唾液以与第二次疫苗接种后的血清和唾液nab作对比。
作为一种选择,5.0×108pfu/剂可以被施用2次,间隔6周,也可以改变为提供更少的mva疫苗(2.0×108pfu)或更高的量(1.0×109pfu)。基于先前的结果,这些建议量在rm中最优。
来自免疫的rm的血清和唾液的评估。体外中和是检测nab活性的主要测试。中和测定和在小鼠研究中的目的是一样的,被研究的病毒和被感染的细胞系可以是相同的。猴子血清的稀释技术改变可以基于比小鼠研究中更低的期望效价而设置(1∶31,1∶100,1∶300)。这些稀释与在rm中使用同源rhcmv疫苗观察到的效价是一致的(图6)。作为阳性对照,获得来自五种匿名的hcmv阳性人类献血者的血清。另外,按照用hcmvtb40/e甲醛灭活的病毒粒子(abel等2010)赋予rhcmv阴性rm(n=6)免疫性的步骤实施,并且可以获得血清和唾液作为另外的阳性对照,如近期所述(wang等2011)。唾液可在超过相比于血清稀释起始的1∶10稀释的连续半对数稀释下分析。关于hcmvul128c-mva引发对hcmv的中和响应的效率以及与那些发现于自然感染的人体内的nab效价的对比,有相关对照的nab测定应当是信息最全的。
实施例3:用gb作为一种疫苗或一种2mva疫苗(ul128c+gb)组装ul128c-mva来研发nab在rm中同时抑制纤维原细胞和内吞噬的hcmv感染途径。
动物和免疫方案。上述研究提供了证据证明单独的rhul128c可以引发同时抑制epi/ec和纤维原细胞的感染的nab(图6)。可以进行另外的研究来结合ul128c和gb/pp65以增强或提高对两种hcmv侵入途径的抑制。这些研究可以分3个阶段进行。在第一阶段,未感染rhcmv的恒河猴(n=18总量)可以被重组mva载体免疫(n=6每个载体),其中每个重组mva载体单独表达三种不同的mva疫苗中的一种:#1:5-agul128c(从实施例2中确定)+gb/pp65;#2:单独的5-agul128c;#3:单独的gb/pp65。对第#1组,动物可以被接种同时包含ull28c的5-agmva载体和gb/p65mva构建体的疫苗混合物。另外,一个对照组(n=6)可以用对照mva被模拟免疫。动物可以在第0、6和26周被肌内(im)免疫三次,用在pbs中的5×108pfu/剂的重组mva。在第二阶段,动物(n=6)可以在第0、6和26周被肌内免疫,用在一个mva构建体中表达全部5种ul128c成分和gb/pp65的7-agmva复合体免疫,或者动物可以分别用单独的5-agmva免疫然后用gb/pp65mva免疫。对于后一组,动物可以在第0、12和26周被肌内免疫,用5-agmva以及用gb/pp65在第6、18和32周免疫。用标准方法从麻醉的(克他命)动物中获得静脉血样和唾液。可以在34周时间内每1-4周收集样品(相对于第0周预注免疫)。抽血不会超过12/月/kg体重。血液可以通过标准方法被处理成血浆和pbmc,并被等分用来检测全血计数(cbc)和血液化学(chem20)。可以通过用一根涤纶棉签在牙龈和口腔颊囊转动获得唾液,并且如上文所述的那样处理。这是一个用微创过程进行的非终极研究。
对于第三阶段,未感染rhcmv的rm可以通过皮下(s.c.)途径被接种,使用在多个位点(n=6)(从上述第1和2阶段确定)的优选疫苗配方或者对照mva(n=3)。直径1cm的皮肤活检,可以从全部9种动物在第0周初次接种后的第3、12、26和52周的一个注射位点被去除。这是一个用微创过程进行的非终极研究。rhcmv被施用于已接种疫苗的被研究的rm的病毒攻击的途径,可以通过如鼻内的粘膜部分,或可以通过直肠内的或s.c.的途径。病毒攻击也可以通过与受感染的笼内同伴的病毒传播被实施。
基本原理。第一个在人体试验中显示50%的效率的hcmv疫苗是在mf59辅剂中配制的gb蛋白(gb/mf59)(pass等2009)。因此,一个追求大于50%效率的方案可能需要同时抑制epi/ec和纤维原细胞hcmv入侵途径。先前的rhcmv研究证明了gb是引发nab的必要的成分并且有助于50%动物中的泄出的下降,这些动物也被接种了表达自mva的pp65和ie1(abel等2011)。然而,不能保证同时结合纤维原细胞和epi/ec途径的疫苗将引起各自的和有效的抑制两种途径的免疫;或者可能会发生交叉抑制。没有评价在同一配方中包括对ul128c和gb特异性的ags的这些组合的疫苗引发nab的先例。因此,最佳的施用mva疫苗的方法可以通过进行在小鼠中的初步试验之后通过在rm中的验证试验被确定。为此,两种mva病毒可以被结合,一种表达ul128c亚基,另一种表达gb和pp65,以研究是否两种抗原复合体可以被同时施用以刺激与每种抗原复合体单独施用同等水平的nab。或者,可以确定是否由于在两种抗原复合体之间的干扰,ul128c-mva和gb/pp65-mva应被隔开6周作为分别的注射。然而,假设通过在一个单独配方中包含全部七种抗原,没有在同时特异于内吞噬和纤维原细胞途径的nab产生中发现干扰,表达ul128c和gb的mva可以作为一种便利的、单独的疫苗方式被生产,以同时把hcmv入侵的内吞噬和纤维原细胞途径作为目标。因为pp65不能刺激nab,所以hcmv-pp65在保护中的作用需要攻击模型。另外,可以研究插入第七个基因(pp65)到ul128c-mva中同时保留好的稳定性以反映该抗原补体的重要成分(pp65/gb),其在先前研究中提供了预防泄出的最高级别的保护(abel等2010)。评价如在上面实施例所述的这些研究中的配方和方案。最平移的方法把所有抗原合并成一个单独的mva疫苗,其可被使用两次并被发现对上述纤维原细胞(abel等2010)和内吞噬途径研究均有效(参见图6)。
ul128c+gb/pp65mva的构建和体外表达。可以如上述实施例构建表达hcmvul128c的mva。尽管存在表达人pp65和gb的mva构建体,为了一致性两种基因都可被插入1974-mva-bac。本文所述的方法和在上面实施例所述的方法一样,并且g1l/18r位点被用于gb-δtm插入并且igr3被用于pp65插入,两种基因用如图1b所示的mh5启动子控制。与gh不同,表达gb-fl有一些困难,并且用gb-δtm进行的试验表明构建体应当被限制在gb的单体形式:gb-δtm(wang等2004a)。然而,先前的表达不同gb形式的mva重组体是利用转移质粒转染/mva感染过程在真核细胞中生成的,其未能生成表达全长gb的稳定的重组体。由于bac技术的便利,两种形式的gb(全长和缺失tm的gb)可以被组装到一个病毒载体中,这将允许研究它们提高抗体生成的性质。另外,将pp65和/或gb插入ul128c-1974-mva-bac的另外的位点可以选自最近确定的有效的和稳定的转基因表达的位点(timm等2006)。或者,两种抗原可以被插入两种已知的插入位点中的每一个(g1l/i8r、del3),这两种位点已经被证明允许非常大的和/或有毒的序列的稳定传播。新的构建体在mva-bac中产生的便利,促进了替代插入位点的快速筛选或对双插入一个位点保留与ul128c-mva相当的基因稳定性的评价。添加新基因到bac而没有在载体构建期间操作多agmva的简便,将使得该过程比插入添加物需要真核转染感染步骤的替代过程更简便(wang等2008;earl等2007)。pp65/gb-mva的构建不大可能有问题,可以进行如对ul128c-mva所做的那样的10次传代的稳定性研究,来确保该项目的制造阶段恰当的表达和基因稳定性。为了有充足的病毒用于猴子研究,扩增pp65/gbmva菌株,可能需要小于等于5次传代。类似的,通过上面的实施例所述的方法,可以研究具有被添加的pp65和/或gb插入物的ul128c-mva病毒的表达稳定性和基因稳定性。用于猴子研究的充足的病毒的产生需要小于等于5次稳定传代,但是传代可以被扩大到约10轮以深入了解构建体的长期稳定性。尽管这些新的构建体不大会有问题,但还是需要如本文所述的评估那样,小心评估两种在一个mva中插入两种糖蛋白基因的共表达和基因稳定性,以确保通过同等水平的nab的诱发,两种途径被同等抑制。
通过mva表达的ul128c的抑制hcmv感染。一个重要目的是用6或7种ag疫苗配方同时抑制epi/ec和纤维hcmv感染途径。在用研发用于epi/ec和纤维途径的mva构建体体外感染后,epiarpe-19细胞的hcmv感染的抑制可以被效仿。任何干扰hcmv感染的h-ul128c可以被感染epi/ec和纤维谱系(tb40/e和tr)的hcmv菌株识别,并通过评价h-ul128c-mva的有效性来预防感染。表4显示体外抑制试验可能的结果。该体外试验应该证明h-ul128c通过其干扰arpe-19细胞的hcmv感染的成功组装,合适的对照如mrc-5纤维应在被表达的h-ul128c存在的条件下被感染,如其它已经显示的那样75。如果gb/pp65和h-ul128c在arpe-19细胞中的共表达阻止了h-ul128c干扰(tr和tb/40e)菌株的hcmv感染,那么h-ul128c和gb/pp65疫苗可以被替换来抑制epi/ec感染途径。有3种mva疫苗可以被评价:1)单体mvah-ul128c-gb-pp65-mva[7ag],2)作为一个混合物被引入的两种不同的mva(h-ul128c-mva[5ag]+gb/pp65-mva[2ag]),3)gh/gl/go-mva,一种可以被构建(数据未列出)的hcmvgh/gl的简单改进。体外的结果对于小鼠和rm研究均是重要的。
在balb/c小鼠中结合的ul128c+gb/pp65疫苗的免疫。为了确定对hcmv感染的内吞噬和纤维入口引发nab的能力,五种不同的ul128c和gb/pp65疫苗组合物可以依照下面的表5被研究。免疫方法的细节将和上述方法一致。同时抑制纤维和内吞噬hcmv感染入口的、通过用1或2种mva基于全部7种亚基(表5)使小鼠免疫的nab应当被引发。在体外病毒攻击后,arpe-19和纤维应只有在h-ul128c-mva和gb/pp65-mva(a或e组)或表达7ag(d组)的单体疫苗成功生成了nab以抑制它们各自感染入口的情况下,同时耐epi/ec趋向的和纤维趋向的hcmv感染。由ags在1或2种mva中注射所引起的干扰将允许在arpe-19细胞中的感染(表4)。如果那样,如表5所示,h-ul128c-mva可以被独立于gb/pp65-mva地注射,随后评价抑制hcmv感染的nab。如果每种疫苗病毒的分别注射仍然引起干扰,rm研究仍然可以被进行以提高预测能力。
表5.
balb/c小鼠研究利用上述的一种疫苗方案被提出。该mva浓度、接受免疫之间的时间以及血清抽取基于观察到的中和的水平而改变。
利用疫苗配方和剂量水平的rm研究可以基于上述研究进行。可以改变剂量水平、接受免疫之间的时间和到抽血前的时间以提高体外中和结果。如果有干扰的迹象,那么可以应用在rm中的mva混合物的研究以证实小鼠研究。
以在rhcmv阴性的rm中的ul128c和gb/pp65为目标的组合疫苗配方。rm研究可以在获得小鼠研究的结果并得到结论后开始。尽管小鼠的预测能力可能受限制,但将产生一些选择范围的缩小以限制rm研究的广度。这可以通过利用每组6只动物的策略评价来达到。遗传上远系繁殖的、未感染rhcmv的动物(n=24,约1-2岁)在评价的第一阶段将被随机的分配到4组中的1组(表5,a-c、f组)。动物将被反复测试来确认为rhcmv阴性。cnprc的每个动物通过微卫星图谱被分子测试其血统和mhci类单体型(mamua*01,b*01,及b*17)。将基于平衡遗传多样性把动物分配至每个疫苗组。任何兄弟姐妹或异父同胞将被在组间分配。混合方式的成功(表5,a组)将促进作为第二阶段的评价的研究的、对表达包括ul128c和gb/pp65的全部7种抗原的研究(表5,d组)。然而,如果组合的抗原降低了疫苗开发血清或粘膜的nab抑制内吞噬和纤维原细胞入口的感染的能力,该结果即表示干扰。一个可替代的第二疫苗接种阶段可以是ul128c-mva和gb/pp65-mva在6周模式中交替地提供,如此每种疫苗被提供两次以确保潜在干扰更低的可能性,如果相同疫苗的两种剂量是被重复提供而不是交替地提供(表5,e组)。通过进行体外中和的疫苗接种的结果分析将类似地用于实施例8和上文所述的猴子和rm研究中。这些研究的目的是发现一种产生同时为内吞噬和纤维原细胞hcmv感染入口的nab的hcmv疫苗,可以作为用于人类研究的fda注册的基础。
在该实施例中,所有的疫苗包含pp65,与防止泄出相关的t细胞靶标(abel等2010)。因此,pbmc可以从每次抽血被存储,并通过在使用重叠的pp65和对照肽库的体外刺激之后的细胞因子流式细胞计数被评价。
此外,血清和粘膜(唾液)nab的效价可以通过实施例8所述的体外试验被检测。可以选择一种疫苗方案和配方,用于基于血清nab效价的第二阶段的评价,因为那些测量被更广泛地施用。然而,粘膜的nab将被测定,并且同时引发血清和粘膜nab的疫苗将优先于仅仅诱发血清nab的候选物。
在rhcmv-mva疫苗接种后,在rhcmv阴性动物中的rhcmv病毒攻击将通过不同路径被执行。如果疫苗包含rhcmv亚基并且被注射到rhcmv阴性恒河猴中,那么可以通过rhcmv的剧毒的上皮向性菌株进行正式的病毒攻击研究。攻击的路径既可以是粘膜的(鼻内的)、如wussow等2013皮下的,也可以是rhcmv阳性恒河猴与已经免疫的rhcmv阴性动物共居住的。
参考文献
以下参考文献、专利和已公开的专利申请,以及列于以上说明书的所有文献,通过援引如同在本文中完全详述一般并入。
abel,k.,j.martinez,y.yue,s.f.lacey,z.wang,l.strelow,a.dasgupta,z.li,k.a.schmidt,k.l.oxford,b.assaf,j.a.longmate,d.j.diamond,andp.a.barry.2011.vaccine-inducedcontrolofviralsheddingfollowingrhesuscytomegaloviruschallengeinrhesusmacaques.j.virol.85:2878-2890.
abel,k.,l.strelow,y.yue,m.k.eberhardt,k.a.schmidt,andp.a.barry.2008.aheterologousdnaprime/proteinboostimmunizationstrategyforrhesuscytomegalovirus.vaccine26:6013-6025.
adlersp,nigrog,pereiral.recentadvancesinthepreventionandtreatmentofcongenitalcytomegalovirusinfections.seminperinatol.2007;31:10-18.
adlersp,nigrog.interruptingintrauterinetransmissionofcytomegalovirus.revmedvirol.2006;16:69-71.
adler,b.,l.scrivano,z.ruzcics,b.rupp,c.sinzger,andu.koszinowski.2006.roleofhumancytomegalovirusul131aincelltype-specificvirusentryandrelease.j.gen.virol.87:2451-2460.
adler,s.p.,s.e.starr,s.a.plotkin,s.h.hempfling,j.buis,m.l.manning,anda.m.best.1995.immunityinducedbyprimaryhumancytomegalovirusinfectionprotectsagainstsecondaryinfectionamongwomenofchildbearingage.j.infect.dis.171:26-32.
adler,s.p.,s.h.hempfling,s.e.starr,s.a.plotkin,ands.riddell.1998.safetyandimmunogenicityofthetownestraincytomegalovirusvaccine.pediatr.infect.dis.j.17:200-206.
arvin,a.m.,p.fast,m.myers,s.plotkin,andr.rabinovich.2004.vaccinedevelopmenttopreventcytomegalovirusdisease:reportfromthenationalvaccineadvisorycommittee.clin.infect.dis.39:233-239.
assaf,b.t.,k.g.mansfield,s.v.westmoreland,a.kaur,k.l.oxford,d.j.diamond,andp.a.barry.2012.patternsofacuterhesuscytomegalovirus(rhcmv)infectionpredictlong-termrhcmvinfection.j.virol.86:6354-6357.
barrypa,changw-lw.primatebetaherpesviruses.in:arvina,campadiellig,moorep,mocarskies,roizmanb,whitleyrjetal.,eds.humanherpesviruses:biology,therapy,andimmunoprophylaxis.cambridge:cambridgeuniversitypress;2007:1051-1075.
barrypa,strelowli.2012developmentofbreedingpopulationsofrhesusmacaquesthatarespecificpathogenfreeforrhesuscytomegalovirus.comparativemedicine.58:43-46..
barry,p.a.,k.m.lockridge,s.salamat,s.p.tinling,y.yue,s.s.zhou,s.m.gospe,jr.,w.j.britt,anda.f.tarantal.2006.nonhumanprimatemodelsofintrauterinecytomegalovirusinfection.ilar.j.47:49-64.bernstein,d.i.,e.a.reap,k.katen,a.watson,k.smith,p.norberg,r.a.olmsted,a.hoeper,j.morris,s.negri,m.f.maughan,andj.d.chulay.2009.randomized,double-blind,phase1trialofanalphavirusrepliconvaccineforcytomegalovirusincmvseronegativeadultvolunteers.vaccine28:484-493.
boppanasb,brittwj.antiviralantibodyresponsesandintrauterinetransmissionafterprimarymaternalcytomegalovirusinfection.jinfectdis.1995;171:1115-1121.
boppanasb,riveralb,fowlerkb,machm,brittwj.intrauterinetransmissionofcytomegalovirustoinfantsofwomenwithpreconceptionalimmunity.nengljmed.2001;344:1366-1371.
brittw.manifestationsofhumancytomegalovirusinfection:proposedmechanismsofacuteandchronicdisease.currtopmicrobiolimmunol.2008;325:417-470.
brittwj,vuglerl,stephenseb.inductionofcomplement-dependentand-independentneutralizingantibodiesbyrecombinant-derivedhumancytomegalovirusgp55-116(gb).jvirol.1988;62:3309-3318.
britt,w.j.,l.vugler,e.j.butfiloski,ande.b.stephens.1990.cellsurfaceexpressionofhumancytomegalovirus(hcmv)gp55-116(gb):useofhcmv-recombinantvacciniavirus-infectedcellsinanalysisofthehumanneutralizingantibodyresponse.j.virol.64:1079-1085.
brittwj.neutralizingantibodiesdetectadisulfide-linkedglycoproteincomplexwithintheenvelopeofhumancytomegalovirus.virology.1984;135:369-378.
chata,tome,kemblegwetal.humancytomegalovirusclinicalisolatescarryatleast19genesnotfoundinlaboratorystrains.jvirol.1996;70:78-83.
cottinghammg,gilbertsc.rapidgenerationofmarkerlessrecombinantmvavaccinesbyenpassantrecombineeringofaself-excisingbacterialartificialchromosome.jvirolmethods.2010;168:233-236.
cottingham,m.g.,r.f.andersen,a.j.spencer,s.saurya,j.furze,a.v.hill,ands.c.gilbert.2008.recombination-mediatedgeneticengineeringofabacterialartificialchromosomecloneofmodifiedvacciniavirusankara(mva).plos.one.3:e1638.
cui,x.,b.p.meza,s.p.adler,andm.a.mcvoy.2008.cytomegalovirusvaccinesfailtoinduceepithelialentryneutralizingantibodiescomparabletonaturalinfection.vaccine26:5760-5766.
domi,a.andb.moss.2002.cloningthevacciniavirusgenomeasabacterialartificialchromosomeinescherichiacoliandrecoveryofinfectiousvirusinmammaliancells.proc.natl.acad.sci.u.s.a99:12415-12420.
dunnw,chouc,lihetal.functionalprofilingofahumancytomegalovirusgenome.procnatlacadsciusa.2003;100:14223-14228.
earlpl,americojl,wyattlsetal.recombinantmodifiedvacciniavirusankaraprovidesdurableprotectionagainstdiseasecausedbyanimmunodeficiencyvirusaswellaslong-termimmunitytoanorthopoxvirusinanon-humanprimate.virology.2007;366:84-97.
earl,p.l.,b.moss,l.s.wyatt,andm.w.carroll.2001.generationofrecombinantvacciniaviruses.curr.protoc.mol.biol.chapter16:unit16.
endresz,v.,k.burian,k.berencsi,z.gyulai,l.kari,h.horton,d.virok,c.meric,s.a.plotkin,ande.gonczol.2001.optimizationofdnaimmunizationagainsthumancytomegalovirus.vaccine19:3972-3980.
fouts,a.e.,p.chan,j.p.stephan,r.vandlen,andb.feierbach.2012.antibodiesagainstthegh/gl/ul128/ul130/ul131complexcomprisethemajorityoftheanti-cmvneutralizingantibodyresponseincmv-hig.j.virol.86:7444-7447.
genini,e.,e.percivalle,a.sarasini,m.g.revello,f.baldanti,andg.gerna.2011.serumantibodyresponsetothegh/gl/pul128-131five-proteincomplexofhumancytomegalovirus(hcmv)inprimaryandreactivatedhcmvinfections.j.clin.virol.52:113-118.
gerna,g.,a.sarasini,m.patrone,e.percivalle,l.fiorina,g.campanini,a.gallina,f.baldanti,andm.g.revello.2008.humancytomegalovirusserumneutralizingantibodiesblockvirusinfectionofendothelial/epithelialcells,butnotfibroblasts,earlyduringprimaryinfection.j.gen.virol.89:853-865.
gonczole,ianaconej,howzetal.isolatedga/gbglycoproteincomplexofhumancytomegalovirusenvelopeinduceshumoralandcellularimmune-responsesinhumanvolunteers.vaccine.1990;8:130-136.
gonczole,plotkins.developmentofacytomegalovirusvaccine:lessonsfromrecentclinicaltrials.expertopinbiolther.2001;1:401-412.
graziarm,baldantif,percivalleeetal.invitroselectionofhumancytomegalovirusvariantsunabletotransfervirusandvirusproductsfrominfectedcellstopolymorphonuclearleukocytesandtogrowinendothelialcells.jgenvirol.2001;82:1429-1438.
griffiths,p.d.,a.stanton,e.mccarrell,c.smith,m.osman,m.harber,a.davenport,g.jones,d.c.wheeler,j.o′beirne,d.thorburn,d.patch,c.e.atkinson,s.pichon,p.sweny,m.lanzman,e.woodford,e.rothwell,n.old,r.kinyanjui,t.haque,s.atabani,s.luck,s.prideaux,r.s.milne,v.c.emery,anda.k.burroughs.2011.cytomegalovirusglycoprotein-bvaccinewithmf59adjuvantintransplantrecipients:aphase2randomisedplacebo-controlledtrial.lancet377:1256-1263.
hahn,g.,m.g.revello,m.patrone,e.percivalle,g.campanini,a.sarasini,m.wagner,a.gallina,g.milanesi,u.koszinowski,f.baldanti,andg.gerna.2004.humancytomegalovirusul131-128genesareindispensableforvirusgrowthinendothelialcellsandvirustransfertoleukocytes.j.virol.78:10023-10033.
hanket,mcmichaelaj,dennismjetal.biodistributionandpersistenceofanmva-vectoredcandidatehivvaccineinsiv-infectedrhesusmacaquesandscidmice.vaccine.2005;23:1507-1514.
hansensg,powerscj,richardsretal.evasionofcd8+tcellsiscriticalforsuperinfectionbycytomegalovirus.science.2010;328:102-106.
hansen,s.g.,l.i.strelow,d.c.franchi,d.g.anders,ands.w.wong.2003.completesequenceandgenomicanalysisofrhesuscytomegalovirus.j.virol.77:6620-6636.
heinemantc,schleissm,bernsteindietal.aphase1studyof4live,recombinanthumancytomegalovirustowne/toledochimericvaccines.jinfectdis.2006;193:1350-1360.
huff,j.l.,r.eberle,j.capitanio,s.s.zhou,andp.a.barry.2003.differentialdetectionofbvirusandrhesuscytomegalovirusinrhesusmacaques.j.gen.virol.84:83-92.
isaacson,m.k.andt.compton.2009.humancytomegalovirusglycoproteinbisrequiredforvirusentryandcell-to-cellspreadbutnotforvirionattachment,assembly,oregress.j.virol.83:3891-3903.
jarvisma,nelsonja.molecularbasisofpersistenceandlatency.humanherpesviruses:biology,therapy,andimmunoprophylaxis.cambridge:cambridgeuniversitypress;2007.
johnson,d.c.andp.g.spear.1983.o-linkedoligosaccharidesareacquiredbyherpessimplexvirusglycoproteinsinthegolgiapparatus.cell32:987-997.
kharfan-dabaja,m.a.,m.boeckh,m.b.wilck,a.a.langston,a.h.chu,m.k.wloch,d.f.guterwill,l.r.smith,a.p.rolland,andr.t.kenney.2012.anoveltherapeuticcytomegalovirusdnavaccineinallogeneichaemopoieticstem-celltransplantation:arandomised,double-blind,placebo-controlled,phase2trial.lancetinfect.dis.12:290-299.
kinzlerer,comptont.characterizationofhumancytomegalovirusglycoprotein-inducedcell-cellfusion.jvirol.2005;79:7827-7837.
latorrer,nigrog,mazzoccom,bestam,adlersp.placentalenlargementinwomenwithprimarymaternalcytomegalovirusinfectionisassociatedwithfetalandneonataldisease.clininfectdis.2006;43:994-1000.
lanzavecchiaetal.u.s.patentpublicationno.2009/0081230
lilja,a.e.andt.shenk.2008.effificientreplicationofrhesuscytomegalovirusvariantsinmultiplerhesusandhumancelltypes.proc.natl.acad.sci.u.s.a105:19950-19955.
lillerid,fornarac,furionemetal.developmentofhumancytomegalovirus-specifictcellimmunityduringprimaryinfectionofpregnantwomenanditscorrelationwithvirustransmissiontothefetus.jinfectdis.2007;195:1062-1070.
liuyn,klausa,karibetal.then-terminal513aminoacidsoftheenvelopeglycoproteingbofhumancytomegalovirusstimulatesbothb-andt-cellimmuneresponsesinhumans.jvirol.1991;65:1644-1648.
lubakimn,eganma,silicianorf,weinholdkj,bollingerrc.anovelmethodfordetectionandexvivoexpansionofhivtype1-specificcytolytictlymphocytes.aidsreshumretroviruses.1994;10:1427-1431.
macagno,a.,n.l.bernasconi,f.vanzetta,e.dander,a.sarasini,m.g.revello,g.gerna,f.sallusto,anda.lanzavecchia.2010.isolationofhumanmonoclonalantibodiesthatpotentlyneutralizehumancytomegalovirusinfectionbytargetingdifferentepitopesonthegh/gl/ul128-131acomplex.j.virol.84:1005-1013.
maidjie,mcdonaghs,genbacevo,tabatat,pereiral.maternalantibodiesenhanceorpreventcytomegalovirusinfectionintheplacentabyneonatalfcreceptor-mediatedtranscytosis.amjpathol.2006;168:1210-1226.
maidjie,percivallee,gernag,fishers,pereiral.transmissionofhumancytomegalovirusfrominfecteduterinemicrovascularendothelialcellstodifferentiating/invasiveplacentalcytotrophoblasts.virology.2002;304:53-69.
mansata,mengellec,chaletmetal.cytomegalovirusdetectionincryopreservedsemensamplescollectedfortherapeuticdonorinsemination.humreprod.1997;12:1663-1666.
manuel,e.r.,z.wang,z.li,r.c.la,w.zhou,andd.j.diamond.2010.intergenicregion3ofmodifiedvacciniaankaraisafunctionalsiteforinsertgeneexpressionandallowsforpotentantigen-specificimmuneresponses.virology403:155-162.
marshall,g.s.,g.g.stout,m.e.knights,g.p.rabalais,r.ashley,h.miller,ande.rossier.1994.ontogenyofglycoproteingb-specificantibodyandneutralizingactivityduringnaturalcytomegalovirusinfection.j.med.virol.43:77-83.
mayr,a.andk.malicki.1966.[attenuationofvirulentfowlpoxvirusintissuecultureandcharacteristicsoftheattenuatedvirus].zentralbl.veterinarmed.b13:1-13.
murphy,e.,d.yu,j.grimwood,j.schmutz,m.dickson,m.a.jarvis,g.hahn,j.a.nelson,r.m.myers,andt.e.shenk.2003.codingpotentialoflaboratoryandclinicalstrainsofhumancytomegalovirus.proc.natl.acad.sci.u.s.a100:14976-14981.
navarrod,pazp,tugizovsetal.glycoproteinbofhumancytomegaloviruspromotesvirionpenetrationintocells,transmissionofinfectionfromcelltocell,andfusionofinfectedcells.virology.1993;197:143-158.
nigrog,torrerl,pentimallihetal.regressionoffetalcerebralabnormalitiesbyprimarycytomegalovirusinfectionfollowinghyperimmunoglobulintherapy.prenatdiagn.2008;28:512-517.
nigro,g.,s.p.adler,t.r.la,anda.m.best.2005.passiveimmunizationduringpregnancyforcongenitalcytomegalovirusinfection.n.engl.j.med.353:1350-1362.
oxford,k.l.,l.strelow,y.yue,w.l.chang,k.a.schmidt,d.j.diamond,andp.a.barry.2011.openreadingframescarriedonul/b′areimplicatedinsheddingandhorizontaltransmissionofrhesuscytomegalovirusinrhesusmonkeys.j.virol.85:5105-5114.
oxford,k.l.,m.k.eberhardt,k.w.yang,l.strelow,s.kelly,s.s.zhou,andp.a.barry.2008.proteincodingcontentoftheul)b′regionofwild-typerhesuscytomegalovirus.virology373:181-188.
oxford,k.l.,m.k.eberhardt,k.w.yang,l.strelow,s.kelly,s.s.zhou,andp.a.barry.2008.proteincodingcontentoftheul)b′regionofwild-typerhesuscytomegalovirus.virology373:181-188.
pass,r.f.,a.m.duliege,s.boppana,r.sekulovich,s.percell,w.britt,andr.l.burke.1999.asubunitcytomegalovirusvaccinebasedonrecombinantenvelopeglycoproteinbandanewadjuvant.j.infect.dis.180:970-975.
pass,r.f.,c.zhang,a.evans,t.simpson,w.andrews,m.l.huang,l.corey,j.hill,e.davis,c.flanigan,andg.cloud.2009.vaccinepreventionofmaternalcytomegalovirusinfection.n.engl.j.med.360:1191-1199.
patronem,secchim,fiorinaletal.humancytomegalovirusul130proteinpromotesendothelialcellinfectionthroughaproducercellmodificationofthevirion.jvirol.2005;79:8361-8373.
plachterb,sinzgerc,jahng.celltypesinvolvedinreplicationanddistributionofhumancytomegalovirus.advvirusres.1996;46:195-261.
plotkinsa,furukawat,zygraichn,huygelenc.candidatecytomegalovirusstrainforhumanvaccination.infectimmun.1975;12:521-527.
plotkinsa,starrse,friedmanhmetal.effectoftownelivevirusvaccineoncytomegalovirusdiseaseafterrenaltransplant.acontrolledtrial[seecomments].anninternmed.1991;114:525-531.
plotkinsa,starrse,friedmanhm,gonczole,weibelre.protectiveeffectsoftownecytomegalovirusvaccineagainstlow-passagecytomegalovirusadministeredasachallenge.jinfectdis.1989;159:860-865.
rasmussen,l.,c.matkin,r.spaete,c.pachl,andt.c.merigan.1991.antibodyresponsetohumancytomegalovirusglycoproteinsgbandghafternaturalinfectioninhumans.j.infect.dis.164:835-842.
revello,m.g.andg.gerna.2010.humancytomegalovirustropismforendothelial/epithelialcells:scientificbackgroundandclinicalimplications.rev.med.virol.20:136-155.
rivailler,p.,a.kaur,r.p.johnson,andf.wang.2006.genomicsequenceofrhesuscytomegalovirus180.92:insightsintothecodingpotentialofrhesuscytomegalovirus.j.virol.80:4179-4182.
ryckmanbj,jarvisma,drummonddd,nelsonja,johnsondc.humancytomegalovirusentryintoepithelialandendothelialcellsdependsongenesul128toul150andoccursbyendocytosisandlow-phfusion.jvirol.2006;80:710-722.
ryckman,b.j.,b.l.rainish,m.c.chase,j.a.borton,j.a.nelson,m.a.jarvis,andd.c.johnson.2008b.characterizationofthehumancytomegalovirusgh/gl/ul128-131complexthatmediatesentryintoepithelialandendothelialcells.j.virol.82:60-70.
ryckman,b.j.,m.c.chase,andd.c.johnson.2008a.hcmvgh/gl/ul128-131interfereswithvirusentryintoepithelialcells:evidenceforcelltype-specificreceptors.proc.natl.acad.sci.u.s.a105:14118-14123.
ryckman,b.j.,m.c.chase,andd.c.johnson.2010.humancytomegalovirustrstrainglycoproteinoactsasachaperonepromotinggh/glincorporationintovirionsbutisnotpresentinvirions.j.virol.84:2597-2609.
saccocciof,sauera,cuixetal.2011.peptidesfromcytomegalovirusul130andul131proteinsinducehightiterantibodiesthatblockviralentryintomucosalepithelialcells.vaccine.29:2705-2711.
saccoccio,f.m.,a.l.sauer,x.cui,a.e.armstrong,e.habib,d.c.johnson,b.j.ryckman,a.j.klingelhutz,s.p.adler,andm.a.mcvoy.2011.peptidesfromcytomegalovirusul130andul131proteinsinducehightiterantibodiesthatblockviralentryintomucosalepithelialcells.vaccine29:2705-2711.
schleissmr.roleofbreastmilkinacquisitionofcytomegalovirusinfection:recentadvances.curropinpediatr.2006a;18:48-52.
schleiss,m.r.2006b.nonprimatemodelsofcongenitalcytomegalovirus(cmv)infection:gaininginsightintopathogenesisandpreventionofdiseaseinnewborns.ilar.j.47:65-72.
schleiss,m.r.2010.cytomegalovirusvaccinesandmethodsofproduction(wo20009049138):theemergingrecognitionoftheimportanceofvirusneutralizationattheepithelial/endothelialinterface.expert.opin.ther.pat20:597-602.
schleiss,m.r.,a.mcgregor,k.y.choi,s.v.date,x.cui,andm.a.mcvoy.2008.analysisofthenucleotidesequenceoftheguineapigcytomegalovirus(gpcmv)genome.virol.j.5:139.
sequar,g.,w.j.britt,f.d.lakeman,k.m.lockridge,r.p.tarara,d.r.canfield,s.s.zhou,m.b.gardner,andp.a.barry.2002.experimentalcoinfectionofrhesusmacaqueswithrhesuscytomegalovirusandsimianimmunodeficiencyvirus:pathogenesis.j.virol.76:7661-7671.
shenketal.u.s.patentapplicationpublicationno.2008/0187545.
shimamura,m.,m.mach,andw.j.britt.2006.humancytomegalovirusinfectionelicitsaglycoproteinm(gm)/gn-specificvirus-neutralizingantibodyresponse.j.virol.80:4591-4600.
sinzger,c.,m.digel,andg.jahn.2008.cytomegaloviruscelltropism.curr.top.microbiol.immunol.325:63-83.
stagnos,reynoldsd,tsiantosaetal.cervicalcytomegalovirusexcretioninpregnantandnonpregnantwomen:suppressioninearlygestation.jinfectdis.1975;131:522-527.
stratton,k.r.,j.s.durch,andr.s.lawrence.2001.vaccinesforthe21stcentury:atoolfordecisionmaking.bethesda:nationalacademypress.
timma,enzingerc,feldere,chaplinp.geneticstabilityofrecombinantmva-bn.vaccine.2006;24:4618-4621.
tischer,b.k.,e.j.von,b.kaufer,andn.osterrieder.2006.two-stepred-mediatedrecombinationforversatilehigh-efficiencymarkerlessdnamanipulationinescherichiacoli.biotechniques40:191-197.
tischer,b.k.,g.a.smith,andn.osterrieder.2010.enpassantmutagenesis:atwostepmarkerlessredrecombinationsystem.methodsmol.biol.634:421-430.
urban,m.,m.klein,w.j.britt,e.hassfurther,andm.mach.1996.glycoproteinhofhumancytomegalovirusisamajorantigenfortheneutralizinghumoralimmuneresponse.j.gen.virol.77(pt7):1537-1547.
vankooten,c.andj.banchereau.2000.cd40-cd40ligand.j.leukoc.biol.67:2-17.
vanarsdall,a.l.andd.c.johnson.2012.humancytomegalovirusentryintocells.curr.opin.virol.2:37-42.
vanarsdall,a.l.,b.j.ryckman,m.c.chase,andd.c.johnson.2008.humancytomegalovirusglycoproteinsgbandghh/glmediateepithelialcell-cellfusionwhenexpressedeitherincisorintrans.j.virol.82:11837-11850.
wangd,lif,freeddcetal.quantitativeanalysisofneutralizingantibodyresponsetohumancytomegalovirusinnaturalinfection.vaccine.2011.29:9075-9080.
wangz,larosac,laceysfetal.attenuatedpoxvirusexpressingthreeimmunodominantcmvantigensasavaccinestrategyforcmvinfection.jclinvirol.2006;35:324-331.
wangz,larosac,mekhoubadsetal.attenuatedpoxvirusesgenerateclinicallyrelevantfrequenciesofcmv-specifictcells.blood.2004;104:847-856.
wangz,zhouw,srivastavatetal.afusionproteinofhcmvie1exon4andie2exon5stimulatespotentcellularimmunityinanmvavaccinevector.virology.2008;377:379-390.
wang,d.andt.shenk.2005a.humancytomegalovirusul131openreadingframeisrequiredforepithelialcelltropism.j.virol.79:10330-10338.
wang,d.andt.shenk.2005b.humancytomegalovirusvirionproteincomplexrequiredforepithelialandendothelialcelltropism.proc.natl.acad.sci.u.s.a102:18153-18158.
wang,z.,j.martinez,w.zhou,r.c.la,t.srivastava,a.dasgupta,r.rawal,z.li,w.j.britt,andd.diamond.2010.modifiedh5promoterimprovesstabilityofinsertgeneswhilemaintainingimmunogenicityduringextendedpassageofgeneticallyengineeredmvavaccines.vaccine28:1547-1557.
wang,z.,r.c.la,r.maas,h.ly,j.brewer,s.mekhoubad,p.daftarian,j.longmate,w.j.britt,andd.j.diamond.2004.recombinantmodifiedvacciniavirusankaraexpressingasolubleformofglycoproteinbcausesdurableimmunityandneutralizingantibodiesagainstmultiplestrainsofhumancytomegalovirus.j.virol.78:3965-3976.
wang,z.,r.c.la,z.li,h.ly,a.krishnan,j.martinez,w.j.britt,andd.j.diamond.2007.vaccinepropertiesofanovelmarkergene-freerecombinantmodifiedvacciniaankaraexpressingimmunodominantcmvantigenspp65andie1.vaccine25:1132-1141.
wilckmb,chua,wlochmetal.interimanalysisofaphase2trialoftransvaxtm,atherapeuticdnavaccineforcontrolofcytomegalovirusintransplantrecipients[abstract].icaac.2010.
wille,p.t.,a.j.knoche,j.a.nelson,m.a.jarvis,andd.c.johnson.2010.ahumancytomegalovirusgo-nullmutantfailstoincorporategh/glintothevirionenvelopeandisunabletoenterfibroblastsandepithelialandendothelialcells.j.virol.84:2585-2596.
wlochmk,smithlr,boutsaboualoysetal.safetyandimmunogenicityofabivalentcytomegalovirusdnavaccineinhealthyadultsubjects.jinfectdis.2008;197:1634-1642.
wussowf,yuey,martinezj,deerejd,longmatej,herrmanna,barrypa,diamonddj.2013.avaccinebasedontherhesuscytomegalovirusul128complexinducesbroadlyneutralizingantibodiesinrhesusmacaques.jvirol.2013feb;87(3):1322-32.
wyatt,l.s.,p.l.earl,w.xiao,j.l.americo,c.a.cotter,j.vogt,andb.moss.2009.elucidatingandminimizingthelossbyrecombinantvacciniavirusofhumanimmunodeficiencyvirusgeneexpressionresultingfromspontaneousmutationsandpositiveselection.j.virol.83:7176-7184.
yamada,s.,n.nozawa,h.katano,y.fukui,m.tsuda,y.tsutsui,i.kurane,andn.inoue.2009.characterizationoftheguineapigcytomegalovirusgenomelocusthatencodeshomologsofhumancytomegalovirusmajorimmediate-earlygenes,ul128,andul130.virology391:99-106.
yud,silvamc,shenkt.functionalmapofhumancytomegalovirusad169definedbyglobalmutationalanalysis.procnatlacadsciusa.2003;100:12396-12401.
yue,y.andp.a.barry.2008.rhesuscytomegalovirusanonhumanprimatemodelforthestudyofhumancytomegalovirus.adv.virusres.72:207-226.
yue,y.,s.s.zhou,andp.a.barry.2003.antibodyresponsestorhesuscytomegalovirusglycoproteinbinnaturallyinfectedrhesusmacaques.j.gen.virol.84:3371-3379.
yue,y.,z.wang,k.abel,j.li,l.strelow,a.mandarino,m.k.eberhardt,k.a.schmidt,d.j.diamond,andp.a.barry.2008.evaluationofrecombinantmodifiedvacciniaankaravirus-basedrhesuscytomegalovirusvaccinesinrhesusmacaques.med.microbiol.immunol.197:117-123.
zhang,c.andr.f.pass.2004.detectionofcytomegalovirusinfectionduringclinicaltrialsofglycoproteinbvaccine.vaccine23:507-510.
zhang,c.,h.buchanan,w.andrews,a.evans,andr.f.pass.2006.detectionofcytomegalovirusinfectionduringavaccineclinicaltrialinhealthyyoungwomen:seroconversionandviralshedding.j.clin.virol.35:338-342.
- 还没有人留言评论。精彩留言会获得点赞!