一种促进栅藻生长和叶黄素积累的培养基的制作方法
本发明属于微藻培养技术领域,具体涉及一种促进栅藻生长和叶黄素积累的培养基。
背景技术:
叶黄素(lutein)又名植物黄体素、核黄体、万寿菊花素等,是一类天然类胡萝卜素,广泛存在于花卉、水果、蔬菜和藻类中。叶黄素在自然界中与玉米黄素共同存在,是构成植物色素的主要成分,因此可作为天然色素用于食品、医药和化妆品的色素添加剂以及家禽畜、动物组织的增色剂等。叶黄素还是一种性能优异的抗氧化剂,并可以吸收蓝光等有害光线,早在1995年,美国食品与药物管理局(fda)就已批准其作为食品补充剂用于食品饮料。叶黄素是唯一存在于人眼视网膜上的一种类胡萝卜素,它选择性地沉积在黄斑区和整个视网膜,对眼睛的主要生理功能是作为抗氧化剂和光保护剂。大量研究表明,叶黄素在预防控制视力下降、视网膜黄斑病变、白内障等常见眼疾中起到举足轻重的作用。此外,科学研究证实,叶黄素能够有效抵御自由基对人体细胞与器官造成的损伤,防止机体衰老引发的心血管硬化、冠心病和肿瘤等疾病;还能够激发免疫反应,提高机体免疫力。叶黄素无毒安全,具有优异的生理功效,符合食品添加剂“天然”,“营养”,“多功能”的发展方向,是目前国际功能性食品成分的研究热点之一。随着提取工艺和食品工业化水平完善的提高,叶黄素在保健食品等领域的前景将越来越广阔。
由于叶黄素的化学合成工艺十分复杂,因此目前具有生物功能活性的叶黄素均来自于植物提取。在食用的水果、蔬菜中,叶黄素含量差异显著。并且从果蔬中提取叶黄素的成本将很高,因此,生产上国内外均采用以叶黄素含量较高的万寿菊为原料,提取精制叶黄素。然而大规模的万寿菊栽培,存在占地面积大、生产效率低等问题,而且受到季节、气候及地域等条件的限制。藻类中的某些微藻,其细胞中也含有较多的叶黄素,而且微藻具有易于规模化培养及藻种改良、可进行生物质综合利用等多方面的优势,利用微藻生物合成叶黄素近年来得到国内外学者越来越多的关注。
栅藻(scenedesmusmeyen)又称栅列藻,属于绿藻门绿球藻目栅藻科,是淡水中常见的浮游藻类,极喜在营养丰富的静水中繁殖,生长在湖泊、水库、池塘、水坑、沼泽等各种水体中。栅藻易存活,繁殖能力强,对有机污染物具有较强的耐受性,在水体自净和污水净化中有一定作用。栅藻中的油脂组成与一般植物油相似,以c16、c18系脂肪酸为主,油脂含量为11%~55%,是新型生物柴油的理想原料。因此,目前关于栅藻的研究主要集中在污水治理和油脂积累等方面。
栅藻除了富含蛋白质、氨基酸和脂肪酸外,还含有多种维生素和色素,其中叶黄素的质量分数可达0.26%~0.31%,属于叶黄素含量较高的微藻。栅藻在自然条件下可以利用光能和二氧化碳进行正常的自养生长,此外还可以在异养条件下利用有机碳源进行生长和繁殖。异养培养栅藻可以克服自养培养下栅藻生物量低等诸多缺陷,是提高栅藻产量与产率的有效途径。在异养培养条件下,栅藻的生长以及代谢产物的积累与藻种、温度、光照、溶氧等环境条件密切相关,其中培养基的影响最显著,并且不同藻种对营养元素的种类及浓度存在一定的偏好性。目前我国关于利用栅藻生产叶黄素的研究还处在萌芽阶段,而在现有的技术条件下,栅藻培养的生物量以及叶黄素含量都处于一个较低的水平,还未能达到产业化标准。因此,如何显著提高栅藻生物量以及叶黄素含量是本发明的重要研究课题。
技术实现要素:
本发明的目的是提供一种能够促进栅藻生长和叶黄素积累的培养基,本发明所采用的技术方案如下:
一种促进栅藻生长和叶黄素积累的培养基,其特征在于,该培养基含有以下配比的组分:
葡萄糖4~6g/l,nano3120~150mg/l,大豆蛋白胨55~75mg/l,kh2po446~54mg/l,mgso4·7h2o70~80mg/l,cacl2·2h2o34~40mg/l,柠檬酸5.7~6.5mg/l,柠檬酸铁铵3.8~4.6mg/l,na2edta5.0~5.4mg/l,h3bo32.8~3.0mg/l,mnso4·4h2o0.66~0.70mg/l,znso4·7h2o0.21~0.25mg/l,cuso4·5h2o0.01~0.02mg/l,na2moo4·2h2o0.22~0.26mg/l,co(no3)2·6h2o0.01~0.02mg/l,肌醇80~100mg/l,盐酸硫胺素0.08~0.12mg/l,泛酸0.04~0.06mg/l,叶酸0.04~0.06mg/l,生物素0.01~0.03mg/l,缬氨酸5~10mg/l,亮氨酸10~15mg/l。
该培养基还含有以下配比的组分:l-硒-甲基硒代半胱氨酸3.0~4.0mg/l,硫代硫酸银0.47~0.61mg/l。
该培养基还含有以下配比的组分:二苯基脲磺酸钙1.4~1.6mg/l,iaa0.6~0.8mg/l。
该培养基还含有以下配比的组分:α-酮戊二酸2.5~3.5mg/l,烯草酮10~14μg/l。
该培养基还含有以下配比的组分:烟碱0.05~0.07mg/l,菠菜汁4~6ml/l。
该培养基的ph值为6.5~7.5。
该培养基含有以下最佳配比的组分:葡萄糖5g/l,nano3135mg/l,大豆蛋白胨65mg/l,kh2po450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,co(no3)2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,二苯基脲磺酸钙1.5mg/l,iaa0.7mg/l,α-酮戊二酸3.0mg/l,烯草酮12μg/l,烟碱0.06mg/l,菠菜汁5ml/l。
使用该培养基进行栅藻培养时,培养条件为:光照强度2000~3000lx,光照时间10~14h/d,培养温度25~30℃,摇床转速100~140rpm。
本发明的有益效果是:
本发明所提供的培养基是在常规藻类培养基上进行的优化,采用葡萄糖作为碳源,硝酸钠和大豆蛋白胨作为复合氮源,并调整了二者的质量比,使其更有利于栅藻生长和叶黄素积累;本发明的培养基还添加了肌醇、盐酸硫胺素、泛酸、叶酸等多种维生素,叶黄素合成代谢的前提化合物如缬氨酸、亮氨酸以及含有这些化合物的菠菜汁,生长调节剂如二苯基脲磺酸钙和iaa,有利于叶黄素积累的诱导剂如l-硒-甲基硒代半胱氨酸、硫代硫酸银、α-酮戊二酸、烯草酮和烟碱,通过以上手段可以显著提高栅藻的生物量,还可以诱导栅藻叶黄素的合成与积累,从而提高栅藻的综合利用价值。本发明对于利用栅藻生物合成叶黄素以及规模化的生产具有重要价值。
附图说明
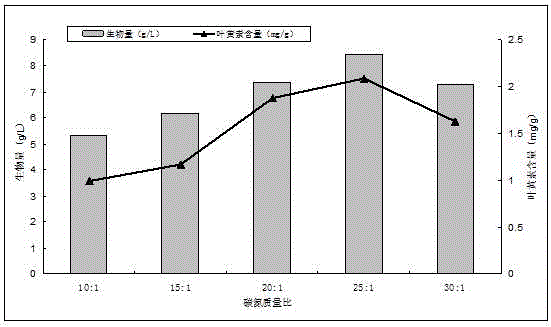
图1:碳氮质量比对栅藻生长及叶黄素含量的影响;
图2:二苯基脲磺酸钙浓度对栅藻生长及叶黄素含量的影响;
图3:α-酮戊二酸浓度对栅藻生长及叶黄素含量的影响;
图4:烯草酮浓度对栅藻生长及叶黄素含量的影响;
图5:烟碱浓度对栅藻生长及叶黄素含量的影响。
具体实施方式
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
下面对本发明所涉及的试验材料与方法描述如下:
1.1试验材料
试验所用栅藻为四尾栅藻(scenedesmusquadricauda),购自中国科学院水生生物研究所,编号fachb-1471。如无特殊说明,试验所用试剂、原料等均可通过商业途径购买。
1.2培养条件与方法
在500ml锥形瓶中装入200ml培养基,并经过121℃高温灭菌20min;将处于对数生长期的栅藻接入培养基中,接种量为10%,再放入光照摇床中培养14d,培养基条件为:光照强度2500lx,光照时间12h/d,培养温度27℃,摇床转速120rpm。
1.3生物量测定
在培养结束后,取一定体积的培养液置于离心管中,以6000r/min离心5min后去上清液,用蒸馏水洗涤沉淀、再离心,如此重复洗涤两次,60℃烘干至恒重,称重。
1.3叶黄素含量测定
在培养结束后,取5ml培养液置于离心管中,以10000r/min离心10min后去上清液,用磷酸盐缓冲液洗涤沉淀、再离心,如此重复洗涤3次后加入5ml甲醇-二氯甲烷(体积比2:1)溶液,用超声波细胞破碎机破碎藻细胞20min后,再次以10000r/min离心10min,取上清液进行hplc分析,以叶黄素标准品作为对照计算出对应的叶黄素浓度。
实施例1:碳氮质量比对栅藻生长及叶黄素含量的影响
按照以下配比组分制备培养基:nano3135mg/l,大豆蛋白胨65mg/l,kh2po450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,co(no3)2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,二苯基脲磺酸钙1.5mg/l,iaa0.7mg/l,α-酮戊二酸3.0mg/l,烯草酮12μg/l,烟碱0.06mg/l,菠菜汁5ml/l,ph值为7.0。
向培养基中分别添加2、3、4、5、6g/l的葡萄糖,使碳氮质量比分别为10:1,15:1,20:1,25:1和30:1,培养结束后测定栅藻的生物量和叶黄素含量,结果如图1所示。
在氮源浓度都为200mg/l的情况下,碳氮质量比较低即碳源浓度较低,无法满足栅藻的正常生长代谢,碳氮质量比过高即碳源浓度过高,会对栅藻的生长产生抑制。从图1可以看出,栅藻的生物量和叶黄素含量随着碳氮质量比的增加而呈现先增加后降低的趋势。当碳氮质量比从10:1增加到25:1时,栅藻的生物量和叶黄素含量逐渐升高,在25:1时达到最大,此时栅藻的生物量为8.45g/l,叶黄素含量为2.09mg/g,当碳氮质量比继续增加到30:1时,栅藻的生物量和叶黄素含量有所降低,因此选择25:1为最适宜的碳氮质量比。
实施例2:二苯基脲磺酸钙浓度对栅藻生长及叶黄素含量的影响
按照以下配比组分制备培养基:葡萄糖5g/l,nano3135mg/l,大豆蛋白胨65mg/l,k2hpo450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,co(no3)2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,iaa0.7mg/l,α-酮戊二酸3.0mg/l,烯草酮12μg/l,烟碱0.06mg/l,菠菜汁5ml/l,ph值为7.0。
向培养基中分别添加浓度为0、0.5、1.0、1.5、2.0mg/l的二苯基脲磺酸钙,培养结束后测定栅藻的生物量和叶黄素含量,结果如图2所示。
二苯基脲磺酸钙是一种生长调节剂,能够影响细胞内核酸和蛋白质的合成,促进细胞分裂或生长,调控多种酶的活性,增强细胞活力,促进光合作用等,因此添加适宜的浓度有利于促进栅藻生长和叶黄素积累。从图2可以看出,与对照(浓度为0mg/l)相比,添加了二苯基脲磺酸钙后,栅藻的生物量和叶黄素含量都有所增加。当二苯基脲磺酸钙浓度为1.5mg/l时,栅藻的生物量达到最大,为8.48g/l,较对照的6.28g/l有极显著提高,在此浓度下叶黄素含量也达到最大,为2.06mg/g,较对照1.25mg/g也有显著提高,因此,选择1.5mg/l为最适宜的二苯基脲磺酸钙浓度。
实施例3:α-酮戊二酸浓度对栅藻生长及叶黄素含量的影响
按照以下配比组分制备培养基:葡萄糖5g/l,nano3135mg/l,大豆蛋白胨65mg/l,k2hpo450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,co(no3)2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,二苯基脲磺酸钙1.5mg/l,iaa0.7mg/l,烯草酮12μg/l,烟碱0.06mg/l,菠菜汁5ml/l,ph值为7.0。
向培养基中分别添加浓度为0、1.0、3.0、5.0、7.0mg/l的α-酮戊二酸,培养结束后测定栅藻的生物量和叶黄素含量,结果如图3所示。
α-酮戊二酸可能对栅藻叶黄素合成代谢过程中的某些关键酶(如β-胡萝卜素羟化酶)具有一定的促进作用,从而能影响栅藻细胞中叶黄素的积累。从图3可以看出,与对照(浓度为0mg/l)相比,添加了α-酮戊二酸对栅藻的生物量没有显著影响,但对叶黄素含量的影响较为显著。当α-酮戊二酸浓度为3.0mg/l时,叶黄素含量达到最大,为2.13mg/g,较对照1.01mg/g有极显著提高,此时栅藻的生物量为8.38g/l,因此,选择3.0mg/l为最适宜的α-酮戊二酸浓度。
实施例4:烯草酮浓度对栅藻生长及叶黄素含量的影响
葡萄糖5g/l,nano3135mg/l,大豆蛋白胨65mg/l,k2hpo450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,co(no3)2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,二苯基脲磺酸钙1.5mg/l,iaa0.7mg/l,α-酮戊二酸3.0mg/l,烟碱0.06mg/l,菠菜汁5ml/l,ph值为7.0。
向培养基中分别添加浓度为0、6、12、18、24μg/l的烯草酮,培养结束后测定栅藻的生物量和叶黄素含量,结果如图4所示。
烯草酮是一种除草剂,其作用原理是乙酰辅酶a羧化酶抑制剂。乙酰辅酶a羧化酶是栅藻脂肪酸生物合成的关键酶,通过添加适量浓度的烯草酮可以限制栅藻细胞内脂肪酸合成途径,胁迫碳源流向叶黄素合成途径,从而促进叶黄素的大量积累,但浓度过高的烯草酮会导致栅藻细胞死亡。从图4可以看出,与对照(浓度为0mg/l)相比,随着烯草酮浓度的增加,栅藻的生物量逐渐减少,当烯草酮浓度达24μg/l时,生物量为5.94g/l,仅为对照的68.51%,可见,烯草酮的添加对栅藻生长有一定的抑制作用。烯草酮对叶黄素的积累有明显的促进作用,当烯草酮浓度为12μg/l时,叶黄素含量达到最大,为2.16mg/g,较对照的0.77mg/g有极显著提高,随着烯草酮浓度的继续增加,对叶黄素积累的促进作用逐渐减弱,因此,选择12μg/l为最适宜的烯草酮浓度。
实施例5:烟碱浓度对栅藻生长及叶黄素含量的影响
葡萄糖5g/l,nano3135mg/l,大豆蛋白胨65mg/l,k2hpo450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,co(no3)2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,二苯基脲磺酸钙1.5mg/l,iaa0.7mg/l,α-酮戊二酸3.0mg/l,烯草酮12μg/l,菠菜汁5ml/l,ph值为7.0。
向培养基中分别添加0、0.02、0.04、0.06、0.08mg/l的烟碱,培养结束后测定栅藻的生物量和叶黄素含量,结果如图5所示。
烟碱可能对栅藻生长代谢过程中的某些关键酶具有促进或抑制作用,从而能影响栅藻细胞的生长以及细胞中叶黄素的积累。从图5可以看出,与对照(浓度为0mg/l)相比,随着烟碱浓度的增加,栅藻的生物量和叶黄素含量均呈现先增加后降低的趋势。当烟碱浓度为0.04mg/l时,生物量达到最大,为8.32g/l,较对照的6.89g/l有显著提高;当烟碱浓度为0.06mg/l时,叶黄素含量达到最大,为2.10mg/g,较对照的1.03mg/g有极显著提高,因此,综合考虑选择0.06mg/l为最适宜的烟碱浓度。
实施例6:不同培养基对栅藻生长及叶黄素含量的影响
本发明的培养基:葡萄糖5g/l,nano3135mg/l,大豆蛋白胨65mg/l,kh2po450mg/l,mgso4·7h2o75mg/l,cacl2·2h2o37mg/l,柠檬酸6.1mg/l,柠檬酸铁铵4.2mg/l,na2edta5.2mg/l,h3bo32.9mg/l,mnso4·4h2o0.68mg/l,znso4·7h2o0.23mg/l,cuso4·5h2o0.015mg/l,na2moo4·2h2o0.24mg/l,cocl2·6h2o0.015mg/l,肌醇90mg/l,盐酸硫胺素1.0mg/l,泛酸0.05mg/l,叶酸0.05mg/l,生物素0.02mg/l,缬氨酸7.5mg/l,亮氨酸12.5mg/l,二苯基脲磺酸钙1.5mg/l,iaa0.7mg/l,α-酮戊二酸3.0mg/l,烯草酮12μg/l,烟碱0.06mg/l,菠菜汁5ml/l,ph值为7.0。
bg11培养基:nano31.5g/l,na2co320mg/l,k2hpo440mg/l,mgso4·7h2o70mg/l,cacl2·2h2o40mg/l,柠檬酸6mg/l,柠檬酸铁铵6mg/l,na2edta1mg/l,h3bo32.86mg/l,mncl2·4h2o1.86mg/l,znso4·7h2o0.22mg/l,na2moo4·2h2o0.39mg/l,cuso4·5h2o0.08mg/l,co(no3)2·6h2o0.05mg/l,ph值为7.0。
m11培养基:nano3100mg/l,na2co320mg/l,k2hpo410mg/l,mgso4·7h2o75mg/l,cacl2·2h2o40mg/l,柠檬酸铁6mg/l,na2edta1mg/l,ph值为8.0。
f/2培养基:nano375mg/l,nah2po4·2h2o5.6mg/l,na2edta4.36mg/l,fecl3·6h2o3.16mg/l,mncl2·4h2o0.18mg/l,znso4·7h2o0.022mg/l,na2moo4·2h2o0.006mg/l,cuso4·5h2o0.01mg/l,cocl2·6h2o0.01mg/l,维生素b10.1mg/l,维生素b120.0005mg/l,生物素0.0005mg/l,ph值为8.0。
将栅藻分别在以上四种培养基上培养,培养结束后测定栅藻的生物量和叶黄素含量,结果如表1所示。
bg11、m11、f/2均为藻类常用培养基,从表1可以看出,使用本发明的培养基进行培养,栅藻的生物量达到8.43g/l,叶黄素含量达到2.12mg/g,与使用其它藻类常用培养基相比,无论是栅藻的生物量还是叶黄素含量都有了显著提高,说明本发明的培养基是一种优良的适用于栅藻生长和叶黄素积累的培养基。本发明的培养基是在常规藻类培养基上进行的优化,采用葡萄糖作为碳源,硝酸钠和大豆蛋白胨作为复合氮源,并调整了二者的质量比,使其更有利于栅藻生长和叶黄素积累;本发明的培养基还添加了肌醇、盐酸硫胺素、泛酸、叶酸等多种维生素,叶黄素合成代谢的前提化合物如缬氨酸、亮氨酸以及含有这些化合物的菠菜汁,生长调节剂如二苯基脲磺酸钙和iaa,有利于叶黄素积累的诱导剂如l-硒-甲基硒代半胱氨酸、硫代硫酸银、α-酮戊二酸、烯草酮和烟碱,通过以上手段不仅可以显著提高栅藻的生物量,还可以诱导栅藻叶黄素的合成与积累。
当然,上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!