一种稳态化锦葵-3,5-O-二葡萄糖苷衍生物及其制备方法与应用与流程
本发明涉及花青素提取
技术领域:
,更具体地说是涉及一种稳态化锦葵-3,5-O-二葡萄糖苷衍生物及其制备方法与应用。
背景技术:
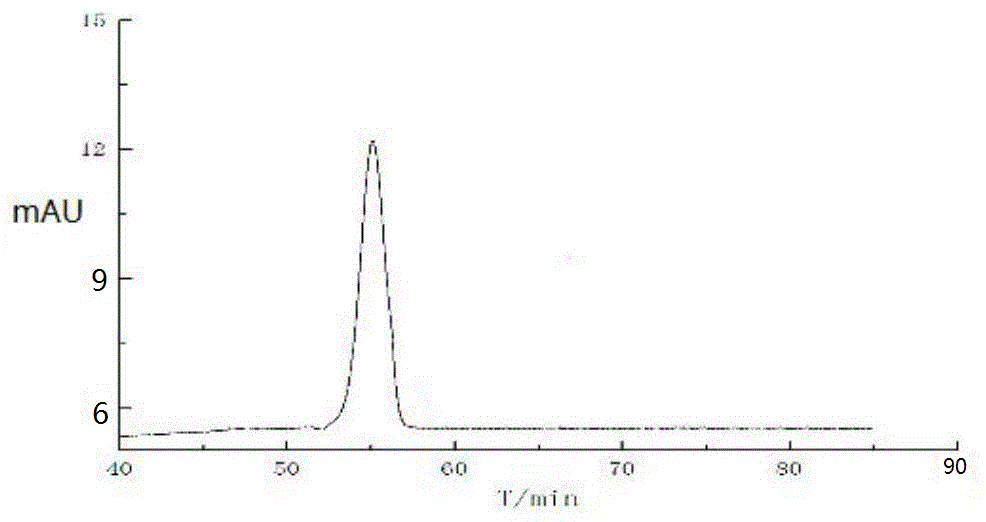
:花青素属类黄酮化合物,故具有类黄酮的典型结构,以C6-C3-C6为基本骨架,具有2-苯基-苯并毗喃阳离子结构。常见的6种花青素类别分别是天竺葵素、矢车菊素、飞燕草素、芍药素、矮牵牛素及锦葵素。天然的花青素色泽艳丽,并具有很好的保健功能,不仅在食品加工等领域应用潜力大,而且目前广泛应用于功能性食品及保健食品领域中,但天然花青素稳定性差,在提取、加工及贮藏过程中易发生降解,应用范围受限。研究发现:山葡萄中锦葵类花青素含量最高,约占总花青素含量的60%,包括锦葵色素、锦葵-3-O-葡萄糖苷及锦葵-3,5-O-二葡萄糖苷,其中锦葵-3,5-O-二葡萄糖苷含量最为丰富,但其存在稳定性差、不利于加工、保存及应用的缺陷。因此提高天然锦葵-3,5-O-二葡萄糖苷的稳定性十分必要。目前常用的增强花青素稳定性的方法主要是有机酸与花青素之间的互作辅色技术,但自发性辅色反应的速度慢,效率低,无法满足实际生产的需要。而超高压由于较高的压力,具有瞬时压缩、作用均匀、操作安全、生态友好等优点,可最大程度地对物质进行提取;但是超高压技术用于促进色素稳定的相关研究甚少,且超高压促锦葵-3,5-O-二葡萄糖苷与咖啡酸稳态化处理及其机理未见报道;锦葵-3,5-O-二葡萄糖苷经超高压稳态化处理后,衍生为其衍生物,而这种衍生物性质稳定,功效优于锦葵-3,5-O-二葡萄糖苷,在抗氧化应激领域可广泛应用。因此,如何提供一种利用锦葵-3,5-O-二葡萄糖苷制备稳态化锦葵-3,5-O-二葡萄糖苷衍生物的方法与应用是本领域技术人员亟需解决的问题。技术实现要素:有鉴于此,本发明提供了一种态化锦葵-3,5-O-二葡萄糖苷衍生物及其制备方法与应用。为了实现上述目的,本发明采用如下技术方案:一种稳态化锦葵-3,5-O-二葡萄糖苷衍生物,其结构如式I所示:以上技术方案达到的技术效果是:稳态化锦葵-3,5-O-二葡萄糖苷衍生物又名锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷,其稳定性较锦葵-3,5-O-二葡萄糖苷好,且在细胞及动物水平上的抗氧化应激作用优于锦葵-3,5-O-二葡萄糖苷,可广泛应用于食品和保健食品领域。一种稳态化锦葵-3,5-O-二葡萄糖苷衍生物,在抗氧化应激中的应用。一种稳态化锦葵-3,5-O-二葡萄糖苷衍生物的制备方法,包括如下过程:1)提取:先将葡萄去柄、打浆,得到浆体;再利用非热高压脉冲电场技术于所述浆体中提取花青素,得到花青素溶液;2)离心、浓缩:先将步骤1)中的花青素溶液在3000~5000r/min下离心5~15min,取上清液;再将得到的上清液浓缩,减压浓缩至其密度为(1.0~1.1)×103kg/m3,停止浓缩,得到浓缩液;3)洗脱、浓缩:先将步骤2)所得浓缩液进行洗脱,得到洗脱浓缩液;再对所得洗脱浓缩液进行浓缩,直至洗脱浓缩液变为膏体,停止浓缩,得到花青素纯化物膏体;4)稀释、单体制备:先将步骤3)所得花青素纯化物膏体以含有0.5~1%(v/v)HCl的甲醇溶液稀释稀释10~20倍,得到花青素纯化物稀释液;再利用制备型高效液相色谱技术,对花青素纯化物稀释液进行梯度洗脱,收集出峰时间为78~80min时间段的洗脱液,得到锦葵-3,5-O-二葡萄糖苷单体溶液;5)冷冻干燥:对步骤4)所得锦葵-3,5-O-二葡萄糖苷溶液进行在冷阱温度-40℃,真空度50~100Pa条件冷冻干燥8~10h,得到高纯度的锦葵-3,5-O-二葡萄糖苷(>95%);6)稳态化处理:以3~8倍咖啡酸质量的无水乙醇溶解咖啡酸,得到咖啡酸溶液;先向咖啡酸溶液中加入步骤5)所得锦葵-3,5-O-二葡萄糖苷,得到混合溶液;再以pH为3.0的磷酸氢二钠-柠檬酸缓冲液稀释混合溶液,至锦葵-3,5-O-二葡萄糖苷的最终浓度为0.1mg/mL,即可得到反应液备用,所述锦葵素与咖啡酸的浓度比1:3~5;然后将反应液避光放入50~60℃水浴中30~60min后,在稳定压力200~400MPa、稳定时间1~15min条件下对稀释液进行超高压稳态化处理,得到稳态化处理液;7)离心、洗脱、浓缩:将步骤6)中得到的稳态化处理液在3000~5000r/min条件下,离心5~10min,取上清液;将上清液进行洗脱、浓缩、冻干,得到锦葵-3,5-O-二葡萄糖苷衍生物。以上技术方案达到的技术效果是:超高压由于较高的压力可影响分子空间排列,催化反应,具有瞬时压缩、作用均匀、操作安全、生态友好等优点。本发明采用非热的高压脉冲电场技术提取纯化并制备山葡萄中锦葵-3,5-O-二葡萄糖苷,在这一系列过程中最大程度地保护花青素不受破坏。将锦葵-3,5-O-二葡萄糖苷与咖啡酸进行超高压稳态化处理,通过改变稳定剂浓度、稳定压力及稳定时间进一步提升了稳态化效果;然后,利用液相色谱,超高效液相色谱-四极杆-静电场轨道阱串联质谱分析锦葵-3,5-O-二葡萄糖苷衍生物的结构,并对新生成的花青素的抗氧化应激作用进行研究,得出葵-3,5-O-二葡萄糖苷衍生物对生物体细胞及动物水平具有较强的抗氧化应激作用,为天然锦葵-3,5-O-二葡萄糖苷高效稳定修饰及其在食品加工领域的应用提供技术支持,提升了天然色素产业竞争力。作为本发明优选的技术方案,步骤1)中利用高压脉冲电场技术提取花青素的工艺条件包括:按照液(提取液)料(山葡萄研磨浆)比为5~9:1(w/w)将山葡萄研磨浆加入0.1~0.5%盐酸—55~75%乙醇(v/v,即100mL溶液中含有0.1~0.5mL的HCl和55~75mL的乙醇,其余为去离子水)提取液中,电场强度为10~20kV/cm,脉冲个数为4~10。作为本发明优选的技术方案,步骤3)中对浓缩液进行洗脱及浓缩的具体操作包括:(1)先将浓缩液用去离子水稀释5~10倍,在4~10℃条件下,以1~2BV/h的速率上样于D101大孔树脂柱中,上样完成后,静置15~35min;(2)用4~6倍柱体积的去离子水洗脱柱中盐离子、多糖等杂质;再用含有0.1%HCl—75%乙醇溶液(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱4~6倍柱体积,至其无色,合并洗脱液;洗脱速率均为1~2BV/h;(3)将洗脱液在45~55℃,40~60r/min,真空度0.08~0.1Mpa条件下减压浓缩至密度为(1.0~1.1)×103kg/m3,得花青素纯化物膏体作为本发明优选的技术方案,步骤4)中利用制备型高效液相色谱技术对花青素纯化物膏体稀释10~20倍进行单体制备时,洗脱液包括A相和B相;A相:浓度为5%(v/v)甲酸水溶液;B相:甲醇溶液。作为本发明优选的技术方案,步骤4)中,对花青素纯化物膏体稀释液进行单体制备的具体操作如下:进样量为2mL,流动相以2mL/min流速进行洗脱,流动相由A相为5%(v/v)甲酸水溶液和B相为甲醇,按照以下洗脱时间和洗脱梯度对应关系进行洗脱,洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%;然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始,增加B的体积分数,直至第100min结束,B的体积为35%;在101min时,增加B相的体积分数,直至第105min结束,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%。在78~80min时收集锦葵类-3,5-O-二葡萄糖苷洗脱液。作为本发明优选的技术方案,步骤1)~步骤7)中的浓缩方法均为:在40~55℃,40~60r/min,真空度0.08~0.1Mpa条件下进行减压浓缩至密度为(1.0~1.1)×103kg/m3。步骤1)-步骤7)中的冻干方法均为:在冷阱温度-40℃,真空度50~100Pa条件冷冻干燥8~10h。经由上述的技术方案可知,与现有技术相比,本发明达到的技术效果是:超高压稳态化处理后获得新花青素为锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷(Malvidin-3-O-(6″-O-caffeoyl)-5-diglucoside),其结构较比未稳态化处理的锦葵-3,5-O-二葡萄糖苷稳定,有更好的光热稳定性和抗氧化应激作用。本发明采用非热的高压脉冲电场技术提取纯化并制备山葡萄中锦葵-3,5-O-二葡萄糖苷,在这一系列过程中最大程度保护花青素不受破坏。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1附图为实施例6制备得到的锦葵-3,5-O-二葡萄糖苷的HPLC图谱;图2附图为实施例6制备得到的锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷的HPLC图谱;图3附图为实施例6制备得到的锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷的MS/MS图谱;图4附图为锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷的形成机理;图5附图为实施例6制备的不同浓度Mv35G及Mv3-C-5G对HUVEC细胞内增殖率的影响示意图;图6附图为实施例6制备的不同浓度Mv35G及Mv3C5G对HUVEC细胞内ROS水平的影响示意图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1一、锦葵-3,5-O-二葡萄糖苷的制备:(1)将山葡萄去果柄打浆,以胶体磨在2000r/min下研磨20min,得到浆体;按照液(提取液)料(山葡萄研磨浆)比为5:1(w/w)将山葡萄研磨浆加入0.5%盐酸—75%乙醇(v/v,即100mL溶液中含有0.5mL的HCl和75mL的乙醇,其余为去离子水)提取液中,采用高压脉冲电场在电场强度10kV/cm,脉冲个数为10的条件下提取葡萄浆体中的花青素,得到花青素溶液,然后将花青素溶液在3000r/min离心15min,取上清液,并在45℃,50r/min,真空度0.08Mpa条件下减压浓缩至密度为1.0×103kg/m3,得到山葡萄花青素粗提物浓缩液;(2)将上述浓缩液用去离子水稀释5倍,在4℃条件下,上样于处理好的D101大孔树脂柱中,上样及洗脱速率均为1BV/h,上样后静置15min使花青素充分被大孔树脂吸附,用4倍柱体积的去离子水洗脱杂质,再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱4倍柱体积至其无色,收集洗脱液,并将洗脱液置于40℃,40r/min,真空度0.08Mpa条件下减压浓缩至密度为1.0×103kg/m3,得山葡萄花青素纯化物膏体;(3)用含0.5%(v/v)HCl的甲醇溶液将花青素纯化物膏体稀释10倍,得到花青素纯化物溶液;并以制备型高效液相色谱技术从花青素纯化物中分离锦葵-3,5-O-二葡萄糖苷,分离条件:Waters2545制备型高效液相色谱、Waters2489UV/Vis检测器,SunFirePrepC18柱(10mm×250mm,5μm);柱温25℃;检测波长530nm;进样量2mL;流速2mL/min;流动相A:5%(v/v)甲酸水溶液,B:甲醇;以A相和B相的混合相进行洗脱;洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%,然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,逐渐增加B相的体积分数,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始时,增加B的体积分数,直至第100min结束时,B的体积为35%;在101min开始时增加B相的体积分数,直至第105min结束时,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%;收集出峰时间为78~80min时的洗脱液,获得锦葵-3,5-O-二葡萄糖苷溶液;然后对锦葵-3,5-O-二葡萄糖苷溶液在-40℃,真空度50Pa条件进行冷冻干燥8h,获得高纯度山葡萄锦葵-3,5-O-二葡萄糖苷(纯度>95%)。二、超高压稳态化处理:(4)取3倍咖啡酸质量的无水乙醇溶解适量咖啡酸,再加入步骤(3)得到的锦葵-3,5-O-二葡萄糖苷,得到锦葵-3,5-O-二葡萄糖苷混合溶液;用pH3.0的磷酸氢二钠-柠檬酸缓冲溶液稀释咖啡酸与锦葵-3,5-O-二葡萄糖苷的混合液,使锦葵-3,5-O-二葡萄糖苷最终浓度为0.1mg/mL,得到锦葵-3,5-O-二葡萄糖苷反应液,此时,锦葵-3,5-O-二葡萄糖苷与咖啡酸浓度比1:3;将锦葵-3,5-O-二葡萄糖苷反应液避光放入50℃水浴中加热60min,然后在稳定压力200MPa、稳定时间15min条件下进行超高压稳态化处理,得到稳态化锦葵-3,5-O-二葡萄糖苷处理液;将稳态化锦葵-3,5-O-二葡萄糖苷处理液在3000r/min下离心10min,取上清液,经D101大孔树脂纯化后在4℃条件下,以1BV/h的上样速率上样至D101大孔树脂柱中,然后静置15min;接着以1BV/h洗脱速率先用4倍柱体积去离子水洗脱、再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱4倍柱体积至无色,合并洗脱液,在40℃,40r/min,真空度0.08Mpa条件下减压浓缩至密度为1.0×103kg/m3,然后在冷阱温度-40℃,真空度50Pa条件下冷冻干燥8h,得稳定的锦葵-3,5-O-二葡萄糖苷衍生物。实施例2一、锦葵-3,5-O-二葡萄糖苷的制备:(1)将山葡萄去果柄打浆,以胶体磨在2500r/min下研磨18min,得到浆体;按照液(提取液)料(山葡萄研磨浆)比为6:1(w/w)将山葡萄研磨浆加入0.4%盐酸—70%乙醇(v/v,即100mL溶液中含有0.4mL的HCl和70mL的乙醇,其余为去离子水)提取液中,采用高压脉冲电场在电场强度12kV/cm,脉冲个数为9的条件下提取葡萄浆体中的花青素,得到花青素溶液,然后将花青素溶液在3500r/min离心10min,取上清液,并在50℃,45r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,得到浓缩液;(2)将上述浓缩液用去离子水稀释6倍,在5℃条件下,上样于处理好的D101大孔树脂柱中,上样及洗脱速率均为1.25BV/h,上样后静置20min,用5倍柱体积去离子水洗脱杂质,再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5倍柱体积至其无色,收集洗脱液,并将洗脱液置于45℃,45r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,得山葡萄花青素纯化物膏体;(3)用含0.75%(v/v)HCl的甲醇溶液将花青素纯化物膏体稀释12倍,得到花青素纯化物溶液;并以制备型高效液相色谱技术从花青素中分离锦葵-3,5-O-二葡萄糖苷,分离条件:Waters2545制备型高效液相色谱、Waters2489UV/Vis检测器,SunFirePrepC18柱(10mm×250mm,5μm);柱温25℃;检测波长530nm;进样量2mL;流速2mL/min;流动相A:5%甲酸水溶液,B:甲醇;以A相和B相的混合相进行洗脱;洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%,然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,逐渐增加B相的体积分数,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始时,增加B的体积分数,直至第100min结束时,B的体积为35%;在101min开始时,增加B相的体积分数,直至第105min结束时,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%;收集出峰时间为78~80min时的洗脱液,获得锦葵-3,5-O-二葡萄糖苷溶液;然后对锦葵-3,5-O-二葡萄糖苷溶液在冷阱温度-40℃,真空度75Pa条件下进行冷冻干燥9h,获得高纯度山葡萄锦葵-3,5-O-二葡萄糖苷(纯度>95%)。二、超高压稳态化处理:(4)取4倍咖啡酸质量的无水乙醇溶解适量咖啡酸,再加入步骤(3)得到的锦葵-3,5-O-二葡萄糖苷,得到锦葵-3,5-O-二葡萄糖苷混合溶液;用pH3.0的磷酸氢二钠-柠檬酸缓冲溶液稀释咖啡酸与锦葵-3,5-O-二葡萄糖苷的混合液,使锦葵-3,5-O-二葡萄糖苷最终浓度为0.1mg/mL,得到锦葵-3,5-O-二葡萄糖苷稀释液,此时,锦葵-3,5-O-二葡萄糖苷与咖啡酸浓度比1:4;将锦葵-3,5-O-二葡萄糖苷稀释液避光放入53℃水浴中加热50min,然后在稳定压力250MPa、稳定时间13min条件下进行超高压稳态化处理,得到稳态化锦葵-3,5-O-二葡萄糖苷处理液;将稳态化锦葵-3,5-O-二葡萄糖苷处理液在3500r/min下离心8min,取上清液,经D101大孔树脂纯化后在5℃条件下,以1.25BV/h的上样速率上样至D101大孔树脂柱中,然后静置20min;接着以1.25BV/h洗脱速率先用5倍柱体积去离子水洗脱、再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5倍柱体积至无色,合并洗脱液,在45℃,45r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,然后在冷阱温度-40℃,真空度75Pa条件下冷冻干燥9h,得稳定的锦葵-3,5-O-二葡萄糖苷衍生物。实施例3一、锦葵-3,5-O-二葡萄糖苷的制备:(1)将山葡萄去果柄打浆,以胶体磨在3000r/min下研磨15min,得到浆体;按照液(提取液)料(山葡萄研磨浆)比为7:1(w/w)将山葡萄研磨浆加入0.3%盐酸—65%乙醇(v/v,即100mL溶液中含有0.3mL的HCl和65mL的乙醇,其余为去离子水)提取液中,采用高压脉冲电场在电场强度15kV/cm,脉冲个数为7的条件下提取葡萄浆体中的花青素,得到花青素溶液,然后将花青素溶液在4000r/min离心10min,取上清液,并在50℃,50r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,得到浓缩液;(2)将上述浓缩液用去离子水稀释7.5倍,在7℃条件下,上样于处理好的D101大孔树脂柱中,上样及洗脱速率均为1.5BV/h,上样后静置25min,用5倍柱体积去离子水洗脱杂质,再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5倍柱体积至其无色,收集洗脱液,并将洗脱液置于50℃,50r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,得山葡萄花青素纯化物膏体;(3)用含0.75%(v/v)HCl的甲醇溶液将花青素纯化物膏体稀释15倍,得到花青素纯化物溶液;并以制备型高效液相色谱技术从花青素中分离锦葵-3,5-O-二葡萄糖苷,分离条件:Waters2545制备型高效液相色谱、Waters2489UV/Vis检测器,SunFirePrepC18柱(10mm×250mm,5μm);柱温25℃;检测波长530nm;进样量2mL;流速2mL/min;流动相A:5%(v/v)甲酸水溶液,B:甲醇;以A相和B相的混合相进行洗脱;洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%,然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,逐渐增加B相的体积分数,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始时,增加B的体积分数,直至第100min结束时,B的体积为35%;在101min开始时,增加B相的体积分数,直至第105min结束时,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%;收集出峰时间为78~80min时的洗脱液,获得锦葵-3,5-O-二葡萄糖苷溶液;然后对锦葵-3,5-O-二葡萄糖苷溶液在冷阱温度-40℃,真空度80Pa条件下进行冷冻干燥8.5h,获得高纯度山葡萄锦葵-3,5-O-二葡萄糖苷(纯度>95%)。二、超高压稳态化处理:(4)取8倍咖啡酸质量的无水乙醇溶解适量咖啡酸,再加入步骤(3)得到的锦葵-3,5-O-二葡萄糖苷,得到锦葵-3,5-O-二葡萄糖苷混合溶液;用pH3.0的磷酸氢二钠-柠檬酸缓冲溶液稀释咖啡酸与锦葵-3,5-O-二葡萄糖苷的混合液,使锦葵-3,5-O-二葡萄糖苷最终浓度为0.1mg/mL,得到锦葵-3,5-O-二葡萄糖苷稀释液,此时,锦葵-3,5-O-二葡萄糖苷与咖啡酸浓度比1:4;将锦葵-3,5-O-二葡萄糖苷稀释液避光放入55℃水浴中加热45min,然后在稳定压力300MPa、稳定时间5min条件下进行超高压稳态化处理,得到稳态化锦葵-3,5-O-二葡萄糖苷处理液;将稳态化锦葵-3,5-O-二葡萄糖苷处理液在4000r/min下离心7min,取上清液,经D101大孔树脂纯化后在7℃条件下,以1.5BV/h的上样速率上样至D101大孔树脂柱中,然后静置25min;接着以1.5BV/h洗脱速率先用5倍柱体积去离子水洗脱、再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5倍柱体积至无色,合并洗脱液,在50℃,50r/min,真空度0.09Mpa条件下减压浓缩至密度为1.02×103kg/m3,然后在冷阱温度-40℃,真空度80Pa条件下冷冻干燥8.5h,得稳定的锦葵-3,5-O-二葡萄糖苷衍生物。实施例4一、锦葵-3,5-O-二葡萄糖苷的制备:(1)将山葡萄去果柄打浆,以胶体磨在4000r/min下研磨10min,得到浆体;按照液(提取液)料(山葡萄研磨浆)比为9:1(w/w)将山葡萄研磨浆加入0.1%盐酸—55%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和55mL的乙醇,其余为去离子水)提取液中,采用高压脉冲电场在电场强度20kV/cm,脉冲个数为10的条件下提取葡萄浆体中的花青素,得到花青素溶液,然后将花青素溶液在5000r/min离心5min,取上清液,并在55℃,60r/min,真空度0.1Mpa条件下减压浓缩至密度为1.1×103kg/m3,得到浓缩液;(2)将上述浓缩液用去离子水稀释10倍,在10℃条件下,上样于处理好的D101大孔树脂柱中,上样及洗脱速率均为2BV/h,上样后静置35min,用6倍柱体积纯化水洗脱杂质,再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱6倍柱体积至其无色,收集洗脱液,并将洗脱液置于55℃,60r/min,真空度0.1Mpa条件下减压浓缩至密度为1.1×103kg/m3,得山葡萄花青素纯化物膏体;(3)用含1%(v/v)HCl的甲醇溶液将花青素纯化物膏体稀释20倍,得到花青素纯化物溶液;并以制备型高效液相色谱技术从花青素中分离锦葵-3,5-O-二葡萄糖苷,分离条件:Waters2545制备型高效液相色谱、Waters2489UV/Vis检测器,SunFirePrepC18柱(10mm×250mm,5μm);柱温25℃;检测波长530nm;进样量2mL;流速2mL/min;流动相A:5%(v/v)甲酸水溶液,B:甲醇;以A相和B相的混合相进行洗脱;洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%,然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,逐渐增加B相的体积分数,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始时,增加B的体积分数,直至第100min结束时,B的体积为35%;在101min开始时,增加B相的体积分数,直至第105min结束时,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%;收集出峰时间为78~80min时的洗脱液,获得锦葵-3,5-O-二葡萄糖苷溶液;然后对锦葵-3,5-O-二葡萄糖苷溶液在冷阱温度-40℃,真空度100Pa条件下进行冷冻干燥10h,获得高纯度山葡萄锦葵-3,5-O-二葡萄糖苷(纯度>95%)。二、超高压稳态化处理:(4)取6倍咖啡酸质量的无水乙醇溶解适量咖啡酸,再加入步骤(3)得到的锦葵-3,5-O-二葡萄糖苷,得到锦葵-3,5-O-二葡萄糖苷混合溶液;用pH3.0的磷酸氢二钠-柠檬酸缓冲溶液稀释咖啡酸与锦葵-3,5-O-二葡萄糖苷的混合液,使锦葵-3,5-O-二葡萄糖苷最终浓度为0.1mg/mL,得到锦葵-3,5-O-二葡萄糖苷稀释液,此时,锦葵-3,5-O-二葡萄糖苷与咖啡酸浓度比1:5;将锦葵-3,5-O-二葡萄糖苷稀释液避光放入60℃水浴中加热30min,然后在稳定压力400MPa、稳定时间1min条件下进行超高压稳态化处理,得到稳态化锦葵-3,5-O-二葡萄糖苷处理液;将稳态化锦葵-3,5-O-二葡萄糖苷处理液在5000r/min下离心5min,取上清液,经D101大孔树脂纯化后在10℃条件下,以2BV/h的上样速率上样至D101大孔树脂柱中,然后静置35min;接着以2BV/h洗脱速率先用6倍柱体积去离子水洗脱、再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱6倍柱体积至无色,合并洗脱液],在55℃,60r/min,真空度0.1Mpa条件下减压浓缩至密度为1.1×103kg/m3,然后在冷阱温度-40℃,真空度100Pa条件下冷冻干燥10h,得稳定的锦葵-3,5-O-二葡萄糖苷衍生物。实施例5一、锦葵-3,5-O-二葡萄糖苷的制备:(1)将山葡萄去果柄打浆,以胶体磨在3500r/min下研磨12min,得到浆体;按照液(提取液)料(山葡萄研磨浆)比为8:1(w/w)将山葡萄研磨浆加入0.2%盐酸—60%乙醇(v/v,即100mL溶液中含有0.2mL的HCl和60mL的乙醇,其余为去离子水)提取液中,采用高压脉冲电场在电场强度18kV/cm,脉冲个数为8的条件下提取葡萄浆体中的花青素,得到花青素溶液,然后将花青素溶液在4500r/min离心8min,取上清液,并在53℃,55r/min,真空度0.09Mpa条件下减压浓缩至密度为1.1×103kg/m3,得到浓缩液;(2)将上述浓缩液用去离子水稀释8倍,在8℃条件下,上样于处理好的D101大孔树脂柱中,上样及洗脱速率均为1.75BV/h,上样后静置30min,用5.5倍柱体积去离子水洗脱杂质,再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5.5倍柱体积至其无色,收集洗脱液,并将洗脱液置于53℃,55r/min,真空度0.09Mpa条件下减压浓缩至密度为1.1×103kg/m3,得山葡萄花青素纯化物膏体;(3)用含0.75%(v/v)HCl的甲醇溶液将花青素纯化物膏体稀释18倍,得到花青素纯化物溶液;并以制备型高效液相色谱技术从花青素中分离锦葵-3,5-O-二葡萄糖苷,分离条件:Waters2545制备型高效液相色谱、Waters2489UV/Vis检测器,SunFirePrepC18柱(10mm×250mm,5μm);柱温25℃;检测波长530nm;进样量2mL;流速2mL/min;流动相A:5%(v/v)甲酸水溶液,B:甲醇;以A相和B相的混合相进行洗脱;洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%,然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,逐渐增加B相的体积分数,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始时,增加B的体积分数,直至第100min结束时,B的体积为35%;在101min开始时,增加B相的体积分数,直至第105min结束时,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%;收集出峰时间为78~80min时的洗脱液,获得锦葵-3,5-O-二葡萄糖苷溶液;然后对锦葵-3,5-O-二葡萄糖苷溶液在冷阱温度-40℃,真空度100Pa条件下进行冷冻干燥10h,获得高纯度山葡萄锦葵-3,5-O-二葡萄糖苷(纯度>95%)。二、超高压稳态化处理:(4)取7倍咖啡酸质量的无水乙醇溶解适量咖啡酸,再加入步骤(3)得到的锦葵-3,5-O-二葡萄糖苷,得到锦葵-3,5-O-二葡萄糖苷混合溶液;用pH3.0的磷酸氢二钠-柠檬酸缓冲溶液稀释咖啡酸与锦葵-3,5-O-二葡萄糖苷的混合液,使锦葵-3,5-O-二葡萄糖苷最终浓度为0.1mg/mL,得到锦葵-3,5-O-二葡萄糖苷稀释液,此时,锦葵-3,5-O-二葡萄糖苷与咖啡酸浓度比1:4.5;将锦葵-3,5-O-二葡萄糖苷稀释液避光放入55℃水浴中加热40min,然后在稳定压力350MPa、稳定时间5min条件下进行超高压稳态化处理,得到稳态化锦葵-3,5-O-二葡萄糖苷处理液;将稳态化锦葵-3,5-O-二葡萄糖苷处理液在4500r/min下离心8min,取上清液,经D101大孔树脂纯化后在8℃条件下,以1.75BV/h的上样速率上样至D101大孔树脂柱中,然后静置30min;接着以1.75BV/h洗脱速率先用5.5倍柱体积去离子水洗脱、再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5.5倍柱体积至无色,合并洗脱液],在53℃,55r/min,真空度0.09Mpa条件下减压浓缩至密度为1.1×103kg/m3,然后在冷阱温度-40℃,真空度100Pa条件下冷冻干燥10h,得稳定的锦葵-3,5-O-二葡萄糖苷衍生物。实施例6一、锦葵-3,5-O-二葡萄糖苷的制备:(1)将山葡萄去果柄打浆,以胶体磨在3500r/min下研磨15min,得到浆体;按照液(提取液)料(山葡萄研磨浆)比为8.5:1(w/w)将山葡萄研磨浆加入0.1%盐酸—65%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和65mL的乙醇,其余为去离子水)提取液中,采用高压脉冲电场在电场强度15kV/cm,脉冲个数为6的条件下提取葡萄浆体中的花青素,得到花青素溶液,然后将花青素溶液在4500r/min离心10min,取上清液;最后上清液在50℃,50r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,得到浓缩液;(2)将上述浓缩液用去离子水稀释5倍,在6℃条件下,上样于处理好的D101大孔树脂柱中,上样及洗脱速率均为1.5BV/h,上样后静置20min,用5倍柱体积去离子水洗脱杂质,再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5倍柱体积至其无色,收集洗脱液,并将洗脱液置于50℃,50r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,得山葡萄花青素纯化物膏体;(3)用含1%(v/v)HCl甲醇溶液将花青素纯化物膏体稀释15倍,得到花青素纯化物溶液;并以制备型高效液相色谱技术从花青素中分离锦葵-3,5-O-二葡萄糖苷,分离条件:Waters2545制备型高效液相色谱、Waters2489UV/Vis检测器,SunFirePrepC18柱(10mm×250mm,5μm);柱温25℃;检测波长530nm;进样量2mL;流速2mL/min;流动相A:5%(v/v)甲酸水溶液,B:甲醇;以A相和B相的混合相进行洗脱;洗脱开始时,B相的体积分数为8%,逐渐增加B相的体积分数,洗脱至第5min结束时,B相的体积分数变为10%,然后保持B相的体积分数不变,直至第50min结束;从第51min开始,逐渐增加B相的体积分数,直至洗脱60min结束时,B相的体积分数变为20%;在第61min开始时,逐渐增加B相的体积分数,直至洗脱80min结束时,B相的体积分数变为25%;在第81min开始时,增加B的体积分数,直至第100min结束时,B的体积为35%;在101min开始时,增加B相的体积分数,直至第105min结束时,B相的体积分数为70%,停止洗脱;期间,A相和B相的体积分数始终为100%;收集出峰时间为78~80min时的洗脱液,获得锦葵-3,5-O-二葡萄糖苷溶液;然后对锦葵-3,5-O-二葡萄糖苷溶液在冷阱温度-40℃,真空度75Pa条件下进行冷冻干燥9h,获得高纯度山葡萄锦葵-3,5-O-二葡萄糖苷(纯度>95%)。二、超高压稳态化处理:(4)取8倍咖啡酸质量的无水乙醇溶解适量咖啡酸,再加入步骤(3)得到的锦葵-3,5-O-二葡萄糖苷,得到锦葵-3,5-O-二葡萄糖苷混合溶液;用pH3.0的磷酸氢二钠-柠檬酸缓冲溶液稀释咖啡酸与锦葵-3,5-O-二葡萄糖苷的混合液,使锦葵-3,5-O-二葡萄糖苷最终浓度为0.1mg/mL,得到锦葵-3,5-O-二葡萄糖苷稀释液,此时,锦葵-3,5-O-二葡萄糖苷与咖啡酸浓度比1:4.5;将锦葵-3,5-O-二葡萄糖苷稀释液避光放入55℃水浴中加热45min,然后在稳定压力300MPa、稳定时间5min条件下进行超高压稳态化处理,得到稳态化锦葵-3,5-O-二葡萄糖苷处理液;将稳态化锦葵-3,5-O-二葡萄糖苷处理液在4500r/min下离心10min,取上清液,经D101大孔树脂纯化后在6℃条件下,以1.5BV/h的上样速率上样至D101大孔树脂柱中,然后静置20min;接着以1.5BV/h洗脱速率先用5倍柱体积去离子水洗脱、再用0.1%HCl—75%乙醇(v/v,即100mL溶液中含有0.1mL的HCl和75mL的乙醇,其余为去离子水)洗脱5倍柱体积至无色,合并洗脱液,将洗脱液在50℃,50r/min,真空度0.09Mpa条件下减压浓缩至密度为1.05×103kg/m3,然后在冷阱温度-40℃,真空度75Pa条件下冷冻干燥9h,得稳定的锦葵-3,5-O-二葡萄糖苷衍生物。实施例7锦葵-3,5-O-二葡萄糖苷衍生物的结构鉴定收集实施例6制备得到的锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物,对其进行结构的鉴定:液相色谱条件:ThermoSyncronisC18色谱柱(100mm×3mm,1.7μm),梯度洗脱,流动相为0.1%甲酸水溶液(A)和乙腈(B);梯度洗脱:0~2min,8~10%B;2~11min,10%B;11~19min,10~15%B;19~24min,15~20%B;24~27min,20~25%B;27~33min,25~35%B;33~36min,35~45%B;36~38min,45~55%B;38~45min,55~80%B。柱温30℃;流速0.2mL/min;进样量10μL。得到锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物的HPLC图谱,参见附图1和附图2;质谱条件:采用电喷雾正离子扫描模式(ESI+),干燥气温度350℃,雾化气流速35arb,辅助气流速10arb,质量扫描范围m/z50~1000;得到的锦葵-3,5-O-二葡萄糖苷衍生物的MS/MS数据如表1所示;其MS/MS图谱如附图3所示;稳态化处理前后锦葵-3,5-O-二葡萄糖苷的液相图谱(图1和图2)说明锦葵-3,5-O-二葡萄糖苷与咖啡酸在超高压条件下发生反应生成锦葵-3,5-O-二葡萄糖苷衍生物。在正离子模式下,锦葵-3,5-O-二葡萄糖苷与咖啡酸键合后锦葵-3,5-O-二葡萄糖苷衍生物存在准分子离子峰m/z817.21914,在二级串联质谱中可见碎片离子m/z655.34326,493.13761,331.12026,282.07894,150.3890,121.02881。其中,碎片离子m/z655.34326是由分子离子m/z817.21914丢失1分子质量数为162的葡萄糖残基或由分子离子m/z817.21914失去1分子质量数为162的咖啡酰基产生的,m/z493.13761是由碎片离子m/z655.34326丢失一分子质量数为162的咖啡酰基或由碎片离子m/z655.34326丢失1分子质量数为162的葡萄糖残基产生的,碎片离子m/z331.14216是由碎片离子m/z493.13761继续丢失一分子质量数为162的葡萄糖残基形成,m/z150.33725是由花青素C环发生0/2位C-C键断裂而产生的0,2A+·自由基正离子,在碎片离子中发现有m/z282.07894,121.02881,m/z282.07894可能是由花青素C环发生0/3位C-C键断裂而产生的0,3A+·自由基正离子,m/z121.02881是由碎片离子m/z282.07894丢失1分子质量数为162的葡萄糖残基产生的(表1),由此推断咖啡酰基连接在3位葡萄糖苷上。根据结果分析,鉴定锦葵-3,5-O-二葡萄糖苷与咖啡酸键合后的化合物鉴定为:锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷(Malvidin-3-O-(6″-O-caffeoyl)-5-diglucoside),分子式为C38H41O20,分子量817。锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷化合物形成机理如图4:锦葵-3,5-O-二葡萄糖苷与咖啡酸键合,脱去一分子H2O得锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷。表1锦葵-3,5-O-二葡萄糖苷衍生物的MS/MS数据实施例8锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷的稳定性测定以实施例6步骤(3)获得的未稳态化处理的锦葵-3,5-O-二葡萄糖苷作为空白对照组;将实施例6步骤(4)获得的锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷用pH3.0磷酸二氢钠-柠檬酸钠的缓冲液稀释后浓度为0.1mg/mL作为试验组,在最大吸收波长λ521nm处测定各组吸光值,并按公式(1)计算稳态后锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷的辅色率(C),评估锦葵-3,5-O-二葡萄糖苷经过超高压稳态化处理后的效果。公式(1)C(%)=[(A-A0)/A0]×100公式(2)R(%)=(At/A)×100式(1)中:A为稳态化处理后的吸光度;A0为未稳态化处理的吸光度;式(2)中:At为光、热不同处理时间后溶液的吸光度值;A为光、热处理前溶液的吸光度值。稳定性测定方法:以pH3.0磷酸二氢钠-柠檬酸钠的缓冲液将锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷稀释后浓度为0.1mg/mL,分别在在100℃水浴条件下加热0h、2h,评估温度对花青素的影响;同时,在室温自然光条件下处理0d、20d,评估光照对花青素的影响。分别将经过四种不同处理的锦葵-3,5-O-二葡萄糖苷和锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷在λ521nm处测定吸光度值,按公式(2)计算花青素溶液的保存率(R),结果见表2;表2锦葵-3,5-O-二葡萄糖苷超高压稳态化处理结果评价表2结果表明:锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷增色率平均值为49.02±0.02%,RSD值为0.05%;其在100℃水浴中,加热2h或在室温日光放置20d后,其保存率R值仍在60%以上,较未稳态化处理锦葵-3,5-O-二葡萄糖苷溶液颜色保持更好。说明经过稳态化处理后,葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷的热稳定性及光稳定性更好。实施例9锦葵-3-O-(6″-O-咖啡酰基)-5-二葡萄糖苷在细胞水平上的抗氧化应激作用鉴定方法(1)HUVEC细胞培养①培养基配置取F12K、10%FBS及1%Penicillin-Streptomycin溶液(v/v/v,8.9:1:0.1),配成细胞培养基。②细胞复苏取出HUVEC细胞,将其在37℃水浴中溶解;然后转移到5mL上述①配置成的培养基中,室温1000~1200rpm/min下离心5~10min,弃上清;用含10%胎牛血清的细胞培养基(F12K:10%FB:1%Penicillin-Streptomycin=8.9:1:0.1,v/v/v)悬浮细胞,接种到培养基中,混匀,细胞置于37℃、5%CO2饱和湿度条件下培养。③细胞传代待步骤②细胞密度达80%时,对细胞进行传代。先弃去培养基,用PBS洗涤细胞;然后向细胞中加1~2mL0.25%胰蛋白酶消化1~3min,于显微镜下观察,若细胞相互分离变圆,即消化完成;然后,弃去胰酶,加入完全培养基,制成单细胞悬液,按1:3的比例(单细胞悬液与培养液的比例)传代,细胞置于37℃、5%CO2饱和湿度条件下扩大培养。(2)CCK-8检测细胞增殖率及药物对HUVEC细胞的毒性作用CCK-8是应用成熟的细胞增殖-毒性检测的方法。通过酶标仪在450nm波长处测定样本的吸光度值(Opticaldensity,OD值),可以准确反映实验板各孔中活细胞的相对量,加入化合物作用的孔中活细胞数量与加入溶剂处理的孔中活细胞数量进行比较,可以间接衡量化合物的细胞毒性情况,以细胞的增殖率(Proliferationrate,P)或抑制率(Inhibitionratio,I)来评价。公式(3)P(%)=(OD样品组/OD对照组)×100%公式(4)I(%)=1-(OD样品组/OD对照组)×100%式中:OD样品组为受试组的吸光度值;OD对照组为对照组的吸光度值。试验分组:正常组:只是对数生长期细胞,未加入H2O2、咖啡酸、锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物受试组1:10μmol/L咖啡酸受试组2:50μmol/L咖啡酸受试组3:100μmol/L咖啡酸受试组4:10μmol/L实施例6中的锦葵-3-O-葡萄糖苷受试组5:50μmol/L实施例6的锦葵-3-O-葡萄糖苷受试组6:100μmol/L实施例6的锦葵-3-O-葡萄糖苷受试组7:10μmol/L实施例6的锦葵-3-O-葡萄糖苷衍生物受试组8:50μmol/L实施例6的锦葵-3-O-葡萄糖苷衍生物受试组9:100μmol/L实施例6的锦葵-3-O-葡萄糖苷衍生物结果:利用CCK-8试验法,考察咖啡酸、锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物对HUVEC细胞的毒性作用。与正常组比较,各受试组的不同浓度对细胞存活率的影响无差异显著性,无统计学意义,说明咖啡酸、锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物对HUVEC细胞无毒性作用,对HUVEC细胞的生长无促进增值作用,对细胞生长是安全的。(3)细胞内ROS水平测定细胞内ROS的产生和增多,将导致细胞衰老或调亡。细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF,可通过荧光分光光度仪或流式细胞分析仪检测DCF的荧光,进而检测细胞内ROS的水平。公式(5)比值(Ratio,R)=A样品组/A对照组式中:A样品组为受试组的吸光度值;A对照组为对照组的吸光度值。(4)H2O2诱导HUVEC细胞氧化损伤模型建立分别考察H2O2浓度为100、200、300、500、750、1000μmol/L对HUVEC细胞进行不同时间(6、12、24、48h)作用处理后,采用CCK-8法检测细胞抑制率。每组3个平行,计算不同浓度H2O2对细胞增殖的抑制率(%),以细胞增殖抑制率为50%(IC50)的H2O2浓度作为后续实验的H2O2浓度,并检测细胞内ROS的水平;结果如表3所示,随着处理时间的延长,H2O2诱导HUVEC细胞氧化应激损伤的半数抑制浓度IC50逐渐降低,呈现出浓度依赖性。表3H2O2诱导细胞不同时间后对细胞半数抑制浓度的影响分组6h12h24h36hIC50(μmol/L)701.643616.683385.778301.644不同浓度H2O2对HUVEC细胞进行不同时间处理后,细胞内ROS水平测定结果如表4所示,而当H2O2溶液浓度为300μmol/L时,细胞中的ROS比值与正常组比较开始有显著性差异(p<0.05),培养24h及48h时,细胞中的ROS比值与正常组比较有显著性差异(p<0.01),24h时ROS比值为2.56,细胞损伤明显且稳定,故本实验诱导模型选择浓度为300μmolH2O2溶液诱导HUVEC细胞24h。表4不同浓度H2O2处理细胞不同时间对细胞内ROS水平的影响注:与正常组(0μmolol/L)比较,*代表有显著性差异(p<0.05),**代表有极显著性差异(p<0.01)。(5)花青素对H2O2诱导HUVEC细胞氧化损伤的影响①试验分组取对数生长期细胞传代后随机分组进行试验。包括正常组(只是对数生长期细胞),H2O2诱导模型组,受试组(各设三个浓度10、50、100μmol/L):咖啡酸(CA)、锦葵-3,5-O-二葡萄糖苷(Mv35G)、锦葵-3,5-O-二葡萄糖苷衍生物(Mv3C5G)。具体分组如下:正常组:只是对数生长期细胞,未加入H2O2、咖啡酸、锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物模型组:300μmol/L的过氧化氢处理24h受试组1:10μmol/L咖啡酸受试组2:50μmol/L咖啡酸受试组3:100μmol/L咖啡酸受试组4:10μmol/L实施例6中的锦葵-3-O-葡萄糖苷受试组5:50μmol/L实施例6的锦葵-3-O-葡萄糖苷受试组6:100μmol/L实施例6的锦葵-3-O-葡萄糖苷受试组7:10μmol/L实施例6的锦葵-3-O-葡萄糖苷衍生物受试组8:50μmol/L实施例6的锦葵-3-O-葡萄糖苷衍生物受试组9:100μmol/L实施例6的锦葵-3-O-葡萄糖苷衍生物②CCK-8检测细胞增值率取对数生长期HUVEC细胞,按5×103个/孔接种于96孔板中,每孔加入培养液200μL,置于37℃、5%CO2培养箱中培养24h;加入300μmol/L的H2O2处理24h后,分别以受试组1-9的给药方式处理24h;以正常组和模型组为对照,向正常组、模型组及受试组中每孔加入20μLCCK-8溶液,37℃培养4h,酶标仪测定各孔吸光值OD450,每样设3个平行。③细胞内ROS水平测定取对数生长期HUVEC细胞,按5×103个/孔接种于96孔板中,每孔加入培养液200μL,37℃、5%CO2培养箱中培养24h,加入300μmol/L的H2O2处理24h后,再分别以受试组1-9的给药方式处理24h,以正常组和模型组为对照。处理后用PBS润洗细胞1次;按照DCFH-DA细胞ROS检测试剂盒操作说明测定。测定结果:CCK-8检测结果及细胞内ROS水平测定结果如图5、图6所示,H2O2氧化损伤模型组的细胞增殖率为正常组的0.51倍,有极显著性差异(p<0.01),表明建模成功,同时细胞内ROS释放量显著增加(p<0.01)。不同浓度的受试组1-3与模型组相比,细胞增殖率无显著性差异(p>0.05),说明浓度为10、50及100μmol/L的咖啡酸对氧化损伤细胞处理24h时无保护作用;受试组4-6的细胞增殖率显著增加,浓度在100μmol/L时,与模型组相比有显著性差异(p<0.05),细胞内ROS释放量显著降低(p<0.01),说明锦葵-3,5-O-二葡萄糖苷(Mv35G)对H2O2诱导HUVEC细胞氧化损伤具有一定的保护作用。受试组7-9的细胞增殖率较模型组显著增加,浓度在50μmol/L和100μmol/L时,与模型组相比均有显著性差异(p<0.05),分别增至76.98±0.06%、77.30±0.01%,呈浓度依赖性,同时细胞内ROS释放量显著降低(p<0.01),分别降至1.69±0.34%、1.30±0.42%、1.18±0.21%。细胞增殖率和ROS活性指标显示锦葵-3,5-O-二葡萄糖苷衍生物(Mv3CG)的作用效果优于锦葵-3,5-O-二葡萄糖苷(Mv35G)。结果表明锦葵-3,5-O-二葡萄糖苷衍生物(Mv3C5G)对H2O2诱导HUVEC细胞氧化损伤具有一定的保护作用,作用效果优于锦葵-3,5-O-二葡萄糖苷(Mv35G)。结果见表5;表5不同处理方式对细胞增殖率的影响增殖率ROS水平正常组100.00±0.011.00±0.20受试组156.62±0.032.33±0.33受试组257.07±0.052.20±0.27受试组362.21±0.042.09±0.41受试组458.36±0.032.24±0.31受试组560.75±0.022.15±0.44受试组676.82±0.05ΔΔ1.61±0.35ΔΔ受试组768.72±0.091.69±0.34ΔΔ受试组876.98±0.06Δ1.30±0.42ΔΔ受试组977.30±0.01Δ1.18±0.21ΔΔ模型组51.43±0.02**2.44±0.38**注:与正常组(control)比较,*代表显著性差异(p<0.05),**代表极显著性差异(p<0.01);与模型组(H2O2)比较,Δ代表显著性差异(p<0.05),ΔΔ代表极显著性差异(p<0.01);与添加咖啡酸(CA)的组比较,#代表显著性差异(p<0.05),##代表极显著性差异(p<0.01);与添加锦葵-3,5-O-二葡萄糖苷(Mv35G)的组比较,▲代表显著性差异(p<0.05),▲▲代表极显著性差异(p<0.01)H2O2)实施例10锦葵-3,5-O-二葡萄糖苷衍生物动物水平上抗氧化应激作用评价:(1)试验分组取健康雄性ICR小鼠,雄性,体重20±2g,购于长春市亿斯实验动物技术有限责任公司,许可证号:SCXK(吉)2016-0004。适应性饲养1周后,随机分为正常组、模型组、锦葵-3,5-O-二葡萄糖苷组、锦葵-3,5-O-二葡萄糖苷衍生物组(表6),每组10只。表6实验动物分组组别简称给药剂量(mg/kgbw)空白对照组Control生理盐水模型组Model生理盐水锦葵-3,5-O-二葡萄糖苷组Mv35G50锦葵-3,5-O-二葡萄糖苷衍生物组Mv3C5G50(2)造模及给药方法试验开始后,模型组、锦葵-3,5-O-二葡萄糖苷组、锦葵-3,5-O-二葡萄糖苷衍生物组每天腹腔注射98%D-半乳糖,剂量为500mg/kg,空白组腹腔注射等量的生理盐水。锦葵-3,5-O-二葡萄糖苷组和锦葵-3,5-O-二葡萄糖苷衍生物组每天分别灌胃给药;空白组和模型组灌胃给予等量的生理盐水。每隔2~3天称重,连续灌胃给药35天。试验期间,每日观察并记录小鼠的体重、毛发色泽及变化、饮食饮水、自主活动、精神状态和死亡情况,结果见表7;表7各组小鼠体重变化比较组别0d7d14d21d28d35dControl23.06±1.4729.36±1.4932.03±1.5034.53±1.0638.26±2.5838.30±3.61Model23.30±2.6428.76±1.5231.83±1.4732.41±1.43**35.23±2.56**34.10±3.70**Mv35G23.19±2.1629.49±2.3132.50±2.2933.52±1.36Δ36.79±3.6938.69±2.85ΔMv3C5G23.35±1.5629.90±0.7733.80±1.3633.16±1.12Δ37.46±5.4538.58±2.95Δ可知:锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物能明显改善氧化损伤小鼠的各种体征,并对氧化损伤小鼠体重的增长有促进作用(3)小鼠脏器指数的测定利用上述步骤(2)中的方法喂养小鼠35天后,禁食12小时,称重,眼球取血后,迅速摘取出心、肝、脾、肺、肾、脑等脏器,生理盐水冲洗,滤纸吸干,准确称重,并按如下公式计算,结果见表8;公式(6)脏器指数(%)=脏器重量/小鼠体重×100%表8小鼠脏器指数指标组别肝(%)脾(%)心(%)肺(%)脑(%)肾(%)胸腺(%)Control3.79±0.220.34±0.050.41±0.100.52±0.081.29±0.131.31±0.040.32±0.05Model3.21±0.36**0.31±0.02**0.31±0.06**0.50±0.021.05±0.17**1.16±0.14**0.24±0.02**Mv35G3.50±0.22Δ0.34±0.12Δ0.37±0.05Δ0.51±0.191.27±0.06Δ1.27±0.08Δ0.28±0.04ΔMv3C5G3.57±0.16Δ0.34±0.11Δ0.38±0.05Δ0.51±0.031.28±0.09Δ1.28±0.12Δ0.28±0.04Δ可知:锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物能够使损伤小鼠的肝、脾、心、脑、肾、胸腺脏器指数显著升高(p<0.01)。(4)小鼠血清及肝脏中生化指标的测定小鼠摘取眼球取血,置于离心管中,3000~5000rpm离心,10~15min,取上清液用于血清中生化指标的测定。同时摘取小鼠肝脏组织,剔除脂肪,生理盐水冲洗,滤纸吸干,称重。制备10%的肝组织匀浆液,3000~5000rpm离心,10~15min,用于肝脏组织中生化指标的测定。按照试剂盒中说明书进行总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)测定。数据以平均数±标准差(X±SD)表示,采用SPSS软件处理试验数据,组间差异用t检验计算。结果见表9~13;表9青素对小鼠SOD活性的影响组别血清(U/mLprot)肝脏(U/mgprot)Control17.76±0.8511.32±0.78Model15.76±1.45**9.35±0.75**Mv35G17.72±1.20ΔΔ11.25±0.97ΔΔMv3C5G17.69±1.45ΔΔ12.96±1.02ΔΔ▲▲表10花青素对小鼠GSH-Px活性的影响组别血清(U/mLprot)肝脏(U/mgprot)Control270.34±20.65484.97±20.72Model182.75±40.21**408.60±18.25**Mv35G274.48±21.65ΔΔ479.12±12.89ΔΔMv3C5G282.08±19.45ΔΔ592.56±21.60ΔΔ▲▲表11花青素对小鼠CAT活性的影响组别血清(U/mLprot)肝脏(U/mgprot)Control8.55±0.8222.20±0.62Model6.87±0.22**19.70±1.64**Mv35G7.92±0.95Δ21.16±1.20ΔMv3C5G8.24±1.45ΔΔ21.89±1.15ΔΔ表12花青素对小鼠T-AOC活性的影响组别血清(U/mLprot)肝脏(U/mLprot)Control15.49±1.620.25±0.02Model11.87±1.56**0.15±0.03**Mv35G13.57±1.19Δ0.20±0.03ΔMv3C5G14.24±1.09ΔΔ0.23±0.02ΔΔ表13花青素对小鼠MDA含量的影响组别血清(nmol/mLprot)肝脏(nmol/mgprot)Control1.54±0.080.59±0.07Model3.87±0.23**1.58±0.03**Mv35G2.09±0.51ΔΔ0.67±0.04ΔΔMv3C5G1.99±0.15ΔΔ0.54±0.13ΔΔ▲▲注:与空白组(Control)比较,*代表显著性差异(p<0.05),**代表极显著性差异(p<0.01);与模型组(Model)比较,Δ代表显著性差异(p<0.05),ΔΔ代表极显著性差异(p<0.01),与添加锦葵-3,5-O-二葡萄糖苷组(Mv35G)比较,▲代表有显著性差异(p<0.05),▲▲代表有极显著性差异(p<0.01)。通过对小鼠血清及肝脏中生化指标的测定结果表明(表9~13),与模型组比较,锦葵-3,5-O-二葡萄糖苷及锦葵-3,5-O-二葡萄糖苷衍生物能够显著升高血清及肝脏中SOD、GSH-Px、CAT、T-AOC等抗氧活酶的活性(p<0.01),显著降低MDA的含量(p<0.01),对于肝脏中SOD、GSH-Px及MDA指标,锦葵-3,5-O-二葡萄糖苷衍生物的作用效果明显优于锦葵-3,5-O-二葡萄糖苷(p<0.01)。结合其细胞水平上抗氧化应激作用评价结果,说明锦葵-3,5-O-二葡萄糖苷衍生物可以通过清除体内自由基进而保护细胞完整和活力,从而达到抗氧化应激作用,且抗氧化损伤能力优于锦葵-3,5-O-二葡萄糖苷。本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1