一种好养反硝化细菌筛选引物及方法与流程
本发明属于微生物领域,具体地涉及一种好养反硝化细菌筛选引物及方法。
背景技术:
近年来,随着氮素污染物的过量排放导致的水体富营养化日益严重,利用生物脱氮技术去除水体中氮素污染物已经成为最经济有效、且无二次污染的热点生物技术之一。生物脱氮理论认为,水体中氮素的去除主要利用微生物将有机氮经过氨化、硝化、反硝化作用还原为NO、N2O和N2,才能彻底去除水体中的氮素污染物。可见反硝化过程是富营养化水体净化整个脱氮过程最后且最关键的一步。研究参与反硝化过程的微生物不仅利于废水的生物脱氮、土壤肥力的保存,而且对于臭氧气层的保护,减少N2O气体的排放均具有重要的意义。因此筛选出具有反硝化功能的微生物至关重要。
反硝化主要途径为硝酸盐在周质硝酸盐还原酶Nap或膜质硝酸盐还原酶Nar的作用下还原为亚硝酸盐,亚硝酸盐在亚硝酸盐还原酶Nir的作用下还原为NO,NO在亚硝酸盐氧化还原酶Nor的作用下还原为N2O,N2O在氧化亚氮还原酶Nos的作用下还原为N2。目前,已有报道对反硝化菌的筛选大多基于底物消除法,以硝酸氮和亚硝酸氮的减少作为反硝化细菌存在的依据。但是,有些异养菌会通过同化作用吸收硝酸氮和亚硝酸氮,转化成细胞物质,这样即使检测到两种底物的减少,而非一定转化成了气体,还有报道在此基础上,通过气体产生检测或利用编码反硝化酶的功能基因的PCR检测来作为筛选条件。但是PCR检测方法对反应条件要求高,如果条件不合适,会出现假阴性,而气体检测常用的气相色谱法操作繁琐、费用高。因此探究出一种简便、精确的筛选菌株的方法尤为重要。
技术实现要素:
本发明要解决的技术问题在于提供一种方便、快捷、精准的好养反硝化细菌筛选引物及方法。
所述引物及方法能够从环境中分离筛选出好氧反硝化菌株,能够用于废水的脱氮治理。
本发明是通过如下技术方案来实现的:
一种好养反硝化细菌筛选的LAMP扩增引物,所述的引物序列如下表1:
表1引物序列
利用所述引物进行好养反硝化细菌的筛选方法,所述方法具体步骤如下:
(1)菌株富集培养:
无菌条件下取含有菌体的水样的按照体积比1:9接入到灭菌的生理盐水中,恒温振荡;
取振荡液接种于液体富集培养基中,于28℃、好氧条件下振荡培养5d,重复转接3~4次后,取富集液进行系列梯度稀释,取适当倍数稀释液涂布于分离培养基上,放于28℃恒温培养箱,培养48~72h,根据菌落特征挑选不同形态的单菌落进行平板划线分离,重复划线分离4~5次,直至得到纯的单菌落,作为候选菌株;
(2)LAMP初次筛选:提取候选菌株的DNA,以提取的DNA为模板,分别利用表1nirS、nirK和nosZ基因的引物进行LAMP扩增反应,扩增反应体系如下:10×等温扩增反应缓冲液2.5μL、100mM的MgSO4溶液1.5μL、10mM dNTP Mix 3.5μL、25×FIP/BIP Primers1μL、25×F3/B3Primers1μL、8000U/ml Bst 2.0DNA聚合酶1μL、DNA Sample 1μL、灭菌水补充至25μL;10×GeneFinderTM核酸染料4μL点在离心管盒盖内侧,反应温度60℃,反应时间60min;检测过程中以特定的反硝化标准菌株作为阳性对照,以ddH2O代替菌株作为阴性对照;
LAMP扩增产物的检测,将预先点于离心管盖内侧的染料弹下,直接肉眼观察,反应液变为绿色的阳性,选取LAMP反应中nirS或nirK基因为阳性、同时nosZ基因也为阳性的菌株作为初筛菌株,进行后续筛选;
(3)PCR二次筛选:提取初筛菌株的DNA,以提取的DNA为模板,利用nosZ引物进行PCR扩增反应,nosZ引物的序列为nosZ-F:5'-cgytgttcmtcgacagccag-3',nosZ-1622R5'-cgcrasggcaasaaggtscg-3';反应体系为:Premix LA Tap 25μL、25×Primers0.4μL、模板2μL、ddH2O补充至50μL;PCR程序如下:94℃预变性3min,94℃变性30S,55℃退火30S:72℃延伸30S;循环30次,最后72℃延伸5min,4℃保存;PCR产物进行2%琼脂糖凝胶电泳,然后在凝胶成像系统观察拍照;选择nirS或nirK基因为阳性、同时nosZ基因也为阳性的菌株为阳性的菌株,进行下一步筛选;
(4)产气检测三次筛选:将步骤(3)的阳性菌株接种到产气测试培养基中,然后将锥形瓶放进密闭的数字式压差仪气罐中,28℃,振荡培养24h以上,选择有气体产生的菌株即好养反硝化细菌。
本发明与现有技术相比的有益效果:
本发明引物和方法能够方便、快速、精准地筛选产N2的好养反硝化细菌,LAMP初次筛选由于灵敏度高,因此在LAMP初次筛选之后进行了PCR二次筛选,最后结合产气验证,确定最终的筛选结果。本发明筛选反硝化细菌方法准确可靠,且不需要昂贵的仪器和复杂的操作。所筛选的阳性菌株能够利用富营养环境中有害的亚硝酸氮和硝酸氮,将其转化为无害的氮气,而脱离水体系统,且避免了产生有害的温室气体。在污水处理中具有广阔的应用前景。
附图说明
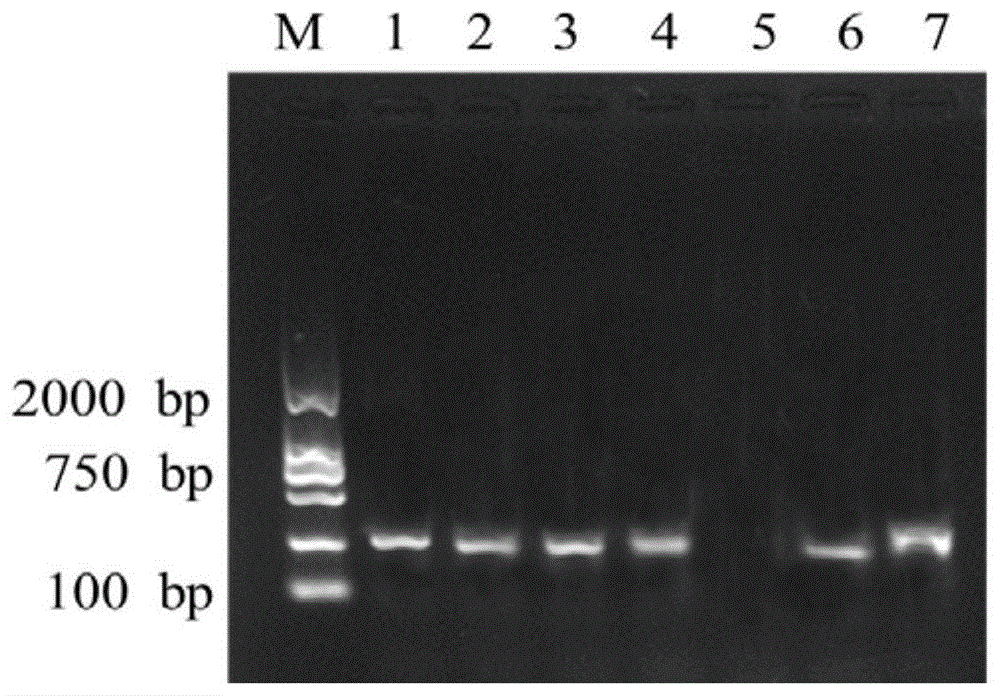
图1为以初筛菌株nirS基因-为靶基因的PCR产物的电泳结果,M:2000bp marker;1:菌株KFDX1;2:菌株KFDX2;3:菌株KFDX3;4:菌株KFDX4;5:菌株KWDX1;6:菌株FJ3-1;7:菌株FJ3-2。
图2以初选菌株nirK基因-为靶基因的PCR产物的电泳结果;M:2000bp marker;1:菌株KFDX1;2:菌株KFDX2;3:菌株KFDX3;4:菌株KFDX4;5:菌株KWDX1;6:菌株FJ3-1;7:菌株FJ3-2。
图3以初选菌株nosZ基因-为靶基因的PCR产物的电泳结果;M:2000bp marker;1:菌株KFDX1;2:菌株KFDX2;3:菌株KFDX3;4:菌株KFDX4;5:菌株KWDX1;6:菌株FJ3-1;7:菌株FJ3-2。
图4为7株菌在亚硝酸氮环境中的菌量变化;
图5为7株菌对亚硝酸氮的去除效果;
图6为7株菌在硝酸氮环境中的菌量变化;
图7为7株菌对硝酸氮的去除效果。
具体实施方式
下面通过实施例结合附图来对本发明的技术方案作进一步解释,但本发明的保护范围不受实施例任何形式上的限制。
实施例
引物序列见表1,由金唯智生物科技有限公司进行引物合成。实施例中所用到的试剂均为市售商品。
试剂:TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒、Bst酶购自纽英伦生物技术(北京)有限公司、PCR试剂购自北京博迈德科技发展有限公司;所用国产化学药品均为分析纯,采购于国药集团。
仪器:Zealway GI54D立式自动高压灭菌器(致微仪器有限公司);台式恒温振荡器(上海精宏实验设备有限公司);LP1200S型电子天平(赛多利斯,德国);7230G可见分光光度计(上海菁华科技仪器有限公司);PHS-3C型pH计(上海精密科学仪器有限公司雷磁仪器厂);SIGMA 3-18K高速冷冻离心机(Sigma,德国);5331型梯度PCR仪(Eppendorf,德国);MF-chemiBIS 3.2化学发光型凝胶成像系统(DNR,以色列);超微量核酸蛋白分析仪(Biodropsis Bo-1000,北京五洲东方科技发展有限公司);testo 510数字式压差仪(0-100hPa,德国仪器国际贸易(上海)有限公司)。
富集培养基:MgSO4·7H2O 0.1g,NaH2PO4 0.2g,K2HPO4 0.5g,CaCO3 1g,FeSO40.1g,NaNO3 2.47g,(NH4)2SO4 2g,葡萄糖(孔径0.22μm滤膜过滤灭菌)1.25g,过滤后的陈海水1000mL(固体培养基则加入2%琼脂粉),PH 7.4~7.8,121℃高压蒸汽灭菌20min。
分离培养基:KNO3 1.2g、柠檬酸钠5g,K2HPO4 1g,KH2PO4 1g,MgSO4·7H2O 0.2g,微量元素(EDTA 2.06g,FeSO4·7H2O 1.54g,MnCl·4H2O 0.2g,ZnSO4·7H2O 0.1g,CuSO4·5H2O 0.02g,Na2MnO4 0.1g,CoCl·6H2O 2mg,蒸馏水1000mL)2mL,蒸馏水1000mL(固体培养基则加入2%琼脂粉),PH 7.4~7.8,121℃高压蒸汽灭菌20min。
产气测试培养基:柠檬酸钠5g,K2HPO4 1g,KH2PO4 1g,MgSO4·7H2O 0.2g,微量元素2mL,KNO3 1.2g,KNO2 1.2g,(NH4)2SO4 0.008g,蒸馏水1000mL(固体培养基则加入2%琼脂粉),PH 7.4~7.8,121℃高压蒸汽灭菌20min。
反硝化能力测试培养基:柠檬酸钠5g,K2HPO4 1g,KH2PO4 1g,MgSO4·7H2O 0.2g,微量元素2mL,KNO31.2g,蒸馏水1000mL,PH 7.4~7.8。121℃高压蒸汽灭菌20min。亚硝酸氮去除测试培养基则将KNO3分别替换为KNO2 1.2g,各形态氮含量为50mg·L-1,其余条件不变。实施例1菌株筛选
(1)菌株富集与分离
取去除亚硝酸氮效果良好的南美白对虾种虾培育系统生物滤池的水样和挂膜材料,将水样带回实验室,恒温振荡30min,充分混匀后,无菌条件下取10mL接入到90mL生理盐水中;取40mL灭菌海水放进盛挂膜材料的蓝盖玻璃瓶中,恒温振荡1h,然后取10mL接入到90mL无菌生理盐水中,恒温振荡15min。
取10mL振荡液接种于液体富集培养基中,放于28℃、180r·min-1振荡培养5d,重复转接3~4次后,取10mL富集液进行系列梯度稀释,取适当倍数稀释液100μL均匀涂布于富集培养基上,放于28℃恒温培养箱,培养48~72h,根据菌落特征挑选不同形态的单菌落进行平板划线分离,重复划线分离4~5次,直至得到纯的单菌落,分别编号为KFDX1、KFDX2、KFDX3、KFDX4、KFDX5、KFDX6、KFDX7、KWDX1、KWDX2、KWDX3、FJ3-1、FJ3-2、F6-1等13株菌株。
(2)基因组DNA提取
取上述步骤(1)获得的13株菌株的保存菌种分别加入到2216E液体培养基中,28℃、150r/min条件下过夜培养。取培养液进行DNA提取,方法参照TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒。将得到的基因组DNA片段,使用微量DNA定量仪进行DNA浓度和纯度的检测,然后将产物进行分装,用于后续实验。
(3)好氧反硝化菌株的LAMP初步筛选
以步骤(2)提取的DNA为模板,分别利用表1中nirS、nirK和nosZ基因的引物进行LAMP扩增反应;
反应体系如下:10×等温扩增反应缓冲液2.5μL、MgSO4(100mM)1.5μL、dNTP Mix(10mM)3.5μL、FIP/BIP Primers(25×)1μL、F3/B3Primers(25×)1μL、Bst 2.0DNA聚合酶(8000U/ml)1μL、DNA Sample 1μL、灭菌水补充至25μL,再将10×GeneFinderTM核酸染料4μL点在离心管盒盖内侧用封口膜封口,放置60℃恒温水浴锅中反应60min。检测过程中以特定的反硝化标准菌株作为阳性对照,以ddH2O代替菌株作为阴性对照。
对扩增后的LAMP扩增产物采用添加GeneFinderTM核酸染料显色液进行直接观察的方式:水浴60min后,将盒盖上的染料轻轻弹下混匀后,用肉眼直接观察颜色变化,呈荧光绿的为阳性,仍呈橙色的为阴性。LAMP法对三种反硝化相关基因的检测结果。
由nirS基因作为靶基因的LAMP体系反应产物与GeneFinderTM核酸染料反应后,可以发现其中菌株KFDX1、KFDX2、KFDX3、KFDX4、FJ3-1、FJ3-2颜色变为荧光绿,结果为阳性;其余7株反应液颜色为橙色,结果为阴性。
由nirK基因作为靶基因的LAMP体系反应60min后,可以观察有菌株KFDX1、KFDX2、KFDX3、KFDX4、KWDX1、FJ3-1、FJ3-2等7株颜色变为荧光绿,结果为阳性;6株筛选的反硝化菌株反应液颜色为橙色,结果为阴性。
由nosZ基因作为靶基因的LAMP体系反应产物的颜色变化,其中,菌株KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2等5株颜色变为荧光绿,结果为阳性;其余8株为橙色,结果为阴性。
结果表明菌株KFDX1、菌株KFDX2、菌株KFDX3、菌株KWDX1、菌株FJ3-2在分别以表1中nirS的引物对或nirK的引物对和nosZ的引物对中为阳性。
(4)菌株的PCR二次筛选
为了防止通过LAMP筛选的含nirS基因或nirK基因和nosZ基因的反硝化菌株存在假阳性,而采用PCR进行进一步验证和筛选。本次实施例的验证为了确认LAMP筛选结果,因此同时对KFDX1、KFDX2、KFDX3、KFDX4、KWDX1、FJ3-1、FJ3-27株菌株进行了PCR二次筛选,PCR引物如表2所示。反应体系(50μL)为:Premix LA Tap 25μL、Primers(25×)0.4μL、模板2μL、ddH2O补充至50μL。PCR程序如下:94℃预变性3min,94℃变性30S,55℃退火30S,:72℃延伸30S;循环30次,最后72℃延伸5min,4℃保存。PCR产物进行2%琼脂糖凝胶电泳,然后在凝胶成像系统观察拍照。结果如附图1、2、3所示。
表2 PCR反应的引物序列
由nirS基因作为靶基因、以nirS引物对的PCR体系反应产物琼脂糖凝胶电泳检测结果(图1)显示:7株菌株中,KFDX1、KFDX2、KFDX3、KFDX4、FJ3-1、FJ3-2等6株菌株有清晰条带,表明该6株菌株含有nirS基因。与LAMP体系的结果一致。
由nirK基因作为靶基因、以nirK引物对的PCR体系反应产物琼脂糖凝胶电泳检测结果(图2)显示:7株菌株都有清晰条带,该结果表明7株菌株都含有nirK基因。与由nirK基因作为靶基因LAMP体系的结果一致。
由nosZ基因作为靶基因、以nosZ引物对的PCR体系反应产物琼脂糖凝胶电泳检测结果(图3)显示:7株菌株中,只有KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2等5株菌株有清晰条带,表明该5株菌株含有nosZ基因。与由nosZ基因作为靶基因LAMP的结果一致。
(5)菌株的产气检测筛选
本次实施例的验证为了确认PCR的筛选结果,因此同时对KFDX1、KFDX2、KFDX3、KFDX4、KWDX1、FJ3-1、FJ3-27株菌株进行了产气检测,将初步筛选到的7株菌株接种到500mL产气测试培养基中,然后将锥形瓶放进带有气体表盘和接有实时监测气压数据的显示器的密闭性testo 510数字式压差仪气罐中,28℃,150r·min-1振荡培养48h,结果如表2所示,菌株KFDX1、KFDX2、KFDX3、KWDX1、FJ3-1、FJ3-2等6株菌株有气体产生。
综合步骤(4)和(5)的筛选结果,确认KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2为目标产N2的好氧反硝化菌株。
表2.7株菌株的产气结果
(6)菌株的反硝化性能测试结果
将7株菌在添加葡萄糖、以亚硝酸钾为氮源的测试液中连续培养72h,如图4所示,除菌株KFDX1的OD600值一直在0.5左右以外,其余菌株生长迅速,12h即达到对数生长期,亚硝酸氮浓度迅速下降,如图5所示,7株菌对亚硝酸氮的去除均降到1mg·L-1以下,7株菌株对亚硝酸氮的去除速率均在3.8mg·(L·h)-1以上。随着菌体的繁殖,48h之后菌体生长缓慢,亚硝酸氮去除速率变慢,开始趋于平缓;72h后,7株菌株均将亚硝酸氮降到0.5mg·L-1以下,去除率高达99%。其中,菌株KFDX2去除最快,速率为3.91mg(L·h)-1,72h后达到最大去除率为99.04%;菌株KWDX1次之,去除速率为3.90mg(L·h)-1、72h后最大去除率为99%;菌株FJ3-1去除速率最低,为2.63mg(L·h)-1、36h后最大去除率也达到了99%。数据表明,筛选出含nosZ基因的菌株KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2对亚硝酸氮的降解效果和降解速率都优于不含nosZ基因的菌株KFDX4、FJ3-1。
将7株菌在添加葡萄糖、以硝酸钾为氮源的测试液中连续培养72h,如图6、图7所示,12h后,KFDX3、KFDX4、FJ3-1、FJ3-2菌体迅速生长,菌株KFDX1、KFDX212h后才快速生长并迅速去除硝酸氮。菌株KFDX1、KFDX2、KFDX3、KFDX4、FJ3-2对硝酸氮的最大去除速率分别可达到2.1633mg·(L·h)-1、3.824mg·(L·h)-1、3.7737mg·(L·h)-1、4.0312mg·(L·h)-1、3.5958mg·(L·h)-1。12-48h内,菌体生长达到平台期,对硝酸氮的利用也趋于平缓。KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2对硝酸氮的去除效果良好,去除率高达90%以上。其中菌株FJ3-2对硝酸氮12h的降解率最大为98.02%,去除速率为3.5958mg/(L·h);另外发现筛选出来的含nosZ基因的菌株KFDX2、KWDX1、FJ3-2对硝酸氮浓度的降解效果和降解速率优于不含nosZ基因的菌株FJ3-1。
综合上述指标,可确认KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2为反硝化细菌。
序列表
<110> 中国水产科学研究院黄海水产研究所
<120> 一种好养反硝化细菌筛选引物及方法
<160> 19
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
ggccgaagaa acagctcaac 20
<210> 2
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
cgatcatgtc gatccgcg 18
<210> 3
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tgctgtcgcc gtcgaccagt tttgacctcg acctgcccaa 40
<210> 4
<211> 43
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
cgtcaaggtc atcgataccg gctttttcac cagcaggtag cgg 43
<210> 5
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
gcagggtcac cgagaacag 19
<210> 6
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
gcgcgttgga gaattttcc 19
<210> 7
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
accgaaaccg aagaggtga 19
<210> 8
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
tgctgatcgt gcactcgcag ctcccagaca tagtcgccat 40
<210> 9
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
cggtcagtgc gttcttgccg tgaagaagct gatcccctcg 40
<210> 10
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
tcgatatttc cggcgaggaa 20
<210> 11
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
caccttgttg tcggattcca 20
<210> 12
<211> 41
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
tctggtcacg acgtaccagg atctggttca cgatggccct a 41
<210> 13
<211> 39
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
gatctacgag cgcaacgacc ccacaccgtc cttctcagc 39
<210> 15
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 15
cgytgttcmt cgacagccag 20
<210> 15
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 15
cgcrasggca asaaggtscg 20
<210> 16
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 16
ccgcacccgg gbcgygg 17
<210> 17
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 17
cgttgaactt rccggt 16
<210> 18
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 18
ggmatggtkc cstggca 17
<210> 19
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 19
ggmatggtkc cstggca 17
- 还没有人留言评论。精彩留言会获得点赞!