DHX33基因作为Ras驱动的癌症分子靶点的应用的制作方法
本发明涉及生物医药领域,具体地说,涉及dhx33基因作为ras驱动的癌症分子靶点的应用。
背景技术:
原癌基因ras编码约20kda的小gtp酶,其可通过法尼基化与细胞膜连接。在细胞外信号刺激后,ras-gdp被鸟嘌呤交换因子(gef)激活成gtp结合形式,然后激活多个下游信号通路,以调节细胞生长、增殖、存活和分化。已发现包括pi3k/akt、raf/map和rhogtp酶在内的三种主要信号传导途径被ras作为其下游效应物激活。通过gtp水解成ras-gdp形式可以关闭活化的ras。然而,在人类癌症中,这经常被ras上的位点突变破坏。ras突变最常发生在g12位上,g12通常在人类癌症中突变为val、ser或asp。该突变导致gtp结合形式的ras锁定。尽管已发现ras长期以来经常在人类癌症中发生突变,但由于其表面光滑,尚未发现有效药物可抑制ras,并且ras蛋白在临床上仍然是众所周知的难以抑制的分子靶标。ras-gtp可激活多个下游效应子,使癌细胞能够绕过单一途径抑制,从而赋予其对许多治疗药物的抗性。已发现组合抑制剂可有效治疗许多人类癌症。在ras驱动的癌症的情况下,人们已经发现同时抑制c-raf和egfr可有效地减少胰腺导管腺癌(pdac)和患者衍生的异种移植物(pdx)模型中的癌症生长。已发现同时对shp2的抑制可以增强ras突变的肺癌、胰腺癌和胃癌细胞中mek抑制剂的抗肿瘤作用。另外,亲脂性双膦酸盐和雷帕霉素相互补偿可以抑制krasg12d诱导的小鼠肺肿瘤发生。其他组合药物如pi3k和mek抑制剂、mtor和hdac抑制剂、plk1和rock均已显示对ras驱动的肿瘤有效。尽管如此,ras突变的癌症仍然难以治疗。
现有研究表明,dhx33是细胞中ras的下游转录和翻译靶标。作为deah盒rna解旋酶的成员,dhx33已被确定为核糖体生物发生的关键因子,并在感知细胞质中双链rna后激活nlrp3炎性体。进一步研究发现dhx33蛋白受多种癌症关键基因的调节,并且在许多人类癌症中失调,例如肺癌、肝癌、成胶质细胞瘤和淋巴瘤。ras在30%的非小细胞肺癌中发生突变,并且其突变被认为是肿瘤发生的潜在因素。然而,迄今为止尚未开发出成功的药物来抑制ras用于肺癌治疗。
此前研究中,已将dhx33鉴定为ras下游效应子,促进细胞周期进程和细胞生长。并发现dhx33的上调对于ras通过促进核糖体生物发生和蛋白质翻译来增强细胞生长至关重要。像rna解旋酶家族的许多成员一样,dhx33是一种多功能蛋白质。进一步发现dhx33积极参与mrna翻译,并通过与基因启动子结合从而在基因转录中发挥作用。在肺癌细胞中,发现dhx33调节参与细胞周期进程和细胞迁移的基因子集。目前尚不清楚dhx33是否可能成为ras驱动的癌症的分子靶点。
技术实现要素:
本发明的目的是提供dhx33基因作为ras驱动的癌症分子靶点的应用。
本发明基于测定解旋酶活力从化学化合物库中进行高通量筛选寻找具有抑制dhx33酶活力的小分子。最终确定了一种有前途的dhx33小分子抑制剂,它可以阻止多种肺癌细胞系中的癌细胞增殖、迁移和细胞存活。抑制剂处理后细胞转录组的变化与dhx33敲低的转录组变化部分重叠,解旋酶活力分析表明该抑制剂对dhx33具有一定的选择性。更重要的是,这种抑制剂可以阻止异种移植和ras驱动肺癌模型的肺癌发展,同时对小鼠的毒性很小。
为了实现本发明目的,第一方面,本发明提供dhx33基因作为ras驱动的癌症分子靶点的应用。
第二方面,本发明提供dhx33基因或受dhx33基因调控的下游基因的抑制剂,或者由dhx33基因编码的解旋酶的抑制剂的以下任一应用:
1)用于制备抗肺癌药物或组合物;
2)作为ras信号通路的抑制剂;
3)用于治疗由ras驱动的癌症,如肺癌。
第三方面,本发明提供dhx33基因或受dhx33基因调控的下游基因的抑制剂,或者由dhx33基因编码的解旋酶的抑制剂在制备由ras驱动的癌症的治疗药物或组合物中的应用;所述癌症包括肺癌。
其中,所述dhx33基因或受dhx33基因调控的下游基因的抑制剂的有效成分是能够从转录或翻译水平上抑制dhx33基因表达的物质,所述抑制剂选自shrna、sirna、dsrna、mirna、cdna、反义rna/dna、低分子化合物、肽、抗体、dhx33基因打靶载体(例如基于crispr/cas9系统的打靶载体)等中的至少一种。
优选地,所述抑制剂的有效成分为2-{3-[2-(1h-苯并咪唑-2-基)-2-氰基乙烯基]-2,5-二甲基-1h-吡咯-1-基}-4,5-二甲基-3-呋喃腈(简称化合物bcd38)或其药学上可接受的盐。bcd38结构如式(i)所示:
第四方面,本发明提供化合物bcd38的以下任一应用:
1)作为dhx33基因或受dhx33基因调控的下游基因的抑制剂;
2)作为由dhx33基因编码的解旋酶的酶活抑制剂。
第五方面,本发明提供dhx33基因或受dhx33基因调控的下游基因的抑制剂或抑制剂药物组合物,其中所述抑制剂或抑制剂药物组合物的有效成分是能够从转录或翻译水平上抑制dhx33基因表达的物质,所述抑制剂选自shrna、sirna、dsrna、mirna、cdna、反义rna/dna、低分子化合物、肽、抗体、dhx33基因打靶载体(例如基于crispr/cas9系统的打靶载体)等中的至少一种。
优选地,所述抑制剂或抑制剂药物组合物的有效成分为式(i)化合物或其药学上可接受的盐。
第六方面,本发明提供一种由dhx33基因编码的解旋酶的酶活抑制剂,所述酶活抑制剂的有效成分为式(i)化合物或其药学上可接受的盐。
第七方面,本发明提供一种由ras驱动的癌症的治疗药物或组合物,所述药物或组合物的有效成分选自如下①和/或②:
①dhx33基因或受dhx33基因调控的下游基因的抑制剂;
②由dhx33基因编码的解旋酶的酶活抑制剂;
其中,所述癌症包括肺癌。
优选地,所述药物或组合物的有效成分为式(i)化合物或其药学上可接受的盐。
本发明中,所述dhx33基因来自于鼠,其核苷酸序列如seqidno:1所示。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明基于rna解旋酶的高通量筛选(hts)方法,从含有15,000个小分子的chembridge化学库中筛选dhx33抑制剂。鉴定了化合物bcd38作为dhx33的选择性抑制剂。bcd38处理通过调节基因子集抑制癌细胞增殖和迁移,诱导细胞凋亡。此外,发现该抑制剂在体内阻止异种移植癌症和ras驱动的肺癌模型中的肿瘤生长。本发明首次揭示了dhx33在体内ras驱动的肺癌中的关键作用,解旋酶dhx33是一种有希望的癌症靶标,并突出了药理学靶向dhx33可能是ras突变肺癌的可行选择。
附图说明
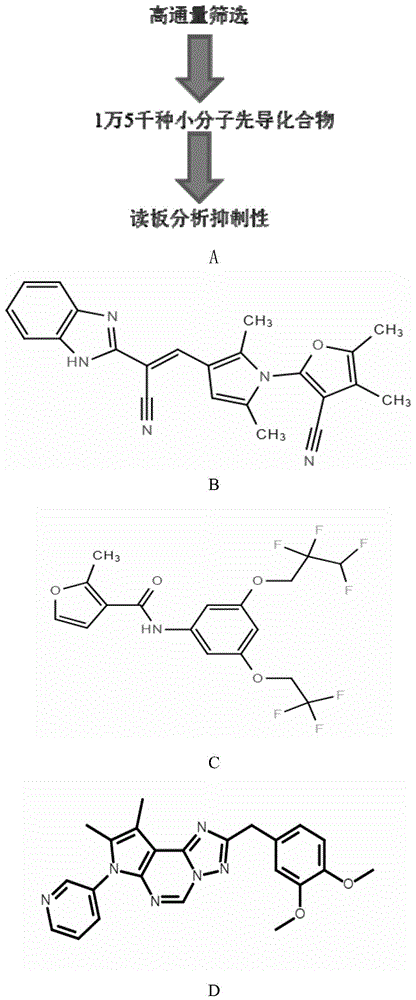
图1为本发明实施例1中dhx33解旋酶抑制剂的高通量筛选流程图(a)以及小分子化合物bcd38(b)、mnt41(c)和ddp58(d)的化学结构式。
图2为本发明实施例1中dhx33抑制细胞生长的分子机制。
a:三种潜在的dhx33抑制剂的细胞生长抑制性(mtt法)分析。用每种化合物以5μm的终浓度处理a549细胞48小时。然后基于标准方案对细胞进行mtt分析。*表示p<0.05,n=3。
b:用三种dhx33抑制剂处理a549细胞,通过western印迹分析指定基因的表达,gapdh用作内部对照。
c:用bcd38处理h1299细胞,通过western印迹分析特定基因的表达。
d:用bcd38处理calu-1和h460细胞,通过western印迹分析指定基因的表达。
e:通过rt-pcr分析进一步分析这些基因的表达。用bcd38处理a549细胞。与dmso对照相比,分析基因表达。*表示p<0.05,n=3。
f:用bcd38处理a549细胞,dmso作为对照,或用shdhx33(ttgggaagctggttggctata)处理,shscr作为对照。分离总rna,然后进行rna测序。比较这两组之间的差异基因表达变化。
g:在四种不同的样品中用rna测序分析细胞周期基因的表达水平。
h:绘制bcd38处理和dhx33敲低条件的差异基因表达模式。上调基因的选择标准基于log2foldchange值,其应大于或等于1,fdr小于或等于0.001。下调基因的选择标准基于log2foldchange值,其应小于或等于-1,fdr应小于或等于0.001。而如果abs(log2fold变化小于1,或fdr大于0.001,则该基因定义为no-deg(差异表达基因)。
图3为本发明实施例1中bcd38对dhx33的半抑制浓度ic50,bcd38与dhx33结合的等温滴定量热法itc实验以及bcd38对解旋酶抑制的专一性分析。
a:在不同浓度的bcd38存在下,对dhx33进行解旋酶活性的抑制性分析。如图所示测定半抑制浓度。
b:bcd38与重组dhx33蛋白结合的热力学参数。显示itc热力学数据。
c:纯化四种不同的rna解旋酶,并用commassie蓝染色进行sds-page分析。
d:bcd38对三种rna解旋酶的抑制作用。图示一系列的抑制剂浓度处理下对各种rna解旋酶活力的抑制性比较。
图4为本发明实施例2中bcd38抑制癌细胞增殖,锚定独立细胞生长,细胞存活率等分析。
a:在bcd38处理下一组肺癌细胞系的生长曲线。
b:在bcd38处理下,一组癌细胞系的锚定独立生长。
c:在bcd38处理下,在一组癌细胞系中观察到细胞凋亡。图中显示了每种细胞系的凋亡率分析,*表示p<0.05,n=3。
图5为本发明实施例2中bcd38抑制癌细胞迁移。具体为一组肺癌细胞系中bcd38的transwell细胞迁移分析。用dapi标记细胞核。每个transwell细胞迁移的定量分析。*表示p<0.05,n=3。
图6为本发明实施例2中bcd38导致正常细胞的细胞周期停滞,但不出现细胞凋亡。
a:用终浓度为4μm的bcd38化合物处理mef细胞96小时。然后绘制细胞生长曲线。
b:在碘化丙啶(pi)/膜联蛋白(annexinv)蛋白染色后,将细胞进一步进行流式细胞术分析。没有观察到明显的细胞死亡。
c:用bcd38化合物处理正常肺上皮beas2b细胞,终浓度为4μm,持续96小时。然后将细胞进行pi染色以进行细胞周期分析。然后对不同细胞周期阶段的细胞百分含量进行定量分析。
d:在annexinv/pi染色后,将细胞进一步进行流式细胞术分析。没有观察到显著的细胞死亡。
图7为本发明实施例3中bcd38在人肺癌细胞异种移植模型中抑制肿瘤生长。
a:将等量的人肺癌细胞a549皮下注射到裸鼠(balb/c)中以建立异种移植癌症模型。当肿瘤大小达到100mm3时,将它们随机分成两组,每组包含4只小鼠。将bcd38溶解于二甲亚砜(dmso)中,以0.2mg/小鼠(按10-15mg/kg体重)的剂量给予腹膜内注射组,用二甲亚砜作为对照注射到另一组小鼠腹腔。每隔一天注射bcd38,处理时间共两周。监测小鼠体重并制图(上图)。监测肿瘤大小并制图(下图)。*表示p<0.05,差异有统计学意义。
b:药物治疗后,在解剖前后对来自小鼠的肿瘤进行拍照。
c:用ki67抗体做免疫组织化学实验分析每组的肿瘤组织的癌细胞增生指数。
d:每组小鼠进行生理解剖,分析主要器官的病理及病变情况。图示是苏木精-伊红(he)染色。
图8为本发明实施例4中bcd38对ras驱动的原发肺癌发展的抑制性分析。
a:基因型为rasg12d-lsl/+的c57b6小鼠到8周龄时用编码重组酶cre的腺病毒处理,剂量为每只小鼠加1×107pfu。加入腺病毒一个月后,小鼠随机分为两组,通过灌胃的方法给小鼠饲喂含有bcd38的药物,每周处理3次,每次的剂量为0.2mg/只(按10-15mg/kg体重),定期测定小鼠的体重。两个月后处死小鼠,取肺拍照。
b:小鼠肺重量的比较和统计学分析。
c:小鼠体重的曲线图。
d:小鼠肺部组织的ki67免疫组织化学染色结果。
e:ki67染色的定量分析。bcd38的药物处理组有明显的细胞增生指数下调。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
以下实施例中涉及到的材料和方法:
1、腺病毒感染
腺病毒购自山东维真公司(vigene),adeno-lacz或adeno-cre的滴度为1.0×1011pfu/ml。利用k-ras(g12d-lsl)小鼠建立肺癌模型,参见dupagem,dooleyal,andjackst.conditionalmouselungcancermodelsusingadenoviralorlentiviraldeliveryofcrerecombinase.natureprotocols.2009;4(7):1064-72。模型构建方法概述如下:将约1×107pfu的ade-cre与基础细胞培养基mem和cacl2混合培育,获得氯化钙病毒的复合沉淀物。先用腹腔注射阿佛丁以麻醉小鼠,然后通过鼻吸入使病毒直接进入小鼠肺中。
2、重组rna解旋酶的制备
蛋白质的分离纯化参见wangx,gew,andzhangy.recombinantdhx33proteinpossessesdualdna/rnahelicaseactivity.biochemistry.2019;58(4):250-8。将几种不同的rna解旋酶基因(小鼠dhx33基因,人ddx6基因、人ddx59基因)分别克隆到pet32m-3c载体的bamhi/noti酶切位点之间;将人dhx32基因、人dhx35基因分别克隆到pet32m-3c载体的bamhi/hindiii酶切位点之间。然后将质粒转化到大肠杆菌菌株bl-21plyss(de3)中,加入0.5mm异丙基1-硫代-β-d-吡喃半乳糖苷(iptg),在16℃诱导重组蛋白表达16小时。将细胞沉淀并重悬于细胞裂解缓冲液[50mmtris-hcl(ph7.2),150mmnacl,1%tritonx-100和添加有蛋白酶抑制剂的50mm咪唑]中。然后将细胞超声处理并以13000rpm的转速离心25分钟。将上清液与tris缓冲液平衡的镍-次氮基三乙酸珠孵育,然后充分洗涤。然后用tris缓冲液中的300mm咪唑洗脱提纯的蛋白质,然后在4℃下对不含咪唑的tris缓冲液透析过夜。
3、化合物文库
含有15000种化合物的化合物文库选自来自chembridge筛选文库的191,157种合成化合物的集合。在化合物选择过程中,采用了几个标准,包括分子量在300和600da之间,clogp≤6,h-键受体≤10,h-键供体≤5,tpsa≤150,键数≤12。使用licss软件中的diversecompoundpacker选择总共15,000种化合物,tanimoto截止值为0.7以确保多样性。参见lawsonkr,andlawsonj.licss-achemicalspreadsheetinmicrosoftexcel.journalofcheminformatics.2012;4(1):3。
从chembridge购买的15,000种化合物在dmso中以10mm的浓度制备。使用biomekfxp液体处理站稀释384孔板中的文库化合物。在第一次稀释后,将储备溶液用tris缓冲盐水(tbs)从10mm稀释至1mm。随后,将化合物溶液在tbs中进一步稀释至50μm。
4、高通量筛选解旋酶分析
将解旋酶活性反应成分添加到384孔不透明白色板中。方法概述如下:将中性抗生物素蛋白(neutravidin)以10μg/ml(100μl/孔)的终浓度在4℃下包被在96孔板上过夜。随后将中性抗生物素蛋白包被的板用100μl的0.1%(w/v)bsa(溶于常规pbs中)在22℃封闭2小时。洗涤后,加入由两条寡dna单链(一条单链的序列为生物素标记的5'-gctgaccctgctcccaatcgtaatctatag-3';另一条单链的序列为dig标记的5'-cgattgggagcagggtcagc-3')所退火产生的dna双链体[2.5ng,退火反应在含1mnacl的浓度为1m的pbs(ph7.0)中进行],并在22℃温育4小时。加入90μl反应混合物后开始解旋酶反应[纯化的全长dhx33蛋白0.25μg,溶解于25mm4-mops(ph7.0),5mmatp,2mmdtt,3mmmncl2和100μg/mlbsa]。在37℃下反应60分钟。洗涤后,每个孔用封闭溶液[10%(w/v)bsa在0.1m马来酸和0.15mnacl(ph7.5)中]培育30分钟,然后与20μl抗体溶液一起孵育(抗-dig-ap,roche,在封闭缓冲液中)30分钟。用100μl检测缓冲液[0.1mtris-hcl和0.1mnacl(ph9.5)]洗涤后,然后将1μl化学发光底物(cspd-0.25mm)加入各孔,并将板在17℃孵育5分钟。然后将板拍干并在37℃下孵育30分钟。通过发光多孔板读数器(enspire,perkinelmer)对每个孔中剩余的dig-ap标记物对照计数10分钟。
5、ic50测定
手动鉴定bcd38的半抑制浓度(ic50)。参照wangx,gew,andzhangy.recombinantdhx33proteinpossessesdualdna/rnahelicaseactivity.biochemistry.2019;58(4):250-8.进行解旋酶反应,除了在反应混合物中,加入不同浓度的bcd38。将实验重复三次,并绘制在bcd38存在下dhx33的解旋酶活性并计算。
6、等温滴定量热法(itc)的结合研究
将重组蛋白dhx33稀释至150μm并在含有50mmtris-hcl(ph7.4),100mmnacl,2mmmgcl2的缓冲液中透析。在室温下含有0.2%二甲亚砜的蛋白质缓冲液中制备浓度为20μm的bcd38。将重组蛋白定位于反应池中。将小分子抑制剂缓慢注入维持在室温的微量热计中的反应池中。微量热仪(microcalvp-itc,gehealthcare)用于检测蛋白和小分子结合所产生的热量。使用microcal定制的origin7软件将数据拟合到单站点模型中。
7、细胞培养
分离小鼠胚胎成纤维细胞并培养在含有10%胎牛血清(fbs),2mml-谷氨酰胺和链霉素和青霉素的dmem培养基中。h1299、calu-1、h1650、a549和sk-lu-1肺癌细胞系购自atcc;h460由thomasleung博士(香港理工大学)馈赠。将这些细胞系维持在含有10%胎牛血清(fbs),2mml-谷氨酰胺和链霉素和青霉素的rpmi-1640培养基中。beas2b细胞(人正常肺上皮细胞)购自atcc并保持在含有10%fbs和链霉素和青霉素的dmem培养基中。hek293t细胞购自atcc并保持在含有10%fbs和链霉素/青霉素的dmem培养基中。
8、慢病毒生产
为了产生慢病毒,用lipofectamine2000试剂(lifetechnologies)将plko.1-shrna和病毒包装质粒pcmv-vsv-g和pcmv△r8.2转染到hek293t细胞中。靶向人dhx33的shrna序列参见yuanb,wangx,fanc,youj,liuy,weberjd,zhongh,andzhangy.dhx33transcriptionallycontrolsgenesinvolvedinthecellcycle.molecularandcellularbiology.2016;36(23):2903-17。48小时后,收集培养物上清液并以2000rpm离心2分钟。然后将病毒等分并在-80℃冷冻。
9、细胞周期分析
将细胞用胰蛋白酶消化并重悬浮于磷酸缓冲液中以产生单细胞悬浮液。将无水乙醇逐滴加入悬浮液中,同时轻轻涡旋,直至乙醇的终浓度达到75%。然后将细胞在室温下固定半小时或在-20℃冰箱中过夜。沉淀细胞并用磷酸缓冲液洗涤两次,然后重悬浮于碘化丙啶工作溶液(含有1%胎牛血清,250μg/mlrna酶a和30μg/ml碘化丙啶的磷酸缓冲液)中。将细胞通过35μm过滤膜(bectondickinson)过滤,然后进行流式细胞分选仪(facs)分析。
10、细胞凋亡分析
根据制造商的方案用vybrant凋亡试剂盒#2(molecularprobes)进行凋亡测定。
11、软琼脂试验
将1.0×104个细胞用4.0ml含0.3%琼脂和10%fbs的dmem培养基中混合,并加在基础琼脂上(4.0ml凝固的含0.6%琼脂和10%fbs的dmem培养基)。将平板在37℃温育,每3天检查一次,每周加入2.0ml含0.3%琼脂和10%fbs的dmem培养基。观察菌落生长情况,2-3周后计数。
12、rna测序
rna测序参见yuanb,wangx,fanc,youj,liuy,weberjd,zhongh,andzhangy.dhx33transcriptionallycontrolsgenesinvolvedinthecellcycle.molecularandcellularbiology.2016;36(23):2903-17。用编码shscrambled或#2-shdhx33的慢病毒感染a549细胞,或用浓度4μm的bcd38处理a549细胞,用dmso作为对照。处理后3天,收获细胞,用nucleospinrnaii试剂盒提取总rna。然后在变性后用磁性oligo-dt珠进一步纯化rna样品。将纯化的mrna样品逆转录成第一链cdna,并进一步合成第二互补dna。片段化的dna样品是平端的并且在3'末端腺苷酸化。用适配子连接然后构建文库。通过qubit(invitrogen)定量dna。在cbot簇生成后,然后通过来自genergybio(上海晶能)的iluminahiseq2500sbs对dna样品进行测序。原始数据转换为fastq格式。每个样品中的转录物的量基于fpkm-片段每千碱基转录物的每百万个片段计算,使用cuffnorm软件计算每个样品的fpkm值并应用log2值。cuffdiff软件用于计算不同样品之间的差异基因转录物。对于kegg通路分析,使用整个转录本作为背景列表,使用差异转录本作为候选列表,计算p值。基于基因功能对重要基因进行分类。
13、蛋白质印迹分析
用添加有蛋白酶和磷酸酶抑制剂(thermofisher)的ripa缓冲液裂解细胞。在冰上孵育10分钟后,通过超声处理进一步破坏细胞裂解物。然后将全细胞提取物进行sds-page凝胶,每个样品的加载量为50μg蛋白质。然后将蛋白质转印到聚偏二氟乙烯膜(pvdf)上。将膜在5%脱脂奶中封闭,将其在1×tbst缓冲液中在室温下培育1小时。在5%fbs中稀释一抗(用1×tbst稀释),使之与膜在4℃孵育过夜。然后将膜用1×tbst缓冲液冲洗多次,并在室温下与5%fbs(用1×tbst稀释)中的hrp标记的第二抗体一起孵育2小时。用ecl试剂盒(thermofisher)显示印迹。抗体来源如下:抗gapdh,absin(abs830030);anti-auroraa,santacruzbiotechnology(sc-56881);抗mcm2,santacruzbiotechnology(sc-9839);抗mcm3,圣克鲁斯生物技术(sc-9850);anti-mcm4,santacruzbiotechnology(sc-22779);anti-mcm6,santacruzbiotechnology(sc-9843);抗mcm7,santacruzbiotechnology(sc-9960);抗细胞周期蛋白d1,圣克鲁斯生物技术(sc-753);抗细胞周期蛋白e2,圣克鲁斯生物技术(sc-9566);抗细胞周期蛋白b2,圣克鲁斯生物技术(sc-22776)。
14、定量实时pcr
引物均由idt(http://sg.idtdna.com/site)在线“realtimepcrtool”设计,购自bgi(深圳)公司。通过highpurerna分离试剂盒(roche)提取总rna,然后使用primescript混合试剂盒(takara)转录成cdna。使用abionesteppluscycler进行实时pcr,使用相应的软件进行管理。为了分析mrna水平,使用sybrgreensupermix(bio-rad),并且在归一化为gapdh值之后通过△△ct值计算转录物定量。熔解曲线用于确认单一产物的扩增。引物序列参见yuanb,wangx,fanc,youj,liuy,weberjd,zhongh,andzhangy.dhx33transcriptionallycontrolsgenesinvolvedinthecellcycle.molecularandcellularbiology.2016;36(23):2903-17。
15、免疫组化分析
解剖小鼠肺组织并脱水,石蜡包埋并基于标准方案进一步切片。将组织在二甲苯中脱石蜡并在一系列乙醇浓度逐渐降低的溶液中再水合。在蒸汽器中用tris缓冲液(ph9.0)呈现抗原。然后将组织在含有1%h2o2的甲醇溶液中孵育以灭活内源性过氧化物酶。在室温下用10%fbs封闭1小时后,将组织与第一抗体在4℃孵育过夜。然后根据制造商的建议使用dako试剂盒进行标准方案。使用的抗体来源如下:anti-ki67,abcam(ab15580)。
16、小鼠异种移植模型
所有小鼠实验均遵循标准指南。nude雌性小鼠购自北京维多利华实验动物有限公司并接受标准的机构护理。将细胞用胰蛋白酶消化并用终浓度为1×108个细胞/ml的pbs重悬浮。对8周龄裸鼠(balb/c)小鼠皮下注射,沿其侧翼1×107个细胞,每个处理组4只小鼠。当肿瘤直径达到0.5~1cm时,处死小鼠并解剖肿瘤进行拍照。
17、统计分析
数据表示为平均值±sd。使用student'st检验确定统计学显著性,p值<0.05表示差异显著。
实施例1dhx33抑制剂的高通量筛选
此前的研究结果表明dhx33的功能取决于其解旋酶活性。目前尚未开发出dhx33的抑制剂。基于已建立的dhx33解旋酶活性测定,发现dhx33具有双重dna/rna解旋活性。使用设置在384孔板中的重组dhx33评估chembridge化学库中15,000种化合物在10μm工作浓度下的抑制作用。用dig标记的双链dna作为底物,在解旋酶反应完成后,检测384孔板中剩余dig的发光情况。利用已建立的hts系统(图1a),从化合物库中选择具有显著抑制作用的63种化合物。它们的dhx33抑制作用在体外得到证实。我们通过mtt法进一步分析了这些化合物在a549肺癌细胞系中的细胞毒性作用。从这些小分子中,进一步确定了11种潜在的dhx33抑制剂,它们可以更有效地抑制细胞增殖。为了确定这些抑制剂是否像dhx33敲低一样调控基因表达,我们进一步分析了经抑制剂处理后,一些基因的mrna含量,此前发现这些基因受dhx33调节。我们发现#38化合物导致这些参与细胞周期基因的下调,而#41和#58化合物只是适度地降低了某些基因的表达。分别将这些化合物命名为bcd38、mnt41和ddp58,并做进一步研究。其中,bcd38的结构如式(i)所示。
1、鉴定bcd38作为dhx33的优先抑制剂
这些化合物的详细化学结构显示在图1(b-d)中。我们进一步证实了这三种化合物对细胞的抑制作用,如图2a所示。为了研究这些化合物是否像dhx33敲低那样下调基因表达,利用这些抑制剂分别处理a549细胞,然后通过蛋白质印迹分析蛋白质表达。结果如图2b所示,dhx33抑制剂可下调mcm蛋白表达,细胞周期蛋白cyclinb2和auroraa。与其他两种化合物相比,bcd38效果更突出。为了确定bcd38是否同样导致其他肺癌细胞系中这些蛋白质的下调,我们进一步分析了h1299(图2c),calu-1和h460(图2d)中这些细胞周期相关基因的蛋白质表达。在所有这些细胞系中,我们发现很多蛋白质被bcd38下调。进一步分析mcm和细胞周期蛋白的mrna水平。结果如图2e所示,bcd38能够下调受dhx33调控的基因表达。为进一步阐明bcd38的细胞毒性机制,我们对a549细胞进行了rna测序分析,这些细胞用bcd38处理或用shdhx33敲低。结果如图2f所示,细胞经bcd38处理后转录组的变化与dhx33敲低后转录组的变化进行比较。从该列表中,我们鉴定了参与细胞周期的基因子集,其已被证明之前由dhx33调节。这些基因的表达变化以及富集kegg途径分析见图2g。我们发现bcd38处理组和dhx33敲低组之间的变化相当,尽管效率较低。图2h显示了两种条件的差异基因表达模式。bcd38不如急性dhx33敲低那么有效,在bcd38处理下仅有少部分的基因(800多种基因)表达水平发生改变,相比而言,对照组dhx33敲低导致近2000个基因的变化。
2、ic50测定dhx33抑制
为了确定化合物bcd38对dhx33的半数最大抑制浓度(ic50),我们在bcd38的一系列稀释液条件下进行dhx33解旋酶活性测定。鉴定体外抑制纯化的dhx33的ic50值为519nm(图3a)。由于bcd38的溶解性差,在较高浓度下,化合物从溶液系统中沉淀出来并在体外失去其对dhx33蛋白的抑制作用。然而,在较低浓度下,bcd38表现出一定抑制作用。
3、利用等温滴定量热法(itc)测定bcd38与dhx33蛋白的结合亲和力
进一步分析抑制剂bcd38是否在体外与dhx33直接相互作用。为了分析小分子与dhx33之间的关联,将重组蛋白滴定到化合物溶液中。itc分析结果显示在图3b中,暗示dhx33直接与bcd38相互作用。计算得到kd=4.7μm。
4、bcd38与dhx33蛋白的特异性分析
在人类基因组中,共有15种deah盒蛋白和40种dead盒蛋白。通常这些蛋白质会折叠成两个裂缝(reca1和reca2结构域)。如果这些蛋白质折叠成类似的三维结构,那么了解bcd38是否与其他rna解旋酶具有交叉反应性将是必需的。为了研究bcd38化合物是否具有特异性,我们构建了几种质粒,分别用于表达dhx32,dhx35,ddx59和ddx6蛋白。结果如图3c所示,commassie蓝染色表明这些蛋白质具备一定的纯度。然后我们用分析了药物处理下各蛋白的解旋酶活性。不经药物处理条件下,dhx32和ddx59表现出良好的解旋酶活性,而ddx6具有中等的解旋酶活性。在我们的实验设置下,未检测到dhx35的解旋酶活性。接着我们分析了bcd38对这些蛋白质的抑制作用。结果如图3d所示,我们发现在合理浓度范围内,bcd38不能抑制dhx32,ddx59和ddx6的解旋酶活性。这正是我们希望的结果。
实施例2bcd38抑制细胞增殖、细胞存活、锚定非依赖性生长和细胞迁移
我们分析了bcd38对一组肺癌细胞系的影响。首先,我们用六种癌细胞系分析了细胞生长曲线,包括a549、calu-1、h460、h1299、h1650和sk-lu-1。如图4a所示,在所有癌细胞系中,我们发现bcd38降低了细胞增殖速度。接着,我们分析了bcd38对这些癌细胞系中不依赖锚定的细胞生长的影响。如图4b所示,在许多肺癌细胞系中观察到具有一定的抑制。统计分析表明存在显著差异。对a549、calu-1、h1299和h460细胞进行进一步的膜联蛋白v/pi染色,然后进行流式细胞分析细胞凋亡率,结果如图4c所示。许多癌细胞系中的bcd38处理导致细胞凋亡。我们进一步分析了在这些癌细胞系中bcd38处理后的细胞迁移。如图5所示,在所有六种癌细胞系中,除h460细胞外,bcd38抑制了细胞迁移。为了研究bcd38对正常细胞系的影响,我们进一步分析了bcd38对beas2b(人正常肺上皮细胞)和mef细胞(原代小鼠胚胎成纤维细胞)的影响。如图6a和图6b所示,我们发现bcd38有效地阻止了mef的细胞周期,没有细胞凋亡。对于beas2b细胞,类似地,我们观察到细胞增殖减少而细胞死亡很少(图6,c和d)。
实施例3bcd38阻止异种移植小鼠模型中的肿瘤生长
为了分析bcd38是否抑制体内癌症生长,我们首先建立人肺癌细胞的异种移植小鼠模型。将等量的人肺癌a549细胞皮下注射到免疫缺陷小鼠(balb/c品系,雌性8周龄裸鼠,体重约20克)的侧腹。当肿瘤达到100mm3的体积时,通过腹膜内注射用bcd38处理小鼠。将bcd38溶解于dmso中,按每次0.2mg剂量给药,每周给药2-3次。期间监测肿瘤大小和小鼠体重。两周后,处死小鼠进行肿瘤切除。小鼠体重和肿瘤体积的曲线见图7a。解剖前后的肿瘤图像见图7b。我们进一步对肿瘤组织进行ki-67染色,结果如图7c所示,我们发现bcd38显着降低ki-67增殖指数,从对照组的60%下调到17%左右。这是我们首次在体内进行bcd38治疗,接下来进一步解剖分析了小鼠的重要器官,以检查这种抑制剂的潜在毒性。结果如图7d所示,我们发现小鼠中的抑制剂治疗没有引起关键器官如肝脏,肾,肺,脾脏和心脏的明显缺陷。我们进一步分析了来自这些器官的生化标志物的血液测试,发现该抑制剂引起alt的适度降低,但通常生物标志物没有变化(表1)。
实施例4bcd38抑制ras驱动的肺癌模型中的肿瘤生长
基于癌细胞系建立的异种移植肿瘤,考虑到其不能够完全反映原发性肿瘤的特性。为了分析bcd38对原发癌症的影响,我们进一步使用k-ras(g12d)驱动小鼠肺癌模型分析。用腺病毒介导重组酶的摄入,处理小鼠(c57b6品系,含有k-ras(g12d)转基因,8周龄的雌鼠,体重20克)两个月后,我们将小鼠随机分成两组。对照组通过灌胃法用dmso处理小鼠,实验组用bcd38处理小鼠。每周给小鼠服用2-3次该抑制剂,连续给药一个月。bcd38每次以0.2mg的剂量给药。定期监测小鼠体重。我们重复了两次实验。然后处死小鼠进行肿瘤切除。如图8a和图8b所示,经抑制剂处理后,与对照组相比,肿瘤生长似乎显著降低。我们观察到小鼠对该抑制剂的治疗具有中度耐受性。来自重要器官的生物标志物的分析显示对照组和实验组之间没有显着变化(表2)。还监测每组中小鼠的体重并绘制在图8c中。也没有重大变化。组织免疫组织化学染色后计算ki-67增殖指数;结果如图8d和图8e所示,药物处理后,细胞增殖明显减少。
本发明通过高通量筛选,鉴定出dhx33的小分子抑制剂--bcd38,它能够阻止dhx33解旋酶活性,从而抑制癌细胞增殖、存活、迁移和锚定非依赖性生长。还发现该先导化合物抑制人肺癌细胞异种移植和由突变体ras驱动的原发性肺肿瘤发生。研究结果表明dhx33是一种有希望的癌症靶标。
尽管鉴定出bcd38对癌细胞具有抑制作用,但该化合物具有有限的溶解度,需进一步进行分子优化以及优化给药体系。例如,bcd38容易从溶液或介质中沉淀出来。在不同的体系中,由于溶液组成不同,bcd38表现出不同的溶解度。例如,在体外解旋酶活性分析中,bcd38以较低浓度从系统中沉淀。bcd38对dhx33具有一定的特异性,这可以通过对dhx32、ddx59和ddx6的有限抑制作用看出来。有待进一步研究这种药物是否可以抑制其他rna解旋酶。另外,虽然抑制剂处理后细胞转录组的变化与dhx33敲低的转录组变化部分重叠,但大多数基因表达的变化低于急性dhx33敲低所引起的转录组表达的变化。这些值得进一步研究和分析。以上实验数据支持dhx33的进一步抑制剂筛选,以探索治疗ras驱动的癌症的潜在治疗药物。本发明首次证明了dhx33的小分子抑制剂,并且针对dhx33可能是寻找治愈人类癌症中不可遏制的ras的良好选择。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>深圳市开悦生命科技有限公司
<120>dhx33基因作为ras驱动的癌症分子靶点的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>2151
<212>dna
<213>鼠(mus)
<400>1
ccccagccgagcggaactgtctgcgtccctgcctccggccgcggtcctcccgacatgccg60
gaggaggcgagcctcccgcccgctaagagattccggccgggctcctgccctcccgggaga120
cgagtagtgatgctgttgacggctggcggcggcggcggagctggaggaggccggaggcag180
acgccgccgctggcccagccttcggccagtccctaccgcgaggccctggagctgcagcgc240
cggagtctgcccatcttccgggcgcgggggcagctattggctcagctccgaaacctggac300
aacgcggtcctcatcggggaaactggctctgggaaaacaactcagatcccacagtacctc360
tatgaagggggaattagccgccagggcatcatcgctgtgacccagccccgtcgagtggct420
gccatctctcttgccaccagagtctcagatgagaagaggacagaactcgggaagctggtt480
ggctatacagtgcgctttgaggatgtcacctcagaagacaccaggatcaagttcctgaca540
gatggcatgcttctgcgtgaagcaatttcagactccttgcttcggaagtacagctgtgtc600
attttggacgaggcccatgagcggactattcacacagatgtgctctttggagtggtgaag660
actgcacagaagaggcgaaaggagctagggaaactgcctctcaaagtgattgtgatgtca720
gctaccatggatgtcgacctgttttctcagtacttcaatagagcccctgtcctttacctt780
gagggtcggcagcatccaatccagatcttctataccaaacagcctcagcaggattacctg840
catgcagcccttgtctcagtcttccagatccaccaggaagctcctgcttctcaagacatc900
ctggtgttcctcactggtcaggaggagatcgaagcaatgagcaagacctgcagagacatc960
gcaaggcacctcccagatggctgcccttcaatgctcgtccttcctctgtacgcctccctg1020
ccctattcgcagcagcttcgagtctttcaaggggccccaaagggctatcgcaaagtgatc1080
atttcaaccaacatcgctgaaacctccataaccattacaggaataaaatatgtagttgac1140
acgggcatggttaaagcaaagaagtataaccctgacagtggtcttgaggtactagctgta1200
cagagagtatcaaagacccaggcctggcagcgcacaggcagggctgggcgagaggacagt1260
ggcatctgctaccgactctacactgaggacgagtttgagaagttcgagaagatgacggtg1320
ccagagatccagaggtgtaacctggccagtgtaatacttcagctcctagcaatgaaagtc1380
ccaaatgtgctcacctttgacttcatgtccaaaccttctccagatcacattgaggcggcc1440
attgcccagctggacctgttaggtgctcttgaacataaggatgaccagcttaccctgact1500
ccaattggaagaaagatggcagcattccctttagagcccagatttgccaaaactatcctc1560
ctgtcctccaaattccactgtaccgaagagattctgaccatagtctccctgctatctgtg1620
gacagtgtcctttacaaccctcctgcccggagagatgaggtgcagagtgtccggaagaaa1680
ttcatatccagtgagggggatcacatcaccctgctcaatatctatcggaccttcaaaaac1740
atcggtgggaataaggactggtgcaaagagaattttgtcaacagcaagaatatgctgcta1800
gtagctgaagtcagagcacagctgagagaaatctgcttaaagatgtcaatgccaatcatg1860
tcatctcgaggggacatggagagtgtccgccgttgcatggctcacagcctctttatgaat1920
actgctgaactccagacagatggcacctatgccaccacggacacacatcagccagtggcc1980
atccacccatcatctgtcctcttccactgcaagcctgcctgcgtggtctacacttcactg2040
ctctacaccaacaaatgctacatgcgtgacctctgtgtggtggatgccgagtggctctac2100
gaggctgcccctgactacttcaggaggaagctgagaacggccagaaactga2151
- 还没有人留言评论。精彩留言会获得点赞!